ПАРАЗИТОЛОГИЯ, 2023, том 57, № 1, с. 20-37.
УДК 576.895.132.2.99
УЛЬТРАСТРУКТУРНЫЕ ОСОБЕННОСТИ
КОЖНО-МУСКУЛЬНОГО МЕШКА ГЕЛЬМИНТА
HETERAKIS DISPAR (SCHRANK, 1790)
(NEMATODA, HETERAKIDAE)
© 2023 г. Ф. Г. Рзаев*
Институт зоологии Министерства науки и образования Азербайджанской Республики,
Баку, ул. А. Аббасзаде, 1128/504, AZ1004 Азербайджан
Азербайджанский медицинский университет,
Баку, ул. С. Вургуна 163, AZ1078 Азербайджан
*e-mail: fuad.zi@mail.ru
Поступила в редакцию 19.10.2022 г.
После доработки 11.12.2020 г.
Принята к публикации 17.12.2022 г.
С помощью методов световой и электронной микроскопии исследована ультраструктура
кожно-мускульного мешка нематоды Heterakis dispar (Schrank, 1790) из семейства Heterakidae,
а также проведено сравнение строения этого мешка с аналогичным мешком у других видов
того же семейства. Кутикула нематоды H. dispar состоит из восьми слоев: 1 - эпикутикула;
2, 3 - внешний и внутренний корковые слои; 4, 5 - внешний и внутренний гомогенные слои;
6, 7 - внешний и внутренний волокнистые слои; 8 - базальная мембрана. Гомогенный слой
кутикулы в несколько раз толще в латеральных крыльях у обоих полов и вблизи бурсы самца,
по сравнению с другими частями кутикулы гельминта. В отличие от других видов семейства,
у самцов H. dispar кутикула имеет 3 различных типа строения в разных участках тела. В ба-
зальном слое кутикулы выявлены трубкообразные структуры, состоящие из плотных фибрилл
и микротрубочек. Эти структуры ранее не отмечались у других видов семейства. В гиподерме
нематоды прослеживаются дорсальный, вентральный и 2 латеральных валика, причем латераль-
ные валики вдвое крупнее остальных. Также были выявлены ультраструктурные особенности
экскреторного канала и нервных стволов, расположенных в гиподермальных валиках. Нервная
система гельминта ортогональная. Мускулатура полимиарного типа, число мышечных клеток
колеблется от 17 до 26 в зависимости от пола и части тела гельминта.
Ключевые слова: нематода, Heterakis dispar, кутикула, гиподерма, мышечный слой, ультра-
структура, трансмиссионный электронный микроскоп
DOI: 10.31857/S0031184723010027; EDN: FJAUUL
20
В результате проведенных гельминтологических исследований на территории Азер-
байджанской Республики у домашних водоплавающих птиц (домашний гусь - Anser
anser domesticus (L.) и домашняя утка - Anas platyrhynchos domesticus (L.)) нами
было зарегистрировано 27 видов гельминтов (Seyidbeyli, Rzayev, 2018; Rzayev, 2021a,
2021b; Rzayev et al., 2021), из них 13 видов относятся к классу нематод (Eyvazov,
2022). Из них 3 вида (Heterakis dispar, H. gallinarum, H. altaicus) относятся к семей-
ству Heterakidae. У птиц во всех исследованных районах на территории республики
нематода H. dispar имеет высокую интенсивность и экстенсивность заражения. Этот
гельминт также является специфическим паразитом для данных хозяев. Определение
таксономического положения видов, принадлежащих к семейству Heterakidae, по при-
знакам, представленным в определителях, имеет некоторые трудности. Это связано
с тем, что виды, входящие в это семейство, морфологически очень схожи. Изучение
микроструктуры тканей позволит выявить дополнительные таксономические признаки
для идентификации видов паразитов. Проведенный анализ литературных данных по-
казал, что работы по изучению ультраструктуры имеются лишь для нескольких видов
нематод (H. gallinarum, H. spumosa), относящихся к семейству Heterakidae (Lee, 1971,
1973, 1975; Lee, Lestan, 1971; Богоявленский, 1973; Богоявленский и др., 1982; Wright,
Hui, 1976; Zmoray, Guttekova, 1987; Bird, Bird, 1991; Mehlhorn, Harder, 1997). При этом
эти данные включают в себя сведения об ультраструктуре только некоторых органов
изучаемого паразита. У нематоды H. dispar полностью изучен митохондриальный ге-
ном, в том числе проведена молекулярная идентификация и филогенетический анализ
(Bobrek et al., 2019; Gao et al., 2019; Elshahawy et al., 2021). Литературы, посвященной
изучению ультраструктур этой нематоды, нами не было выявлено, и имеются только
сведения о морфологическом строении нематоды, полученные с использованием све-
тового микроскопа (Насиров и др., 2008). Учитывая все вышесказанное, мы поставили
цель - изучить строение кожно-мускульного мешка (кутикула, гиподерма и мышечный
слой) нематоды H. dispar методами световой и электронной микроскопии, а также
провести сравнительный анализ с другими видами того же семейства.
МАТЕРИАЛ И МЕТОДИКА
В результате исследований, проведенных методом полного паразитологического вскрытия
(Скрябин, 1928; Дубинина, 1971), изучено 12 экз. птиц в возрасте одного года (6 экз. гусей
и 6 экз. уток) из частных птицеводческих хозяйств г. Шабран (41°12´18.3˝ N, 48°59´44.8˝ E)
Азербайджанской Республики. Гельминты были собраны из слепых отростков кишечника.
Из собранного материала были приготовлены постоянные препараты, заключенные в канад-
ский бальзам. Паразитов изучали под стереомикроскопом (МБС-9, Россия) и микроскопом
Primo Star (Zeiss, Германия). Идентификацию видов паразитов проводили по определителю
Рыжикова (1967). Для приготовления полутонких и ультратонких срезов половозрелых не-
матод (разрезанных на части) фиксировали смесью 2% раствора глютаральдегида, 2% рас-
твора параформальдегида и 0.1% раствора пикриновой кислоты на 0.1M фосфатном буфере
(рН = 7.4). Постфиксация проводилась в 1% растворе четырехокиси осмия в течение 1 часа.
21
Фиксированный материал был залит в Аралдит-Эпон (Kuo, 2014; Yushin et al., 2021). Полу-
тонкие и ультратонкие срезы приготовлены на ультрамикротоме EM UC7 (Leica, США). По-
лутонкие срезы (1 мкм) окрашивали метиленовым синим, азур II, фуксином (D’Amico, 2005) и
просматривали под световым микроскопом Primo Star (Zeiss, Германия). Фотографии получали
с помощью цифровой фотокамеры EOS 650D (Canon, Япония). Ультратонкие срезы (50-70 нм)
окрашивали 2% насыщенным водным раствором уранилацетата и докрашивали 0.6% раство-
ром чистого цитрата свинца на 0.1 M растворе NaOH. Электронограммы получали на транс-
миссионном электронном микроскопе JEM-1400 (JEOL, Япония) при напряжении 80-120 кВ.
Измерения на фотографиях сделаны при помощи программы İTEM-TEM İmaging Platform.
Статистические расчеты проводились с помощью программы Microsoft Excel. Анализ данных
проводился различным параметрам (Min, Max, mean±SD). Данные принимались как статисти-
чески значимые при р < 0.05.
РЕЗУЛЬТАТЫ
Кожно-мускульный мешок половозрелой нематоды H. dispar (самка и самец) со-
стоит из кутикулы, гиподермы и мышечного слоя (рис.1A).
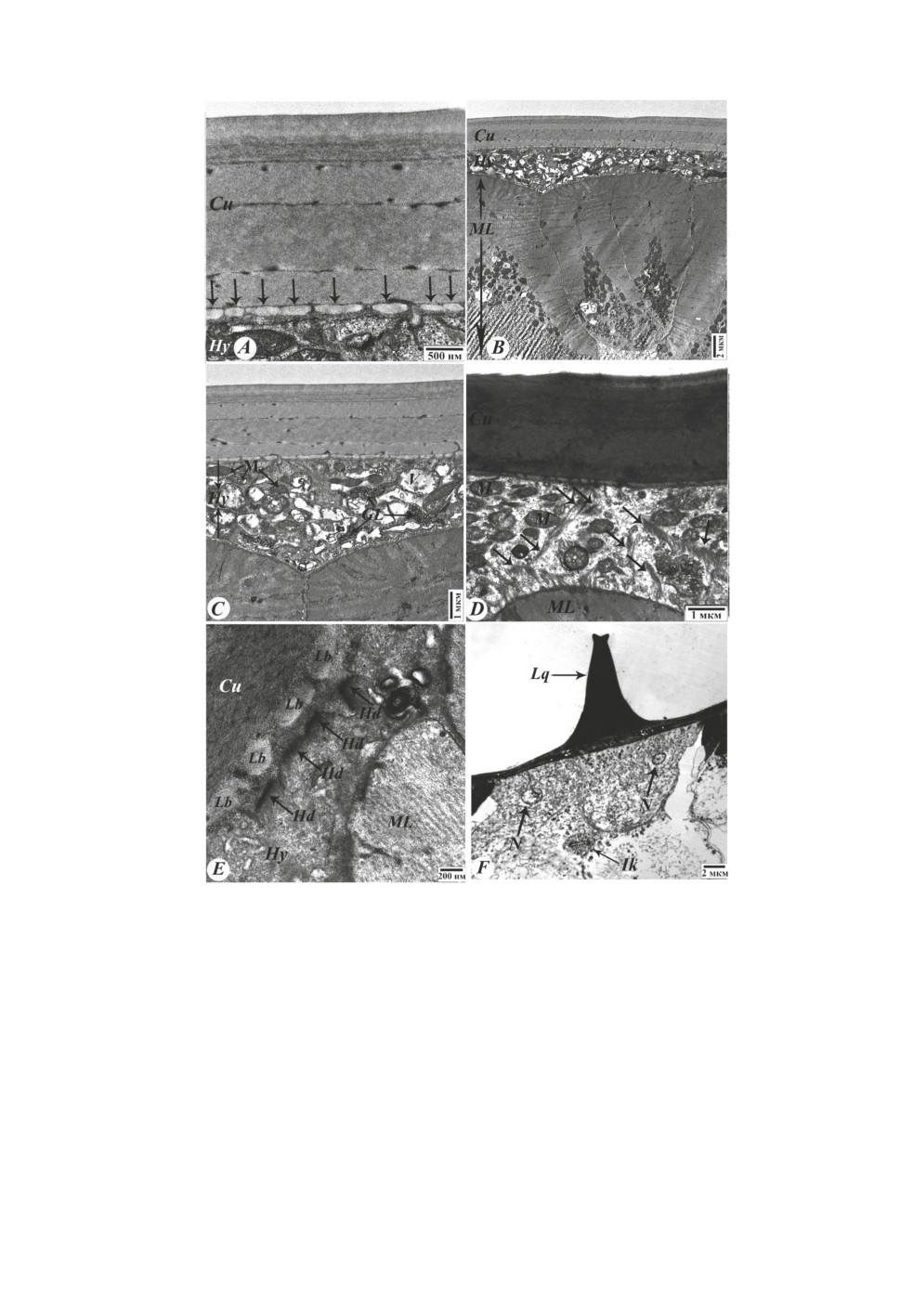
Кутикула. Было выявлено, что кутикула нематоды H. dispar, имеющая некле-
точное строение, состоит из восьми слоев: 1 - эпикутикула, 2 - внешний корковый
слой, 3 - внутренний корковый слой, 4 - внешний гомогенный слой, 5 - внутренний
гомогенный слой, 6 - внешний волокнистый слой, 7 - внутренний волокнистый слой,
8 - базальная мембрана (рис. 1A). При больших увеличениях электронного микроскопа
над эпикутикулой был обнаружен тонкий гликопротеиновый слой (рис. 1B). Измере-
ния толщины слоёв кутикулы паразита были статистически обработаны, результаты
представлены в табл. 1. Общая толщина кутикулы нематоды составляет 2.4-2.7 мкм
(2.5 ± 0.035 мкм). По всей длине тела у особей обоего пола располагается пара
латеральных крыльев, которые имеют кутикулярное происхождение (рис. 1C и 1D).
Крылья состоят из коркового, гомогенного и фибриллярного слоев (рис. 1D). Толщина
коркового слоя на боковой части крыльев составляет 0.79-1.19 мкм (0.94 ± 0.048 мкм),
на кончиках 0.40-0.57 мкм (0.48 ± 0.022 мкм). Гомогенный и фибриллярный слои
имеют толщину 1.48-4.19 мкм (2.72 ± 0.33 мкм) и 1.03-3.20 мкм (1.90 ± 0.21 мкм) со-
ответственно. Длина латеральных крыльев составляет 20.3-34.3 мкм (27.3 ± 0.16 мкм).
В отличие от кутикулы, гомогенный слой на боковых крыльях выглядит темным и
состоит из двух частей (рис. 1D). У самцов, в отличие от самок, боковые крылья
более развиты в каудальной части и окружают бурсу (рис. 2А и 2B). При электронно-
микроскопическом исследовании кутикулярных крыльев вокруг бурсы наблюдается
структура, сходная с ультраструктурой боковых крыльев. Однако гомогенный слой во-
круг бурсы в 4 раза толще, чем в гомогенном слое крыльев (толщина 7.29-14.30 мкм
(11.34 ± 0.82 мкм)) и не разделен на две части (рис. 2С). У самок внешняя форма
кутикулы в передней, средней и задней частях тела одинакова. У самцов, в передней
части тела, форма кутикулы гладкая (рис. 2D). В области расположения семенного
22
мешка на поперечных срезах гельминта прослеживаются углубления, расположенные
на одинаковом расстоянии (4 мкм) друг от друга. Эти углубления простираются до
гомогенного слоя кутикулы (рис. 2Е). В задней части тела, в области расположения
спикул, кутикула имеет форму волны (рис. 2F).
Рисунок 1. Ультраструктура кутикулы нематоды H. dispar. A, B, D - электронно-
микроскопические фотографии ультратонких поперечных срезов (50-70 нм), окрашенных
уранилацетатом и цитратом свинца; C - фотография на световом микроскопе, полутонкий
поперечный срез (1 мкм), двухслойное окрашивание методом D’Amico. А - слои кутикулы,
B - гликопротеиновый слой, C и D - латеральные крылья. 1 - эпикутикула, 2 - внешний
корковый слой, 3 - внутренний корковый слой, 4 - внешний гомогенный слой,
5 - внутренний гомогенный слой, 6 - внешний волокнистый слой, 7 - внутренний
волокнистый слой, 8 - базальная мембрана, Cu - кутикула, Hy - гиподерма,
ML - мышечный слой, C - корковый слой, H - гомогенный слой, F - фибриллярный слой,
двойные черные стрелки - тонкий гликопротеиновый слой.
Figure 1. Ultrastructure of cuticle of the nematode H. dispar. A, B, D - electron microscopic
photograph of an ultra-thin cross section (50-70 nm) stained by uranyl acetate and lead citrate;
C - light microscopic photograph of a semi-thin cross section (1 μm), two-layer staining by
D’Amico method. А - layers of cuticle, B - glycoprotein layer, C and D - lateral alae.
23
Рисунок 2. Формы кутикулы нематоды H. dispar. А-B - фотографии на световом
микроскопе, полутонкий поперечный срез (1 мкм), двухслойное окрашивание методом
D’Amico; C-F - электронно-микроскопические фотография ультратонких поперечных срезов
(50-70 нм), окрашенных уранилацетатом и цитратом свинца. А и B - кутикула вокруг бурсы
самца, C - гомогенный слой кутикулы около бурсы, D - гладкая форма кутикулы,
E - кутикула с углублениями (до гомогенного слоя), F - кутикула в форме волны.
C - корковый слой, H - гомогенный слой, F - фибриллярный слой, Hy - гиподерма,
ML - мышечный слой, черные стрелки - боковые крылья бурсы.
Figure 2. Forms of cuticle of the nematode H. dispar. А-B - light microscopic photograph
of a semi-thin cross section (1 μm), two-layer staining by D’Amico method; C-F - electron
microscopic photograph of an ultra-thin cross section (50-70 nm) stained by uranyl acetate
and lead citrate. А-B - cuticle around bursae of the male nematode, C - homogeneous layer
of the cuticle around the bursae, D - smooth form of cuticle, E - cuticle with depressions
(up to a homogeneous layer), F - cuticle in wave form.
24
Рисунок 3. Ультраструктура базальной части кутикулы и гиподермы нематоды H. dispar.
Электронно-микроскопические фотографии ультратонких поперечных срезов (50-70 нм),
окрашенных уранилацетатом и цитратом свинца. A - трубкообразные структуры
в базальной части кутикулы, B - кожно-мускульный мешок, в том числе и гиподерма,
C - органеллы гиподермы, D - филаменты в гиподерме, E - полудесмосомы между
кутикулой и гиподермой, F - ядра в валиках. Cu - кутикула, Hy - гиподерма,
ML - мышечный слой, M - митохондрия, V - вакуоль, GL- гликоген, Hd - полудесмосом,
Lq - латеральные крылья, N - ядро, Ik - секреторный канал, Lb и черные стрелки
(A) - трубкообразные структуры, черные стрелки (D) - филаменты.
Figure 3. Ultrastructure of basal layer of the cuticle and hypodermis of the nematode H. dispar.
Electron microscopic photograph of an ultra-thin cross section (50-70 nm) stained by uranyl
acetate and lead citrate. А - sustaining structures in the basal layer of the cuticle, B - body wall,
including hypodermis, C - organelles of the hypodermis, D - filaments in hypodermis,
E - hemidesmosomes between cuticle and hypodermis, F - nucleuses in hypodermal ridges.
25
Таблица 1. Некоторые статистические расчеты толщины слоев кутикулы
нематоды Heterakis dispar
Table 1. Some statistical calculations of layers thickness of cuticule
from the nematode Heterakis dispar
Слои кутикулы
Min, мкм
Max, мкм
X ± Sx, мкм
Эпикутикула
0.013
0.015
0.014 ± 0.00016
Корковый
Внешний корковый
0.019
0.028
0.024 ± 0.0011
Внутренний корковый
0.254
0.285
0.274 ± 0.003
Внешний гомогенный
0.393
0.448
0.424 ± 0.007
Гомогенный
Внутренний гомогенный
0.686
0.753
0.708 ± 0.007
Внешний волокнистый
0.764
0.841
0.798 ± 0.009
Фибриллярный
Внутренний волокнистый
0.205
0.277
0.238 ± 0.008
Базальная мембрана
0.017
0.022
0.021 ± 0.0007
Для каждого параметра n = 36.
В базальном слое кутикулы были выявлены поддерживающие трубкообразные
структуры, толщина которых составляла 0.079-0.144 мкм (0.12 ± 0.006 мкм) (рис. 3A).
При более высоких увеличениях микроскопа внутри этих трубок также наблюдались
фибриллы и микротрубочки.
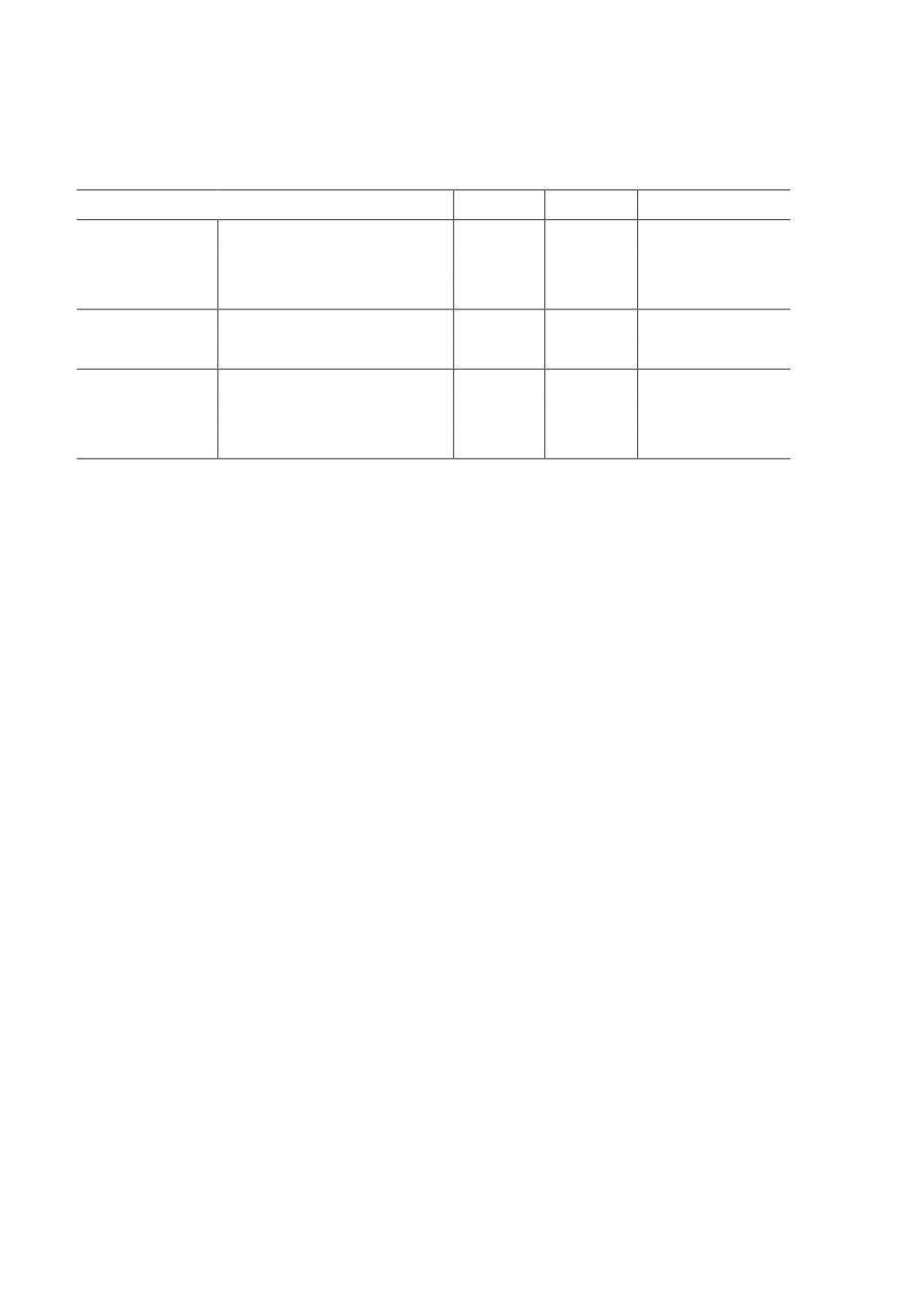
Гиподерма. Гиподермальный слой нематод располагается между кутикулой и
мышечным слоем паразита (рис. 3B). Слой имеет синцитиальное строение. По всей
длине гиподерма образует 4 гиподермальных валика, 2 латеральных, 1 дорсальный
и 1 вентральный. Толщина латеральных валиков достигает 82.17-84.92 мкм (83.57 ±
0.36 мкм). Дорсальный валик имеет толщину 46.92-48.43 мкм (47.78 ± 0.18 мкм),
а вентральный валик не превышает 41.47-44.32 мкм (42.48 ± 0.32 мкм). Дорсальные
валики крупнее вентральных, а латеральные почти в два раза больше обоих. Толщина
гиподермы, вне гиподермальных валиков, достигает 2.24-4.44 мкм (3.40 ± 0.24 мкм).
В гиподерме обнаружены вакуоли, рибосомы, эндоплазматическая сеть и комплек-
сы Гольджи, а также большое количество митохондрий и гликоген (рис. 3C). Кроме
того, в гиподерме выявлены многочисленные плотные филаменты (рис. 3D). Между
базальным слоем кутикулы и мембраной гиподермы наблюдались полудесмосомы
(рис. 3Е). В гиподермальных валиках обнаруживаются ядра (рис. 3F). В каждом из ла-
теральных валиков отмечено по два ядра, диаметр которых составляет 4.02-6.73 мкм
(5.38 ± 0.35 мкм). В дорсальном и вентральных валиках ядра нами не обнаружены.
В латеральных валиках наблюдаются гликоген, митохондрии, эндоплазматическая
сеть, рибосомы, комплекс Гольджи, микротрубочки, различные типы миофибрилл
и вакуоли. Кроме того, в латеральных валиках были выявлены цитоплазматические
тельца (inclusion bodies) (рис. 4А и 4В). Цитоплазматические тельца, диаметр которых
составляет 0.31-0.61 мкм (0.49 ± 0.042 мкм), были также обнаружены в гиподерме,
26
находящейся под кутикулярными крыльями вокруг бурсы самца. В кутикуле, рас-
положенной на границе с латеральными валиками, наблюдаются отростки базальной
мембраны (длина 0.53-0.95 мкм (0.75 ± 0.04 мкм)) (рис. 4А и 4B). При высоких
увеличениях микроскопа хорошо видны все три слоя отростков базальной мембраны
(рис. 4B). Те же самые отростки были обнаружены в кутикулярных крыльях самцов
нематод H. dispar. Однако длина их меньше (0.35-0.66 мкм (0.46 ± 0.035 мкм)), чем
у вышеуказанных.
Рисунок 4. Структура отростков базальной мембраны, цитоплазматических телец и
экскреторного канала гиподермы нематоды H. dispar. Электронно-микроскопические
фотографии ультратонких поперечных срезов (50-70 нм), окрашенных уранилацетатом и
цитратом свинца. A - общий вид отростков базальной мембраны, цитоплазматических телец,
B - те же отростки при увеличении 100 000, C - общий вид экскреторного канала,
D - ультраструктура цитоплазмы канала. Cu - кутикула, Sb - цитоплазматические тельца,
Md - отростки базальной мембраны, Ik - секреторный канал, R - рибосом,
De - гранулярная эндоплазматическая сеть, K - каналы, Km - просвет экскреторного канала,
Bm - просвет канальцев, Me - мембрана стенки экскреторного канала, M - митохондрии,
V1 - вакуоли в латеральных валиках, V2 - прикрепленные к мембране вакуоли;
снежинки (С) - гиподермальный валик.
Figure 4. The structure of basement membrane processes, inclusion bodies, and excretory canal
of hypodermis of the nematode H. dispar. Electron microscopic photograph of an ultra-thin cross
section (50-70 nm) stained by uranyl acetate and lead citrate. A - general view of the basement
membrane processes and inclusion bodies, B - same processes at a magnification 100 000,
C - general view of the excretory canal, D - ultrastructure of the cytoplasm of canals.
27
В центре каждого латерального валика расположен трубчатый экскреторный канал,
который имеет клеточное строение и диаметр которого достигает 2.61-4.20 мкм (3.58 ±
0.20 мкм). Его цитоплазма содержит различные органеллы - рибосомы, гранулярную
эндоплазматическую сеть, митохондрии, вакуоли и каналы (рис. 4C и 4D). В мем-
бране клетки имеются поры. Прослеживается процесс выведения продуктов обмена
с участием вакуолей, расположенных в латеральных валиках. Вакуоли приближаются
к мембране секреторного канала, их содержимое попадают в цитоплазму стенки экс-
креторного канала через отверстия (поры) мембраны путем эндоцитоза (рис. 4D). Из
цитоплазмы выделенные вещества переходят в каналы, которые находятся в толще
стенки экскреторного протока. Эти каналы открываются в просвет экскреторного
канала (рис. 4D). Попавшие в этот просвет продукты обмена удаляются из организма
посредством протока, расположенного в передней части гельминта.
Нервная система нематоды H. dispar ортогональная, состоит из нервного кольца
и отделяющихся от него нервных стволов. Эти стволы расположены в дорсальных и
вентральных валиках. Нервные стволы соединяются между собой множеством комис-
сур. Комиссуры имеют форму полуколец. Дорсальный ствол иннервирует мышечные
клетки спинной части, а вентральный ствол - брюшную часть тела паразита. Нервные
клетки иннервируют также стенки органов пищеварения и размножения. Вентральный
ствол толще, чем спинной. Общий вид вентрального и дорсального гиподермаль-
ных валиков показан на рис. 5А и 5С, а структура нервных стволов представлена на
рис. 5В и 5D. В центральной части вентрального и дорсального валиков отчетливо
видны отростки нервных клеток - дендриты и аксоны. Аксоны содержат микротру-
бочки и нейрофиламенты. В дендритах, кроме выше указанных структур, обнаружи-
ваются митохондрии, а также гликоген (рис. 5В и 5D).
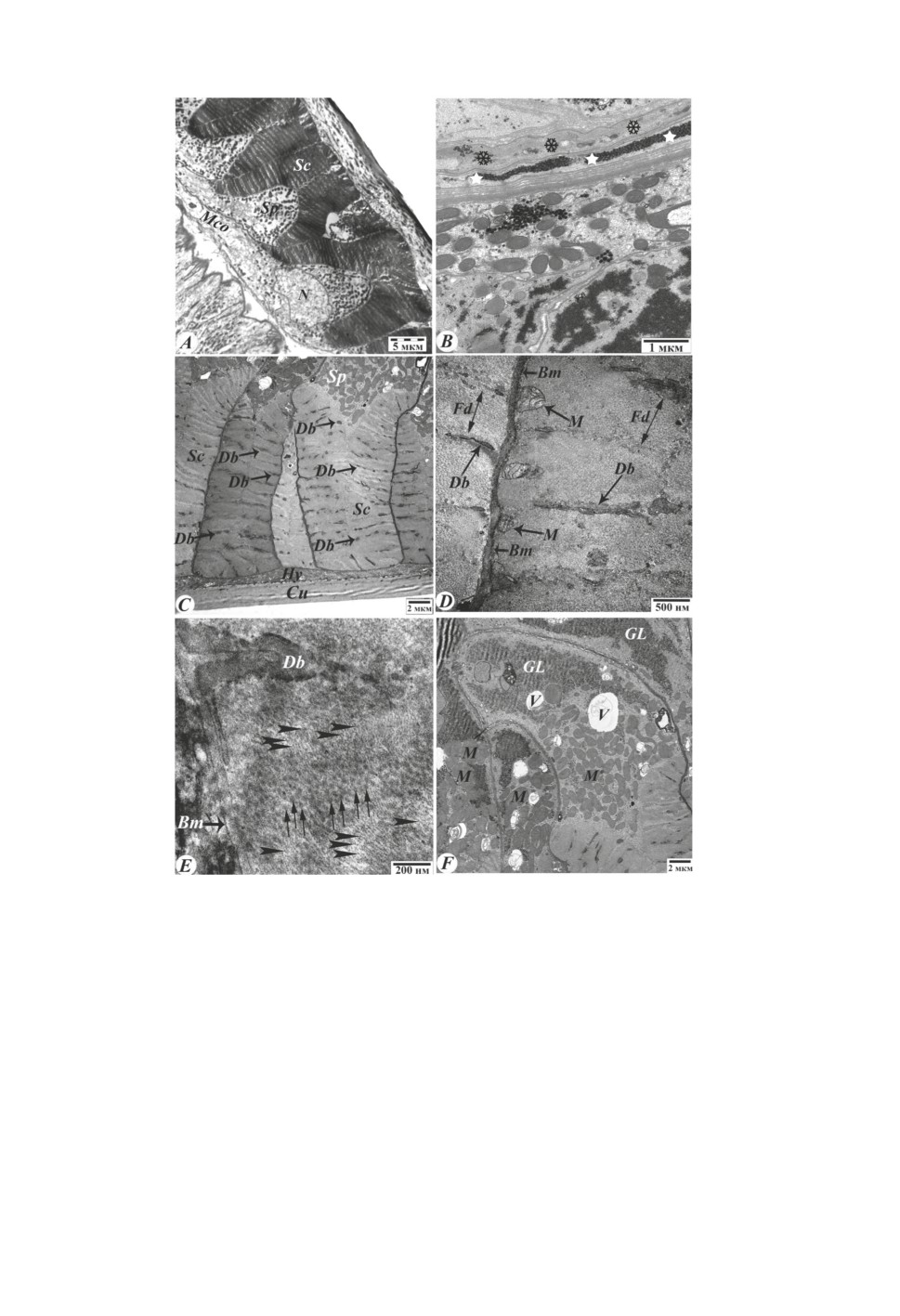
Мышечный слой. Являясь третьим слоем кожно-мускульного мешка, располага-
ется между гиподермой и стенкой первичной полости тела. Мышечный слой паразита
развит хорошо. Его толщина достигает 21.28-27.28 мкм (24.54 ± 0.62 мкм). Посред-
ством гиподермальных валиков мышечной слой разделен на 4 части. Установлено, что
количество мышечных клеток между валиками у нематоды H. dispar колеблется от
17 до 26 в зависимости от пола и части тела гельминта. Мышечный слой нематоды
H. dispar относится к полимиарному типу. Мышечные клетки образованы из трех частей -
саркомера (диаметр 7.02-18.16 мкм (12.83 ± 1.37 мкм)), саркоплазмы (диаметр 5.65-
15.34 мкм (10.91 ± 1.28 мкм)) и цитоплазматических отростков (рис. 6А). В центре
саркоплазмы расположено большое ядро. Его продольная ось достигает 4.66-6.33 мкм
(5.54 ± 0.19 мкм). Цитоплазматические отростки мышечных клеток направлены
в сторону нервных пучков, которые расположены в вентральных и дорсальных гипо-
дермальных валиках (рис. 6В). В цитоплазме этих отростков наблюдаются митохон-
дрии, вакуоли и большое количество гликогена (рис. 6В). Мышечный слой отделяет от
гиподермы базальная мембрана. Ее толщина равна 0.037-0.065 мкм (0.049 ± 0.003 мкм).
Сократимая часть мышечной клетки состоит из двух крупных фибриллярных стволов
28
(рис. 6С). Стволы, в свою очередь, разделяются на многочисленные продольные фи-
бриллярные пучки (рис. 6D). Между фибриллярными волокнами располагаются темные
тельца (dense bodies). Их диаметр составляет 0.091-0.17 мкм (0.14 ± 0.01 мкм). Фи-
бриллярные пучки делятся на толстые (диаметр 0.019-0.024 мкм (0.022 ± 0.0005 мкм))
и тонкие (диаметр 0.004-0.006 мкм (0.005 ± 0.0002 мкм)) филаменты (рис. 6Е).
В цитоплазме саркоплазмы также наблюдаются митохондрии, гликоген и вакуоли
(рис. 6F). При высоком разрешении электронного микроскопа в сократимой части
мышечных клеток было выявлено небольшое количество митохондрий (рис. 6D).
Рисунок 5. Ультраструктурные особенности нервных стволов нематоды H. dispar.
Электронно-микроскопические фотографии ультратонких поперечных срезов (50-70 нм),
окрашенных уранилацетатом и цитратом свинца. A - общий вид вентрального нервного
ствола, B - ультраструктура нервных клеток вентрального ствола, C - общий вид
дорсального нервного ствола, D - ультраструктура нервных клеток дорсального ствола.
Mс - мышечные клетки, Ax - аксон, Dt - дендрит, Cu - кутикула, NC - нервный ствол,
Vc - вентральный валик, Dc - дорсальный валик.
Figure 5. Ultrastructural features of nerve cords of the nematode H. dispar. Electron microscopic
photograph of an ultra-thin cross section (50-70 nm) stained by uranyl acetate and lead citrate.
A - general view of ventral nerve cord, B - ultrastructure of nerve cells of the ventral cord,
C - general view of dorsal cord, D - ultrastructure of nerve cells of the dorsal cord.
29
Рисунок 6. Строение мышечных клеток нематоды H. dispar. Электронно-микроскопические
фотографии ультратонких поперечных срезов (50-70 нм), окрашенных уранилацетатом
и цитратом свинца. А - общий вид мышечной клетки, B - электронограмма
цитоплазматического отростка мышечных клеток, C - общий вид саркомера, D - строение
саркомера, E - тонкие и толстые филаменты, F - структура саркоплазмы. Sc - саркомер,
Sp - саркоплазма, Mco и звезда (B) - цитоплазматические отростки мышечных клеток,
N - ядро, Cu - кутикула, Hy - гиподерма, Bm - базальная мембрана, Db - темные тельцы,
V - вакуоль, M - митохондрия, GL - гликоген, Fd - фибриллярные пучки,
стрелка (Е) - толстые филаменты, голова стрелы (Е) - тонкие филаменты,
снежинка (B) - отросток нервной клетки.
Figure 6. The structure of muscle cells of the nematode H. dispar. Electron microscopic
photograph of an ultra-thin cross section (50-70 nm) stained by uranyl acetate and lead citrate.
А - general view of muscle cell, B - electronogram of the muscle arms, C - general view
of the sarcomere, D - structure of the sarcomere, E - thin and thick filaments,
F - structure of the sarcoplasm.
30
ОБСУЖДЕНИЕ
В доступной нам литературе имеются данные о некоторых микроморфологиче-
ских особенностях кожно-мускульного мешка паразитических червей двух видов
H. gallinarum (Martini, 1909; Богоявленский, Дрыночкина, 1968; Богоявленский, 1973)
и H. spumosa (Шарипова, 1972; Mehlhorn, Harder, 1997), относящихся к семейству
Heterakidae. Из них нематода H. spumosa частично изучена с использованием элек-
тронного микроскопа (Mehlhorn, Harder, 1997). Все вышеуказанные авторы отмечали,
что кожно-мышечный мешок исследованных нематод состоит из кутикулы, гиподермы
и мышечного слоя. У нематоды H. dispar, изученной нами впервые на ультраструк-
турном уровне и относящейся к тому же семейству, кожно-мускульный мешок также
состоит из указанных слоев (рис. 1А, 3В). В кутикуле нематоды H. dispar нами было
выявлено восемь слоев. То же количество слоёв кутикулы было обнаружено ранее
у другого вида этого же рода, H. gallinarum (Богоявленский, 1973). В результате
анализа полученных нами статистических данных (табл. 1) для нематоды H. dispar
установлено, что корковый слой составляет 12.4%, гомогенный слой - 45.3%, а фи-
бриллярный слой - 42.3% от общей толщины кутикулы. У свободноживущих почвен-
ных нематод (Caenorhabditis elegans) эпикутикулу снаружи покрывает гликокаликс
(гликопротеин) (Page, Johnstone, 2007; Cox et al., 1981). В наших исследованиях над
эпикутикулой гельминта H. dispar на больших увеличениях микроскопа (>100000)
также был прослежен гликокаликс (рис. 1B). В литературе сведения о поверхностном
покрытии кутикулы гликопротеином у видов, относящихся к семейству Heterakidae,
нами не обнаружены. Эти данные по семейству приводятся впервые. Имеются данные
о том, что строение и форма кутикулы могут быть различными у взрослых особей и
личиночных стадий, самцов и самок или в разных частях тела одной и той же особи.
Подобные различия ранее наблюдались нами при изучении ультраструктуры кожно-
мускульного мешка нематоды Trichostrongylus tenuis (Mehlis, 1846), относящейся
к другому семейству (Trichostrongylidae) (Сеидбейли и др., 2020; Рзаев и др., 2020).
По форме и структуре кутикулы 4-я личиночная стадия нематоды T. tenuis сильно
отличалась от половозрелой формы. В другом нашем исследовании установлено, что
нематода T. tenuis имеет 4 различные формы кутикулярных крыльев (Рзаев и др.,
2020). Подобные различия в строении кутикулы, отмеченные выше, обнаружены нами
у самцов нематоды H. dispar. Так, в передней части тела паразита кутикула гладкая,
а в средней находятся углубления, которые располагаются на одинаковом расстоянии
друг от друга. В задней части тела кутикула имеет форму волны (рис. 2D-2F). Эти
различия не обнаружены у самок нематоды H. dispar. Другой отличительной чертой
кутикулы является то, что ее гомогенный слой в латеральных крыльях нематоды
H. dispar толще, чем в других частях кутикулы паразита. При этом в базальном слое
кутикулы отмечено наличие трубкообразных структур (рис. 3A). Согласно результа-
там анализа литературных данных, похожие поддерживающие структуры (sustaining
structures) выявлены также у нематоды Procamallanus (Spirocamallanus) halitrophus
31
(Nematoda: Camallanidae) (Cardenas et al., 2005). По данным авторов, поддерживаю-
щие структуры имеют округлую или удлиненную форму (Cardenas et al., 2005). Эти
же структуры, которые называются «распорками» и которые соединяют внутреннюю
кору с волокнистым слоем, присутствуют в промежуточном слое C. elegans. Авторы
считают, что они способствует равномерному распределению сил в кутикуле (Peixoto
et al., 1997). Эти структуры впервые выявлены у нематод семейства Heterakidae.
Микроморфологические особенности строения гиподермы нематод семейства
Heterakidae изучены слабо. Имеется лишь несколько работ, посвященных этой теме
(Богоявленский, 1973; Mehlhorn, Harder, 1997; Насиров и др., 2008). В литературе
отмечается, что между базальным слоем кутикулы и мембраной гиподермы просле-
живаются полудесмосомы (Bird, Bird, 1991). Эта же информация была подтверждена
в работе других авторов (Neuhaus et al., 1996). Мы тоже наблюдали эти структуры
у нематоды H. dispar на больших увеличениях электронного микроскопа (рис. 3E).
Имеются также литературные сведения о расположении ядер в латеральных валиках
(Frantova et al., 2005). В других источниках имеются сведения о наличии одного-
двух крупных или же нескольких мелких ядер (у нематоды H. gallinarum) в гиподер-
мальных валиках (Богоявленский, 1973). Согласно результатам наших исследований,
у нематоды H. dispar в каждом боковом латеральном валике находится по два ядра
(рис. 3F). Цитоплазматические тельца (рис. 4А, 4В), обнаруженные в гиподерме не-
матоды H. dispar, представляют собой темные шаровидные белковые образования
различных размеров. По данным некоторых авторов, эти образования формируются
в результате экспрессии рекомбинантных белков (Cardenas et al., 2005). Ранее бел-
ки цитоплазматических телец обнаружены в клетках нейронов, различных тканевых
клетках, и в том числе в эритроцитах, бактериях, вирусах и растениях (Singhvi, Panda,
2022; Hashemzadeh et al., 2021). Цитоплазматические тельца были обнаружены и
у гельминтов P. (S.) halitrophus, относящегося к семейству Camallanidae, и Ascaridia
suum, относящегося к семейству Ascaridiidae. Цитоплазматические тельца отмечались
в латеральных валиках, в т.ч. среди фибрилл, в цитоплазме мышечных клеток мы-
шечного слоя, вокруг эндоплазматических сетей и микротрубочек кишечной клетки
(Cardenas et al., 2005). Мы не нашли сведений об отростках базальной мембраны на
границе кутикулы и гиподермы у других видов нематод, принадлежащих к семейству
Heterakidae (рис. 4А и 4В). Но имеются данные о нахождении этих же отростков
у нематоды Wuchereria bancrofti, которая относится к семейству Onchocercidae и па-
разитирует у человека (Oliveira-Menezes et al., 2010). По нашему мнению, такая на-
правленность базальной мембраны в сторону гиподермы во много раз увеличивает
площадь контакта кутикулы с гиподермой и придает им прочность.
Нами обнаружено, что через центральную часть каждого из латеральных валиков
гиподермы гельминта проходит экскреторный канал. Есть подробные сведения об
ультраструктурном строении выводных каналов нематод Cystidicoloides ephemeridarum,
32
Trichostrongylus colubriformis, Haemonchus placei, Nematodirus battus (Frantova,
Moravec, 2003; Smith, Harness, 1972; Martin, Lee, 1983). Имеются также краткие све-
дения об ультраструктуре экскреторных каналов нематоды H. spumosa, относящейся
к семейству Heterakidae (Mehlhorn, Harder, 1997). Анализ собственных и литератур-
ных данных показал, что морфометрические показатели выводного канала нематоды
вида H. dispar соответствуют таковым нематоды вида H. spumosa, но меньше, чем
у других исследованных видов (C. ephemeridarum, T. colubriformis, H. placei, N. battus),
относящихся к другим семействам.
Ультраструктурное строение нервных стволов, находящихся в дорсальном и
вентральном гиподермальных валиках, ранее изучено у нематод C. ephemeridarum,
P. halitrophus, T. colubriformis и H. placei (Smith, Harness, 1972; Frantova, Moravec,
2003; Cardenas et al., 2005), а также у нематоды H. spumosa, относящейся к семей-
ству Heterakidae (Mehlhorn, Harder, 1997). Наши данные о структуре нервных стволов
H. dispar соответствуют ранее полученным данным.
Исследования показали, что мышечная система H. dispar состоит из соматических
мышечных клеток. По данным некоторых авторов, между гиподермой и мышечными
клетками имеется базальная пластинка (basal lamina) (Cardenas et al., 2005). В то же
время в работах других исследователей сообщается о наличии в этой области базаль-
ной мембраны (Bird, Bird, 1991; Lecroisey et al., 2007). Мы считаем, что у нематоды
H. dispar между гиподермой и мускульным слоем располагается базальная мембрана.
Обычно мышечные клетки большинства видов нематод состоят из трех частей - со-
кратимой, плазматической и мышечных отростков. Имеются данные об отсутствии
отростков у некоторых видов нематод (Богоявленский, 1973; Сеидбейли и др., 2020;
Рзаев и др., 2020). Среди нематод, принадлежащих к семейству Heterakidae, отростки
имеют H. gallinarum и H. spumosa (Mehlhorn, Harder, 1997; Богоявленский, 1973).
Нами также были обнаружены отростки мышечных клеток у нематоды H. dispar. Ана-
лиз литературных (Богоявленский, 1973; Mehlhorn, Harder, 1997) и собственных дан-
ных показал, что все исследованные виды нематод, входящие в семейство Heterakidae,
в том числе и нематода H. dispar, имеют полимиарный тип мышечного слоя.
ВЫВОДЫ
Установлено, что кутикула нематоды H. dispar состоит из восьми слоев. Гомоген-
ный слой в латеральных крыльях, как у самцов, так и у самок состоит из двух частей
и значительно толще других слоев. В отличие от самок, у самцов форма кутикулы на
передней части тела гладкая, в средней части заметны углубления, расположенные
на одинаковом расстоянии одно от другого и направленные внутрь (до гомогенного
слоя) кутикулы. В задней части тела кутикула имеет форму волны. В базальном слое
кутикулы выявлены трубкообразные структуры, которые состоят из плотных фибрилл
и микротрубочек и которые ранее не были обнаружены у изученных видов семей-
33
ства Heterakidae. Дорсальный гиподермальный валик нематоды крупнее вентрального,
а латеральные почти в два раза больше вышеупомянутых. Выявлены ультраструк-
турные особенности экскреторного канала, расположенного в центре латеральных
валиков. Нервная система гельминта ортогональная, состоит из узловатого кольца и
нервных стволов. Вентральный ствол по толщине больше, чем спинной. Мышечный
слой нематоды H. dispar относится к полимиарному типу, число мышечных клеток
колеблется от 17 до 26 в зависимости от пола и части тела гельминта.
СПИСОК ЛИТЕРАТУРЫ
Богоявленский Ю.К. 1973. Структура и функции покровных тканей паразитических нематод. Москва, Наука,
205 с. [Bogoyavlensky Yu.K. 1973. Structure and functions of integumentary tissues of parasitic nematodes.
Moscow, Nauka, 205 pp. (in Russian)].
Богоявленский Ю.К., Боголепова И.И., Онушко Н.В. 1982. Микроструктура тканей паразитических нематод.
Москва, Наука, 277 с. [Bogoyavlensky Yu.K., Bogolepova I.I., Onushko N.V. 1982. Microstructure of
tissues of parasitic nematodes. Moscow, Nauka, 277 pp. (in Russian)].
Богоявленский Ю.К., Дрыночкина З.В. 1968. Сравнительно-гистологическое изучение кожно-мускульного
мошка некоторых оксиурат. Материалы к научной конференции ВОГ. М., ч. 1, 38-44. [Bogoyavlensky
Yu.K., Drynochkina Z.V. 1968. Comparative histological study of the bady wall of some oxyurates.
Materials for the scientific conference VOG. Moscow, Vol. 1, 38-44. (in Russian)].
Дубинина М.Н. 1971. Паразитологическое исследование птиц. Методы паразитологических исследований.
Ленинград, Наука, 140 с. [Dubinina M.N. 1971. Parasitological study of birds. Methods of parasitological
research. Leningrad, Nauka, 140 pp. (in Russian)].
Насиров А.М., Бунятова К.И., Казиева Н.Ш., Рзаев Ф.Г. 2008. Микроморфология тканей нематоды Gangu-
leterakis dispar (Schrank, 1790). Материалы IV Всероссийского Съезда Паразитологического общества
при РАН, «Паразитология в XXI веке - проблемы, методы, решения». Т. 2. Санкт-Петербург: Лемма,
208-210.[ Nasirov A.M., Bunyatova K.I., Kazieva N.Sh., Rzaev F.H. 2008. Micromorphology of tissues
of the nematode Ganguleterakis dispar (Schrank, 1790). Materials of the IV All-Russian Congress of the
Parasitological Society at the Russian Academy of Sciences, “Parasitology in the XXI century - problems,
methods, solutions”. Vol. 2. StP.: Lemma, 208-210. (in Russian)].
Рзаев Ф.Г., Сеидбейли М.И., Магеррамов С.Г., Гасымов Э.К. 2020. Формы и ультраструктурные особенности
латеральных крыльев гельминта Trichostrongylus tenuis Mehlis, 1846 (Nematoda: Trichostrongylidae).
Вестник Харковского национального университета им. В.Н. Каразина 34: 112-119. https://doi.
org/10.26565/2075-5457-2020-34-12 [Rzayev F.H., Seyidbeyli M.I., Maharramov S.H., Gasimov E.K.
Forms and ultrastructural features of the lateral alae of the helminth Trichostrongylus tenuis Mehlis, 1846
(Nematoda: Trichostrongylidae). The Journal of V.N. Karazin Kharkiv National University 34: 112-119.
Рыжиков К.М. 1967. Определитель гельминтов домашних водоплавающих птиц. Москва, Наука, 262 с.
[Ryzhikov K.M. 1967. Key to helminths of domestic waterfowl. Moscow, Nauka, 262 pp. (in Russian)].
Скрябин К.И. 1928. Метод полевых гельминтологических вскрытий позвоночных, включая человека. Мо-
сква, Московский государственный университет, 46 с. [Skryabin K.I. 1928. Method of field helmin-
thological dissections of vertebrates, including humans. Moscow, Moscow State University, 46 pp. (in
Russian)].
Сеидбейли М.И., Рзаев Ф.Г., Гасымов Э.К. 2020. Ультраструктурные особенности кожно-мускульного мешка
гельминта Trichostrongylus tenuis (Mehlis, 1846) (Nematoda: Trichostrongylidae). Паразитология 54
(5): 402-412. DOI: 10.31857/S123456780605003X [Seyidbeyli M.I., Rzayev F.H., Gasimov E.K. 2020.
Ultrastructural features of the body wall of the helminth Trichostrongylus tenuis (Mehlis, 1846) (Nematoda:
Trichostrongylidae). Parazitologiya 54 (5): 402-412. (in Russian)] doi: 10.31857/S123456780605003X
34
Шарипова А.А. 1972. Микроморфологическое исследование покровных тканей и соматической мускулатуры
нематоды Ganguleterakis spumosa (Schneider, 1866). Материалы конференции по микроморфологии
гельминтов. Кемерово, 87-89. [Sharipova A.A. 1972. Micromorphological study of integumentary tis-
sues and somatic muscles of the nematode Ganguleterakis spumosa (Schneider, 1866). Materials of the
conference on the micromorphology of helminths. Kemerovo, 87-89. (in Russian)].
Bird F.A., Bird J. 1991. The structure of Nematodes. 2nd edition. Academic Press, San Diego, 316 pp.
Bobrek K., Hildebrand J., Urbanowicz J., Aweł A. 2019. Molecular identification and phyloge-
netic analysis of Heterakis dispar isolated from Geese. Acta Parasitologica 64: 753-760.
Cardenas M.Q., Souza D.W., Lanfredi R.M. 2005. Ultrastructure of Procamallanus (Spirocamallanus) halitrophus
(Nematoda: Camallanidae) parasite of flounder. Parasitol Research 97: 478-485. doi: 10.1007/s00436-
005-1477-5
Cox G.N., Kusch M., Edgar R.S. 1981. Cuticle of Caenorhabditis elegans: its isolation and partial characterisa-
tion. Journal of Cell Biology 90: 7-17. doi: 10.1083/jcb.90.1.7
D’Amico F. 2005. A polychromatic staining method for epoxy embedded tissue: a new combination of
methylene blue and basic fuchsine for light microscopy. Biotechnic Histochemitry 80 (5-6): 207-210.
doi: 10.1080/10520290600560897
Elshahawy I., El-Siefy M., Fawy S., Mohammed E. 2021. Epidemiological Studies on Nematode Parasites of
Domestic Geese (Anser anser f. domesticus) and First Molecular Identification and Phylogenetic Analysis of
Eyvazov A. (ed.) 2022. Taxonomic spectrum of the Azerbaijan fauna. Protozoa and helminths. Baku, Institute of
Zoology, 141 pp. (in Azerbaijanian).
Frantova D., Brunanska M., Fagerholm H., Kihlström M. 2005. Ultrastructure of the body wall of female Philo-
metra obturans (Nematoda: Dracunculoidea). Parasitology Research 95: 327-332. doi: 10.1007/s00436-
004-1294-2
Frantova D., Moravec F. 2003. Ultrastructure of the body wall of Cystidicoloides ephemeridarum (Nematoda,
Cystidicolidae) in relation to the histopathology of this nematode in salmonids. Parasitology Research 91:
100-108. doi: 10.1007/s00436-003-0935-1
Gao J.F., Hou M.R., Wang W.F., Gao Z.Y., Zhang X.G., Lu Y.X., Shi T.R. 2019. The complete mitochondrial
genome of Heterakis dispar (Ascaridida: Heterakidae). Mitochondrial DNA part B 4 (1): 1630-1631.
Hashemzadeh S.M., Mohammadi M., Ghaleh H.E.G., Sharti M., Choopani A., Panda A.K. 2021. Expression,
Solubilization, Refolding and Final Purification of Recombinant Proteins as Expressed in the form of
“Classical Inclusion Bodies” in E. coli. Protein and Peptide Letters 28 (2): 122-130. doi: 10.2174/09298
66527999200729182831
Kuo J. 2014. Electron microscopy: methods and protocols. Totowa, Humana Press, 799 pp. doi: 10.1007/978-
1-62703-776-1
Lecroisey C., Segalat L., Gieseler K. 2007. The C. elegans dense body: anchoring and signaling structure of
the muscle. Journal of Muscle Research and Cell Motility 28: 79-87. doi: 10.1007/s10974-007-9104-y
Lee D.L. 1971. The structure and development of the spermatozoon of Heterakis gallinarum (Nematoda). Journal
Lee D.L. 1973. Evidence for a sensory function for the copulatory spicules of nematodes. Journal of Zoology
Lee D.L. 1975. Structure and function of the intestinal-cloacal junction of the nematode Heterakis gallinarum.
Parasitology 70: 389-396. doi: 10.1017/S0031182000052161
Lee D.L., Lestan P. 1971. Oogenesis and egg shell formation in Heterakis gallinarum (Nematoda). Journal of
Martin J., Lee D.L. 1983. Nematodirus battus: structure of the body wall of the adult. Parasitology 86: 481-488.
doi: 10.1017/s0031182000050678
35
Martini E. 1909. Uber Subcuticula und Seitenfelder ciniger Nematoden. Zeitschrift für wissenschaftliche Zoologie
93: 535-622.
Mehlhorn H., Harder A. 1997. Effects of the synergistic action of febantel and pyrantel on the nematode Het-
erakis spumosa: a light and transmission electron microscopy study. Parasitology Research 83: 419-434.
doi: 10.1007/s004360050275
Neuhaus B., Brescianit J., Christensen Ch.M., Frandsen F. 1996. Ultrastructure and Development of the Body
Cuticle of Oesophagostomum dentatum (Strongylida, Nematoda). The Journal of Parasitology 82 (5):
Oliveira-Menezes A., Noroes J., Dreyer G., Lanfredi R. 2010. Ultrastructural analysis of Wuchereria bancrofti
Page A.P., Johnstone I.L. 2007. The cuticle, WormBook, ed. The C. elegans Research Community, WormBook,
doi/10.1895/wormbook.1.138.1
Peixoto C.A., Kramer J.M., De Souza W. 1997. Caenorhabditis elegans cuticle: a description of new elements of
Rzayev F.H. 2021a. Cestodes (Plathelminthes: Cestoda) of domestic waterfowl. Advances in Biology & Earth
Sciences 6 (2): 133-141.
Rzayev F.H. 2021b. A systematic review of flukes (Plathelminthes: Trematoda) of domestic goose (Anser anser
dom). Biosystems Diversity 29 (3): 294-302. doi: 10.15421/012137
Rzayev F.H., Nasirov A.M., Gasimov E.K. 2021. A systematic review of tapeworms (Plathelminthes, Cestoda)
of domestic ducks (Anas platyrhynchos dom). Regulatory Mechanisms in Biosystems 12 (2): 353-361.
doi: 10.15421/022148
Seyidbeyli M.I., Rzayev F.H. 2018. Systematical review of helminth fauna of waterfowl poultry in the territory
of Babek region of Nakhchivan AR. Journal of Entomology and Zoology Studies 6 (1): 1668-1671.
Singhvi P., Panda A.K. 2022. Solubilization and Refolding of Inclusion Body Proteins. Methods in Molecular
Biology 2406: 371-387. doi: 10.1007/978-1-0716-1859-2_22
Smith K., Harness E. 1972. The ultrastructure of the adult stage of Trichostrongylus colubriformis and Haemon-
chus placei. Parasitology 64: 173-179. doi: 10.1017/S0031182000029590
Yushin V.V., Claeys M., Leunissen J.L.M., Zograf J.K. 2021. Electron Microscopy Techniques. Techniques for
work with plant and soil nematodes. Boston, CABI, 230 pp. doi: 10.1079/9781786391759.0008
Wright K.A., Hui N. 1976. Post-labial sensory structures on the cecal worm, Heterakis gallinarum. The Journal
Zmoray I., Guttekova A. 1987. Ultrastructure of intestinal cells of Heterakis gallinarum. Angewandte Parasitologie
19 (2): 106-111.
ULTRASTRUCTURAL FEATURES OF THE BODY WALL OF THE HELMINTH
HETERAKIS DISPAR (SCHRANK, 1790) (NEMATODA, HETERAKIDAE)
F. H. Rzayev
Keywords: nematodes, Heterakis dispar, cuticle, hypodermis, muscle layer; ultrastruc-
ture, transmission electron microscope
SUMMARY
The structure of the body wall (cuticle, hypoderm, and muscle layer) of the nematode Heterakis
dispar (Schrank, 1790) from the family Heterakidae was studied using light and electron microscopy
methods and compared with other species of the same family. The cuticle of the adult nematode
H. dispar consists of 8 layers: 1 - an outer membrane layer or epicuticle; 2, 3 - outer and inner
cortical layers; 4, 5 - outer and inner homogeneous or middle layers; 6, 7 - outer and inner fibrous
36
or fibrillar layers; 8 - basement membrane. The cortical, homogeneous and fibrillary layers constitute
12.4, 45.3 and 42.3% of the all cuticle, respectively. The homogeneous layer of the cuticle in the
lateral ridges in both male and female and near the bursa of the male is several times as thick as
other parts of the helminth cuticle. Unlike other species of the family, males of H. dispar possess
3 different forms of cuticular structure in different parts of the body. In the basal layer of the cu-
ticle, sustaining structures consisting of dense fibrils and microtubules were found, which were not
previously noted in other species of the family. It is likely that they provide strength to the body
wall of the helminth. In the hypodermis of the nematode, dorsal, ventral, and 2 lateral ridges are
traced, the lateral ridges being twice as large as others. Ultrastructural features of the excretory
channels and nerve cords located in the hypodermal ridges, were also revealed. The nervous system
of the helminth is orthogonal. The ventral nerve cord is wider than the dorsal one. Muscle layer is
of the polymyar type, number of muscle cells arranged in groups varies from 17 to 26, depending
on the sex and body part of the helminth.
37