ПАРАЗИТОЛОГИЯ, 2023, том 57, № 1, с. 44-51.
УДК 576.895.133:595.133
Об организации ядер в тегументе
некоторых скребней классов Palaeacanthocephala
и Archiacanthocephala
© 2023 г. В. П. Никишинa,*, Д. В. Пономарёвb
aИнститут биологических проблем Севера ДВО РАН,
Портовая ул., 18, Магадан, 685000 Россия
bИнститут цитологии и генетики СО РАН,
пр. акад. Лаврентьева, 10, Новосибирск, 630090 Россия
*e-mail: nikishin@ibpn.ru
Поступила в редакцию 21.07.2022 г.
После доработки 16.12.2022 г.
Принята к публикации 22.12.2022 г.
Гигантские ядра тегумента скребней классов Archiacanthocephala и Palaeacanthocephala фраг-
ментируются на завершающем этапе формирования цистаканта в промежуточном хозяине, но
в течение дальнейшей жизни паразита фрагменты ядер могут оставаться связанными друг
с другом. Предполагается, что фрагменты каждого гигантского ядра образуют самостоятельную
сеть. Биологический смысл такой конструкции предположительно заключается в регуляции жиз-
недеятельности тегумента, объем которого многократно увеличивается в период интенсивного
роста паразита в дефинитивном хозяине.
Ключевые слова: акантоцефалы, ядра тегумента, фрагментация ядер, Corynosoma stru-
mosum, Macracanthorhynchus catulinus
DOI: 10.31857/S0031184723010040; EDN: FJKZVU
Покров скребней, как известно, представлен уникальным многоядерным образова-
нием - тегументом, организованным в виде симпласта, в отличие от синцитиального
тегумента плоских паразитических червей. Во внутреннем, радиально-волокнистом,
слое тегумента располагаются ядра или их производные. Количество и морфология
тегументных ядер во многих случаях могут существенно различаться как у пред-
ставителей разных таксономических групп, так и у одного вида на протяжении его
онтогенеза (Van Cleave, 1914, 1928). У скребней класса Eoacanthocephala шесть (реже
пять) гигантских ядер более или менее округлой формы сохраняются на протяже-
нии жизни от эмбриональной личинки до взрослой особи. У представителей класса
Archiacanthocephala в период развития паразита в промежуточном хозяине ядра ста-
44
новятся амебоидными, разветвленными или фрагментированными, и их количество,
по разным данным, может увеличиваться до двадцати или даже сотни, тогда как
у Palaeacanthocephala ядра, также без образования веретена деления, распадаются или
фрагментируются на множество небольших фрагментов (Van Cleave, 1928; Meyer,
1933; Петроченко, 1956, 1958; Robinson, 1973; Miller, Dunagan, 1985; Хохлова, 1986;
Лисицына, 2019; и др.).
Ещё ранние исследователи отмечали наличие связей между отдельными «ядер-
ными телами» (Graybill, 1902; Van Cleave, 1928), и по этой причине ядра иногда
называли «дендритными» (Graybill, 1902). Анализируя морфологию ядер у разных
видов скребней и имеющиеся на тот момент данные литературы, Van Cleave (1928)
подчеркивал, что у некоторых видов между ядерными фрагментами могут сохранять-
ся тончайшие связи: «In exceptional preparations of many of these forms it is possible
in some instances to trace minute thread-like strands of nuclear material uniting widely
dispersed nuclear bodies» (Van Cleave, 1928, p. 113). Тонкие связи между ядрами тегу-
мента у поздней акантеллы скребня Polymorphus minutus иногда наблюдались в процессе
электронно-микроскопических исследований (Butterworth, 1969), однако фотографии
связей в этой работе, как и в других, упомянутых выше, отсутствуют. В большинстве
же других исследований подобные связи не отмечались.
Изучая морфологию тегумента некоторых скребней, мы обнаружили связи фраг-
ментов ядер друг с другом. В настоящем сообщении приводятся результаты этих
наблюдений.
Материал и методика
Материалом для исследований послужили взрослые скребни Macracanthorhynchus catulinus
Kostylew, 1927 (Archiacanthocephala) и ювенильные скребни Corynosoma strumosum (Rudolphi,
1802) Lühe, 1904 (Palaeacanthocephala). Жизненный цикл M. catulinus включает обязательных
промежуточного (чернотелки) и окончательного (хищные млекопитающие) хозяев, а также
паратенического хозяина (мелкие млекопитающие). Жизненный цикл C. strumosum также трик-
сенный и включает бокоплавов в качестве промежуточного, морских и пресноводных рыб
в качестве паратенического и морских млекопитающих и рыбоядных птиц в качестве оконча-
тельного хозяев (Петроченко, 1958).
Скребней M. catulinus извлекали из кишечника окончательного хозяина - обыкновенной
лисицы (Vulpes vulpes) и препарировали по общепринятой методике с заключением их в гисто-
микс. Срезы изготовляли на микротоме Sakura Accu-Cut® SRM™ 200 (Япония), окрашивали
гематоксилин-эозином и изучали в световом микроскопе Nikon CI-S (Япония).
Скребней C. strumosum извлекали из полости тела паратенических хозяев - тихооке-
анской наваги (Eleginus gracilis) и тихоокеанской зубастой корюшки (Osmerus mordax den-
tex), фиксировали в 2%-ном глутаральдегиде на 0.1 М фосфатном буфере, постфиксировали
1%-ным тетраоксидом осмия на 0.2 М фосфатном буфере, обезвоживали в спиртах возрастаю-
щей концентрации и заключали в смесь Аралдита и Эпона. В процессе обезвоживания образцы
контрастировали 1%-ным уранилацетатом в 70%-ном спирте в течение 12 ч. Полутонкие сре-
зы изготовляли на ультрамикротоме LKB-V (Швеция), окрашивали смесью кристаллического
45
фиолетового и метиленового синего (в соотношении 1:1), изучали в световых микроскопах
Биомед-2 (Российская Федерация) и Olympus CX41 (Япония) и фотографировали цифровой
камерой Olympus E-420. Ультратонкие срезы изготовляли на ультрамикротоме PT-PC (США),
дополнительно контрастировали уранилацетатом, просматривали в электронном микроскопе
JEM 1400 PLUS (Япония) и фотографировали цифровой камерой Veleta.
Результаты и обсуждение
Тегумент исследованных скребней обоих видов устроен по единой схеме и пред-
ставляет собой симпласт, снаружи и изнутри ограниченный цитоплазматическими
мембранами. В составе тегумента определяются покровный комплекс и поперечнопо-
лосатый (полосатый), везикулярный, войлочно-волокнистый (войлочный), радиально-
волокнистый (радиальный) и трубочковый (базальный лабиринт) слои (Taraschewski,
2000; Никишин, 2004).
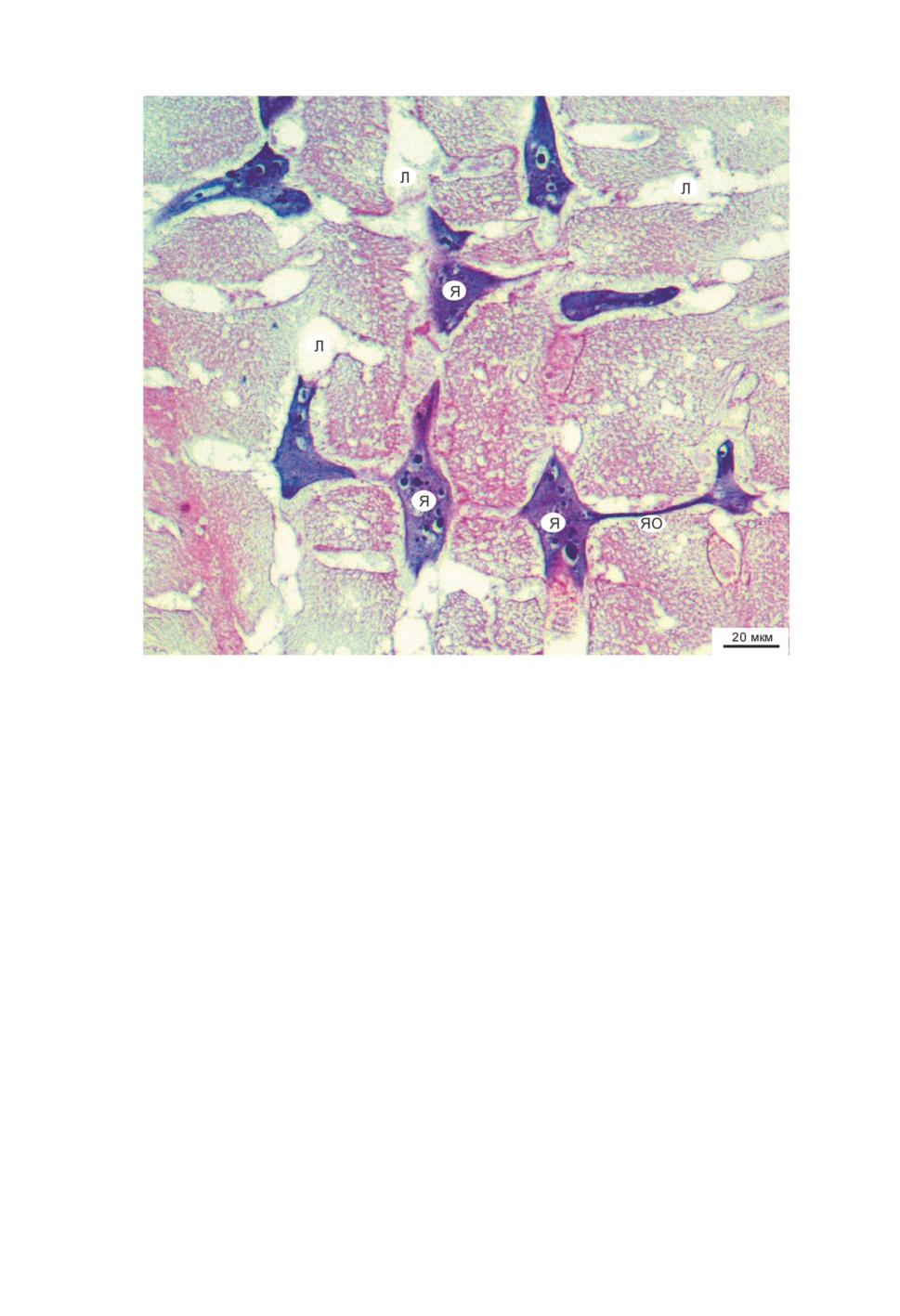
В радиально-волокнистом слое тегумента скребня Macracanthorhynchus catulinus
обнаружены многочисленные фрагменты ядер разнообразной, неправильной формы
с отростками (рис. 1). Наличие отростков затрудняет определение размеров этих
фрагментов, но в большинстве случаев они не превышают 60 мкм по большей оси.
Кариоплазма ядер интенсивно окрашена и включает плотные образования разного
размера, чаще всего напоминающие скопления гетерохроматина. Наиболее крупные
из них вследствие правильной овальной или округлой формы сходны с ядрышками
и часто полностью или частично окружены светлыми гало.
Обычно ядерные фрагменты частично или, реже, полностью располагаются в ла-
кунах тегумента. На срезах лакуны выглядят как светлые участки цитоплазмы, огра-
ниченные нечеткими тонкими фибриллоподобными элементами.
Соседние ядерные фрагменты связаны между собой тонкими отростками. Карио-
плазма отростков темная, без заметных включений. Эти связи пересекают цитоплазму
и лакуны, в которых частично или полностью помещаются ядра.
Фрагменты ядер тегумента C. strumosum, в отличие от наблюдаемых у M. catulinus,
обычно более компактные, неправильно угловатой формы, размерами 10-15 мкм (рис.
2, 3). Гомогенная кариоплазма включает несколько мелких скоплений гетерохрома-
тина и довольно часто одно ядрышко диаметром 1-3 мкм. Большинство ядерных
фрагментов характеризуется относительно короткими конусовидными выростами. От
выростов начинаются нитевидные отростки, во многих случаях связывающие ядерные
фрагменты друг с другом.
Лакуны в тегументе C. strumosum визуально не столь многочисленны, как в тегу-
менте M. catulinus, и лишь некоторые ядра частично располагаются в них. По краям
лакун, как и у первого вида, наблюдаются нечеткие фибриллоподобные образования.
У обоих видов связи между фрагментами ядер наблюдались на срезах, ориентиро-
ванных параллельно или почти параллельно поверхности тела скребней. На попереч-
ных срезах они не выявлялись; возможно, именно по этой причине, а также вслед-
ствие их малой толщины сведения об этих связях в литературе немногочисленны.
46
Рисунок 1. Фрагменты ядер (Я) в радиально-волокнистом слое тегумента скребня
Macracanthorhynchus catulinus. Л - лакуны; ЯО - отростки, связывающие ядерные
фрагменты. Световая микроскопия, гистомиксовый срез.
Figure 1. Fragments of nuclei (Я) in the radial layer of the tegument
of the Macracanthorhynchus catulinus. Л - lacunae; ЯО - processes that bind nuclear fragments.
Light microscopy, histomix section.
Согласно данным большинства исследователей (Crook, Grundmann, 1964; Butter-
worth, 1969; Olson, Pratt, 1971; Robinson, 1973; Amin, 1982; Oetinger, Nickol, 1982), фраг-
ментация ядер у разных видов скребней, относящихся к классам Palaeacanthocephala
и Archiacanthocephala, происходит в период их развития от средней до поздней акан-
теллы. Так, у Acanthocephalus jacksoni в эксперименте фрагментация «гигантских кортикаль-
ных ядер» начиналась в период между 50 и 60-ми сутками развития, а к 80-м суткам ядра были
полностью фрагментированы; при этом вполне развитые цистаканты наблюдались между 80
и 90-ми сутками эксперимента (Oetinger, Nickol, 1982). Результаты изучения развития цистакан-
тов этого вида в естественных условиях позволили предположить, что факторы, регулирующие
дифференцировку «гигантских субкутикулярных ядер» у этого вида, могут действовать неза-
висимо от факторов, влияющих на дифференцировку и рост половых зачатков (Amin, 1982).
У скребня Echinorhynchus lageniformis «гигантские кортикальные ядра становятся ден-
дритными к 22 дню» эксперимента, а к 25-му дню начинают распадаться, образуя
47
«конденсированные ядерные фрагменты»; весь период формирования цистаканта
составлял в эксперименте 30 дней (Olson, Pratt, 1971). Похожая картина наблюдается
у скребня Polymorphus minutus, у которого на стадии поздней акантеллы ядра становятся дре-
вовидными и затем распадаются на мелкие фрагменты, между которыми иногда наблюдаются
тонкие связи (Butterworth, 1969). У Moniliformis clarki многочисленные ядра отмечены
авторами на 29-е сутки эксперимента при общей его продолжительности до достиже-
ния стадии цистаканта 60 суток (Crook, Grundmann, 1964). В детальном исследовании
другого представителя рода, Moniliformis moniliformis, тегумент акантора сразу после
вылупления последнего содержит около сорока ядер, а у цистаканта их количество
примерно удваивается; через несколько часов после заражения окончательного хозяина
(крысы) ядра становятся дольчатыми и через 4 недели частично фрагментируются
(Robinson, 1973).
Рисунок 2. Фрагменты ядер (Я) в радиально-волокнистом слое тегумента скребня
Corynosoma strumosum. Л - лакуны. Овалом показаны ядерные фрагменты, тонкими
отростками связанные друг с другом. Стрелками показаны отростки ядер. Световая
микроскопия, полутонкий срез.
Figure 2. Fragments of nuclei (Я) in the radial layer of the tegument of the Corynosoma
strumosum. Л -lacunae. The oval shows nuclear fragments connected to each other by thin
processes. The arrows show the processes of the nuclei. Light microscopy, semi-thin section.
48
Рисунок 3. Два фрагмента ядра (Я) в радиально-волокнистом слое тегумента скребня
Corynosoma strumosum, вероятно соединенные отростком (стрелка). Яд - ядрышко.
Электронная микроскопия.
Figyre 3. Two fragments of the nuclei (Я) in the radial layer of the tegument of Corynosoma
strumosum, probably connected by a process (arrow). Яд - nucleolus. Electron microscopy.
Из анализа литературы следует, что, за исключением последнего случая, фрагмен-
тация ядер происходит до достижения скребнем стадии цистаканта и тем более до
перехода его в следующего хозяина. В то же время наши результаты в совокупности с
приведенными здесь данными других исследователей (Graybill, 1902; Van Cleave, 1928;
Butterworth, 1969) свидетельствуют о том, что фрагментация ядер в ряде случаев не
является полной, и между их фрагментами сохраняются связи в виде узких полосок
кариоплазмы, ограниченной типичной двумембранной ядерной оболочкой. Различия
в размерах фрагментов ядер и толщине соединяющих их отростков, по-видимому,
соответствуют различиям в размерах исследованных скребней: у M. catulinus длина
тела 35-125 мм, у C. strumosum - 5-9 мм (Петроченко, 1958). Не исключено, что
подобные связи между фрагментами ядер характерны для представителей других
видов обоих упомянутых классов скребней; дополнительные исследования должны
подтвердить или опровергнуть это предположение.
Невозможно сказать, насколько длителен процесс фрагментации, но нет
никаких данных, за исключением упомянутой работы Робинзона (Robinson, 1973),
о том, что фрагментация в таком же виде продолжается на следующей после
цистаканта стадии жизненного цикла, т.е. у ювенильных и взрослых червей. На наш
взгляд, более принципиальным является предположение о постоянстве связей между
фрагментами ядер и сохранении их у взрослых скребней, основанием для которого
являются приведенные здесь наши наблюдения взрослого скребня M. catulinus.
49
Если это предположение верно, то тогда ядерные фрагменты, возможно, остаются
объединенными этими связями в несколько систем, количество которых может быть
равно количеству первоначальных гигантских ядер тегумента. Биологический смысл
такой конструкции может заключаться в обеспечении жизнедеятельности тегумента,
объем которого многократно увеличивается в период жизни паразита в дефинитивном
хозяине. Интересно, что у представителей класса Eoacanthocephala, которые в своем
большинстве характеризуются мелкими размерами, гигантские ядра тегумента не
фрагментируются и на протяжении всей жизни паразита сохраняют «яйцевидную или
амебоидную» форму (Петроченко, 1956; Miller, Dunagan, 1985).
Некоторое сходство с фрагментацией ядер имеет явление отпочкования от
фрагментированных ядер мелких фрагментов, недавно обнаруженное у взрослого
скребня Acanthocephalus tenuirostris (Palaeacanthocephala) (Давыденко, Никишин).
Однако в этом случае связи между ядрами и отпочковавшимися мелкими фрагментами
не наблюдались.
Таким образом, фрагментация гигантских ядер в тегументе скребней,
относящихся к классам Palaeacanthocephala и Archiacanthocephala, не является полной,
и образовавшиеся ядерные фрагменты, как минимум, у исследованных здесь видов,
сохраняют связи друг с другом. Можно предполагать, что фрагменты каждого
гигантского ядра тегумента объединены друг с другом в самостоятельную сеть.
Эта сеть обеспечивает жизнедеятельность тегумента, объем которого многократно
увеличивается в период интенсивного роста паразита в окончательном хозяине.
Благодарности
Исследования проведены в ходе выполнения государственного задания по
теме «Таксономическое, морфологическое и экологическое разнообразие гельминтов
позвоночных животных Северной Азии № ААА-А17-117012710031-6».
Список литературы
Давыденко Т.В., Никишин В.П. Особенности организации тегумента у цистаканта и взрослого скребня
Acanthocephalus tenuiristris. Биология внутренних вод. (В печати). [Davydenko T.V., Nikishin V.P.
Features of the tissue organization in the female reproductive system of Acanthocephalus tenuirostris
(Palaeacanthocephala, Echinorhynchida). Inland water biology. (in Press) (In Russian)].
Лисицына О.И. 2019. Фауна Украины. Т. 31. Акантоцефалы. Киев, Наукова Думка, 223 с. [Lisitsyna O.I.
2019. Fauna of Ukraine. Vol. 31. Acanthocephala. Kyiv, Naukova Dumka. 223 pp. (In Russian)].
Никишин В.П. 2004. Цитоморфология скребней (покровы, защитные оболочки, эмбриональные личинки).
М., ГЕОС, 234 с. [Nikishin V.P. 2004. Tsitomorfologiya skrebney (pokrovy, zashchitnyye obolochki,
embrional’nyye lichinki. Moscow, GEOS, 234 pp. (In Russian)].
Петроченко В.И. 1956. Акантоцефалы (скребни) домашних и диких животных. Т. I. М., Изд-во АН СССР,
435 с. [Petrochenko V.I. 1956. Vol. I. Acanthocephala of Domestic and Wild Animals. Moscow, Izdatel’stvo
Akademii Nauk SSSR. 435 pp. (In Russian)].
Петроченко В.И. 1958.Акантоцефалы (скребни) домашних и диких животных. Т. II. М., Изд-во АН СССР,
458 с. [Petrochenko V.I. 1958. Vol. II. Acanthocephala of Domestic and Wild Animals. Moscow, Izdatel’stvo
Akademii Nauk SSSR, 458 pp. (In Russian)].
50
Хохлова И.Г. 1986. Акантоцефалы наземных позвоночных фауны СССР. М., Наука, 278 с. [Khokholova I.G.
1986. Acanthocephals of Terrestrial Vertebrates of the USSR Fauna. Moscow, Nauka, 278 pp. (In Russian)].
Amin O.M. 1982. Description of larval Acanthocephalus parksidei Amin, 1975(Acanthocephala: Echinorhyn-
chidae) from its isopod intermediate host. Proceedings of the Helminthological Society of Washington
49 (2): 235245.
Butterworth P. 1969. The development of the body wall of Polymorphus minutus (Acanthocephala) in its inter-
Crook J.R., Grundmann A.W. 1964. The life history and larval development of Moniliformis clarki (Ward. 1917).
Journal of Parasitology 50 (5): 689--693.
Graybill H.W. 1902. Some points in the structure of the Acanthocephala. Transactions of the American Micro-
scopical Society 23: 191-200.
Meyer A. 1933. Acanthocephala. Leipzig, Akademische Verlagscesellschaft M.B.H., 582 S.
Miller D.M., Dunagan T.T. 1985. Functional morphology. In: Crompton D.W.T., Nickol B.B. (eds). Biology of
the Acanthocephala. Cambridge, Cambridge University Press, 73-123.
Oetinger D.F., Nickol В.B. 1982. Developmental relationship between acanthocephalans and altered pigmentation
in freshwater isopods. Journal of Parasitology 68 (3): 463-469.
Olson R.E., Pratt I. 1971. The life cycle and larval development of Echinorhynchus lageniformis Ekbaum, 1938
(Acanthocephala: Echinorhynchidae). Journal of Parasitology 57 (1): 143-149.
Robinson E.S. 1973. Growth and differentiation of giant nuclei in Moniliformis (Acanthocephala). Journal of
Parasitology 59 (4): 678-684.
Taraschewski H. 2000. Host-parasite Interactions in Acanthocephala: a Morphological Approach. Advances in
Parasitology 46: 1-179.
Van Cleave H.J. 1914. Studies on cell constancy in the genus Echinorhynchus. Journal of Morphology 25 (2):
253-298.
Van Cleave H.J. 1928. Nuclei of the subcuticula in the Acanthocephala. Zeitschrift für Zellforschung und Mik-
roskopische Anatomie 7 (1): 109-113.
ON THE ORGANIZATION OF THE NUCLEI IN THE TEGUMENT
OF SOME PALAEACANTHOCEPHALA AND ARCHIACANTHOCEPHALA
V. P. Nikishin, D. V. Ponomarev
Keywords: anthocephalans, tegument nuclei, fragmentation of nuclei, Corynosoma strumosum,
Macracanthorhynchus catulinus
SUMMARY
The giant tegument nuclei of the acanthocephalans of the classes Archiacanthocephala and Palae-
acanthocephala are fragmented at the final stage of cystacanthus formation in the intermediate host,
but remain connected with each other during later life. It can be assumed that the fragments of each
giant tegument nucleus are united with each other forming an independent network that ensures the
vital activity of the tegument, the volume of which increases repeatedly during the period of intensive
growth of the parasite in the definitive host.
51