ПАРАЗИТОЛОГИЯ, 2023, том 57, № 2, с. 108-123.
УДК 576.895.121.21:591.46
РЕКОНСТРУКЦИЯ СТРОЕНИЯ МИРАЦИДИЯ
DEROGENES VARICUS (DIGENEA: DEROGENIDAE):
ПЕРВОЕ УЛЬРАСТРУКТУРНОЕ ОПИСАНИЕ ШИПОВ
НА ПОВЕРХНОСТИ ЛИЧИНОК HEMIURATA
© 2023 г. П. А. Смирнов* a, b, Д. Ю. Крупенкоb
a Зоологический институт РАН,
Университетская наб., 1, Санкт-Петербург, 199034 Россия
b Санкт-Петербургский государственный университет,
Университетская наб., 7/9, Санкт-Петербург, 199034 Россия
* e-mail: smirnov_pa@rambler.ru
Поступила в редакцию 03.03.2023 г.
После доработки 24.03.2023 г.
Принята к публикации 26.03.2023 г.
Мы провели детальную ультраструктурную реконструкцию «пассивного» мирацидия Dero-
genes varicus Müller, 1784 - представителя гемиуратных дигеней. Мирацидий сильно миниа-
тюризован и упрощен по сравнению с «активными» личинками. Впервые определена природа
шипов личинок Hemiurata: они являются производными эпителиальных пластинок. Мирацидий
несет на переднем конце три эпителиальные пластинки, снабженные и шипами, и ресничками.
Большая часть покровов представлена тегументом. Нервная система упрощена до «минималь-
ного» состояния - обнаружен лишь один нейрон; выделительная система мирацидия полно-
стью редуцирована, генеративный материал представлен единственной недифференцированной
клеткой. Обсуждаются тенденции морфофункциональной эволюции мирацидиев Hemiurata
в контексте их перехода к пассивной стратегии заражения первого промежуточного хозяина.
Ключевые слова: мирацидий, личинка, редукция, пассивная стратегия заражения, TEM,
Hemiuroidea
DOI: 10.31857/S0031184723020023; EDN: AZWGWF
Hemiurata - один из крупнейших таксонов Digenea, монофилия которого подтверж-
дается как морфологическими (Brooks et al., 1985), так и молекулярными (Olson et al.,
2003) данными. Одним из синапоморфных признаков группы принято считать наличие
шипов на поверхности мирацидиев (Gibson, Bray, 1979). Судя по многочисленным све-
тооптическим описаниям личинок гемиурат, вооружение из шипов развито в разной
степени у представителей группы. Мирацидий Lecithaster salmonis Yamaguti, 1934
108
полностью покрыт ресничками (Schell, 1975), никаких шипов на поверхности не выяв-
лено. Большая часть покровов мирацидия Genarchopsis goppo Ozaki, 1925 также несет
реснички, но передний конец снабжен вооружением из шипов (Madhavi, 1978). По-
хожая картина характерна для мирацидия Hirudinella ventricosa, однако в этом случае
реснички покрывают только переднюю часть личинки, при этом передний конец несет
шипы, радиально организованные в три группы по четыре шипа (Murugesh, Madhavi,
1990). Описанная на ультраструктурном уровне личинка Lecithochirium furcolabiatum
Jones, 1933 лишена шипов (Matthews, Matthews, 1991); ее покровы представлены че-
тырьмя ресничными эпителиальными пластинками, окружающими передний конец. Во
всех остальных светооптических описаниях мирацидиев Hemiurata авторы отмечают
только шипы на поверхности: группы шипов многократно описываются в составе по-
кровов мирацидиев Azygiidae (Schauinsland, 1883; Looss, 1894; Hussey, 1945; Stunkard,
1956; Wootton, 1957; Anderson, Anderson, 1963) и Didymozoidae (Baylis, 1938; Self
et al., 1963). Для всех этих личинок характерно наличие шипов, покрывающих лишь
отдельные участки тела. Наибольший уровень развития шипов на поверхности опи-
сан для мирацидия Bunocotyle progenetica Markowski, 1936 - эта личинка полностью
покрыта упорядоченно расположенными шипами (Galaktionov, Dobrovolskij, 2003).
Природа шипов на поверхности гемиуратных мирацидиев оставалась совершенно
неясна. Некоторые исследователи вообще сомневались в самой трактовке поверхност-
ных структур личинок Hemiurata как шипов, предполагая, что они могут оказаться
«сложными структурами типа мембранелл Ciliata» (Семенов, 1991). Фактически не-
известны и детали внутреннего строения гемиуратных мирацидиев, поскольку эти
личинки слишком малы для информативного светооптического исследования.
Ни в одном из светооптических описаний мирацидиев Hemiurata не говорится об
активном выходе личинок из яиц в водную среду. Судя по всему, все гемиуратные
мирацидии используют пассивную стратегию заражения первого промежуточного
хозяина. Заражение происходит только после случайного проглатывания моллюском-
хозяином инвазивного яйца. В пищеварительной системе моллюска мирацидии вы-
лупляются и внедряются в его ткани через кишечный эпителий. Такая стратегия
противопоставляется активной, при которой мирацидии выходят из яиц в воду, где
за счет сложного поискового поведения достигают первого промежуточного хозяина.
Переход мирацидиев к пассивной стратегии заражения - тенденция, которая неза-
висимо реализуется в разных ветвях эволюции Digenea. Во всех случаях этот переход
ассоциирован с экстремальной миниатюризацией личинок и глубокими структурными
изменениями (Galaktionov, Dobrovolskij, 2003; Smirnov, Gonchar, 2022). Очевидно, что
не являются исключением и мирацидии Hemiurata, строение которых существенно
отличается от всех описанных «активных» личинок. Отсутствие полноценного ультра-
структурного описания гемиуратного мирацидия не позволяет предметно обсуждать
природу преобразований, вызванных переходом к пассивной стратегии заражения
в рамках таксона Hemiurata. Данное исследование - первая полная ультраструктурная
реконструкция мирацидия Hemiurata - нацелено на восполнение этого пробела.
109
МАТЕРИАЛ И МЕТОДИКА
Сбор материала для данного исследования осуществлялся в полевой сезон 2017 г. в окрест-
получены при паразитологических вскрытиях трески (Gadus morhua). Все собранные мариты
были помещены в раствор Рингера (для холоднокровных) для мацерации и получения яиц.
В таком виде материал был доставлен в лабораторию кафедры зоологии беспозвоночных
СПбГУ. В лаборатории была проведена оценка общего состояния и степени развития личинок
в яйцах методами световой микроскопии с контрастом Номарского (Differential interference
contrast) с использованием микроскопа Leica DM2500. На всех этапах материал хранился при
4°C. В процессе работы производился постоянный мониторинг состояния яиц с использованием
микроскопа LeicaDM2500 с DIC. Зрелыми личинки признавались тогда, когда в течение двух
недель с ними не происходило никаких заметных преобразований.
Яйца со зрелыми личинками были заморожены под высоким давлением с помощью стан-
ции криофиксации Leica EM HPM100. В качестве криопротектора использовался 20% раствор
бычьего сывороточного альбумина (BSA) на морской воде (20‰). Зафиксированные образцы
хранились в жидком азоте при температуре -120°C. Криозамещение осуществлялось в стан-
ции Leica EM AFS2. В качестве фиксирующего «коктейля» использовался 1% раствор OsO4
+ 0.5% уранил ацетата на безводном ацетоне. Полученные образцы были проведены через
смеси ацетона со средой для заключения Epon 812 с возрастающей концентрацией последней
c увеличенными сроками. Все этапы Все этапы пробоподготовки к TEM-исследованию произ-
водились на базе ресурсного центра СПбГУ «Развитие молекулярных и клеточных технологий»
лучены серии ультратонких срезов. Изготовление серий осуществлялось следующим образом:
1) с заточенного участка блока, содержащего личинок, получались серии срезов толщиной
60 нм, 2) после получения такой серии с блока «срезалось» 2-3 полутонких среза толщиной
200-250 нм, 3) затем процедура повторялась. Такая методика позволила получить прерывистые
серии срезов личинок в разных проекциях. Полученные серии были исследованы с помо-
щью электронного микроскопа FEI Morgagni268 (80kV) в центре коллективного пользования
обработаны с использованием графического редактора Adobe Photoshop. По полученным фото-
графиям срезов пяти личинок была выполнена схема-реконструкция мирацидия. Рисунки были
оформлены в графическом редакторе CorelDRAW.
РЕЗУЛЬТАТЫ
Светооптические наблюдения
Мирацидий Derogenes varicus Müller, 1784 заключен в эллипсоидное яйцо с тол-
стыми стенками. На одном из полюсов четко выражена крышечка. Стенки яйца плохо
пропускают свет, что говорит о высокой степени задубленности белков, образующих
скорлупу. Мирацидий гантелевидной формы, размером порядка 15×10 мкм. При-
веденные размерные характеристики в определенной степени условны, поскольку
передний конец личинки может быть как сильно ввернут, так и полностью вывернут.
Детали строения мирацидия на светооптическом уровне очень плохо видны. Удается
110
определить только наличие шипов на переднем конце личинки и небольшое коли-
чество ресничек прямо за ними. При сдавливании яиц покровным стеклом личинки
активизируются, вворачивая и выворачивая свой передний конец.
Схема-реконструкция мирацидия, созданная на основе комбинации светооптиче-
ских и ультраструктурных данных, представлена на рис. 1. Схема покровов пред-
ставлена на рис. 2.
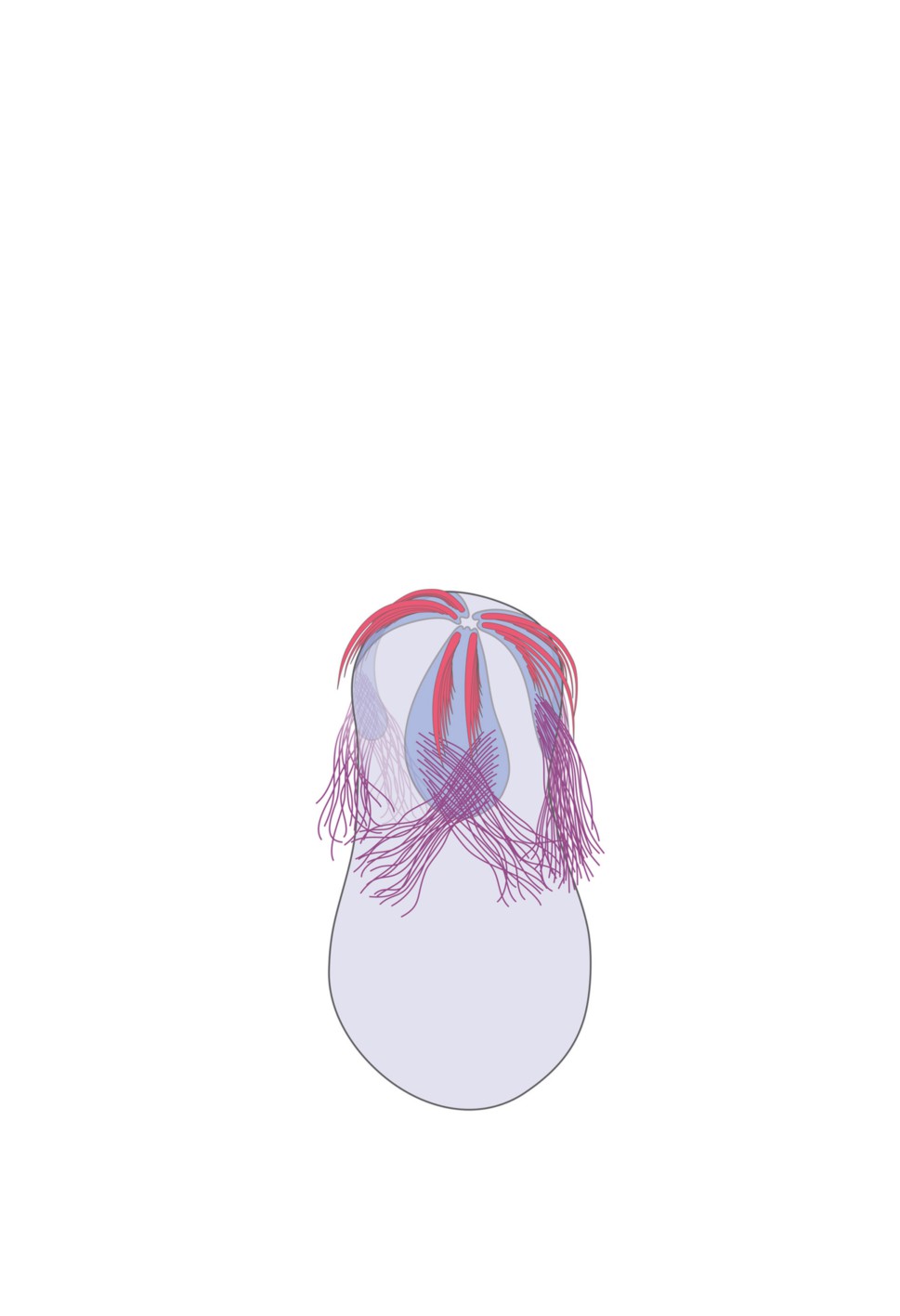
Рисунок 1. Схема-реконструкция мирацидия Derogenes varicus: ag - апикальная железа,
b - цитоплазматический мостик (связывающий ct и t), cep - ребро эпителиальной пластинки,
cm - кольцевые мышечные клетки, ct - цитон тегумента, dg - «темная» железа,
ep - эпителиальная пластинка, mr - мышечная клетка-ретрактор хоботка, nc - нейрон,
sp - шипы, t - пластинка тегумента, uc - недифференцированная клетка.
Схема выполнена таким образом, что ее левая и правая части являются срезами
через радиусы, обусловленные расположением эпителиальных пластинок.
Figure 1. Reconstruction of Derogenes varicus miracidium. Abbreviations: ag - apical gland,
b - cytoplasmic bridge (between ct and t), cep - core of epithelial plate, cm - circular muscle
cell, ct - tegumental cyton, dg - “dark” gland, ep - epithelial plate, mr - retractor muscle cell,
nc - nerve cell, sp - spines, t - tegument, uc - undifferentiated cell.
*The scheme is constructed in the way that its left and right sides are sections through the radii
determined by the position of the epithelial plates.
111
Ультраструктурные данные
Покровы
Покровы мирацидия D. varicus представлены тегументом, к которому крепят-
ся три эпителиальные пластинки (рис. 2), расположенные радиально-симметрично
на передней трети тела личинки (рис. 3; 5a). Пластинки треугольные, характеризуются
очень своеобразным строением: наряду с развитым ресничным аппаратом, занимаю-
щим задние участки поверхности клеток (рис. 3d), на передних концах пластинок
располагаются шипы (рис. 3a, 3b). Ультраструктура этих шипов в общих чертах со-
ответствует структуре актин-армированных шипов тегумента, характерных для марит
и их личинок (церкарий и метацеркарий). Материал, из которого состоит шип, зер-
нистый, электронно-плотный. Выделяется тонкий более светлый гомогенный слой,
расположенный под плазмалеммой, покрывающей шип (рис. 3b). Каждая эпителиаль-
ная пластинка несет два продольных ряда таких шипов, расположенных по бокам от
медиальной линии (рис. 2). В каждом ряду находится не менее десяти направленных
назад шипов, расположенных по размерному градиенту таким образом, что передние
оказываются самыми длинными (2-3 мкм), а задние - самыми короткими (<1 мкм).
Медиальная зона клетки несет сильно скрученный «клубок» из двух мембран
(рис. 3c, 3d) - ребро эпителиальной пластинки. Этот мембранный комплекс имеет
форму конуса, его широкое основание лежит в задней трети эпителиальной пла-
стинки; узкая вершина достигает передней трети. Удивительна природа этого ребра.
Внешняя поверхность задней части пластинки пронизана множеством инвагинаций
(рис. 3a). Поверхность полостей, сформированных этими инвагинациями, представлена
сложной системой цитоплазматических выростов. Ближе к переднему концу эти выро-
сты структурируются в единый клубок, являющийся совокупностью вложенных друг
в друга стенок описанных инвагинаций (рис. 1). Реснички классического строения
расположены на поверхности задней части эпителиальной пластинки продольными
рядами (двумя группами по бокам от медиальной линии пластинки), немногочислен-
ны (рис. 2). Основание каждой реснички окружено небольшой кольцевой складкой
поверхностной мембраны пластинки (рис. 3d). От базального тельца реснички от-
ходит сильно редуцированный единственный корешок. Цитоплазма эпителиальных
пластинок слабо развита, заполнена неким электронно-плотным зернистым веществом,
характеризуется наличием небольшого числа митохондрий, а также вакуолей непра-
вильной формы. Края эпителиальных пластинок связаны с тегументом при помощи
десмосом (рис. 3c). Под базальной мембраной участков клеток, не соприкасающихся
с тегументом, можно наблюдать хорошо выраженную базальную пластинку (рис. 3c).
Базальная пластинка также выражена и под тегументом. Как было отмечено выше,
передний конец тела личинки способен вворачиваться - на срезах удалось наблюдать
личинок как с ввернутым (рис. 5a), так и с вывернутым (рис. 3a) «интровертом».
112
Тегумент личинки D. varicus характеризуется разной толщиной на разных участках
тела. Он может быть представлен в виде узкой полоски, фактически лишенной цито-
плазмы, но может и достигать существенной толщины (1.5-2 мкм). На тех участках,
где тегумент хорошо выражен, он представляет собой синцитиальную пластинку, бо-
гатую органоидами и гранулами гликоген-подобного полисахарида (рис. 3a). Здесь
имеются крупные митохондрии, развитый шероховатый эндоплазматический ретику-
люм (ШЭПР), свободные рибосомы, а также множество вакуолей. Последние часто
оказываются сгруппированными, что создает впечатление «пенистости» тегумента.
Все это, очевидно, говорит о высокой степени активности тегумента. Погруженная
часть тегумента представлена единственным цитоном, занимающим около половины
объема мирацидия (рис. 4a). Узкий цитоплазматический мостик, расположенный на
заднем участке тела личинки (рис. 4b), связывает синцитиальную пластинку с цито-
ном. Клеточное тело несет два активных ядра (рис. 4a), окруженных развитым ШЭПР.
Цитоплазма цитона,значительно отличаясь от цитоплазмы пластинки, содержит боль-
шое число сферических секреторных гранул разной степени зрелости.
Рисунок 2. Схема покровов мирацидия Derogenes varicus.
Figure 2. Scheme of the surface of Derogenes varicus miracidium.
113
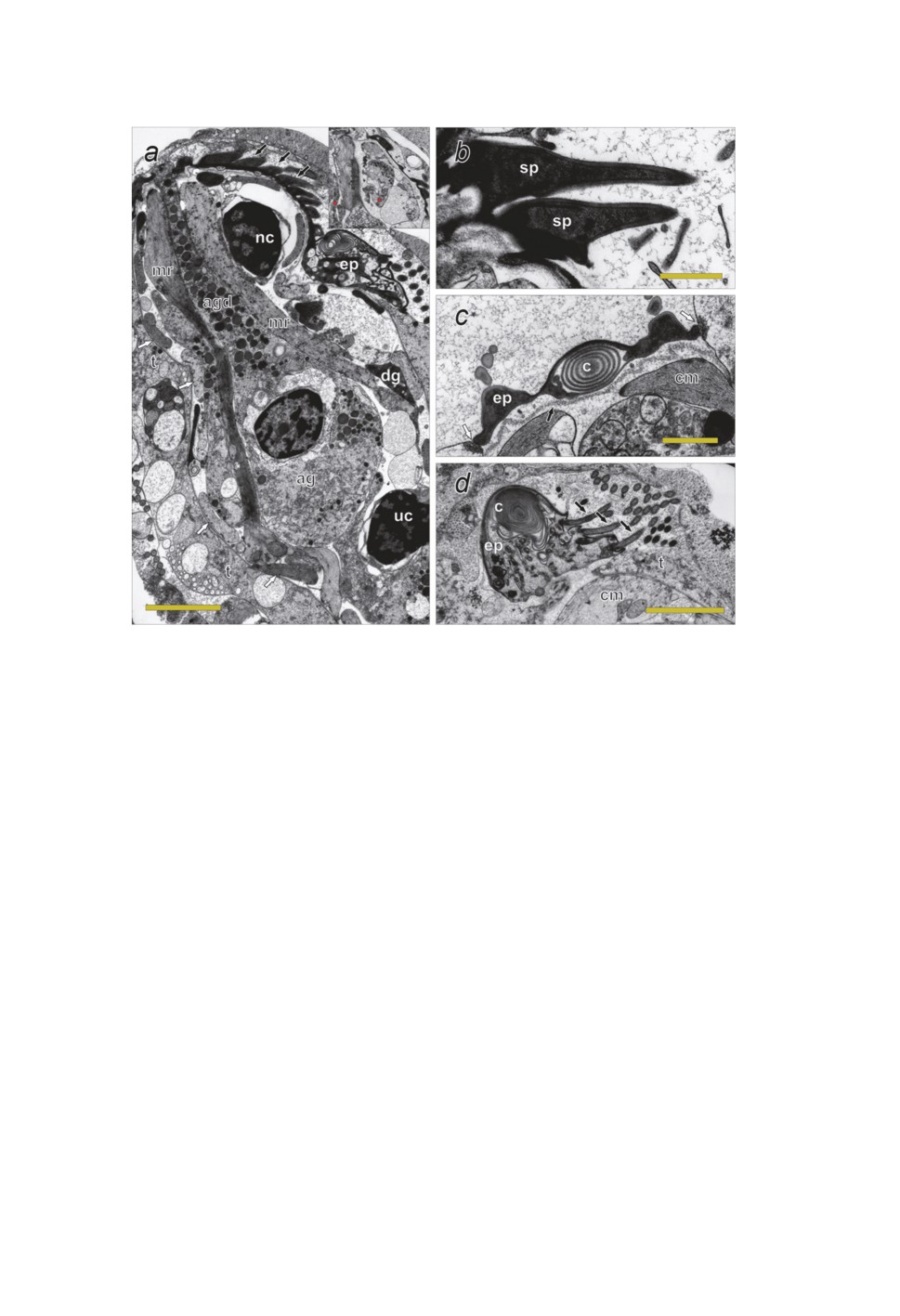
Рисунок 3. Электронограммы срезов мирацидия Derogenes varicus I.
а - срез через переднюю половину мирацидия (черные стрелки указывают на шипы,
белые - на кольцевые мышечные клетки), масштабная линейка: 2 мкм, в рамку вынесен
фрагмент среза из той же серии, демонстрирующий нервные отростки (отмечены
звездочкой), b - срез через шипы мирацидия. Масштабная линейка: 0.5 мкм, c - поперечный
срез через переднюю треть эпителиальной пластинки (черная стрелка указывает
на базальную пластинку, белые стрелки - на десмосомы), масштабная линейка: 0.5 мкм,
d - косой срез через заднюю треть эпителиальной пластинки (черные стрелки указывают
на реснички), масштабная линейка: 2 мкм.
Сокращения: ag - апикальная железа, agd - проток апикалной железы, c - ребро
эпителиальной пластинки, cm - кольцевые мышечные клетки, dg - «темная» железа,
ep - эпителиальная пластинка, mr - мышечная клетка-ретрактор хоботка, nc - нервная
клетка, sp - шипы, t - пластинка тегумента, uc - недифференцированная клетка.
Figure 3. Micrographs of the sections through Derogenes varicus miracidium I.
a - section through the anterior half of the miracidium, (black arrows point spines, white arrows -
circular muscle cells), scalebar: 2 μm, box contains section from the same series that demonstrate
neural processes marked with asterisk,
b - section through the spines of the miracidium, scalebar: 0.5 μm, c - transverse section
through the anterior third of the epithelial plate (black arrows point basal lamina, white arrows -
desmosomes), scalebar: 0.5 μm, d - oblique section through the posterior third of the epithelial
plate (black arrows point cilia), scalebar: 2 μm.
Abbrevialtions: ag - apical gland, agd - apical gland duct, c - core of epithelial plate,
cm - circular muscle cell, dg - “dark” gland, ep - epithelial plate, mr - retractor muscle cell,
nc - nerve cell, sp - spines, t - tegument, uc - undifferentiated cell.
114
Мускулатура
Мускулатура мирацидия D. varicus представлена не менее чем восьмью кольцевы-
ми клетками и двумя продольными (рис. 3a). Кольцевые клетки содержат неупорядо-
ченно расположенные миофиламенты и лежат под базальной пластинкой, с которой
они связаны гемидесмосомами. Расположены эти мышечные клетки на равном рас-
стоянии друг от друга. Среди всех колец можно выделить 4-6-е кольца - в зоне этих
колец наблюдается слегка выраженная перетяжка у мирацидиев, зафиксированных
в вывернутом состоянии. Продольная мускулатура представлена двумя мощными клет-
ками, выполняющими функцию ретракторов интроверта (рис. 3a). Одним концом они
крепятся к базальной пластинке у переднего конца. Сзади ретракторы соединены
с базальной пластинкой двумя лопастями - в промежутках между 4-м и 5-м, а также
между 5-м и 6-м кольцами мускулатуры. Кольцевые мышечные клетки в некоторых
местах формируют широкие отростки. В них можно наблюдать гранулы полисахарида
и изредка попадающие на срез вакуоли. Как правило, такие отростки направлены
к переднему концу тела (рис. 4с).
Рисунок 4. Электронограммы срезов мирацидия Derogenes varicus II.
a - продольный срез через цитон тегумента, масштабная линейка: 1 мкм, b - срез через
мостик, соединяющий цитон и пластинку тегумента (черная стрелка), масштабная линейка:
1 мкм, c - срез через стенку тела, демонстрирующий отросток мышечной клетки (черная
стрелка), масштабная линейка: 2 мкм.
Сокращения: cm - кольцевые мышечные клетки, ct - цитон тегумента, nu - ядра цитона
тегумента, t - пластинка тегумента.
Figure 4. Micrographs of the sections through Derogenes varicus miracidium II.
a - longitudinal section through cyton of tegument of the miracidium, scalebar: 1 μm,
b - section through the cytoplasmic bridge connecting cyton and tegument of the miracidium,
scalebar: 1 μm, c - section through body wall that demonstrates the extending of circular muscle
cell of the epithelial plate (black arrows point basal lamina, white arrows - desmosomes),
scalebar: 2 μm,
Abbrevialtions: cm - circular muscle cell, ct - cyton of tegument, nu - nuclei of cyton
of tegument, t - tegument.
115
Аппарат проникновения
Аппарат проникновения представлен двумя типами желез. Обширная двуядерная
апикальная железа грушевидной формы занимает переднюю половину тела личинки
(рис. 3a). В ней можно наблюдать хорошо развитый белоксинтезирующий аппарат,
представленный ШЭПР. В цитоплазме железы проникновения накоплены зрелые
гранулы секрета. Гранулы сферические, равномерно заполнены электронно-плотным
содержимым. Апекс железы связан с эпителиальными пластинками десмосомами.
Хорошо выражен проток железы, армированный цитоскелетом из микротрубочек.
Железы второго типа представлены двумя «темными» клетками (рис. 5b). Темные
железы расположены в передней половине тела, по бокам от железы проникновения.
Эти клетки безъядерны, характеризуются электронно-плотной цитоплазмой, запол-
ненной секреторными гранулами. Протоки темных желез тянутся к переднему концу
тела мирацидия, иногда примыкая к базальной пластинке. Точное место, где темные
железы открываются на поверхности личинки, установить не удалось.
Рисунок 5. Электронограммы срезов мирацидия Derogenes varicus III.
a - поперечный срез через ввернутый передний конец (белая стрелка указывает
на сенсорное окончание), масштабная линейка: 1 мкм, b - срез через «темную» железу
(черная стрелка указывает на проток железы), масштабная линейка: 1 мкм.
Сокращения: cm - кольцевые мышечные клетки, dg - «темная» железа, ep - эпителиальная
пластинка, sp - шипы, t - пластинка тегумента.
Figure 5. Micrographs of the sections through Derogenes varicus miracidium III.
a - section through the inverted anterior end of the miracidium, (white arrow points sensory
ending), scalebar: 1 μm, b - section through “dark” gland of the miracidium (black arrow points
gland duct), scalebar: 1 μm,
Abbrevialtions: cm - circular muscle cell, dg - “dark” gland, ep - epithelial plate, sp - spines,
t - tegument.
Нервная система
В теле мирацидия D. varicus удалось обнаружить единственную нервную клет-
ку (рис. 3a), тело которой расположено в его передней трети. Это мультиполярный
116
нейрон с гантелевидным ядром, богатым гетерохроматином. Точное расположение от-
ростков установить не удалось. Однако, судя по всему, один отросток огибает проток
железы проникновения, где, раздваиваясь, направляет ветви к переднему и заднему
концам тела личинки. Также от тела нейрона отходят ещё два отростка, один из ко-
торых тянется назад, а другой - к переднему концу. Вероятно, последний формирует
на переднем конце сенсиллу. Структура, трактуемая нами как сенсилла, приурочена
к тегументу (рис. 5a), несет пучок неупорядоченных микротрубочек; клеточный кон-
такт, связывающий сенсиллу с синцитиальной пластинкой, на срезы не попал. Цито-
плазма всех элементов нервной системы, которые удалось наблюдать, характеризуется
наличием микровезикул с нейромедиатором.
Выделительная система
Специализированная выделительная система у мирацидия D. varicus отсутствует.
Генеративный материал
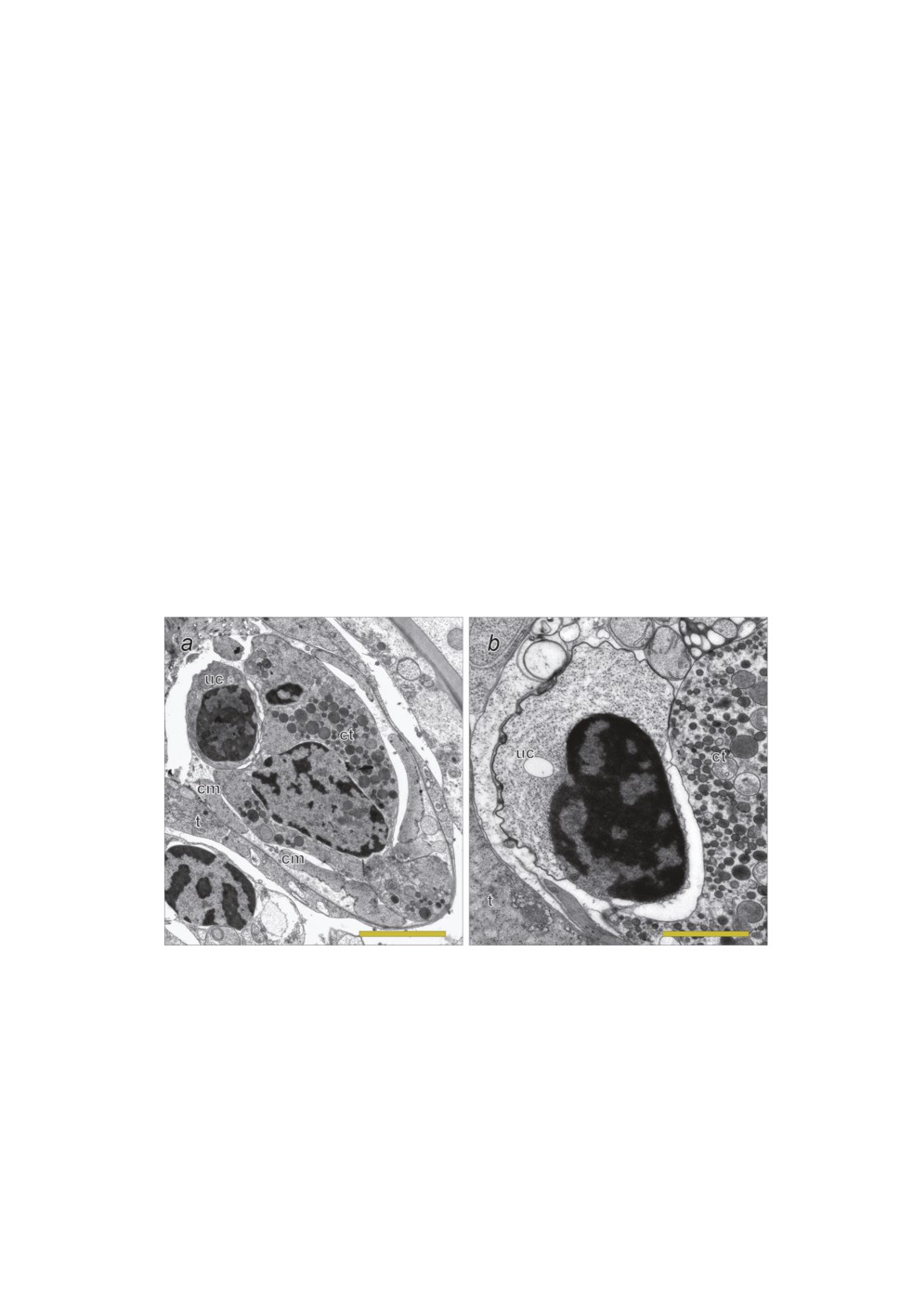
Генеративный материал представлен в теле личинки одной недифференцирован-
ной клеткой, расположенной в середине тела. Будучи «зажатой» между железой про-
никновения и цитоном тегумента, недифференцированная клетка оказывается слегка
вдавленной в последний. Ядро этой клетки богато гетерохроматином, в цитоплазме
лежит множество свободных рибосом (рис. 6).
Рисунок 6. Электронограммы срезов мирацидия Derogenes varicus IV.
a - срез через задний конец, масштабная линейка: 2 мкм, b - недифференцированная клетка,
масштабная линейка: 1 мкм.
Сокращения: cm - кольцевые мышечные клетки, ct - цитон тегумента, t - пластинка
тегумента, uc - недифференцированная клетка.
Figure 6. Micrographs of the sections through Derogenes varicus miracidium IV.
a - section through the posterior end of the miracidium, scalebar: 2 μm, b - section through
undifferentiated cell, scalebar: 1 μm.
Abbrevialtions: cm - circular muscle cell, ct - cyton of tegument, t - tegument,
uc - undifferentiated cell.
117
ОБСУЖДЕНИЕ
Переход к пассивной стратегии заражения первого промежуточного хозяина повлек
за собой существенные изменения в строении мирацидиев Hemiurata. Исследованная
нами личинка D. varicus - чрезвычайно миниатюризована и упрощена по сравнению
с любым описанным «активным» мирацидием (Wilson, 1969a, 1969b, 1969c, 1970,
1971; Pan, 1980; Тихомиров, 2000). Смена стратегии заражения, включающая смену
среды, в которой мирацидий активен (с водной среды на среду содержимого кишки
моллюска), полностью изменила функциональную нагрузку на все клеточные систе-
мы - вероятно, это и послужило причиной столь резких и глубоких структурных
модификаций.
Ранее нами было высказано предположение о несоответствии ресничного спо-
соба локомоции мирацидиев условиям вязкого слизистого содержимого кишечника
моллюска (Smirnov, Gonchar, 2022). Преобразования покровов мирацидиев Hemiurata
полностью подтверждают этот тезис. Мы полагаем, что наблюдаемое разнообразие
организации покровов у гемиуратных личинок отражает этапы редукции ресничного
покрова и его замещения шипами. Мирацидий Lecithaster salmonis характеризуется
полноценно развитым ресничным покровом (Schell, 1975). В этом контексте пред-
положение Семенова (1991) о цирриподобной природе «шипов» личинок гемиурат
выглядит вполне логичным, ведь материал для формирования таких структур имеется
у некоторых личинок. Вероятно, собранные в пучки реснички действительно по-
зволили бы мирацидиям более успешно перемещаться в вязком содержимом кишки
(таковой способ передвижения по субстрату известен для ряда инфузорий). С другой
стороны, описание личинки Lecithochirium furcolabiatum (Matthews, Matthews, 1991)
демонстрирует схему покровов, преимущественно лишенных ресничек. И пусть ав-
торы не решились описывать эти покровы как тегумент, в который впаяны несущие
реснички эпителиальные пластинки, - такая трактовка, безусловно, напрашивается.
Исходя из этого, логично было бы предположить, что наблюдаемые у гемиуратных
мирацидиев шипы могли бы являться классическими для Neodermata шипами тегу-
мента. Мирацидий D. varicus, описываемый в данной работе, оказался весьма удачным
объектом для проверки этих двух гипотез. Организация покровов личинки D. varicus
во многом напоминает строение покровов мирацидия L. furcolabiatum. Здесь мы так-
же наблюдаем отдельные эпителиальные пластинки, располагающиеся в передней
части личинки. Однако, эти пластинки несут и реснички, и шипы. Очевидно, что
шипы используются личинкой для проникновения через кишечный эпителий. Меха-
низм этого проникновения несложно представить, если учесть, что передняя часть
личинки способна вворачиваться. Выворачивание этого участка сопровождается вы-
бросом вооружения из шипов - так, вероятно, личинка способна «пробить» эпителий
кишки. Самыми эффективными в этом процессе, конечно же, являются передние
118
шипы (самые длинные). В таком случае не столь удивительным кажется то, что шипы
формируются именно на поверхности эпителиальных пластинок, а не на тегументе,
который составляет большую часть покровов личинки. Необычное место располо-
жения шипов можно объяснить тем, что после проникновения мирацидия в стенку
кишечника моллюска-хозяина эти структуры полностью теряют функциональную на-
грузку. Сбрасывая эпителиальные пластинки в процессе проникновения, мирацидий
D. varicus избавляется и от шипов, которые уже сыграли свою роль. Важно отметить,
что эпителиальные пластинки приобрели новую для подобных клеток функцию, фак-
тически став элементом аппарата проникновения. Об этом свидетельствуют чуть ли не
все детали их строения. Описанный мембранный клубок в средней части пластинки
скорее всего выполняет функцию ребра жёсткости, что, очевидно, увеличивает эф-
фективность проникновения. Открытым остается вопрос о возможности выполне-
ния локомоторной функции подобными эпителиальными пластинками. Мы склонны
трактовать ресничный аппарат пластинок мирацидия D. varicus как своеобразный
рудимент. Во-первых, ресничек на поверхности этих клеток не так уж и много - их
явно недостаточно для локомоции целого организма в слизистом содержимом кишки.
Во-вторых, корешковый аппарат этих ресничек значительно редуцирован. В-третьих,
для большинства мирацидиев Hemiurata реснички на поверхности не описаны вовсе,
что также намекает на «остаточную» природу ресничек у D. varicus.
Определив общую схему строения покровов и природу шипов на примере
D. varicus, мы можем вкладывать новый смысл в старые схемы по некоторым дру-
гим мирацидиям Hemiurata. Так, личинка Proterometra dickermani, описанная Ан-
дерсонами (Anderson, Anderson, 1963), характеризуется покровами, схожими с по-
кровами D. varicus. Пять эпителиальных пластинок, расположенных вокруг апекса
этой личинки, по-видимому, несут настоящие шипы, которые авторы обозначают как
«щетинки». Возможно, похожая организация наблюдается и у личинок семейства
Hirudinellidae (Murugesh, Madhavi, 1990). А вот такие мирацидии, каких описывают
для Halipegus amherstensis (Ranking, 1944), Nematobothrium texomensis (Self et al.,
1963) или Bunocotyle progenetica (Galaktionov, Dobrovolskij, 2003), демонстрируют не-
сколько иную схему. Вся поверхность таких личинок или большая ее часть покрыта
шипами. Скорее всего, и эти шипы являются элементами эпителиальных пластинок.
Последние, покрывая практически все тело мирацидия, в данном случае оказались
полностью лишены ресничек. Таким образом, для некоторых личинок Hemiurata ха-
рактерны редукция эпителиальных пластинок и их концентрация на переднем конце,
для других характерно наличие полноценно развитых «шипастых» пластинок, по-
крывающих большую часть тела.
Открытым остается вопрос о возможности локомоции мирацидия D. varicus
в кишке моллюска. Как было сказано выше, эффективное использование ресничек
выглядит сомнительным. Мы полагаем, что организация мускулатуры у личинки
119
D. varicus позволяет личинке осуществлять только один тип движения: вворачивание/
выворачивание переднего конца. Возможно, что работа переднего конца как интровер-
та позволяет мирацидию перемещаться, но столь же вероятно, что личинка использует
этот тип движения исключительно для проникновения в кишечный эпителий. Не ис-
ключено, что возле поверхности кишки личинка оказывается в результате пассивного
перемещения вместе с остальным содержимым кишки.
Общий уровень редукции клеточных систем мирацидия D. varicus сопоставим
с тем, что наблюдается у других «пассивных» мирацидиев (Smirnov, Dobrovolskij,
2019, 2021; Smirnov, Gonchar, 2022). Экстремальная редукция нервной системы, безу-
словно, связана с отсутствием необходимости поиска первого промежуточного хозяи-
на. Вопрос о том, как именно осуществляется работа таких простых нервных систем,
какие мы наблюдаем у пассивных личинок требует дополнительных исследований.
Тем не менее, очевидно, что ситуация, при которой всего один нейрон обеспечивают
работу всей мускулатуры организма, накладывает определенные ограничения на ин-
нервацию. Судя по всему, редукция нервной системы пассивных личинок влечет за
собой компактизацию нейромышечного взаимодействия. Вероятно, единичной нервной
клетке D. varicus оказывается затруднительно связаться со всеми элементами муску-
латуры. Отростки мышечных клеток, которые мы наблюдаем у мирацидия D. varicus,
видимо, снимают эту задачу с нейронов и самостоятельно тянутся к последним. По-
хожую картину мы наблюдали у «пассивного» мирацидия Parvatrema affine (Smirnov,
Dobrovolskij, 2021). Вполне вероятно, что эти отростки гомологичны перикарионам
(миоцитонам) мышечных клеток «активных» личинок, но в случае D. varicus ядра
редуцированы, и в отростках не наблюдается ничего, кроме митохондрий и гранул
гликогена. Видимо, отростки сохраняют функцию запасания питательных веществ
для работы мускулатуры.
Судя по всему, тенденция к редукции выделительной системы является общей
для «пассивных» мирацидиев (Smirnov, Gonchar, 2022). Вероятно, характерный для
них пассивный образ жизни не сопровождается накоплением критической концентра-
ции метаболитов, что делает возможной полную редукцию протонефридиев. Осмо-
регуляторные потребности «пассивных» мирацидиев крайне сложно определить, но
отсутствие специализированной выделительной системы и у личинки D. varicus,
и у некоторых ранее описанных «пассивных» личинок (Smirnov, Dobrovolskij, 2021;
Smirnov, Gonchar, 2022) позволяет утверждать, что эти потребности невелики.
Фактически все системы мирацидия D. varicus можно считать редуцированными
по сравнению с «активными» личинками. Все, за исключением аппарата проник-
новения. Строение личинки демонстрирует, что проникновение в ткани моллюска
- главная (если не единственная) функция личинки. Как было сказано выше, важ-
ную роль в этом процессе играют эпителиальные пластинки. Столь же значимы-
ми элементами, вероятно, являются железы, занимающие переднюю половину тела.
120
Не исключено, что и снабженный развитым секрет-продуцирующим аппаратом цитон
тегумента, занимающий большую часть задней половины личинки также участвует
в проникновении или миграции мирацидия в тканях моллюска-хозяина. Разнообразие
элементов аппарата проникновения может указывать на «сложность» процесса про-
никновения через кишечный эпителий.
Очевидно, что после метаморфоза мирацидия D. varicus материнская спороци-
ста будет развиваться - эта стадия полноценно развита у гемиурат (Madhavi, 1978)
и представлена крупным подвижным червеобразным организмом. Это означает, что
в мирацидии заложен потенциал для развития соматических элементов. Как и в ранее
описанных нами случаях (Smirnov, Dobrovolskij, 2019, 2021; Smirnov, Gonchar, 2022),
мы полагаем, что этот потенциал реализуется за счет деления недифференцированной
клетки и последующей специализации ее потомков.
ЗАКЛЮЧЕНИЕ
Смена стратегии заражения первого промежуточного хозяина повлекла за собой
существенные преобразования в строении мирацидиев Hemiurata, что ясно и из мно-
гочисленных светооптических схем, и из приводимых нами данных по D. varicus.
Мирацидий D. varicus - сильно миниатюризованный организм, сложенный из малого
числа клеточных элементов. Главная функция мирацидия - проникновение в кишеч-
ный эпителий моллюска-хозяина. Клеточные элементы, не являющиеся необходимыми
для выполнения этой функции, подверглись редукции. Важной тенденцией эволюции
мирацидиев Hemiurata следует считать появление шипов и дальнейшее замещение
ими ресничек на поверхности эпителиальных пластинок. Очевидно, что шипы служат
для внедрения мирацидия в кишечный эпителий. Не исключено, что шипы могут
увеличивать эффективность движения мирацидия в химусе кишки у некоторых пред-
ставителей Hemiurata.
БЛАГОДАРНОСТИ
Работа была выполнена в рамках государственной академической программы
1021051402849-1 (AAAA-A19-119020690109-2).
Авторы выражают благодарность К.В. Галактионову за комментарии и редактуру
текста.
СПИСОК ЛИТЕРАТУРЫ
Семёнов О.Ю. 1991. Мирацидии: строение, биология, взаимодействие моллюсками. Тр. ЛОЕ 83 (4): 203
с. [Semenov O.Y. 1991. Miracidia: structure, biology, inter-relationships with molluscs. Tr. LOE 83 (4):
203 pp. (in Russian)].
Тихомиров И.А. 2000. Микроанатомия мирацидия Philophthalmus rhionica (Trematoda: Philophthalmidae).
Паразитология 34 (3): 210-221. [Tikhomirov I.A. 2000. Microanatomy of Philophthalmus rhionica mi-
racidium (Trematoda: Philophthalmidae). Parasitologiya 34 (3): 210-221. (in Russian)].
Anderson M.G., Anderson F.M. 1963. Life history of Proterometra dickermani Anderson, 1962. The Journal of
121
Baylis H.A. 1938. On two species of the trematode genus Didymozoon from the mackerel. Journal of the Marine
Brooks D.R., O’Grady R.T., Glen D.R. 1985. Phylogenetic analysis of the Digenea (Platyhelminthes: Cercomeria)
with comments on their adaptive radiation. Canadian Journal of Zoology 63 (2): 411-443.
Galaktionov K.V., Dobrovolskij A.A. 2003. The biology and evolution of trematodes: an essay on the biology,
morphology, life cycles, transmissions, and evolution of digenetic trematodes. Springer Science & Busi-
ness Media.
Gibson D.I., Bray R.A. 1979. The Hemiuroidea: terminology, systematics and evolution. Bulletin of the British
Hussey K.L. 1945. The miracidium of Proterometra macrostoma (Faust) Horsfall 1933. The Journal of Parasitol-
ogy 31 (4): 269-271.
Looss A. 1894. Die Distomen unserer Fische und Frösche: Neue Untersuchungen über Bau und Entwickelung
des Distomenkörpers. Bibliotheca Zoologica 6 (16): 1-296.
Madhavi R. 1978. Life history of Genarchopsis goppo Ozaki, 1925 (Trematoda: Hemiuri-
dae) from the freshwater fish Channa punctata. Journal of Helminthology 52 (3): 251-259.
Matthews B.F., Matthews R.A. 1991. Lecithochirium furcolabiatum (Jones, 1933), Dawes 1947:
The miracidium and mother sporocyst. Journal of Helminthology
65
(4):
259-269.
Murugesh M., Madhavi R. 1990. Egg and miracidium of Hirudinella ventricosa (Trematoda: Hirudinellidae). The
Olson P.D., Cribb T.H., Tkach V.V., Bray R.A., Littlewood D.T.J. 2003. Phylogeny and classification of the
Digenea (Platyhelminthes: Trematoda) 1. International Journal for Parasitology 33 (7): 733-755.
Pan C.T. 1980. The fine structure of the miracidium of Schistosoma mansoni. Journal of Invertebrate Pathology
36
Ranking J.S. 1944. A review of the trematode genus Halipegus Looss, 1899, with an account of the life his-
tory of H. amherstensis n. sp. Transactions of the American Microscopical Society 63(2): 149-164.
Schauinsland H. 1883. Beitrag zur Kenntniss der Embryonalentwicklung der Trematoden. Gustav Fischer.
Schell S.C. 1975. The miracidium of Lecithaster salmonis Yamaguti, 1934 (Trematoda: Hemiuroidea). The Journal
of Parasitology 61 (3): 562-563. https://doi.org/10.2307/3279350
Self J.T., Peters L.E., Davis C.E. 1963. The egg, miracidium, and adult of Nematobothrium texomensis (Trematoda:
Smirnov P.A., Gonchar A. 2022. Miracidium of Steringophorus furciger (Digenea: Fellodistomidae) and other
Smirnov P.A., Dobrovolskij A.A. 2019. What is hidden under an eggshell? Ultrastructural evidence on morphology
of” passive” Prosorhynchus squamatus miracidium (Digenea: Bucephalidae). Invertebrate Zoology 16(4):
Smirnov P.A., Dobrovolskij A.A. 2021. Fine structure of a tiny gymnophalloid miracidium (Digenea). Journal of
Stunkard H.W. 1956. The morphology and life-history of the digenetic trematode, Azygia sebago Ward, 1910.
Wilson R.A. 1969a. Fine structure of the tegument of the miracidium of Fasciola hepatica L. The Journal of
Wilson R.A. 1969b. Fine structure and organization of the musculature in the miracidium of Fasciola hepatica.
122
Wilson R.A. 1969c. The fine structure of the protonephridial system in the miracidium of Fasciola hepatica.
Wilson R.A. 1970. Fine structure of the nervous system and specialized nerve endings in the miracidium of
Wilson R.A. 1971. Gland cells and secretions in the miracidium of Fasciola hepatica. Parasitology 63 (2):
Wootton D.M. 1957. Notes on the life-cycle of Azygia acuminata Goldberger, 1911 (Azygiidae-Trematoda). The
RECONSTRUCTION OF DEROGENES VARICUS MIRACIDIUM
(DIGENEA: DEROGENIDAE): FIRST ULTRASTRUCTURAL DESCRIPTION
OF SPINES ON THE SURFACE OF HEMIURATA LARVAE.
Peter A. Smirnov, D. Y. Krupenko
Keywords: Miracidium, Larva, TEM, Digenea, Hemiuroidea, Derogenidae
SUMMARY
We performed the detailed ultrastructural reconstruction of the “passive” miracidium of Derogenes
varicus - the species from Hemiurata group. The miracidium is highly miniaturized and simplified
in comparison with the “active” miracidia. For the first time we elucidate the nature of the spines
on the surface of hemiuroid larva: they are derivatives of the epithelial plates. The anterior end
of the larva is equipped with three epithelial plates, that bear both spines and cilia. The major part
of the miracidial surface is formed by tegument. The nervous and excretory systems of the D. vari-
cus miracidium are extremely reduced. Single undifferentiated cell comprises the germinal material
of the miracidium. We discuss the trends of evolution of hemiuroid miracidia that are associated with
transition to passive strategy of infection.
123