ПАРАЗИТОЛОГИЯ, 2023, том 57, № 3, с. 179-198.
УДК 576.895.121(265+268):591.557.81:595.351.6
МОРСКИЕ ЖЕЛУДИ SEMIBALANUS BALANOIDES (L.)
И BALANUS CRENATUS BRUGUIÈRE (BALANIDAE) -
ПРОМЕЖУТОЧНЫЕ ХОЗЯЕВА FIMBRIARIOIDES INTERMEDIA
(FUHRMANN, 1913) И ДВУХ ВИДОВ РОДА MICROSOMACANTHUS
(CESTODA, HYMENOLEPIDIDAE), ПАРАЗИТОВ МОРСКИХ УТОК
АТЛАНТИЧЕСКОГО СЕКТОРА АРКТИКИ
И СЕВЕРНОЙ ПАЦИФИКИ
© 2023 г. К. В. Регель*
Институт биологических проблем Севера ДВО РАН,
Портовая ул., 18, Магадан, 685000 Россия
*e-mail: kire@ibpn.ru
Поступила в редакцию 19.03.2023 г.
После доработки 03.05.2023 г.
Принята к печати 05.05.2023 г.
Исследована зараженность метацестодами балянусов Semibalanus balanoides (L., 1767)
и Balanus crenatus Bruguière, 1789, собранных в Баренцевом и Белом морях в 2020 г., а также
в заливе Шелихова Охотского моря в 2021 г. Вскрыты 313 экз. S. balanoides с о-ва Киль-
дин Баренцева моря и единичные B. crenatus со створок мидий Mytilus edulis из Печорского
и Белого морей. Метацестоды Fimbriarioides intermedia (Fuhrmann, 1913) обнаружены на о-ве
Кильдин у 1.00 ± 0.6% S. balanoides с интенсивностью инвазии (ИИ) 2-5 экз. и, впервые,
у одного из двух B. crenatus из Печорского моря (ИИ 15 экз.). Там же в обоих B. crenatus впер-
вые встречены метацестоды Microsomacanthus sp. I (ИИ 13 и 20 экз., средняя длина крючьев
хоботка 39.4 ± 0.1 мкм, лезвия 10.7 ± 0.1 мкм). Другой вид Microsomacanthus sp. II (ИИ 19 экз.,
средняя длина крючьев хоботка 45.7 ± 0.1 мкм, лезвия 14.8 ± 0.1 мкм) найден в одном из
четырёх B. crenatus Кандалакшского залива Белого моря. В заливе Шелихова Охотского моря
(сборы 2021) 8.0 ± 1.4% S. balanoides (при n = 362) заражены метацестодами F. intermedia
(ИИ 1-19 экз.). Представлены описания метацестод и рассмотрена таксономическая принад-
лежность цистицеркоидов Microsomacanthus spp.
Ключевые слова: метацестода, Fimbriarioides intermedia, Microsomacanthus, морские же-
луди, Balanidae, Balanus crenatus, Semibalanus balanoides, морские утки, Somateria mollissima,
S. spectabilis, Clangula hyemalis
DOI: 10.31857/S0031184723030018, EDN: ftuakv
Обыкновенные морские желуди Semibalanus balanoides (L., 1767) впервые были
указаны в роли промежуточных хозяев цестод Белопольской (1953), обнаружившей
179
у балянусов в заповеднике «Семь Островов» (восточный Мурман) метацестод трёх
видов и обозначившей их как цистицеркоиды «а», «б» и «в». В материале домини-
ровали цистицеркоиды «а», отнесенные автором «с большой долей вероятности»
к виду Fimbriarioides intermedia (Fuhrmann, 1913) (Hymenolepididae) — фоно-
вому паразиту обыкновенной гаги Somateria mollissima L. и гаги-гребенушки
S. spectabilis L. в районе исследования (Белопольская, 1952, 1953). Цистицер-
коид «б» встречен единожды и определён автором как личиночная форма вида
Anomotaenia clavigera (Krabbe, 1869) (Dilepididae), найденного в заповеднике
у морского песочника Calidris maritima Brünnich и камнешарки Arenaria interpres L.
Наконец, цистицеркоид «в», обнаруженный в пяти балянусах, не был идентифици-
рован с каким-либо видом цестод. Однако согласно описанию Белопольской (1953),
метацестоды имели сходное с цистицеркоидом «а» строение, а также идентичные
форму и длину хоботковых крючьев, но большее их число (14) и более короткий
хвостовой придаток.
Успенская (1963), исследуя фауну гельминтов ракообразных восточного Мурмана
(в районе Дальних Зеленцов), вновь регистрирует цистицеркоиды «а» как наиболее
многочисленные в районе исследования и отмечает колебание зараженности баля-
нусов от 2 до 90% в зависимости от местообитания (Ouspenskaia, 1960; Успенская,
1963). Не достигнув успеха в эксперименте по заражению птенцов неспецифичных
хозяев и не имея возможности поставить опыт с гагами, Успенская (1963) осторожно
полагает, что морфологические данные всё же позволяют согласиться с мнением Бело-
польской (1953) о принадлежности цистицеркоидов «а» виду F. intermedia.
Идентичные метацестоды обнаружены нами в S. balanoides северного побережья
Охотского моря, в ареале охотоморской популяции обыкновенной гаги, у которой
также паразитирует F. intermedia (Атрашкевич и др., 2008; Регель, 2008).
Помимо перечисленных находок, в обыкновенных балянусах на побережье
Йоркшира обнаружены метацестоды паразита куликов - дилепидиды Acanthocirrus
retirostris (Krabbe, 1869), отмеченной в Англии и Ирландии у камнешарки A. interpres
и чернозобика Calidris alpina L. (Williams et al., 1981).
В августе 2020 г. представилась возможность проверить уровень зараженности
балянусов S. balanoides баренцевоморского побережья Кольского полуострова на
свежем материале, собранном П.П. Стрелковым на о-ве Кильдин. Одновременно
с обыкновенными балянусами были переданы для просмотра единичные особи зуб-
чатых балянусов Balanus crenatus Bruguière на створках мидий Mytilus edulis L. из
Печорского и Белого морей. Наконец, в августе 2021 г. мной собраны и исследованы
свежие выборки балянусов из залива Шелихова Охотского моря - основного района
обитания охотоморской популяции обыкновенной гаги.
В статье представлены результаты исследования зараженности балянусов из пере-
численных мест сборов 2020 и 2021 годов из Белого, Баренцева и Охотского морей.
Для последнего региона уточнены полученные ранее данные 2006-2007 г. Приведены
иллюстрированные описания трёх обнаруженных видов метацестод, а также инвази-
онных яиц Fimbriarioides intermedia.
180
МАТЕРИАЛ И МЕТОДИКА
Сборы балянусов
Баренцевоморская выборка: более 300 экз. Semibalanus balanoides собраны в бухте Мо-
гильной о-ва Кильдин (69.320639° N, 34.327389° E) П.П. Стрелковым в августе 2020 г. Живой
материал (камни, обросшие балянусами) доставили в Санкт-Петербург, поместили в аквариум
факультета географии СПБГУ и содержали при 10°С. Половина выборки исследована in vivo
в сентябре 2020, вторая - была заморожена и вскрыта в январе 2021 г.
Печорская выборка: единичные экземпляры B. crenatus (2 зрелых и 5 молодых)
сняты с двух створок мидий, содержавшихся в том же аквариуме (см. выше), и ис-
следованы in vivo в сентябре 2020 г. Мидии добыты в августе 2020 г. в Хайпудыр-
ской губе (68.714167°N, 59.716944°E) с глубины 5 м (тралом Сигсби) в период рабо-
ты экспедиции ББС ЗИН РАН на судне «Профессор Владимир Кузнецов», собраны
А.А. Миролюбовым.
Беломорская выборка: 4 зрелые и 5 мелких особей B. crenatus сняты с двух замороженных
мидий, собранных В.М. Хайтовым 23.08.2020 на берегу Кандалакшского залива в окрестностях
пос. Лувеньга (67.096667° N, 32.713556° E). Вскрыты в январе 2021 г.
Охотоморские выборки S. balanoides: 166 балянусов из залива Кекурный (59.144053° N,
154.354194° E) из сбора 2006 г.; 220 - из бухты Астрономическая (59.152722° N, 153.320372°
E) залива Бабушкина, из сборов 2006-2007 г. 1; и более 350 балянусов, собранных в августе
2021 г. на рифах Наяханской губы залива Шелихова, восточнее пос. Эвенск (61.864961° N,
159.402856° E).
Вскрытие балянусов
Отделив скальпелем известковый домик рачка от субстрата (и удалив у B. crenatus из-
вестковое основание), захватывали пинцетом основание пучка ножек и извлекали тело рачка
из мантийной полости. Тело помещали между двумя предметными стёклами и исследовали
компрессорно под бинокуляром МБИ-10. При обнаружении метацестод их измеряли и фото-
графировали, используя микроскопы (Leica DMLS, AxioImager 1D), после чего помещали на
препарат в просветляющую среду (поливинил 2). Часть метацестод зафиксирована 96° спиртом
или глютаральдегидом для дальнейших исследований.
Просмотр коллекций цестод морских уток
Белого, Печорского и Охотского морей
В дополнение к характеристике F. intermedia приведены описания хоботковых крючьев
и инвазионных яиц по материалу от S. mollissima, добытой 27.07.2007 в бухте Внутренняя
Ямской губы Охотского моря. Зрелые цестоды обнаружены также в материале, собранном К.В.
Галактионовым от гаги-гребенушки 2.08.2010 у о-ва Долгий в Печорском море и А. Виногра-
довой от обыкновенной гаги с о-ва Средний Белого моря в августе 2019.
Для уточнения видового состава цестод рода Microsomacanthus, паразитирующих у морских
уток Белого и Печорского морей, помимо литературных источников, просмотрены коллекции
цестод 3 морянки Clangula hyemalis L. (собрана в 50-60-х годах на Белом море В.Г. Кулачковой);
обыкновенной гаги и гаги-гребенушки (собраны на Белом и Печорском морях В.В. Куклиным
в 2007 и К.В. Галактионовым в 2010 г.).
Все измерения приведены в микрометрах, если не указано иначе.
1 Первые результаты исследования этих сборов были представлены ранее (Регель, 2008). Здесь они
дополнены результатами вскрытия размороженных балянусов из сбора 2007 г.
2 Поливиниловый спирт (ПС) - 2 г, ацетон - 7 мл, молочная кислота - 5 мл, глицерин - 5 мл,
дистиллированная вода - 10-20 мл. Смесь нагревается на водяной бане до полного растворения
гранул ПС.
3 Хранятся в лаборатории паразитических червей ЗИН РАН.
181
РЕЗУЛЬТАТЫ
Метацестоды балянусов
В обыкновенных балянусах S. balanoides из Баренцева и Охотского морей об-
наружены метацестоды только одного вида - Fimbriarioides intermedia (рис. 1, 2).
Показатели их заражённости представлены в табл. 1, в том числе: экстенсивность
инвазии (ЭИ), интенсивность инвазии (ИИ), индекс обилия (ИО).
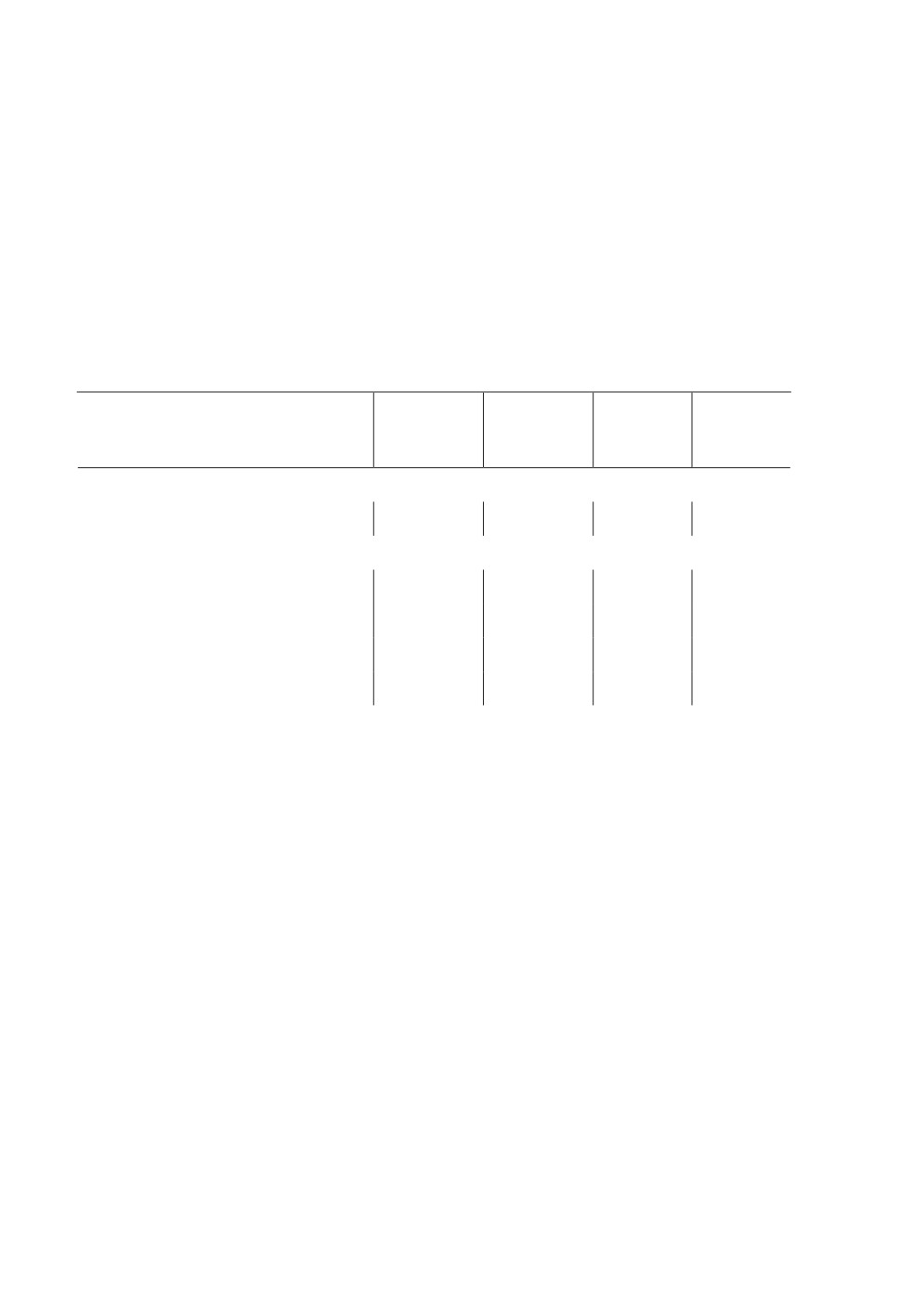
Таблица 1. Зараженность балянусов Semibalanus balanoides метацестодами
Fimbriarioides intermedia в Баренцевом и Охотском морях
Table 1. Metacestode Fimbriarioides intermedia infestation of Semibalanus balanoides,
collected in the Barents Sea and in the Sea of Okhotsk
Вскрыто
Место, дата сбора
балянусов,
ЭИ%
ИИ, экз.
ИО, экз.
экз.
Баренцево море:
О-в Кильдин, август 2020
313
1.0 ± 0. 6
2-5
0.03
Охотское море:
Залив Кекурный, июль 2006
166
2.4 ± 1. 2
1-2
0.04
Бухта Астрономическая, июль 2006
50
4.0 ± 2.8
2-12
0.28
Бухта Астрономическая, август 2007
170
3.5 ± 1.4
1-3
0.06
Гижигинская губа, август 2021
362
8.0 ± 1. 4
1-19
0.49
Первые вскрытия единичных зубчатых балянусов B. crenatus из Печорского и Бе-
лого морей дали иной результат. В них (помимо метацестод F. intermedia) впервые
обнаружены цистицеркоиды двух видов рода Microsomacanthus. Первый из них -
Microsomacanthus sp. I (рис. 3) - найден в Хайпудырской губе Печорского моря
у двух зрелых экземпляров B. crenatus с ИИ 13 и 20 экз. При этом один из этих баля-
нусов был совместно заражён 15 экз. F. intermedia. Напротив, лишь в одном зубчатом
балянусе из Кандалакшского залива Белого моря, вскрытом после размораживания,
найдено 19 метацестод другого вида - Microsomacanthus sp. II (рис. 4).
Часть препаратов с метацестодами из балянусов Белого, Печорского и Охотского
морей передана на хранение в лабораторию паразитических червей ЗИН РАН.
Fimbriarioides intermedia (рис. 1, 2). В исследованном материале ИИ балянусов
S. balanoides варьирует от 2 до 5 в сборах с о-ва Кильдин и от 1 до 19 - из Охотского
моря. Также относительно высока ИИ балянуса B. crenatus, заражённого совместно
метацестодами Microsomacanthus sp. I (13) и F. intermedia (15). Интенсивное зара-
жение балянусов обусловлено удобной упаковкой яиц F. intermedia, которые выходят
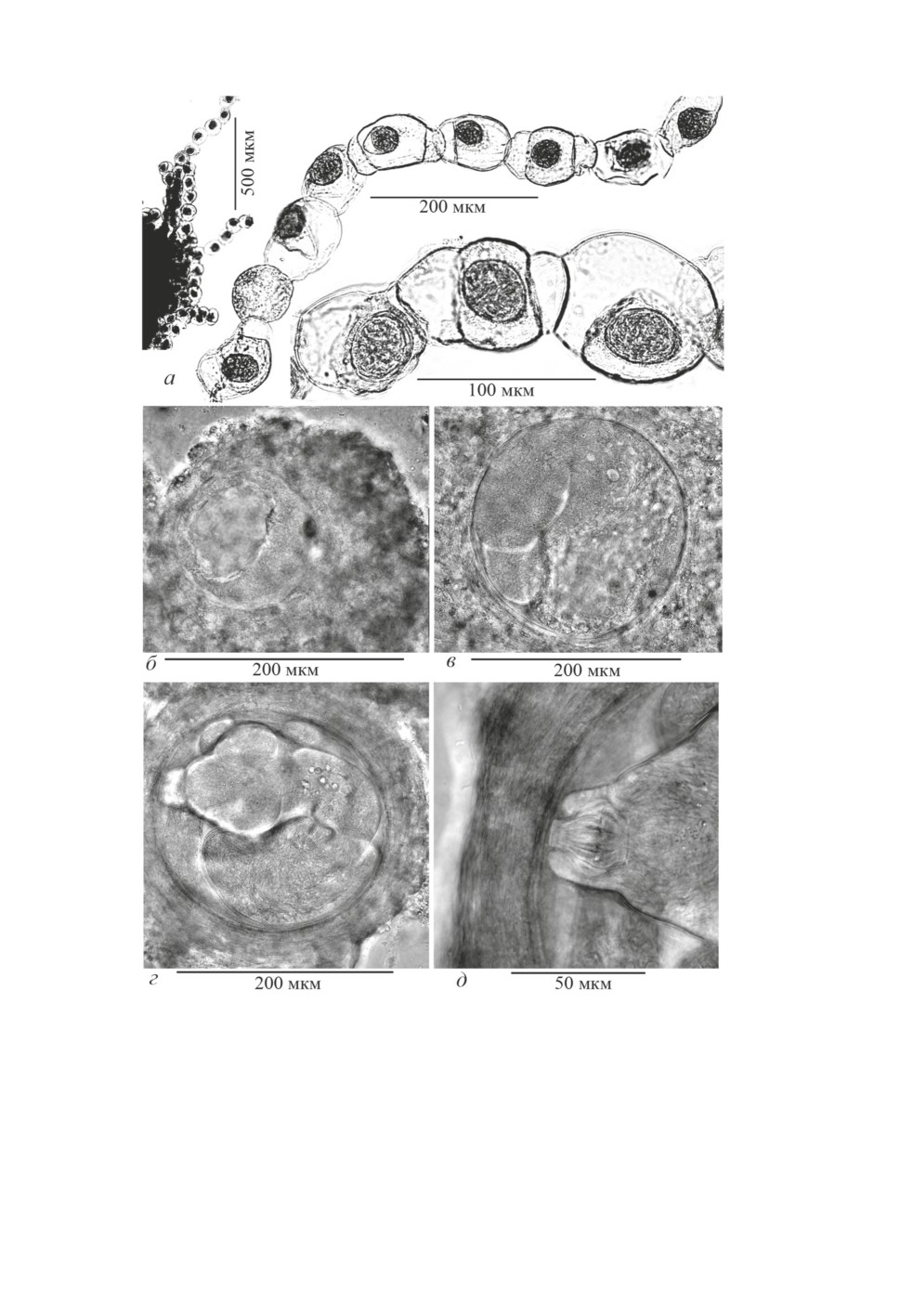
из зрелых маточных проглоттид в виде цепочек из 10-30 округлых яиц (рис. 1а).
Средний размер наружной оболочки фиксированных спиртом яиц 92.3 ± 2.0 × 68.9 ±
182
1.3, зернистой оболочки 55.4 ± 2.4 × 44.2 ± 2.0, эмбриофора 41.2 ± 1.2 × 32.4 ± 0.6,
онкосферы 33.3 ± 1.1 × 26.9 ± 1.1. Длина эмбриональных крючьев 14-15.
Характеристика метацестод F. intermedia в основном дана по материалу 2021 г.
от S. balanoides из Наяханской губы Охотского моря. В виде дополнения, в конце
описания, приведены некоторые параметры цистицеркоидов F. intermedia от обык-
новенных балянусов о-ва Кильдин Баренцева моря и от нового хозяина - зубчатого
балянуса из Хайпудырской губы Печорского моря.
В выборке 2021 г. обнаружены преимущественно полностью сформированные мета-
цестоды. Лишь в двух балянусах найдены ранние стадии морфогенеза (от стадии фор-
мирования первичной полости до раннего сколексогенеза), очевидно принадлежащие
обсуждаемому виду, т.к. такое строение наружных оболочек (экзоцисты и капсулы)
выявлено только у метацестод F. intermedia. При этом другие виды метацестод
в исследованных выборках S. balanoides из Охотского моря не обнаружены.
Диаметр метацестод на стадии первичной полости 117 и 150; размер одной
на стадии дифференциации 168 × 150, на стадии раннего сколексогенеза - от
185 × 189 до 225 × 235 (рис. 1б-1в). Также дважды, наряду со сформированными,
найдены единичные особи на стадии позднего сколексогенеза и начала инвагина-
ции, их размер варьирует от 209 × 227 до 270 × 308 (рис. 1г-1д). Морфогенез
метацестод F. intermedia проходит по характерному для представителей рода
Fimbriaria типу «циклоцерк» (Котельников, 1971), при котором линейный рост
тела цистицеркоида, ограниченный наружной неклеточной оболочкой (экзоцистой),
идёт циклично (рис. 1в-1д). Обычно метацестоды локализуются на стенке средней
кишки рачка (рис. 2а) и очень редко встречаются в области пищеварительных желёз
или на семенниках. Вокруг метацестод формируется капсула, образованная клеточны-
ми элементами хозяина (рис. 1б-1д, 2б). Толщина стенки капсулы достигает 35-68.
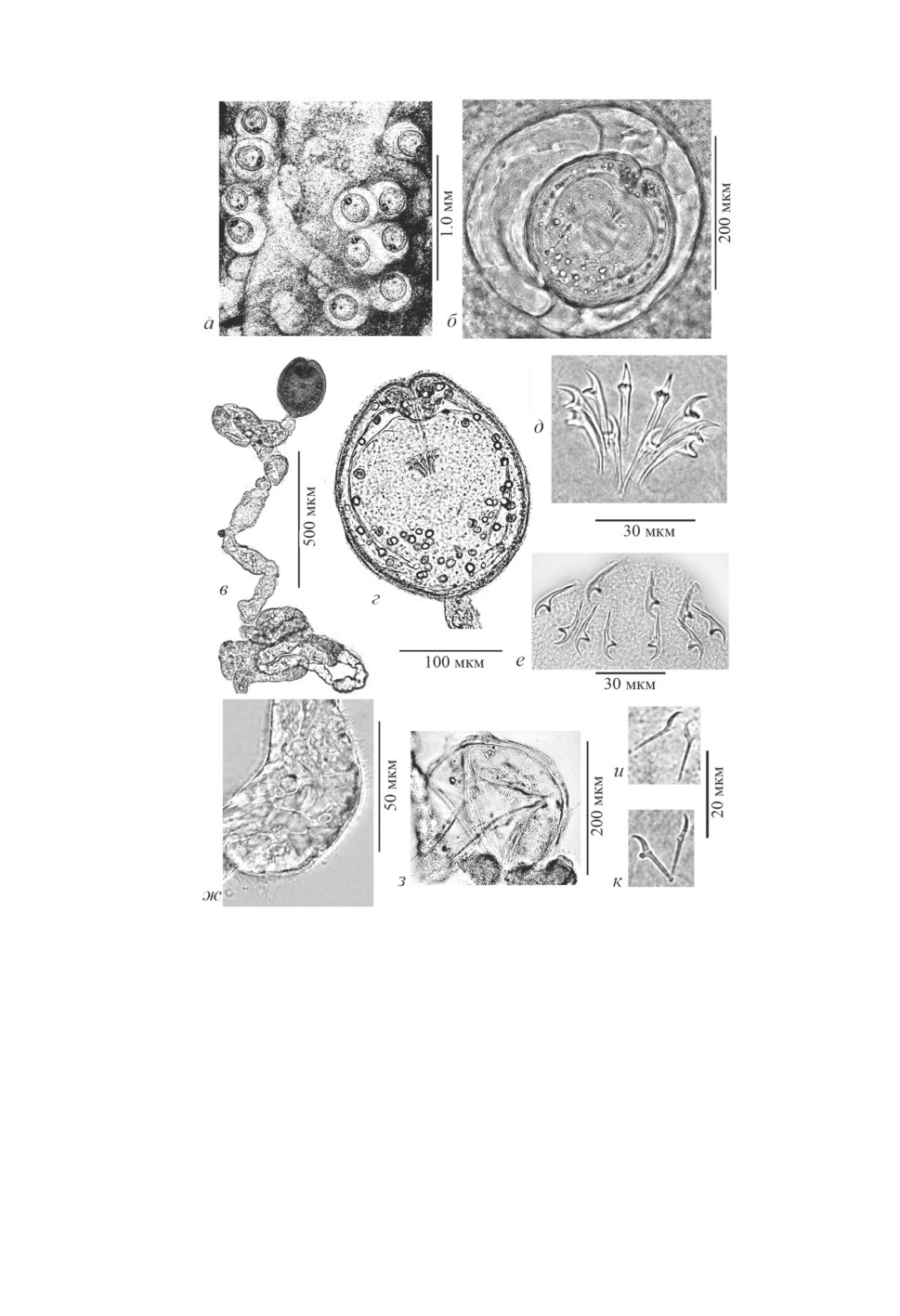
Размер метацестод без учёта капсулы варьирует в широких пределах. У наиболее
крупных особей, при низкой ИИ 1-2 экз. размер наружной цисты достигал 426 × 417
и 443 × 386. Пределы размера экзоцисты при ИИ более 10 экз. колеблются от 273 ×
174 до 372 × 350, в среднем 312.2 ± 7.3 × 268.6 ± 7.8 при n = 34. Различия в объёмах
метацестод обусловлены степенью развития хвостового придатка, который, оплетая
эндоцисту, у крупных особей может занимать до 2/3 полости (объёма) наружной ци-
сты. При механическом разрушении капсулы и толстостенной (3-4) экзоцисты (рис.
2з) иногда удавалось извлечь цистицеркоид с неповреждённым хвостовым придатком
длиной до 2.8 мм и толщиной 17-130 (рис. 2в). Размер внутренней цисты (эндоцисты)
варьирует не столь широко - от 173 × 169 до 247 × 202, в среднем 218.3 ± 2.8 ×
184.7 ± 2.0 (n = 43) (рис. 2в, 2г).
Общая толщина стенки эндоцисты, состоящей из пяти слоев, 7.0-15.0, толщина
пристеночной части шейки 5-10, ширина сколекса 87-138 (средняя 115.1 ± 2.6, n = 30),
размер присосок 49-58 × 45-53. Хоботковых крючьев 10, их длина 23.0-25.5 4, лезвия
5.5-7.0, корневого отростка 3.5-4.0, в среднем 24.5 ± 0.07, 6.6 ± 0.05 и 4.0 ± 0.01
(n = 78), соответственно (рис. 2д).
4 Крючья хоботка ленточной стадии F. intermedia изучены у двух комплектных половозрелых
цестод: длина крючьев 22.0-24.5, лезвия 6.0-7.0, корневого отростка 3.5-4.0 (рис. 2е).
183
Рисунок 1. Яйца Fimbriarioides intermedia и некоторые стадии постэмбрионального развития
вида из спонтанно заражённых балянусов Semibalanus balanoides: а - цепочки яиц;
б - первичная полость; в - дифференциация (дефинитивного отдела и церкомера);
г - поздний сколексогенез; д - хоботок не полностью втянут, крючья ещё не инвертированы.
Figure 1. The eggs of Fimbriarioides intermedia and several stages of postembryonal
development of this species from spontaneously infected Semibalanus balanoides: а - chain
of eggs; б - primary lacuna; в - differentiation (on the definitive part and cercomer); г - late stage
of scolex development; д - proboscis not fully retracted, rostellar hooks not yet inverted.
184
Рисунок 2. Сформированные метацестоды и хоботковые крючья комплектной зрелой
цестоды Fimbriarioides intermedia: а - участок кишки балянуса с метацестодами;
б - одна из них; в - цистицеркоид, извлечённый из капсулы и экзоцисты; г - эндоциста;
д - венчик хоботковых крючьев метацестоды; е - хоботок с крючьями зрелой цестоды;
ж - длинные микроворсинки на хвостовом придатке; з - толстостенная экзоциста после
извлечения цистицеркоида; и - средняя и к - латеральная пары эмбриональных крючьев.
Figure 2. Fully development metacestodes and rostellar hooks of complete (whole) gravid cestode
Fimbriarioides intermedia: а - part of the balanus intestine with metacestodes; б - one of them;
в - cysticercoid extracted from capsule and exocyst; г - endocyst; д - coronas (corollas)
of metacestode rostellar hooks; е - rostellum of complete gravid cestode with hooks;
ж - long microvilli on the caudal appendage; з - thick-walled exocyst after cysticercoid
extraction; и - middle and к - lateral pairs of embryonic hooks.
185
На хвостовом придатке цистицеркоидов, извлеченных из капсул и экзоцист, отме-
чен густой покров из микроворсинок длиной 6-7 (рис. 2ж). Эмбриональные крючья
обычно расположены на хвостовом придатке, очень редко единичные крючья про-
никают в фиброзно-паренхиматозный слой стенки цисты. Варьируют длина (14-16)
и форма эмбриональных крючьев разных пар (рис. 2и, 2к).
Ниже дано краткое дополнение к описанию цистицеркоидов F. intermedia по ма-
териалу от обыкновенных балянусов о-ва Кильдин и от зубчатого балянуса Хайпу-
дырской губы.
Параметры метацестод F. intermedia от обыкновенного балянуса S. balanoides
с о-ва Кильдин близки приведённым выше: средний размер экзоцисты (при ИИ 3-5
и n = 7) - 292.0 ± 7.9 × 274.6 ± 6.2, эндоцисты - 213.9 ± 6.4 × 186.4 ± 6.9, длина
крючьев хоботка 23.0-25.0, лезвия 6.0-7.0, корневого отростка 4.0. Метацестоды из
балянуса B. crenatus были лишены капсул (лишь у одной сохранились следы экзоци-
сты), и их цистицеркоиды заметно мельче, чем в типичном хозяине - S. balanoides.
Размер эндоцисты в поливиниле колеблется от 143 × 120 до 208 × 175, в среднем
160.8 ± 6.7 × 139.9 ± 5.5, при n =12. Хвостовые придатки относительно короткие,
не более чем в 3-4 раза длиннее цисты. Длина крючьев хоботка 21.0-25.0 (в среднем
22.9 ± 0.4, при n = 15), лезвия 6.0-6.5 (6.0±0.03), корневого отростка 3.5-4.5 (4.0 ±
0.09). Длина эмбриональных крючьев 14-16, у большинства метацестод часть крючьев
смещена в стенку цисты.
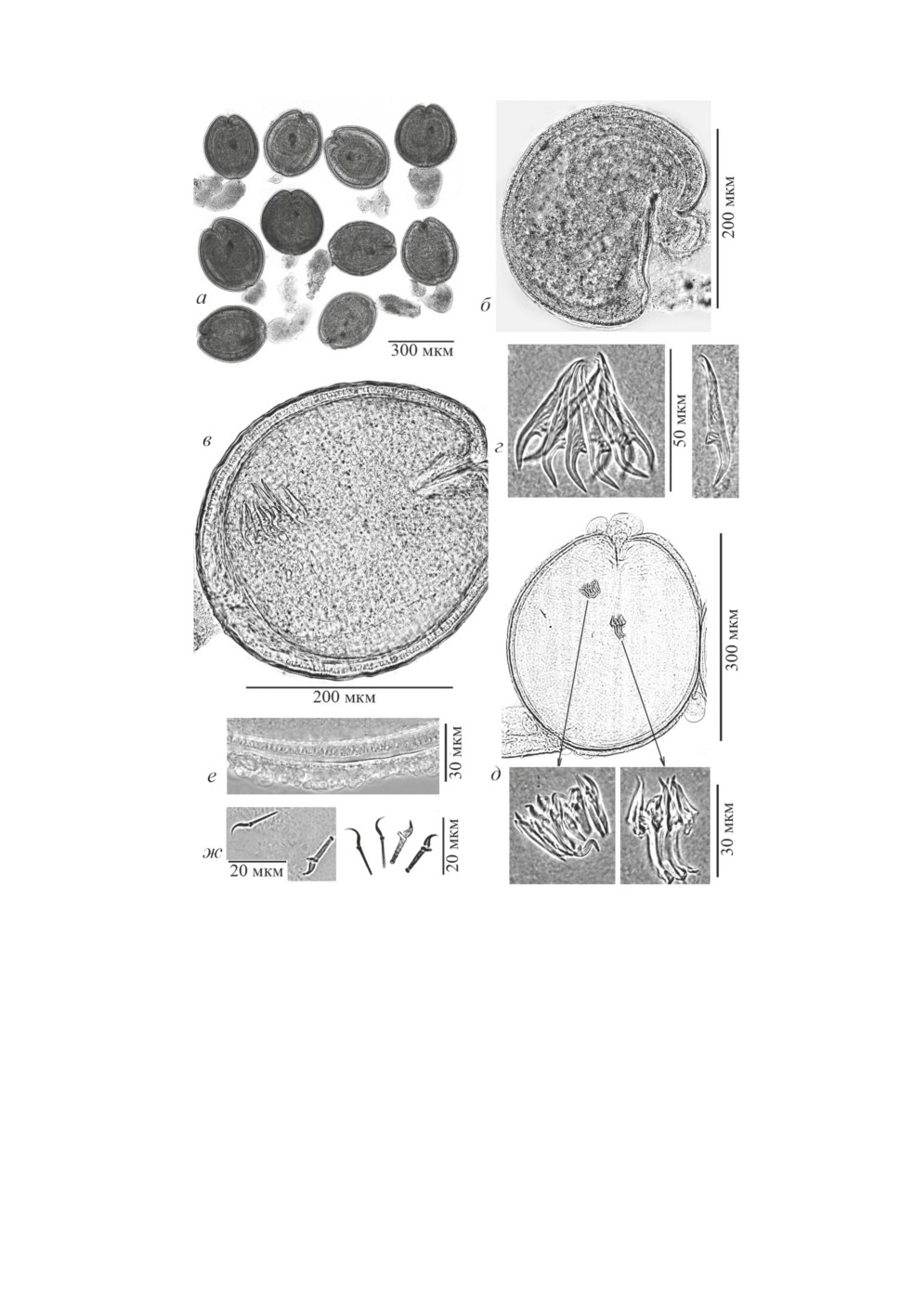
Microsomacanthus sp. I (рис. 3). При вскрытии балянусов B. crenatus из Печор-
ского моря большая часть цистицеркоидов выпала из тонких неклеточных оболочек
(экзоцист) и только часть из них сохранила хвостовые придатки (рис. 3а-3в). Лишь
5 метацестод, прикреплённых к кишке балянуса, сохранили экзоцисты (этот материал
зафиксирован в глютаре для морфологических исследований). Размер цисты живых
(рис. 3а, 3б) и заключённых в поливинил (рис. 3в) цистицеркоидов варьирует от 250 ×
235 до 300 × 240 (в среднем 273.6 ± 4.6 × 239.2 ± 1.9, n = 10). Общая толщина пяти
слоёв стенки цисты 9-18, пристеночной части шейки 13-20 (рис. 3г). Ширина сво-
бодной части шейки 85-137. Диаметр сколекса 170-189, размер присосок 75-98 ×
60-74. Диаметр втянутого хоботка 65-76. На хоботке 10 диорхоидных крючьев дли-
ной 38-41 (в среднем 39.4 ± 0.11, n = 33), лезвие около ¼ длины крючка 9.5-11
(10.7 ± 0.06) (рис. 3д). Длина хвостового придатка 235-430, толщина от 28 до 111.
Длина эмбриональных крючьев 15-16.5 (рис. 3е), часть крючьев обычно смещена
в фиброзно-паренхиматозный слой стенки цисты (рис. 3ж).
Microsomacanthus sp. II (рис. 4). При вскрытии размороженных балянусов
B. crenatus Кандалакшского залива из тела одного рачка выпали 10 сформирован-
ных метацестод с частично утерянными хвостовыми придатками (рис. 4а) и 2 не
завершивших морфогенез цистицеркоида (рис. 4б). Несколько метацестод, прикре-
плённых к кишке рачка (5 сформированных и 2 не завершившие развитие), были
сначала зафиксированы спиртом, а затем также заключены в поливинил (их параме-
тры приведены ниже в круглых скобках). У не завершивших развитие (инвагинацию)
186
метацестод, возможно, в результате замораживания, произошла деформация цист,
а с выдвинутых хоботков были утеряны крючья (рис. 4б). Размер асимметричных цист
265 × 170 и 300 × 172 (265 × 138 и 317 × 193). Внутри одной из них сохранились
уродливые хоботковые крючья, сходные с группой мелких крючков, обнаруженных и
описанных ниже у одной из сформированных метацестод. Размер цисты последних
варьировал у 10 нефиксированных особей от 294 × 243 до 347 × 294, средняя длина
цисты 313.7 ± 5.0, ширина - 269.5 ± 5.4 (у 5 цист после фиксации - 300 ± 8.4 и 261 ±
6.5, соответственно). Ширина хвостового придатка - от 85 до 153. Просмотр деталей
внутреннего строения метацестод стал возможным только после просветления их
в поливиниле (рис. 4в-4з). Средняя толщина стенки цисты, состоящей из пяти слоёв,
18.3 ± 0.8, пристеночной части шейки - 26.1 ± 1.8 (рис. 4в, 4д). Диаметр сколекса
варьировал от 151 до 201, в среднем 169.5 ± 5.2. Хоботок вооружён 10 крючьями
диорхоидного типа длиной 44.0-49.5 (в среднем 45.7 ± 0.5, n = 67), длина лезвия -
14.0-16.0 (14.8 ± 0.07) (рис. 4в, 4г). Одна из полностью сформированных метаце-
стод имела две группы уродливых крючьев хоботка, одна из которых включала более
10 крючков длиной 20-22 мкм, а вторая - 3-4 S-образных крючка длиной 33-37
(рис. 4е, 4ж). Эмбриональные крючья локализовались как в остатках хвостового при-
датка, так и во внутреннем слое стенки цисты, варьировали длина (15-18) и форма
крючьев разных пар (рис. 4з).
Microsomacanthus spp. морских уток Белого и Баренцева морей
Для предварительного определения видовой принадлежности метацестод рода
Microsomacanthus проведено сравнение параметров хоботковых крючьев найденных
цистицеркоидов и цестод, паразитирующих у гаг и других морских уток Белого, Ба-
ренцева морей и сопредельных акваторий приатлантического сектора Арктики.
Согласно литературным и собственным данным, в фауне цестод обыкновенной гаги
этих морей род Microsomacanthus представлен 7 видами: M. microsoma (Creplin, 1829);
M. diorchis (Fuhrmann, 1913); Microsomacanthus sp. (syn. M. ductilis sensu Galkin et al.,
1997); M. jaegerskioeldi (Fuhrmann, 1913); M. parasobolevi Regel, 2005; M. polystictae
Regel, 1988 и M. somateriae Ryzhikov, 1965 (Белопольская, 1952; Галактионов и др.,
1997; Галкин, 1997; Галкин и др., 1999; Галкин, Регель, 2010; Куклина, Куклин, 2019;
Кулачкова, 1958; Регель, 2019; Galkin et al., 2005, 2006, 2008). Из них у гаг Бело-
го моря доминируют M. diorchis и M. microsoma (Кулачкова, 1958, 1979). При этом
у взрослых гаг в период весеннего прилёта особо отмечена сильная заражённость
видом M. microsoma (Кулачкова, 1958). Это подтверждают и оригинальные данные -
результаты определения фиксаций цестод рода Microsomacanthus от 6 взрослых
S. mollissima, добытых на Белом море в начале июня 2007. Все 6 гаг были инвази-
рованы M. microsoma, а 4 из них ещё двумя видами (M. diorchis и M. jaegerskioeldi).
Из этих трёх видов (а также из остальных перечисленных выше) M. microsoma имеет
наиболее близкие параметры хоботковых крючьев (длина крючка 45-50/длина лезвия
14-15) к представленной выше характеристике метацестод Microsomacanthus sp. II.
187
Рисунок 3. Полностью сформированные метацестоды Microsomacanthus sp. I:
а - цистицеркоид, извлечённый из тканей Balanus crenatus; б - цистицеркоид с плотно
прилегающим хвостовым придатком в тканях балянуса; в - он же, после просветления
в поливиниле; г - стенка цисты (с.ц.) и пристеночная (окружающая сколекс) часть шейки
(п.ш.); д - хоботковые крючья; е - эмбриональные крючья; ж - они часто проникают
из хвоста в фиброзный слой цисты.
Figure 3. Fully-formed metacestodes Microsomacanthus sp. I: а - cysticercoid extracted
from the tissues of Balanus crenatus; б - cysticercoid with a tightly adjacent tail appendix
in the tissues of balanus; в - the same, after enlightenment in polyvinyl; г - the cyst wall (с.ц.)
and the exfoliated (surrounding scolex) part of neck (п.ш.); д - rostellar hooks;
е - embryonic hooks; ж - they often penetrate from the tail into the fibrous layer of cysts.
188
Рисунок 4. Метацестоды Microsomacanthus sp. II из размороженных Balanus crenatus:
а - полностью сформированные метацестоды, частично или полностью потерявшие
хвостовые придатки; б - деформированная циста не завершившей инвагинацию метацестоды
(утеряны крючья хоботка, выдвинутого из устья цисты); в - циста через 3 часа после
просветления в поливиниле; г - хоботковые крючья; д -цистицеркоид с тератологией
крючьев хоботка; е - стенка цисты с разбухшей (расслоившейся) наружной оболочкой;
ж - эмбриональные крючья.
Figure 4. Metacestodes Microsomacanthus sp. II from defrosted Balanus crenatus:
а - fully-formed cysticercoids that partially or completely lost tail appendages; б - misshapen
cyst of metacestodes that did not completly invaginated (hooks of the proboscis protruding
from the cyst aperture are lost); в - cysticercoid after 3 hours enlightenment in polyvinyl;
г - rostellar hooks; д - cysticercoid with rostellar hooks teratology; е - cyst wall
with an outer layer swollen (exfoliated, stratified); ж - embryonic hooks.
189
Предварительное изучение коллекции цестод морянки Clangula hyemalis L. Бело-
го моря показало наличие в ней 8 видов рода Microsomacanthus (доминируют среди
них 4 вида, помеченные звёздочками*): M. microsoma; M. abortiva (Linstow, 1904);
M. jaegerskioeldi*; M. mica Regel, 1988; M. polystictae Regel, 1988*; M. sobolevi Spassky
et Jurpalova, 1964*; M. tuvensis Spasskaja et Spassky, 1961 и Microsomacanthus sp.*. Из
перечисленных видов три (доминирующих) имеют близкие параметры хоботковых
крючьев к таковым метацестод Microsomacanthus sp. I: M. polystictae (38-42/11-12),
M. sobolevi (39-42/10-12) и Microsomacanthus sp. (40-43/11-12).
ОБСУЖДЕНИЕ
Определение видовой принадлежности метацестод из спонтанно заражённых про-
межуточных хозяев возможно лишь при наличии уникальных по размеру и форме
хоботковых крючьев цестод. В данной работе мы вынуждены идти более сложным
путём: идентификация метацестод опирается на знание видового разнообразия це-
стод гаг и других морских уток исследуемой территории, а также особенностей их
питания.
Как уже отмечено во введении, у балянусов S. balanoides неоднократно регистри-
ровали спонтанную инвазию цистицеркоидами «а», отнесёнными «с большой долей
вероятности» к виду Fimbriarioides intermedia (Белопольская, 1953; Ouspenskaia,
1960; Успенская, 1963). Кроме того, можно полагать, что цистицеркоиды «в», имев-
шие, согласно описанию Белопольской (1953), сходное с цистицеркоидом «а» строе-
ние, но большее число хоботковых крючьев (14) и более короткий хвостовой при-
даток, также принадлежат виду F. intermedia. Увеличение числа хоботковых крючьев
цистицеркоидов «в» выглядит тератологией - удвоение нескольких (2-5) крючьев
в венчике, в норме имеющем 10 крючьев, отмечалось как уродство у ювенильных
Fimbriaria sp. А длина хвостового придатка метацестод сильно варьирует и обычно
зависит от интенсивности инвазии промежуточного хозяина. В нашем материале
у метацестод F. intermedia не отмечено «дупликации» крючьев хоботка.
Напомним, что ленточная стадия F. intermedia (Fuhrmann, 1913) была описана
от обыкновенной гаги Исландии по материалу без сколексов. Белопольская (1952)
впервые дополнила характеристику вида описанием сколекса от комплектных цестод,
указав количество (10) и длину хоботковых крючьев (25.0), а рисунок опубликова-
ла одновременно с описанием цистицеркоида «а» (Белопольская, 1953, рис. 1в, 1г).
Идентичную длину хоботковых крючьев (24-25) цистицеркоида «а» и рисунок крючка
привела Успенская (Ouspenskaia, 1960, fig.17,3; 1963, рис. 19,3). Шиллер также на-
шёл комплектных цестод в материале от тихоокеанского подвида обыкновенной гаги
(S. mollissima v-nigrum) и гаги-гребенушки на Аляске и описал сколексы F. intermedia
и хоботковые крючья сходной формы, длиной 22.0 (Schiller, 1955, Plate I, fig. 11, 12).
Приведённые авторами рисунки хоботковых крючьев взрослых цестод F. intermedia
и метацестод из балянусов дают представление о длине лезвия (около 1/4 длины
190
крючка) и корневого отростка (около 1/6 длины крючка). В нашем материале (от охо-
томорской гаги) длина крючьев F. intermedia варьирует в пределах 22.0-24.5, лезвия
6.0-7.0, корневого отростка 3.5-4.0 (рис. 2е).
Итак, в подтверждение видовой принадлежности метацестод из балянусов к виду
F. intermedia можно предъявить, во-первых, идентичные характеристики хоботковых и
эмбриональных крючьев метацестод и взрослых цестод. Во-вторых, именно этот вид
доминирует у обыкновенных гаг и гаг-гребенушек в заповеднике «Семь Островов»
(Белопольская, 1952), а также у взрослых обыкновенных гаг в Кандалакшском запо-
веднике в период весеннего прилёта (Кулачкова, 1958). В последнем районе у погиб-
шего летом самца гаги отмечена гиперинвазия цестодами, в т.ч. видом F. intermedia
(ИИ = 1466); значительно слабее заражены этим паразитом нелётные птенцы - 2 из
14 с ИИ не более 2 (Кулачкова, 1979). Всё это обусловлено возрастными различия-
ми рациона. Известно, что у взрослых гаг исключительно важную роль в питании
играют бентосные моллюски, прежде всего - мидии (Бианки и др., 1979; Гаврило,
Стрём, 2015; Мокиевский и др., 2012; Татаринкова и др., 1979; Шкляревич, Фомина,
2012; Skirnisson, 2016). Важно при этом, что мидии нередко служат субстратом для
поселения балянусов и, таким образом, могут выполнять роль пассивных передатчи-
ков инвазионных метацестод. Интересно, что самих балянусов очень редко отмечают
в списках кормовых объектов гаг Белого и Баренцева морей (Бианки и др., 1979;
Шкляревич, Фомина, 2012).
В результате, учитывая приведённые выше доводы, мы без сомнений относим
обсуждаемых метацестод к виду Fimbriarioides intermedia и считаем морских усо-
ногих раков Balanus spp. его облигатными промежуточными хозяевами.
Здесь следует вспомнить, что ранее в литературе были представлены альтерна-
тивные сведения о жизненном цикле F. intermedia, надолго связавшие его постэм-
бриональное развитие с пресноводными циклопидами и остракодами (Jarecka, 1958,
1961). До настоящего времени именно пресноводные рачки упоминались в сводках
как основные промежуточные хозяева F. intermedia (Спасская, 1966; McDonald, 1969
и др.), хотя это трудно сопоставить с экологией его облигатного дефинитивного
хозяина - обыкновенной гаги, которая ведет исключительно морской образ жизни
на большей части своего ареала. Ныне уже установлено (Максимова, 1989), что
F. intermedia ошибочно регистрировали у различных видов птиц в континенталь-
ных зонах Евразии (Wiśniewski, 1958; Спасская, 1966; Максимова, 1976 и др.).
Основную роль в этом сыграла работа Ярецкой (Jarecka, 1958, p. 88), в которой
автор определила как “Fimbriarioides intermedia” цестоду от белоглазого нырка
Aythya nyroca (Güldenstädt) (определила с некоторым сомнением - “this identification
is not, however, absolutly certain”). К сожалению, Ярецкая (Jarecka, 1958, p. 89)
не привела подробного описания найденной цестоды, а лишь дифференцировала
её от Fimbriaria fasciolaris (Pallas, 1781) «на основании различий анатомической
191
структуры» и, главное, по наличию одиночных яиц 5. Успешно проведя экспери-
менты по заражению пресноводных циклопов и остракод яйцами обоих видов,
Ярецкая (Jarecka, 1958, с. 90) отметила лишь различия формы и числа(!) хобот-
ковых крючьев их цистицеркоидов, описав у “F. intermedia” 10 крючьев длиной
0.02 мм, с чуть более длинным (0.011 мм) лезвием, чем у F. fasciolaris. При этом
у метацестод F. fasciolaris автор указывает меньшее число крючьев (обычно 8,
изредка 6!), хотя в диагнозе подсемейства Fimbriariinae Wolffhügel, 1900, типо-
вым родом которого избран род Fimbriaria Froelich, 1802, приведен безальтер-
нативный признак - одинарная корона из 10 крючьев (Czaplinski, Vaucher, 1994).
Здесь следует ещё особо отметить, что описанные Ярецкой параметры крючьев
“F. intermedia” (с индексом лезвия более 50%) отличаются от таковых не толь-
ко взрослых цестод и метацестод F. intermedia (индекс варьирует в пределах
27-31%), но не известны пока и у других фимбриариин.
Наконец, зрелые яйца F. intermedia, также как F. fasciolaris, объединены
в цепочки, но имеют форму чёток. А одиночные яйца характерны для нескольких
видов рода Fimbriaria (F. amurensis Kotelnikov, 1960; F. kubanica Kotelnikov, 1965;
F. czaplinski Grytner-Ziecina, 1994) и описаны у Fimbriarioides tadornae Maksimova,
1976. Повторяя диагноз F. tadornae и описывая новый вид F. spasskajae от крас-
ноносого нырка Aythya ferina L. Казахстана, Максимова (1989) свела к этим
видам в синонимы“F. intermedia” по собственным материалам от нырковых уток
Казахстана и материалам коллег из сопредельных регионов. Личиночное развитие
F. tadornae связано с обитателями солёных (и гиперсолёных) озёр - жаброно-
гими рачками Artemia salina (Максимова, 1976, 1989) и Artemia spp. (Vasileva
et al., 2009). При этом, по мнению Максимовой (1976), у “F. intermedia” (синоним
F. spasskajae) от нырков Казахстана предполагается пресноводный промежуточный
хозяин, т.к. нырки предпочитают пресноводные биотопы, и эксперимент по за-
ражению A. salina яйцами F. spasskajae не увенчался успехом. Таким образом,
жизненный цикл F. spasskajae, вероятно, проходит с участием пресноводных ра-
кообразных в качестве промежуточных хозяев (Максимова, 1989). Следовательно,
не исключая возможность паразитирования у нырков озера Друзно в Польше какого-
то неизвестного вида Fimbriarioides с «пресноводным жизненным циклом», вопрос
о таксономической принадлежности “F. intermedia” sensu Jarecka, 1958 оставляем
открытым.
Результаты настоящей работы показывают возможные пути циркуляции в морских
экосистемах некоторых видов цестод морских уток, в питании которых большую
долю составляют мидии с их эпибионтами - балянусами. В нашем материале, имен-
но в снятых с раковин мидий зубчатых балянусах, впервые найдены метацестоды
Microsomacanthus spp. Несомненно, эти цестоды, также как F. intermedia, заражают
5 В результате этот признак был включён в последний диагноз рода Fimbriarioides: “Oncospheres
with spherical outer envelope, leave uterus singly” (Czaplinski, Vaucher, 1994, p. 609).
192
балянусов независимо от вида субстрата, но паразитирование в рачках, поселившихся
на излюбленном кормовом объекте гаг и других морских уток - на мидиях, явно об-
легчает путь паразита к дефинитивному хозяину.
Предварительное определение метацестод рода Microsomacanthus, обнаруженных
у балянусов B. crenatus, основано не только на морфологической характеристике,
но и на данных о видовом разнообразии цестод нырковых уток Белого и Баренцева
морей. К сожалению, параметры хоботковых крючьев метацестод Microsomacanthus
sp. I близки таковым сразу трёх видов (M. polystictae, M. sobolevi и Microsomacanthus
sp.), встреченных у морянок Белого моря. M. polystictae описан от сибирской гаги
Polysticta stelleri (Pall.) западной Чукотки, обнаружен там же у морянок (наши но-
вые данные) и зарегистрирован у обыкновенной гаги Исландии (Skirnisson, 2016).
M. sobolevi - редкий паразит морянок арктического побережья Азии, встречен
у единичных взрослых птиц на Чукотке (Спасский, Юрпалова, 1966; Регель, 2001) и
в низовьях Енисея (Толкачёва, 1966). На Белом море отмечаем его впервые у 9.2 ±
3.6% морянок, как у взрослых птиц летом и осенью, так и у сеголеток поздней осе-
нью. Третий вид будет описан как новый.
Параметры хоботковых крючьев метацестод Microsomacanthus sp. II идентичны
таковым M. microsoma, обычного паразита гаг Белого и Баренцева морей (Кулачко-
ва, 1958; Белопольская, 1952). Однако данное определение требует подтверждения.
Во-первых, минимальные показатели длины крючьев метацестод Microsomacanthus
sp. II и взрослых M. microsoma (44-46) перекрываются с максимальной длиной крю-
чьев близкого вида - M. jaegerskioeldi (Fuhrmann, 1913) (Galkin et al., 2006), про-
межуточный хозяин которого пока не известен. Во-вторых, ранее на материале из
Охотского моря был успешно проведён эксперимент по заражению анизогаммари-
ды Eogammarus tiushovi (Derzhavin), явно неспецифичного хозяина, пакетами яиц
M. microsoma (Атрашкевич и др., 2008). Однако естественная инвазия метацестодами
M. microsoma так и не обнаружена ни у анизогаммарид Охотского и Берингова морей,
ни у других исследованных видов бокоплавов из районов обитания обыкновенной
гаги (Регель, Атрашкевич, 2008; Регель, 2008, 2019). Близкие к M. microsoma пара-
метры хоботковых крючьев (48-56) имеет специфичный паразит гаг M. somateriae
Ryjikov, 1965, а его промежуточным хозяином служит амфибореальный вид, распро-
страненный в прибрежных водах Арктики и северной Пацифики, Gammarus setosus
(Регель, Атрашкевич, 2008; Регель, 2019). Видовая принадлежность метацестод
M. somateriae подтверждена экспериментально путём заражения неспецифичного хозя-
ина - тихоокеанской чайки - метацестодами из гаммарусов Чаунской губы Восточно-
Сибирского моря, подготовлен материал для молекулярно-генетических исследова-
ний и публикации. Наконец, ошибочные регистрации метацестод “M. microsoma”
(с крючьями хоботка 60-61) у амфипод Восточного Мурмана (Белопольская, 1952;
Успенская, 1963) были отнесены позднее к виду M. diorchis (Fuhrmann, 1913) (Galkin
et al., 2008).
193
В дальнейшем безусловными подтверждениями (видовой принадлежности) могут
служить успешные эксперименты по заражению дефинитивных хозяев метацестодами
из балянусов либо эксперименты по заражению промежуточных хозяев (балянусов)
яйцами цестод. Применение молекулярно-генетических методов для определения ви-
довой принадлежности метацестод (в нашем случае - из морских промежуточных
хозяев) возможно лишь при наличии половозрелых цестод (от морских птиц) либо
при наличии соответствующих нуклеотидных последовательностей, депонированных
в базе данных ГенБанк NCBI.
Всё это требует дополнительных исследований и продолжения сбора материала из
мест находок в Белом, Баренцевом (преимущественно в его юго-восточной акватории -
Печорском море) и Охотском морях.
БЛАГОДАРНОСТИ
Исследования проведены в ходе выполнения государственного задания по
теме «Таксономическое, морфологическое и экологическое разнообразие гельмин-
тов позвоночных животных Северной Азии» (2017-2021 гг.), № госрегистрации
АААА-А17-117012710031-6.
Выражаю искреннюю благодарность П.П. Стрелкову, к.б.н., доценту кафедры их-
тиологии и гидробиологии СПбГУ, за предоставление материала из Баренцева и Бело-
го морей для настоящей работы. В заключение, благодарю уважаемых рецензентов
и редакторов за конструктивные замечания.
СПИСОК ЛИТЕРАТУРЫ
Атрашкевич Г.И., Орловская О.М., Регель К.В. 2008. Первые сведения о паразитах охотоморской популя-
ции обыкновенной гаги (Somateria mollissima L.). Паразитология в XXI веке - проблемы, методы,
решения. Материалы IV Всероссийского съезда Паразитологического общества Российской Академии
Наук, 25-28 октября 2008, Санкт-Петербург, 1: 35-38. [Atrashkevich G.I., Orlovskaja O.M., Regel K.V.
2008. The first data about the parasites of common eiderʼ (Somateria mollissima L.) population of the
sea of Okhotsk. Proceedings Proceedings of the IV Congress of the Russian Society of Parasitologists -
Russian Academy of Sciences, held 20-25 October 2008 at the Zoological Institute RAS, St. Petersburg
”Parasitology in XXI century - problems, methods, solutions”, 1: 35-37. (In Russian)].
Белопольская М.М. 1952. Паразитофауна морских водоплавающих птиц. Ученые записки Ленинградского
государственного университета. Серия биологических наук 28 (141): 127-180. [Belopolskaja M.M.
1952. Parasite fauna of marine waterfowl. Scientific notes of Leningrad State University. A series of biol.
Sciences, 28 (141): 127-180. (In Russian)].
Белопольская М.М. 1953. Balanus balanoides L. как промежуточный хозяин некоторых паразитических чер-
вей. Доклады Академии Наук СССР, новая серия 91 (2): 437-440. [Belopolskaja M.M. 1953. Balanus
balanoides as intermediate hosts of some parasitic worms. Doklady Akademii Nauk SSSR novaya seriya,
91 (2): 437-440. (In Russian)].
Бианки В.В., Бойко Н.С., Нинбург Е.А., Шкляревич Г.А. 1979. Питание обыкновенной гаги Белого моря.
В кн.: Экология и морфология гаг. М., Наука, 126-170. [Bianki V.V., Boyko Y.C., Ninburg E.A.,
Schklyarevich G.A. 1979. Nutrition of the common eider of the White Sea. In: Ecology and morphology
of eiders. M., Nauka, 126-170. (In Russian)].
194
Гаврило М. В., Стрём Х. 2015. Рацион гаг-гребенушек Somateria spectabilis, линяющих в Печорском море.
Русский орнитологический журнал, 24, экспресс-выпуск 1114: 795-796. Второе издание. Первая
публикация 2005. [Gavrilo M.V., Ström H. 2015. Diet of king eiders Somateria spectabilis molting in
the Pechora Sea. Russian Ornithological Journal, 24, express issue 1114: 795-796. Second edition. First
publication 2005. (In Russian)].
Галактионов К.В., Куклин В.В., Ишкулов Д.Г., Галкин А.К., Марасаев С.Ф., Марасаева Е.Ф., Прокофьев
В.В. 1997. К гельминтофауне птиц побережья и островов Восточного Мурмана (Баренцево море).
В кн.: Экология птиц и тюленей в морях Северо-Запада России. Апатиты, 67-153. [Galaktionov K.V.,
Kuklin V.V., Ishkulov D.G., Galkin A.K., Marasaev S.F., Marasaeva E.F., Prokofiev V.V. 1997. On the
helminth fauna of birds on the coast and islands of Eastern Murman (Barents Sea). In: Ecology of Birds
and Seals in the Seas of the North-West of Russia. Apatity, 67-153. (In Russian)].
Галкин А.К. 1997. Переопределение “Hymenolepis setigera” от гаг мурманского побережья. Паразитология
31 (3): 223-230. [Galkin A.K. 1997. Reidentification of “Hymenolepis setigera” from eider ducks of the
Murman coast. Parazitologiya 31 (3): 223-230. (In Russian)].
Галкин А.К., Галактионов К.В., Марасаев С.Ф. 1999. Находка Microsomacanthus ductilis (Cestoda:
Hymenolepididae) у гаги Земли Франца-Иосифа. Паразитология 33 (2): 113-117. [Galkin A.K.,
Galaktionov K.V., Marasaev S.F. 1999. The occurrence of Microsomacanthus ductilis (Cestoda:
Hymenolepididae) in eider ducks of Franz Joseph Land. Parazitologiya 33 (2): 113-117. (In Russian)].
Галкин А.К., Регель К.В. 2010. Диагностические признаки Microsomacanthus microsoma (Creplin, 1829)
- типового вида рода Microsomacanthus Lopez-Neyra, 1942 - как основа для ревизии рода. Па-
разитология 44 (5): 389-405. [Galkin A.K., Regel K.V. 2010. Diagnostic features of Microsomacanthus
microsoma (Creplin, 1829), type species of the genus Microsomacanthus Lopez-Neyra, 1942, as the base
for the revision of the genus. Parazitologiya 44 (5): 389-405. (In Russian)].
Котельников Г.А. 1971. Типология личиночных форм у цестод семейства гименолепидид. Материалы на-
учных конференций Всесоюзного Общества Гельминтологов, 22: 116-126. [Kotelnikov G.A. 1971.
Typology of larval forms in cestodes of the hymenolepidid family. Materialy k Nauchnoi Konferencii
Vsesoyuznogo Obshchestva Gel’mintologov 22: 116-126. (In Russian)].
Куклина М.М., Куклин В.В. 2019. Гельминты обыкновенной гаги (Somateria mollissima) Восточного Мур-
мана, их влияние на пищеварительную активность и физиологическое состояние хозяина. Доклады
Академии Наук 487 (1): 107-110. [Kuklina M.M., Kuklin V.V. 2019. Helminthes of the common eider
(Somateria mollissima) on the eastern Murman, its impact on the digestive activity and physiological state.
Кулачкова В.Г. 1958. Эколого-фаунистический обзор паразитофауны обыкновенной гаги Кандалакш-
ского залива. Труды Кандалакшского гос. заповедника, вып. 1: 103-160. [Kulachkova V.G. 1958.
Ecological and faunistic review of the parasite fauna of the common eider of the Kandalaksha Bay. Trudy
Kandalakshskogo gosudarstvennogo zapovednika 1: 103-160. (In Russian)].
Кулачкова В.Г. 1979. Гельминты как причина смертности обыкновенной гаги в вершине Кандалакшского
залива. В кн.: Экология и морфология гаг. М., Наука, 119-125. [Kulachkova V.G. 1979. Helminths as
a cause of mortality in the common eider at the top of the Kandalaksha Bay. In: Ecology and morphology
of eiders. Moscow, Nauka, 119-125. (In Russian)].
Максимова А.П. 1976. Новая цестода - Fimbriarioides tadornae sp. n. от пеганки Tadorna tadorna и ее
развитие в промежуточном хозяине. Паразитология 10 (1): 17-24. [Maksimova A.P. 1976. A new
cestode, Fimbriarioides tadornae sp. n., from Tadorna tadorna and its development in the intermediate
host. Parazitologiya 10: 17-24. (In Russian)].
195
Максимова А.П. 1989. Цестоды - гименолепидиды водных птиц Казахстана. Алма-Ата, Наука, 224 с.
[Maksimova A.P. 1989. Cestodes - Hymenolepidids of water birds of Kazakhstan. Alma-Ata, Nauka, 224
pp. (In Russian)].
Мокиевский В.О., Поповкина А.Б., Поярков Н.Д., Цетлин А.Б., Жадан А.Э., Исаченко А.Ю. 2012. Пи-
тание обыкновенной гаги (Somateria mollissima), зимующей в проливе Великая Салма (Канда-
лакшский залив Белого моря). Зоологический журнал 91 (7): 887-896. [Mokievsky V.O., Popovkina
A.B., Poyarkov N.D., Tsetlin A.B., Zhadan A.E., Isachenko A.Yu. 2012. Feeding of the Common Eider
(Somateria mollissima) wintering in the Velikaya Salma Strait (Kandalaksha Bay, White Sea). Zoological
journal 91 (7): 887-896. (In Russian)].
Регель К.В. 2001. Гименолепидиды утиных птиц северо-западной Чукотки (фауна, жизненные циклы, эко-
логия). Автореферат дис
канд. биол. наук. М., 24 с. [Regel K.V. 2001. Hymenolepidids of the anatid
birds of North Eastern Chukotka (fauna, life cycles, ecology). Thesis of Candidate Dissertation. Institute
of Parasitology, Russian Academy of Sciences. Moscow, 24 pp. (In Russian)].
Регель К.В. 2008. К биологии цестод (Hymenolepidata) морских уток и чаек северной части Охотского
моря. Биоразнообразие и экология паразитов наземных и водных ценозов. Материалы междуна-
родной конференции, посвящённой 130-летию со дня рождения акад. К.И. Скрябина, 9-11 декабря,
Москва, 309-312. [Regel K.V. 2008. On the biology of cestodes (Hymenolepidata) of marine ducks and
gulls of the northern part of the Sea of Okhotsk. Biodiversity and ecology of parasites of terrestrial and
water cenoses. The Proceedings of International Symposium dedicated to the 130-th Anniversary of acad.
K.I. Skrjabin (December 9-11, 2008, Moscow), 309-312. (In Russian)].
Регель К.В. 2019. К биологии «морских» видов цестод (Cestoda: Cyclophyllidea) - паразитов гаг и других
нырковых уток в арктическом бассейне и северной Пацифике. Школа по теоретической и морской
паразитологии. VII Всероссийская конференция с международным участием. 9-14 сентября, Севасто-
поль: ФИЦ ИнБЮМ, тезисы докладов, 54. [Regel K.V. To the biology of “marine” species of cestodes
(Cestoda: Cyclophyllidea) - parasites of eiders and other diving ducks in the Arctic Basin and the North
Pacific. School of Theoretical and Marine Parasitology. VII All-Russian conference with international
participation. September 9-14, Sevastopol: FSC InBSM, abstracts, 54. (In Russian)].
Регель К.В., Атрашкевич Г.И. 2008. Роль морских амфипод беринговоморского побережья Чукотки в жиз-
ненных циклах цестод рода Microsomacanthus. Первые итоги исследования. Паразитология 42 (1):
31-40. [Regel K.V., Atrashkevich G.I. 2008. The role of marine amphipods in the life cycles of the cestode
genus Microsomacanthus at Bering sea coast of Chukchi peninsula. First results of the investigation.
Parazitologiya 42 (1): 31-40. (In Russian)].
Спасская Л.П. 1966. Цестоды птиц СССР. Гименолепидиды. М.: Наука, 698 с. [Spasskaya L.P. 1966. Cestodes
of birds of the USSR, Hymenolepidids. Moscow, Nauka, 697 pp. (In Russian)].
Спасский А.А., Юрпалова Н.М. 1966. Цестоды рода Microsomacanthus (Hymenolepididae) от гусиных птиц
Чукотки // Паразиты животных и растений. Вып. 2. Кишинев: Картя Молдовеняскэ, 15-49. [Spassky
A.A., Jurpalova N.M. 1966. Cestodes of the genus Microsomacanthus (Hymenolepididae) from anserine
birds of Chukotka. Parazity Zhivotn. i Rast., Kishinev, Kartya Moldonenyaske, (2): 15-49 (In Russian)].
Толкачева Л.М. 1966. К цестодофауне гусиных птиц низовья Енисея и Норильских озер. Тр. ГЕЛАН, 17:
211-239.
[Tolkacheva L.M. 1966. The cestode fauna of anserine birds of the lower Yenisei and Noril
Lake. Trudy Gel’mint. Lab. AN SSSR, 17: 211-239 (In Russian)].
Татаринкова И.П., Горлас М.В., Письменная Т.И. 1979. О весеннем питании гаги на Айновых островах.
В кн.: Экология и морфология гаг. М., Наука, 171-178. [Tatarinkova I.P., Gorlas M.V., Pismennaya T.I.
1979. About the spring feeding of the eider on the Ainov Islands. In: Ecology and morphology of eiders.
M., Nauka, 171-178. (In Russian)].
196
Успенская А.В. 1963. Паразитофауна бентических ракообразных Баренцева моря. Москва - Ленинград, 128
с. [Uspenskaya A.V. 1963. Parasite fauna of benthic crustaceans in the Barents Sea. Moscow-Leningrad,
128 pp. (In Russian)].
Шкляревич Г.А., Фомина О.В. 2012. Особенности формирования паразитофауны гаги обыкновен-
ной (Somateria mollissima L.) Белого моря. Труды Карельского научного центра РАН 1: 86-93.
[Schklyarevich G.A., Fomina O.V. 2012. Formation patterns of the parasite fauna of common eider
(Somateria mollissima L.) in the White sea area Proceedings of the Karelian Scientific Center RAS 1:
86-93. (In Russian)].
Czaplinski B., Vaucher C. 1994. Family Hymenolepididae Ariola, 1899. In: Khalil L.F., Jones A., Bray R.A. (Eds)
Keys to the cestode parasites of vertebrates. Wallingford, U.K: CAB International, 595-663.
Fuhrmann O. 1913. Nordische Vogelcestoden aus dem Museum von Göteborg. Meddelanden fran Göteborgs
Musei Zoologiska 1: 1-41.
Galkin A.K., Regel K.V., Skirnisson K. 2005. Study of Somateria mollissima parasite fauna: species of the genus
Microsomacanthus (Cestoda: Hymenolepididae). Proc. of the Ist Symposium of the Scandinavian-Baltic
Society for Parasitology, Vilnius, Lithuania 26-29 May. Bulletin of the Scandinavian-Baltic Society for
Parasitology 12-13: 37-38.
Galkin A.K., Regel K.V., Mariaux J. 2006. Redescription of Hymenolepis jaegerskioeldi Fuhrmann, 1913 (Cestoda,
Hymenolepididae). Systematic Parasitology 64 (1): 1-11. DOI:10.1007/s11230-005-9020-8
Galkin A.K., Mariaux J., Regel K.V., Skirnisson K. 2008. Redescription and new data on Microsomacanthus
diorchis Fuhrmann, 1913 (Cestoda, Hymenolepididae). Systematic Parasitology 70 (2): 119-130.
DOI:10.1007/s11230-008-9134-x
Jarecka L. 1958. Plankton crustaceans in the life cycle of tapeworms occurring at Druzno Lake. Acta Parasitologica
Polonica 6: 65-109.
Jarecka L. 1961. Morphological adaptations of tapeworm eggs and their importance in the life cycles. Acta
Parasitologica Polonica 9 (26): 409-426.
McDonald M.E. 1969. Catalogue of helminth of waterfowl (Anatidae). (Bureau of Sport Fisheries and Wildlife).
Special Scientific Report - Wildlife, № 126. Washington, 692 pp.
Ouspenskaia (Uspenskaja) A.V. 1960. Parasitofaune des crustacés benthiques de la mer de Barents. Annales de
Parasitologie Humaine et Comparee 35 (3): 221-242.
Schiller E.L. 1955. Studies on the Helminth Fauna of Alaska. XXIII. Some Cestode Parasites of eider ducks.
Journal Parasitology 41 (1): 79-87.
Skirnisson K. 2016. Association of helminth infections and food consumption in common eiders Somateria
mollissima in Iceland. Journal of Sea Research 113: 132-141. DOI:10.1016/j.seares.2015.05.005
Vasileva G.P., Redón S., Amat F., Nikolov P.N., Sánchez M.I., Lenormand T., Georgiev B.B. 2009. Records of
cysticercoids of Fimbriarioides tadornae Maksimova, 1976 and Branchiopodataenia gvozdevi (Maksimova,
1988) (Cyclophyllidea, Hymenolepididae) from brine shrimps at the Mediterranean coasts of Spain and
France, with a key to cestodes from Artemia spp. from the Western Mediterranean. Acta Parasitologica
54 (2): 143-150. DOI:10.2478/s11686-009-0025-3
Williams I.C., Ellis C., Cross A.S. 1981. The Occurrence of the Cysticercoids of Acanthocirrus retirostris (Krabbe,
1869) Baer, 1956 (Cyclophyllidea, Dilepididae) and the Metacercariae of Maritrema gratiosum Nicoll, 1907
(Digenea, Microphallidae) in the Barnacle, Balanus balanoides (L.), on the Coast of Yorkshire, England.
Zeitschrift für Parasitenkunde 66: 155-162.
Wiśniewski W.L. 1958. Characterization of the parasitofauna of an eutrophic lake [Parasitofauna of the
biocenosis of Drużno lake - part. I]. Acta Parasitologica Polonica 6: 1-64.
197
SEMIBALANUS BALANOIDES (L.) AND BALANUS CRENATUS BRUGUIÈRE
(BALANIDAE) ARE INTERMEDIATE HOSTS OF FIMBRIARIOIDES INTERMEDIA
(FUHRMANN, 1913) AND TWO SPECIES OF THE GENUS MICROSOMACANTHUS
(CESTODA, HYMENOLEPIDAE), PARASITES OF SEA DUCKS
FROM THE ATLANTIC SECTOR OF THE ARCTIC AND NORTHERN PACIFIC
K. V. Regel
Keywords: metacestode, Fimbriarioides intermedia, Microsomacanthus, barnacles,
Balanidae, Balanus crenatus, Semibalanus balanoides, sea ducks, Somateria mollissima,
S. spectabilis, Clangula hyemalis
SUMMARY
Metacestode infestation of Semibalanus balanoides and Balanus crenatus, collected in the Barents
and White Seas and in the northern part of the Sea of Okhotsk in 2020 and 2021, correspondingly,
has been studied. 313 S. balanoides from Mogilnaya Bay of Kildin Island (Barents Sea) and isolated
mature wrinkled barnacles B. crenatus, 2 and 4 specimens from the Pechora Sea and Kandalaksha
Bay of the White Sea, respectively, were examined in 2020. Metacestodes Fimbriarioides intermedia
(Fuhrmann, 1913) (Cyclophyllidea, Hymenolepididae) were found in 1.0 ± 0.6% of S. balanoides
in the Barents Sea with an invasion intensity (I I) of 2-5 specimens, and in one of two B. crenatus
from the Pechora Sea (I I = 15). For the first time in both B. crenatus from the Pechora Sea, taken
from the valves of the mussel Mytilus edulis, metacestodes Microsomacanthus sp. I (I I = 13 and 20)
with proboscis hooks 38-41 (39.4 ± 0.1) µm long, blades of 9.5-11 (10.7 ± 0.1) µm were obtained.
One of four B. crenatus from the Kandalaksha Bay was infected with another Microsomacanthus sp.
II (I I = 19) with proboscis hooks 44.0-49.5 (45.7 ± 0.5) µm long and blades - 14.0-16.0 (14.8 ±
0.07) µm. 362 S. balanoides were collected and dissected in Gizhiginskaya Bay of the northern part
of the Sea of Okhotsk in 2021, of which 8.0 ± 1.4% were infected with F. intermedia metacestodes
(I I = 1-19). Study results of the infestation of S. balanoides on the Koni-Pyagin coast of the Sea of
Okhotsk (according to the collections of 2006-2007) were supplemented and clarified. Description
of metacestodes and the taxonomic affiliation of cysticercoids Microsomacanthus spp. are given.
198