Письма в ЖЭТФ, том 115, вып. 3, с. 144 - 149
© 2022 г. 10 февраля
Коллективный эффект трансформации сетки водородных связей
на начальном этапе роста гидрата метана
В.Р.Белослудов+∗1), К.В.Гец+∗, Р.К.Жданов+∗, Ю.Ю.Божко+∗, Р.В.Белослудов×, Л.-Дж.Чен◦2)
+Институт неорганической химии им. А. В. Николаева Сибирского отделения РАН, 630090 Новосибирск, Россия
∗Новосибирский государственный университет, 630090 Новосибирск, Россия
×Institute for Materials Research, Tohoku University, 980-8577 Sendai, Japan
◦Department of Chemical Engineering, National Taiwan University, 10617 Taipei, Taiwan
Поступила в редакцию 7 декабря 2021 г.
После переработки 11 декабря 2021 г.
Принята к публикации 11 декабря 2021 г.
Используя методы молекулярной динамики, было проведено исследование перестройки динамиче-
ской сетки водородных связей жидкой воды в кристаллическую сетку водородных связей гидрата метана
по ходу его формирования и роста. Для изучения природы нуклеации исследовались временные зави-
симости степени “кристалличности” ближайшего окружения всех молекул воды, скорость упорядочения
сетки водородных связей и связь этих параметров со скоростью роста гидрата метана. Изучено влияние
на эти параметры наличия ионов морской соли и гидратной затравки. Были созданы системы с пол-
ностью размешанным газом, т.е. с минимальным индукционным временем, и показано, что нуклеация
газовых гидратов может проходить одновременно во всем объеме раствора, что в свою очередь позволяет
говорить о коллективном эффекте формирования гидратов из жидкого раствора.
DOI: 10.31857/S1234567822030028
Введение. За последние несколько десятилетий
(КС-I), кубическая структура II (КС-II) и гексаго-
проблема доступа к чистой воде стала более актуаль-
нальная структура III (ГС-III).
ной во многих регионах нашей планеты. В настоящее
Ионы солей, которые присутствуют в морской во-
время единственным промышленно применимым ре-
де, (Na+, Cl-, Mg2+, SO2-4 Ca2+, K+), обычно ис-
шением является опреснение морской воды. Для это-
пользуются как ингибиторы образования гидратов,
го применяется целый набор различных методик,
а значит, влияют на кинетику их образования. По-
среди которых стоит отдельно выделить опреснение
нимание механизмов гидратообразования, особенно
гидратным методом, который очень близок к класси-
в присутствии различных ингибирующих добавок,
ческому опреснению замораживанием [1]. Этот метод
является ключевым фактором для разработки про-
основан на том, что при формировании кристалли-
стых способов синтеза гидратов. Экспериментальное
ческой фазы ионы соли остаются в растворе воды.
изучение кинетики крайне затруднено из-за требова-
Однако остаются не до конца решенными проблема
ний к нано- или даже фемто-секундному временно-
разделения гидратной фазы и морской воды после
му разрешению для непосредственного наблюдения
формирования гидрата и проблема медленной кине-
процессов образования гидратов [3]. В то же время
тикой образования [2].
методы молекулярной динамики являются наиболее
Газовые гидраты - это соединения включения, ко-
подходящими теоретическими методами для изуче-
торые образуются помещением молекул-гостей, в по-
ния данных процессов, хоть и по-прежнему являются
лости кристаллического каркаса сформированными
требовательными к вычислительным мощностям [4].
молекулами воды [3]. Тип образуемого гидрата за-
Для понимания процесса формирования гидра-
висит от газа или смеси газов, участвующих в фор-
тов и динамики их роста необходимо понимать ме-
мировании. Наиболее часто встречающимися струк-
ханизм нуклеации, который до сих пор является не
турами гидратов являются: кубическая структура I
до конца понятым из-за стохастичности процесса. В
настоящее время имеются две основные теории нук-
леации: гомогенная нуклеация и гетерогенная нукле-
1)e-mail: gets@niic.nsc.ru
ация. В случае гомогенной нуклеации формирование
2)L.-J. Chen.
новой фазы происходит непосредственно из исходной
144
Письма в ЖЭТФ том 115 вып. 3 - 4
2022
Коллективный эффект трансформации сетки водородных связей...
145
фазы после формирования так называемого крити-
Детали вычислений. В данной работе нами бы-
ческого зародыша, после чего происходит рост гид-
ла использована комбинация методов молекулярной
ратной фазы. Стоит отметить, что данный процесс
динамики, реализованной в пакете LAMMPS [22], и
является стохастическим по своей натуре. В реаль-
набор собственных программ для структурного ана-
ных системах крайне затруднительно наблюдать го-
лиза сетки водородных связей молекул воды.
могенную нуклеацию из-за наличия примесей и мно-
Моделирование проводилось на наборе систем
жества побочных факторов, из-за которых реали-
различного размера и состава. Первая группа систем
зуется гетерогенный вариант нуклеации [5]. Гетеро-
состояла из 1200 молекул воды и 104 молекул метана,
генная нуклеация происходит в присутствии третьей
такое количество метана позволяет перевести в гид-
фазы, например, примеси или границы раздела фаз.
рат половину молекул воды. При этом были созда-
С энергетической точки зрения гетерогенный путь
ны варианты этой системы с ионами соли морской
формирования гидрата более выгоден, нежели фор-
воды Na+ и Cl- (из-за очень малой концентрации
мирование из чистой фазы, что значительно увели-
остальных ионов, содержащихся в морской воде, они
чивает скорость нуклеации [6]. К сожалению, данный
не учитывались в модели) с концентрацией 1 пара
механизм слабо изучен из-за своей сложности [7]. Из-
ионов на 100 молекул воды, а также системы с гид-
за того что до сих пор нет единого мнения в пользу
ратной затравкой, представляющей большую и ма-
одной или другой теории, исследования по изучению
лую полости структуры КС-I, соединенные вместе, и
нуклеации гидратов продолжаются [8-11].
без гидратной затравки.
В течение последних десятилетий было проведе-
Для описания молекул воды был выбран четы-
но множество работ по молекулярно-динамическому
рехточечный потенциал TIP4P/Ice [23]. Данный по-
моделированию, которые позволили на качествен-
тенциал хорошо подходит для описания фазовых пе-
ном и количественном уровне изучить начальные
реходов между различными фазами воды. Молекулы
стадии образования гидрата под действием высоко-
метана описывались как сферические незаряженные
го избыточного давления или низкой температуры
частицы с потенциалом Ван дер Ваальса [24]. Па-
при переохлаждении [12, 13]. Ключевым компонен-
раметры потенциала для Na+ и Cl- были взяты из
том этих исследований является расчет параметров
работ [25, 26].
порядка [14, 15], которые являются количественной
Начальные структуры были созданы случайным
мерой степени упорядоченности в системе и исполь-
распределением требуемого количества молекул
зуются для оценки прогресса и механизмов образо-
нужного типа, после чего производилась оптимиза-
вания гидратов, а также других ключевых свойств.
ция структуры, чтобы ликвидировать перекрытие
Процессы образования гидратов связаны с упоря-
молекул. При наличии гидратной затравки, затрав-
дочением как молекул гостей, так и молекул воды
ка рассматривалась как твердое тело, т.е. положение
[16], которые формируют сетку водородных связей.
молекул друг относительно друга было фиксирован-
Ее роль важна для понимания процесса образования
ным. Давление и температура при моделировании
гидратов, так как сетка водородных связей опреде-
контролировалось термостатом и баростатом Нозе-
ляет локальные свойства воды, например, структур-
Гувера [27,28]. Моделирование систем происходило
ные неоднородности [17], макроскопические свойства
при давлении
50
и
1000
бар и фиксированной
воды, например, вязкость [18], термодинамические
температуре 270 K. Шаг моделирования составил
свойства гидратов [19 и библиография в ней] и про-
1 фс.
тонная проводимость [20,21].
Молекулярная структура растворов, координаты
В данной работе мы постарались реализовать ге-
атомов и молекул, а также взаимная ориентация мо-
терогенный путь нуклеации. При этом основой це-
лекул воды, динамически изменялись во времени.
лью было изучить процесс перехода сетки водород-
В данной работе сетка водородных связей рассмат-
ных связей жидкой воды в стабильную сетку водо-
ривается как динамическая [17], т.е. объединяющая
родных связей гидрата. Для этого мы использовали
флуктуирующие водородные связи между соседними
методы молекулярного моделирования и набор соб-
молекулами воды, существование, образование и рас-
ственных программ для постобработки и анализа по-
пад которых в каждый момент времени определяется
лученных данных. Исследование проводилось в мо-
геометрическими критериями: расстояние кислород-
дельных системах “вода + метан” и “вода + метан
кислород dO-O < 3.2Å, а угол взаимной ориентации
+ ионы соли морской воды”, а также “вода + метан
αHO-O < 30◦ ([29], число связей с 30◦ < αHO-O < 40◦
+ затравка гидрата” и “вода + метан + ионы соли
незначительно). Данный критерий применялся для
морской воды + затравка гидрата”.
анализа мгновенных конфигураций и при поиске ма-
Письма в ЖЭТФ том 115 вып. 3 - 4
2022
146
В.Р.Белослудов, К.В.Гец, Р.К.Жданов и др.
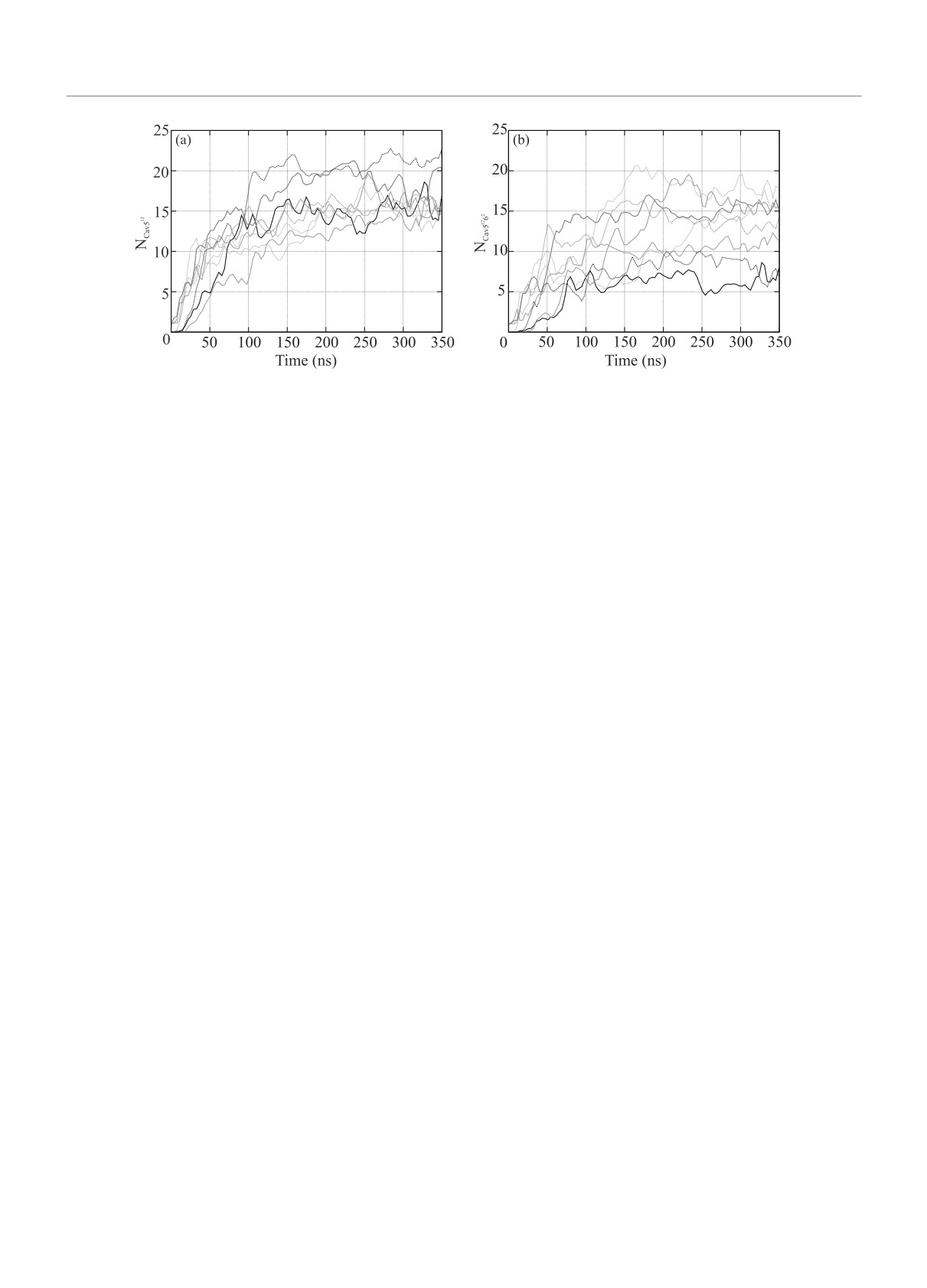
Рис. 1. (Цветной онлайн) Число малых 512 (a) и больших 51262 (b) полостей, содержащих метан, в зависимости от
времени моделирования. Черному цвету соответствуют данные для системы “вода + метан”, оранжевому - “вода +
+ метан + затравка гидрата”, голубому - “вода + метан + ионы соли морской воды”, зеленому - “вода + метан + ионы
соли морской воды + затравка гидрата”. Сплошными линиями показаны данные при давлении 50 бар, пунктирными -
при 1000 бар
лых и больших полостей гидрата КС-I. Число по-
дит раньше больших, что можно объяснить их боль-
лостей и средние значения описанных ниже харак-
шей энергетической выгодностью, при этом образо-
теристик сетки водородных связей рассчитывались
вание больших полостей происходит только в непо-
для отдельных молекулярных конфигураций, полу-
средственной близости к малым полостям, так как
чаемых каждые 100 пс. Важно, что при анализе сет-
при их образовании участвуют грани малых поло-
ки водородных связей учитывались только связи, об-
стей. Наличие гидратной затравки упрощает образо-
разующиеся между молекулами воды.
вание больших полотей. Наличие ионов соли не су-
Для анализа структуры воды использовались па-
щественно сказывается на скорости роста или коли-
раметры F3 [14] и F4 [15]. Параметр F3 характеризу-
честве полостей. В гидрате структуры КС-I соотно-
ет коэффициент отличия локальной структуры мо-
шение числа малых полостей к большим составля-
лекулы воды от идеальной тетраэдричности и равен
ет 2 к 6, однако в нашем случае это отношение ока-
0 в случае идеального кристалла и ≈0.1 для случая
зывается нарушенным из-за небольшого количества
жидкой воды и рассчитывается как среднее по всем
молекул метана в системе. Можно видеть, что чис-
молекулам воды значение F3 = 〈Σi(| cos(α)| cos(α) +
ло полостей для всех систем выходит на постоянное
+ cos2(109.47◦))2〉, где α - угол кислород-кислород-
значение за 150-200 нс.
кислород между ближайшими молекулами в центре
Благодаря выбранному методу получения на-
с рассматриваемой молекулой воды, а суммирование
чальных структур удалось снизить до незначитель-
ведется по 6 независимым углам, которые образует
ных величин индукционное время, которое в других
молекула с четырьмя соседними молекулами, когда
работах по молекулярному моделированию может
выполняется правило льда. Идеальный тетраэдриче-
достигать микросекунд [10]. В данной работе созда-
ский угол равен 109.47◦. Параметр F4 отражает сред-
ется конфигурация с достаточным для начала про-
нее значение величины торсионных углов между все-
цесса роста гидрата содержанием метана в раство-
ми соседними молекулами воды: F4 = 〈cos(3ϕ)〉, где
ре, что является необходимым условием гидратооб-
ϕ - торсионный угол между ближайшими молекула-
разования. По предварительным данным для фреона
ми. Для гидратов характерным значением F4 явля-
14, пропана или изо-бутана, данный эффект способен
ется ≈ 0.7, для жидкой фазы воды ≈ 0 и для льда
проявлять себя и в других гидратных системах.
≈ -0.3.
Для анализа пространственной ориентации мо-
Результаты и обсуждение. На рисунке 1a и b
лекул воды и их относительного расположения бы-
показана динамика изменения числа малых 512 и
ли использованы часто используемые параметры F3
больших 51262 полостей, заполненных молекулами
и F4. Зависимость от времени параметра F3 при-
метана гидрата КС-I, образующихся в системе со-
ведена на рис.2a. Из рисунка видно упорядочение
ответственно. В системах, не содержащих гидрат-
структур растворов, о чем свидетельствует снижение
ные затравки, образование малых полостей происхо-
значения параметра F3 со временем. При давлении
Письма в ЖЭТФ том 115 вып. 3 - 4
2022
Коллективный эффект трансформации сетки водородных связей...
147
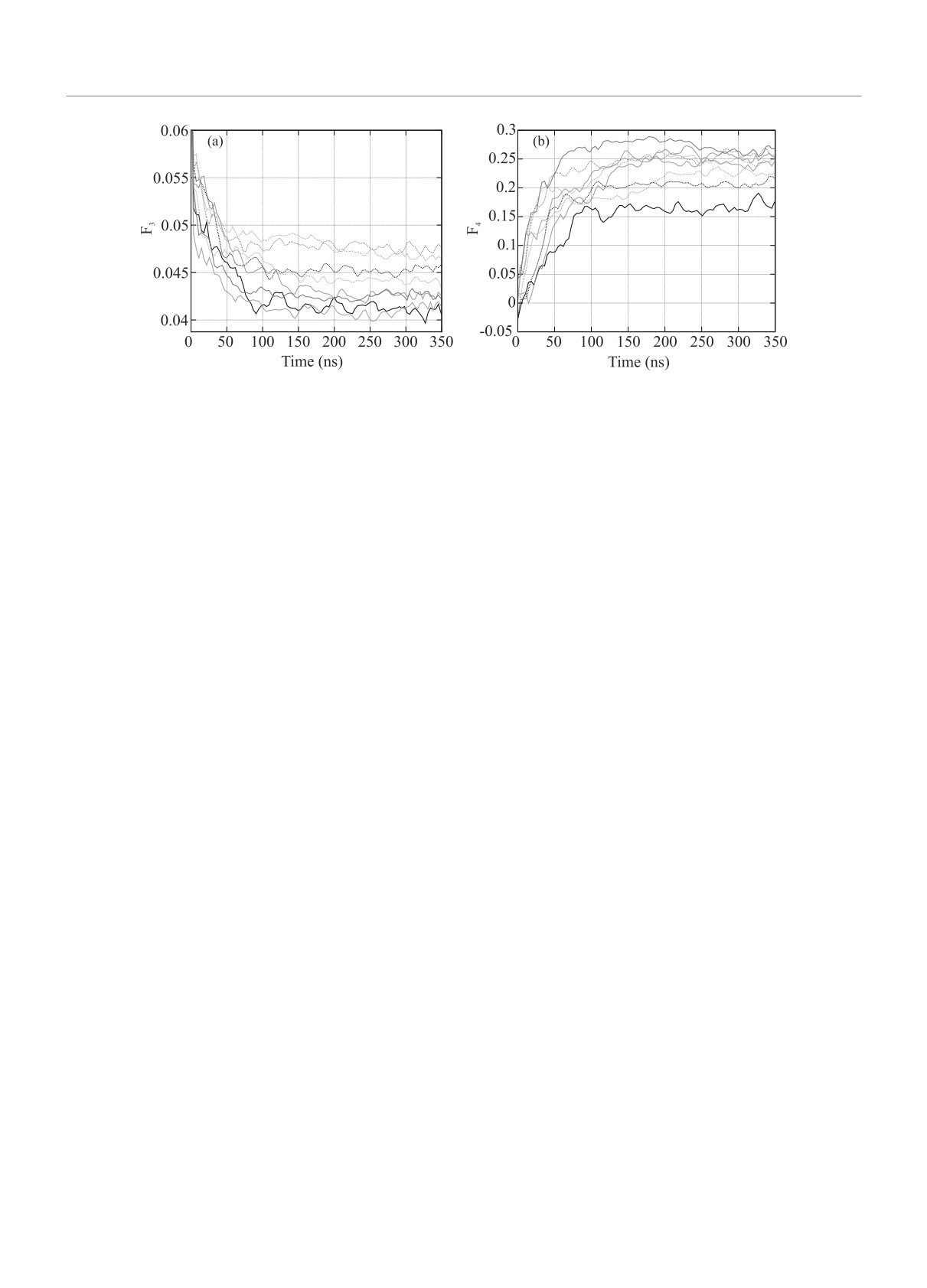
Рис. 2. (Цветной онлайн) Зависимость параметров F3 (a) и F4 (b) от времени моделирования. Черному цвету соответ-
ствуют данные для системы “вода + метан”, оранжевому - “вода + метан + затравка гидрата”, голубому - “вода +
+ метан + ионы соли морской воды”, зеленому - “вода + метан + ионы соли морской воды + затравка гидрата”.
Сплошными линиями показаны данные при давлении 50
бар, пунктирными - при 1000 бар
50 бар упорядочение по тетраэдрическому окруже-
Видно, что параметры F3 и F4 выходят на на-
нию молекул воды идет быстрее, чем при 1000 бар,
сыщение за ∼ 100 нс, что значительно отличается от
что обусловлено больше подвижностью молекул во-
аналогичного времени для зависимости числа малых
ды при меньшем давлении. Аналогично можно ви-
и больших полостей гидрата. Это свидетельствует о
деть, что наличие соли в воде приводит к ослабле-
том, что упорядочение структуры сетки водородных
нию тетраэдричности ближнего окружения молекул
связей предшествует видимому росту самого гидра-
воды в сетке водородных связей, что подтверждает-
та. Другими словами, можно сказать, что процесс
ся данными рентгеновского рассеяния и моделирова-
роста гидрата захватывает куда больший объем си-
ния [30], где наблюдалось снижение числа водород-
стемы, чем объем, занимаемый формируемыми по-
ных связей в ближнем порядке в растворе Na+Cl- по
лостями.
сравнению с чистой водой. Выход зависимостей на
На рисунке 3 приведено число молекул, параметр
постоянное значение и колебание вокруг этого зна-
F3 для которых меньше 0.025 (наиболее близких к
чения определяется тем, что почти все молекулы ме-
кристаллическому веществу для водных фаз), нор-
тана, изначально присутствовавшие в растворе, пе-
мированное на общее число молекул воды, а также
реходят в фазу гидрата.
число водородных связей, соединяющих эти молеку-
Зависимость от времени параметра F4 приведена
лы. Рост числа таких молекул свидетельствует об
на рис. 2b. Можно видеть, что наличие затравки гид-
общем упорядочении сетки водородных связей. Вид-
рата приводит к более ярко выраженному межмоле-
но, что число тетраэдрически упорядоченных моле-
кулярному упорядочению, независимо от давления,
кул выходит на постоянное значение также в тече-
что свидетельствует о постепенном образовании гид-
ние первых 100 нс, как и для параметров F3 и F4.
рата. Сравнение систем без затравки “вода + метан”
К этому же моменту наблюдается наибольшая свя-
и “вода + метан + ионы морской соли” показывает,
занность водородными связями этих молекул, чис-
что наличие соли делает взаимную ориентацию мо-
ло которых достигает 40-45 % в системах с затрав-
лекул воды более свойственной гидрату, что объяс-
ками и ∼ 35 % в системах без завтраки. При этом
няется понижением подвижности молекул воды, ко-
степень связности в первые 50 нс достаточно низ-
торые взаимодействуют с ионами Cl- [30]. Как и для
кая, особенно в структурах без затравки, что сви-
параметра F3, здесь наблюдается рост гидрата, в ко-
детельствует об делокализации таких молекул и от-
торый входят почти все молекулы метана, изначаль-
сутствии одного общего центра нуклеации. Высо-
но присутствовавшие в растворе. Отличие получен-
кая степень связанности показывает, что большин-
ного значения F4 ≈ 0.2-0.25 от идеального значения
ство этих молекул образуют твердую фазу. Таким
0.7 для гидрата обусловлено тем, что в гидрат мо-
образом, можно видеть, что гидрат продолжает об-
жет перейти только половина молекул воды, а также
разовываться, когда сетка водородных связей уже
существенным вкладом образующих гидрат молекул
трансформировалась и соответствует твердой фазе.
воды, которые находятся на поверхности гидрата.
При этом может образовываться “аморфная” струк-
Письма в ЖЭТФ том 115 вып. 3 - 4
2022
148
В.Р.Белослудов, К.В.Гец, Р.К.Жданов и др.
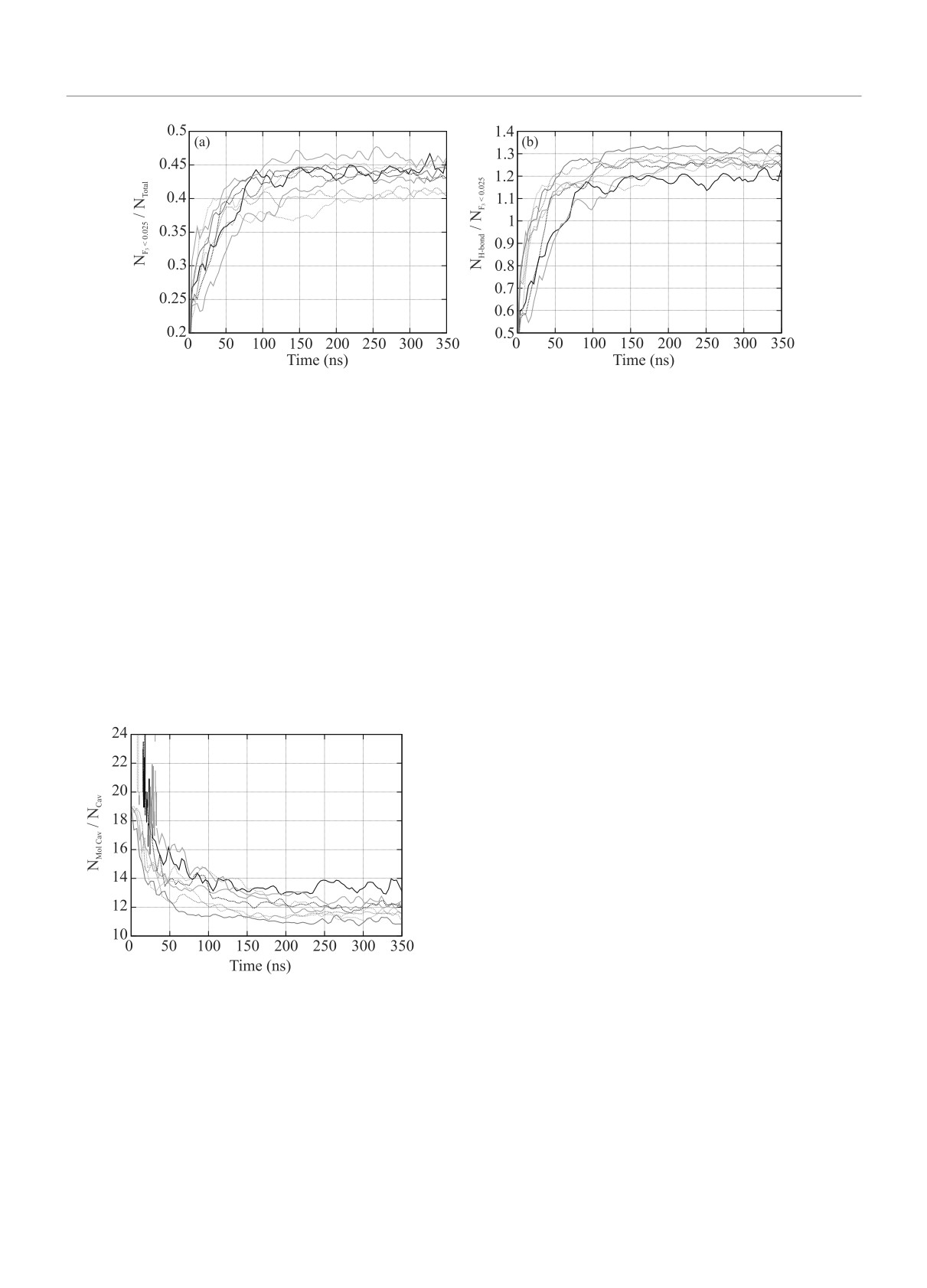
Рис. 3. (Цветной онлайн) Доля молекул, параметр F3 которых ниже 0.025, от общего числа молекул (a) и нормиро-
ванного на число молекул с F3 < 0.025 числа водородных связей, связывающих эти молекулы (b) в зависимости от
времени. Черному цвету соответствуют данные для системы “вода + метан”, оранжевому - “вода + метан + затравка
гидрата”, голубому - “вода + метан + ионы соли морской воды”, зеленому - “вода + метан + ионы соли морской воды
+ затравка гидрата”. Сплошными линиями показаны данные при давлении 50 бар, пунктирными - при 1000 бар
тура гидрата, переходящая со временем в кристал-
личного типа к числу полостей. Видно, что если на
лическую.
малых временах полости не соединены друг с дру-
Объемный переход сетки водородных связей во-
гом (имеют меньше общих молекул, чем в одной пя-
ды в сетку гидрата в случае равномерного началь-
тиугольной или шестиугольной грани), то со време-
ного распределения газа можно наблюдать в виде
нем они начинают соприкасаться и заполняют собой
формирования малых и больших полостей гидрат-
большую часть объема модельной ячейки, что приво-
ной структуры по всему модельному объему, а не
дит к снижению соотношения, которое в случае иде-
только в какой-то определенной выделенной области.
ального гидрата равно 5.75. При этом в отсутствие
На рисунке 4 приведена временная зависимость со-
затравки в начальные моменты времени чаще обра-
отношения числа молекул, образующих полости раз-
зуются большие полости 51262, которые сформирова-
ны 24 молекулами воды, тогда как вокруг затравки
начинают с большей скоростью формироваться ма-
лые полости, образованные 20 молекулами воды.
Заключение. В представленной работе были ис-
следованы методом молекулярной динамики систе-
мы “вода + метан” и “вода + метан + ионы соли мор-
ской воды” при различных давлениях. Было показа-
но, что при создании насыщенного газом раствора
можно добиться значительного сокращения индук-
ционного времени и наблюдать быстрый рост гидрат-
ной фазы из полученного раствора. При этом рост
гидрата происходил во всем объеме сразу без явной
локализации центров нуклеации. Более того, было
показано, что перестроение сетки водородных свя-
Рис. 4. (Цветной онлайн) Число молекул, образующих
зей начинается и заканчивается раньше, чем проис-
полости различного типа, нормированное на число по-
ходит визуально обнаруживаемое выстраивание мо-
лостей, в зависимости от времени моделирования. Чер-
лекул воды в кристаллическую структуру гидрата.
ному цвету соответствуют данные для системы “вода +
Наличие затравки способствует более высокой ско-
+ метан”, оранжевому - “вода + метан + затравка гид-
рости гидратообразования даже в условиях полного
рата”, голубому - “вода + метан + ионы соли морской
“перемешивания” метана в воде. Присутствие ионов
воды”, зеленому - “вода + метан + ионы соли морской
морской соли не оказывает существенного влияния
воды + затравка гидрата”. Сплошными линиями пока-
на кинетику гидратообразования, но оказывает вли-
заны данные при давлении 50 бар, пунктирными - при
яние на геометрию ближнего порядка молекул воды.
1000 бар
Письма в ЖЭТФ том 115 вып. 3 - 4
2022
Коллективный эффект трансформации сетки водородных связей...
149
Исследование выполнено при финансовой под-
13.
G. C. Sosso, J. Chen, S. J. Cox, M. Fitzner, P. Pedevilla,
держке Российского фонда фундаментальных иссле-
A. Zen, and A. Michaelides, Chem. Rev. 116, 7078?7116
дований и МНТ в рамках совместного научного про-
(2016).
екта # 21-52-52001 (номер проекта в Тайване MOST
14.
L. A. Baez and P. Clancy, Ann. N. Y. Acad. Sci. 715(1),
110-2923-E-002-008-MY3). Мы благодарим команду
177 (1994).
Центра Вычислительного Материаловедения Инсти-
15.
P. M. Rodger, T. R. Forester, and W. Smith, Fluid Ph.
тута Исследования Материалов в Университете Тох-
Equilibria 116(1-2), 326 (1996).
оку (проект # 2012SC0504) за постоянную поддерж-
16.
P. M. Rodger, Ann. N. Y. Acad. Sci. 912(1), 474 (2000).
ку в проведении расчетов на суперкомпьютере.
17.
V. Belosludov, K. Gets, R. Zhdanov, V. Malinovsky,
Y. Bozhko, R. Belosludov, N. Surovtsev, O. Subbotin,
and Y. Kawazoe, Sci. Rep. 10, 7323 (2020).
1. C. Xu, X. Li, K. Yan, X. Ruan, Z. Chen, and Z. Xia,
18.
V. K. Malinovsky, R. K. Zhdanov, K. V. Gets,
Chinese J. Chem. Eng. 27(9), 1998 (2019).
V. R. Belosludov, Y.Y. Bozhko, V. A. Zykova, and
2. E. D. Sloan and C. A. Koh, Clathrate Hydrates of
N. V. Surovtsev, JETP Lett. 102(11), 732 (2015).
Natural Gases, Taylor & Francis Group: Boca Raton
19.
R. K. Zhdanov, V. R. Belosludov, Y. Y. Bozhko,
(2008).
O. S. Subbotin, K. V. Gets, and R.V. Belosludov, JETP
3. D. Bai, Z. Wu, C. Lin, and D. Zhou, Fluid Ph. Equilibria
Lett. 108(12), 806 (2018).
487, 76 (2019).
20.
M. I. Ryzhkin, I. A. Ryzhkin, A. M. Kashin, and
4. S. Liang, K. W. Hall, A. Laaksonen, Z. Zhang, and
V. V. Sinitsyn, JETP Lett. 112(8), 498 (2020).
P. G. Kusalik, Phil. Trans. R. Soc. A 377, 20180167
(2019).
21.
I. A. Ryzhkin and M. I. Ryzhkin, JETP Lett. 113(7),
5. D. Kashchiev and A. Firoozabadi, J. Crystal Growth
461 (2021).
243(3-4), 476 (2002).
22.
S. Plimpton, J. Comput. Phys. 117, 1 (1995).
6. L. Jensen, K. Thomsen, and N. von Solms, Chem. Eng.
23.
J. L. F. Abascal, E. Sanz, R. Garcia Fernández, and
Sci. 63(12), 3069 (2008).
C. Vega, J. Chem. Phys. 122, 234511 (2005).
7. P. Warrier, M. N. Khan, V. Srivastava, C. M. Maupin,
24.
M. G. Martin and J. I. Siepmann, J. Phys. Chem. B 102,
and C. A. Koh, J. Chem. Phys. 145(21), 211705 (2016).
2569 (1998).
8. C. A. Koh, J. L. Savidge, and C. C. Tang, J. Phys. Chem.
25.
H. Tanaka, J. Chem. Phys. 101(12), 10833 (1994).
100(16), 6412 (1996).
26.
R. T. Cygan, J. J. Liang, and A.G. Kalinichev, J. Phys.
9. T. Uchida, S. Takeya, L. Wilson, C. A. Tulk,
Chem. B 108(4), 1255 (2004).
J. A. Ripmeester, J. Nagao, T. Ebinuma, and H. Narita,
27.
S. Nosé, Mol. Phys. 52, 255 (1984).
Can. J. Phys. 81(1-2), 351 (2003).
28.
W. G. Hoover, Phys. Rev. A 31(3), 1695 (1985).
10. M. R. Walsh, C. A. Koh, E. D. Sloan, A. K. Sum, and
D. T. Wu, Science 326(5956), 1095 (2009).
29.
R. Kumar, J. R. Schmidt, and J. L. Skinner, J. Chem.
Phys. 126(20), 05B611 (2007).
11. C. Moon, R. Hawtin, and P. M. Rodger, Faraday Discuss
136, 367 (2007).
30.
G. V. Bondarenko, Y. E. Gorbaty, A. V. Okhulkov, and
12. M. Khurana, Z. Yin, and P. Linga, ACS Sustain. Chem.
A. G. Kalinichev, J. Phys. Chem. A 110(11),
4042
Eng. 5, 11176 (2017).
(2006).
Письма в ЖЭТФ том 115 вып. 3 - 4
2022