Письма в ЖЭТФ, том 116, вып. 5, с. 330 - 337
© 2022 г. 10 сентября
Низкочастотное комбинационное рассеяние транспортной и
рибосомной РНК
А. Ю. Сосорев+∗1), О. Д. Паращук∗, О. Г. Харланов∗, И. В. Чичерин∗, А. А. Трубицын∗, П. А. Каменский∗,
Д.Ю.Паращук∗
+Институт биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН, 117997 Москва, Россия
∗Московский государственный университет имени М. В. Ломоносова, 119991 Москва, Россия
Поступила в редакцию 28 июня 2022 г.
После переработки 16 июля 2022 г.
Принята к публикации 16 июля 2022 г.
ДНК и РНК играют важнейшую роль в жизнедеятельности всех организмов, обеспечивая хранение
и передачу наследственной информации и использование ее для построения белков. Кроме того, неко-
торые некодирующие РНК являются частью различных молекулярных машин, например, рибосомы.
Для нормального протекания процессов с участием ДНК и РНК, в том числе репликации, транскрип-
ции и трансляции, крайне важна третичная структура этих макромолекул, информацию о которой
можно получить из спектров комбинационного рассеяния (КР) в низкочастотном (НЧ) диапазоне (до
200 см-1). В настоящей работе впервые получены спектры КР двух некодирующих РНК - транспортной
и рибосомной (последней - в составе рибосомы), - а также проведено их сравнение со спектром ДНК.
Обнаружено, что в области до 100 см-1 спектры двух РНК весьма похожи, а в области 100-200 см-1
значительно различаются после вычитания характерного широкополосного НЧ сигнала. Кроме того,
выявлено значительное различие между спектрами РНК и ДНК: для первых интенсивность НЧ КР
заметно меньше, чем для вторых. Это различие, подтвержденное также численным моделированием
транспортной РНК и ДНК методом молекулярной динамики, объяснено большей упорядоченностью об-
разцов РНК по сравнению с ДНК за счет более сильного взаимодействия между отдельными участками
биомолекул. Таким образом, исследование НЧ спектров КР нуклеиновых кислот может предоставить
необходимую для молекулярной и клеточной биологии информацию о состоянии этих биомолекул, опре-
деляющем протекание важнейших внутриклеточных процессов с их участием.
DOI: 10.31857/S1234567822170116, EDN: jtgsaa
1. Введение. Нуклеиновые кислоты
- ДНК
то присутствуют двойные спирали разной длины;
и РНК - играют важнейшую роль в хранении и
в них пары нуклеотидов, связанных водородны-
реализации наследственной информации, а также
ми связями, образуют π-стеки. В частности, РНК
участвуют в различных клеточных процессах. Все
в рибосоме можно представить как набор спира-
они состоят из сахаро-фосфатного остова и азоти-
лей, соединенных между собой короткими гибки-
стых оснований, которые могут образовывать па-
ми участками [1]. Связь различных участков рРНК
ры за счет водородных связей, однако третичная
друг с другом поддерживается широким спектром
структура этих биомолекул может существенно раз-
разнообразных взаимодействий, таких как компле-
личаться. ДНК обычно имеет вид длинной двух-
ментарные взаимодействия, коаксиальный стекинг
цепочечной спирали (см. рис. 1a), кодирующая бе-
спиралей, боковые спираль-спиральные взаимодей-
лок матричная РНК (мРНК) - одиночной цепоч-
ствия, ортогональные спираль-петлевые взаимодей-
ки. Некодирующие РНК (нРНК) сворачиваются в
ствия, А-минорные взаимодействия, водородные свя-
разнообразные структуры: в частности, транспорт-
зи и взаимодействия с участием магниевых класте-
ная (тРНК) имеет характерную L-образную фор-
ров [2].
му, а рибосомная (рРНК) упаковывается в ком-
Слаженная работа молекулярных машин, состо-
пактные квазисферические субъединицы, состоящие
ящих из нуклеиновых кислот и белков, совершенно
из нескольких сложно организованных доменов [1]
необходима для жизнедеятельности клетки. Для
(см. рис. 1b, c). В последних двух структурах час-
правильной работы этих машин крайне важна
третичная структура макромолекул
- трехмер-
1)e-mail: sosorev@physics.msu.ru
ная укладка биополимерной цепи,
во многом
330
Письма в ЖЭТФ том 116 вып. 5 - 6
2022
Низкочастотное комбинационное рассеяние транспортной и рибосомной РНК
331
Рис. 1. (Цветной онлайн) Структура ДНК (а), тРНК (b) и рибосомы (c). Оранжевым цветом показан сахаро-
фосфатный остов (backbone), бело-синим - азотистые основания (nucleobases). На панели (c) зеленым обозначены
рибосомные белки
определяемая взаимодействием между звеньями
НЧ спектры КР ДНК изучаются на протяжении
(аминокислотами, нуклеотидами). Соответственно,
более 50 лет. В большинстве работ в спектре КР су-
знание этой структуры и ее изменения под действи-
хой ДНК наблюдался широкополосный НЧ сигнал
ем различных факторов может помочь в понимании
(примерно до 150 см-1), а поверх него - достаточно
внутриклеточных процессов и в разработке новых
широкая полоса с центром в районе 20-30 см-1, ин-
методов лечения различных заболеваний, в том чис-
тенсивность которой на порядок превышала интен-
ле наследственных и онкологических. Информацию
сивность КР в высокочастотной (ВЧ, ω > 200 см-1)
об этих взаимодействиях и о конформации биопо-
области [4-6]. Более детальный анализ позволил вы-
лимера позволяет получить низкочастотная (НЧ)
делить слабые полосы на ∼ 60 см-1 и ∼ 100 см-1, ко-
колебательная спектроскопия, регистрирующая
торые были подтверждены более поздними экспери-
колебания с частотами ω
<
200 см-1, соответ-
ментами [7]. Интересно, что НЧ колебания ДНК (а,
ствующими коллективным
движениям участков
возможно, и РНК) не только отражают информацию
макромолекулы и колебаниям слабых межцеп-
о структуре, но и могут иметь важную биологиче-
ных связей. Различные вариации колебательной
скую роль [8]: поскольку их частоты близки к тако-
спектроскопии
- инфракрасная, терагерцовая,
вым для белков, резонанс между колебаниями двух
комбинационного рассеяния (КР), неупругого ней-
структур может влиять на взаимодействие между
тронного рассеяния
- позволяют регистрировать
ними [9, 10]. Наконец, по ДНК [11-13] и РНК [14-16]
различные колебания и дополняют друг друга.
возможен транспорт заряда, и НЧ колебания могут
Однако, несмотря на более чем 50-летнюю историю
иметь на него существенное влияние [14, 16, 17].
использования, НЧ колебательная спектроскопия
В отличие от ДНК, для РНК НЧ спектры КР
остается относительно редким инструментом ис-
практически не были исследованы; нам известно
следования биомолекул. Причина состоит в том,
лишь о двух работах [18, 19]. В них показано, что
что полосы НЧ колебательного спектра биомолекул
спектр двойных спиралей комплементарных мРНК
часто накладываются друг на друга и оказываются
напоминает спектр ДНК, но наиболее НЧ поло-
трудно разрешимыми, вследствие чего анализ такого
са сдвинута в область более высоких частот, что
спектра оказывается трудоемким и малонадежным.
объяснено более жесткой структурой спирали РНК
Также, регистрация НЧ колебаний более слож-
по сравнению с ДНК за счет меньшего расстояния
на с экспериментальной точки зрения; наиболее
между основаниями. Зависимость спектров НЧ КР
перспективной в этом плане представляется НЧ
РНК от последовательности нуклеотидов, а также от
спектроскопия КР [3].
внешних условий (температуры, влажности и т. д.) не
Письма в ЖЭТФ том 116 вып. 5 - 6
2022
332
А. Ю. Сосорев, О. Д. Паращук, О. Г. Харланов и др.
была исследована; более того, НЧ спектры КР нРНК
(например, тРНК и рРНК) измерены не были. В то
же время, поскольку нРНК имеют достаточно ста-
бильную третичную структуру, естественно предпо-
лагать, что их спектр будет отличаться от спектров
ДНК и мРНК. Поэтому, а также в силу упомянутой
выше важности этой структуры для функциониро-
вания нРНК, исследование НЧ спектров КР биомо-
лекул представляется интересным и перспективным.
В настоящей работе впервые измерены спектры
КР тРНК и рибосомы (основную долю которой со-
ставляет рРНК, см. рис. 1c), играющих чрезвычайно
важную роль в синтезе белка - трансляции; в каче-
Рис. 2. (Цветной онлайн) Спектры КР тРНК, рибосомы
стве контрольного образца выбрана ДНК. Спектры
и ДНК с вычтенным широкополосным НЧ сигналом,
измерены в широком диапазоне, включающем НЧ и
нормированные на максимум интенсивности полосы с
ВЧ области. ВЧ спектры всех трех объектов изуче-
центром на отстройке в диапазоне 783-785 см-1. Встав-
ния крайне схожи между собой. Напротив, НЧ спек-
ка: те же спектры без вычитания указанного сигнала
тры различаются положением отдельных полос, од-
нако имеют сходную структуру - наиболее интенсив-
раздел 4). Как видно из этого рисунка, ВЧ спек-
ная полоса с наименьшей частотой и две менее ин-
тры всех трех исследуемых биомолекул очень близ-
тенсивные полосы с более высокими частотами. Об-
ки, несмотря на некоторые отличия в нуклеотидном
наружено, что интенсивность КР тРНК и рибосомы
составе и сахаро-фосфатном остове (между ДНК и
в НЧ области заметно ниже, чем для ДНК. К тако-
РНК). В этих спектрах хорошо видны наиболее ин-
му же выводу о спектрах и суммарной интенсивно-
тенсивные характеристические полосы нуклеиновых
сти НЧ КР приводит проведенное нами моделирова-
кислот [21, 22], в том числе пик с центром в диапа-
ние тРНК и ДНК методом классической молекуляр-
зоне 783-785 см-1, соответствующий колебанию O-
ной динамики (МД): как интенсивность НЧ КР, так
P-O составляющей сахаро-фосфатного остова и сжа-
и величина динамического беспорядка в ДНК ока-
тию и растяжению кольца цитозина; пики на 500
зываются выше, чем в тРНК. На основании данных
и 1100 см-1 (колебания PO-2 составляющей сахаро-
результатов предложено объяснение слабого НЧ КР
фосфатного остова), пики на 1314, 1482 и 1592 см-1,
от тРНК и рРНК более жесткой структурой этих
соответствующие внутренним колебаниям аденина и
биомолекул и межмолекулярными взаимодействия-
гуанина, а также широкая полоса на 1241 см-1, со-
ми, уменьшающими динамический беспорядок. Та-
ответствующая внутренним колебаниям цитозина и
ким образом, НЧ спектроскопия КР может быть ис-
тимина/урацила.
пользована для оценки жесткости структуры биомо-
В то же время, ВЧ спектры трех биомолекул
лекул, что должно существенно способствовать раз-
имеют и ряд отличий. В частности, для РНК нож-
витию молекулярной биологии.
ничное колебание PO-2 группы на ∼ 500 см-1 име-
2. Результаты и обсуждение. На рисунке 2
ет более высокую частоту, чем для ДНК, а сим-
представлены полученные спектры КР тРНК и ри-
метричное сжатие/растяжение связей этой группы
босомы, включающие НЧ и ВЧ области, а также,
на ∼ 1100 см-1 - более низкую частоту. Растяжение
для сравнения, - спектр КР ДНК. В исходных спек-
кольца аденина в РНК отмечается на 725 см-1, а
трах всех трех биомолекул (вставка на рис. 2) при-
в ДНК - на 731 см-1. Аналогично смещаются час-
сутствует широкополосный НЧ сигнал (примерно до
тоты для внутренних колебаний азотистых основа-
150 см-1), связанный с большим числом степеней
ний в районе 1180, 1481 и 1572 см-1 пики в спектре
свободы, их мягкостью, а также низкой степенью
ДНК сдвигаются на 5-7 см-1 в сторону бoльших час-
симметрии, что находится в согласии с предшеству-
тот. Стоит также отметить, что в целом интенсив-
ющими работами [4, 6, 18-20]. Этот сигнал связан с
ность колебаний сахаро-фосфатного остова (относи-
модуляцией поляризуемости НЧ колебаниями [20] и,
тельно интенсивности внутренних колебаний азоти-
следовательно, может говорить о беспорядке в об-
стых оснований) больше в ДНК, чем в РНК. Нако-
разце (что подтверждается моделированием методом
нец, в рибосоме также проявляются линии амино-
МД, см. ниже), однако на рис. 2 этот сигнал вы-
кислот рибосомных белков (например, фенилалани-
чтен для удобства анализа характерных полос (см.
на на 1000 см-1). Однако эти линии значительно сла-
Письма в ЖЭТФ том 116 вып. 5 - 6
2022
Низкочастотное комбинационное рассеяние транспортной и рибосомной РНК
333
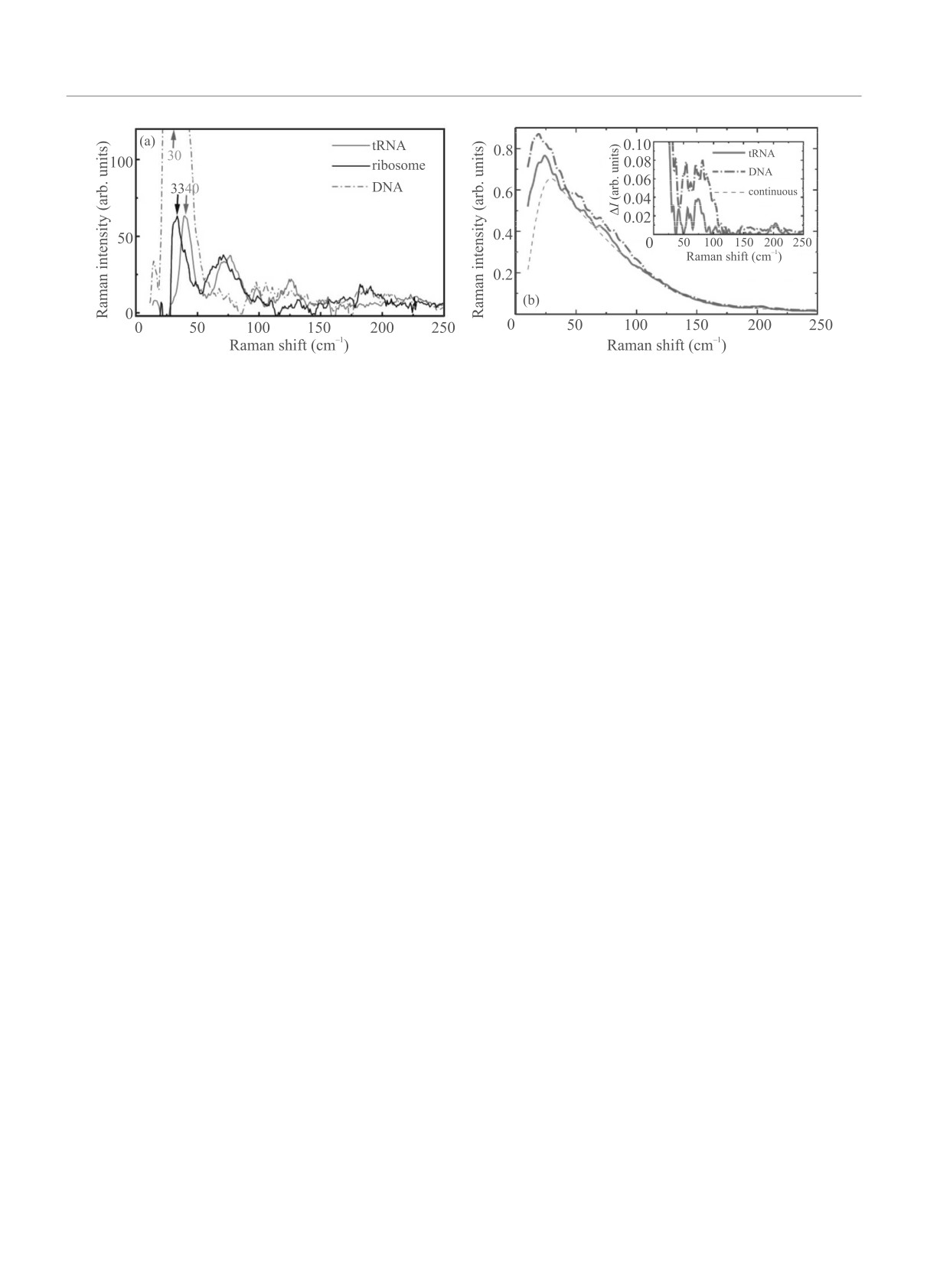
Рис. 3. (Цветной онлайн) (a) - НЧ часть экспериментального спектра КР исследуемых биомолекул (нормировка на
максимум наиболее интенсивной полосы в ВЧ области - с центром на отстройке в диапазоне 783-785 см-1, см. рис. 2).
Стрелками отмечено положение максимума наиболее интенсивной НЧ полосы. (b) - Предсказанные с помощью МД
КР спектры тРНК и ДНК (нормировка на число нуклеотидов); пунктир обозначает непрерывную компоненту спектра,
а врезка демонстрирует спектры после ее вычитания
бее по интенсивности, чем линии РНК, что связано с
Наиболее низкочастотную полосу в ДНК приписы-
небольшой массовой долей белков (менее 1/3) в рибо-
вают колебанию π-стека нуклеозидов относитель-
соме и, следовательно, малым числом ароматических
но сахаро-фосфатного остова (pendulums-nucleoside
аминокислот, которые могли бы вносить значитель-
vibrations) [23, 24]. Вторую из описанных полос, а так-
ный вклад в КР. Таким образом, можно утверждать,
же плечо первой моды можно отнести к колебаниям
что подавляющая часть сигнала КР рибосомы обу-
водородных связей между комплементарными осно-
словлена рРНК.
ваниями [23]. Полосу около 200 см-1 можно отнести
На рисунке 3a крупным планом представлены
к колебаниям связанных с фосфатами противоионов
НЧ области указанных спектров КР после вычита-
[23] и молекул воды [24]. Из спектров, представлен-
ния широкополосного НЧ сигнала. Спектры тРНК и
ных на рис. 3а, видно, что наиболее НЧ полоса спек-
рибосомы в области до 100 см-1 очень похожи и име-
тров РНК близка по частоте к таковой для ДНК,
ют две отдельных полосы с центрами на 33-40 см-1
но немного сдвинута в область более высоких час-
и 70-80 см-1, несмотря на отличие в нуклеотидном
тот, что находится в согласии с данными предше-
составе биомолекул. В диапазоне 100-150 см-1 для
ствующих работ [18]; увеличение частоты этой по-
тРНК наблюдается полоса на ∼ 125 см-1; для рибо-
лосы в РНК можно объяснить меньшим расстояни-
сомы наблюдается некоторая особенность в той же
ем и, следовательно, более сильным взаимодействи-
области (∼ 130 см-1), которая из-за недостаточного
ем между нуклеозидами по сравнению с ДНК. НЧ
соотношения сигнал-шум не позволяет однозначно
полосы РНК на ∼ 70 см1 и 120 см-1, по-видимому, со-
отнести ее полосе КР. В диапазоне 150-250 см-1 спек-
ответствуют колебаниям водородных связей в ДНК
тры двух биомолекул различаются: тРНК имеет по-
на 60 см-1 (плечо первой моды) и 100 см-1, таким
лосу на 225 см-1, а рибосома - на 185 см-1. Полу-
образом, они также сдвинуты в область более вы-
ченные спектры в целом согласуются с данными бо-
соких частот по сравнению с ДНК, в согласии с
лее ранних работ по НЧ КР РНК [18, 19], однако
предположениями предыдущих работ [19]. Увеличе-
позволяют различить отдельные моды в отличие от
ние частоты этих мод по сравнению с ДНК так-
предыдущих данных. Спектр ДНК крайне близок к
же можно объяснить увеличением жесткости струк-
представленному в работах [4, 6, 7]; его отличитель-
туры, как за счет изменения характера самой спи-
ной особенностью является крайне интенсивная по-
рали, так и за счет взаимодействия между сосед-
лоса на ∼ 30 см-1 (с плечом около 60-70 см-1), а так-
ними спиралями (в пределах одной рибосомы или
же две значительно более слабые полосы на ∼ 100 и
соседних молекул тРНК). Отличие положения мо-
185 см-1.
ды около 200 см-1 в исследованных биомолекулах
можно объяснить различием буферного раствора и
Для понимания природы описанных полос полез-
конформации биомолекул, и, следовательно, локаль-
но сравнить полученные спектры РНК и ДНК, по-
ной концентрации противоионов вблизи фосфатных
скольку для последней отнесение НЧ полос КР к тем
групп.
или иным колебаниям было выполнено ранее [23, 24].
Письма в ЖЭТФ том 116 вып. 5 - 6
2022
334
А. Ю. Сосорев, О. Д. Паращук, О. Г. Харланов и др.
Важной особенностью спектров КР исследован-
сивностями тех ВЧ линий КР, которые соответству-
ных образцов тРНК и рибосомы является то, что по-
ют колебаниям сахаро-фосфатного остова (500, 784,
сле вычитания широкополосного НЧ сигнала их ин-
1100 см-1), по сравнению с внутренними колебания-
тенсивность в НЧ области значительно меньше, чем
ми азотистых оснований. Это может свидетельство-
интенсивность в ВЧ области (см. рис. 2). Это замет-
вать о большей подвижности остова в ДНК.
но отличается от данных для ДНК (как получен-
Выводы о меньшем динамическом беспорядке в
ных в данной работе, так и опубликованных ранее
РНК по сравнению с ДНК также независимо под-
[4, 6]), где интенсивность НЧ КР была существен-
тверждаются моделированием методом МД молекул
но выше, чем в ВЧ области. Более того, даже без
тРНК и ДНК в воде (подробности - в разделе 4).
вычитания широкополосного НЧ сигнала, НЧ сиг-
А именно, после нормировки на число нуклеотидов
нал КР ДНК примерно в 6 раз выше, чем РНК.
(соответствующей нормировке на интенсивность КР
Согласно работам по НЧ КР органических полу-
от более локализованных ВЧ колебательных мод)
проводников [25-28], интенсивное НЧ КР свидетель-
НЧ КР спектры двух биомолекул (рис.3b) представ-
ствует о сильном динамическом беспорядке в сис-
лены непрерывными компонентами, совпадающими
теме - флуктуациях положений атомов и ориента-
выше примерно 120 см-1, и набором полос поверх
ций молекулярных фрагментов. Мы предполагаем,
них. Прежде всего, выделяются интенсивная поло-
что сделанные в вышеупомянутых работах выводы
са на 20-30 см-1, пик которой действительно сдви-
применимы и к нуклеиновым кислотам, поскольку
нут в РНК в область более высоких частот, груп-
основной вклад в интенсивность КР в них, как и в ор-
па полос в районе 50-100 см-1 и менее интенсив-
ганических полупроводниках, дают изменения ори-
ная полоса в районе 200 см-1 (см. также вставку на
ентации π-сопряженных фрагментов молекул (азоти-
рис. 3b), что вполне согласуется с эксперименталь-
стых оснований), одновременно приводящие к моду-
ными результатами. Важно, что независимо от на-
ляции интегралов переноса между ними. В рамках
личия или отсутствия вычитания широкополосного
такого подхода, для ДНК интенсивный сигнал НЧ
НЧ сигнала из полученного спектра, ДНК демон-
КР можно объяснить относительной мягкостью ее
стрирует более мощный сигнал НЧ КР; в то же вре-
структуры и большой длиной цепей: даже при вы-
мя, на интенсивность НЧ КР практически не влия-
сыхании в образце остается некоторая часть раство-
ют другие параметры МД-расчета, такие как разме-
рителя (например, связанной воды), вследствие чего
ры пространственной области моделирования. Нако-
должны быть “свободные” участки ДНК, не контак-
нец, динамический беспорядок в РНК действитель-
тирующие с соседними цепями, а имеющие возмож-
но оказывается более низким, чем в ДНК: например,
ность совершать колебания большой амплитуды. Ме-
нормированная дисперсия тензора поляризуемости
нее интенсивный НЧ спектр КР для РНК, наблю-
молекулы (характеризующая интенсивность тепло-
даемый в настоящей работе, таким образом, свиде-
вого движения азотистых оснований и пропорцио-
тельствует о меньшем динамическом беспорядке в
нальная нормированной интегральной интенсивно-
образцах этих биомолекул. Для рибосомы это мож-
сти НЧ КР, см. раздел 4), для РНК меньше, чем для
но объяснить сильным взаимодействием между ее
ДНК.
плотно упакованными спиралями рРНК (с участием
Полученные результаты указывают на воз-
ионов магния и калия [2]), которое делает последнюю
можность оценки динамического беспоряд-
достаточно жесткой структурой (см. рис. 1c и, на-
ка/компактности упаковки биомолекул с помощью
пример, [1]). Для тРНК малый динамический беспо-
НЧ спектроскопии КР. В этом смысле, данная
рядок можно объяснить взаимодействием соседних
работа является развитием предложенного нами
молекул при высыхании пленки: в отличие от ДНК,
ранее в работах [25-28] подхода для оценки динами-
эти молекулы достаточно коротки, что способству-
ческого беспорядка в кристаллических органических
ет их более плотной упаковке, поскольку олигоме-
полупроводниках. Подчеркнем, что для биомолекул
ры кристаллизуются обычно в более упорядоченную
такая оценка очень важна, поскольку компактность
фазу, чем полимеры [29]. Изменения интенсивности
структуры часто связана с функциями биомолекул
НЧ КР коррелируют с вышеописанными различия-
[30]. Например, в большом количестве исследований
ми в частотах ВЧ колебаний сжатия-растяжения (на-
продемонстрирована корреляция между плотностью
пример, на 1100 см-1) между более компактно упако-
упаковки хроматина и его транскрипционной актив-
ванными тРНК и рРНК и менее компактной ДНК.
ностью: наиболее компактно упакованные участки
Также более интенсивный НЧ спектр КР ДНК по
генома содержат меньше генов, обладают слабо
сравнению с РНК коррелирует с большими интен-
выраженной экспрессией генов и находятся ближе к
Письма в ЖЭТФ том 116 вып. 5 - 6
2022
Низкочастотное комбинационное рассеяние транспортной и рибосомной РНК
335
периферии ядра. Напротив, транскрипционно актив-
испарителе Concentrator Plus (Eppendorf) в течение
ными являются открытые участки ДНК, которые
2ч при 60◦С.
упакованы менее плотно и обладают некоторой сво-
Рибосомы были выделены из штамма E. Coli
бодой флуктуаций (а следовательно, динамическим
MRE600 по протоколу, описанному в статье [32].
беспорядком), что делает их доступными для фак-
Клетки бактерий из
1л культуры с оптической
торов транскрипции [31]. Таким образом, указанный
плотностью 0.6 (600 нм) собирали центрифугирова-
подход к оценке беспорядка с помощью НЧ КР
нием, суспендировали в буферном растворе, содер-
может быть использован для мониторинга жест-
жащем 50 мМ Трис-HCl pH 7.4, 100 мM хлорида
кости/транскрипционной активности различных
калия и 5 мМ ацетата магния. Клетки лизирова-
областей клеточного ядра, что крайне важно для
ли ультразвуком, лизаты осветляли центрифугиро-
понимания функционирования клетки. Возможность
ванием при 20000 g в течение 15 минут. Суперна-
оценки динамического беспорядка в биомолекулах
танты наносили поверх 10 % раствора сахарозы в
также важна для нанобиоэлектроники - направле-
аналогичном буфере и центрифугировали 18 часов
ния органической электроники, ориентированного
при 80000 g на центрифуге Optima XPN (Beckman)
на создание электронных устройств на основе
в роторе SW40Ti (Beckman). Осадки растворяли в
биологических или подобных им молекул [13].
минимальном объеме (500-700 мкл) буферного рас-
3. Заключение. Таким образом, в настоящей ра-
твора (10 мМ Tris-HCl pH 7.0; 60 мМ хлорида ка-
боте впервые представлены спектры КР транспорт-
лия, 60 мМ хлорида аммония, 7 мМ ацетата маг-
ной и рибосомной РНК в широком диапазоне, вклю-
ния, 7 мМ β-меркаптоэтанола и 0.25 мМ ЭДТА). Рас-
чающем НЧ и ВЧ области, которые сопоставлены
творы наносили на линейные сахарозные градиенты
с экспериментальными КР спектрами ДНК и рас-
(15-40 %) и центрифугировали 18 часов при 80000 g
четными КР спектрами РНК и ДНК. В НЧ спек-
на центрифуге Optima XPN (Beckman) в роторе
трах ниже 100 см-1 выявлены две отдельные поло-
SW40Ti (Beckman). Градиент разделяли на фракции
сы, практически совпадающие для обеих биомоле-
по 300 мкл, измеряли поглощение при 260 нм, и фрак-
кул. Одна из этих полос, по-видимому, соответству-
ции, содержащие пик рибосом, смешивали. Рибосо-
ет колебанию π-стека нуклеотидов, а другая - сжа-
мы собирали центрифугированием в течение 18 ч при
тию сжатию/растяжению водородных связей между
80000 g.
комплементарными нуклеотидами. Важно, что ин-
Образец тРНК (E.Coli MRE600, фенилаланино-
тенсивность НЧ спектра КР тРНК и рибосомы (по
вая) был получен испарением раствора порошка,
отношению к ВЧ области) существенно ниже, чем
приобретенного в компании Merck.
для ДНК. Это отличие объяснено меньшим динами-
Для исследования спектров КР образцов исполь-
ческим беспорядком в образцах рибосомы и тРНК
зовался КР-микроскоп inVia (Renishaw). В качестве
по сравнению с ДНК за счет более сильного меж-
источника возбуждения использовался He-Ne лазер
цепного взаимодействия внутри рибосомы и между
(633 нм, максимальная мощность 20 мВт). Деграда-
соседними молекулами тРНК. Полученные результа-
ция образцов при использовании 100 % мощности ла-
ты указывают на то, что исследование НЧ спектров
зера не наблюдалась, поэтому все эксперименты про-
КР нуклеиновых кислот, в том числе интенсивностей
водились с использованием максимальной мощности.
полос, может предоставить информацию о компакт-
Количество накоплений выбиралось в зависимости
ности упаковки и межцепных взаимодействиях этих
от интенсивности сигнала КР. НЧ спектры были по-
биомолекул - факторах, определяющих многие био-
лучены из измерений КР в диапазоне 10-450 см-1
логические процессы на микроуровне, в том числе
(далее - “первая серия измерений”), ВЧ спектры -
транскрипцию, репликацию и трансляцию, - а зна-
из измерений КР в диапазоне 100-1800 см-1 (да-
чит, существенно способствовать развитию молеку-
лее - “вторая серия измерений”). Для регистрации
лярной и клеточной биологии.
ВЧ спектров использовались краевые фильтры рэ-
4. Методы. Для экспериментов использова-
леевского излучения, для измерения НЧ спектров -
лись векторные конструкции pEGFP-N1 (Clontech,
двойной монохроматор NExT. Поскольку с помощью
NExT фильтра необходимо пространственно отфиль-
pTag-RFP-N (Евроген, cat.
# FP142). Выделение
тровать лазерную линию, при каждом его использо-
плазмидной ДНК проводилось с помощью набора
вании проверялась юстировка зеркал, щелей и линз,
реактивов Plasmid Midiprep kit 2.0 (Евроген, кат.
входящих в NExT фильтр, и контролировалась фор-
#BC124) по протоколу производителя. Полученный
ма лазерного пучка, поступающего с образца. Прова-
раствор плазмиды высушивался на вакуумном
лы в НЧ спектрах на 18, 25 и 160 см-1 являются ар-
5
Письма в ЖЭТФ том 116 вып. 5 - 6
2022
336
А. Ю. Сосорев, О. Д. Паращук, О. Г. Харланов и др.
тефактами измерений, связанными с наличием пы-
AmberTools [33]. После прогрева до 300 К и даль-
линок на зеркалах NExT фильтра. Обработка спек-
нейшего уравновешивания системы в течение 4 нс
тров, в частности вычитание фона, осуществлялась
проводился финальный расчет МД в NpT-ансамбле
в программе WiRE 3.4 с помощью встроенного мето-
в течение 10 нс, из которого каждые 50 фс брались
да интерполяции кубическими полиномами. Из всех
координаты xb,i(t) всех атомов i всех азотистых
спектров в диапазоне 10-1800 см-1 вычитался непре-
оснований b. Для обработки сформированной таким
рывный широкополосный фон. Все спектры, помимо
образом МД-траектории для метилзамещенных
широкополосного непрерывного фона содержали в
аденина, гуанина, тимина/урацила и цитозина были
диапазоне 10-200 см-1 широкополосный НЧ сигнал,
вычислены равновесные геометрии x(0)b,i, тензоры по-
вследствие чего процедура вычитания фона в ВЧ и
ляризуемости α(0)b и их производные по координатам
НЧ области несколько различалась: в диапазоне 200-
атомов dα(0)b/dxb,i; данные вычисления были прове-
1800 см-1 производилась интерполяция непрерывно-
дены на уровне B3LYP/6-31G(d,p) в пакете GAMESS
го широкополосного фона набором кубических по-
US [34, 35] только единожды, не требуя пересчета
линомов; полученная таким образом интерполяци-
для каждого запуска МД. Поляризуемости азоти-
онная функция далее экстраполировалась в диапа-
стых оснований в момент времени t вычислялись по
зон 10-200 см-1. Спектры в диапазоне 10-200 см-1
формуле αb(t) = Rb(t)(α(0) +dα(0)b/dxb,i ·rb,i(t))RTb(t),
были проанализированы как при наличии НЧ ши-
где Rb - ортогональное преобразование, вместе со
рокополосного сигнала, так и после его вычитания
сдвигом Δb приближенно переводящее геомет-
(также методом интерполяции кубическими полино-
рию DFT-расчета основания в мгновенную его
мами) с целью анализа отдельных КР полос в НЧ
геометрию из МД, а rb,i - остаточные смещения
области, см. раздел 2. Для сшивания НЧ и ВЧ спек-
(деформации): xb,i(t) = Rb(t)(x(0)b,i + rb,i(t)) + Δb(t).
тров в области перекрытия диапазонов двух серий
Расчетный НЧ КР спектр был получен из выра-
измерений, 100-450 см-1, выбирались наиболее ин-
жения I(ω) ∝ C(ω) · (ℏω/kBT)(1 - e-ℏω/kBT)-1 ,
тенсивные полосы (для тРНК и рибосомы выбра-
содержащего фурье-образ C(ω) автокоррелятора
на полоса на отстройке 270 см-1, а для ДНК - на
〈tr(Δα(t)Δα(t+τ))〉 суммарной поляризуемости всех
отстройке 335 см-1). Спектры, измеренные в диапа-
азотистых оснований, умноженный на классическо-
зоне 10-450 см-1, умножались на такой коэффици-
квантовую поправку для частот в районе 200 см-1
ент, чтобы интенсивности полос стали равны интен-
(ℏ - постоянная Планка, kB - постоянная Больцма-
сивностям в максимуме этих же полос, измеренных
на) [36].
в диапазоне 100-1800 см-1; при этом, вся область пе-
Авторы
выражают
благодарность
рекрытия хорошо согласовалась между двумя сери-
А. Ю. Чикишеву за ценные обсуждения и
ями измерений спектров КР. Спектр КР, сшитый та-
С. А. Гончаруку за предоставленные образцы тРНК.
ким образом из двух серий измерений и содержащий
Работа выполнена при финансовой поддержке Рос-
НЧ и ВЧ области, далее нормировался на интенсив-
сийского фонда фундаментальных исследований
ность в максимуме наиболее яркой ВЧ полосы (783-
(грант # 19-32-60081 Перспектива).
785 см-1), а также на время и число накоплений. Ин-
Экспериментальная часть работы выполнена с
тенсивности полос (270, 335 и 783-785 см-1) опреде-
использованием оборудования, приобретенного за
лялись с помощью аппроксимации последних гауссо-
счет средств Программы развития Московского уни-
выми профилями: для тРНК и рибосомы для поло-
верситета.
сы 783-785 см-1 были взяты два гауссовых профиля
вследствие перекрывания с полосой на 810 см-1, для
остальных полос - один гауссов профиль.
1. B. S. Schuwirth, M. A. Borovinskaya, C. W. Hau,
W. Zhang, A. Vila-Sanjurjo, J. M. Holton, and
Для предсказания спектров КР в тРНК и ДНК
J. H. Cate, Science 310, 827 (2005).
использовалось многомасштабное моделирование,
2. А. С. Спирин, Молекулярная биология: рибосомы и
сочетающее квантовохимические расчеты методом
биосинтез белка, Издательский центр “Академия”,
теории функционала плотности (DFT) с классиче-
М. (2011).
ской МД. А именно, к исходным структурам тРНК и
3. A. Yu. Sosorev, D. R. Maslennikov, O. G. Kharlanov,
ДНК из E.Coli (структуры 3L0U и 6LXN в базе дан-
I. Yu.
Chernyshov,
V. V.
Bruevich,
and
ных RCSB PDB) добавлялись недостающие атомы
D. Yu. Paraschuk, Phys. Status Solidi Rapid Research
водорода, а также противоионы Na+ и раствори-
Letters 13, 1800485 (2019).
тель - вода, - после чего проводились расчеты МД
4. H. Urabe and Y. Tominaga, Biopolymers 21,
2477
с использованием силового поля AMBER в пакете
(1982).
Письма в ЖЭТФ том 116 вып. 5 - 6
2022
Низкочастотное комбинационное рассеяние транспортной и рибосомной РНК
337
5.
H. Urabe, Y. Sugawara, M. Ataka, and A. Rupprecht,
25.
M. V. Vener, O. D. Parashchuk, O. G. Kharlanov,
Biophys. J. 74, 1533 (1998).
D. R. Maslennikov, D. I. Dominskiy, I. Yu. Chernyshov,
6.
V.S. Gorelik and A. Yu. Pyatyshev, Phys. Wave
D. Yu. Paraschuk, and A. Yu. Sosorev, Adv. Electron.
Phenom. 22, 252 (2014).
Mater. 7, 2001281 (2021).
7.
B. S. Kalanoor, M. Ronen, Z. Oren, D. Gerber, and
26.
O. G. Kharlanov, D. R. Maslennikov, E. V. Feldman,
Y.R. Tischler, ACS Omega 2, 1232 (2017).
G. G. Abashev, O. V. Borshchev, S. A. Ponomarenko,
8.
B. S.
Alexandrov,
V. Gelev,
S. W. Yoo,
M. V. Vener, D. Yu. Paraschuk, and A. Yu. Sosorev, Adv.
L. B. Alexandrov, Y. Fukuyo, A. R. Bishop,
Electron. Mater. 7, 2100579 (2021).
K. Rasmussen, and A. Usheva, Nucleic Acids Res.
27.
A. Yu. Sosorev, O. D. Parashchuk, N. V. Tukachev,
38(6), 1790 (2010).
D. R. Maslennikov, D. I. Dominskiy, O. V. Borshchev,
9.
V.S. Gorelik, L. I. Zlobina, A.S. Krylov, V. P. Sverbil,
M. S. Polinskaya, M. S. Skorotetcky, O. G. Kharlanov,
and P. P. Sverbil, Phys. Wave Phenom. 24, 272 (2016).
and D. Yu. Paraschuk, Phys. Chem. Chem. Phys. 23,
10.
K.-C. Chou, Biophys. J. 45, 881 (1984).
15485 (2021).
11.
E. O’Brien, M. E. Holt, M. K. Thompson, L. E. Salay,
28.
V. A. Trukhanov, D.I. Dominskiy, O. D. Parashchuk,
A.C. Ehlinger, W. J. Chazin, and J. K. Barton, Science
E. V. Feldman, N. M. Surin, E. A. Svidchenko,
355, eaag1789 (2017).
M. S. Skorotetcky, O. V. Borshchev, D. Yu. Paraschuk,
12.
K. J. McDonnell, J. A. Chemler, P. L. Bartels,
and A. Yu. Sosorev, RSC Adv. 10, 28128 (2020).
E. O’Brien, M. L. Marvin, J. Ortega, R. H. Stern,
29.
B. Chitturi, S. Shi, L. N. Kinch, and N. V. Grishin,
L. Raskin, G. M. Li, D. H. Sherman, J. K. Barton, and
J. Mol. Biol. 428, 4392 (2016).
S. B. Gruber, Nat. Chem. 10, 873 (2018).
30.
C. Liu, K. Huang, W.-T. Park, M. Li, T. Yang, X. Liu,
13.
V.D. Lakhno, Int. J. Quant. Chem. 108, 1970 (2008).
L. Liang, T. Minaric, and Y.-Y. Noh, Mater. Horiz. 4,
14.
A.Yu. Sosorev and O. G. Kharlanov, Phys. Chem.
608 (2017).
Chem. Phys. 23, 7037 (2021).
31.
N. Gilbert and B. Ramsahoye, Brief. Funct. Genomics
15.
A.Yu. Sosorev, Molecules 26, 5479 (2021).
Proteomics 4, 129 (2005).
16.
А. Сосорев, Биоорг. химия 48, 223 (2022).
32.
S. Levitskii, K. Derbikova, M. V. Baleva, A. Kuzmenko,
17.
J. C. Genereux and J. K. Barton, Chem. Rev. 110, 1642
A. V. Golovin, I. Chicherin, I. A. Krasheninnikov, and
(2010).
P. Kamenski, PeerJ 6, e5620 (2018).
18.
G. Edwards and C. Liu, Phys. Rev. A 44, 2709 (1991).
33.
A. Pérez, I. Marchán, D. Svozil, J. Sponer,
19.
T. Weidlich and S. Lindsday, J. Phys. Chem. 92, 6479
T. E. Cheatham 3rd, C. A. Laughton, and M. Orozco,
(1988).
Biophys. J. 92, 3817 (2007).
20.
M.
González-Jiménez,
G.
Ramakrishnan,
34.
M. W. Schmidt, K. K. Baldridge, J. A. Boatz,
N.V. Tukachev, H.M. Senn, and K. Wynne, Phys.
Chem. Chem. Phys. 23, 13250 (2021).
S. T. Elbert, M. S. Gordon, J. H. Jensen, S. Koseki,
N. Matsunaga, K. A. Nguyen, S. Su, T. L. Windus,
21.
J. M. Benevides, S. A. Overman, and G. J. Thomas Jr.,
M. Dupuis, and J. A. Montgomery Jr., J. Comput.
J. Raman Spectrosc. 36, 279 (2005).
Chem. 14, 1347 (1993).
22.
G. J. Thomas Jr., J. M. Benevides, S. A. Overman,
T. Ueda, K. Ushizawa, M. Saitoh, and M. Tsuboi,
35.
M. S. Gordon and M. W. Schmidt, Theory and
Biophys J. 68, 1073 (1995).
applications of computational chemistry: the first forty
23.
S. M. Perepelytsya and S. N. Volkov, Eur. Phys. J. E 31,
years, ed. by C. E. Dykstra, G. Frenking, K. S. Kim, and
201 (2010).
G. E. Scuseria, Elsevier, Amsterdam (2005).
24.
T. L. Bubon and S. M. Perepelytsya, Eur. Phys. J. E 44,
36.
S. Luber, M. Iannuzzi, and J. Hutter, J. Chem. Phys.
84 (2021).
141, 094503 (2014).
Письма в ЖЭТФ том 116 вып. 5 - 6
2022
5∗