ВВЕДЕНИЕ
Углекислый газ содержится в атмосфере, гидросфере, литосфере и биосфере. В основном именно за счет двуокиси углерода происходит углеродный обмен между этими сферами. Почвы, почвенный покров играют ключевую роль в этих процессах, поддерживая постоянное взаимодействие, а также обмен веществом между атмосферой, поверхностными водами и литосферой [7]. Современный структурно-функциональный подход рассматривает почву не только как “самостоятельное, обособленное естественно-историческое природное тело”, но и как активный компонент биогеосферы с жизненно важными экологическими функциями [4, 8].
Неоспоримым является тот факт, что в наземном цикле углерода, с точки зрения величины потока, преобладают фотосинтез и дыхание почвы. По сравнению с этими процессами вынос углерода грунтовыми водами сравнительно невелик, но на его долю приходится постоянный транзит различных форм растворенного неорганического углерода, включая СО2, во внутренние воды (озера, реки, ручьи) [59, 68]. Для экосистем, близких к равновесию, размер выноса с грунтовым стоком может иметь решающее значение для оценки долгосрочного баланса углерода. Большинство крупномасштабных оценок выноса углерода в растворенном виде из почв и наземных экосистем не превышает первых процентов от их газообмена с атмосферой, поэтому данной статьей нередко пренебрегают при расчетах углеродного баланса [9, 14, 16]. Для гидроморфных почв существуют оценки потоков растворенных С-газов, соизмеримые с почвенным дыханием, а иногда и превышающие его [5, 7, 16]. Однако эти оценки получены косвенным путем через эксперименты по биодеградации органического вещества почвы или расчетом по модулю стока с известной площади и известной средней концентрацией растворенных газов. В прямом лизиметрическом исследовании [17] сток растворенного СО2 в вегетационные периоды составил 0.3–3.7% от эмиссии с поверхности, исключая резкие всплески (до 14%), вызванные обильными осадками. И лишь в холодное время года эта статья углеродного газового обмена достигала 22–92% при средней за весь период наблюдений величине ~30%, что несильно повышало вклад лизиметрического стока растворенного СО2 в среднегодовой газообмен почвы.
Ряд исследований показывает, что игнорирование экспорта углерода, как органического, так и неорганического через поверхностные воды может привести к значительной переоценке его накопления в наземных экосистемах [46, 53, 87, 120]. При этом потеря углерода через водные объекты редко включается в региональные углеродные модели, а если включается, то расчеты подвержены большим неопределенностям. По мнению исследователей, это связано как с недостатком первичных данных, так и со сложностями в оценке ряда показателей. Вышеизложенное касается трех основных аспектов, определяющих выбросы CO2 из внутренних вод: количество CO2 в воде; глобальная площадь поверхности ручьев, рек, озер и водохранилищ и скорость газообмена с атмосферой [90, 93].
Анализ отечественной и зарубежной литературы указывает на небольшое количество и противоречивость информации о педогенных потоках растворенного неорганического углерода и их роли в углеродном цикле, несмотря на давнюю предысторию исследований растворенной углекислоты в почвоведении, гидрогеологии и сопряженных дисциплинах. В отечественном почвоведении растворимый неорганический углерод начали активно изучать с середины прошлого столетия в связи с процессами почвообразования и выветривания минералов [2, 13, 18, 19]. Для бореальной лесной зоны работы [2, 18, 19] оценили содержание углекислоты почвенных растворов диапазоном 20–300 мг/л и более, а в поверхностных водах – 15–70 мг/л.
Опираясь на вышеизложенное, можно заключить необходимость учета почвенно-грунтового стока и поверхностных вод при региональном и глобальном моделировании углеродного цикла. Особенно это касается циркумбореальных биомов, которые характеризуются высокой обводненностью [108], что контрастирует с ограниченным числом исследований, в которых изучалось функционирование и региональная роль водных систем, особенно с точки зрения динамики углерода [97].
В ходе данного обзора поставили задачей осветить три вопроса: 1 – теоретические основы и актуальность исследований растворенного диоксида углерода в природных водах; 2 – методические подходы в оценке данного показателя; 3 – роль растворенного диоксида углерода в почвенных, грунтовых и поверхностных водах в бореальных и арктических регионах.
РАСТВОРЕННЫЙ ДИОКСИД УГЛЕРОДА В ПРИРОДНЫХ ВОДАХ
Растворенный неорганический углерод (РНУ) (dissolved inorganic carbon, DIC) в природных водах представлен метаном, диоксидом углерода, угольной кислотой и продуктами ее диссоциации. В данном обзоре не будем рассматривать метан, так как его поведение в растворах существенно отличается от поведения диоксида углерода [26]. Растворенный диоксид углерода является веществом, во многом формирующим химический состав природных вод [10, 50]. Он играет важную роль в регулировании кислотности [32, 96], а также в функционировании пресноводной биоты [98].
Растворение СО2 в водных средах проходит в два этапа: на первом происходит образование гидрата диоксида углерода, на втором – образование угольной кислоты [12]:
Доля угольной кислоты в растворах составляет около 0.3%, остальное приходится на гидрат двуокиси углерода, но для простоты расчетов карбонатного равновесия принимают за Н2СО3 весь растворенный СО2 [28]. Количество углекислого газа, растворяющегося в чистой воде, в значительной степени определяется парциальным давлением СО2 (рСО2) в газовой фазе согласно закону Генри. Связь между этими величинами осуществляется с помощью константы Генри, которая зависит от температуры воды [12, 25]. Закон Генри применим только для идеальных условий, для детального количественного описания процессов в системе жидкость–газ необходим учет карбонатно-кальциевого равновесия и эффекта высаливания (уменьшение растворимости газа при добавлении в раствор солей) [6, 16]. Ряд работ также указывает на необходимость учета кинетики взаимодействия газов с жидкой фазой ввиду продолжительности установления равновесия в системе вода–воздух [15].
Помимо гидратированной формы СО2, в растворах природных вод присутствуют продукты диссоциации угольной кислоты: карбонат- и бикарбонат ионы. Соотношение этих форм связано с рН раствора и хорошо иллюстрируется рис. 1. В кислом диапазоне рН (≤4) в растворе будет абсолютно преобладать Н2СО3 (СО2); максимальная доля ${\text{HCO}}_{3}^{ - }$ достигается при рН 8.34 [12]. Эти величины и уравнения имеют практическую ценность для расчетов концентраций в водах разной природы.
Рис. 1.
Соотношение между Н2СО3, ${\text{HCO}}_{3}^{ - },$ ${\text{CO}}_{3}^{{2 - }}$ в воде при различных рН (25°С) [12].

Вернемся к идеальному раствору. Предположим, что все водные объекты являются безжизненными резервуарами, не содержащими реакционноспособных химических веществ и открытыми только для атмосферы, иногда такие модели называют “тефлоновыми озерами” [28]. Тогда концентрация данного газа полностью бы зависела от состава атмосферы и физики газообмена. То есть в равновесном состоянии концентрация газа в воде соответствовала бы величине предельной растворимости по закону Генри при его данном парциальном давлении в атмосфере, и во всех водах было бы близкое количество растворенного CO2, за исключением различий в растворимости при разных температурах и высотах над уровнем моря, а также диффузионно-гравитационной стратификации по глубине водоема. Поскольку растворимость СО2 в кислых водах близка к 1 [16], при равновесии по Генри его объемная доля в воде приближается к атмосферной (400 ppm), что соответствует равновесной молярной концентрации ~19.5 мкмоль/л [78] и парциальному газовому давлению ~400 мкатм. В природе такая ситуация встречается крайне редко. Большинство водных резервуаров, как естественных, так и искусственных, характеризуются величинами содержания СО2 большими, а иногда и существенно большими, чем вышеупомянутая величина. Такие воды предложено называть пересыщенными (supersaturated) СО2 по отношению к атмосфере. Если в водах содержится меньше CO2, чем при равновесии с атмосферой, они называются ненасыщенными (undersaturated) [28]. Соответственно, при контакте с атмосферным воздухом пересыщенные воды могут быть источником СО2 в атмосферу, а ненасыщенные – поглотителем.
РОЛЬ ПРИРОДНЫХ ВОД В ЦИКЛЕ УГЛЕРОДА
Поскольку внутренние пресноводные экосистемы (озера, реки, водно-болотные угодья, водохранилища и др.) покрывают лишь небольшую часть поверхности Земли, они редко рассматривались в качестве потенциально важных количественных компонентов углеродного цикла как в глобальном масштабе, так и в региональном [29, 69]. Эволюция концепции круговорота углерода во внутренних водах очень емко представлена Травник с соавт. [111]. Например, прослежена эволюция исследований круговорота углерода в озерах, которые изначально рассматривались как изолированные микрокосмы с сугубо внутренним метаболизмом. Затем пришло осознание сильного воздействия на их функционирование импортируемого из наземных экосистем углерода, что в итоге привело к современному взгляду на внутренние воды как на важный компонент в общепланетарном углеродном цикле. Также очень ярко отражает роль внутренних вод в глобальном углеродном цикле противопоставление двух моделей: “пассивной” и “активной трубы” [29, 110], схематично представленные на рис. 2. В случае “пассивной трубы” внутренние воды рассматривались как простой канал, транспортирующий углерод из наземных экосистем в моря и океаны. В противоположность, посредством “активной трубы” воды удерживают (путем захоронения в отложениях) и отводят в атмосферу (путем выброса углекислого газа) значительную часть углерода, поступающего с водоразделов. Приводимые в литературе обобщенные оценки показывают, что во внутренние водные системы с суши поступает примерно в 2 раза больше углерода, чем экспортируется с суши в море (1.9 и 0.9 Пг С/год). В длительном временном интервале чистые потоки углерода в водных системах, как правило, выше на единицу площади, чем на большей части окружающей суши [29]. Включение водных экосистем в расчеты региональных балансов углерода, даже с учетом их небольших площадей, может потребовать пересмотра того, как описывается современный чистый сток углерода на суше [93].
ИСТОЧНИКИ СО2 В ПРИРОДНЫХ ВОДАХ
В отличие от океана, лишь 40% площади которого выделяет в атмосферу CO2 [106], подавляющее большинство (около 90%) исследованных в мире пресноводных экосистем являются пересыщенными по диоксиду углерода и выбрасывают CO2 в атмосферу [39].
Описаны 4 основных группы процессов, определяющих концентрацию растворенного диоксида углерода в водотоках и водных резервуарах: 1 – дыхание почвы (микробное и корневое), приводящее к насыщению грунтовых вод CO2; 2 – дыхание водных растений и гетеротрофное разложение органического вещества непосредственно в водотоках; 3 – растворение карбонатов и выветривание силикатных минералов в почвах и подстилающей породе; 4 – атмосферный обмен (дегазация или поглощение газов) [105, 117]. Определенный вклад могут вносить газогенерация со дна водоемов, химические и биохимические реакции в водной толще, включая осаждение карбонатов, но этот вклад количественно пока не соотнесен с четырьмя основными группами процессов, преимущественно аллохтонного, почвенного происхождения. Выделение вулканических газов, образующихся в недрах земли, также в некоторой степени может влиять на повышение концентрации диоксида углерода в подземных водах. При этом наиболее значимый процесс, приводящий к уменьшению концентрации двуокиси углерода в воде, помимо физической дегазации и образования карбонатов – это фотосинтез (поглощение диоксида углерода водными автотрофными организмами).
Рассмотрим более подробно первые два источника пересыщения вод диоксидом углерода. Здесь можно привести интересную аналогию Теллмана [109], который предложил рассматривать озера и другие водные системы как “реакторы” и “воздушные клапаны” (reactors or vents). В качестве реакторов в них минерализуется наземный органический углерод и затем высвобождается в атмосферу в газообразной форме. В качестве воздушного клапана водные резервуары получают неорганический земной углерод (РНУ) из подземных или поверхностных вод с последующим выделением его в атмосферу [102, 109]. Какие из этих двух групп процессов преобладают? Данный вопрос остается открытым, предполагается, что превалирование того или иного процесса связано с влиянием общеклиматических условий, типа водного объекта, характеристик водосбора и др. [55, 75, 97, 111, 118].
В историческом аспекте, на начальных этапах оценки экосистем с точки зрения их автотрофности или гетеротрофности, считалось, что большинство водных экосистем, за исключением загрязненных органическими веществами и олигоминеральных, являются автотрофными, то есть валовая первичная продукция в них преобладает над экосистемным дыханием [86]. В обобщениях конца прошлого – начала нынешнего века показано, что дыхание имеет тенденцию доминировать над продуктивностью во многих реках, эстуариях, олиготрофных и мезотрофных озерах, водохранилищах и районах олиготрофного океана [39]. При этом до недавнего времени считалось, что концентрация CO2 в поверхностных водах определяется в основном биохимическими процессами, происходящими in situ, то есть является результатом деструкции аллохтонного органического вещества, перенесенного в растворенном виде из наземной среды в водную [27, 39, 113]. Важность данного источника не вызывает сомнения, процессы преобразования аллохтонного органического вещества в природных водах активно изучаются в современной литературе на протяжении последних десятилетий [22, 51, 66, 76, 77, 88, 90, 101, 103]. Помимо биологической деструкции в литературе широко обсуждаются процессы фотохимической деструкции органического вещества во внутренних водах [76, 110, 114]. Мы не будем подробно останавливаться на обсуждении процессов высвобождения СО2 в процессе деструкции растворенного органического вещества, это предмет отдельного обзора.
В единичных работах конца прошлого века [67] и в ряде работ последнего десятилетия указывается, что неорганический углерод, привносимый из наземных экосистем в водные объекты, может иметь не только большое значение, но и превалировать в общем балансе [118]. Показано, что для текучих вод (рек и ручьев) внешние поступления CO2 очень важны [53, 55, 59, 60], в то время как концентрация СО2 в озерах является результатом как внешних, так и внутренних процессов [66, 118]. В подземных водах углекислый газ в основном появляется в процессе внутрипочвенного корневого и гетеротрофного дыхания, а также выветривания карбонатных пород [16]. Данных по количеству диоксида углерода, который попадает в грунтовые воды непосредственно из почв, крайне мало в силу ряда обстоятельств. Кратко – это недоучет в почвенных исследованиях абиотических процессов, связанных с газообменом [8, 16], изучение процессов газообмена только на границе почва–атмосфера без учета взаимодействия с грунтовыми водами, а также методические трудности прямых измерений концентраций газов в почвенно-грунтовых водах и большие неопределенности в расчетных методах.
МЕТОДЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ОЦЕНКИ КОНЦЕНТРАЦИИ СО2 В ПРИРОДНЫХ ВОДАХ И ЕГО РАВНОВЕСНОГО ПАРЦИАЛЬНОГО ДАВЛЕНИЯ
Попытаемся систематизировать методы оценки концентрации растворенного СО2 в природных водах и соответствующего ей равновесного парциального давления газа над раствором, в табл. 1 и ниже остановимся на них подробнее.
Таблица 1.
Методы определения концентрации растворенного СО2 в природных водах
| Метод | Приборная база | Ссылка |
|---|---|---|
| Титриметрический метод | Оборудование для определения физико-химических параметров природных вод | [2, 3, 17, 19] |
| Расчетный метод через карбонатную щелочность, рН, температуру воды и константы диссоциации угольной кислоты с поправкой на температуру | Оборудование для определения физико-химических параметров природных вод | [20, 35, 65, 67, 71, 118] |
| Прямое измерение концентрации СО2 в воде с применением мембранных дегазаторов | 3M™ Liqui-Cel™ MM Series Membrane Contactor | [75, 97, 108] |
| Метод выравнивая (уравновешивания) концентраций “equilibration technique” | Газоанализатор, пробоотборники или эквилибраторы | [24, 33, 63, 67, 70, 71, 82, 85, 87, 91, 95] |
| Прямой метод с помощью датчиков в воде | Однолучевой двухволновой недисперсионный инфракрасный (NDIR) источник света и датчик СО2 на основе кремния (Vaisala CARBOCAP GMT 222 (Vaisala Oyj, Финляндия)) и трубка (рукав) из вспененного политетрафторэтилена (ПТФЭ), обладающие высокой проницаемостью для CO2, но непроницаемыми для воды | [41, 58, 72, 82, 87, 99] |
| Косвенный метод, основанный на измерении концентрации газа в пространстве камеры над водой | Недорогие датчики, измеряющие концентрацию СО2 в воздухе | [23] |
Оценка содержания свободного СО2 через измерение общей кислотности (титриметрический метод). Данный метод подробно описан во всех практических руководствах [1, 3]. Основан на титровании пробы воды 0.01 М Ba(OH)2 или 0.02 М NaOH в присутствии фенолфталеина до появления не исчезающей в течение 2–3 мин красной окраски. Подход имеет ряд ограничений [3, 83]. В частности, на результаты титрования существенное влияние оказывают другие компоненты, такие как органические кислоты. В таком случае метод предполагает повторное титрование после кипячения. Необходимым условием является отсутствие контакта пробы воды с воздухом до проведения титрования, что предполагает определенную процедуру пробоотбора и наличие специального оборудования.
Расчетный метод. Несмотря на длительную предысторию изучения неорганического углерода в природных водах, инструментальное измерение равновесного парциального давления СО2 из водных объектов появилось относительно недавно [51]. Косвенно такой показатель можно рассчитать исходя из величины щелочности воды, измерение которой проводилось для других целей, с использованием ряда дополнительных показателей: pH, температуры и концентрации ряда других ионных соединений [28, 84]. В первом приближении (без учета карбонат-анионов) может быть использовано уравнение:
Таким образом, для того, чтобы рассчитать равновесное с данным раствором парциальное давление (pCO2) в замкнутой атмосфере над ним необходимо знать: 1 – константу Генри для растворения (K0) и константу диссоциации угольной кислоты по первой ступени (K1), зависящие от температуры, поэтому надо знать температуру; 2 – щелочность (может быть заменена на общее содержание неорганического углерода); 3 – рН. Возможные комбинации показателей для расчетов: температура и либо общий РНУ и pH, щелочность и pH, либо щелочность и РНУ [28]. При этом щелочность может быть общая, обусловленная всеми щелочными компонентами, или обусловленная компонентами только углеродных соединений. Приведенное уравнение имеет упрощенный вид и предполагает, что в общей щелочности водного объекта преобладают бикарбонат ионы и угольная кислота. Более детализированные подходы, учитывающие химические взаимодействия и буферность в жидкофазных объектах содержатся в работах [6, 12, 16, 36]. В подавляющем большинстве исследований по карбонатно-кальциевому равновесию рассматриваются прямые задачи оценки химических процессов и рН растворов при известном и постоянном уровне СО2 в атмосфере. Для жидкой фазы почв в предположении кислотно-щелочной буферности Смагин [16] предпринял попытку расчета эффективной растворимости СО2 с последующей количественной оценкой содержания растворенного СО2 во всех трех формах: свободной углекислоты, бикарбонат и карбонат-анионов в зависимости от рН и температуры раствора. Этот подход впоследствии был использован для выявления роли растворенного СО2 в общем педогенном цикле углерода, дифференциации растворения и сорбции в межфазных взаимодействиях СО2 в почве, определения соотношения эмиссии и общего продуцирования СО2 объемом почвы [15–17].
Открытым остается вопрос о допустимости такого подхода для чисто водных объектов, которые в отличие от трехфазных почвенных систем могут не иметь буферность по отношению к реакции среды и, соответственно, величинам рН. Кроме того, формула Смагина [16] предполагает обратимость химических превращений водорастворимого неорганического углерода, что далеко не очевидно как для почвенных растворов, так и для грунтовых и поверхностных вод. Любое взаимодействие карбонат и бикарбонат анионов с противоположно заряженными ионами будет смещать рассматриваемое химическое равновесие вправо, вплоть до необратимого перевода в твердую фазу (осаждения из раствора) части неорганического углерода, причем жизнедеятельность организмов как правило способствует такой иммобилизации [28]. Это указывает на сложность процессов, контролирующих трансформацию биогенного СО2 в почвах, и потенциально сильное занижение оценки растворенного СО2 по расчетной формуле [16].
Также при расчетной оценке содержания растворенного СО2 существует возможность потенциальных ошибок [84], связанных с недоучетом влияния температуры, ионной силы раствора, образования комплексных солей с кальцием в условиях повышенного рН, зависимости рСО2 от метеорологических условий, получением завышенных значений щелочности за счет органических кислот и алюминия. Помимо этого, потеря растворенного CO2 путем дегазации образца перед титрованием также может привести к недооценке концентрации свободного CO2 [50].
Техника проведения анализа (методика) проста и предполагает измерение температуры воды в полевых условиях, определение рН с точностью до сотых и определение общей щелочности. Последние работы рекомендуют титровать пробы 0.1 М HCl до рН 3.0 в 2 этапа. Сначала относительно быстро добавляют кислоту до достижения рН 4.0. На втором этапе кислоту добавляют медленно, ступенчато до конечного значения pH 3.0 [20]. Это позволяет проводить измерения для сильнокислых вод. Для сравнения, методика определения щелочности природных вод по ГОСТ 31957-2012 предполагает титрование до рН 4.5. Существуют опубликованные доступные компьютерные программы для расчета концентрации СО2, правда в основном для морских и океанических вод [79].
Несколько слов о применимости данного метода. Расчеты концентрации СО2, когда учитываются щелочность воды, ее температура и рН, широко используются при изучении пресноводных экосистем с низким содержанием органического углерода и pH > 6 из-за гораздо более простой процедуры титрования. Показано, что этот метод хорошо работает в водах с щелочностью от умеренной до высокой (общая щелочность >1000 мг экв/л) [71, 94, 116]. Недавние исследования доказали, что pCO2, рассчитанный через щелочность–рН, в высокой степени соответствует непосредственно измеренному значению в субтропических реках с рН > 7.2 [81]. Источники некарбонатной щелочности (органические кислоты, фосфор, азот и кремний) будут вносить вклад в pCO2 и расчетные значения pCO2 будут завышенными [20, 56, 79]. Существует ряд работ, утверждающих, что вклад этих источников в pCO2 незначителен в образцах с pH > 7.0 [20, 56]. Но если пробы воды характеризуются высокими концентрациями растворенного органического углерода, стоит обратить на это внимание.
Согласно анализу Abril et al. [20], рассчитанный pCO2 в подавляющем большинстве случаев выше измеренных в равновесной над раствором замкнутой атмосфере значений, причем максимальное завышение рассчитанного pCO2 наблюдается в кислых, содержащих органическое вещество, водах. Работы, связанные с оценкой неопределенностей данного метода, показали интересные результаты [45]. Несмотря на низкую величину случайных эмпирических ошибок входных измеряемых параметров (pH, растворенный неорганический углерод, щелочность и температура), результирующая ошибка расчетной величины рСО2 независимо от набора параметров приближалась в ряде случаев к 30%. Все комбинации параметров при сравнении с прямыми измерениями pCO2 давали смещенные оценки, при этом менее одной трети общей неопределенности объяснялось случайными ошибками, то есть систематическая неопределенность в данном методе преобладает и является очень существенной. Сейчас появляется много работ, в которых авторы пытаются снизить расчетную ошибку. На наш взгляд, это сильно “утяжеляет” расчеты и не является перспективным. Большинство авторов склоняются к необходимости прямых измерений.
Метод выравнивая (уравновешивания) концентраций “equilibration technique”. Поскольку все типы газоанализаторов определяют концентрацию компонента в газовой фазе, газ, растворенный в воде, предварительно необходимо привести в равновесие с искусственно созданным “свободным пространством”. Измерения парциального давления CO2 в равновесной атмосфере над раствором на основе данной методики обычно состоят из трех этапов: 1 – уравновешивание СО2 между пробой жидкости и воздухом фиксированного объема; 2 – измерение концентрации газа в пробе воздуха из “свободного пространства” либо с помощью газовой хроматографии (в лабораторных условиях), либо с помощью инфракрасной спектроскопии (может применяться в полевых условиях); 3 – дополнительные расчеты для преобразования концентраций газа, измеренных анализатором, в pCO2 с поправкой на температуру и давление [121]. Все варианты методов можно сгруппировать в три категории: ручное уравновешивание в свободном пространстве, уравновешивание с помощью специальных устройств-эквилибраторов и уравновешивание непосредственно около датчиков, защищенных мембраной (рис. 3).
Рис. 3.
Схематические диаграммы четырех методов уравновешивания: а – “ручное” уравновешивание, b – эквилибратор со стеклянными шариками, c – эквилибратор распылительного типа, d – датчик, защищенный мембраной [121]. IRG-A – инфракрасный газоанализатор, GC – газовый хроматограф.
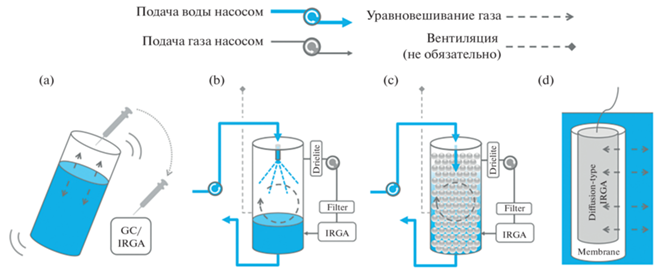
Существует множество модификаций данных методов, например, может быть ручной или автоматический отбор проб воды и воздуха, активная или пассивная подача газа к детектору и др. Отметим лишь некоторые особенности ряда методов. В некоторых работах показана возможность использования инфракрасных датчиков CO2 (например, Vaisala GMT220) под водой, при условии защиты водонепроницаемой, но газопроницаемой мембраной [61]. Существуют две модификации этих датчиков: для низких и высоких концентраций СО2. Этот метод находит применение [41, 58, 72, 82, 87, 99], но в силу высокой стоимости измерительного оборудования, как отмечают исследователи, приходится жертвовать информацией о пространственной изменчивости [23]. Существуют некоторые неопределенности с использованием оборудования данного типа: неизвестно точное время пассивного уравновешивания газовой фазы с жидкой, возможны процессы биообрастания на мембране, которые могут привести как к завышению, так и занижению результатов [121].
Существуют вариации “активных” мембранных дегазаторов (3M™ Liqui-Cel™), в которых используется микропористая или непористая полупроницаемая мембрана из полых волокон, которая помещается внутрь корпуса контактора. В них жидкость обтекает наружную часть половолоконной мембраны, в то время как внутри половолокна создают вакуум и/или в него подают продувочный газ. Создание вакуума или подача продувочного газа создают разницу в уровнях концентрации газа внутри (со стороны просвета) и снаружи (со стороны оболочки) половолоконной мембраны. Эта разница концентраций обеспечивает быструю и эффективную передачу растворенного газа [75, 97, 108].
Используются также методы с активной подачей воды: со стеклянными шариками или распылительного типа, при которых вода прокачивается через мембранный контактор, в котором СО2 уравновешивается между водой и воздухом и переносится в подключенный анализатор [42].
Предложена система на основе автоматического пассивного датчика, не заключенного в мембрану, который помещается в воздушное пространство плавающей камеры без контакта с водой для непрерывного определения концентрации CO2 в воздухе, находящегося в равновесии с водой [23].
Но, как видно из табл. 1, наиболее часто применяется метод с “ручным” уравновешиванием, иногда его еще называют “шприцевым” методом или просто метод “уравновешивания свободного пространства”. Метод удобен, особенно в полевых условиях, так как не зависит от сложного оборудования и дает надежные результаты [70]. В связи с этим он широко используется в гидрологических и лимнологических исследованиях. Метод заключается в отборе пробы воды в сосуд или шприц и замещении части пространства над водой газом с известной концентрацией СО2. Затем шприц энергично встряхивается, дается время для уравновешивания, отбирается проба газа с последующим измерением концентрации СО2 [50]. Модификаций данного метода очень много (табл. 2), связаны они с варьированием объемов газовой и жидкой фаз, временем встряхивания и уравновешивания, замещающим газом, добавлением консервантов. Существенным недостатком, на наш взгляд, является отсутствие единой методики.
Таблица 2.
Модификации метода “уравновешивания свободного пространства”
| Замещающий газ | Соотношение проба воды/свободное пространство | Встряхивание/отстаивание, мин | Окончание | Особенность | Ссылка |
|---|---|---|---|---|---|
| Азот | 135/10 | Не указано | Лаборатория, хроматограф | KCl (подавление микробиологической деятельности) | [48, 64] |
| Воздух | Не указано, “известный объем” | 5/0 | Лаборатория, хроматограф | Нет | [21] |
| Азот | 40% свободного пространства, 60% воды приблизительно | Не указано | Лаборатория, хроматограф | 0.2 мл насыщенного HgCl2 для подавления микробиологической деятельности | [92] |
| Или воздух над водой или газ без СО2 | 20/40 | 1/0 (сразу отбор пробы) | Лаборатория, хроматограф | Встряхивание под водой для стабильной температуры | [38, 47] |
| Воздух | 20/40 | 1/0 (не уточнено, сразу отбор пробы) | Лаборатория, хроматограф | Нет | [24, 52, 54, 71] |
| Гелий | 250/50 | 1/1 | Лаборатория, хроматограф | Нет | [62] |
| Азот | 5/17.5 | Не указано (хранились в темноте не дольше недели во флаконах) | Лаборатория, хроматограф | Подкислено 0.1 мл 85% H3PO4 для перевода в СО2 | [115] |
| Азот | 30/30 | Не указано | Лаборатория, хроматограф | Проба пропускалась через 0.45 мкм фильтр | [103] |
| Воздух | 940/60 | 3/не указано | Лаборатория, хроматограф | Полипропиленовая бутыль с трехходовым люэровским краном | [107] |
| Воздух | 1150/50 | 1/0 (указано, что это время в 2 раза превышает необходимое для уравновешивания) | Поле, портативный инфракрасный газоанализатор (Ppsystem) | Нет | [89] |
| Воздух | 30/30 ручьи, 10/50 почвенные воды | 2/0 | Поле, портативный ИРГА (Ppsystem) | Нет | [91] |
| Воздух | 1980/20 | 3/0 | Лаборатория, хроматограф | Малый объем свободного пространства – отсутствует влияние рН на равновесие | [78] |
| Воздух | 160/60 | 1/0 | Лаборатория, хроматограф | Встряхивание под водой для стабильной температуры | [87] |
| Воздух | 30/30 | 1/0 | Лаборатория, хроматограф | Нет | [33] |
| Воздух | 30/30 | 1/1 | Поле, портативный инфракрасный газоанализатор (Ppsystem) | Нет | [44] |
В англоязычной литературе опубликованы документы и протоколы расчетов, в которых этот метод применяется для анализа концентрации растворенного CO2 в пресных водах [47, 74, 112]. Однако принцип расчетов рCO2 в них после процедуры уравновешения напрямую перенесен из расчетов для других газов, в частности метана, без учета того, что растворенный CO2 находится в динамическом химическом равновесии с карбонатами и гидрокарбонатами. Данный процесс подробно описан, особенно в исследованиях морских вод [37], однако практическая оценка систематической ошибки при расчетах до недавнего времени отсутствовала [70]. Считалась, что этот эффект невелик. Возможно, данное допущение делалось как раз в исследованиях соленых вод, где особое внимание в расчетах уделялось минерализации воды, как основному фактору, влияющему на растворимость СО2. При этом методика “headspace equilibration” применялась изначально в варианте “бесконечно малый объем газовой фазы и бесконечно большой объем жидкой”, при котором влияние химических взаимодействий минимизировалось. Единственная работа, которую удалось найти, где количественно оценивается ошибка, связанная с простым применением закона Генри к данным о концентрации CO2 в “свободном пространстве”, это исследование Кошоррек с соавт. [70]. В нем показано, что метод можно использовать без корректировки на щелочность для большинства бореальных вод (ошибка <5%), где pH < 7.5 или pCO2 > 1000 мкатм. Бо́льшие ошибки могут возникать для недонасыщенных по отношению к СО2 водам (эвтрофные экосистемы), а также для проб с высокой щелочностью. Величину погрешности, по утверждению авторов, можно уменьшить, увеличив соотношение воды и свободного пространства, снизив температуру уравновешивания, а также используя воздух вместо N2 в качестве свободного пространства. Также оценить ошибку или скорректировать данные можно по представленным в работе диаграммам [70].
НЕОРГАНИЧЕСКИЙ УГЛЕРОД В ВОДАХ БОРЕАЛЬНЫХ И АРКТИЧЕСКИХ РЕГИОНОВ
Выбор региона для обсуждения источников, величин, драйверов РНУ в природных водах, не случаен. Во-первых, большая часть Российской Федерации находится в этой области. Во-вторых, данные области характеризуются большой площадью водных угодий. В-третьих, сфера научных интересов авторов данного обобщения – это север Западной Сибири. Еще одна из причин – повышенное внимание к данным регионам в связи с глобальным потеплением и связанными с ним деградацией многолетнемерзлых пород (ММП), высвобождением захороненного органического углерода и возможным повышением эмиссионного потока парниковых газов. При этом, как сказано выше, роль внутренних вод, особенно небольших водоемов, малых водотоков, водно-болотных угодий, которые занимают обширные площади, оценена явно недостаточно [100].
Прежде всего, следует отметить, что пересыщенность вод, особенно озерных, СО2 признана неоспоримым фактом для бореальных окрашенных гумусовых вод [76, 82, 111, 119]. В региональном масштабе, по мере увеличения среднегодовых температур воздуха, насыщенность вод растет [102, 120], а по мере продвижения от верховий (водосбора) к водотокам более высокого порядка, уменьшается, что показано в немногочисленных исследованиях сопряженных ландшафтов [53, 108]. Отмечено, что в верховьях водосборов (ручьи) сезонные колебания в концентрации растворенного СО2 коррелировали с колебаниями концентраций в почвенных грунтовых водах. Данная связь уменьшалась вниз по течению, где концентрация в большей степени определялась величиной речного стока [54]. Некоторыми авторами, помимо летнего пика концентрации РНУ, отмечается существенное ее возрастание подо льдом и связанные с этим интенсивные весенние выбросы газообразного СО2 [30, 43, 66, 87].
Географический охват работ, в которых представлена оценка содержания СО2 в природных водах бореальных, субарктических и арктических регионов закономерно включает Россию (Западная и Восточная Сибирь), Финляндию, Швецию, США (Аляска, северный Висконсин), Канаду (табл. 3). Мы собрали данные по величинам концентраций СО2 в тех единицах, в которых они были представлены авторами, сгруппировав по типам исследованных вод. Наибольшее число работ связано с озерами разного размера и происхождения, далее следуют гидрологические исследования рек, в основном крупных. Небольшие водотоки исследуются гораздо реже. Наименьшее количество работ связано с исследованием болотных, почвенных, грунтовых вод (с точки зрения концентрации в них СО2). Работ, в которых исследовали гидрологически сопряженные ландшафты, крайне мало.
Таблица 3.
Содержание растворенного СО2 в природных водах бореальных и арктических регионов
| Тип вод | Регион, объект | Содержание СО2* | Уточнение | Ссылка |
|---|---|---|---|---|
| Почвенные, надмерзлотные, болотные воды | Надмерзлотные воды, Западная Сибирь (криолитозона), Россия | 447 мкмоль/л | Среднее по региону для мочажин | [92] |
| Почвенные воды, Квебек, Канада | ≈4000 мкатм | Среднее | [91] | |
| Канада (окрестности Оттавы), болото и вытекающие ручьи | 3200 мкатм (2.1 мг C/л) – 9320 мкатм (7.8 мг C/л) | Диапазон | [24] | |
| Озера большие, малые, термокарстовые | Средняя тайга и лесотундра, Западная Сибирь, Россия | 22–160 мкМ | Диапазон | [95] |
| Северный Висконсин, США, 27 озер | 108–1348 мкатм | Диапазон | [52] | |
| Озера, Финляндия | 5.26–6.0 мг С–СО2/л | Предельные величины для двух озер | [41] | |
| Канада, Квебек, открытые водоемы бореальных торфяников | От 0.50 (±0.13) до 0.99 (±0.50) мг/л С–СО2 | Среднее ± стандартное октлонение от больших к малым озерам | [87] | |
| Бореальные озера, Канада (Квебек) | 687; 606 мкатм | Среднее, медиана | [75] | |
| По всем изученным озерам Швеции во все сезоны | 1762 ± 111 мкатм | Среднее ± стандартное отклонение | [89] | |
| Озера (78) Квебека (Канада) | 631 ± 222 мкатм, от 340 до 2400 мкатм | Среднее и диапазон за 3 года | [97] | |
| Канада, термокарсты в арктической/ субарктической зонах | 30 ± 15/–1 ± 32 мкмоль/л | Среднее превышение над концетрацией, равновесной с атмосферной (19.5 мкмоль/л) | [78] | |
| Северо-восточная Шотландия | 6.8 (0–23) мг/л | Средняя по ручьям и речкам в водосборе | [54] | |
| Восточная Сибирь, Россия, олиготрофная тундра, бассейн р. Индигирки | Термокарстовые озера – 0.24–0.85 мг/л; малые озера – 0.42–0.77 мг/л; запруды (ponds) – 1.42–16.02 мг/л | Диапазон | [33] | |
| 439 Швецких озер | 67 ± 36 мкмоль/л | Среднее ± стандартное отклонение | [65] | |
| Реки (+ручьи), Квебек, Канада | 1718 ± 138 мкатм | Среднее | [91] | |
| Реки | Север Швеции, субарктика, водотоки | 2–7 мг/л | По графику, диапазон | [44] |
| Восточная Сибирь, Россия, олиготрофная тундра, бассейн р. Индигирки, малые водотоки | 0.82–7.25 мг/л | Диапазон | [33] | |
| Русло р. Оби на всем протяжении | 2324.2 ± 814.4 мкатм (мерзлотная зона), 1054.9 ± 691.4 мкатм (безмерзлотная зона) | Среднее ± стандартное отклонение | [11] | |
| Швеция, верховья суббореальных рек | 1.9 (1.0–3.5) мг/л С–СО2 | Медиана и диапазон 10–90% | [115] | |
| Колыма и притоки, Россия | Водотоки 3336 ± 2737 мкатм; реки-притоки 412 ± 250 мкатм; Колыма, основное русло 613 ± ± 315 мкатм | Среднее ± стандартное отклонение | [35] | |
| Юкон река, США | 68 мкмоль/л | Среднее превышение над атмосферной концентрацией | [104] | |
| Юкон притоки, США | 100 мкмоль/л | Среднее | [104] |
Сильно затрудняет сравнение данных представление их в разных единицах: в величинах парциального давления, мольных концентрациях, иногда используют величины превышения концентрации или давления над равновесными с атмосферным воздухом. Несмотря на вариабельность представленных данных, очевидно, что максимальные концентрации СО2 наблюдаются в болотных и почвенных водах. Что касается озер, водотоков и рек, какую-либо закономерность выделить трудно: есть озера, которые характеризуются высокими концентрациями (пересыщенные по СО2), есть которые недонасыщены по СО2. В реках также наблюдается большой разброс концентраций, связанный как с величиной стока, так и удаленностью от ландшафтов-реципиентов.
На основе литературных данных попытались выявить основные факторы, определяющие концентрацию и связанный с ней поток диоксида углерода в природных водах бореальных и арктических областей. В большинстве рассмотренных работ авторы пытаются найти связь между концентрацией СО2 и содержанием растворенного органического углерода (РОУ), как наиболее очевидного предиктора. В результате удалось обнаружить все варианты (оценку проводили по коэффициенту детерминации регрессионных моделей, R2): отсутствие связи [78], слабую положительную связь [34, 51, 57, 69, 75], сильную положительную связь [58, 64, 73, 77, 89, 97, 101]. Авторы последних обзорных работ, в которых подробно рассматривается связь РОУ–рСО2, в частности в озерах, склоняются к заключению, что она различна для разных регионов (различаются сила связи, наклон кривых аппроксимации и др.) [77]. Некоторые авторы отмечают, что РОУ может оказывать косвенное влияние на растворенный CO2 через температуру, доступность света и структуру водной толщи [78].
В качестве значимых предикторов величины концентрации СО2 в водах указываются площадь озер [49, 52, 75, 80, 100], величина речного стока [54, 55], содержание питательных элементов, в частности, фосфора [75], содержание хлорофилла [88, 97], содержание кислорода [64]. Отмечается также влияние характеристик водосборного бассейна, таких как его площадь, высота над уровнем моря, тип землепользования, характер почвенного покрова, материнская порода и др.
Интересный факт обнаружен лимнологами из США и Швеции, которые проанализировали данные по пяти тысячам озер всего мира [102]. Не выявлено связи между концентрацией СО2 в водах и температурой, как среднегодовой, так и температурой, при которой проводились измерения. Данные результаты свидетельствуют о том, что невозможно дать однозначный прогноз по эмитирующей роли водных объектов при возможных климатических изменениях.
В современных работах по моделированию рСО2 в озерах показано, что даже при схожем наборе факторов, на нее влияющих, результирующие модели для разных регионов будут существенно различаться. В связи с этим, экстраполяция моделей, созданных для одного региона на новый регион исследования маловероятна без существенной корректировки. Связано это с крупномасштабными региональными различиями в транспорте углерода, качестве РОУ и процессах его преобразования, которые еще предстоит оценить [77, 97].
ЗАКЛЮЧЕНИЕ
В заключении хотелось бы отметить несколько направлений на которые следует обратить внимание при изучении круговорота углерода в северных экосистемах и роли в нем природных вод. На сегодняшний день большинство исследований, в которых отмечается роль CO2 почвенного происхождения в динамике его концентрации в водотоках, основаны на косвенных доказательствах [91]. Существует лишь несколько эмпирических исследований, которые подтверждают данное предположение [31, 55], но полностью количественно оценить его лишь предстоит.
Для экосистем, функционирующих при участии ММП, одним из актуальных вопросов является происхождение высвобождающегося из водных систем СО2. В последних работах, основанных на изотопных методах, показано, что >80% всего углерода во внутренних водах в криогенных экосистемах имело современный возраст. Лишь на участках, где наблюдалась существенная деградация ММП, доля “древнего” углерода составляла >50%. При этом РНУ (CO2 и CH4) был моложе, чем РОУ [33].
На общем фоне явного преобладания водных экосистем, выступающих источником диоксида углерода в атмосферу, обнаружено, что ряд арктических озер в летний период выступают как поглотители СО2 [107]. Природа данного явления оказалась не очень понятна, с учетом того, что данные озера содержали высокие концентрации РОУ. Изучение таких нестандартных объектов может пролить свет на причинно-следственные связи в геохимии углерода в арктических системах.
В последних обобщающих работах указывается на необходимость изучать гидрологический континуум: от источника (наземные экосистемы) до крупных рек и озер с особым вниманием на включение СО2 из подземных вод в бюджет углерода всего водосбора [40, 43]. В современных работах данный континуум в основном разбит на отдельные поля исследований, занятые почвоведами, гидрологами, лимнологами и океанологами. Разрозненность таких исследований можно проследить по выходным данным литературы, используемой в данном обобщении. Совместные исследования наземных и водных экосистем необходимы, прежде всего, для понимания современного цикла углерода и его реакции на изменение климата [63]. Считаем, что роль специалистов-почвоведов в данной области должна быть усилена.
