Журнал прикладной химии. 2019. Т. 92. Вып. 1
НЕОРГАНИЧЕСКИЙ СИНТЕЗ И ТЕХНОЛОГИЯ НЕОРГАНИЧЕСКИХ ПРОИЗВОДСТВ
УДК 54.057, 546.72, 546.56, 54-31
ИССЛЕДОВАНИЕ МЕДЬ-ЖЕЛЕЗО СМЕШАННОГО ОКСИДА
СО СТРУКТУРОЙ КУБИЧЕСКОЙ ШПИНЕЛИ,
СИНТЕЗИРОВАННОГО МЕТОДОМ ГОРЕНИЯ
© В. И. Симагина1,2, О. В. Комова1*, Г. В. Одегова1, О. В. Нецкина1,
О. А. Булавченко1, А. А. Почтарь1, Н. Л. Кайль1
1 Институт катализа им. Г. К. Борескова СО РАН, Новосибирск
2 Сибирский институт управления - филиал Российской академии народного хозяйства
и государственной службы при Президенте РФ, Новосибирск
* E-mail: komova@catalysis.ru
Поступила в Редакцию 29 июня 2018 г.
После доработки 15 октября 2018 г.
Принята к публикации 23 октября 2018 г.
Интерес к работам по синтезу и исследованию свойств сложных оксидов обусловлен их широким
использованием в различных областях материаловедения и катализа. В данной работе в режиме
горения при локальном инициировании глицин-нитратного предшественника, спрессованного в таб-
летку, синтезирован медь-железо смешанный оксид структуры кубической шпинели. Получен новый
результат о положительном влиянии добавления аммиака в состав предшественника, что привело к
снижению скорости его горения и увеличению содержания шпинели с 34 до 80% без дополнительной
стадии высокотемпературного прокаливания. В ходе проведенного исследования (рентгенофазовый
анализ, дифференцирующее растворение, инфракрасная спектроскопия НПВО, включая ближнюю ИК
область) установлена стехиометрия меди и железа в фазе феррита меди, определено ее содержание
в продукте горения, обсуждается влияние восстановительных условий, реализующихся в зоне горения,
на характеристики формирующегося продукта.
Ключевые слова: СВС, глицин-нитратное горение, феррит меди, шпинель, стехиометрия.
DOI: 10.1134/S0044461819010031
Феррит меди — смешанный оксид структуры об-
позволяющего получать водород при температуре
ращенной шпинели [1], который нашел применение
окружающей среды, что актуально для создания раз-
в различных областях. Прежде всего следует отме-
личных зарядных устройств и источников питания
тить интерес к нему со стороны материаловедения
на основе низкотемпературных топливных элементов
в силу его высокопроводящих и магнитных свойств
с протонообменной мембраной [4]. Отметим, что
[2]. Анализ литературы показывает, что он успешно
керамический способ синтеза этого соединения энер-
применяется как катализатор разнообразных про-
гозатратен и осуществляется в течение длительного
цессов, где среди новых направлений следует от-
времени. Данным способом получить однофазное
метить фотокатализ под действием видимого света
соединение практически невозможно [5].
[3]. Интересным является его недавнее применение
Среди альтернативных способов получения вы-
в качестве катализатора процесса гидролиза NaBH4, сокодисперсных фаз сложных оксидов, в том числе
24
Исследование медь-железо смешанного оксида со структурой кубической шпинели, синтезированного методом горения
25
и феррита меди, можно выделить метод горения ор-
подтвердить без дополнительных исследований, по-
ганометаллических предшественников, в основе ко-
скольку Fe3O4 и Cu1-xFe2+xO4 обладают структурой
торого лежит экзотермическая окислительно-восста-
шпинели и близкими параметрами решетки. Кроме
новительная реакция [6-8]. Данный метод отличается
того, достаточно редко обсуждается возможность
простотой, доступностью и универсальностью. Его
восстановления образующейся оксидной фазы в зоне
широко и успешно используют для синтеза различ-
горения продуктами неполного окисления органиче-
ных соединений [9-13]. В отличие от многочасово-
ского компонента.
го прокаливания в муфельной печи стадия горения
В опубликованных ранее работах было показано,
предшественника может осуществляться за секунды.
что использование режима автоволнового горения
Традиционно предшественники готовят путем рас-
высушенного и спрессованного в таблетку глицин-ни-
творения нитратов металлов и органического компо-
тратного предшественника более эффективно по
нента (ОК) (лимонная кислота, крахмал, мочевина,
сравнению с режимом объемного горения для синте-
глицин и др.) в минимальном количестве воды. Далее
за фаз сложных оксидов (La2CuO4 [19], LaFeO3 [20],
водный раствор компонентов упаривают до состо-
LaCrO3 [21]). Отметим, что этот режим является бо-
яния вязкого геля (предшественника), дальнейший
лее управляемым, так как горение предшественника
нагрев которого в оптимальных условиях приводит к
в этом случае инициируется кратковременным внеш-
самопроизвольному воспламенению с образованием
ним тепловым воздействием [7]. За счет локализации
большого количества газа и рыхлого высокодисперс-
процесса в узкой зоне и эффективной передачи тепла,
ного продукта горения. Такой режим горения относят
выделяемого в зоне реакции, к последующему холод-
к тепловому взрыву или объемному горению [6, 7,
ному слою предшественника, далее вступающему в
14]. Его недостатком является плохая управляемость
реакцию, наблюдается достижение более высоких
процесса, поскольку горение начинается внезапно,
температур. Это обеспечивало формирование хорошо
достаточно часто взрывообразно, сопровождается
окристаллизованной и чистой фазы сложного оксида
разбросом формирующегося продукта. Сушка геля
без дополнительной стадии высокотемпературного
предпочтительна, поскольку в присутствии воды на-
прокаливания. Автоволновой режим горения органо-
блюдается снижение температуры в зоне горения, так
металлического предшественника, сопровождающий-
как энергия системы окислитель-топливо тратится на
ся выделением большого количества газа, достаточно
ее испарение и нагрев [7, 14].
редко применяется, и его возможности мало изучены.
Анализ литературы показывает, что для синте-
В этой работе представлены новые данные об ис-
за CuFe2O4 используют органические компоненты
пользовании горения высушенных глицин-нитратных
различной природы, варьируют условия приготов-
предшественников, предварительно спрессованных
ления предшественника, его горения/разложения, а
в таблетки, для синтеза медь-железо смешанного
также температуру дополнительного прокаливания
оксида структуры кубической шпинели. Особое вни-
образующегося продукта. Данные рентгенофазового
мание уделено влиянию добавления водного раствора
анализа (РФА) образцов феррита меди, полученных
аммиака при приготовлении предшественника на его
из предшественников на основе лимонной кислоты,
свойства, характер окислительно-восстановительной
этиленгликоля, мочевины и глицина, представлены
деструкции, а также фазовый состав образующего-
в табл. 1, в зависимости от метода получения может
ся продукта горения и стехиометрию фазы феррита
сформироваться CuFe2O4 как тетрагональной (т),
меди.
так и кубической (к) структуры шпинели. В литера-
туре также имеется информация о применении для
Экспериментальная часть
синтеза феррита меди желатина [15], крахмала [16,
17], дизельного топлива совместно с моноолеатом
Приготовление глицин-нитратных предшествен-
сорбитана [18] и меда [2]. Видно, что характеристики
ников и модельных соединений. Использовали сле-
образующегося кристаллического продукта зависят
дующие реактивы: Cu(NO3)2∙2.5Н2О — 98 мас%
от условий синтеза (табл. 1). При этом природа орга-
(Sigma-Aldrich, CAS 19004-19-4); Fe(NO3)3∙9Н2О —
нического топлива, соотношение топливо/нитраты,
«чистый» (ОАО УЗХР, ГОСТ 4111-74); глицин
условия подготовки предшественника и режим его
С2H5O2N — «чистый» (ООО Спектр-Хим, ГОСТ
горения влияют на достигаемую температуру в зоне
5860-75); аммиак водный — ос.ч. (ЗАО База № 1
реакции и определяют фазовый состав образующего-
Химреактивов, ГОСТ 24147-80); NH4NO3 — ч.д.а.
ся продукта. Но, к сожалению, стехиометрию куби-
(ООО Промхимкомплект, ГОСТ 22867-77), HNO3 —
ческой шпинели CuFe2O4 методом РФА невозможно
ос.ч. 18-4 (ГОСТ 11125-84), HClO4 — х.ч. (ЗАО Век-
26
Симагина В. И. и др.
Таблица 1
Приготовление CuFe2O4 методом горения
Дополнительное
Органический
ОК/NO3,
Описание
прокаливание,
Данные РФА
компонент
моль
°С
Лимонная кислота [22]
Нагрев высушенного геля
0.34
200
CuFe2O4(к) (9 нм)
Лимонная кислота [23]
Прокаливание высушенного
0.38
150
CuFe2O4 (10 нм)
геля
400
CuFe2O4 (10 нм)
700
CuFe2O4(т) (30 нм)
Этиленгликоль [24]
Интенсивное кипение раствора
6.15
—
CuFe2O4(к) (10 нм)
на основе 0.1 М HNO3 с вос-
пламенением при 300°С
Этиленгликоль [24]
Прокаливание высушенного
6.15
700
CuFe2O4(т) + CuO + Fe2O3
геля
1100
CuFe2O4(т) (40 нм)
Мочевина [25]
Нагрев раствора, воспламене-
0.83
700
CuFe2O4(т) + Fe2O3
ние при 300°С
1000
CuFe2O4(т)
Мочевина [26]
Нагрев раствора, воспламене-
0.83
500
CuFe2O4(т) (98 нм)
ние при 300°С
800
CuFe2O4(т) (110 нм)
900
CuFe2O4(т) (155 нм)
1000
CuFe2O4(т) (191 нм)
Мочевина [27]
Нагрев раствора, воспламене-
0.83
—
CuFe2O4(к) (8 нм)
ние при 500°С
Мочевина [28]
Нагрев раствора, воспламене-
0.13
—
CuFe2O4(к) (26 нм)
ние при 250°С
700
CuFe2O4(т) (37 нм)
800
CuFe2O4(т) (34 нм)
900
CuFe2O4(т) (40 нм)
Глицин [29]
Нагрев растертой смеси реа-
0.67
—
CuFe2O4(к) (34 нм) + CuO
гентов при 300°С
1.33
—
CuFe2O4(к) (40 нм) + CuO
2.00
—
CuFe2O4(к)
2.67
—
CuFe2O4(к) (37 нм) +
+ CuFe2O4(т)
Глицин [30]
Прокаливание растертой и вы-
0.56
800
CuFe2O4(т) (24 нм)+CuO +
сушенной смеси реагентов
+ Fe2O3
Глицин [31]
Нагрев раствора, воспламене-
1; 1.48
800
CuFe2O4 + CuO + Fe2O3
ние
1; 1.48
1000
CuFe2O4 + CuO
2
800
CuFe2O4
2
1000
CuFe2O4
Глицин [28]
Нагрев раствора, воспламене-
0.13
—
CuFe2O4(к) (13 нм)
ние при 250°С
500
CuFe2O4(т) (36 нм)
700
CuFe2O4(т) (39 нм)
800
CuFe2O4(т) (37 нм)
900
CuFe2O4(т) (39 нм)
Глицин [32]
Нагрев высушенного геля
1.4
200
CuFeO2 + CuO + Fe2O3
1.7
200
CuFeO2
1.9
200
CuFeO2 + Cu + Fe3O4
Исследование медь-железо смешанного оксида со структурой кубической шпинели, синтезированного методом горения
27
тон, ТУ 6-09-2878), Fe(ClO4)3·9H2O (Sigma-Aldrich,
ленный процесс испарения, после чего наблюдали
CAS 15201-61-3), FeSO4·7H2O — х.ч. (ЗАО Союз-
выпадение мелких игольчатых рыжих кристаллов.
ХимПром, ГОСТ 4148-78), FeCl3·6H2O — «чистый»
Осадок отфильтровывали и отмывали сухим эфиром
(ЗАО СоюзХимПром, ГОСТ 4147-74), α-Fe2O3 —
на стеклянном фильтре. Сушка осуществлялась в
NANOCAT®Superfine (MACH I Inc.).
вакуумном шкафу без нагрева в течение 4 ч. Полу-
Для приготовления предшественника CuFeGly
ченный образец хранили в эксикаторе. Сравнение ИК
предварительно в стеклянном стакане готовили вод-
спектра этого образца с литературными данными [33,
ный раствор требуемых количеств исходных реаген-
34] свидетельствует о том, что синтезированное со-
тов [1.165 г Cu(NO3)2∙2.5Н2О, 4.04 г Fe(NO3)3∙9Н2О,
единение является [Fe3O(Gly)6(H2O)3](ClO4)7·3H2O.
1.875 г глицина (Gly)] в 10 мл воды, который переме-
Образцы Fe3O4 готовили по традиционной ме-
шивали при комнатной температуре в течение 15 мин.
тодике осаждением. Для удаления примеси кисло-
Мольное отношение Gly/NO3 = 0.63. Показатель рН
рода дистиллированную воду продували аргоном.
раствора, измеренный рН-метром Анион 4100 (НПП
В трехгорлую колбу (500 мл) перенесли навески со-
Инфраспак-Аналит, Россия), составил 0.9. Далее по-
лей: 2.8 г FeSO4·7H2O и 5.4 г FeCl3·6H2O в случае
лученный раствор компонентов грели на магнитной
Fe3+/Fe2+ = 2 (образец Fe3O4-I); 1.4 г FeSO4·7H2O и
мешалке с постоянным перемешиванием в течение
3.7 г FeCl3·6H2O в случае Fe3+/Fe2+ = 2.7 (образец
2 ч, поддерживая температуру в растворе 60°C, в ре-
Fe3O4-II), добавили 150 мл подготовленной воды.
зультате чего формировался вязкий гель. Процедура
Включили продувку аргоном при перемешивании,
приготовления предшественника CuFeGly(NH3) ана-
затем внесли в колбу 1 мл олеиновой кислоты и 10 мл
логичная, отличием являлось добавление по каплям в
28%-ного раствора аммиака. Образовался черный
раствор нитратов металлов и глицина 1.9 мл водного
коллоид, который нагревали при 40°С в течение
раствора аммиака (ρ = 0.908 г·мл-1), что соответ-
30 мин. Полученный образец промыли 3 раза водой,
ствовало мольному отношению Gly/NH3 = 1. В этом
затем спиртом и ацетоном, сушили на воздухе. Рент-
случае рН водного раствора компонентов составил
генофазовый анализ подтвердил структуру кубиче-
2.9. Образцы гелеобразных предшественников досу-
ской шпинели этих образцов, размеры ОКР составили
шивали в вакуумном шкафу в течение 2 ч при тем-
110 Å.
пературе 60°С. Такая температура термообработки
Приготовление медь-железо смешанных окси-
предшественников была выбрана для того, чтобы ис-
дов методом горения. Горение высушенных пред-
ключить окислительно-восстановительные превраще-
шественников [CuFeGly, CuFeGly(NH3)] проводили
ния на этой стадии. Высушенные образцы измельчали
следующим образом: порошок навеской 600 мг пред-
в агатовой ступке до состояния порошка, который
варительно прессовали в таблетку диаметром 12 мм и
хранили в эксикаторе над P2О5. Методом атомно-
толщиной ~4 мм с помощью лабораторного настоль-
эмиccионной спектрометрии с индуктивно связан-
ного гидравлического пресса ПГР-10 (ООО ЛабТулc,
ной плазмой (АЭС-ИСП), выполненным на прибо-
Россия) под давлением 70 бар, затем горение таблетки
ре Optima 4300 DV (Perkin Elmer, США), показано,
инициировали в течение ~2 с с помощью бытовой
что мольное отношение Fe/Cu в образцах CuFeGly и
пропан-бутановой зажигалки, после чего источник
CuFeGly(NH3) составило 2.19 и 2.24 соответственно.
нагрева убирали и наблюдали образование увеличи-
Образцы, обозначенные как GlyNН4NO3 и
вающихся в длине черных рыхлых «змеек» продуктов
GlyHNO3, были синтезированы в качестве соедине-
горения. Скорость горения таблетки определяли сле-
ний сравнения (для анализа ИК спектров предше-
дующим образом: измеряли общее время ее сгорания
ственников): водные растворы глицина и NН4NO3
секундомером (после короткого процесса иниции-
(либо HNO3) смешивали в мольном соотношении
рования). Рассчитывали массовую скорость горения
1:1. В остальном синтез аналогичен синтезу пред-
(мг·с-1). Полученные значения усредняли, различия
шественников.
между ними в одной серии экспериментов не пре-
Комплексное соединение [Fe3O(Gly)6(H2O)3] ×
вышали 10 отн%. Продукты [CuFe-Ign из CuFeGly,
× (ClO4)7·3H2O (шифр FeGlyClO4) было приготовле-
CuFe(NH3)-Ign из CuFeGly(NH3)], получаемые в ходе
но по методике, адаптированной из [33, 34]. Готовили
горения отдельных таблеток, усредняли перемешива-
раствор перхлората железа (0.005 моль в 80 мл) и
нием и изучали рядом физико-химических методов.
водный раствор глицина (0.01 моль в 4 мл). Смеши-
Исследование образцов физическими методами.
вали их в химическом стакане, добавляли по каплям
Инфракрасную спектроскопию нарушенного полного
(0.4 мл) 61% HClO4, стакан накрывали калькой и
внутреннего отражения (ИК НПВО) проводили на
нагревали в течение 12 ч при 40°С, обеспечив мед-
спектрометре Agilent Cary 600 (Agilent Technologies,
28
Симагина В. И. и др.
США), оснащенном приставкой Gladi ATR (PIKE
стехиографического титрования. Проточный дина-
Technologies, США), в диапазоне 250-10 000 см-1 без
мический режим начинали с водного раствора HCl
дополнительной подготовки образцов.
(pH 2), постепенно переходили к 1.2 М HCl, 3 М HCl,
Термический анализ соединений выполняли на
затем к 6 М HCl. Растворение проводили при по-
установке Netzsch STA 449 С Jupiter, оснащенной дер-
степенном повышении температуры от 20 до 80°С.
жателем ДТА/ТГ, в интервале температур 20-1000°С
Поток образующегося раствора пробы направляли
в токе He. Скорость нагрева образцов составляла
в детектор-анализатор стехиографа АЭС-ИСП. Эле-
10 град·мин-1, навески образцов — 10 мг.
ментный состав потока определяли каждые 5 с по
Рентгенофазовый анализ (РФА) был выполнен на
спектральным линиям элементов (нм): Cu 324.7, Fe
дифрактометре Bruker D8 Advance (Германия) в ин-
238.2. Эти линии выбраны с учетом отсутствия их
тервале углов 10-80° с шагом по 2θ 0.05° при времени
спектрального наложения.
накопления 3 с в каждой точке с применением линей-
ного детектора Lynxeye. Использовалось монохро-
Обсуждение результатов
матизорованное CuKα-излучение (λ = 1.5418 Å). Был
проведен количественный фазовый анализ методом
Исследование предшественников методом ИК
Ритвельда и уточнены параметры решетки соеди-
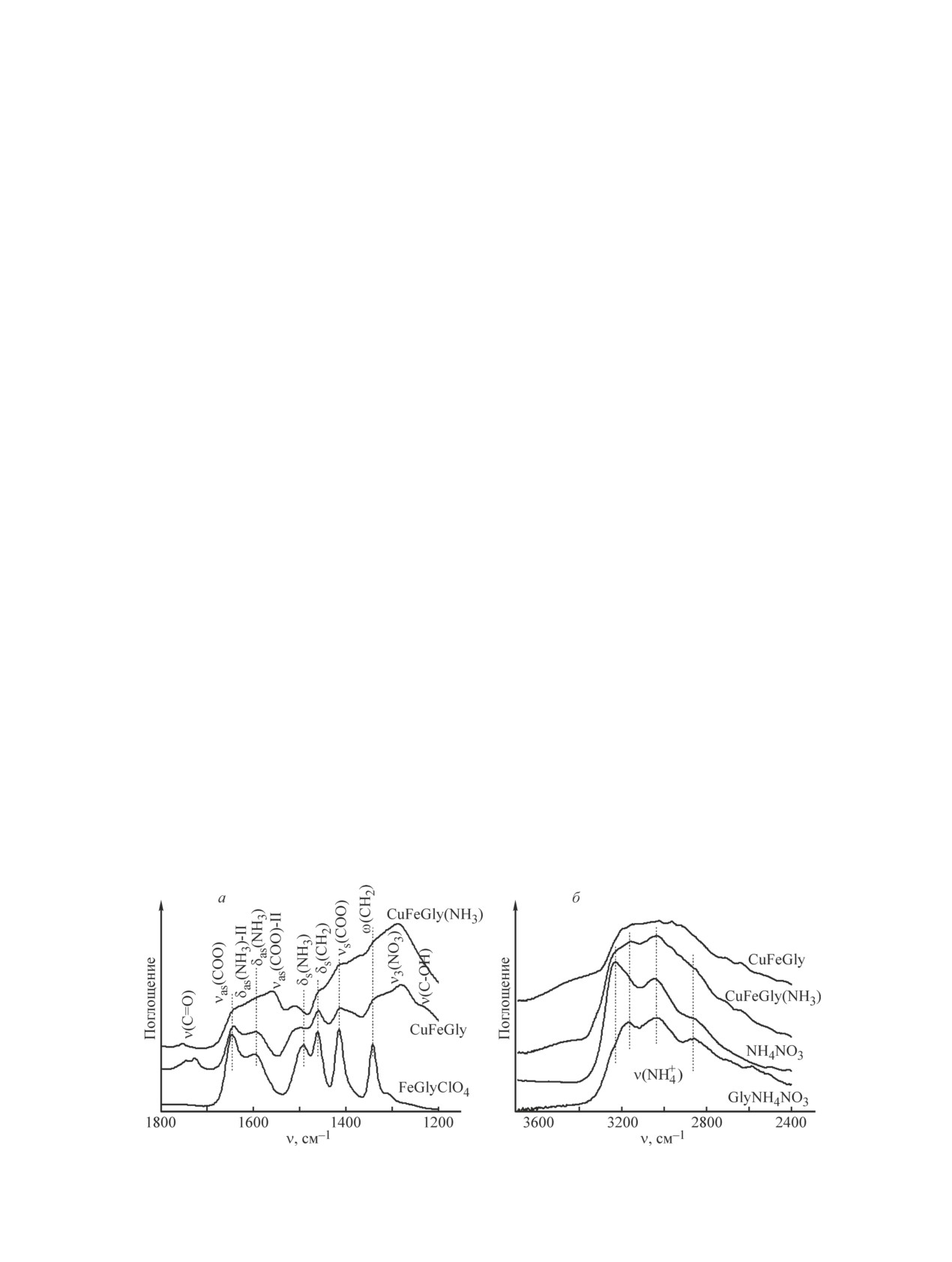
НПВО. На рис. 1 представлен ИК спектр исследу-
нений. Результаты суммированы в табл. 2. Средние
емого образца CuFeGly, приготовленного в кислой
размеры ОКР определялись по следующим рефлек-
среде без добавления аммиака, и образца FeGlyClO4,
сам: 311 для кубической шпинели (Fe3O4, CuFe2O4),
рассматриваемого в качестве модельного соединения,
111 для CuO, 111 для Cu, 104 для Fe2O3. Для иден-
структура и ИК спектр которого хорошо изучены и
тификации фаз использовались данные: кубическая
описаны в литературе [33, 34]. Видно, что спектры
шпинель CuFe2O4 (PDF 25-283), Fe3O4 (PDF 26-1136),
очень близки между собой. Различия связаны с коле-
CuO (PDF 45-937), Сu2O (PDF 5-667), Сu (PDF 4-836),
баниями ионов NO3- и ClO4-, которые поглощают в
Fe2O3 (PDF 33-664), CuFeO2 (ICSD 98488).
разных областях ИК спектра. Это свидетельствует о
Изображения растровой электронной микроско-
том, что соединение, полученное из кислого раство-
пии (РЭМ) были получены с помощью оборудования
ра глицина, имеет близкую структуру с [M3(μ3-O)
JSM-6460 LV (Jeol).
(Gly)6(H2O)3](X)7·nH2O (I), где М — Fe3+, X — ClO4-
Удельную поверхность Sуд продуктов горения
или NO3-. Отличительными спектральными харак-
определяли методом десорбции аргона с использо-
теристиками этого соединения являются полосы по-
ванием Сорбтометра Сорби-М (ЗАО Мета, Россия).
глощения (п. п.) νas(СОО) при 1645 см-1, νs(СОО)
Дифференцирующее растворение анализируемой
при 1413 см-1 и п. п. ν(Fe-O) в области 580-530 и
пробы продукта горения [3.37 мг, CuFe(NH3)-Ign]
390 см-1. Следует отметить, что в ИК спектре об-
проводили в проточном динамическом режиме при
разца CuFeGly не обнаруживаются п. п., соответ-
увеличении во времени концентрации и темпера-
ствующие соединениям меди. Это дает основание
туры растворения с использованием стехиографа.
предположить вхождение основной части ионов меди
Оптимизировали условия растворения в режиме
в структуру обнаруженного соединения. Присутствие
Рис. 1. Сравнение ИК спектров CuFeGly и CuFeGly(NH3) со спектрами модельных соединений.
Исследование медь-железо смешанного оксида со структурой кубической шпинели, синтезированного методом горения
29
неинтенсивных п. п., характерных для колебаний
мыми в спектрах NH4NO3 и модельного соединения
функциональных групп ν(С=О) и ν(C-OH) (рис. 1, a),
GlyNH4NO3 (рис. 1, б).
свидетельствует о взаимодействии небольшой части
Исследование предшественников методом тер-
глицина с азотной кислотой [35].
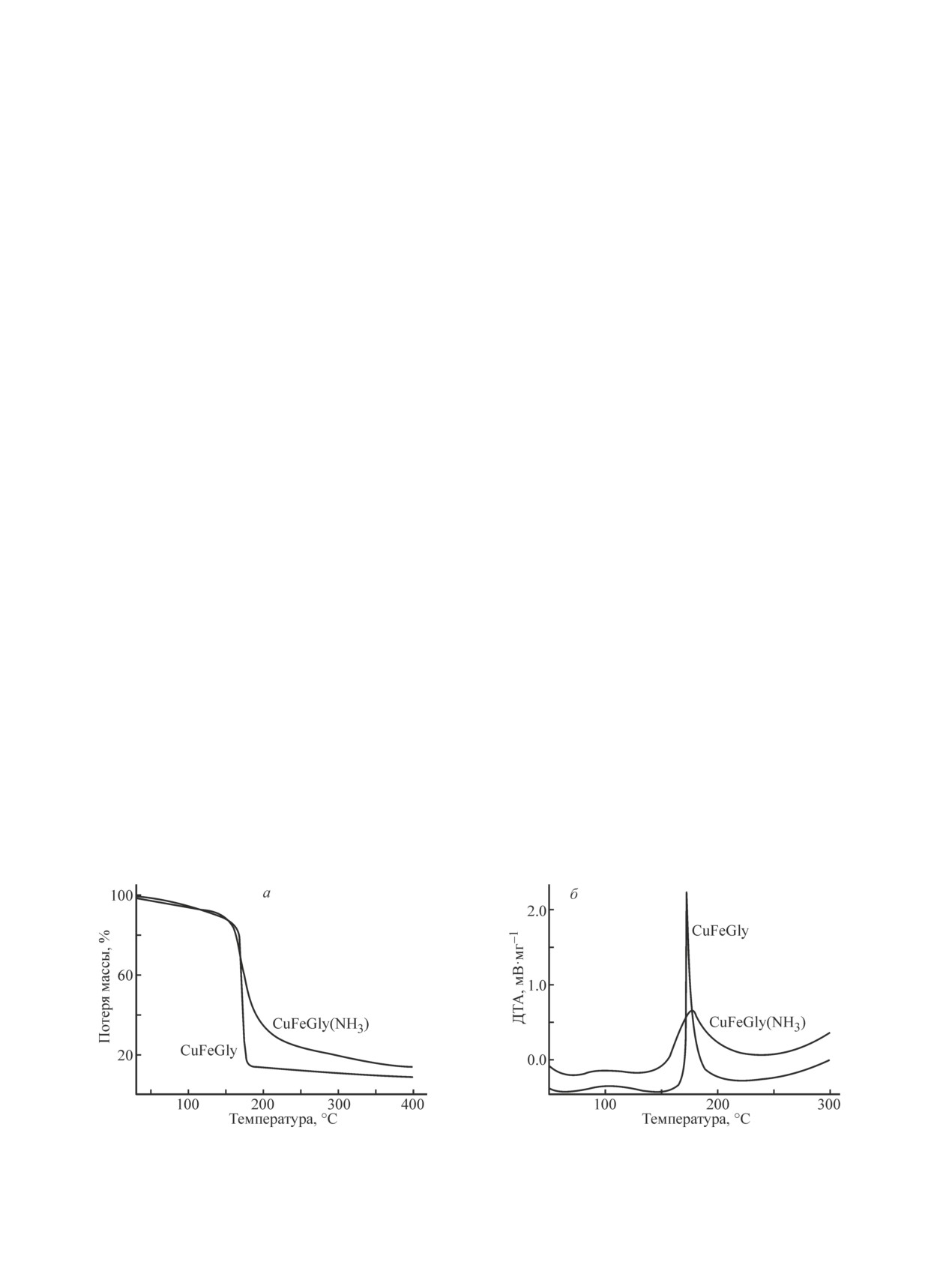
мического анализа. На рис. 2 представлены данные
Известно, что в водном растворе в условиях вы-
термического анализа для CuFeGly и CuFeGly(NH3)
сокой кислотности глицин преимущественно нахо-
в атмосфере гелия. Видно, что разложение CuFeGly с
дится в протонированной форме (NH3+CH2COOH).
высокой скоростью начинается в районе 160°С и за-
Добавление аммиака и увеличение pH раствора до
канчивается уже при 180°С. Такое быстрое развитие
2.9 приводит к увеличению концентрации цвиттер-
окислительно-восстановительного взаимодействия
иона (NH3+CH2COO-), что, по-видимому, отражается
компонентов сопровождается резким выделением
на характере взаимодействия глицина с катионами
тепла на кривой ДТА (рис. 2, б). Использование ам-
металлов. Из рис. 1, а видно, что приготовление об-
миака при синтезе предшественника, как показано
разца CuFeGly(NH3) в среде с добавлением аммиака
методом ИК спектроскопии, снизило его структурную
приводит к снижению интенсивности п. п. ν(С=О)
однородность: было зарегистрировано два состояния
и усложнению ИК спектра в области колебаний
карбоксильной группы глицина, взаимодействующей
функциональных групп СОО- и NH3+. Наряду с п. п.
с катионами металлов, выявлено присутствие ионов
νas(СОО) при 1642 см-1 и νas(NH3) при 1594 см-1,
аммония, предположительно входящих в состав пред-
характерными для соединений со структурой типа
шественника в виде соединения нитрата аммония
(I), в спектре дополнительно наблюдаются интен-
с глицином. Эти изменения в составе и строении
сивная п. п. при 1562 см-1 и плечо при 1627 см-1,
исследуемого образца отразились на его термических
которые могут быть отнесены к колебаниям νas(СОО)
свойствах. В этом случае разложение начинается
и νas(NH3) соответственно (тип II). Можно пред-
при более низкой температуре (~140°С), протекает
положить, что при добавлении аммиака в состав
с меньшей скоростью и заканчивается при 250°С
предшественника реализуется другой тип взаимо-
(рис. 2).
действия карбоксильной группы с катионами метал-
Влияние аммиака на скорость разложения предше-
лов, характеризующийся более низкой величиной
ственника в ходе термического анализа соотносится
∆ = νas(COO) - νs(COO) = 151 см-1, в то время как для
с измеренными величинами скоростей горения та-
соединений структуры (I) она составляет ~230 см-1.
блеток предшественников на воздухе. Так, средняя
Кроме того, введение аммиака способствует нейтра-
массовая скорость горения таблетки массой 600 мг
лизации высвобождающейся азотной кислоты с обра-
при переходе от CuFeGly к CuFeGly(NH3) снижается
зованием нитрата аммония. Методом ИК НПВО по-
с 60 до 12 мг·с-1.
казано, что в состав предшественника CuFeGly(NH3)
Влияние способа приготовления предшествен-
входят и ионы NH4+, о чем свидетельствует наличие в
ников на состав продуктов горения. Данные РФА
спектре п. п. при 3165 (ν3), 3040 (ν2 + ν4) и 2890 см-1
продуктов горения (рис. 3, табл. 2) показывают, что
(2ν4), совпадающих по положению с п. п., наблюдае-
использование CuFeGly предшественника не позво-
Рис. 2. Данные термического анализа CuFe-предшественников: кривые ТГ (а), ДТА (б);
He, 10 мг, 10 град·мин-1.
30
Симагина В. И. и др.
зой в образце CuFe(NH3)-Ign является нестехиоме-
тричный смешанный оксид со структурой кубиче-
ской шпинели — Cu1-xFe2+xO4, где x ~ 0.4. В образце
CuFe-Ign содержание меди в составе шпинели ниже,
и величина x соответствует ~0.6.
Снижение содержания меди в структуре шпинели,
по-видимому, связано с реализацией высоких темпе-
ратур и восстановительных условий в зоне формиро-
вания продукта. Известно, что восстановление ферри-
та меди под действием метана, угля и CO происходит
при относительно невысоких температурах (≤500°С)
[36-38]. Этот процесс начинается с выделением ме-
таллической меди из структуры шпинели, формиро-
ванием Fe3O4 и его последующим восстановлением.
Рис. 3. Рентгенограммы продуктов горения: CuFe-Ign
По окончании процесса горения металлические фазы
(из CuFeGly) и CuFe(NH3)-Ign [из CuFeGly(NH3)].
могут окисляться на воздухе до оксидов. Присутствие
в продукте CuFe(NH3)-Ign примесной фазы CuFeO2
ляет получать фазу шпинели с высоким выходом.
связано с тем, что в процессе горения достигалась
При этом высокое значение ОКР фазы кубической
высокая температура (>800-1000°С) [5, 32]. Отме-
шпинели, наличие Cu0 и Cu2O свидетельствуют о
тим, что присутствие восстановленных Fe2+ и Сu+ в
том, что образец CuFe-Ign формировался в усло-
образцах феррита меди, синтезированных методом
виях высоких температур и недостатка кислорода
горения органометаллического предшественника,
воздуха. Это, полагаем, обусловлено энергетикой
обсуждается в [16, 18, 39].
системы и высокой скоростью горения. Удельная
Полученные результаты формирования кубиче-
поверхность этого продукта составила менее 1 м2·г-1.
ской шпинели согласуются с рядом опубликованных
Использование аммиака на стадии синтеза предше-
работ, посвященных исследованиям продуктов го-
ственника CuFeGly(NH3) способствовало уменьше-
рения органометаллических предшественников раз-
нию скорости горения его таблетки. Это привело к
личной природы (табл. 1). Это, по-видимому, связано
повышению содержания кубической шпинели с 34
с температурным режимом ее формирования в про-
до 80%, снижению ее ОКР (табл. 2) и увеличению
цессе горения. Хорошо известно, что нагрев CuFe2O4
удельной поверхности до 4 м2·г-1. Исходя из содер-
тетрагональной структуры до ~900°С и быстрое ох-
жания кристаллических фаз, определенных методом
лаждение до комнатной температуры (процедура за-
Ритвельда (табл. 2), и закладываемого содержания
каливания) позволяет получать CuFe2O4 кубической
меди и железа в составе предшественника, можно
структуры [40]. Кроме того, снижение концентрации
предположить, что основной кристаллической фа-
кислорода в газовой фазе и уменьшение отношения
Таблица 2
Данные РФА продуктов горения CuFe-предшественников
Характеристики
Скорость
Образец
Sуд, м2·г-1
Фазовый состав
горения, мг·с-1
параметр ячейки а, Å
ОКР, нм
CuFe-Ign из CuFeGly
<1
60
34% кубическая шпинель
8.395
77
40% Fe2O3
66
18% Cu
>100
7% Cu2O
CuFe(NH3)-Ign из
4
12
80% кубическая шпинель
8.376
58
CuFeGly(NH3)
2% Cu
3% Cu2O
6% CuO
9% CuFeO2
Исследование медь-железо смешанного оксида со структурой кубической шпинели, синтезированного методом горения
31
Cu/Fe также способствуют стабилизации шпинели
условиях высоких значений концентрации кислоты и
кубической модификации [5]. Поскольку тетраго-
температуры (рис. 4, б).
нальное искажение октаэдров возникает в результате
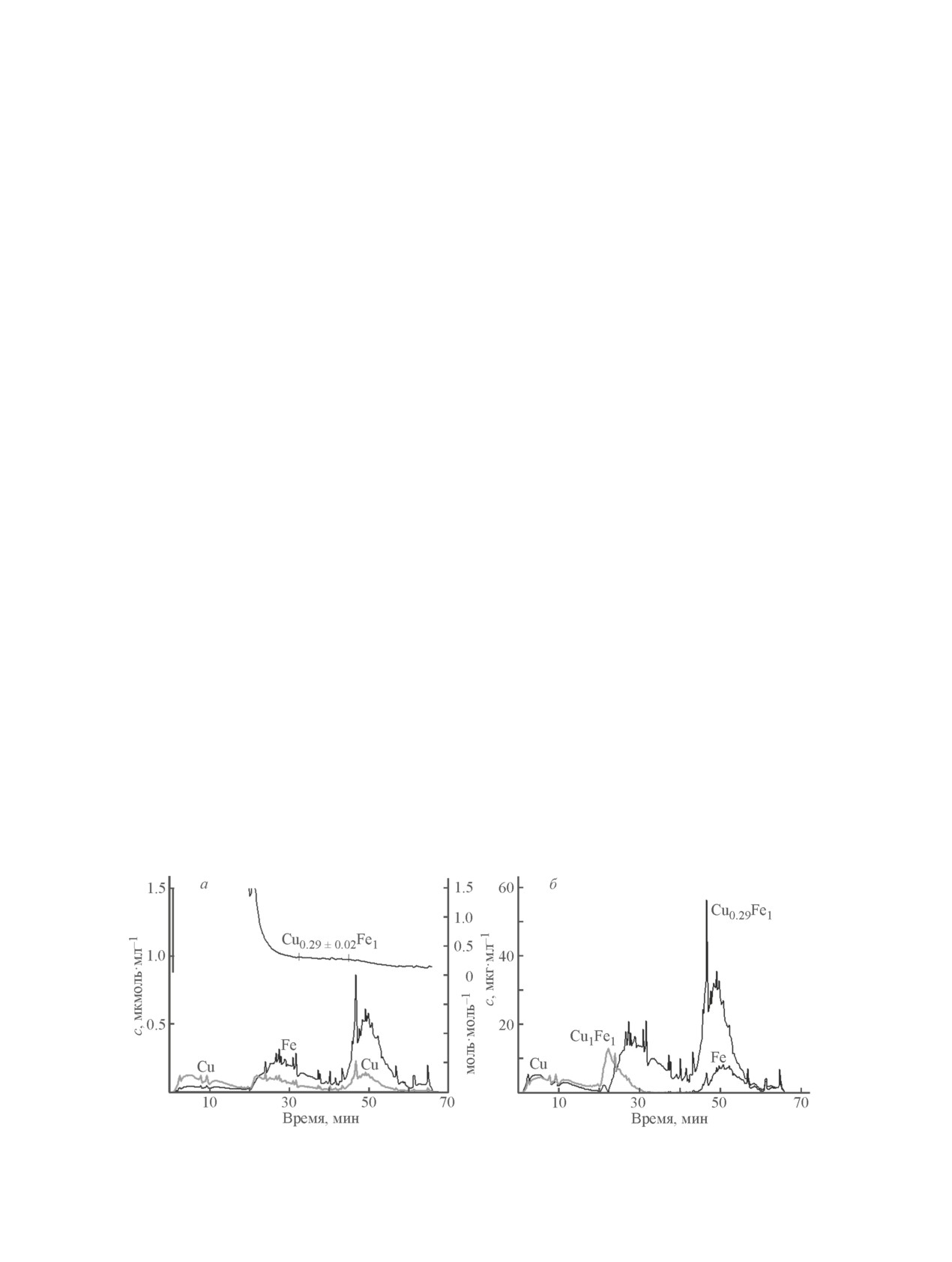
Интегрирование соответствующих областей пока-
кооперативного эффекта Яна-Теллера за счет при-
зало, что содержание фаз со стехиометрией Cu0.29Fe1
сутствия в них ионов Cu2+, формирование шпине-
и Cu1Fe1 равно 64.5 и 16.8 мас% соответственно
ли с тетрагональной или кубической структурой в
(без учета кислорода в их составе). Содержание же-
процессе приготовления образцов будет зависеть от
лезосодержащей фазы — 10.8 мас%. Содержание
температурного режима и характера распределения
медьсодержащей фазы — 7.9 мас%. Этот фазовый
ионов Cu2+ в анионной подрешетке.
состав согласуется с данными РФА этого образца
На основании метода РФА сложно делать выво-
(табл. 2), с учетом того что в методе дифференци-
ды о стехиометрии полученного смешанного оксида
рующего растворения анализируется растворение
Cu1-xFe2+xO4, поскольку структуры и дифракционные
как кристаллических, так и рентгеноаморфных фаз.
картины смешанного Cu-Fe оксида и Fe3O4 близки.
Если растворение железосодержащей фазы связать
На изменение параметров решетки влияет множество
с Fe3O4, то содержание фазы кубической шпинели
факторов, и довольно большой разброс в значениях
будет соответствовать данным РФА. Таким обра-
параметра решетки кубической шпинели представлен
зом, согласно дифференцирующему растворению,
в литературе. В то же время стехиометрия является
если принять, что растворение этого образца соответ-
наиболее важной характеристикой, определяющей
ствует растворению фаз Cu0.67Fe2.33O4, Fe3O4, CuFeO2
проводящие, магнитные и каталитические свойства
и (Cu + Cu2O), то их содержание будет составлять 66,
синтезируемых образцов феррита меди. Для уста-
11, 19 и 7 мас% соответственно. Элементный ана-
новления стехиометрии Cu/Fe образец с содержанием
лиз этого образца составил 48.9 мас% Fe и 23.2 мас%
кристаллической фазы шпинели 80% был изучен
Cu.
методом дифференцирующего растворения.
Таким образом, анализируемый образец
На рис. 4, а представлены кинетические кривые
CuFe(NH3)-Ign содержит, по данным РФА, 80% ку-
дифференцирующего растворения и стехиограмма
бической шпинели, по данным дифференцирующего
Cu/Fe для образца CuFe(NH3)-Ign из CuFeGly(NH3).
растворения — 66% фазы Cu0.67Fe2.33O4 и, возможно,
Отметим, что в ходе эксперимента наблюдалось пол-
примесь Fe3O4 (11%). Снижение содержания меди в
ное растворение образца. Видно, что на стехиограмме
структуре шпинели Cu1-xFe2+xO4 (0 < x ≤ 0.5) приво-
имеется линейный участок, соответствующий Cu/Fe =
дит к изменению электронного состояния меди и же-
= 0.29 ± 0.2. После вычитания этой фазы из суммар-
леза: наряду с Fe3+ и Cu2+ в структуре могут присут-
ных кинетических кривых растворения железа и меди
ствовать Fe2+ и Cu+ [41]. При этом пары (Cu+ + Fe3+)
очевидно выделение начального участка, соответ-
и (Cu2+ + Fe2+) более стабильны в тетраэдрическом и
ствующего растворению медьсодержащей фазы, фазы
октаэдрическом окружении соответственно.
со стехиометрией Cu/Fe = 1 и железосодержащей
Для подтверждения присутствия в образце
фазы, которая растворяется в конце эксперимента в
CuFe(NH3)-Ign ионов Fe2+ были записаны спек-
Рис. 4. Данные дифференцирующего растворения для образца CuFe(NH3)-Ign: кинетические кривые растворения
меди и железа и стехиограмма Cu/Fe (а), кинетические профили растворения выделенных фаз (б).
32
Симагина В. И. и др.
Рис. 5. ИК НПВО спектры продуктов горения [CuFe-Ign и CuFe(NH3)-Ign] и модельных соединений (Fe2O3, Fe3O4):
ближняя ИК область (а), область колебаний металл-кислород (б).
тры НПВО в ближней ИК области. Согласно [42,
ния показывают (рис. 5, б), что в ИК спектре НПВО
43] поглощение в этой области спектра для Fe3O4
CuFe(NH3)-Ign присутствуют две интенсивные п. п. в
обусловлено переносом заряда между близлежащи-
области 540 (тетраэдр) и 320 см-1 (октаэдр), которые,
ми Fe2+-Fe3+ в октаэдрическом окружении. В сте-
согласно [2, 17], хорошо соотносятся с опублико-
хиометрическом CuFe2O4, так же как в Fe2O3, этот
ванными спектрами образцов ферритов меди, полу-
электронный перенос не наблюдается из-за отсут-
ченных в условиях горения органометаллических
ствия в структуре Fe2+. Из рис. 5, а видно, что спектр
предшественников. Асимметрия высокочастотной п.
CuFe(NH3)-Ign, содержащего шпинель состава
п. в районе 600 см-1 может быть связана с поглоще-
Cu0.67Fe2.33O4, характеризуется достаточно интенсив-
нием примесных фаз Cu2O и CuFeO2. Как и следовало
ным поглощением в области 9000-5000 см-1, кото-
ожидать, спектр продукта CuFe-Ign с низким содер-
рое по интенсивности близко к поглощению образца
жанием шпинели (рис. 5, б) характеризуется набором
Fe3O4, синтезированного при отношении Fe3+/Fe2+ =
широких относительно небольшой интенсивности
= 2.76. Это согласуется с предположением о присут-
п. п. в области 650-250 см-1. Помимо п. п., соот-
ствии Fe2+ в образце CuFe(NH3)-Ign.
ветствующих поглощению шпинели, присутствие
Присутствие Fe2+ в составе образца подтвержда-
дополнительных п. п. при 610 (пл.), 450 и 383 см-1
ется и данными инфракрасной спектроскопии в об-
подтверждает наличие в образце фазы Fe2O3 и, воз-
ласти колебаний металл-кислород. Наши исследова-
можно, некоторого количества фазы Cu2O.
Рис. 6. РЭМ синтезированного образца медь-железо смешанного оксида CuFe(NH3)-Ign.
Метки соответствуют 100 и 1 мкм для а и б соответственно.
Исследование медь-железо смешанного оксида со структурой кубической шпинели, синтезированного методом горения
33
По сравнению со спектральными характеристи-
Работа выполнена в рамках государственно-
ками образцов феррита меди, полученных другими
го задания Института катализа СО РАН (проект
методами, спектр CuFe(NH3)-Ign характеризуется
АААА-А17-117041710089-7), исследование спек-
более широким и несимметричным поглощением в
тральными методами проведено при поддержке про-
области колебания октаэдра (400-300 см-1) (рис. 5, б).
граммы президиума РАН № 56 «Фундаментальные
При этом максимум этих колебаний более чем на
основы прорывных технологий в интересах нацио-
70 см-1 смещен в область низких частот. Полагаем,
нальной безопасности». Авторы выражают благодар-
что данные изменения обусловлены прежде всего
ность А. В. Дербилиной за приготовление образцов
присутствием Fe2+ в октаэдрическом кислородном
и Н. А. Рудиной за изучение образца методом РЭМ.
окружении, поскольку близкий спектр наблюдается
для Fe3O4 (рис. 5, б). Различия спектров CuFe(NH3)-
Ign и Fe3O4, по-видимому, связаны с колебаниями
Список литературы
катионов меди в октаэдрическом и тетраэдрическом
окружениях в случае образца феррита меди.
[1] Balagurov A. M., Bobrikov I. A., Maschenko M. S.,
Растровое электронное изображение анализируе-
Sangaa D., Simkin V. G. // Crystallogr. Reports. 2013.
мого образца CuFe(NH3)-Ign представлено на рис. 6.
V. 58. N 5. P. 710-717.
Видно, что во время горения формируется пористая
[2] Yadav R. S., Kuřitka I., Vilcakova J., Havlica J.,
Masilko J., Kalina L., Tkacz J., Hajdúchová M.,
макроструктура за счет выделяющихся газообразных
Enev V. // J. Mater. Sci. Mater. Electron. 2017. V. 28.
продуктов, что приводит к увеличению удельной по-
N 8. P. 6245-6261.
верхности образца.
[3] Casbeer E., Sharma V. K., Li X. Z. // Sep. Purif.
Technol. 2012. V. 87. P. 1-14.
[4] Tang M., Xia F., Gao C., Qiu H. // Int. J. Hydrogen
Выводы
Energy. 2016. V. 41. N 30. P. 13058-13068.
Методами ИК спектроскопии НПВО в области
[5] Kenfack F., Langbein H. // Cryst. Res. Technol. 2004.
250-10 000 см-1, РФА и дифференцирующего раство-
V. 39. N 12. P. 1070-1079.
рения изучено формирование медь-железо смешан-
[6] Мержанов А. Г. // Успехи химии. 2003. Т. 72. № 4.
ного оксида структуры кубической шпинели с раз-
С. 323-345 [Merzhanov A. G. // Russ. Chem. Rev.
витой пористой макроструктурой при автоволновом
2003. V. 72. N 4. P. 289-310].
горении высушенного и спрессованного в таблетки
[7] Рогачев А. С., Мукасьян А. С. // Горение для синте-
за материалов. М.: Физматлит, 2013. 389 с.
глицин-нитратного предшественника. Показана пер-
[8] Sutka A., Mezinskis G. // Front. Mater. Sci. 2012. V. 6.
спективность введения аммиака на стадии синтеза
N 2. P. 128-141.
предшественника, что определило характер взаимо-
[9] Попков В. И., Альмяшева О. В., Гусаров В. В. //
действия исходных компонентов и термические свой-
ЖПХ. 2014. Т. 87. № 10. С. 1416-1420 [Popkov V. I.,
ства формирующегося образца. В итоге снижение
Almjasheva O. V., Gusarov V. V. // Russ. J. Appl.
скорости горения таблетки позволило значительно
Chem. 2014. V. 87. N 10. C. 1417-1421].
увеличить выход фазы шпинели. Без дополнительной
[10] Комлев А. А., Вилежанинов Е. Ф. // ЖПХ. 2013.
стадии прокаливания получен продукт с содержани-
Т. 86. № 9. С. 1373-1380 [Komlev A. A., Vilezha-
ем кубической шпинели, по данным РФА, 80 мас%.
ninov E. F. // Russ. J. Appl. Chem. 2013. V. 86. N 9.
Анализ состава примесей свидетельствует о том,
P. 1344-1350].
что в ходе горения органометаллического предше-
[11] Дьяченко С. В., Мартинсон К. Д., Черепкова И. А.,
ственника в зоне формирования продукта реализу-
Жерновой А. И. // ЖПХ. 2016. Т. 89. № 4. С. 417-
ются восстановительные условия, что подтвержда-
421 [Dyachenko S. V., Martinson K. D., Cherep-
kova I. A., Zhernovoi A. I. // Russ. J. Appl. Chem.
ется присутствием кристаллических фаз Сu0, Cu2O,
2016. V. 89. N 4. P 535-539].
CuFeO2. Использование метода дифференцирующего
[12] Комлев А. А., Гусаров В. В. // Неорган. материа-
растворения позволило установить стехиометрию
лы. 2014. Т. 50, № 12. С. 1346-1351 [Komlev A. A.,
медь-железо смешанного оксида — Cu0.67Fe2.33O4,
Gusarov V. V. // Inorg. Mater. 2014. V. 50. N 12.
а также оценить содержание железо- и медьсодер-
Р. 1247-1251].
жащих примесей. Эти данные хорошо соотносятся
[13] Khaliullin S. M., Zhuravlev V. D., Russkikh O. V.,
с результатами РФА. Исследование образца, состо-
Ostroushko A. A., Bamburov V. G. // Int. J. Self-Propag.
ящего преимущественно из фазы кубической шпи-
High-Temp. Synth. 2015. V. 24. N 2. P. 83-88.
нели, методом ИК НПВО позволило предположить
[14] Mukasyan A. S., Epstein P., Dinka P. // Proc. Combust.
присутствие Fe2+ в его составе.
Inst. 2007. V. 31. N 2. P. 1789-1795.
34
Симагина В. И. и др.
[15] Costa A. F., Pimentel P. M., Aquino, Melo D. M. A.,
[28]
Pongpadung S., Kamwanna T., Amornkitbamrung V.
Melo M. A. F., Santos I. M. G. // Mater. Lett. 2013.
// J. Korean Phys. Soc. 2016. V. 68. N 5. P. 697-704.
V. 112. P. 58-61.
[29]
Deraz N. M. // J. Alloys Compd. 2010. V. 501. N 2.
[16] Köferstein R., Walther T., Hesse D., Ebbinghaus S. G.
P. 317-325.
// J. Solid State Chem. 2014. V. 213. P. 57-64.
[30]
Gingaşu D., Mîndru I., Patron L., Carp O., Matei D.,
[17] Yadav R. S., Havlica J., Masilko J., Kalina L. // J.
Neagoe C., Balint I. // J. Alloys Compd. 2006. V. 425.
Supercond. Nov. Magn. 2015. V. 29. N 3. P. 759-769.
N 1-2. P. 357-361.
[18] Xu Z.-X., Xu G.-S., Fu X.-Q., Wang Q. // Nanomater.
[31]
Hosseini S. N., Enayati M. H., Karimzadeh F., Sam-
Nanotechnol. 2016. V. 6. P. 1-10.
mes N. M. // Int. Sch. Sci. Res. Innov. 2015. V. 9. N 7.
[19] Komova O. V., Mukha S. A., Netskina O. V., Odego-
P. 857-860.
va G. V., Pochtar A. A., Ishchenko A. V., Simagina V. I.
[32]
Chiu T.-W., Huang P.-S. // Ceram. Int. 2013. V. 39.
// Ceram. Int. 2015. V. 41. N 1. Part B. P. 1869-1878.
Suppl.1. P. S575-S578.
[20] Komova O. V., Simagina V. I., Mukha S. A., Netski-
[33]
Straughan B. P., Lam O. M. // Inorg. Chim. Acta. 1985.
na O. V., Odegova G. V., Bulavchenko O .A., Ishchen-
V. 98. N 1. P. 7-10.
ko A. V., Pochtar′ A. A.// Adv. Powder Technol. 2016.
[34]
Tucker W. F., Asplund R. O., Holt S. L. // Arch.
V. 27. N 2. P. 496-503.
Biochem. Biophys. 1975. V. 166. N 2. P. 433-438.
[21] Симагина B. И., Комова О. В., Нецкина О. В., Оде-
[35]
Ghazaryan V. V., Fleck M., Petrosyan A. M. // J. Mol.
гова Г. В, Булавченко О. А., Ищенко А. В. // Альтер-
Struct. 2010. V. 977. N 1-3. P. 117-129.
натив. энергетика и экология. 2017. № 25-27.
[36]
Kang K.-S., Kim C.-H., Cho W.-C., Bae K.-K.,
C. 71-87.
Woo S.-W., Park C.-S. // Int. J. Hydrogen Energy.
[22] Chatterjee B. K., Bhattacharjee K., Dey A.,
2008. V. 33. N 17. P. 4560-4568.
Ghosh C. K., Chattopadhyay K. K. // Dalt. Trans.
[37]
Wang B., Yan R., Zhao H., Zheng Y. // Energy Fuels.
2014. V. 43. N 21. P. 7930-7944.
2011. V. 25. N 7. P. 3344-3354.
[23] Tasca J. E., Quincoces C. E., Lavat A., Alvarez A. M.,
[38]
Estrella M., Barrio L., Zhou G., Wang X., Wang Q.,
González M. G. // Ceram. Int. 2011. V. 37. N 3. P. 803-
Wen W., Hanson J. C., Frenkel A. I., Rodriguez J. A. //
812.
J. Phys. Chem. C. 2009. V. 113. N 32. P. 14411-14417.
[24] Kongkaew T., Sakurai K. // Chem. Lett. 2017. V. 46.
[39]
Thapa D., Kulkarni N., Mishra S. N., Paulose P. L.,
N 10. P. 1493-1496.
Ayyub P. // J. Phys. D: Appl. Phys. 2010. V. 43. N 19.
[25] Selvan R. K., Augustin C. O., Berchmans L. J.,
P. 195004 (5 pp).
Saraswathi R. // Mater. Res. Bull. 2003. V. 38. N 1.
[40]
Roy S., Ghose J. // Mater. Res. Bull. 1999. V. 34.
P. 41-54.
N 10-11. P. 1805-1811.
[26] Iqbal M. J., Yaqub N., Sepiol B., Ismail B. // Mater.
[41]
Nanba N.// J. Appl. Phys. 1978. V. 49. N 5. P. 2950-
Res. Bull. 2011. V. 46. N 11. P. 1837-1842.
2952.
[27] Shetty K., Renuka L., Nagaswarupa H. P., Naga-
[42]
Park S., Ishikawa T., Tokura Y. // Phys. Rev. B. 1998.
bhushana H., Anantharaju K. S., Rangappa D.,
V. 58. N 7. P. 3717-3720.
Prashantha S. C., Ashwini K. // Mater. Today Proc.
[43]
Kim K. J., Lee J. H., Lee S. H. // J. Magn. Magn.
2017. V. 4. N 11. P. 11806-11815.
Mater. 2004. V. 279. N 2-3. P. 173-177.