Журнал прикладной химии. 2019. Т. 92. Вып. 2
НЕОРГАНИЧЕСКИЙ СИНТЕЗ И ТЕХНОЛОГИЯ НЕОРГАНИЧЕСКИХ ПРОИЗВОДСТВ
УДК 546.824-31+546.776+546.284-31
ПОЛУЧЕНИЕ И СВОЙСТВА КОМПОЗИЦИОННЫХ МАТЕРИАЛОВ
MoO3-TiO2-SiO2 СО СФЕРИЧЕСКОЙ ФОРМОЙ АГЛОМЕРАТОВ
© С. А. Кузнецова, А. С. Бричков, К. В. Лисица, А. Н. Шамсутдинова, В. В. Козик
Национальный исследовательский Томский государственный университет
E-mail: onm@mail.tsu.ru
Поступила в Редакцию 14 августа 2018 г.
После доработки 25 октября 2018 г.
Принята к публикации 29 ноября 2018 г.
Термическим разложением предварительно насыщенных анионитов ТОКЕМ-400 и ТОКЕМ-840 иона-
ми Mo7O246- с нанесенным золем на основе тетрабутоксититана с тетраэтоксисиланом получены
композиты MoO3-TiO2-SiO2 со сферической формой агломератов. Методами рентгенофазового и мик-
рорентгеноспектрального анализа определены фазовый и химический составы композитов. Показано
влияние типа анионита на морфологию поверхности композитов MoO3-TiO2-SiO2. Установлено, что
для получения композита MoO3-TiO2-SiO2 со сферической формой агломератов необходимо использо-
вать анионит ТОКЕМ-400, который характеризуется большей сорбционной емкостью по отношению
к Mo7O246- за счет обмена ОН--ионов анионита на Mo7O246-. Предложены температурные режимы
получения сферических композитов MoO3-TiO2-SiO2. Представлены результаты определения полной
и сорбционной емкости к Mo7O246- анионитов гелевой структуры ТОКЕМ-400 и ТОКЕМ-840.
Ключевые слова: композиты MoO3-TiO2-SiO2, получение сферических композитов, ионный обмен,
сорбционная емкость анионитов.
DOI: 10.1134/S0044461819020014
В настоящее время все больше внимания уделяет-
различные носители катализаторов. К классическим
ся разработке экологически безопасных технологий,
способам приготовления катализаторов относятся:
которые позволили бы перерабатывать топливо, вести
осаждение (соосаждение), пропитка, адсорбционное
борьбу с различными загрязнителями воздуха, при-
нанесение, ионный обмен, смешение, сплавление
родных и технических вод. Важными компонентами
[11]. Однако при использовании вышеперечисленных
этих технологий являются каталитически активные
способов затрудняется контроль над состоянием по-
вещества, позволяющие, например, перерабатывать
верхности оксида и геометрией (формой) частиц, что
углеводороды в процессе их глубокого или парциаль-
важно, например, для каталитической селективности
ного окисления при достаточно низких температурах
[12]. Поэтому в настоящее время проводятся иссле-
[1-4] или проявлять высокую фотокаталитическую
дования в направлении разработки новых способов
активность в видимой области спектра, разлагая раз-
приготовления катализаторов с заданной формой и
личные органические загрязнители [5-7], преобразо-
размером частиц без применения носителя для ката-
вывать солнечную энергию [8, 9], а также участвовать
литически активного вещества [13-17].
в каталитическом процессе получения водородного
Так, например, для получения композитов МоО3,
топлива [10]. В качестве таких веществ перспектив-
MoO3-SiO2, MoO3-TiO2, MoO3-ZrO2 со сферической
но использовать оксиды металлов, нанесенные на
формой частиц стали применять способ их приго-
139
140
Кузнецова С. А. и др.
товления в обратной эмульсии [18], а также способ
Получение сферических композитов состава
термического разложения ионитов, предварительно
MoO3-TiO2-SiO2 осуществляли путем термической
насыщенных ионами металлов [19, 20]. Последний
обработки анионитов (ТОКЕМ-840, ТОКЕМ-400),
способ формирования технологически прост. Синтез
насыщенных парамолибдат-ионами с нанесен-
оксидов со сферической формой частиц происходит в
ным золем на основе бутанола, тетрабутокситита-
результате того, что ионы, содержащие металл в ио-
на (ТБТ) и тетраэтоксисилана (ТЭОС). Для этого
ните, расположены друг от друга на атомном рассто-
аниониты помещали в насыщенный водный раствор
янии [21], что дает возможность образующимся заро-
(NH4)6Mo7O24·4Н2О (0.24 моль·л-1) и выдерживали
дышам оксидов металла за счет процессов диффузии
в течение 1 сут в условиях постоянного перемеши-
подвергаться слиянию. Термическое разложение ио-
вания при комнатной температуре. После ионного
нитов, предварительно насыщенных ионами, впервые
обмена аниониты фильтровали, промывали неболь-
было использовано для получения микросфер оксида
шим количеством воды и сушили при температуре
плутония еще в 1989 г. [22]. Позже этим методом
60°С до постоянной массы. Далее высушенные ани-
были получены сферические частицы Fe2O3 [23],
ониты, насыщенные ионами Мо7О246-, помещали в
сложные оксиды составов YBa2Cu3O7-δ (0.02 ≤δ ≤ 0.2)
золь. Золь готовили путем растворения смеси ТБТ
в виде порошка [21], полые гранулы Al2O3 [19], а так-
и ТЭОС в растворе, состоящем из C4H9OH, H2O и
же каталитически активные сферы TiO2-SiO2/MxOy
HNO3. Методика приготовления золя представлена
(M = Co, Cr) [24]. В вышеперечисленных работах
в работе [33]. Концентрации растворенных веществ
применялись иониты различного состава и структу-
составляли (моль·л-1): сТБТ = 0.1, сТЭОС = 2.2·10-2,
ры. В настоящей работе предлагается использовать
сHNO3 = 2.5·10-3 (содержание исходной НNO3 70% по
аниониты гелевой структуры для получения сфери-
массе). После нанесения золя на аниониты, насыщен-
ческих частиц, представляющих собой композиты на
ные ионами Мо7О246-, образцы сушили при темпера-
основе MoO3-TiO2-SiO2. Выбор состава композита
туре 60°С до постоянной массы. Высушенные образ-
обоснован тем, что оксиды молибдена(VI) и тита-
цы отжигали при температуре 350°С в течение 6 ч и
на(IV) находят широкое применение в качестве ката-
при 500°С в течение 5 ч. Скорость нагрева муфельной
лизаторов, солнечных элементов, датчиков, суперкон-
печи составляла 14 град·мин-1. Температурный ре-
денсаторов, входят в состав литий-ионных батарей,
жим отжига образцов выбирали на основе терми-
электрохромных и фотохромных материалов [25-32].
ческого анализа анионитов, насыщенных ионами
Оксид кремния(IV) выбран как связующее веще-
Мо7О246-, а также с нанесенным золем. Для срав-
ство для формирования механически прочных сфер.
нения проводили термический анализ чистых ани-
Целью настоящей работы являлось определение
онитов ТОКЕМ-400 и ТОКЕМ-840. Синхронный
условий получения композитов на основе MoO3-
термический анализ с масс-спектрами выполняли
TiO2-SiO2 со сферической формой частиц методом
на приборе STA 449 F1 Jupiter с газовым масс-спек-
термического разложения ионитов гелевой структуры
трометром QMS 403 Aëolos. Съемку осуществля-
(ТОКЕМ-400, ТОКЕМ-840), предварительно насы-
ли в атмосфере воздуха в температурном интервале
щенных ионами Мо7О246- и выдержанных в золе на
25-700°С. Рентгенофазовый анализ (РФА) получен-
основе бутанола, тетрабутоксититана и тетраэтокси-
ных образцов выполняли на дифрактометре Rigaku
силана, а также установление влияния типа анионита
Miniflex 600 с использованием CuKα-излучения в ин-
на состав, морфологию оксидных композитов.
тервале 2-90° (2θ) с шагом 0.02° и скоростью съемки
2 град·мин-1. Идентификацию дифракционных мак-
симумов проводили с использованием базы данных
Экспериментальная часть
JСPDS. Морфологию полученных образцов и распре-
В качестве органических матриц для получения
деление элементов по их поверхности исследовали на
оксидных композитов MoO3-TiO2-SiO2 в работе ис-
растровом электронном микроскопе Hitachi ТМ-3000
пользовали сильноосновный анионит, состоящий
с приставкой ShiftED 3000 для микрорентгеноспек-
из стирол-дивинилбензольной матрицы с четвер-
трального анализа.
тичными аммониевыми функциональными груп-
Методом потенциометрического титрования опре-
пами в хлоридной ионной форме (ТОКЕМ-840) и
деляли рабочий диапазон рН анионитов, в котором
слабоосновный анионит с полиакрилатной матри-
они проявляют максимальную обменную емкость
цей с третичным амином в гидроксильной форме
[34]. Для этого серию отдельных навесок по 0.1 г
(ТОКЕМ-400). Данные аниониты имеют сфериче-
анионитов в ОН-форме заливали раствором НCl
скую форму с размером гранул 0.4-1.25 мм.
(сисх = 0.1 моль·л-1), содержание которой изменя-
Получение и свойства композиционных материалов MoO3-TiO2-SiO2 со сферической формой агломератов
141
ли в пределах от 0 до 12 ммоль·г-1. Ионную силу
шкаф. В сушильном шкафу при температуре 100°С
раствора поддерживали постоянной 0.1 добавлени-
образцы сушили до постоянной массы. Затем бюкс
ем NaCl. Общий объем раствора составлял 20 мл.
охлаждали при комнатной температуре и снова взве-
После установления равновесия (24 ч) измеряли рН
шивали. Значение массовой доли влаги в анионите
равновесных растворов на иономере I-160 MI (элект-
W (%) рассчитывали по формуле
род стеклянный комбинированный ЭСК-1062). Затем
строили кривую титрования в координатах рН-коли-
чество титранта НСl (ммоль·г-1 ионита).
Полную статическую обменную емкость опреде-
ляли по методике [35]. Для этого навески воздуш-
где m1 — масса набухшего ионита (г), m2 — масса
но-сухих анионитов в ОН-форме массой 0.1 г поме-
сухого ионита (г).
щали в конические колбы и заливали 25 мл 0.1 М
Сорбционную емкость анионитов по иону
раствора HCl. Затем оставляли на неделю для уста-
Мо7О246- определяли в статических условиях.
новления равновесия. Далее раствор отделяли от
Навески воздушно-сухих анионитов ТОКЕМ-400,
анионита и определяли убыль концентрации раствора
ТОКЕМ-840 в ОН- и Cl-форме массой 0.100 г по-
НСl титрованием раствором NaOH с = 0.1 моль·л-1
мещали в конические колбы на 100 мл и заливали
в присутствии смешанного индикатора до перехода
25 мл насыщенного раствора соли (NH4)6Mo7O24.
зеленой окраски раствора в розовую. Полную обмен-
Аниониты оставляли в растворе до достижения рав-
ную емкость (ПОЕ) (ммоль·г-1 ионита) рассчитывали
новесия. Время достижения равновесия определяли
по формуле
отдельными опытами, оно составляло не более 4 ч.
Концентрацию Мо7О246- в исходных и равновесных
растворах после сорбции определяли методом грави-
метрии [36], осаждая из раствора Мо7О246- в форме
PbМоO4. В работе использовали все реактивы марки
где с0 — исходная концентрация НСl (моль·л-1), с1 —
х.ч., кроме парамолибдата аммония (ч.д.а.).
концентрация HCl после установления равновесия
(ммоль·л-1), V — объем раствора HCl (л), m — на-
Обсуждение результатов
веска воздушно-сухого анионита (г), W — массовая
доля влаги в ионите.
Анионит ТОКЕМ-400 является слабоосновным,
Влагосодержание определяли эксперименталь-
имеет гелевую структуру с полиакрилатной матрицей,
но. Для этого навеску воздушно-сухого анионита в
где функциональной группой является третичный
ОН-форме помещали в предварительно высушен-
амин. ТОКЕМ-400 представляет собой свободное
ный до постоянной массы взвешенный бюкс. Бюкс
основание, которое в водном растворе подвергается
с анионитом взвешивали на аналитических весах
диссоциации:
с точностью до 0.0001 г и помещали в сушильный
[-СН2-СНN(CH3)2OH-]n
[-СН2-СНN+(CH3)2-]n + nOH-.
Анионит ТОКЕМ-840 является сильноосновным,
четвертично-аммониевая группа. Данный анионит
имеет гелевую структуру со стирол-дивинилбензоль-
получают в виде основания и хлорида. В водном
ной матрицей, где функциональной группой является
растворе также диссоциирует:
[-СН2-СНC6H4N(CH3)3OH/(Cl)-]n
[-СН2-СНC6H4N+(CH3)3-]n + nOH-/(Cl-).
Все перечисленные аниониты способны вступать в ионный обмен c Мо7О246- по реакции
[-RN(CH3)3OH/(Cl)-]n + mMo7O246- = [-RN+(CH3)3(Mo7O24)m-]n + nOH-/(Cl-).
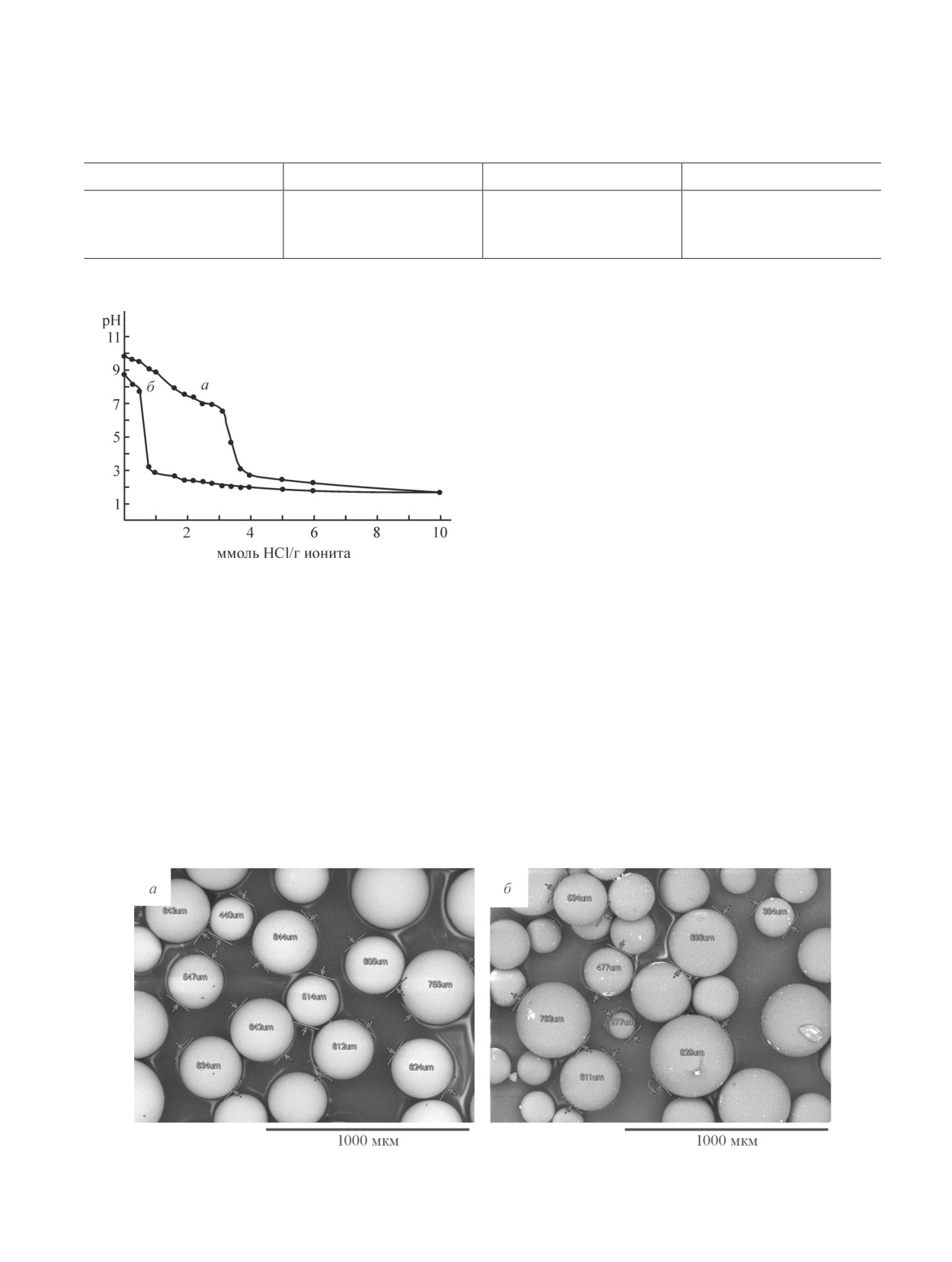
Рабочий диапазон рН максимальной обменной
об их монофункциональности. Кроме того, кривые
емкости каждого анионита установлен по кривым
титрования не имеют подъемов во всем интервале
потенциометрического титрования ОН-формы анио-
рН, что свидетельствует об отсутствии внутримоле-
нитов. На кривых титрования (рис. 1) для всех анио-
кулярных взаимодействий функциональных групп.
нитов наблюдается один скачок, что свидетельствует
Точка эквивалентности для ТОКЕМ-400 соответ-
142
Кузнецова С. А. и др.
Некоторые свойства анионитов ТОКЕМ-400 и ТОКЕМ-840
Анионит
СЕ ± 0.06, ммоль-экв·г-1
ПОЕ ± 0.2, ммоль-экв·г-1
Влагосодержание ± 0.3, %
ТОКЕМ-400
6.64
9.2
29.1
ТОКЕМ-840
6.74
1.6
21.1
В таблице представлены полученные количествен-
ные характеристики физико-химических свойств
анионитов в ОН-форме: сорбционная емкость к
Mo7O246- (СЕ); полная обменная емкость (ПОЕ),
влагосодержание. Как видно из данных таблицы,
большей ПОЕ обладает анионит ТОКЕМ-400. Тем
не менее сорбционная емкость Mo7O246- для двух
анионитов близка. Сорбционная емкость по иону
Mo7O246- для ТОКЕМ-400 составляет порядка 72%
от ПОЕ. Это свидетельствует о том, что не все -ОН-
группы анионита участвуют в сорбционном процессе.
Данный факт можно объяснить возрастанием жестко-
сти полимерного каркаса от поверхности к центру
анионита при набухании в насыщенном растворе,
Рис. 1. Кривые титрования ОН-форм анионитов рас-
уменьшением размера ячеек между цепями полиме-
твором HCl.
ра (особенность процесса эмульсионной полимери-
зации), препятствующим проникновению крупных
а — ТОКЕМ-400, б — ТОКЕМ-840.
ионов Mo7O246- к местам обмена [37]. Большее зна-
чение СЕ анионита ТОКЕМ-840 по сравнению с его
ствует значению рН 4.6, для ТОКЕМ-840 — рН 5.3.
ПОЕ связано с тем, что сорбция происходит не только
Следовательно, максимальная обменная емкость ис-
за счет обмена ионами, но и физически, что под-
следуемых анионитов реализуется при близких зна-
тверждается результатами растровой электронной
чениях. рН насыщенного водного раствора парамо-
микроскопии. Как видно из рис. 2, на поверхности
либдата аммония соответствует значению 6.79 ± 0.03,
анионита ТОКЕМ-840 наблюдается присутствие до-
что находится в рабочем интервале максимальной
полнительной фазы (NH4)6Mo7O24 (частицы белого
емкости анионитов ТОКЕМ-400 и ТОКЕМ-840.
цвета).
Рис. 2. Микрофотографии анионитов с Mo7O246-: ТОКЕМ-400 (а), ТОКЕМ-840 (б).
Получение и свойства композиционных материалов MoO3-TiO2-SiO2 со сферической формой агломератов
143
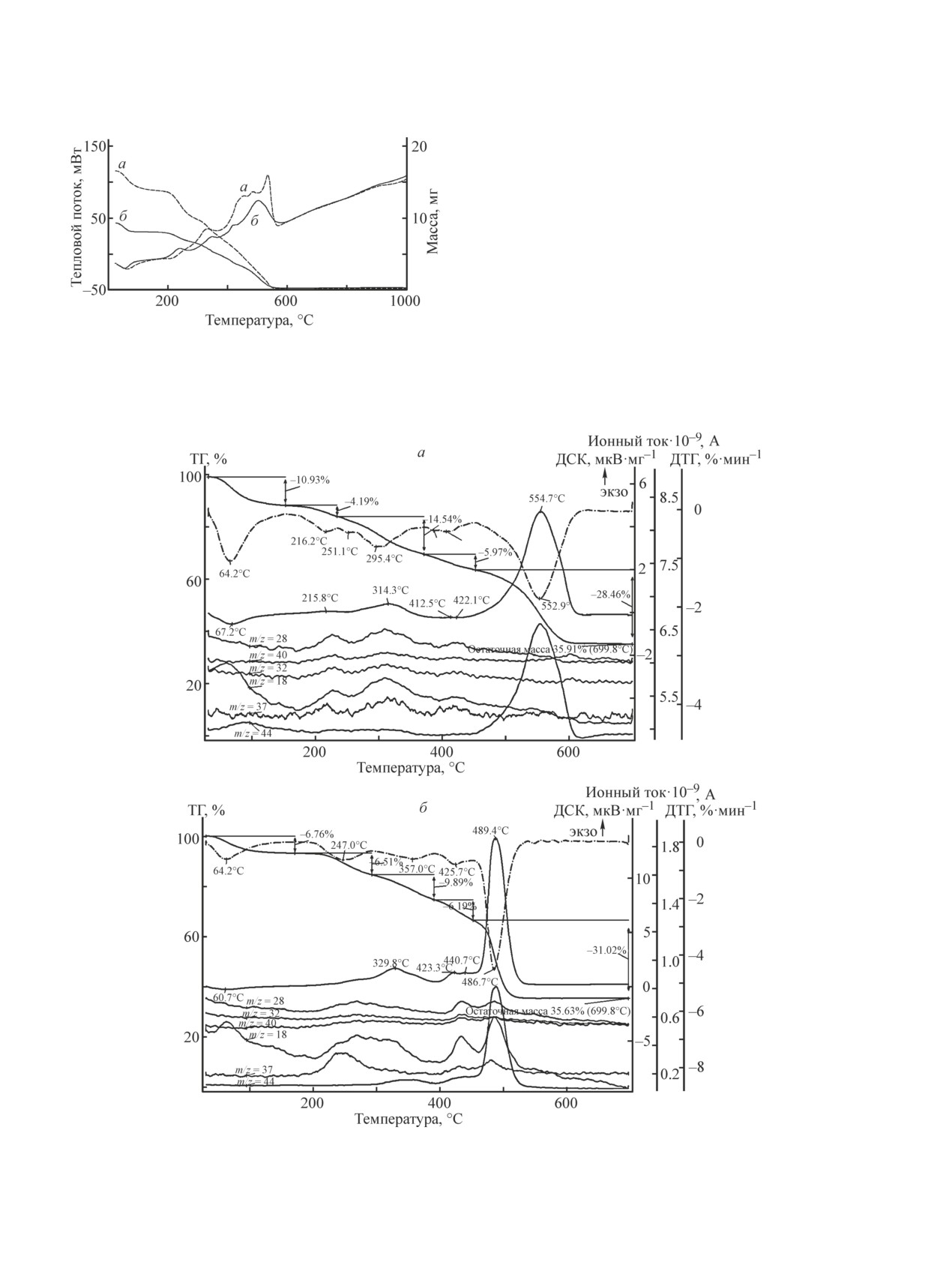
Результаты термического анализа чистых анио-
нитов (рис. 3), анионитов с Mo7O246- (рис. 4) и золем
позволяют выделить ряд процессов, протекающих
в ходе термической обработки. Как видно из рис. 3,
изменение массы анионитов, которое сопровождается
одним эндотермическим и четырьмя экзотермически-
ми эффектами, наблюдается до температуры 550°С.
Эндотермический эффект при Тmах = 55°С соот-
ветствует удалению адсорбированной воды, а после-
дующие экзотермические эффекты свидетельствуют
о деструкции анионитов, сопровождающейся их сго-
Рис. 3. Термограмма разложения анионитов:
ранием с образованием воды и углекислого газа.
ТОКЕМ-400 (а), ТОКЕМ-840 (б).
Рис. 4. Термограммы разложения анионитов с Mo7O246- и данные масс-спектрометрии продуктов их разложения:
ТОКЕМ-400 (а), ТОКЕМ-840 (б).
144
Кузнецова С. А. и др.
При разложении анионитов с Mo7O246- наблю-
Выше температуры 100°С в масс-спектре появ-
дается один эндотермический и пять экзотерми-
ляется пик с m/z = 28, что может свидетельствовать
ческих эффектов (рис. 4). По сравнению с термо-
о присутствии в газовой фазе как молекулярного
граммами анионитов без Mo7O246- добавляется еще
азота, так и оксида углерода(II). На масс-спектре
один экзотермический эффект, который, вероятнее
пики с m/z = 28 наблюдаются в интервалах темпера-
всего, сопровождает реакцию образования МоО3.
тур 220-360 и 400-540°С. В этих же температурных
Эндотермические эффекты с максимумами при тем-
областях в продуктах термолиза образцов аниони-
пературе 67.2°С (образец ТОКЕМ-400 с Mo7O246-)
тов с Mo7O246- масс-спектр регистрирует m/z = 18,
и 60.7°С (образец ТОКЕМ-840 с Mo7O246-) соответ-
m/z = 40, 37 и m/z = 32, что свидетельствует о на-
ствуют удалению физически адсорбированной Н2О.
личии в газовой фазе молекул Н2О и фрагментов
На масс-спектрах при данных температурах в газовой
С3Н4+ и СН3NH3+ соответственно. Полное сгора-
фазе присутствуют линии с m/z = 18.
ние углеводородных фрагментов до СО2 происходит
Рис. 5. Термограммы разложения анионитов, насыщенных ионами Mo7O246- с золем, и данные масс-спектрометрии
продуктов их разложения: ТОКЕМ-400 (а), ТОКЕМ-840 (б).
Получение и свойства композиционных материалов MoO3-TiO2-SiO2 со сферической формой агломератов
145
выше 450°С (на масс-спектре регистрируется пик с
m/z = 44), и в конечном продукте образуется МоО3
с выходом 35.91 (ТОКЕМ-400 с Mo7O246-) и 35.63%
(ТОКЕМ-840 с Mo7O246-) относительно массы анио-
нитов с Mo7O246-.
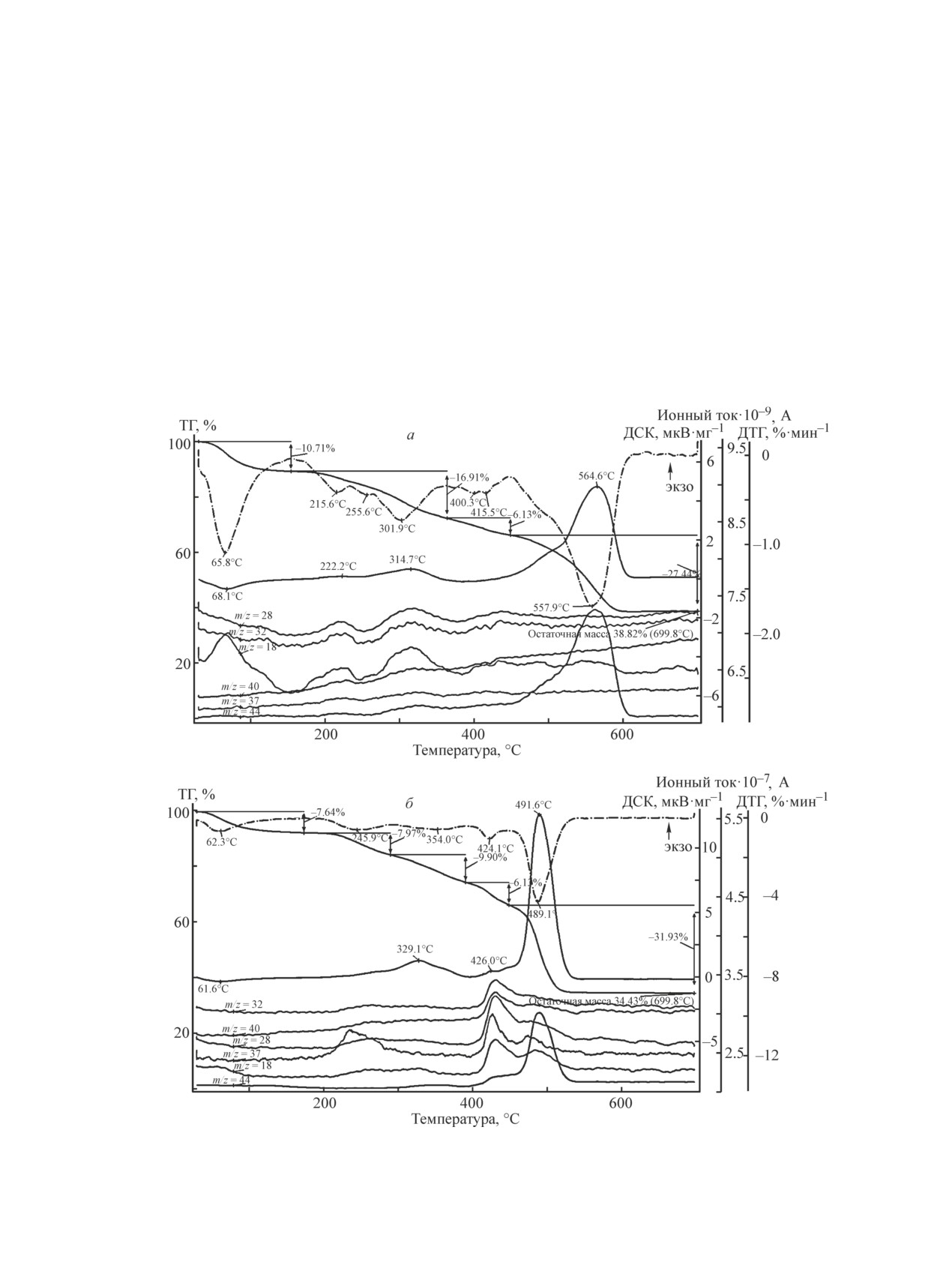
Для образцов анионитов с Mo7O246- и нанесен-
ным золем (рис. 5) термограммы разложения и дан-
ные масс-спектрометрии практически не отличают-
ся от термограмм разложения анионитов только с
Mo7O246-, что, возможно, связано с незначительной
массой осажденного золя. Несмотря на то что образ-
цы ТОКЕМ-400 с Mo7O246- и золем характеризуют-
ся конечной температурой разложения 600°С, нами
был выбран температурный режим отжига не выше
500°С, так как согласно литературным данным [38]
оксид молибдена(VI) при температуре 600°С незна-
чительно сублимируется. Для более полного удаления
углерода сначала проводили термическую обработку
всех образцов при температуре 350°С в течение 6 ч и
затем при 500°С в течение 5 ч.
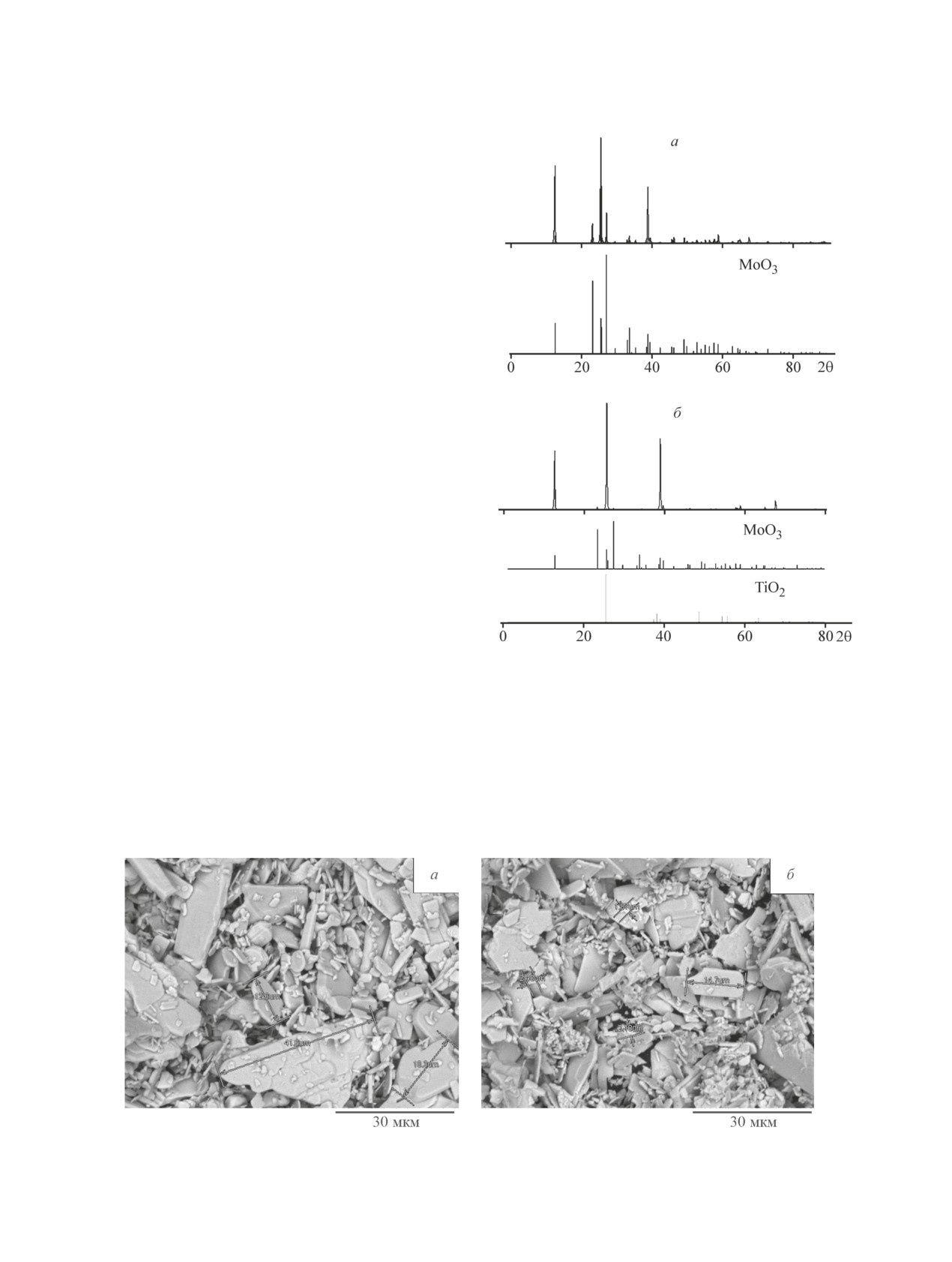
Согласно результатам РФА после термической об-
работки образцов анионитов, насыщенных Mo7O246-,
образуется оксид молибдена(VI) (рис. 6, а). Дифрак-
ционные линии образцов относятся к орторомби-
ческому α-MoO3 с параметрами кристаллической
решетки: а = 1.386 нм, b = 0.369 нм, с = 0.396 нм.
Полученные образцы МоО3 представляют собой пла-
Рис. 6. Дифрактограммы образцов МоО3, полученных
стинки различных размеров (рис. 7). По результатам
термической обработкой анионитов (ТОКЕМ-400,
РФА (рис. 6, б) после термической обработки анио-
ТОКЕМ-840), насыщенных Mo7O246- (а); МоО3-ТiO2-
нитов, насыщенных Mo7O246- с нанесенным золем,
SiO2, полученных термической обработкой анионитов
(ТОКЕМ-400, ТОКЕМ-840), насыщенных Mo7O246- и с
получены композиты, содержащие орторомбический
нанесенным золем (б).
α-MoO3 и, возможно, TiO2 со структурой анатаза.
Рис. 7. Микрофотография образцов МоО3, полученных при температуре 500°С из анионитов, насыщенных Mo7O246-:
ТОКЕМ-400 (а),ТОКЕМ-840 (б).
146
Кузнецова С. А. и др.
Рис. 8. Кривые распределения элементов по поверхности (А) и микрофотографии (Б) композитов TiO2-MoO3-SiO2,
полученных из анионитов, насыщенных Mo7O246- и с нанесенным золем: ТОКЕМ-400 (а), ТОКЕМ-840 (б).
Наличие в образцах SiO2 доказывается результатами
9 мкм (рис. 8). Макроструктура композитов на ос-
микрорентгеноспектрального анализа.
нове MoO3-TiO2-SiO2, полученных с использова-
Как видно из рис. 8, в образцах композитов при-
нием ТОКЕМ-840, представляет собой агломераты,
сутствуют как О, Ti, Mo, так и Si. Согласно результа-
которые состоят из пластинчатых частиц размером
там растровой электронной микроскопии композиты
от 5 до 20 мкм (рис. 8). Отсутствие возможности
сферической формы образуются только на анионите
формирования сферических композитов при исполь-
ТОКЕМ-400. Полые сферические агломераты раз-
зовании анионита ТОКЕМ-840 можно объяснить его
мером порядка 200 мкм состоят из частиц непра-
малой сорбционной емкостью, осуществляемой за
вильной формы, длина которых составляет от 1 до
счет обмена ионов ОН- (Сl-) на Mo7O246-.
Получение и свойства композиционных материалов MoO3-TiO2-SiO2 со сферической формой агломератов
147
Выводы
[10] Hao Tanga, Ning Lia, Shanshan Li, Fang Chena,
Guangyi Li, Aiqin Wanga, Yu Cong, Xiaodong Wanga,
Установлено, что анионит ТОКЕМ-400 с полиа-
Tao Zhang // Catal. Today. 2017. V. 298. P. 16-20.
крилатной матрицей имеет преимущество перед ани-
[11] Пахомов Н. А., Буянов Р. А. // Кинетика и катализ.
онитом ТОКЕМ-840 со стирол-дивинилбензольной
2005. Т. 46. № 5. С. 711-727.
матрицей по сорбционной емкости Mo7O246-, которая
[12] Lee I., Delbecq F., Morales R., Albiter M. A., Zaera F.
осуществляется только за счет обмена ионов ОН-
// Nature Mater. 2009. V. 8. P. 132-138.
(Cl-) на Mo7O246-. Максимальная обменная емкость
[13] Christensen S. T., Feng H., Libera J. L., Guo N., Mil-
анионита ТОКЕМ-400 реализуется при значениях
ler J. T., Stair P. C., Elam J. W. // Nano Lett. 2010.
рН > 4.6, а анионита ТОКЕМ-840 — рН > 5.3.
V. 10. P. 3047-3051.
[14] Biradar A. V., Biradar A. A., Asefa T. // Langmuir.
Тип анионита оказывает влияние на морфоло-
2011. V. 27. P. 14408-14418.
гию поверхности образующихся композитов МoO3-
[15] Gonzalez R. D., Lopez T., Gomez R. // Catal. Today.
TiO2- SiO2. Для формирования композиционных
1997. V. 35. P. 293-317.
материалов со сферической формой агломератов
[16] Wang Y., Biradar A. V., Duncan C. T., Asefa T. // J.
необходимо использовать анионит ТОКЕМ-400, ко-
Mater. Chem. 2010. V. 20. P. 7834-7841.
торый характеризуется большей полной обменной
[17] Wang J., Li X., Zhang S., Lu R. // Nanoscale. 2013.
емкостью.
N 5. P. 4823-4828.
Предложен способ получения сферической фор-
[18] Prakash Chandra, Dhananjay S. Doke, Shubhangi B.
мы композита МoO3-TiO2-SiO2, состоящего из TiO2
Umbarkara, Ankush V. Birada // J. Mater. Chem. A.
со структурой анатаза, орторомбического α-MoO3 и
2014. V. 2. Р. 19060-19066.
рентгеноаморфного SiO2.
[19] Вербовенко И. М., Рычков В. Н., Карташов В. В. //
Работа выполнена в рамках государственного зада-
Изв. вузов. Цв. металлургия. 2014. № 2. С. 30-34.
ния Минобрнауки РФ по проекту № 10.2281.2017/4.6.
[20] Wen-Zhuo Li, Cheng-Gang Qin, Wen-Ming Xiao,
Jie-Sheng Chen // J. Solid State Chem. 2005. V. 178.
P. 390-394.
[21] Пимнева Л. А. // Материалы конференций: совре-
Список литературы
менные наукоемкие технологии. 2006. № 2. С. 52-
[1] Брыкин А. В., Артемов А. В., Колегов К. А. // Катализ
53.
в пром-сти. 2013. № 4. С. 7-15.
[22] Pat. 3438749 USA (publ. 1989). Ion exchange method
[2] Shamsutdinova A. N., Brichkov A. S., Paukshtis E. A.,
for preparing metal oxide microspheres.
Kozik V. V., Larina T. V., Cherepanova S. V., Glazne-
[23] Apblett A. W., Kuriyavar S. I., Kiran B. P. // J. Mater.
va T. S. // Catal. Commun. 2017. V. 89. Р. 64-68.
Chem. 2003. V. 13. N 5. Р. 983-985.
[3] Усачев Н. Я., Харламов В. В., Беланова Е. П., Ста-
[24] Rogacheva A., Shamsutdinova, A., Brichkov A. Lari-
ростина Т. С., Круковский И. М. // Рос. хим. журн.
na T., Paukshtis E., Kozik V. // AIP Conf. Proc. 2017.
(ЖРХО им. Д. И. Менделеева). 2008. T. LII. № 4.
V. 1899. 020007.
С. 22-31.
[25] Isabela Alves de Castro, Robi Shankar Datta, Jian
[4] Dossumov K., Yergazieva G. Y., Myltykbaieva L. K.,
Zhen Ou, Andres Castellanos-Gomez, Sharath Sriram,
Asanov N. A. // Theoret. Experim. Chem. 2016. V. 52.
Torben Daeneke, and Kourosh Kalantar-zadeh // Adv.
N 2. P. 119-122.
Mater. 2017. V. 29. P. 1701619.
[5] Kuznetsova S. A., Pichugina A. A., Kozik V. V. // Inorg.
[26] Santos-Beltra′n M., Paraguay-Delgado F., Garcı′a R.,
Mater. 2014. V. 50. N 4. P. 387-391.
Antu′nez-Flores W. C., Ornelas-Gutie′rrez A. Santos-
[6] Yan X.-M., Kang J., Gao L., Xiong L., Mei P. // Appl.
Beltra′n // J. Mater. Sci: Mater. Electron. 2017. V. 28.
Surface Sci. 2013. V. 265. P. 778-783.
P. 2935-2948.
[7] Быканова В. В., Козуб П. А., Булавин В. И., Ко-
[27] Liu K., Huang X., Pidko E. A., Emiel J. M. // Green
зуб С. Н. // Інтегровані технології та енергозбере-
Chem. 2017. V. 19. P. 3014-3022.
ження. 2012. Т. 4. С. 151-157.
[28] Chia-Jui Li, Chuan-Ming Tseng, Sz-Nian Lai, Chin-Ru
[8] Козюхин С. А., Шерченков А. А., Гринберг В. А.,
Yang, Wei-Hsuan Hung // Nanoscale Res. Lett. 2017.
Иванов В. К. Наноматериалы: свойства и перспек-
V. 12. P. 560-566.
тивные приложения / Отв. ред. А. Б. Ярославцев. М.:
[29] Xuzhe Wang, Weili Cui, Meng Chen, Qun Xu // Mater.
Науч. мир, 2014. С. 240-265.
Lett. 2017. V. 201. P. 129-132.
[9] Козюхин С. А., Иванов В. К., Козик В. В., Бори-
[30] Biana L., Wanga S. P., Maa X. B. // Kinet. Catal. 2014.
ло Л. П. // Материалы Междунар. науч. конф.
V. 55. N 6. P. 763-769.
«Полифункциональные химические материалы и
[31] Козик В. В., Бричков А. С., Шамсутдинова А. Н.,
технологии». 21-22 мая 2015 г. Томск: Изд. Дом
Паукштис Е. А., Иванов В. К., Бричкова В. Ю.,
Томского гос. ун-та, 2015. Т. 1. С. 95-96.
Пармон В. Н. // ДАН. 2016. Т. 470. № 5. С. 545-549
148
Кузнецова С. А. и др.
[Kozik V. V., Brichkov A. S., Shamsutdinova A. N.,
[35] Полянский Н. Г., Горбунов Г. В., Полянская Н. А.
Paukshtis E. A., Brichkova V. Y., Parmon V. N., Ivanov
Методы исследования ионитов. М.: Химия, 1976.
V. K. // Dokl. Phys. Chem. 2016. V. 470. N 2. P. 154-
208 с.
157].
[36] Бусеев А. И. Аналитическая химия молибдена. М.:
[32] Yanping Lia, Huangzhong Yua, Xinxin Huanga, Zuping
Изд-во АН ССР, 1962. С. 160-161.
Wua, Haihong Xua // Solar Energy Mater. Solar Cells.
[37] Жаркова В. В., Бобкова Л. А., Бектимирова К. А.,
2017. V. 171. P. 72-84.
Козик В. В. // Изв. вузов. Физика. 2014. Т. 57. № 7/2.
[33] Шамсутдинова А. Н., Козик В. В. // Химия в инте-
С. 46-52.
ресах устойчив. развития. 2016. Т. 24. № 5. С. 699-
[38] Казенас Е. К., Чижиков Д. М. Давление и состав
704.
пара над окислами химических элементов. М.:
[34] Салдадзе К. М., Копылова В. Д. Комплексообра-
Наука, 1976. 342 с.
зующие иониты. М.: Химия, 1980. 336 с.