Структура и термодинамическая стабильность LuFe2O4
149
Журнал прикладной химии. 2019. Т. 92. Вып. 2
УДК 66.040.46
СТРУКТУРА И ТЕРМОДИНАМИЧЕСКАЯ СТАБИЛЬНОСТЬ LuFe2O4
© Л. Б. Ведмидь1,2, О. М. Федорова1*, В. М. Димитров1
1 Институт металлургии УрО РАН, Екатеринбург
2 Уральский федеральный университет, Екатеринбург
* E-mail: fom55@mail.ru, elarisa100@mail.ru
Поступила в Редакцию 28 сентября 2018 г.
После доработки 22 ноября 2018 г.
Принята к публикации 29 ноября 2018 г.
В работе сообщается о синтезе при температуре 1363 K и низких давлениях кислорода мультиферро-
ика состава LuFe2O4, его кристаллической структуре и термодинамических свойствах. Для получения
феррита LuFe2O4 использован усовершенствованный метод синтеза в контролируемой атмосфере,
определен диапазон устойчивости этого соединения с изменением парциального давления кислоро-
да в газовой атмосфере при термической обработке. При комнатной температуре образец имеет
ромбоэдрическую структуру (пространственная группа R3m). Методом рентгеновской дифракции
установлены структурные характеристики этого соединения, статическим методом с помощью
вакуумной циркуляционной установки определены его термодинамические свойства.
Ключевые слова: мультиферроики, парциальное давление кислорода, смешанная валентность, струк-
тура, термодинамические свойства.
DOI: 10.1134/S0044461819020026
Материалы на основе оксидов переходных метал-
сификация подразделяет системы на четыре груп-
лов, обладающие смешанной валентностью катионов
пы. Соединения LnFeO3, Ln3Fe5O12 синтезируют на
и сочетающие в себе ферромагнитные и сегнето-
воздухе при температурах выше 1273 K для всех Ln,
электрические свойства, относят к специальному
гомологи LnFe2O4 (Ln = Y, Ho-Lu), Ln2Fe3O7 (Ln = Y,
классу мультиферроиков, что обеспечивает им пер-
Yb, Lu), содержащие разновалентные ионы железа
спективное технологическое применение в инфор-
Fe2+, Fe3+, как правило, получают в восстановитель-
мационных и энергосберегающих технологиях [1].
ной смеси газов CO-CO2-H2-H2O в температурном
Их особенные свойства обусловлены взаимосвязью
интервале выше 1423 K [3-6]. Одним из предста-
между спиновым, зарядовым и орбитальным упоря-
вителей таких материалов является оксид LuFe2O4.
дочением. Механизмы возникновения ферромагнит-
На текущий момент данные о возможности синтеза
ного и сегнетоэлектрического упорядочений этого
соединения LuFe2O4 при температурах ниже 1473 K
класса соединений достаточно различаются, вплоть
отсутствуют. Феррит лютеция привлекает внимание
до взаимного исключения [2]. Для получения по-
исследователей тем, что в нем зарядовое упорядоче-
добных соединений и прогнозирования их свойств
ние происходит при комнатной температуре, и его
необходимы сведения об условиях их существования,
структура изменяется с понижением температуры [5].
структурных, а также термодинамических харак-
В литературе имеются сведения о кристаллической
теристиках. В настоящее время имеются сведения
структуре и физических свойствах YbFe2O4 [7, 8],
о классификации по наличию соединений гомоло-
YFe2O4, ErFe2O4 [9], TmFe2O4 [10], однако данных о
гического ряда LnFeO3·nFeO в системах Ln-Fe-O
термодинамической стабильности этих соединений
(Ln — редкоземельный элемент) в температурном
нет.
интервале 1423-1523 K и сообщения о некоторых
Целью нашей работы являлось выявление усло-
фазовых диаграммах [3, 4]. В зависимости от при-
вий синтеза LuFe2O4 при температуре ниже 1423 K,
сутствия того или иного редкоземельного иона Ln3+
получение термодинамических характеристик при
в соединениях и термодинамических условий клас-
пониженных давлениях кислорода и более детальное
150
Ведмидь Л. Б. и др.
изучение структуры в широком интервале темпе-
формирования газовой среды использовали очищен-
ратур. Наличие подобных сведений имеет важное
ную смесь инертного газа (Ar) и O2, в этом случае в
значение для практического применения этого класса
результате взаимодействия образца с компонентами
соединений.
газовой смеси может происходить только кислород-
ный обмен в отличие от применения смеси газов
CO-CO2-H2-H2O, где возможно образование кар-
Экспериментальная часть
бидов. Рентгенофазовый состав закаленных образ-
Для синтеза образцов LuFe2O4 использовали смесь
цов LuFe2O4 выполнен на дифрактометре XRD 7000
из предварительно просушенных при температуре
фирмы Shimadzu (CuKα-излучение) в диапазоне углов
550°С оксидов Fe2O3 марки ч.д.а. и Lu2O3 чистоты
10 < 2θ < 70° с шагом 0.2°. Полнопрофильный рентге-
99.9%. Эквимолярные соотношения исходных ок-
ноструктурный анализ выполнен методом Ритвельда
сидов смешивали и перетирали в агатовой ступке
с использованием программного комплекса EXPGUI
в течение 1 ч. Из полученной смеси прессовали та-
[12], в качестве исходной использовалась модель,
блетки диаметром 10 мм на гидравлическом прессе
описанная в работе [8]. Термическая стабильность
при давлении 150 кПа·см-2 и обжигали в установке
образцов LuFe2O4 исследована на вакуумной цир-
с замкнутым объемом [11], в кварцевом реакторе
куляционной установке статическим методом [13].
при Т = 1363 K в газовой атмосфере с регулируе-
Регистрация изменения термических свойств соеди-
мым давлением кислорода в течение 18 ч. В условиях
нений выполнена методом дифференциальной скани-
эксперимента максимально возможная температура
рующей калориметрии (ДСК) на приборе DSC 204 F1
синтеза 1363 K обусловлена применением в качестве
(фирмы Netzsch). Измерения проведены в алюминие-
материала реактора кварца. Парциальное давление
вых тиглях в атмосфере азота в температурном интер-
кислорода в газовой атмосфере устанавливается и
вале 110-373 K со скоростью нагрева 10 град·мин-1.
контролируется на протяжении всего опыта с по-
мощью кислородной ячейки, включающей кисло-
Обсуждение результатов
родный датчик и кислородный насос. Управление
работой кислородной ячейки производят програм-
Процесс образования соединений типа RFe2O4
мируемым регулятором давления кислорода. Для
(R = Dy-Lu) можно представить схемой
R3+Fe3+O32- + Fe2+O2- → R3+Fe3+Fe2+O42- → RFe2O4.
(1)
Фиксирование одного параметра — температуры
тервале углов 2θ 25-28° (рис. 2, б). Температура этого
при изменении другого параметра — давления кис-
перехода по нашим данным несколько отличается от
лорода при синтезе образцов позволило установить
данных авторов работы [5], вероятной причиной это-
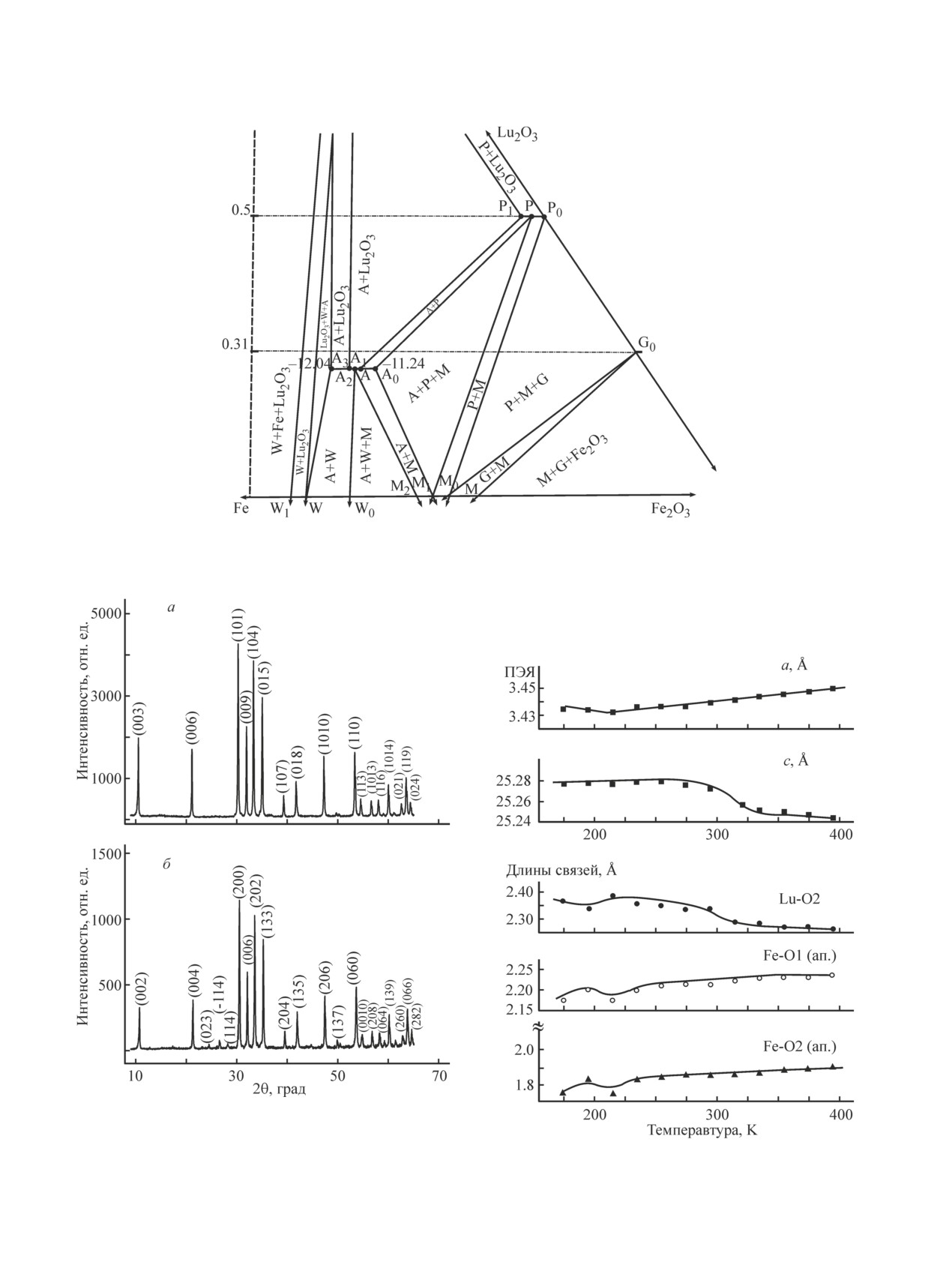
интервал стабильности соединения LuFe2O4. При
го может быть различие в способах получения образ-
изменении парциального давления кислорода при
цов. В пространственной структуре феррита LuFe2O4
температуре 1363 K выше значения PО2 = 10-11.24
анионные полиэдры, в которых разупорядоченно на-
атм рентгенографический анализ фиксирует наличие
ходятся разновалентные катионы железа, образуют
фаз LuFe2O4, LuFeO3 и Fe3O4, применение давления
слои, перпендикулярные главной оси элементарной
кислорода ниже PО2 = 10-12.04 атм приводит к появ-
ячейки z. Катионы железа расположены внутри три-
лению наряду с основной фазой LnFe2O4 фаз Ln2O3
гональной бипирамиды в пятикратном окружении
и FeO (рис. 1). В границах установленного интервала
анионов кислорода. Окружение Lu представляет со-
давлений кислорода образцы сохраняют однофазную
бой октаэдр с шестью анионами кислорода, раздви-
ромбоэдрическую структуру.
нутыми в плоскости x-y, треугольные грани которого
Полученные однофазные образцы LuFe2O4 имеют
ориентированы перпендикулярно главной оси [14].
ромбоэдрическую структуру и принадлежат к про-
На рис. 3 представлена температурная зависи-
странственной группе R3m в гексагональной установ-
мость параметров элементарной ячейки LuFe2O4 c
ке, параметры элементарной ячейки a = 3.4403(1) Å,
ромбоэдрической структурой и длиной связей Lu-О2
c = 25.272(2) Å (рис. 2, а).
и апикальных связей Fe-O1 и Fe-O2. Из рис. 3 вид-
При охлаждении LuFe2O4 ниже 250 K наблюдается
но, что параметр а феррита лютеция незначительно
переход из ромбоэдрической (пр. гр. R3m) в моно-
уменьшается в интервале температур 150-210 K, при
клинную (пр. гр. C2/m) структуру. На рентгенограм-
этом также незначительно уменьшается длина связей
мах этот процесс проявляется появлением пиков в ин-
Fe-O1 и Fe-O2. Затем наблюдается увеличение значе-
Структура и термодинамическая стабильность LuFe2O4
151
Рис. 1. Фрагмент фазовой диаграммы состояния системы Lu-Fe-O при температуре 1363 K.
Обозначение фаз: А — LuFe2O4±δ, Р — LuFeO3±δ, G — Lu3Fe5O12, W — FeO, M — Fe3O4.
Рис. 2. Дифрактограммы образцов LuFe2O4 при 300 (а)
и 150 K (б).
Показаны индексы Миллера для ромбоэдрической (а) и Рис. 3. Температурная зависимость параметров элемен-
моноклинной структур (б).
тарной ячейки (ПЭЯ) и длины связей LuFe2O4.
152
Ведмидь Л. Б. и др.
ния параметра а, вплоть до температуры 400 K. Этот
рост объясняется тепловым расширением образца.
Параметр с остается практически неизменным при
температурах от 150 до 290 K, а затем резко умень-
шается в интервале температур 295-313 K. Такое
поведение параметра с коррелирует с поведением
длины связи Lu-O2. В этом же интервале на кривой
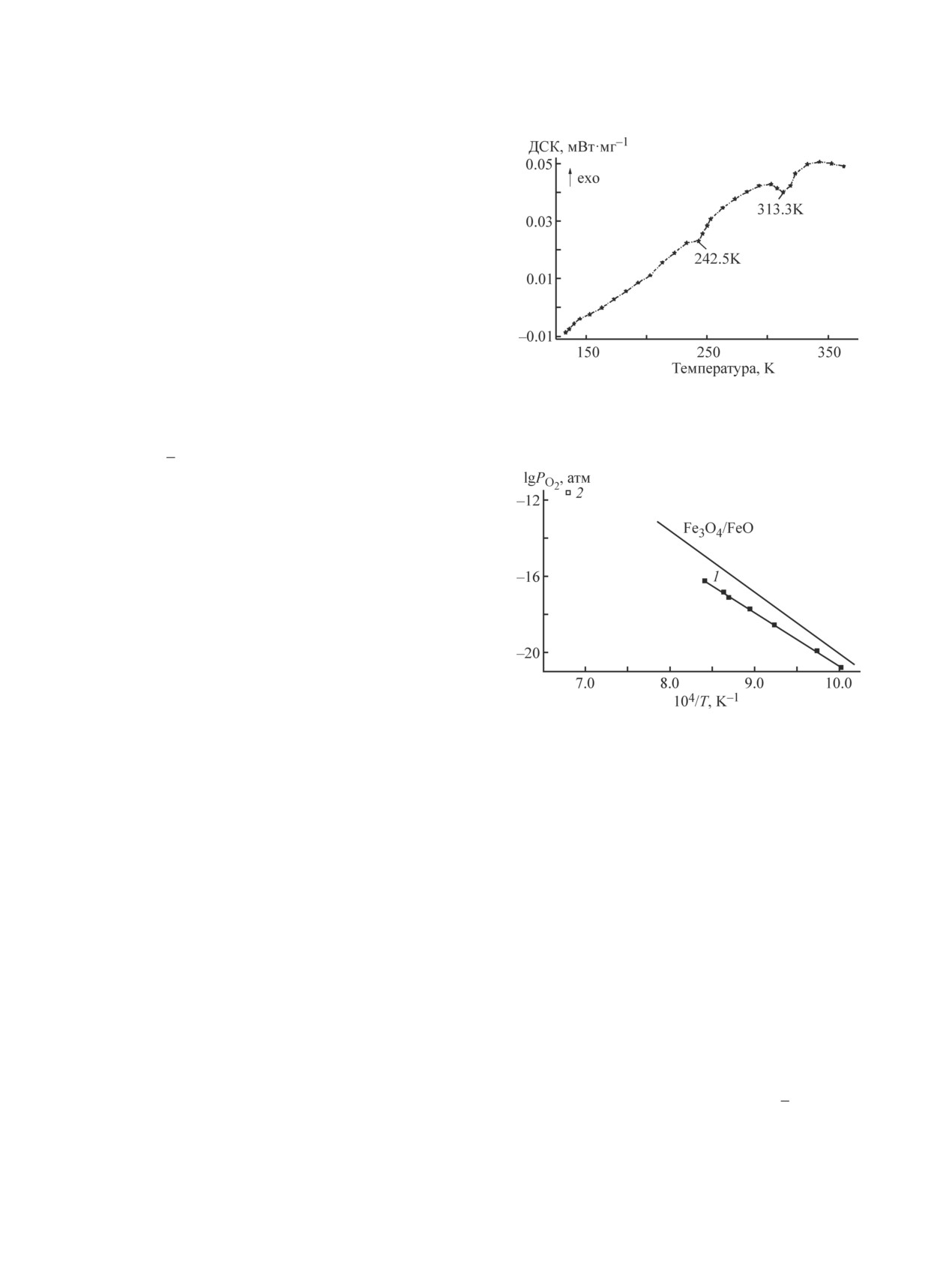
ДСК наблюдается минимум. Уменьшение параметров
с феррита лютеция при 310 K, а также эндотермиче-
ский эффект на кривой ДСК в этом же температур-
ном интервале может свидетельствовать о зарядовом
упорядочении в LuFe2O4. Эта температура совпадает
с данными [5], в которой зарядовое упорядочение в
этом материале было подтверждено методом нейтро-
Рис. 4. Кривая дифференциальной сканирующей кало-
риметрии соединения LuFe2O4.
нографии. Второй эндотермический эффект при тем-
пературе 242.5 K связан со структурным переходом
из пр. гр. R3m в C2/m (рис. 4).
Для установления фазовых равновесий и получе-
ния для них температурных зависимостей равновес-
ного парциального давления кислорода изучен про-
цесс диссоциации соединения LuFe2O4 с помощью
вакуумной циркуляционной установки в интервале
температур 990-1190 K. В условиях эксперимента
под воздействием пониженного давления кислорода
PO2 =10-11.24-10-12.04 атм соединение LuFe2O4 диссо-
циирует с выделением кислорода на простые оксиды
по реакции
LuFe2O4 = 1/2Lu2O3 + 2FeO + 1/4O2.
(2)
При этом температурная зависимость давления
Рис. 5. Температурная зависимость равновесного пар-
кислорода имеет линейный характер (рис. 5, линия 1),
циального давления кислорода при диссоциации соеди-
и выражается уравнением
нения LuFe2O4.
Темные квадраты 1 — наши данные, белый квадрат 2 —
lg(PO2, Па-1) = 12.3-27991/T ± 0.041.
(3)
данные [6].
Точка 2 представляет результаты работы [6], по-
C использованием полученных из уравнения (4)
лученные при более высокой температуре 1473 K.
значений ΔHТº и ΔSТº для реакции (2) и значений тер-
Из уравнения (3) рассчитано изменение свободной
модинамических функций для реакции образования
энергии Гиббса для реакции (2), которое описывает-
простых оксидов Lu2O3 и FeO вычислены изменения
ся выражением
стандартных энтальпии и энтропии образования сое-
ΔGТº = 133.93 - 0.0349T ± 0.12 кДж·моль-1.
(4)
динений из элементов:
ΔHТº = -1610.556 кДж·моль-1, ΔSТº = 237.294 Дж·моль-1·K-1.
Выводы
ния LuFe2O4 из простых оксидов. Установлено, что
в интервале температур 400-150 K LuFe2O4 имеет
Изучены условия синтеза соединения LuFe2O4
ромбоэдрическую кристаллическую структуру и при-
при температуре 1363 K, что позволило дополнить
надлежит к пространственной группе R3m. В области
новыми сведениями Р-Т-Х диаграмму состояния
295-313 K происходит значительное изменение па-
системы Lu-Fe-O. Определены значения термоди-
раметров а и с, не сопровождающееся переходом в
намических характеристик образования соедине-
другую пространственную группу. Такое изменение
Структура и термодинамическая стабильность LuFe2O4
153
параметров можно объяснить происходящим в этом
[5] Blasco J., Lafuerza S., Subias G. // Phys. Rev. 2014.
диапазоне изменением длин связей Lu-O и Fe-O1,
V. 90. P. 094119 (1-11).
Fe-O2. В интервале температур 295-313 K происхо-
[6] Sekine T., Katsura T. // J. Solid State Chem. 1976.
V. 17. P. 49-54.
дит увеличение длины связи Lu-O2 и уменьшение
[7] Katano S., Matsumoto T., Funahashi S., Iida J., Tana-
апикальных длин связей Fe-O1(ap) и Fe-O2, кото-
ka M., Cable J. W. // Physica B. 1995. V. 213. P. 218-
рое вызывает сжатие бипирамид FeO5 и увеличение
222.
высоты октаэдра LuO6. Совпадение температурного
[8] Hervieu M., Damay F., Maignan A., Martin C. // Solid
интервала зарядового упорядочения и резкого умень-
State Sci. 2015. V. 48. P. A1-A6.
шения параметра с может свидетельствовать о связи
[9] Matsumoto T., Mori N., Iida J., Tanaka M., Siratori K.,
этих двух процессов.
Izumi F., Asano H. // Physica B. 1992. V. 180. P. 603-
Работа выполнена в рамках государственного зада-
606.
ния ИМЕТ УрО РАН с использованием оборудования
[10] Yoshii K., Ikeda N., Nakamura A. // Physica B. 2006.
центра коллективного пользования Урал-М.
V. 378-380. P. 585-586.
[11] Пат. РФ 2548949 (опубл. 2015). Способ форми-
рования газовой смеси для анализа и обработки
материалов при переменном давлении.
Список литературы
[12] Toby B. H. // J. Appl. Crystallogr. 2001. V. 34. P. 210-
[1] Pyatakov A. P., Zvezdin A. K. // Successes Phys. Sci.
213.
2012. V. 182. N 6. P. 593-620.
[13] Янкин А. М., Балакирев В. Ф., Ведмидь Л. Б., Федо-
[2] Kimizuka N., Takenaka A., Sasada Y., Katsura T. // Solid
рова О. М. // ЖФХ. 2003. Т. 77. № 11. C. 2108- 2111
State Commun. 1974. V. 15. P. 1321-1323.
[Yankin A. M., Balakirev V. F., Vedmid′ L. B., Fedoro-
[3] Katsura T., Sekine T., Kitayama K., Sugihara T., Ki-
va O. M. // Russ. J. Phys. Chem. 2003. V. 77. N 11.
mizuka N. // J. Solid State Chem. 1978. V. 23. P. 43- 57.
P. 1899-1902].
[4] Kimizuka N., Katsura T. // J. Solid State Chem. 1975.
[14] Безносиков Б. В., Александров К. С. // Перспектив.
V. 15. P. 151-157.
материалы. 2007. T. 1. C. 46-49.