Модифицированный озонолитический синтез из циклического содимера бутадиена и изопрена...
213
Журнал прикладной химии. 2019. Т. 92. Вып. 2
УДК 547.364+547.996+632.936.2
МОДИФИЦИРОВАННЫЙ ОЗОНОЛИТИЧЕСКИЙ СИНТЕЗ
ИЗ ЦИКЛИЧЕСКОГО СОДИМЕРА БУТАДИЕНА И ИЗОПРЕНА
4Z-НОНЕН-1-ОЛА — ПОЛУПРОДУКТА ДЛЯ ПОЛОВЫХ ФЕРОМОНОВ
ХЛОПКОВОЙ И КАПУСТНОЙ СОВОК
© Г. Ю. Ишмуратов, Ю. В. Мясоедова, Л. Р. Гарифуллина,
Э. Р. Нуриева, Н. М. Ишмуратова
Уфимский институт химии Уфимского федерального исследовательского центра РАН
Е-mail: insect@anrb.ru
Поступила в Редакцию 10 ноября 2018 г.
После доработки 13 ноября 2018 г.
Принята к публикации 29 ноября 2018 г.
Разработан улучшенный метод синтеза 4Z-нонен-1-ола — ключевого синтона для половых феромонов
капустной и хлопковой совок — из циклического соолигомера бутадиена и изопрена (1-метил-1Z,5Z-ци-
клооктадиена), базирующийся на одностадийном превращении пероксидного продукта региоселектив-
ного частичного озонолиза (0.9 экв. O3) по тризамещенной двойной связи в 9-гидрокси-5Z-нонен-2-оне
с помощью NaBH(OAc)3 — реагента, не затрагивающего имеющиеся в структуре или образующиеся
кето-функции.
Ключевые слова: озонолиз, 1-метил-1Z,5Z-циклооктадиен, 9-гидрокси-5Z-нонен-2-он, 4Z-нонен-1-ол,
триацетоксиборгидрид натрия.
DOI: 10.1134/S0044461819020117
Более чем полувековая история «эры пестицидов»,
важное место занимают феромонные препараты и
стратегия борьбы в которой с насекомыми-вредите-
актуальной является разработка оптимальных схем
лями базировалась на поиске все более эффективных
синтеза составляющих феромонов [1-4], так как
и экологически приемлемых инсектицидов — хими-
обычно они вырабатываются в организмах насекомых
ческих соединений «убивающего» действия, выявила
в ничтожно малых (нанограммовых) количествах,
их широко известные недостатки: токсичность, низ-
и единственно реальным способом получения их
кую видовую специфичность и быструю выработ-
для практики является направленный химический
ку механизма нейтрализации этих ксенобиотиков.
синтез.
Данных недостатков лишены инсектициды нового
Хлопковая (Heliothis armigera) и капустная (Ma-
поколения — феромоны насекомых, действующие
mestra brassicae) совки, чьи гусеницы питаются на
по иному принципу и экологически безопасные. Фе-
многих растениях, включая культивируемые, явля-
ромоны, вырабатываемые и выделяемые в окружа-
ются опасными многоядными вредителями сель-
ющую среду самими насекомыми, — биологически
скохозяйственных культур. Главные компоненты их
активные вещества, влияющие на физиологическое
половых феромонов - производные 11Z-гексадецен-
состояние и поведение других особей того же вида.
1-ола (1) [11Z-гексадеценаль (3) и 11Z-гексадецен-
Зная количественное соотношение входящих в не-
1-илацетат (2)] ранее получали «ацетиленовым»
го компонентов и химическое строение последних,
методом через соответствующие алкины, олефини-
синтезируя их и составляя из них феромонные ком-
рованием карбонильных соединений по Виттигу и
позиции, можно управлять поведением насекомых:
модификацией углеродного скелета Z-ненасыщенных
направлять в клеевые ловушки, дезориентировать в
соединений [5, 6].
поисках партнера, сгонять с заселенных ими растений
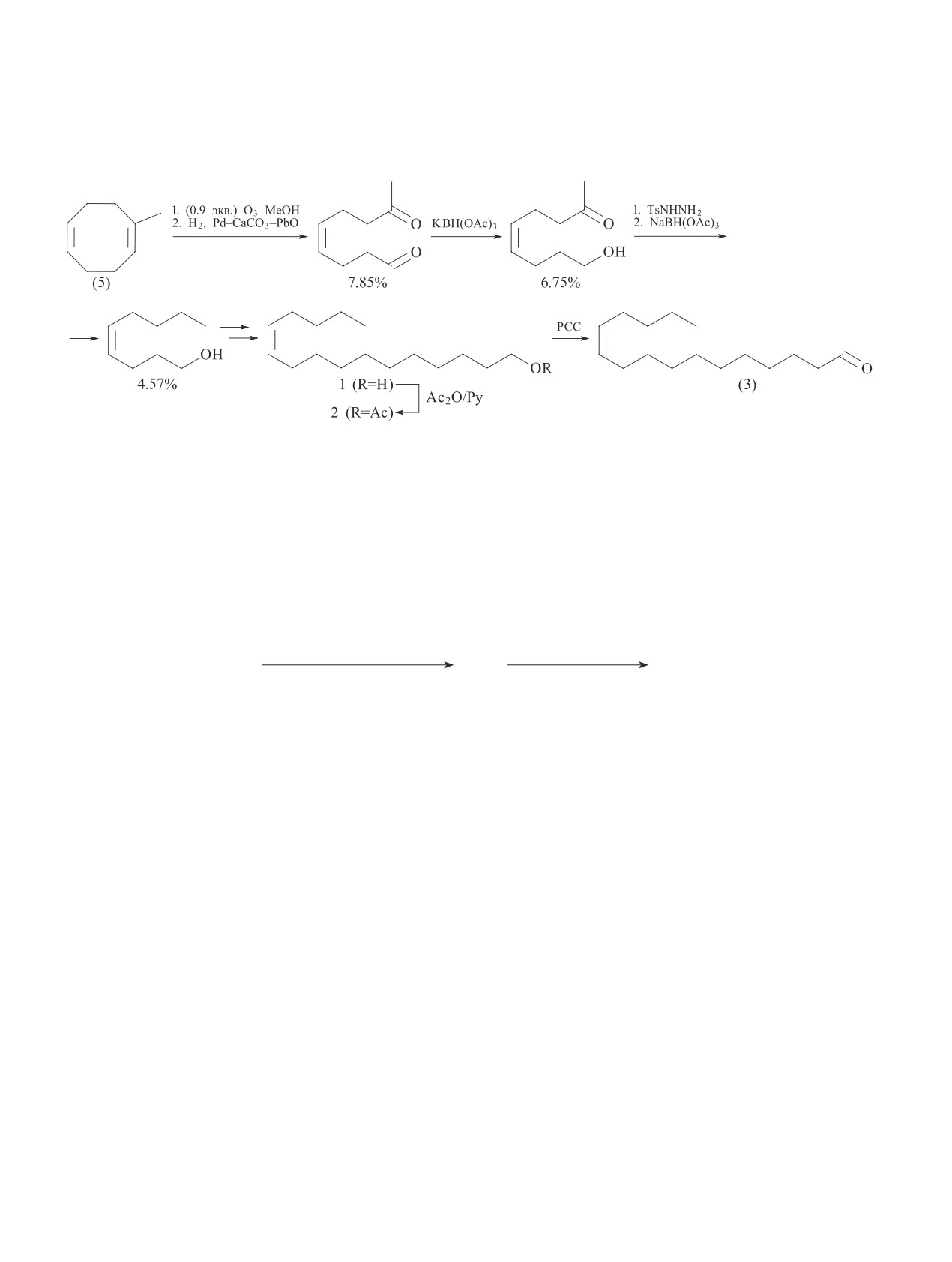
Целью данного исследования являлась разработка
и т. д. Поэтому в интегрированной защите растений модифицированного озонолитического синтеза полу-
214
Ишмуратов Г. Ю. и др.
продукта для феромонов (2) и (3) — 4Z-нонен-1-ола
1.88 г (30.0 ммоль) 80%-ного гидразингидрата, пе-
(4) — исходя из циклического содимера бутадиена и
ремешивали 3 ч и оставляли на 16 ч при комнатной
изопрена (5).
температуре. Затем прибавляли 2.8 г (50.0 ммоль)
KОН, кипятили 2 ч с обратным холодильником,
после чего отгоняли воду и избыток реагента на-
Экспериментальная часть
греванием смеси до 195°С, выдерживали еще 4 ч
ИК спектры записывали на приборе IR Prestige-21
при той же температуре, после чего охлаждали до
(Fourier Transform Spectrophotometer, Shimadzu) в
комнатной температуры, разбавляли 10 мл воды и
тонком слое; спектры ЯМР — на спектрометре
экстрагировали диэтиловым эфиром (4 × 50 мл).
Bruker AvanceIII 500 [рабочие частоты 500.13 (1Н),
Объединенный органический слой сушили Na2SO4
125.76 МГц (13С)] в CDCl3, внутренний стандарт —
и упаривали. Остаток хроматографировали (SiO2,
тетраметилсилан. Газожидкостную хроматографию
гексан-Et2O, 3:1), выделяя 0.98 г (68%) алкенола (4),
выполняли на приборе Chrom-5 [длина колонки
спектры ИК и ПМР которого идентичны описанным
1.2 м, неподвижная фаза — силикон SE-30 (5%) на
в работе [8].
носителе Chromaton N-AW-DMCS (0.16-0.20 мм),
рабочая температура 50-300°С], Chrom-41 (дли-
Обсуждение результатов
на колонки 2.4 м, неподвижная фаза — PEG-6000,
рабочая температура 50-200°С), газ-носитель —
Успехи в области металлокомплексного катализа
гелий. Контроль методом тонкослойной хромато-
в олигомеризации простейших 1,3-диенов и алкенов
графии проводили на SiO2 марки Sorbfil (Россия).
делают доступными различные непредельные сое-
Для колоночной хроматографии применяли SiO2
динения регулярной структуры, в частности цикли-
(70-230) марки Lancaster (Великобритания). Данные
ческие ди- и триены. В свою очередь последующее
элементного анализа всех соединений соответство-
хемо- и региоселективное расщепление одной из
вали вычисленным. Производительность озонатора
кратных связей в таких циклополиенах открывает
40 ммоль О3/ч.
эффективные пути к ациклическим α,ω-бифункцио-
9-Гидрокси-5Z-нонен-2-он (6). Через раствор 1.95 г
нальным ненасыщенным блок-синтонам, способным
(16.0 ммоль) циклодиена (5) в 16 мл перегнанно-
к дальнейшим хемоселективным превращениям в
го циклогексана, содержащего 1.85 мл (32.0 ммоль)
направленном синтезе биологически активных ве-
ледяной уксусной кислоты, барботировали при 5°С
ществ, в том числе низкомолекулярных биорегуля-
озонокислородную смесь до поглощения 14.4 ммоль
торов насекомых, содержащих в своей структуре
озона. Реакционную смесь продували аргоном, де-
Z- либо Е-алкеновые фрагменты [9].
кантировали растворитель от выделившегося перок-
Ранее сообщалось [7] об эффективном синтезе
сидного продукта, который далее разбавляли 45 мл
ряда феромонов насекомых, в том числе и феромонов
хлористого метилена и при перемешивании (10°С)
(2) и (3), основанном на селективном парциальном
добавляли к предварительно приготовленной суспен-
озонолизе циклического соолигомера изопрена и бу-
зии NaBH(OAc)3 [получена прибавлением раствора
тадиена — 1-метил-1Z,5Z-циклооктадиена (5) [10].
11.9 г (198.0 ммоль) ледяной АсОН в 20 мл CH2Cl2 к
Установлено, что частичный озонолиз 0.9 экв. озона
суспензии 2.50 г (66.0 ммоль) NaBH4 в 100 мл CH2Cl2
протекает с 90%-ной селективностью по тризамещен-
с последующим перемешиванием в течение 2 ч].
ной двойной связи при 5°С в циклогексане в присут-
Затем реакционную смесь нагревали до комнатной
ствии 4 экв. метанола и дает после восстановления
температуры, перемешивали 3 ч, после чего охлаж-
водородом над катализатором Линдлара кетоальдегид
дали до 10°С и добавляли к ней раствор 4.5 г NaOH в
(7). Обработка последнего триацетоксиборгидридом
100 мл воды. Органический слой отделяли, промыва-
калия ведет к ненасыщенному гидроксикетону (6),
ли последовательно насыщенным раствором NH4Cl и
превращение которого в соответствующий тозилги-
водой, сушили Na2SO4 и упаривали. Получили 1.92 г
дразон и последующее взаимодействие с триацеток-
(85%) кетоспирта (6) 96%-ной химической чистоты
сиборгидридом натрия дают 4Z-нонен-1-ол (4), об-
(по данным капиллярной ГЖХ), спектры ИК и ПМР
щий выход которого на субстрат (5) составляет 36%.
которого практически совпадают с описанными в
Превращения по гомологизации ключевого алкено-
работе [7].
ла (4) в 11Z-гексадецен-1-ол (1) и далее в целевые
4Z-Нонен-1-ол (4). К 1.56 г (10 ммоль) 9-ги-
феромоны (2) и (3) выполнены катализированным
дрокси-5Z-нонен-2-она (6), растворенного в 10 мл
Li2CuCl4 кросс-сочетанием тозилата 4Z-нонен-1-ола
диэтиленгликоля, добавляли при 15°С по каплям
с реагентом Гриньяра из 7-бром-1-(1-этокси)этокси-
Модифицированный озонолитический синтез из циклического содимера бутадиена и изопрена...
215
гептана с последующим кислым гидролизом, даль- пиридиния либо ацетилированием в стандартных
нейшим хемоселективным окислением хлорхроматом условиях:
В данной работе нами оптимизирован озоноли-
щиеся в структуре или образующиеся кето-функции.
тический синтез базового для получения феромонов
Это позволило сократить одну из стадий [синтез ке-
(2) и (3) кетоспирта (6) исходя из того же субстрата
тоальдегида (7)], число реагентов и повысить выход
(5). Для этого был осуществлен его парциальный
ненасыщенного кетоспирта (6). Дезоксигенирование
озонолиз действием 0.9 экв. О3 в циклогексане в при-
последнего по Хуанг-Минлону в диэтиленгликоле
сутствии 2 экв. ледяной уксусной кислоты, при этом
через соответствующий гидразон привело к ключе-
в качестве восстановителя применен NaBH(OAc)3,
вому 4Z-нонен-1-олу (4) с общим выходом 57%, что
ранее успешно использованный [11, 12] в качестве
более чем на 20% превысило таковой в известном
хемоселективного гидридного реагента для пероксид-
трехстадийном синтезе:
ных продуктов озонолиза, не затрагивающего имею-
1. (0.9 экв.)O3, c-C6H12, AcOH
1. NH2NH2·H2O, DEG
(5)
6.85%
4.68%.
2. NaBH(OAc)3
2. KOH, Δ
Выводы
[2] Фролова Л. Л., Безуглая Л. В., Попов А. В., Ку-
чин А. В., Вендило Н. В. // Изв. Коми науч. центра
Нами модифицирован озонолитический синтез
УрО РАН. 2012. № 1. С. 11-23.
4Z-нонен-1-ола — ключевого полупродукта для ма-
[3] Ишмуратов Г. Ю., Яковлева М. П., Ишмурато-
жорных компонентов половых феромонов хлопковой
ва Н. М., Толстиков А. Г., Толстиков Г. А. Монотер-
и капустной совок, в основе которого применение
пеноиды в химии оптически активных феромонов
триацетоксиборгидрида натрия, хемоселективно ре-
насекомых. М.: Наука, 2012. 171 с.
агирующего с пероксидными продуктами озонолиза
[4] Ишмуратов Г. Ю., Легостаева Ю. В., Гарифул-
и альдегидами в присутствии кето-функции, что по-
лина Л. Р., Боцман Л. П., Яковлева М. П., Тол-
зволило сократить одну из стадий и повысить общий
стиков Г. А. // Химия природ. соединений. 2015.
выход более чем на 20%.
№ 2. С. 177-196 [Ishmuratov G. Yu., Legostaeva Yu. V.,
В работе использовали оборудование Центра
Garifullina L.R., Botsman L. P., Yakovleva M. P.,
коллективного пользования «Химия» Уфимского
Tolstikov G. A. // Chem. Nat. Compounds. 2015. V. 51.
N 2. P. 199-219].
института химии УФИЦ РАН. Работа выполне-
[5] Одиноков В. Н., Серебряков Э. П. Синтез феромонов
на при финансовой поддержке программы РАН
насекомых. Уфа: Гилем, 2001. 372 с.
«Фундаментальные основы химии», тема № 8
[6] Ишмуратов Г. Ю., Ишмуратова Н. М., Одино-
«Хемо-, регио- и стереоселективные превращения
ков В. Н., Толстиков Г. А. // Химия природ. соеди-
терпеноидов, стероидов и липидов в направленном
нений. 1997. Т. 33. № 1. С. 34-42 [Ishmuatov G. Yu.,
синтезе низкомолекулярных биорегуляторов» (№ гос-
Ishmuratova N. M., Odinokov V. N., Tolstikov G. A. //
регистрации АААА-А17-117011910023-2, 2017 г.).
Chem. Nat. Compounds. 1997. V. 33. N 1. P. 25-30].
[7] Толстиков Г. А., Одиноков В. Н., Галеева Р. И.,
Список литературы
Бакеева Р. С., Ахунова В. Р. // Химия природ. соеди-
[1] Ando T., Yamakawa R. // Nat. Prod. Rep. 2015. V. 32.
нений. 1982. Т. 18. № 2. C. 239-245 [Tolstikov G. A.,
P. 1007-1041.
Odinokov V. N., Galeeva R. I., Bakeeva R. S., Akhu-
216
Ишмуратов Г. Ю. и др.
nova V. R. // Chem. Nat. Compounds. 1982. V. 18. N 2.
[11] Ишмуратов Г. Ю., Харисов Р. Я., Яковлева М. П.,
P. 219-224].
Боцман О. В., Муслухов Р. Р., Толстиков Г. А. //
[8] Millar J. G., McElfresh J. S., Romero C., Vila M.,
ЖОрХ. 2001. T. 37. № 1. C. 49-50 [Ishmura-
Mari-Mena N., Lopez-Vaamonde C. // J. Chem.
tov G. Yu., Kharisov R. Ya., Yakovleva M. P.,
Ecology. 2010. V. 36. N 9. P. 923-932.
Botsman O. V., Muslukhov R. R., Tolstikov G. A. //
[9] Ишмуратов Г. Ю., Харисов Р. Я., Одиноков В. Н.,
Russ. J. Org. Chem. 2001. V. 37. N 1. Р. 37-39].
Толстиков Г. А. // Успехи химии. 1995. T. 64. № 6.
[12] Ишмуратов Г. Ю., Легостаева Ю. В., Боц-
C. 580-608 [Ishmuatov G. Yu., Kharisov R. Ya., Odi-
ман Л. П., Насибуллина Г. В., Муслухов Р. Р., Каза-
nokov V. N., Tolstikov G. A. // Rus. Chem. Rev. 1995.
ков Д. В., Толстиков Г. А. // ЖОрХ. 2012. Т. 48.
V. 64. N 6. P. 541-568].
№ 1. С. 26-32 [Ishmuratov G. Yu., Legostaeva Yu. V.,
[10] Одиноков В. Н., Бакеева Р. С., Галеева Р. И., Аху-
Botsman L. P., Nasibullina G. V., Muslukhov R. R.,
нова В. Р., Мухтаров Я. Г., Толстиков Г. А., Ха-
Kazakov D. V., Tolstikov G. A. // Russ. J. Org. Chem.
лилов Л. М., Панасенко А. А. // ЖОрХ. 1979. T. 15.
2012. V. 48. N 1. Р. 18-24].
C. 2017.