Исследование сорбционных свойств болотных руд для извлечения ионов марганца и железа из подземных вод
257
Журнал прикладной химии. 2019. Т. 92. Вып. 2
УДК 628.161.2:54.414
ИССЛЕДОВАНИЕ СОРБЦИОННЫХ СВОЙСТВ БОЛОТНЫХ РУД
ДЛЯ ИЗВЛЕЧЕНИЯ ИОНОВ МАРГАНЦА И ЖЕЛЕЗА ИЗ ПОДЗЕМНЫХ ВОД
© А. И. Фоменко, Л. И. Соколов
Вологодский государственный университет, Вологда
Е-mail: fomenko1212@indox.ru
Поступила в Редакцию 28 августа 2018 г.
После доработки 23 ноября 2018 г.
Принята к публикации 29 ноября 2018 г.
Представлены результаты исследований сорбционных свойств железомарганцевых болотных руд
с целью оценки возможности использования их для очистки природной питьевой воды из подземных
источников от ионов марганца и железа. Изучены кинетические зависимости процесса сорбции,
определены сорбционные характеристики болотных руд по отношению к ионам марганца и железа.
Установлено, что исследованный природный материал является эффективным сорбентом для извле-
чения ионов марганца и железа из подземных вод без применения дополнительных реагентов.
Ключевые слова: адсорбция, природные сорбенты, изотермы сорбции, количественные характери-
стики процесса адсорбции.
DOI: 10.1134/S004446181902018X
Поиск новых материалов фильтрующей загрузки
бляемыми в настоящее время, природные сорбенты
для удаления ионов марганца и железа из подземных
обладают рядом ценных особенностей. Природные
вод в значительной степени обусловлен повышен-
сорбенты безвредны, позволяют получить воду гаран-
ным содержанием этих примесей в используемых
тированного качества по содержанию ионов марганца
для питьевых целей природных водах. Для удале-
и железа в одну ступень водоподготовки, производ-
ния ионов марганца и железа из подземных вод ис-
ство их экологически безопасно и требует меньших
пользуют аэрацию, дегазацию, фильтрование через
материальных затрат.
инертную загрузку [1, 2] или загрузку, предваритель-
В литературе приведены результаты исследований
но обработанную реагентами, в качестве которых
по изучению сорбционных свойств по отношению к
в основном используются водные растворы солей
ионам марганца и железа низкосортных марганцевых
двухвалентного железа и двухвалентного марганца
руд [9, 10] и их использованию в качестве материала
[3, 4] или смеси оксидов марганца [5], водным рас-
фильтровально-сорбционной загрузки при водопод-
твором, содержащим ионы двухвалентного железа
готовке. Показано, что марганцевые руды обладают
[6], и др. Реагентный метод подготовки фильтрующей
каталитическими свойствами реакции окисления
загрузки является самым распространенным в прак-
ионов марганца двухвалентного до четырехвалент-
тике водоподготовки подземных вод для питьевых
ного и ионов железа двухвалентного до трехвалент-
целей. Реализация таких методов требует значитель-
ного. Образующиеся малорастворимые соединения
ных расходов химических реагентов, большой про-
удерживаются поверхностью сорбента-катализатора.
должительности и трудоемкости при изготовлении
Установлено, что при фильтровании марганецсодер-
материала фильтровально-сорбционной загрузки,
жащей воды через загрузку на поверхности зерен
сложного аппаратурного оформления, необходимости
марганцевой руды образуется слой из отрицательно
регенерации фильтрующего материала, что приводит
заряженного осадка оксигидрата марганца Mn(ОН)4,
к удорожанию способа очистки воды.
который адсорбирует Mn2+. Гидролизуясь, эти ио-
Известны работы [7, 8], показывающие, что по
ны вступают в реакцию с осадком, образуя Mn2О3,
сравнению с синтетическими сорбентами, потре-
хорошо окисляемый до оксигидрата марганца(IV),
258
Фоменко А. И., Соколов Л. И.
действующего в процессе окисления в качестве ка-
несситы (Na,Ca,K,Ba,Li)x(Mn4+,Mn3+)2O4∙1.5H2O,
тализатора:
асболаны (Co,Ni)xMn4+O4∙nH2O, тодорокит
(K,Ca,Mn2+)(Mn4+,Mn2+,Mg)6O12∙3H2O, вер-
Mn(ОН)4 + Mn(ОН)2 → Mn2О3 + 3Н2О,
надиты (Mn4+,Fe3+,Ca,Na)O2∙nH2O, бузерит
2Mn2О3 +О2 + 8Н2О → 4Mn(ОН)4↓.
Na0.31+(Mn0.694+,Mn0.313+)O2∙0.4H2O. Минеральные
Показано, что соединения марганца и других ме-
фазы железа представлены гидроксидами же-
таллов, содержащихся в природном минерале, в очи-
леза — гетитом α-FeO(OH), лепидокрокитом
щаемую воду не выделяются. Основным преимуще-
δ-FeO(OH), γ-FeO(OH), акаганеитом β-FeO(OH),
ством использования марганцевых руд для очистки
гематитом α-Fe2O3, гидратом железа 5Fe2O3·9Н2О.
подземных вод перед искусственно полученными
Породообразующие минералы в исследованных
фильтрующими материалами является отсутствие
образцах представлены в основном кварцем, гли-
необходимости химического возобновления поверх-
нистыми минералами. Особенностью железомар-
ности загрузки в процессе эксплуатации, достаточно
ганцевых болотных руд является значительное
отмывки водой. Однако месторождения таких руд
содержание марганца и железа. Химический со-
встречаются только в определенных регионах, что
став исследованных образцов болотной руды
ограничивает их широкое применение для целей водо-
определяется следующим содержанием (мас%):
подготовки питьевой воды из подземных источников.
54.88-60.69 Mn, 26.27-33.0 Fe, 4.62-5.0 Si, 2.58-
В работе [11] в качестве сорбента для очистки во-
3.02 Ca, 0.90-0.89 Mg, 1.69-1.79 Al, 0.03-0.60
ды от ионов железа исследованы железомарганцевые
Na, 1.01-1.02 K, 0.31-0.46 Ba, 0.26-0.29 P [12].
конкреции Финского залива. Показано, что исследо-
Задача наших исследований состояла в изучении
ванные конкреции характеризуются более высокими
сорбционных характеристик природного материа-
значениями динамической емкости, чем импортные
ла в его естественном состоянии, что имеет важное
пиролюзитсодержащие сорбенты, действие которых
значение при использовании его как фильтрующей
основано на реакции окисления Fe(II) до Fe(III) с
загрузки для обезжелезивания и деманганации под-
образованием малорастворимого осадка гидроксида
земных вод в системах водоподготовки для малочис-
железа(III):
ленных населенных пунктов на территориях забо-
лоченных регионов. Для проведения исследований
MnO2 + 2Fe2+ + 5H2O → MnO + 2Fe(OH)3↓ + 4H+.
использовались образцы железомарганцевых болот-
Возможность широкого применения океанских
ных руд в воздушно-сухом состоянии. Данная руда
железомарганцевых конкреций также ограничена их
темно-коричневого цвета, имеет рыхлую механиче-
малой доступностью для многих регионов.
скую структуру и легко измельчается в фарфоровой
Целью данной работы являлось исследование
ступке. Для исследований исходную железомарган-
сорбционных характеристик болотных руд для их
цевую болотную руду измельчали до размера есте-
использования в качестве сорбционной загрузки для
ственных гранул, рудную составляющую отделяли от
очистки от ионов марганца и железа питьевой воды
песчано-глинистой составляющей ситовым методом.
из подземных источников в системах водоподготовки
Подготовленные таким образом пробы болотной руды
небольшой производительности, что характерно для
рассматривались как исходные. Измельченная и под-
малочисленных населенных пунктов, а также в систе-
готовленная путем сухого рассева по классам круп-
мах нецентрализованного водоснабжения.
ности проба хранилась при комнатной температуре
Выбор природного материала обусловлен его
в стеклянной посуде с плотной крышкой и являлась
доступностью на территориях многих заболочен-
материалом для взятия аналитической пробы, пред-
ных регионов. Количественная оценка сорбционной
назначенной для лабораторных исследований.
способности болотных руд проведена на примере
Для сорбции ионов марганца и железа использова-
железомарганцевых болотных руд месторождений
ли рудную составляющую, представленную смесью
Вологодской области.
фракций класса крупности 0.16-1.25 мм. Сорбцию
Железомарганцевые болотные руды, пока-
ионов марганца и железа болотной рудой изучали в
затели основных адсорбционных свойств ко-
статическом режиме при температуре 25°С с исполь-
торых были исследованы в данной работе,
зованием модельных растворов, приготовленных на
являются полиминеральным природным образова-
дистиллированной воде, и природных подземных вод
нием с преобладающим содержанием рудных Mn-
при соотношении твердой (т) и жидкой (ж) фаз 1:100.
и Fe-минералов сорбционного типа. Основными
Модельные растворы определяемых ионов готовили
минеральными фазами марганца являются бер-
по навескам соли сульфата марганца MnSO4 и желе-
Исследование сорбционных свойств болотных руд для извлечения ионов марганца и железа из подземных вод
259
зоаммонийных квасцов Fe2(SO4)3∙(NH4)2SO4∙24H2O
леза общего обобщены построением графической
с повышенными относительно реальной природной
зависимости концентрации остаточного содержания
воды из подземных источников концентрациями ио-
определяемых ионов в растворе от продолжительно-
нов марганца и железа. Эффективность сорбции в
сти контакта раствора с сорбентом τ в координатах
каждом конкретном случае оценивали путем сравне-
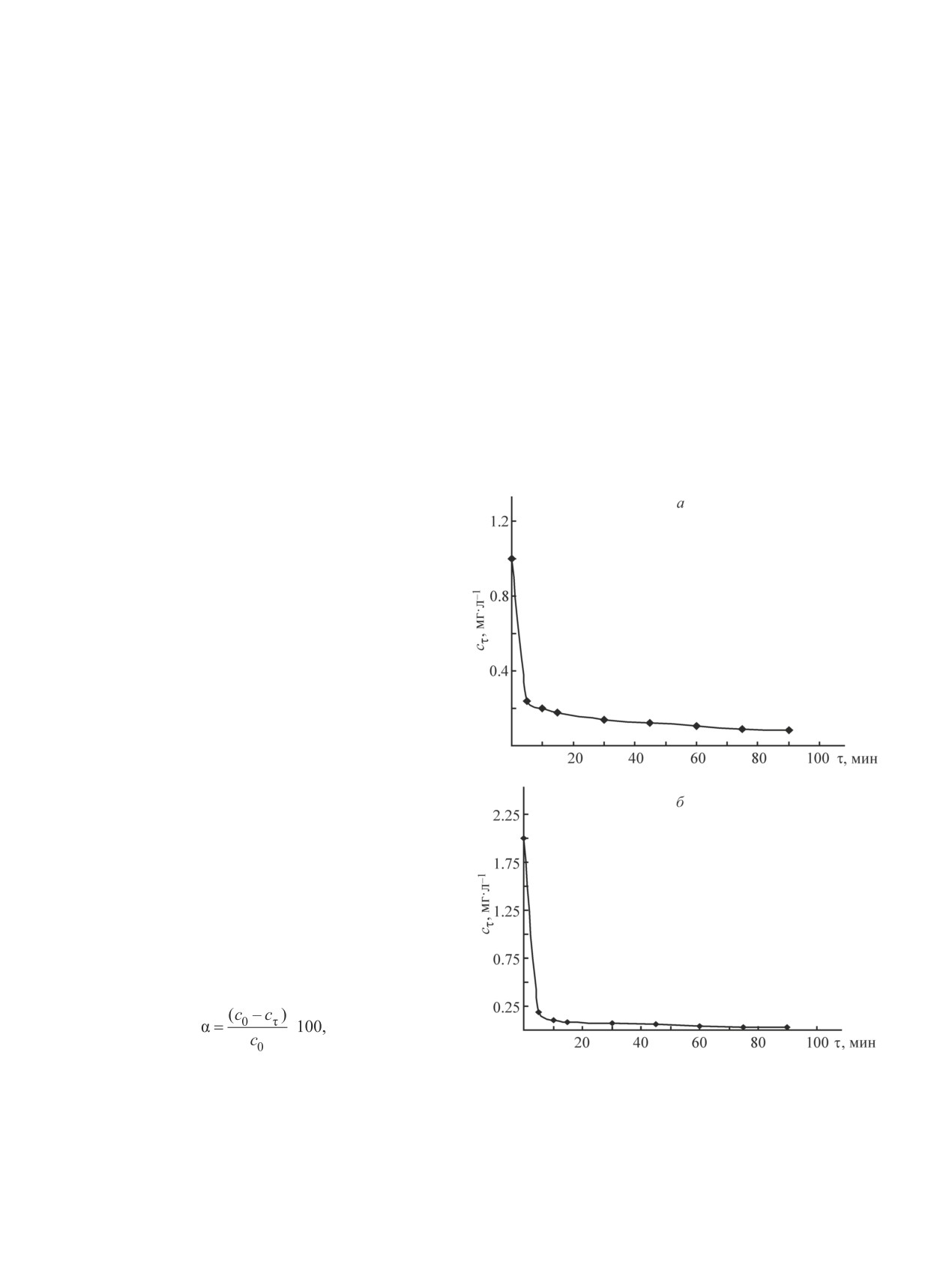
сτ = f(τ) (рис. 1).
ния значения исходной концентрации определяемых
Как видно из представленных кинетических кри-
ионов в растворе с остаточной концентрацией после
вых, характер сорбционной активности определяе-
контакта раствора с сорбентом. Контроль содержания
мых ионов идентичен, максимальные скорости извле-
ионов марганца и железа в исходных и равновесных
чения ионов марганца и железа общего из раствора
растворах осуществляли фотометрическим методом
отмечаются на начальных стадиях сорбции в интер-
на фотоколориметре КФК-2МП по методикам [13].
вале первых минут контакта раствора с сорбентом.
Исследование сорбции ионов железа проводили ме-
Степень извлечения ионов марганца в течение пер-
тодом, основанным на взаимодействии ионов Fe3+ с
вых 5 мин контакта раствора с сорбентом достигала
роданидом аммония, при длине волны λ = 540 нм с
76.1%, а через 30 мин составила 86.3%, достигая в
использованием кюветы с толщиной поглощающего
течение 90 мин 91.5%. Степень извлечения ионов же-
свет слоя 30 мм. Адсорбционную активность болот-
леза общего в данном диапазоне продолжительности
ных руд по катионам марганца определяли методом,
сорбции составила 90.8, 96.4 и 98.4% соответственно.
основанным на взаимодействии ионов марганца с
персульфатом аммония в кислой среде, при длине
волны λ = 540 нм с использованием кюветы с тол-
щиной поглощающего свет слоя 50 мм. Пределы до-
пускаемой погрешности при измерении ±0.5%. Все
реактивы использовали марки х.ч. В процессе иссле-
дований рН раствора не корректировали. Измерения
рН растворов проводили с использованием иономера
И-130М, погрешность метода ±0.05%. Во всех экс-
периментах каждое значение определяемой величины
сорбции является средним арифметическим из ре-
зультата трех измерений. Погрешность эксперимента
не превышала 10%.
Для изучения кинетики процесса в конические
колбы емкостью 250 мл помещали пробы образца
сорбента массой 1 г, добавляли 100 мл модельного
водного раствора с фиксированной концентрацией
определяемых ионов марганца (1 мг·л-1) и железа об-
щего (2 мг·л-1), перемешивали на магнитной мешал-
ке в течение 1-2 мин. Продолжительность контакта
раствора с сорбентом составляла 5-90 мин, через
каждые 5 мин отбирали пробы очищаемого раство-
ра для анализа. Степень извлечения определяемых
ионов из раствора α (%), рассчитывали по разности
концентраций начальной с0 и остаточной в каждый
данный момент времени сτ по формуле
∙
где с0 — начальная концентрация определяемых
Рис. 1. Кинетическая кривая сорбции определяемых
ионов в растворе (мг·л-1), сτ — остаточная концен-
ионов марганца (а) и железа общего (б) из раствора
трация определяемых ионов в растворе в момент
железомарганцевой болотной рудой.
времени τ (мг·л-1).
сτ — остаточное содержание определяемых ионов в рас-
Результаты экспериментального изучения кине-
творе, τ — продолжительность контакта раствора с сор-
тики сорбции болотной рудой ионов марганца и же-
бентом.
260
Фоменко А. И., Соколов Л. И.
Адсорбционную активность железомарганцевых
трации 10-4-10-1 моль·л-1 по стандартной методике
болотных руд по извлечению ионов марганца и же-
[16]. Содержание в фильтрате очищаемого раствора
леза общего из природной подземной воды изучали
ионов кальция и магния и общую жесткость опре-
в аналогичных условиях эксперимента. Степень из-
деляли титриметрическим методом, основанным на
влечения определяемых ионов при времени контакта
титровании пробы воды 0.1 моль·л-1 раствором ди-
воды с сорбентом в течение 90 мин в анализируемых
натриевой соли этилендиаминтетрауксусной кислоты,
пробах в интервале концентраций ионов двухвалент-
по утвержденным стандартным методикам [17, 18].
ного марганца 0.356-1.920 мг·л-1 и ионов железа
В данных условиях эксперимента заметного перехо-
общего 0.410-1.926 мг·л-1 составила (%): ионов
да ионов Na+, K+, Ca2+, Mg2+ в раствор не отмечено.
марганца — 94.5-96.2, ионов железа — 97.7-98.8.
Значения величины содержания ионов натрия и калия
Остаточная концентрация определялась в интервале
в пробе воды, взятой для анализа, ниже предела обна-
концентраций ионов марганца 0.020-0.086 мг·л-1,
ружения. При определении жесткости и содержания
ионов железа 0.007-0.035 мг·л-1, что не превыша-
ионов кальция в исследованных пробах воды переход
ет установленные нормативы показателей качества
окраски раствора наблюдался до начала титрования.
питьевой воды по содержанию ионов железа и мар-
По полученным данным сделан вывод, что механизм
ганца (ПДКFe = 0.3, ПДКMn = 0.1 мг·л-1).
по ионно-обменному типу не является определяю-
Изучение адсорбционной активности железомар-
щим, как это характерно для океанских (морских)
ганцевых болотных руд включало исследование воз-
железомарганцевых конкреций.
можного механизма процесса. Известно [14], что
Отличительной особенностью железомарганцевых
океанские железомарганцевые конкреции являются
болотных руд является содержание в их естественном
природным катионитом с ионообменной функцией.
состоянии соединений марганца разной валентности,
Обменный комплекс океанских железомарганцевых
что позволяет предположить механизм извлечения
конкреций состоит из главных катионов океанской
ионов марганца и железа из очищаемых подземных
и морской воды (Na+, K+, Ca2+, Mg2+, Mn2+) и второ-
вод преимущественно по сорбционно-каталитиче-
степенных катионов металлов (Ni2+, Cu2+, Co2+, Pb2+
скому типу, описываемому уравнениями согласно
и др.). Известно, что состав обменного комплекса
данным работ [9, 10] при использовании марганцевых
осадочных пород определяется катионным составом
руд в качестве материала фильтровально-сорбцион-
вод бассейна седиментации [15]. По этому признаку
ной загрузки при водоподготовке.
выделяют два основных типа обменных комплексов
Анализ кинетических кривых (рис. 1) показал,
— морской и континентальный, в первом из которых
что зависимость сорбции от времени контакта фаз
преобладают катионы Na+ и K+, во втором — катионы
нелинейная, отражающая наряду с каталитическим
Ca2+ и Mg2+. Обменные реакции являются стехиоме-
процессом окисления характер сорбционного взаимо-
трическими. Мерой емкости обмена принято считать
действия адсорбата и адсорбента по механизму фи-
количество ионов, поглощенных 100 г на сухую массу
зической адсорбции, обусловленной наличием таких
вещества и способных к обмену. Для определения
активных центров, как поверхностные гидроксидные
емкости обмена минералов в конические колбы ем-
группы, что согласуется с результатами работ [9, 10].
костью 500 мл помещали навеску воздушно-сухого
Опыты, необходимые для построения изотерм
образца сорбента массой 5 г, добавляли 200 мл мо-
сорбции, проводили, помещая в модельные водные
дельного водного раствора с фиксированной концен-
растворы одинакового объема (100 мл) с разными
трацией определяемых ионов марганца (1 мг·л-1) и
исходными концентрациями определяемых ионов
железа общего (2 мг·л-1), перемешивали на магнит-
навески сорбента одинаковой массы (1 г). Изучение
ной мешалке в течение 1-2 мин. Продолжительность
равновесия сорбции определяемого иона из раство-
контакта раствора с сорбентом составляла 90 мин,
ров проводили в интервале концентраций ионов мар-
сорбент отделяли от раствора фильтрованием через
ганца 0.1-4 мг·л-1, ионов железа общего в интервале
бумажный фильтр «синяя лента». В фильтрате опре-
1-4 мг·л-1. Растворы перемешивали с использовани-
деляли остаточную концентрацию определяемых
ем магнитной мешалки в течение 3 мин. После кон-
ионов марганца и железа общего и концентрацию
такта растворов определяемых ионов с исследуемым
ионов обменного комплекса (Na+, K+, Ca2+, Mg2+).
сорбентом значение рН раствора устанавливалось
Аналитический контроль состава очищаемых вод-
в интервале 7.6-7.8. Время сорбции, необходимое
ных растворов по содержанию ионов натрия и калия
для установления сорбционного равновесия между
проводили потенциометрическим методом с исполь-
сорбентом и определяемыми ионами, выдерживали
зованием натрий-селективного и калий-селективного
в течение 90 мин. По истечении заданного време-
электродов с рабочим интервалом измерений концен-
ни сорбции сорбент отделяли от раствора фильтро-
Исследование сорбционных свойств болотных руд для извлечения ионов марганца и железа из подземных вод
261
ванием через бумажный фильтр «синяя лента», в
фильтрате определяли остаточную (равновесную)
концентрацию определяемых ионов. Величину ад-
сорбции ионов марганца и железа общего с разной
исходной концентрацией на исследуемом сорбенте
в условиях установившегося равновесия в системе
рассчитывали с использованием экспериментальных
данных по формуле
где сравн — равновесная концентрация определяемых
ионов в растворе (мкмоль·л-1), V — объем исследуе-
мого раствора (л), mсорбента — масса навески сорбента
(г), А — сорбционная емкость сорбента (мкмоль·г-1).
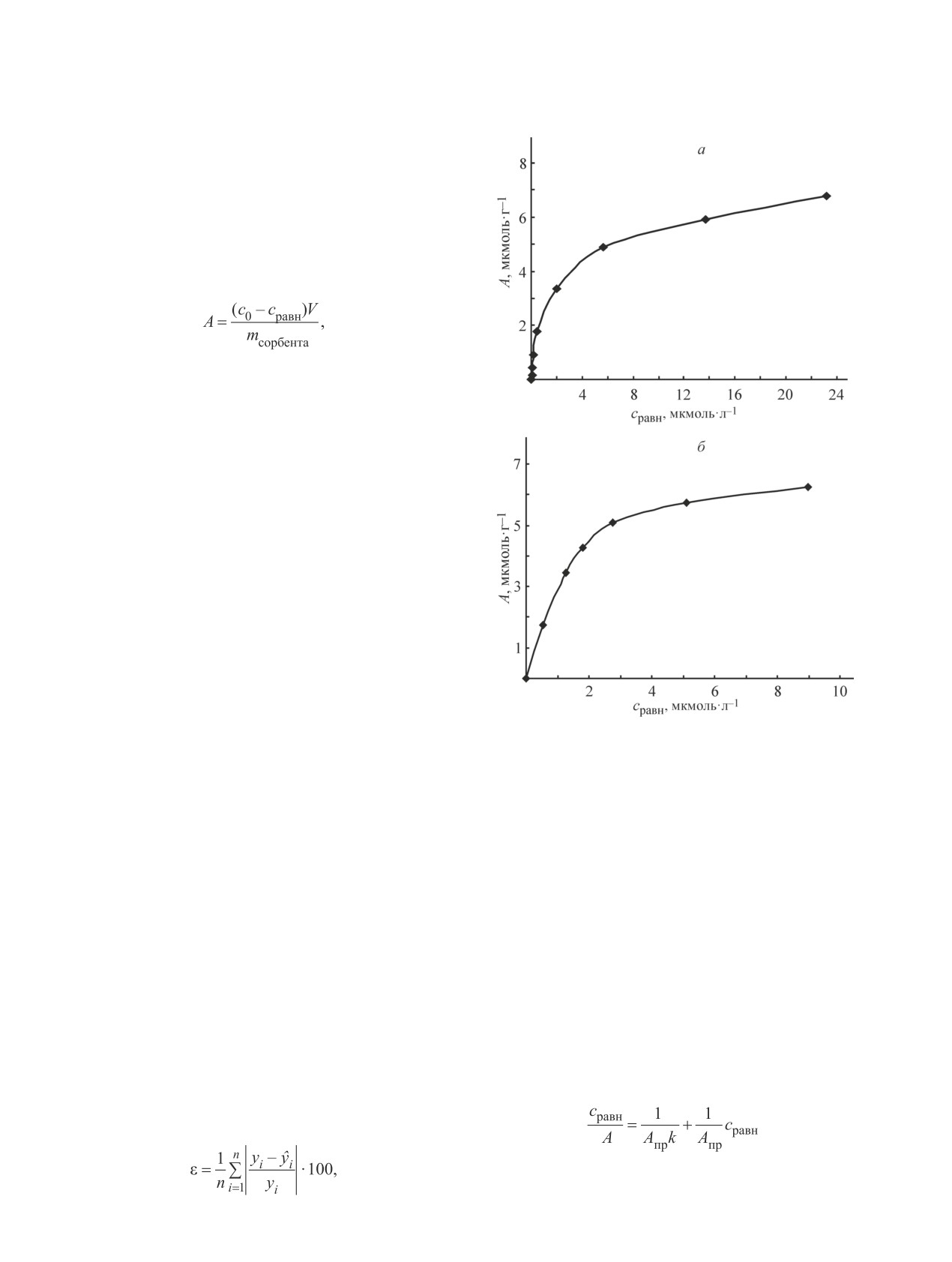
Изотермы сорбции, построенные в координатах
А = f(сравн) методом переменных концентраций опре-
деляемого иона, представлены на рис. 2. При по-
строении изотерм сорбции в координатах уравнения
А = f(сравн) (рис. 2) отклонения от линейности весьма
заметны, особенно на начальном интервале исполь-
зованного диапазона равновесных концентраций
определяемых ионов.
Для аналитического описания изотерм сорбции
использовали уравнения Фрейндлиха и Ленгмюра
[19]. Их математическая обработка позволяет полу-
чить количественные характеристики сорбционного
процесса. В исследованном интервале концентра-
ций определяемых ионов зависимость сорбционной
емкости сорбента от равновесной концентрации ад-
Рис. 2. Изотерма сорбции определяемых ионов марганца
сорбтива хорошо описывается эмпирическим уравне-
(а) и железа общего (б) из раствора железомарганцевой
нием изотермы адсорбции Фрейндлиха
болотной рудой.
А = Kс1/n,
А — сорбционная емкость, сравн — равновесная концентра-
где K — величина адсорбции при равновесной
ция определяемых ионов в растворе после сорбции.
концентрации адсорбтива, равной 1 моль·л-1; с —
Точки — экспериментальные данные, линия — расчет по
равновесная концентрация адсорбтива (моль·л-1);
модели в программе МS Excell.
1/n — характеризует степень приближения изотермы
к прямой.
где уi — значения величины сорбционной емко-
Для нахождения констант уравнения Фрейндлиха
сти, вычисленные по экспериментальным данным
строили график зависимости А = f(сравн). Полученные
(мкмоль·г-1); ŷi — значения величины сорбционной
значения констант уравнения Фрейндлиха K и 1/n
емкости, рассчитанные по модели (мкмоль·г-1); i —
равны для ионов марганца 1.5464 и 0.5313, ионов
номер опыта; n — число опытов.
железа общего 2.8121 и 0.4422 с высокими коэффи-
Для ионов марганца средняя относительная погреш-
циентами корреляции R2 (R2 = 0.8684 и R2 = 0.8819
ность составила 8.5%, ионов железа общего — 4.3%.
соответственно). Расчетные значения сорбционной
Предел адсорбции и константу сорбционного рав-
емкости, полученные с использованием модели, со-
новесия рассчитывали по линейной форме уравнения
гласуются с экспериментальными данными в преде-
изотермы Ленгмюра:
лах допустимого уровня (до 10%). Среднюю отно-
сительную погрешность (%) вычисляли по формуле
,
где Апр — предельная сорбционная емкость
(мкмоль·г-1), k — константа сорбционного равновесия.
262
Фоменко А. И., Соколов Л. И.
Значения А
и k определены при графическом
пр
построении зависимости в координатах (сравн/А) =
= f(сравн) с использованием уравнения прямой (рис. 3).
Рассчитанные значения предельной сорбции опре-
деляемых ионов марганца и железа общего из рас-
твора железомарганцевой болотной рудой одного
порядка. Предельная сорбционная емкость болотной
руды Апр в условиях эксперимента по отношению к
ионам марганца составила 0.403 мг·г-1, железа обще-
го — 0.409 мг·г-1. Значения величины эффективной
константы сорбционного равновесия равны 380.23 и
695.41 соответственно. Каждая изотерма сорбции ха-
рактеризуется высоким коэффициентом корреляции
R2: R2 = 0.9741 (а), R2 = 0.9963 (б).
Наряду с экспериментальным определением изо-
терм сорбции были проведены испытания на реге-
нерацию отмывкой водой от накопившегося осадка
малорастворимых соединений. В коническую колбу
емкостью 250 мл помещали навеску воздушно-сухого
испытуемого сорбента массой 5 г и 100 мл дистил-
лированной воды. Содержимое колбы перемешива-
ли с использованием магнитной мешалки в течение
30 мин. По истечении заданного времени сорбент
отделяли от раствора фильтрованием через бумажный
фильтр «синяя лента», высушивали в течение 24 ч
при температуре 25°С до воздушно-сухого состояния.
Анализ эффективности сорбции повторно исполь-
зуемым материалом в отношении ионов марганца и
железа общего из водных растворов изучали в анало-
Рис. 3. Изотерма сорбции определяемых ионов марганца
гичных условиях эксперимента. Заметного изменения
(а) и железа общего (б) из раствора железомарганцевой
сорбционных свойств не отмечено. Степень извлече-
болотной рудой, линеаризованная в координатах урав-
ния определяемых ионов при времени контакта воды
нения Ленгмюра.
с сорбентом в течение 90 мин в анализируемых про-
бах модельного водного раствора с фиксированной
Точки — экспериментальные данные, линия — расчет
по модели в программе МS Excell.
концентрацией ионов марганца (1 мг·л-1) составила
93.1%, ионов железа общего (2 мг·л-1) — 96.5%.
проводили колориметрическим методом. Значения
Была определена удельная поверхность иссле-
оптической плотности отобранных аликвот исходного
дованных образцов природной железомарганцевой
раствора и раствора после прохождения адсорбции
болотной руды. Изучение удельной поверхности сор-
измеряли на фотоколориметре КФК-2МП при длине
бента проводили по сорбции метиленового голубого
волны λ = 670 нм с использованием кюветы с толщи-
из раствора. Для проведения адсорбции был приго-
ной поглощающего свет слоя 50 мм. Из полученных
товлен 0.1 ммоль·л-1 раствор метиленового голубого
данных оптической плотности, а следовательно, и
в дистиллированной воде. В коническую колбу ем-
концентрации красителя до и после процесса сорбции
костью 250 мл с навеской сорбента массой 1 г была
была рассчитана величина удельной адсорбции А
добавлена аликвота раствора метиленового голубого
(моль красителя на 1 г сорбента). По величине удель-
объемом 50 мл. Содержимое колбы перемешивали и
ной адсорбции рассчитывали удельную поверхность
оставляли на 24 ч. По истечении заданного времени
сорбента S (м2·г-1) по формуле
сорбент отделяли от раствора фильтрованием через
бумажный фильтр «синяя лента», в фильтрате опре-
S = ANAW0,
деляли остаточную (равновесную) концентрацию
где A — величина емкости сорбента относитель-
метиленового голубого. Определение адсорбционной
но метиленового голубого (моль·г-1); NA — чис-
емкости по отношению к метиленовому голубому
ло Авогадро, равное 6.02∙1023; W0 — посадочная
Исследование сорбционных свойств болотных руд для извлечения ионов марганца и железа из подземных вод
263
площадь молекулы метиленового голубого, равная
[2] Пат. РФ 2182890 (опубл. 2002). Способ глубокой
106∙10-20 м2 по данным [20].
очистки подземных вод.
Из полученных данных по величине адсорбции
[3] Пат. РФ 2091158 (опубл.1997). Способ получения
фильтрующего материала для удаления ионов мар-
при полном насыщении была рассчитана удельная
ганца из воды.
поверхность материала, которая составила на исход-
[4] Буравлев В. О., Комарова Л. Ф., Кондратюк Е. В.,
ных образцах руды 2.97 м2·г-1. Величина удельной
Куртукова Л. В. // ЖПХ. 2014. Т. 87. № 6. С. 727-
поверхности исследованных образцов природной
732 [Buravlev V. O., Komarova L. E., Kondratyk E. V.,
железомарганцевой болотной руды свидетельствует
Kurtukova L. V. // Russ. J. Appl. Chem. 2014. V. 87.
о развитой поверхности, характерной для сорбентов.
N 6. P. 720-723].
[5] Пат. РФ 2263535 (опубл. 2005). Сорбент-катали-
Выводы
затор для очистки воды от марганца.
[6] Пат. РФ 2219994 (опубл. 2003). Способ изготов-
1. Совокупность полученных результатов позволяет
ления фильтрующего материала и фильтрующий
считать перспективным использование железомарган-
материал.
цевых болотных руд в процессах водоподготовки под-
[7] Самонин В. В., Чечевичкин А. В. //ЖПХ. 2013. Т. 86.
земных вод с повышенным содержанием ионов мар-
№ 11. С. 1724-1730 [Samonin V. V., Chechevich-
ганца и железа. Установлено, что железомарганцевые
kin A. V. // Russ. J. Appl. Chem. 2013. V. 86. N 11.
болотные руды, прошедшие стадию предварительной
P. 1676-1682].
очистки от песчано-глинистых породообразующих
[8] Калюкова Е. Н., Письменко В. Т., Иванская Н. Н. //
минералов, являются эффективным сорбентом для из-
Сорбцион. и хроматогр. процессы. 2010. Т. 10. № 2.
влечения ионов марганца и железа общего из подзем-
С. 194-200.
ных вод без применения дополнительных реагентов.
[9] Пушкарева Г. И., Скитер Н. А. // ФТПРПИ. 2002.
№ 6. С. 103-107.
2. Получены равновесные и кинетические харак-
[10] Бочкарев Г. Р., Пушкарева Г. И., Коваленко К. А. //
теристики сорбции ионов марганца и железа общего
ФТПРПИ. 2011. № 6. С. 118-123.
как основа для последующего моделирования про-
[11] Чиркст Д. Э., Черемисина О. В., Иванов М. В.,
цесса и расчета режима работы конкретной произ-
Чистяков А. А. // ЖПХ. 2005. Т. 78. № 4. С. 599-
водственной установки для обеспечения заданного
605 [Chirkst D. E., Chremisina O. V., Ivanov M. V.,
качества питьевой воды.
Chistyakov A. A. // Russ. J. Appl. Chem. 2005. V. 78.
3. Показано, что максимальное извлечение опре-
N 4. P. 592-598].
деляемых ионов устанавливается в течение первых
[12] Chuev A. A., Fedorchuk N. M., Petrova M. V. // J.
5 мин контакта воды с рудой, состояние, близкое к
Chem. Chem. Eng. 2012. N 6. Р. 1061-1068.
равновесному, достигается по истечении 1.5 ч.
[13] Унифицированные методы анализа: 2 изд., испр. /
4. Установлено, что степень извлечения из под-
Под ред. Ю. Ю. Лурье. М.: Химия, 1973. 376 с.
земных вод ионов марганца достигает более 90%,
[14] Новиков Г. В., Свальнов В. Н., Богданова О. Ю.,
Сивцов А. В. // Литология и полезные ископаемые.
ионов железа общего — более 98%. Предельная
2010. № 5. С. 461-476.
сорбционная емкость железомарганцевых болот-
[15] Попов В. Г., Абдрахманов Р. Ф. // Геоэкология, ин-
ных руд в их естественном состоянии по отноше-
женерная геология, гидрогеология, геокриология.
нию к ионам марганца и железа общего составила
1996. № 1. С. 85-97.
0.403 и 0.409 мг·г-1 соответственно. Полученные
[16] Методика определения концентраций ионов с по-
значения предельной сорбции практически не
мощью ионселективных электродов «ЭКОМ». М.:
уступают известным образцам фильтрующих ма-
Эконикс, 1993. 74 с.
териалов на основе осадочных горных пород, по-
[17] ПНД Ф 14.1:2.95-97 (2004). М.: Гос. Комитет РФ
лученных обработкой основы раствором реагента.
по охране окружающей среды, 1997. 14 с.
Результаты исследования получены в рамках
[18] ПНД Ф 14.1:2.98-97 (2004). М.: Гос. Комитет РФ
выполнения государственного задания (Задание
по охране окружающей среды, 1997. 10 с.
№ 11.9503.2017/8.9).
[19] Парфит Г., Рочестер К. Адсорбция из растворов
на поверхностях твердых тел / Пер. с англ. М.:
Мир, 1986. 488 с.
Список литературы
[20] ГОСТ 13144-79. Графит. Методы определения
[1] Пат. РФ 2285669 (опубл. 2005). Способ очист-
удельной поверхности. М.: ИПК Изд-во стандар-
ки подземных вод от железа, марганца и солей
тов, 1999. 8 с.
жесткости.