Журнал прикладной химии. 2019. Т. 92. Вып. 2
КАТАЛИЗ
УДК 544.478.41+544.478.13+542.943.7+661.8…782
ВЛИЯНИЕ ОСНОВАНИЙ НА КАТАЛИТИЧЕСКИЕ СВОЙСТВА
КОБАЛЬТ-АЗОТ-УГЛЕРОДНЫХ КОМПОЗИТОВ
В ОКИСЛИТЕЛЬНОЙ ЭТЕРИФИКАЦИИ БЕНЗИЛОВОГО СПИРТА МЕТАНОЛОМ
© Т. В. Астракова1,2, А. Н. Чернов1, В. И. Соболев1, К. Ю. Колтунов1,2*
1 Институт катализа СО РАН, Новосибирск
2 Новосибирский государственный университет
* Е-mail: koltunov@catalysis.ru
Поступила в Редакцию 14 сентября 2018 г.
После доработки 23 октября 2018 г.
Принята к публикации 29 ноября 2018 г.
Изучены особенности протекания низкотемпературной (60°С) реакции окислительной этерификации
бензилового спирта метанолом на кобальт-азот-углеродном гетерогенном катализаторе, полученном
карбонизацией металлоорганической каркасной структуры ZIF-67. Установлен оптимальный темпе-
ратурный режим пиролиза для приготовления высокоактивных образцов катализатора. Исследовано
влияние оснований, таких как K2CO3, Na2CO3, триэтиламин, п-диметиламинопиридин, а также других
добавок на скорость и селективность каталитической реакции. Показано, что этерификация проте-
кает через промежуточное образование бензальдегида, который в присутствии основания быстро
превращается в метилбензоат.
Ключевые слова: аэробное окисление, гетерогенный катализ, кобальт-азот-углеродные композиты,
окислительная этерификация.
DOI: 10.1134/S0044461819020191
Недавно было обнаружено, что наноразмерные
композиты Co-N@C вызвали значительный практи-
кластеры железа и кобальта, встроенные в графи-
ческий интерес и стали активно применяться в новых
топодобные азот-углеродные структуры, проявляют
«зеленых» технологиях и процессах тонкой органи-
исключительно высокую каталитическую актив-
ческой химии [4-15].
ность и устойчивость к дезактивации в ряде реакций
Наиболее активные катализаторы Co-N@C полу-
жидкофазного селективного окисления молекуляр-
чают нанесением на углеродный носитель (сажа или
ным кислородом [1, 2]. В частности, окислитель-
углеродные нанотрубки) комплекса Co(II) с 1,10-фе-
ная этерификация бензилового спирта метанолом
нантролином с последующим пиролизом получен-
на кобальт-азот-углеродных композитах (Co-N@C)
ного материала при температуре от 700 до 900°С в
приводит к получению метилбензоата с количествен-
инертной атмосфере. Другой достаточно техноло-
ным выходом уже через несколько часов реакции
гичный способ синтеза Co-N@C — карбонизация ко-
при температуре 60°С и атмосферном давлении [2],
бальт-азотсодержащих металлоорганических каркас-
что свидетельствует о сопоставимой каталитической
ных структур (MOF), таких как ZIF-67 [4]. При этом
активности Co-N@C и «эталонных» в таких реакциях
разброс «оптимальной» температуры карбонизации
золотосодержащих систем [3]. Неудивительно, что
ZIF-67 варьируется у разных авторов в еще большей
264
Влияние оснований на каталитические свойства кобальт-азот-углеродных композитов...
265
степени — от 600 до 900°С. Независимо от способа
мешивали в течение 1 ч при комнатной температуре,
приготовления катализаторы Co-N@C содержат в
после чего выдерживали еще 12 ч для созревания
своем составе кобальт в степени окисления 0, +2 и
кристаллов. Прозрачный раствор над осадком уда-
+3 и характеризуются наличием сходных кристал-
ляли декантацией. Сине-фиолетовый осадок ZIF-67
лических структур, относимых к металлическим и
дважды попеременно промывали водой и метанолом,
оксидным частицам кобальта [1, 2, 4-15].
высушивали на воздухе, затем в вакууме (10 мм рт.
Cчитают, что активными каталитическими цен-
ст.) при температуре 100°С в течение 5 ч. Образец
трами Co-N@C являются наночастицы смешанного
Co-N@C-850 в виде однородного черного порош-
оксида кобальта — Co3O4, которые встроены в гра-
ка, обладающего парамагнитными свойствами, был
фитоподобный каркас с азотсодержащими гетеро-
получен карбонизацией ZIF-67 при температуре
циклическими фрагментами [2]. Согласно другой
850 ± 10°С (скорость нагрева 5 град·мин-1) в токе
точке зрения, активные центры представляют собой
аргона в течение 2 ч. Катализатор охлаждали до ком-
атомно- и субнаноразмерные частицы кобальта, обра-
натной температуры в токе аргона и хранили на воз-
зующие хелатные комплексы с пиридиноподобными
духе. Карбонизация ZIF-67 при температуре 900°С
вакансиями N-допированного графена [8].
практически не меняла, а при температурах 750, 800
Катализаторы Co-N@C активны при атмосфер-
и 950°С — заметно снижала (на 10-30%) каталитиче-
ном давлении кислорода в интервале температур 25-
скую активность соответствующих образцов. Масса
120°С. В качестве растворителя используют метанол
полученных образцов катализатора во всех случаях
(иногда как реагент), ацетонитрил, воду, хлороформ,
составляла 33-37% от массы ZIF-67, подвергнутого
линейные алканы, толуол и ДМФА. В качестве сока-
карбонизации.
тализатора применяют неорганическое основание —
Рентгенофазовый анализ был выполнен на прибо-
K2CO3 или K3PO4 в количестве 0.2-1.0 мольного
ре Siemens D500 с CuKα-излучением и фокусирующей
эквивалента относительно окисляемого субстрата.
геометрией θ-2θ. Прибор оснащен графитовым мо-
Роль оснований в литературе не обсуждается, а коли-
нохроматором на отраженном пучке, что позволяет
чественные закономерности, связанные с их приме-
снизить вклад флуоресценции от кобальта на медном
нением, до сих пор не были исследованы.
излучении. Для детектирования сигнала использовал-
С учетом высокого прикладного потенциала ком-
ся сцинцилляционный детектор. Съемка проведена в
позитов Co-N@C в качестве новых эффективных
сканирующем режиме в интервале углов 2θ = 10-70°,
катализаторов аэробного окисления нами были изу-
шаг 0.05, время накопления в точке 3 с. Анализ про-
чены некоторые практические аспекты их синтеза и
веден при помощи входящего в аппаратурно-вычис-
применения. В данной работе представлены резуль-
лительный комплекс пакета программ EVA (Bruker).
таты исследования оптимального температурного
Для интерпретации рентгенограмм использовалась
режима карбонизации MOF ZIF-67 при получении
база данных International Center for Diffraction Data
активных образцов катализатора. Кроме того, изучен
(ICDD PDF-2).
промотирующий эффект ряда минеральных и ор-
Содержание кобальта определяли рентгенофлуо-
ганических оснований в модельной реакции окис-
ресцентным методом на спектрометре ARL Perform′X,
лительной этерификации бензилового спирта мета-
расчеты проводили с использованием программного
нолом.
продукта UniQuant компании Thermo Scientific.
Параметры пористой структуры определяли
по изотермам адсорбции N2 при 77 K на установ-
Экспериментальная часть
ке АSАР-2400 фирмы Micromeritics (США) после
ZIF-67 в виде мелкокристаллического порошка
дегазации образцов при 150°С до остаточного дав-
сине-фиолетового цвета был получен реакцией 2-ме-
ления 30 мТорр (4 Па). Расчеты суммарной доступ-
тилимидазола (97%, Аlfa Aesar) с гексaгидратом ни-
ной поверхности методом БЭТ АБЭТ, суммарного
трата кобальта(II) (extra pure, SLR, Fisher Chemical)
объема пор VΣ с эффективными размерами до 100-
согласно методике [4]. С целью получения серии
200 нм (по величине адсорбции при относительном
катализаторов с разными температурами карбони-
давлении азота ~0.99), объема микропор Vμ и поверх-
зации навески, указанные в статье [4], были увели-
ности мезопор Аα, остающихся после заполнения
чены в 10 раз. В раствор 2-метилимидазола (55.0 г,
микропор, проводили по стандартной программе
0.67 моль) в 200 мл дистиллированной воды внесли
прибора.
раствор Со(NO3)2·6H2O (4.5 г, 0.016 моль) в 30 мл
Согласно типичной методике каталитические ре-
дистиллированной воды. Полученную смесь пере-
акции проводили в заполненной кислородом 10 мл
266
Астракова Т. В. и др.
колбе Шленка, соединенной с резиновой камерой,
наполненной кислородом (1 атм). Колбу предвари-
тельно загружали Co-N@C-850 (0.040 г, 0.21 ммоль
Со), метанолом (4 мл), бензиловым спиртом (0.25 г,
2.30 ммоль) и тестируемым основанием (0.27 ммоль).
Реакционную смесь перемешивали на магнитной
мешалке при 60°С (температура термостатированной
масляной бани). Продукты реакции количествен-
но определяли и идентифицировали методом ГЖХ
(ПИД) на хроматографе ЛХМ-8МД, оборудованном
металлической колонкой 0.03 × 1.2 м с сорбентом
HayeSep Q (Chromрack, США).
Обсуждение результатов
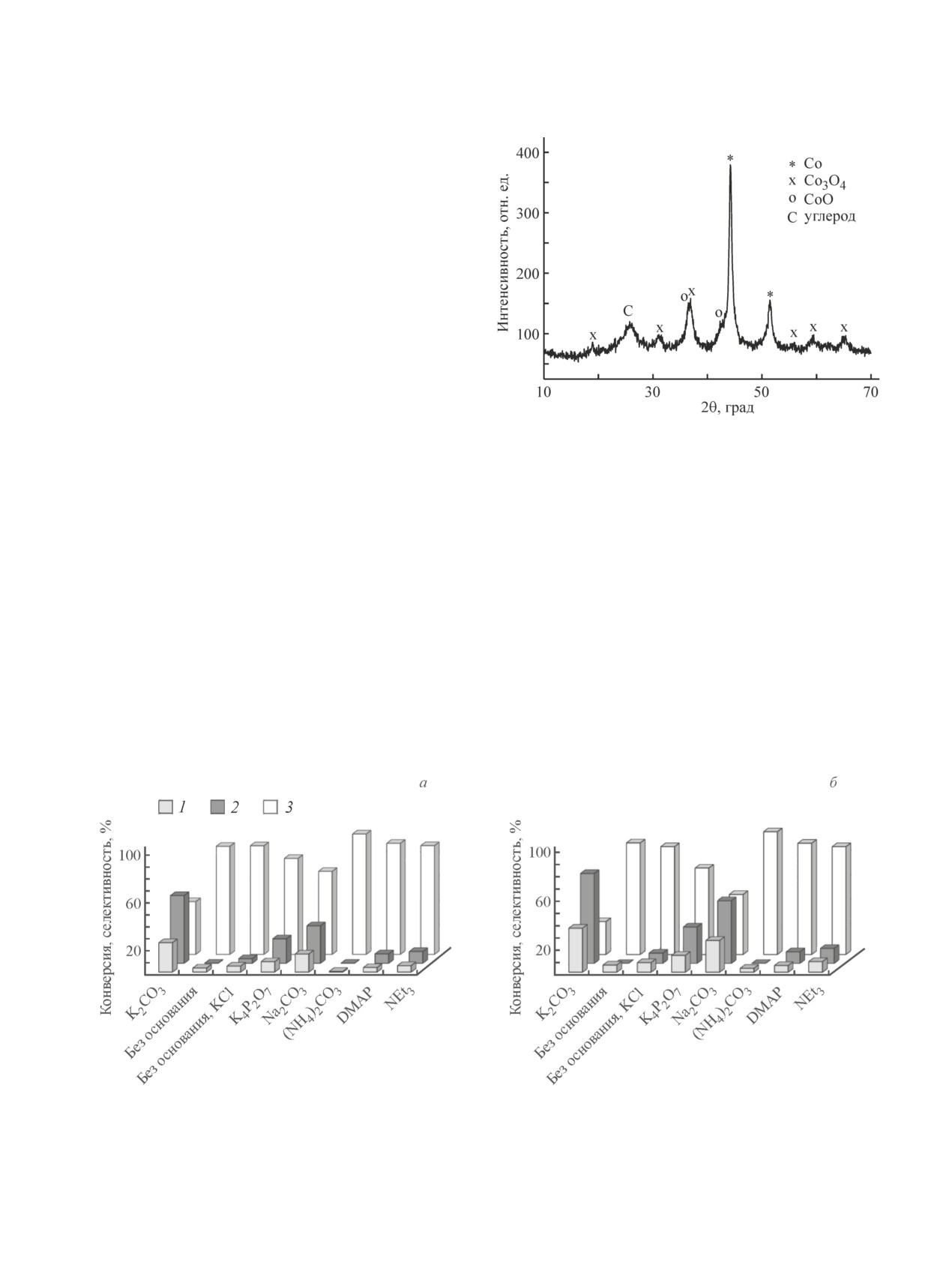
По данным рентгеновской дифрактометрии ка-
Рис. 1. Рентгенограмма и фазовый состав образца
Со-N@C-850.
тализатор Co-N@C-850 содержит кристаллические
формы кобальта в степени окисления 0, +2 и +3
(рис. 1). На рентгенограмме образца присутствует
Со-N@C-850 составило 31%, что также согласуется
широкий пик при 2θ = 25.5-26°, который относится
с литературными данными и определяет высокие
к рассеянию от аморфного углерода, образованного в
магнитные свойства катализатора [4].
результате карбонизации металлоорганической кар-
На рис. 2 отражено влияние ряда оснований на
касной структуры. Помимо этого в составе образца
конверсию бензилового спирта и селективность реак-
обнаружен металлический кобальт кубической мо-
ции по бензальдегиду и метилбензоату. Из диаграмм,
дификации, а также оксиды кобальта CoO и Co3O4.
представленных на рис. 2, следует, что наиболее силь-
Измеренные характеристики полностью соответству-
ными промоторами реакции являются K2CO3 и в
ют данным работы [4].
меньшей степени Na2CO3. Пониженное каталити-
Удельная поверхность образца (по методу БЭТ)
ческое действие Na2CO3 можно объяснить его не-
составила 174 м2·г-1, удельная поверхность мезо-
полной растворимостью в реакционной смеси [16],
пор — 108 м2·г-1. Содержание кобальта в образце
тогда как K2CO3 полностью растворим в условиях
Рис. 2. Влияние оснований на окислительную этерификацию бензилового спирта метанолом на катализаторе
Со-N@C-850 через 2 (а) и через 4 ч (б).
Условия реакции: Т = 60°С, Р(О2) = 1 атм, мольное соотношение Со:BnOH:MeOH:основание = 1:11:470:1.3.
1 — конверсия бензилового спирта, 2 — селективность по метилбензоату, 3 — селективность по бензальдегиду.
Влияние оснований на каталитические свойства кобальт-азот-углеродных композитов...
267
Предполагаемая схема последовательности стадий в окислительной этерификации бензилового спирта
СH3OH
O2 (1 атм)
O2 (1 атм)
PhCh2OH
PhCHO
PhCH(OH)OCH3
PhCOOCH3
Co-N@C,
основание
Co-N@C,
основание
основание
реакции [17]. Однако растворимость данных карбо-
тиламинопиридин (ДМАП) и триэтиламин, что не
натов в метаноле, возможно, не имеет решающего
согласуется с сильным промотирующим действием
значения, поскольку их каталитическая активность
ДМАП в реакциях селективного окисления бензило-
определяется генерированием хорошо растворимых
вого спирта на оксидных ванадиевых катализаторах
в метаноле оснований — CH3ONa и CH3OK соответ-
[19, 20]. При этом ДМАП проявляет более слабый
ственно [17].
промотирующий эффект, чем NEt3, хотя их основ-
Следует отметить слабый, но отчетливо видимый
ность одинакова [21]. Можно полагать, что азотистые
каталитический эффект хлорида калия. Не являясь
основания (NH3, ДМАП и NEt3) координируются с
основанием, KCl может тем не менее способство-
атомами кобальта каталитических центров Со-N@C,
вать восстановлению молекулярного кислорода за
что создает конкуренцию для окисляемого субстрата
счет увеличения ионной проводимости в полученном
и замедляет его окисление.
катализаторе [18] и таким образом промотировать
По аналогии с реакциями окислительной этерифи-
целевую реакцию. Резко контрастирует с этим полное
кации спиртов на золотосодержащих катализаторах
отсутствие каталитического действия у карбоната
промотирующее действие оснований на каталитиче-
аммония, который в условиях реакции разлагается с
скую активность Со-N@C, возможно, обусловлено
выделением аммиака. Несмотря на основные свой-
необходимостью предварительного депротонирова-
ства карбоната аммония (аммиака), при сравнении
ния бензилового спирта на стадии окисления до бен-
с контрольным опытом — без добавления основа-
зальдегида [3]. На второй стадии реакции основание
ния — становится заметным их дезактивирующее
может катализировать образование полуацеталя бен-
действие на реакцию (рис. 2, б). Заслуживает вни-
зальдегида с метанолом, который, как полагают [2, 4],
мания и неожиданно слабый каталитический эффект
является ключевым интермедиатом окислительной
таких сильных азотистых оснований, как п-диме-
этерификации (см. схему). Кроме того, основание
должно удалять с поверхности катализатора побоч-
ный продукт реакции — бензойную кислоту, которая
может дезактивировать катализатор [22].
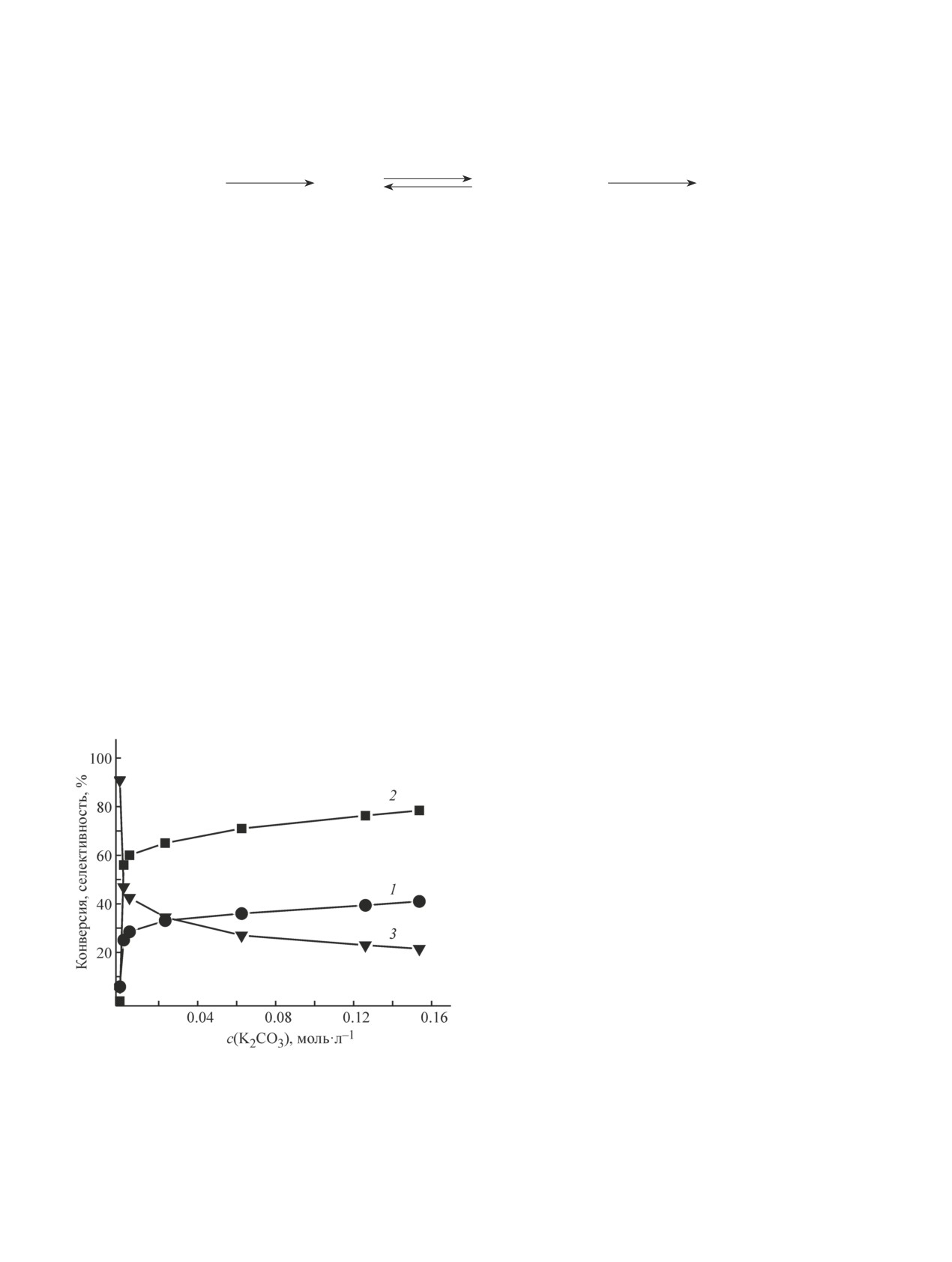
Зависимость каталитической активности образца
Со-N@C-850 от концентрации K2CO3 в реакционной
смеси показана на рис. 3. Очевидно, что K2CO3 уско-
ряет как первую, так и в большей степени вторую ста-
дии реакции. Однако зависимость промотирующего
действия K2CO3 от роста его концентрации имеет вы-
раженный затухающий характер, поэтому эквимоляр-
ное соотношение бензилового спирта и K2CO3, часто
применяемое на практике, нецелесообразно, и концен-
трация основания может быть снижена на порядок.
Выводы
1. Исследовано влияние ряда минеральных и орга-
нических азотистых оснований на протекание окисли-
тельной этерификации бензилового спирта метанолом
Рис. 3. Зависимость конверсии бензилового спирта (1),
селективности по метилбензоату (2) и бензальдегиду (3)
при температуре 60°С и 1 атм О2 на кобальт-азот-
от концентрации K2CO3 на катализаторе Со-N@C-850.
углеродном композите, полученном карбонизацией
металлоорганической каркасной структуры ZIF-67.
Время реакции 4 ч, Т = 60°С, Р(О2) = 1 атм, мольное соот-
2. Показано, что азотистые основания, включая
ношение Со:BnOH:MeOH:K2CO3 = 1:11:470:(0, 0.05, 0.1,
0.5, 1.3, 2.5, 3).
п-диметиламинопиридин, неэффективны в сокатализе
268
Астракова Т. В. и др.
реакции, а среди изученных минеральных оснований
[9] Pisiewicz S., Stemmler T., Surkus A.-E., Junge K., Bel-
наибольшее промотирующее влияние оказывают со-
ler M. // ChemCatChem. 2015. V. 7. P. 62-64.
единения калия.
[10]
Jagadeesh R.V., Junge H., Beller M. // ChemSusChem.
2015. V. 8. P. 92-96.
3. Изучены количественные закономерности вли-
[11]
Westerhaus F. A., Jagadeesh R. V., Wienhofer G.,
яния на целевую реакцию K2CO3 и показано, что
Pohl M.-M., Radnik J., Surkus A.-E., Rabeah J., Jun-
для достижения высокого каталитического эффекта
ge K., Junge H., Nielsen M., Bruckner A., Beller M. //
достаточным является его применение в количестве
Nature Chem. 2013. V. 5. P. 537-543.
5 мол% относительно бензилового спирта.
[12]
Li X.-Y., Zeng C., Jiang Q.-Q., Ai L. // J. Mater. Chem.
Работа выполнена в рамках государственного за-
A. 2016. V. 4. P. 7476-7482.
дания № АААА-А17-117041710083-5 для ФГБУН
[13]
Stemmler T., Westerhaus F.A., Surkus A.-E.,
ИК СО РАН.
Pohl M.-M., Junge K., Beller M. // Green Chem. 2014.
V. 16. P. 4535-4540.
[14]
Iosub A. V., Stahl S. S. // Org. Lett. 2015. V. 17.
Список литературы
P. 4404-4407.
[1] Jagadeesh R. V., Wienhofer G., Westerhaus F. A., Sur-
[15]
Su H., Zhang K.-X., Zhang B., Wang H.-H., Yu Q.-Y.,
kus A.-E., Pohl M.-M., Junge H., Junge K., Beller M. //
Li X.-H., Antonietti M., Chen J.-S. // J. Am. Chem.
Chem. Commun. 2011. V. 47. P. 10972-10974.
Soc. 2017. V. 139. P. 811-818.
[2] Jagadeesh R. V., Junge H., Pohl M.-M., Radnik J.,
[16]
Ellingboe J. L., Runnels J. H. // J. Chem. Eng.
Brückner A., Beller M. // J. Am. Chem. Soc. 2013.
Data. 1966. V. 11. P. 323-324.
V. 135. P. 10776-10782.
[17]
Platonov A. Yu., Evdokimov A. N., Kurzin A. V., Maiyo-
[3] Mallat T., Baiker A. // Chem. Rev. 2004. V. 104.
rova H. D. // J. Chem. Eng. Data. 2002. V. 47. P. 1175-
P. 3037-3058.
1176.
[4] Zhou Y.-X., Chen Y.-Z., Cao L., Lu J., Giang H.-L. //
[18]
Zhang W., Jiang X., Wang X., Kaneti Y. V., Chen Y.,
Chem. Commun. 2015. V. 51. P. 8292-8295.
Liu J., Jiang J. S., Yamauchi Y., Hu M. // Angew.
[5] Banerjee D., Jagadeesh R.V., Junge K., Pohl M.-M.,
Chem. Int. Ed. 2017. V. 56. P. 8435-8440.
Radnik J., Bruckner A., Beller M. // Angew. Chem. Int.
[19]
Wigington B. N., Drummond M. L., Cundari T. R.,
Ed. 2014. V. 53. P. 4359-4363.
Thorn D. L., Hanson S. K., Scott S. L. // Chem. Eur. J.
[6] Zhong W., Liu H., Bai C., Liao S., Li Y. // ACS Catal.
2012. V. 18. P. 14981-14988.
2015. V. 5. P. 1850-1863.
[20]
Koltunov K. Yu., Ishchenko E. V., Sobolev V. I. // Catal.
[7] Baramov T., Loos P., Hassfeld J., Alex H., Beller M.,
Commun. 2018. V. 117. P. 49-52.
Stemmler T., Meier G., Gottfried M., Roggan S. // Adv.
[21]
Scriven E. F. V. // Chem. Soc. Rev. 1983. V. 12.
Synth. Catal. 2016. V. 358. P. 2903-2911.
P. 129-161.
[8] Cheng T.-Y., Yu H., Peng F., Wang H.-G., Zhang B.-S.,
[22]
Davis S. E., Ide M. S., Davis R. J. // Green Chem.
Su D.-S. // Catal. Sci. Technol. 2016. V. 6. P. 1007-
2013. V. 15. P. 17-45.
1015.