Журнал прикладной химии. 2019. Т. 92. Вып. 3
ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ И МАТЕРИАЛЫ НА ИХ ОСНОВЕ
УДК 541.64
ОСОБЕННОСТИ ФЕРМЕНТАТИВНОЙ ДЕСТРУКЦИИ АЦЕТАТА
И СУКЦИНАМИДА ХИТОЗАНА В ПОЛИМЕР-КОЛЛОИДНЫХ ДИСПЕРСИЯХ
С ЗОЛЯМИ ИОДИДА СЕРЕБРА
© В. В. Чернова, Д. Р. Валиев, М. В. Базунова, А. С. Шуршина, Е. И. Кулиш
Башкирский государственный университет, Уфа
E-mail: polymer-bsu@mail.ru
Поступила в Редакцию 13 апреля 2018 г.
После доработки 17 октября 2018 г.
Принята к публикации 23 октября 2018 г.
Изучен процесс ферментативной деструкции полимер-коллоидных дисперсий ацетата и сукцинамида
хитозана с золями иодида серебра. Установлено, что в присутствии заряженных частиц лиофоб-
ного золя наблюдается уменьшение скорости ферментативной деструкции как в растворах, так и
в пленочных образцах. Данный факт обусловлен уменьшением активности ферментного препарата,
вызванного присутствием ионов серебра, а также изменением конформационно-надмолекулярного
состояния полимеров.
Ключевые слова: хитозан, полимер-коллоидные дисперсии, ферментативная деструкция.
DOI: 10.1134/S0044461819030022
В настоящее время в медицинских целях все более
неустойчивого лиофобного золя [15], но и выполняет
широко применяются вещества в коллоидном (нано-
роль матрицы-основы [16]. Использование ПКД в ме-
дисперсном) состоянии. Так, например, золото в виде
дицинских целях диктует выбор полимера-основы в
лиофобного золя может использоваться для диагно-
пользу биополимеров, особенно небелковой природы,
стики раковых опухолей [1], поскольку в коллоидном
обладающих низкой иммуногенностью [17]. В ка-
состоянии оно легче связывается с больными клет-
честве таких полимеров могут быть использованы
ками, золи железа и его оксиды применяются для де-
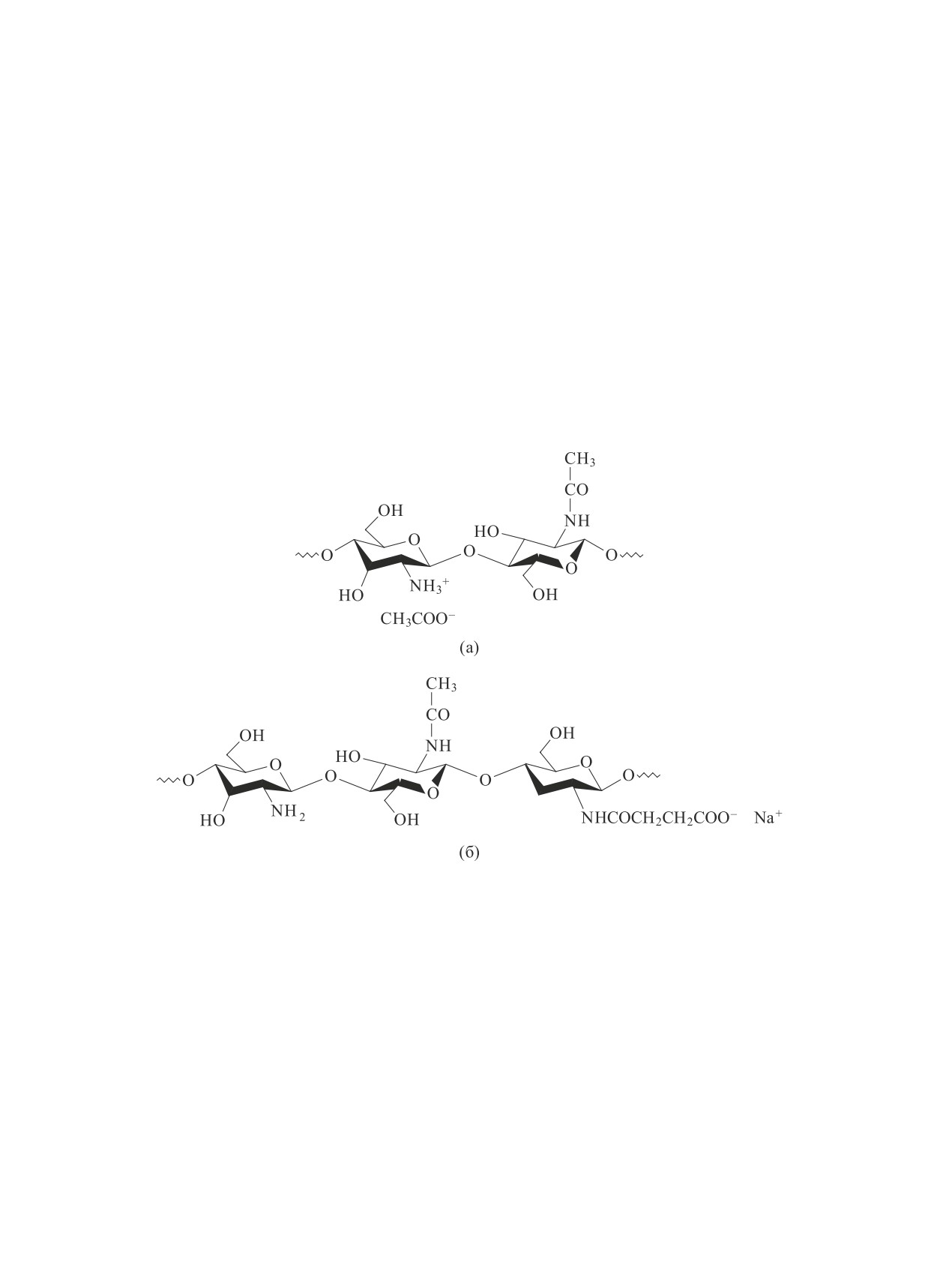
полисахариды, например хитозан, используемый в
тектирования клеточных структур [2-7], коллоидные
виде ацетата (АХТЗ) и сукцинамида хитозана (СХТЗ),
растворы серебра и его производных, проявляющие
характеризующиеся био- и гемосовместимостью,
выраженное бактериостатическое, бактерицидное,
бактериостатичностью, а также, что особенно важ-
противогрибковое и противовирусное действие [8-
но, деструктирующие под действием жидких сред
14], находят применение в качестве лекарственных
организма с образованием нетоксичных продуктов
соединений, стимулирующих восстановительные
[18].
процессы в тканях живых организмов, а также для
В том случае, когда материал биомедицинского
лечения инфекций слизистых оболочек.
назначения получают на основе ПКД, необходимо
Огромные перспективы имеют не только сами
учитывать тот факт, что не только полимер оказывает
коллоидные растворы, но и полимер-коллоидные
влияние на коллоидную дисперсию, но и она в свою
дисперсии (ПКД) на их основе, в которых полимер не
очередь способна предопределить структурно-физи-
только играет роль стабилизатора термодинамически
ческое состояние (конформационную и надмолеку-
286
Особенности ферментативной деструкции ацетата и сукцинамида хитозана...
287
лярную структуру) полимера. Это может сказаться
Экспериментальная часть
на комплексе физико-химических свойств материала,
Золи иодида серебра получали конденсационным
например скорости деструкции полимерной матрицы.
способом по стандартной методике [27] смешени-
Факт определяющего влияния структурно-физи-
ем растворов нитрата серебра и иодида калия в раз-
ческого состояния полимера в растворе на процессы
личных объемных соотношениях. Для получения
термоокислительной [19, 20], термической [21, 22]
положительно заряженных коллоидных частиц в
и ферментативной деструкции [23-26] уже находил
избытке брали нитрат серебра в объемных соотно-
подтверждение.
шениях KI:AgNO3 = 7:10 [золь (+)], а для отрица-
Целью данной работы стало изучение особенно-
тельно заряженных — 10:7 [золь (-)] соответственно.
стей ферментативной деструкции АХТЗ и СХТЗ в
Концентрации исходных растворов составляли 0.001,
ПКД. В качестве гидрофобного золя был использо-
0.01, 0.015, 0.02 моль·л-1. Для формирования ПКД
ван иодид серебра, обладающий ярко выраженными
в качестве полимерной основы были выбраны два
бактерицидными свойствами. Учитывая высокую
полиэлектролита — поликатион АХТЗ (а) и полиа-
светочувствительность иодида серебра, все опыты
нион СХТЗ (б) (производства ЗАО «Биопрогресс»,
проводили в темноте.
Московская область, г. Щелково):
ПКД получали путем сливания предварительно
наклона начального (линейного) участка зависимости
приготовленного раствора золя иодида серебра и рас-
характеристической вязкости [η] от времени кон-
твора полимера соответствующей концентрации в
тактирования с раствором ферментного препарата.
объемных соотношениях 1:1.
Поскольку значения рН растворов АХТЗ и СХТЗ
Характеристическую вязкость исходных (не под-
сильно различаются (3.6 и 7.3 соответственно), срав-
вергнутых процессу ферментативной деструкции)
нивать их скорости ферментативной деструкции не-
полимеров [η]0 и характеристическую вязкость
корректно, однако можно провести оценку изменения
[η]t в ходе проведения деструкции в течение времени
V0 индивидуального полимера и ПКД, в результате
t определяли на вискозиметре Уббелоде при темпера-
образования которых не происходило изменения рН
туре Т = 25 ± 1°С и рассчитывали, используя подход
среды.
Баранова [28], который позволяет исключить влияние
В качестве ферментного препарата использовали
эффекта полиэлектролитного набухания на значение
гиалуронидазу (торговое название Лираза, провод-
характеристической вязкости полимера [29].
ство ЗАО Микроген, Москва, Россия). Концентрация
За начальную скорость процесса ферментативной
ферментного препарата в растворе при проведении
деструкции V0 принимали значение тангенса угла деструкции составляла 0.1 г·л-1. Ферментный пре-
288
Чернова В. В. и др.
парат, растворенный в небольшом количестве воды,
Genzel (Гаппа-Генцеля). Число сканов: 20. Интервал
вносили в раствор полимера (или ПКД), после че-
сканирования: 4000-800 см-1.
го выдерживали в течение определенного времени.
Поскольку значение относительной вязкости раствора
Обсуждение результатов
фермента составляло менее 1% от вязкости раствора
полимера в ПКД, его вклад в значения вязкости рас-
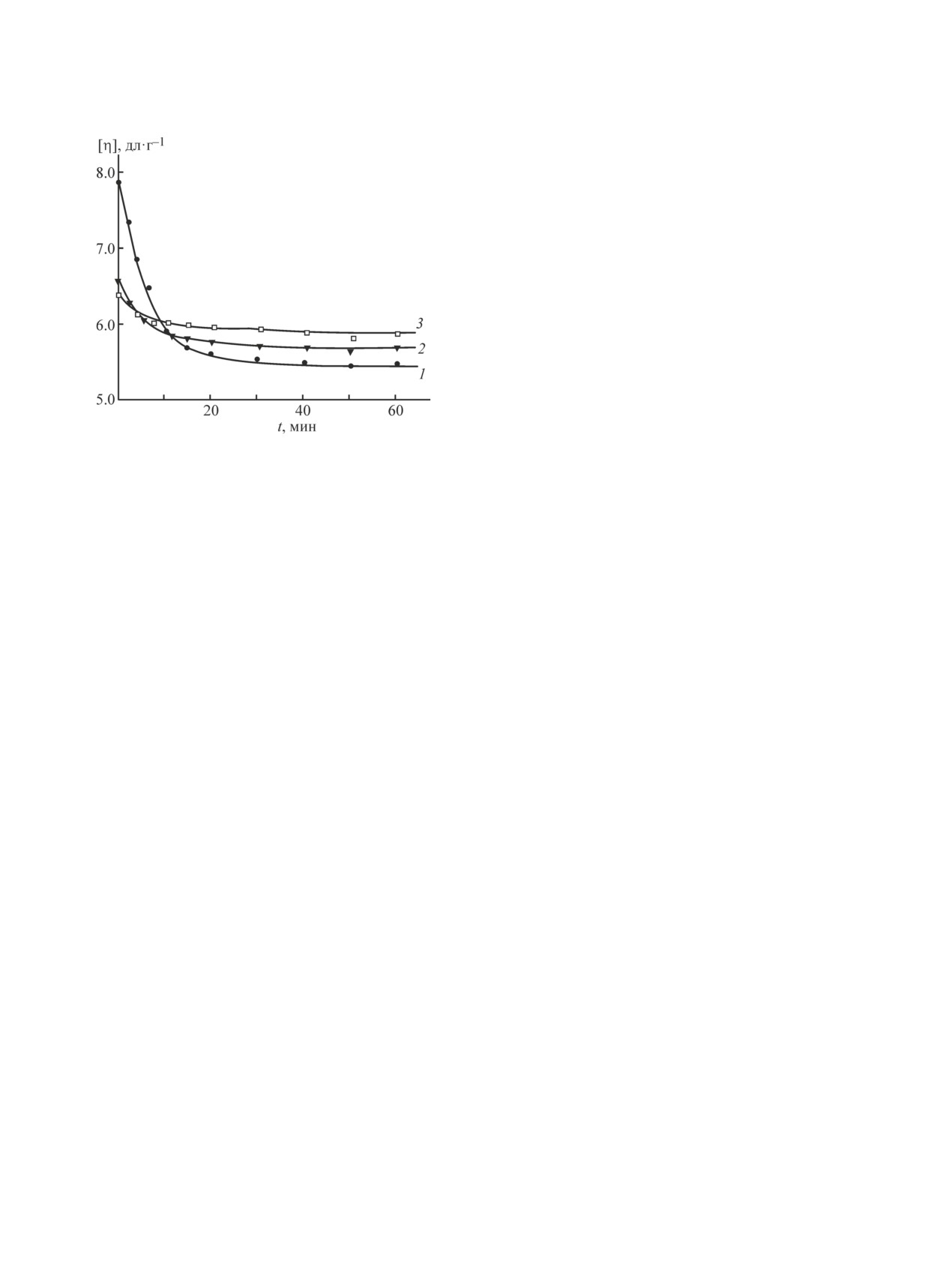
На рис. 1 для примера приведены кривые измене-
твора не учитывался. Протекание ферментативной
ния характеристической вязкости СХТЗ в растворе и
деструкции останавливали путем выдерживания рас-
в ПКД. Видно, что выдержка полимера в присутствии
твора полимера или ПКД в кипящей воде в течение
фермента сопровождается постепенным уменьше-
30 мин.
нием вязкости, что свидетельствует о протекании
Пленки формировали методом полива раствора
процесса деструкции. Кривые изменения характери-
полимера или ПКД на поверхность стекла в чашке
стической вязкости для растворов АХТЗ аналогичны.
Петри. Для проведения ферментативной деструкции
Во всех изученных случаях кинетические кривые
пленочный образец помещали на подложку, смочен-
имели традиционный для ферментативных реакций
ную раствором ферментного препарата, выдерживали
вид — в начальный период (в течение 10-15 мин)
в течение определенного времени в термостатиру-
зависимость характеристической вязкости от времени
емых условиях. Как и в случае раствора полимера,
имеет линейный характер, что позволяет рассчитать
протекание ферментативной деструкции останав-
значение скорости деструкции V0. Дальнейшая вы-
ливали путем выдерживания бюкса с пленочным
держка полимеров с раствором ферментного препа-
образцом в кипящей воде в течение 30 мин. Затем го-
рата приводит к некоторому замедлению процесса и
товили раствор заданной концентрации и проводили
отклонению характера зависимости характеристиче-
определение характеристической вязкости.
ской вязкости от времени от линейной.
Примененный в работе метод дезактивации фер-
В ходе сравнения особенностей протекания про
ментного препарата был выбран в связи с невоз-
цесса ферментативной деструкции АХТЗ и СХТЗ
можностью использования общепринятых методов
в виде растворов и ПКД было выявлено несколько
подавления действия фермента, например, измене-
заслуживающих внимания фактов.
нием рН, поскольку при этом изменилось бы кон-
Во-первых, исходные значения характеристиче-
формационно-надмолекулярное состояние полимера
ской вязкости как СХТЗ, так и АХТЗ, определенные
в растворе, что в свою очередь отразилось бы и на
значениях характеристической вязкости. Время вы-
держивания образцов на водяной бане было подобра-
но экспериментальным путем. Именно при 30-минут-
ном выдерживании наблюдались воспроизводимые
результаты по значениям характеристической вяз-
кости.
Степень структурирования (агрегации) раствора δ
определяли по тангенсу угла наклона прямой экспе-
риментальных зависимостей удельной вязкости рас-
творов полимеров и ПКД от концентрации полимера
в растворе в логарифмических координатах [30].
Активность ферментного препарата определяли
по стандартной методике Хагедорна-Йенсена [31].
За единицу активности принимали количество фер-
ментного препарата, которое образует 1 мкмоль вос-
станавливающих сахаров за 1 мин гидролиза 50 мг
фильтровальной бумаги.
Рис. 1. Зависимость характеристической вязкости СХТЗ,
ИК-cпектры регистрировали на инфракрасном
выделенного из пленочных образцов, полученных из
спектрофотометре с преобразованием Фурье фирмы
раствора СХТЗ в воде (1) и из ПКД на основе золя ио-
Shimadzu FTIR-8400S. Образцы снимали на гори-
дида серебра с отрицательно (2) и положительно заря-
зонтальной приставке методом многократного нару-
женными коллоидными частицами (3).
шенного полного внутреннего отражения (МНПВО).
Золь получен при сливании 0.01 М растворов AgNO3 и KI в
Ячейка прибора: internal. Аподизация: функция Happ-
объемных соотношениях 7:10 (2) и 10:7 (3) соответственно.
Особенности ферментативной деструкции ацетата и сукцинамида хитозана...
289
Таблица 1
Значения степени агрегации и характеристической вязкости полимеров в растворе в присутствии золей
иодида серебра
Объемное соотношение компонентов
Без золя
1:10
3:10
5:10
7:10
Полимер
С золем
[η],
[η],
[η],
[η],
[η],
δ
δ
δ
δ
δ
дл·г-1
дл·г-1
дл·г-1
дл·г-1
дл·г-1
Золь (+)*
1.18
6.4
1.21
5.8
1.22
5.5
1.22
5.5
АХТЗ
1.00
7.8
Золь (-)**
1.19
6.5
1.22
5.8
1.26
5.6
1.22
5.5
KNO3***
1.11
6.9
1.12
6.4
1.14
6.2
1.12
6.2
Золь (+)*
1.18
2.8
1.20
2.8
1.20
2.7
1.21
2.6
СХТЗ
1.00
3.6
Золь (-)**
1.20
2.9
1.25
2.8
1.22
2.8
1.21
2.7
KNO3***
1.15
3.4
1.16
3.3
1.17
3.2
1.15
3.0
* Золь получали при сливании 0.001 М растворов AgNO3:KI в соответствующих объемных соотношениях.
** Золь получали при сливании 0.001 М растворов KI:AgNO3 в соответствующих объемных соотношениях.
*** «Холостой» эксперимент заключался во введении KNO3 в количестве, сопоставимом с тем, которое образуется
при формировании золей.
для растворов и для ПКД этих растворов, неодина-
Таблица 2
ковы (табл. 1).
Значения начальной скорости ферментативной
Во-вторых, процесс деструкции полимеров в ви-
деструкции СХТЗ и АХТЗ
де растворов всегда происходит быстрее и в боль-
шей степени, чем в виде ПКД. Так, если скорость
Объемное соотношение
ферментативной деструкции СХТЗ в воде состав-
Полимер
исходных растворов
V0, дл·г-1·мин-1
KI:AgNO3,* об%
ляет V0 = 0.1 дл·г-1·мин-1, то в виде ПКД — всегда
меньше. Для АХТЗ наблюдаемые закономерности
СХТЗ
Без золя
0.10
аналогичны. При этом уменьшение скорости фер-
1:10
0.07
ментативной деструкции в присутствии золя более
3:10
0.05
ярко выражено в случае ПКД с положительно заря-
5:10
0.04
женными частицами, т. е. в том случае, когда золь
7:10
0.03
был получен в избытке нитрата серебра (табл. 2).
10:1
0.07
В-третьих, значение скорости ферментативной де-
10:3
0.07
струкции АХТЗ и СХТЗ в ПКД зависит от соотноше-
10:5
0.06
ния компонентов, используемых при приготовлении
10:7
0.05
золей.
АХТЗ
Без золя
0.08
Причин, вызывающих уменьшение скорости фер-
1:10
0.06
ментативной деструкции в присутствии золя, может
3:10
0.05
быть по крайней мере две. Во-первых, можно пред-
5:10
0.03
положить, что золь иодида серебра вызывает умень-
7:10
0.02
шение активности фермента. Действительно, непо-
10:1
0.07
средственное добавление к раствору ферментного
10:3
0.07
препарата AgNO3 (т. е. введение свободных ионов се-
10:5
0.05
ребра) сопровождается уменьшением его активности
10:7
0.05
(табл. 3), что согласуется с литературными данными
[32]. Также к уменьшению активности ферментного
препарата приводит добавление золей иодида серебра
* Концентрация исходных растворов KI и AgNO3 со-
с положительно заряженными частицами, т. е. вве- ставляла 0.001 моль·л-1.
290
Чернова В. В. и др.
Таблица 3
Общая гликозидазная активность ферментного препарата гиалуронидазы, определенная в различных
средах
Мольное соотношение
Активность фермента Е, отнесенная
Среда
KI:AgNO3 при получении золя*
к 1 г ферментного препарата
Вода
—
66
Раствор AgNO3 0.01 М
—
22
Золь AgI(+)
7:10
63
5:10
44
3:10
39
Золь (-)
10:7
68
10:5
65
10:3
66
* Концентрация исходных растворов KI и AgNO3 составляла 0.01 моль·л-1.
дение адсорбированных на агрегате ионов серебра.
СХТЗ в растворе в присутствии золей уменьшением
При этом ни введение иодида калия, ни введение золя
активности ферментного препарата (его дезактива-
иодида серебра с отрицательно заряженными кол-
ции) можно только в случае ПКД с положительно
лоидными частицами не сказывается на активности
заряженными частицами, т. е. в случае наличия в рас-
ферментного препарата (табл. 3).
творе ПКД адсорбированных Ag+. Между тем про-
Таким образом, объяснить имеющее место умень-
веденные исследования свидетельствуют о том, что
шение скорости ферментативной деструкции АХТЗ и АХТЗ и СХТЗ, находящиеся в виде ПКД, полученных
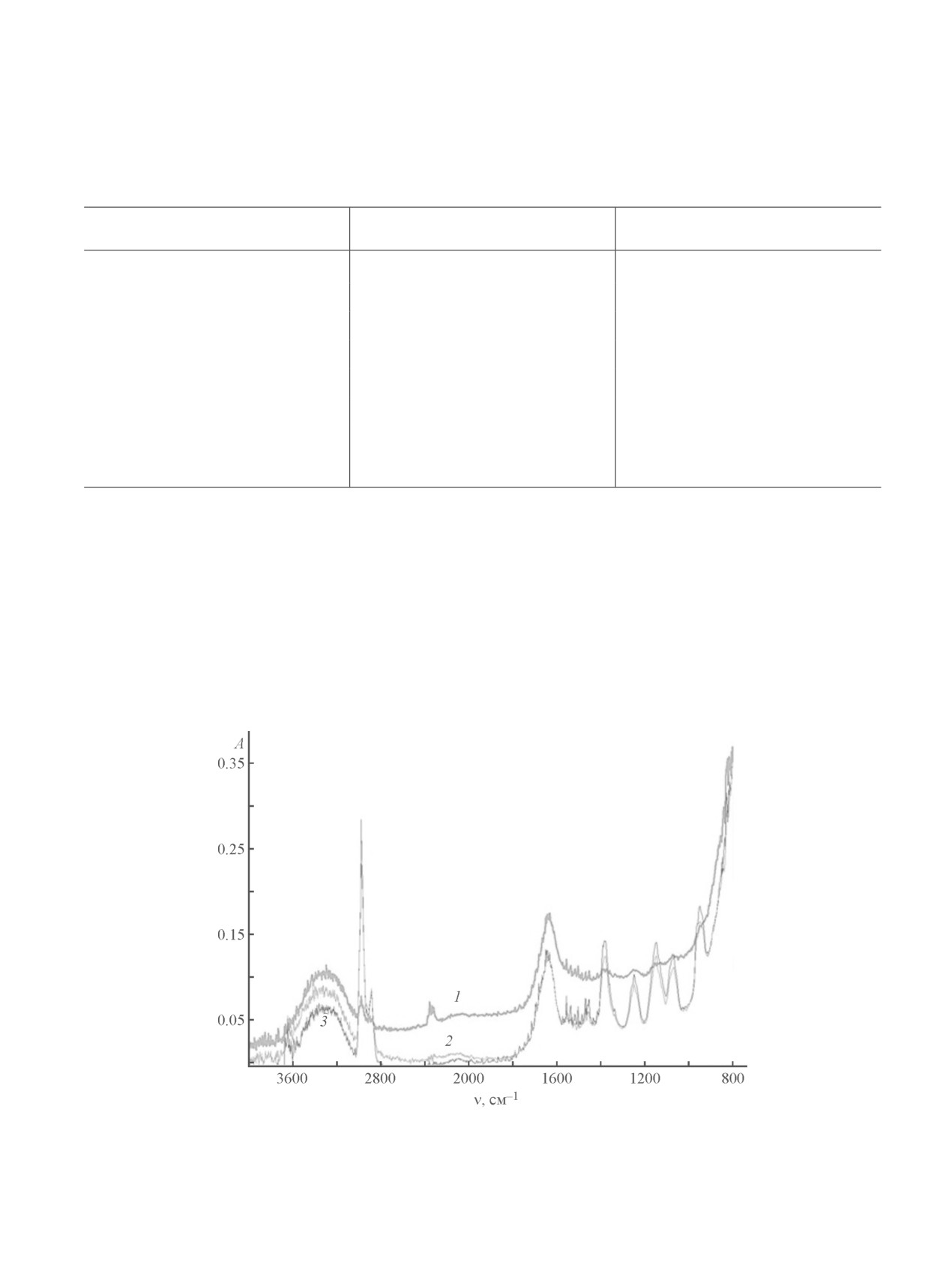
Рис. 2. ИК-спектры золя иодида серебра с положительно заряженными коллоидными частицами (1), СХТЗ (2)
и ПКД на их основе (3).
Золь получен при сливании 0.01 М растворов AgNO3 и KI в объемных соотношениях 10:7, концентрация СХТЗ 0.5%.
Особенности ферментативной деструкции ацетата и сукцинамида хитозана...
291
зующимся при синтезе золей, приводит к тому, что
имеет место снижение [η] и образование макромоле-
кулярных агрегатов в растворе (табл. 1). Однако ана-
лиз данных, приведенных в табл. 1, свидетельствует
о том, что во всех изученных случаях для растворов
обоих полимеров изменение значений характеристи-
ческой вязкости и степени структурирования поли-
меров в растворе в присутствии KNO3 происходит
в меньшей степени, чем в присутствии коллоидных
частиц золя иодида серебра. Следовательно, можно
предположить, что уменьшение скорости и степени
ферментативной деструкции полимеров в ПКД по
сравнению с деструкцией в растворе индивидуаль-
ных полимеров действительно может быть следстви-
ем изменения конформационно-надмолекулярного
состояния полимера в растворе: сжатия макромолеку-
Рис. 3. Зависимость характеристической вязкости
лярных клубков и формирования межмолекулярных
АХТЗ, выделенного из пленочных образцов, получен-
агрегатов, что обусловлено не только и не столько
ных из раствора АХТЗ в воде (1) и из ПКД на основе
изменением ионной силы раствора, но и формиро-
золя иодида серебра с отрицательно (2) и положительно
ванием ПКД путем адсорбции полимера на колло-
заряженными коллоидными частицами (3).
идных частицах. Физический характер адсорбции
Золь получен при сливании 0.01 М растворов AgNO3 и KI в
объемных соотношениях 7:10 (2) и 10:7 (3) соответственно.
подтверждается и данными ИК-спектроскопии. Так,
из представленных (рис. 2) ИК-спектров растворов
СХТЗ и ПКД на его основе с золем иодида серебра
на основе золей с отрицательно заряженными части-
видно, что образование ПКД не приводит к смеще-
цами (т. е. полученных при избытке иодида калия),
нию основных характеристических полос полимера.
деструктируют в меньшей степени, чем растворы
При этом варьирование условий приготовления золей
индивидуального АХТЗ и СХТЗ, что свидетельствует
иодида серебра, а именно соотношения компонентов
о действии иного фактора.
в исходном растворе, приводящее к изменению числа
В качестве второй возможной причины уменьше-
и размера частиц золя, а следовательно, и величины
ния скорости ферментативной деструкции можно
межфазной поверхности [36], позволяет оказывать
предположить, что введение золя иодида серебра
влияние на скорость ферментативной деструкции.
может приводить к уменьшению доступности звеньев
Важно то, что закономерности ферментативной
полимеров для взаимодействия с ферментом вслед-
деструкции, определенные для растворов полимеров,
ствие сжатия макромолекулярного клубка аналогич-
сохраняются и при переходе к пленочным образцам.
но тому, как это имело место при деструкции АХТЗ
На рис. 3 для примера приведены кинетические кри-
в присутствии низкомолекулярных электролитов
вые процесса ферментативной деструкции пленоч-
[33-35]. Поскольку добавление золя иодида серебра
ных образцов АХТЗ и ПКД на его основе. Как видно
в раствор полимера автоматически подразумевает и
из представленных данных, пленочные материалы,
введение низкомолекулярного электролита — нитрата
полученные на основе ПКД, деструктируют в мень-
калия, образующегося в результате реакции обмена
шей степени, чем сформированные из растворов ин-
между нитратом серебра и иодидом калия при фор-
дивидуальных полимеров.
мировании золей AgI конденсационным способом,
Таким образом, можно утверждать, что уменьше-
высказанное ранее предположение представляется
ние скорости ферментативной деструкции пленочных
вполне логичным. АХТЗ и СХТЗ —полиэлектролиты,
образцов, имеющее место при переходе от раство-
в растворе присутствуют в виде поликатиона и поли-
ров полимеров к полимер-коллоидным дисперси-
аниона соответственно, введение любого электролита
ям, обусловлено не только уменьшением активности
должно приводить к подавлению эффекта полиэлек-
ферментного препарата, вызванным присутствием
тролитного набухания.
ионов серебра, но и изменением конформационно-
Действительно, проведение «холостого» экспери-
надмолекулярного состояния полимеров вследствие
мента, когда к растворам АХТЗ и СХТЗ добавляли
адсорбции полимера на поверхности коллоидных
раствор KNO3 в количестве, сопоставимом с обра-
частиц.
292
Чернова В. В. и др.
Выводы
[10]
Щербаков А. Б. // Фармацевтический журн. 2006.
№ 5. С. 45-57.
1. Установлено, что присутствие в растворах аце-
[11]
Нежинская Г. И., Копейкин В. В., Гмиро В. Е.
тата и сукцинамида хитозана заряженных частиц ли-
Серебро в медицине и технике: Препринт № 4.
офобного золя вызывает уменьшение характеристи-
Новосибирск: СО РАМН, 1995. С. 151-153.
ческой вязкости за счет сжатия макромолекулярного
[12]
Pandey D., Ortiz C., Torres R. // Int. J. Nanomed.
клубка и приводит к повышению степени агрегации
2013. V. 3. N 9. Р. 1361-1370.
полимеров в растворе.
[13]
Martindale — The Extra Pharmacopoeia. 28th Ed.
2. Показано, что растворы полимер-коллоид-
Eds J. E. F. Reynolds, A. B. Prasad / London: The
ных дисперсий характеризуются меньшей скоро-
Pharmaceutical Press, 1982. 941 p.
[14]
Рощин А. В., Орджоникидзе Э. К. // Гигиена труда
стью ферментативной деструкции, чем индивиду-
и проф. заболеваний. 1984. № 10. С. 25-28.
альные растворы ацетата и сукцинамида хитозана.
[15]
Щукин Е. Д., Перцов А. В., Амелина Е. А. Кол-
Наименьшая скорость деструкции характерна для
лоидная химия. М.: Высш. шк., 2004. 445 с.
полимер-коллоидных дисперсий, частицы дисперс-
[16]
Неппер Д. Стабилизация коллоидных диспер-
ной фазы которых обладают наибольшей межфазной
сий полимерами / Пер. с англ. В. П. Привалко
поверхностью.
под ред. Ю. С. Липатова. М.: Мир, 1986. 487 c.
3. Установлена корреляция между значениями ско-
[Napper D. H. Polymeric Stabilization of Colloidal
рости ферментативной деструкции, характеристиче-
Dispersions. London: Acad. Press, 1983. 345 p.].
ской вязкости и степени агрегации макромолекул.
[17]
Штильман М. И. Полимеры медико-биологиче-
ского назначения. М.: ИКЦ «Академкнига», 2006.
400 c.
Финансирование работы
[18]
Скрябин К. Г., Вихорева Г. А., Варламов В. П. Хитин
Работа выполнена при финансовой поддержке
и хитозан: Получение, свойства и применение. М.:
Минобрнауки РФ в рамках базовой части государ-
Наука, 2002. 360 с.
[19]
Кулиш Е. И., Герчиков А. Я., Чирко К. С., Коле-
ственного задания в сфере научной деятельности,
сов С. В., Заиков Г. Е. // Высокомолекуляр. соеди-
проект № 4.5032.2017/БЧ.
нения. 2004. Т. 46Б. № 2.С. 349-353 [Kulish E. I.,
Gerchikov A. Ya., Chirko K. S., Kolesov S. V., Zai-
kov G. E. // Polym. Sci. Ser. B. 2004.V. 46. N 1. P. 31-
Список литературы
34].
[1] Bhattacharyya S., Kudgus R. A., Bhattacharyya R.,
[20]
Эмануэль Н. М., Бучаченко А. Л. Химическая физи-
Mukherjee P. // Pharm. Res. 2011. V. 28. N 2. Р. 237-
ка старения и стабилизации полимеров. М.: Наука,
259.
1982. 368 с.
[2] Berry C., Curtis A. // J. Phys. D. Appl. Phys. 2003.
[21]
Колесов С. В., Кулиш Е. И., Заиков Г. Е. //
V. 36. N 13. P. 36-38.
Высокомолекуляр. соединения. 2003. Т. 45А. № 7.
[3] Lu A.-H., Salabas E. L., Schuth F. // Angew. Chem. Int.
С. 1053-1063 [Kolesov S. V., Kulish E. I., Zaikov G. E.
Ed. 2007. V. 46. P. 1222-1244.
// Polym. Sci. Ser. A. 2003. V. 45. N 7. P. 597-
[4] Babic M., Horák D., Trchová M., Jendelová P., Glo-
605].
garová K. I., Lesný P., Herynek V., Hájek M., Syková E.
[22]
Колесов С. В., Кулиш Е. И., Минскер К. С. // Высо-
// Bioconjugate Chem. 2008. V. 19. N 3. P. 740-750.
комолекуляр. соединения. 1994. Т. 36Б. № 8.
[5] Suh J. S., Lee J. Y., Choi Y. S., Yu F., Yang V., Lee S. J.,
С. 1383-1386 [Kolesov S. V., Kulish E. I., Min-
Chung C. P., Park Y. J. // Biochem. Biophys. Res.
sker K. S. // Polym. Sci. Ser. B. 1994.V. 36. N 8.
Commun. 2009. V. 379. N 3. P. 669-675.
P. 1147-1148].
[6] Wang Y. J., Wang Y. M., Wang L., Che Y. Z., Li Z. J.,
[23]
Кулиш Е. И., Колесов С. В., Минскер К. С., Заи-
Kong D. L. // J. Nanosci. Nanotechnol. 2011. V. 11. N 5.
ков Г. Е. // Высокомолекуляр. соединения. 1998.
P. 3749-3756.
Т. 40A. № 8. С. 1309-1313 [Kulish E. I., Kolesov S. V.,
[7] Zhang Z., Dharmakumar R., Mascheri N., Fan Z.,
Minsker K. S., Zaikov G. E. // Polym. Sci. Ser. A.
Wu S., Li D. // Mol. Imaging. 2009. V. 8. N 3. P. 148-
1998. V. 40. N 8. P. 813-817].
155.
[24]
Kulish E. I., Chernova V. V., Kolesov S. V., Volodi-
[8] Савадян Э. Ш., Мельникова В. М., Беликова Г. П. //
na V. P., Monakov Y. B. // J. Balkan Trib. Ass. 2011.
Антибиотики и химиотерапия. 1989. № 11. С. 874-
V. 17. N 2. P. 262-274.
878.
[25]
Туктарова И. Ф., Чернова В. В., Лаздин Р. Ю.,
[9] Shahverdy A. R., Fakhimi A., Minaian S. // Nanomedi-
Кулиш Е. И. // Физикохимия поверхности и за-
cine Nanotechnol. Biol. Med. 2007. V. 3. N 2. P. 168-
щита материалов. 2016. Т. 52. № 2. С. 203-208
171.
[Tuktarova I. F., Chernova V. V., Lazdin R. Y., Ku-
Особенности ферментативной деструкции ацетата и сукцинамида хитозана...
293
lish E. I. // Protection Metals Phys. Chem. Surfaces.
[33] Чернова В. В., Туктарова И. Ф., Кулиш Е. И. // Хим.
2016. V. 52. N 2. P. 297-301].
физика. 2017. Т. 36. № 4. С. 75-80 [Chernova V. V.,
[26]
Chernova V. V., Kulish E. I., Kolesov S. V., Volodi-
Tuktarova I. F., Kulish E. I. // Russ. J. Phys. Chem. B.
na V. P., Monakov Y. B., Zaikov G. E. // Cellulose
2017. V. 11. N 2. P. 338-342].
Chem. Technol. 2008. V. 42. N 9-10. P. 513-516.
[34] Чернова В. В., Туктарова И. Ф., Кулиш Е. И. //
[27]
Лабораторные работы и задачи по коллоидной
Прикл. биохимия и микробиология. 2016. Т. 52.
химии / Под ред. Ю. Г. Фролова, А. С. Гродского.
№ 5. С. 513-519 [Chernova V. V., Tuktarova I. F.,
М.: Химия, 1986. 216 c.
Kulish E. I. // Appl. Biochem. Microbiol. 2016. V. 52.
[28]
Баранов В. Г., Бресткин Ю. В., Агранова С. А.,
N 5. P. 525-530].
Пинкевич В. Н. // Высокомолекуляр. соединения.
[35] Чернова В. В., Шуршина А. С., Базунова М. В.,
1986. Т. 28Б. № 10. С. 841-843.
Кулиш Е. И. // ЖПХ. 2015. Т. 88. № 4. С. 616-621
[29]
Чернова В. В., Туктарова И. Ф., Кулиш Е. И. //
[Chernova V. V., Shurshina A. S., Bazunova M. V.,
Бутлеровские сообщ. 2013. Т. 34. № 4. С. 102-
Kulish E. I. // Russ. J. Appl. Chem. 2015. V. 88. N 4.
106.
P. 647-651].
[30]
Arinshtein A. E. // Sov. Phys. JETP. 1992. V. 74. N 4.
[36] Базунова М. В., Валиев Д. Р., Замула Ю. С., Черно-
P. 646-650.
ва В. В., Колесов С. В., Кулиш Е. И. // Хим. физика.
[31]
Степаненко Б. Н. Химия и биохимия углеводов
2017. Т. 36. № 6. С. 70-78 [Bazunova M. V., Va-
(полисахариды). М.: Высш. шк., 1977. 224 с.
liev D. R., Zamula Y. S., Chernova V. V., Kolesov S. V.,
[32]
Биохимия: Учеб. для вузов / Под ред. Е. С. Севе-
Kulish E. I. // Russ. J. Phys. Chem. B. 2017. V. 11.
рина. М.: ГЭОТАР-Медиа, 2003. 779 с.
N 3. P. 513-520].