Журнал прикладной химии. 2019. Т. 92. Вып. 5
КАТАЛИЗ
УДК 66.097.3:661.961.6
ИСПОЛЬЗОВАНИЕ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ
В ПРОИЗВОДСТВЕ КАТАЛИЗАТОРОВ КОНВЕРСИИ МЕТАНА
© Н. А. Макрушин1, В. Л. Гартман1, О. В. Замуруев3,
А. Я. Вейнбендер1, Д. В. Муравлянский2, А. В. Дульнев1
1 ООО «НИАП-КАТАЛИЗАТОР», Новомосковск Тульской обл.
2 ООО «Проктер энд Гэмбл — Новомосковск», Новомосковск Тульской обл.
3 ООО «Полипласт Новомосковск», Новомосковск Тульской обл.
E-mail: mna@niap-kt.ru
Поступила в Редакцию 19 сентября 2018 г.
После доработки 21 января 2019 г.
Принята к публикации 28 января 2019 г.
Сравнивается влияние различных поверхностно-активных веществ на свойства пропиточного рас-
твора нитратов никеля и алюминия в конденсате, применяемого в производстве нанесенных катали-
заторов конверсии метана. Показано, что использование синтанолов (оксиэтилированных спиртов,
являющихся неионогенными поверхностно-активными веществами) позволяет существенно (на
3 порядка) снизить необходимое содержание поверхностно-активных веществ в растворе, что под-
тверждается многолетним производственным опытом. Приведены результаты квантово-химических
расчетов взаимодействия молекул синтанолов с ионами никеля. Применение синтанола позволяет
существенно снизить вероятность зауглероживания поверхности катализатора и возможный унос
части ионов металла с пропиточным раствором, а также уменьшить токсичность и взрывоопас-
ность внутри производственной зоны.
Ключевые слова: катализаторы конверсии метана; пропиточные растворы; ионы никеля; поверх-
ностно-активные вещества; синтанол; квантово-химические расчеты
DOI: 10.1134/S0044461819050098
Одним из наиболее распространенных вариантов
из таких недостатков является «зависание» раствора
получения нанесенных катализаторов является погру-
в слое носителя (катализатора или полупродукта при
жение носителей в растворы соответствующих солей.
многократной пропитке) в местах контакта гранул
Такой метод получения обладает следующими пре-
между собой и стенками аппарата, а также в отвер-
имуществами: однородностью состава получаемых
стиях гранул. Это приводит к увеличению времени
катализаторов, возможностью организации выпуска
стекания раствора, неоднородному химическому со-
продукции в больших объемах, простотой аппара-
ставу на геометрической поверхности катализатора,
турного оформления [1] и пониженными потерями.
забиванию отверстий гранул оксидами никеля и алю-
Наряду с этим метод имеет и ряд недостатков.
миния (после прокалки), ухудшению товарного вида,
В частности, при получении катализатора конверсии
производственным потерям компонентов пропиточ-
метана путем пропитки корундовых носителей рас-
ного раствора. В целом это выражается в снижении
твором нитрата никеля и нитрата алюминия [2] одним
производительности оборудования, увеличении за-
605
606
Макрушин Н. А. и др.
трат сырья и трудозатрат, особенно ручного труда, и
водным раствором нитрата никеля (никель азотно-
снижении качества продукции.
кислый, 6-водный, ГОСТ 4055-78, марка «чистый»)
Для устранения указанной проблемы применя-
в присутствии ПАВ. Пропитка носителя осуществля-
лась, в частности, продувка слоя гранул носителя
лась в реакторе водным раствором нитрата никеля
(или полупродукта при многократной пропитке) по-
(плотность 1.48-1.50 г·см-3 при 20°С) с последующей
током воздуха после слива пропиточного раствора.
сушкой при температурах 120-210°С для удаления
Это, однако, не снимало проблему полностью, и для
физической воды и прокалкой при 250-450°С для
ликвидации последствий зависания пропиточного
разложения нитратов.
раствора применялись дополнительные операции, в
В качестве ПАВ в пропиточных растворах ис-
частности, окатывание гранул катализатора. Поэтому
пользовались: гидрофобизирующая композиция ка-
был использован другой вариант — снизить время и
тионных ПАВ — Дон 96В (ТУ 2458-005-04706205-
повысить полноту стекания раствора с гранул путем
2004), активной составляющей которой являются
снижения поверхностного натяжения пропиточного
катионоактивные производные типа четвертичных
раствора введением в него поверхностно-активного
аммониевых соединений на основе высших жирных
вещества (ПАВ).
кислот; поливиниловый спирт (ПВС), ГОСТ 10779-
В работе [2] было изучено влияние некоторых
78, марка 16/1; этиленгликоль (этандиол-1,2), ГОСТ
органических веществ (полиакриламид, поливини-
19710-83, сорт — высший; синтанолы марок АЛМ-2
ловый спирт, этиленгликоль, диэтиламин и др.) с
и АЛМ-7 — смеси полиоксиэтиленгликолевых эфи-
невысокой поверхностной активностью (по срав-
ров синтетических первичных высших жирных спир-
нению с современными ПАВ) на полноту стекания
тов фракции С12-С14 (ТУ 2483-076-05015207-2002 и
раствора с гранул катализатора. Наиболее удачный
ТУ 2483-005-71150986-2012 соответственно).
результат был получен при использовании этиленгли-
Спектры поглощения анализируемых образцов
коля: количество зависающего раствора в этом случае
регистрировали на UV/VIS спектрометре Lambda 25
уменьшилось почти в 2 раза. Изменений в работе
(Perkin Elmer) в интервале длин волн 190-500 нм с
катализатора, полученного с применением указанного
шагом 0.01 нм относительно дистиллированной воды
вещества, не обнаружено.
(толщина кюветы l = 1 см). Концентрации исследуе-
Вместе с тем при использовании ПАВ для сниже-
мых водных растворов (мг·мл-1): Ni(NO3)2·4H2O —
ния поверхностного натяжения пропиточного рас-
1.7, синтанола — 1.0.
твора остаются нерешенными следующие вопросы:
С целью теоретической оценки возможного меж-
— можно ли еще уменьшить концентрацию ПАВ
молекулярного взаимодействия ионов Ni2+ с моле-
для снижения опасности зауглероживания поверхно-
кулами синтанола (С) были выполнены квантово-
сти катализатора;
химические расчеты в неэмпирическом базисе
— существует ли вероятность уноса ионов ме-
HF/STO-6-31G**. При этом учитывались те взаимо-
таллов, нанесенных при предыдущих пропитках, с
действия, значения энергий которых выше энергий
поверхности носителя из раствора молекулами ПАВ
взаимодействия молекул воды между собой, и тот
в результате образования между ними устойчивых
факт, что величина энергии ион-дипольного взаимо-
комплексных соединений.
действия для ионов в водном растворе сравнима с
Ответы на указанные вопросы помогают решить
энергией теплового движения (kT) или превышает его
ряд технологических проблем, связанных с зауглеро-
[3]. Энергию взаимодействия рассчитывали как раз-
живанием поверхности катализатора и повышенным
ницу между полной электронной энергией системы
расходом соли никеля вследствие возможного уноса
и суммой полных электронных энергий составных
части ионов металла с пропиточным раствором, а
частей этой системы. Например, энергия взаимодей-
также токсичностью и взрывоопасностью внутри
ствия частиц в системе «Ni2+ … С» равна разности
производственной зоны.
между энергией системы и суммой энергий комплекс-
ного иона и кластера:
Экспериментальная часть
ΔЕ = Е[NiC]2+ - (ЕNi2+ + ЕC).
При моделировании процесса получения катали-
затора конверсии метана НИАП-03-01 принимали,
Обсуждение результатов
что для получения заданного содержания в нем ок-
сида никеля корундовый носитель (ТУ 2163-003-
При изучении влияния различных ПАВ на про-
07620772-2006) подвергается трехкратной пропитке
цесс пропитки было установлено, что для третичных
Использование поверхностно-активных веществ в производстве катализаторов конверсии метана
607
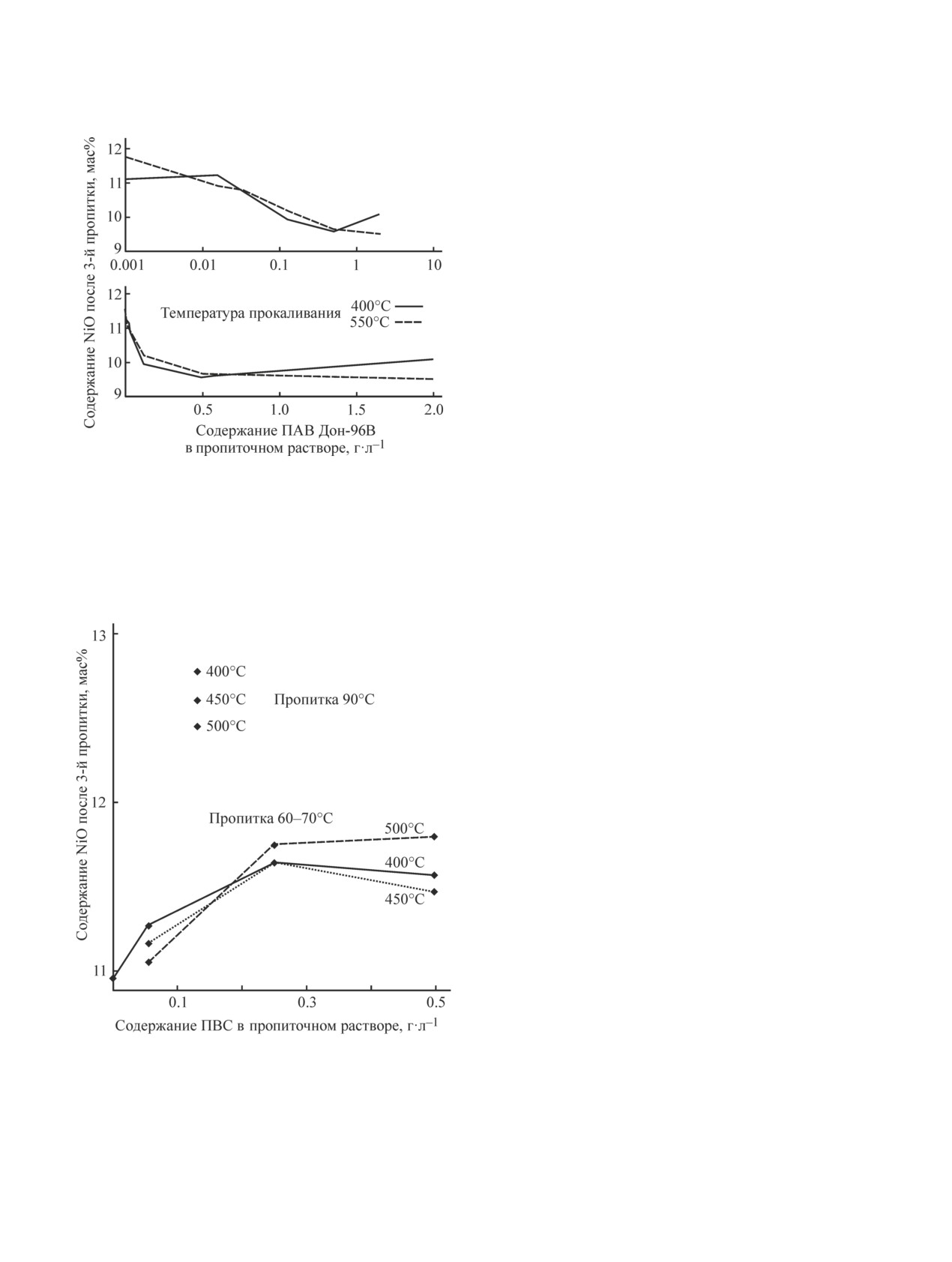
ПАВ. На рис. 1 приведена соответствующая зависи-
мость содержания NiO после трех пропиток от содер-
жания этого ПАВ в пропиточном растворе.
Удовлетворительные результаты были получены
при использовании в качестве ПАВ поливинилового
спирта. Установлено, что от температуры прокал-
ки содержание NiO зависит слабо и бессистемно.
Увеличение температуры пропитки до 90°С резко
повышает прирост содержания NiO в катализаторе
(рис. 2). При температурах пропитки 60-70°С со-
держание NiO в катализаторе после 3-й пропитки
перестает зависеть от содержания поливинилового
спирта в пропиточном растворе, когда оно превышает
величину 0.25 г·л-1.
С целью снижения содержания ПАВ в пропиточ-
ном растворе в данной работе был использован синта-
нол — современное промышленное ПАВ с высокими
Рис. 1. Зависимость содержания NiO после трех про-
смачивающими и эмульгирующими свойствами. В во-
питок корундового носителя от содержания добавки
дных растворах синтанол обеспечивает мгновенное
Дон-96В в пропиточном растворе и температуры про-
диспергирование и образование мелкодисперсной
каливания.
эмульсии без механического воздействия, как и рас-
аминов (Дон-96В) наблюдается снижение содержания
смотренные выше органические вещества, не со-
NiO в катализаторе с увеличением концентрации
держит в своем составе соединений серы и хлора,
которые являются сильными ядами для большинства
катализаторов, поэтому синтанол удобно использо-
вать в процессе производства нанесенных катализато-
ров. Широкое практическое использование синтано-
лов — оксиэтилированных спиртов, представляющих
собой смесь полиэтиленгликолевых эфиров с различ-
ными количествами оксиэтильных групп и величи-
ной радикала R (неионогенных ПАВ), общеизвестно.
Синтанолы входят в состав моющих средств, исполь-
зуются как стабилизаторы суспензий, эмульгаторы,
антистатики при переработке синтетических воло-
кон, а также в качестве обезжиривателей шерсти и
металлических поверхностей, выравнивателей при
крашении кубовыми красителями, смачивателей, в
виде добавок в моющие композиции, диспергаторы
[4]. Благодаря поверхностно-активным свойствам
они широко используются в растворах электролитов
в качестве смачивателей для получения высококаче-
ственных катодных покрытий различными металлами
и сплавами [5-7].
На практике наиболее часто используются синта-
нолы марок АЛМ и ДС. Синтанол АЛМ — с общей
формулой CnH(2n+1)O(C2H4O)m, где n = 10-13 — дли-
Рис. 2. Зависимость содержания NiO после 3-й пропит-
на углеродной цепи, m = 7-10 — степень этокси-
ки корундового носителя от содержания ПВС в пропи-
лирования. Марка обозначается по степени этокси-
точном растворе при разных температурах пропитки и
прокалки.
лирования: АЛМ-7 — m = 7, АЛМ-2 — m = 2 [4].
Синтанол ДС — с общей формулой: углеводородный
В случае пропитки при 90°С показаны экспериментальные
точки для одного значения содержания ПВС — 0.125 г·л-1.
радикал С10Н21 (гидрофобная группа) и оксиэтили-
608
Макрушин Н. А. и др.
рованная часть (С2Н4О)mОН (гидрофильная группа).
Недостатком способа снижения поверхностного
Соответственно для марки синтанола ДС-10 m = 10.
натяжения пропиточного раствора путем введения
В настоящей работе для снижения поверхностного
в него ПАВ является существование межмолекуляр-
натяжения в пропиточный раствор добавлялся синта-
ного взаимодействия в растворе молекул синтанола с
нол марки АЛМ-7.
ионами Ni2+, приводящего к связыванию части ионов
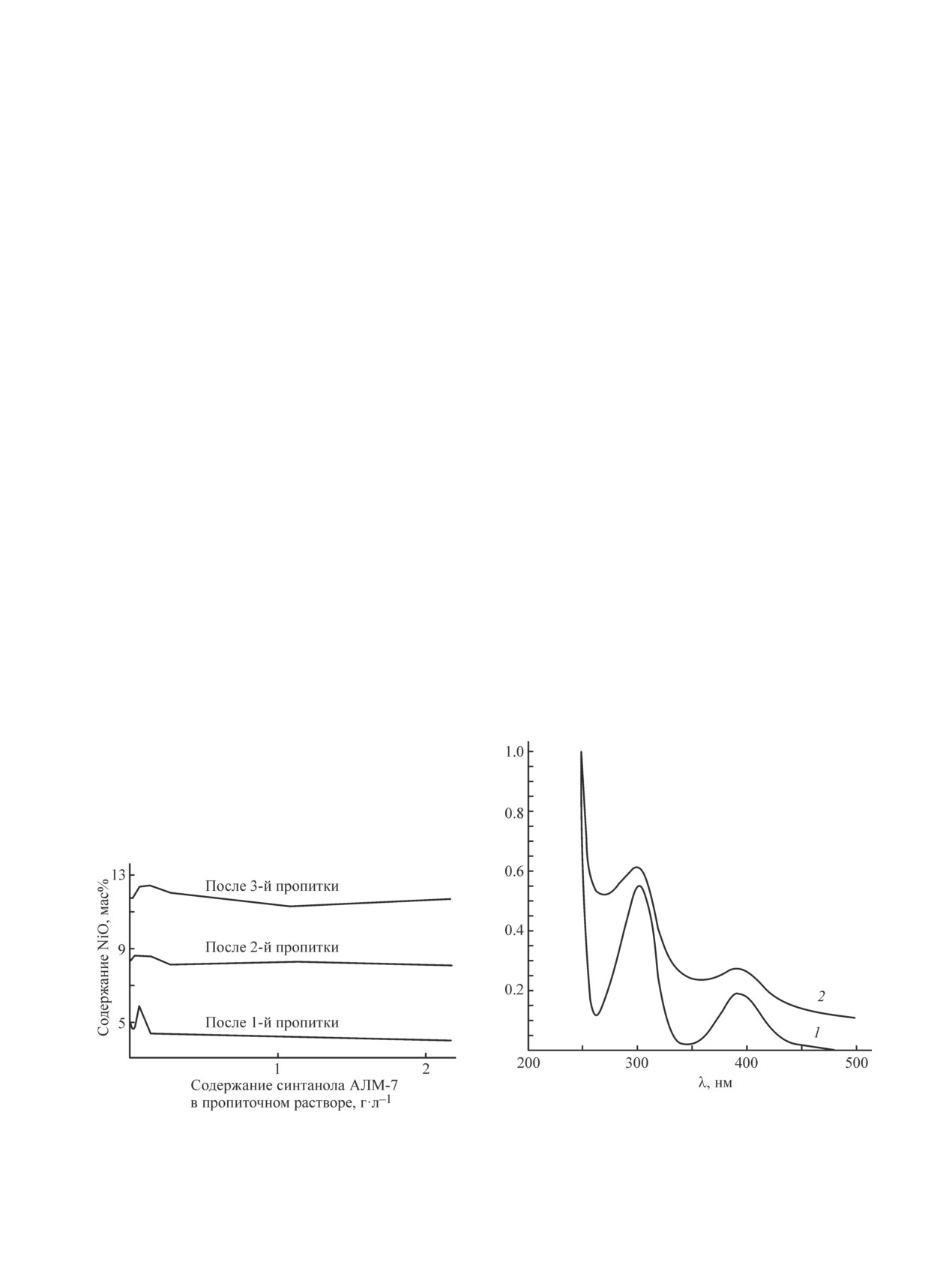
На рис. 3 приведены зависимости содержания NiO
в растворе. Оно может приводить к снижению коли-
от содержания этого ПАВ в пропиточном растворе.
чества наносимого металла из пропиточного раствора
Видно, что содержание NiO слабо зависит от концен-
на поверхность носителя или полупродукта. Этим
трации синтанола. Максимумы при низких значениях
можно объяснить уменьшение содержания NiO на
содержания ПАВ получены пропиткой горячих гра-
поверхности катализатора при увеличении концен-
нул (90°С) холодным раствором. Экспериментальным
трации синтанола в пропиточном растворе (рис. 3).
путем было установлено, что 100%-ное смачивание
С целью экспериментального установления факта
достигается при концентрации синтанола в растворе
такого взаимодействия ионов никеля с молекулами
1.5 г·л-1. В то же время при разработке промыш-
синтанола были получены ультрафиолетовые спек-
ленной технологии оказалось, что для получения
тры синтанолов марок АЛМ-2 и АЛМ-7 в спектраль-
качественных катализаторов в раствор достаточно
ном диапазоне 190-800 нм.
добавить синтанол в десятикратно меньшей концен-
Полученные результаты показывают, что для ин-
трации — не более 0.15 г·л-1 (рис. 3). Более того, в
дивидуальных синтанолов заметное диффузное по-
результате отработки технологии на промышлен-
глощение излучения наблюдается лишь в коротко-
ном оборудовании это содержание было снижено
волновой области спектра с максимумом в области
до 6.3·10-3 г·л-1. Это минимальное количество ПАВ
230 нм.
(0.00042 мас%) позволяет избежать протекания не-
Известно, что ионы никеля(II) в водном раство-
желательных процессов, таких как образование кокса
ре поглощают излучение в спектральной области
на поверхности катализатора. Иными словами, мас-
200-800 нм [9, 10]. При этом в спектрах выделяют че-
совая доля синтанола, необходимая для получения
тыре основные полосы поглощения с максимумами в
требуемого результата, в 700 раз меньше таковой для
областях около 240, 300, 390 и 720 нм. В полученных
этиленгликоля (0.3% [2]). Следует также иметь в виду
УФ-спектрах водного раствора Ni2+ (рис. 4, кривая 1)
токсичность и взрывоопасность этиленгликоля, суще-
и этого раствора с добавлением в него синтанола
ственно усложняющие технологический процесс по
(рис. 4, кривая 2) также наблюдаются указанные по-
причине дополнительных материальных и финансо-
вых затрат на создание безопасных условий труда на
рабочих местах. При использовании в качестве ПАВ
синтанола такой проблемы не существует, поскольку
он широко используется в товарах санитарно-гигие-
нического назначения [8].
Рис. 4. УФ-спектры водных растворов Ni2+ (1), Ni2+ с
Рис. 3. Зависимость содержания NiO в катализаторе на
добавлением синтанола (2).
корундовом носителе от содержания синтанола АЛМ-7
Концентрация исследуемых водных растворов (мг·мл-1):
в пропиточном растворе.
Ni(NO3)2·4H2O — 1.7, синтанола — 1.0.
Использование поверхностно-активных веществ в производстве катализаторов конверсии метана
609
лосы, причем наиболее информативными являются
кал С10Н21 — гидрофобная группа) и глобулярной
вторая и третья полосы поглощения.
[оксиэтилированная часть (С2Н4О)10ОН — гидро-
Как следует из рис. 4, добавление к водному рас-
фильная группа], закрученной в подобие спирали.
твору нитрата никеля синтанола АЛМ-2 приводит к
Максимальные размеры данной молекулы по расчет-
смещению максимумов наблюдаемых спектральных
ным данным (пм) составляют 2400 × 900 × 800.
полос в коротковолновую область с 301.8 до 298.6 нм
Молекула синтанола АЛМ-7 (рис. 5, а) по резуль-
и с 393.9 до 389.2 нм соответственно. Аналогично
татам проведенных как полуэмпирических, так и
смещаются и максимумы двух оставшихся полос:
неэмпирических расчетов имеет несколько меньшие
коротковолновой с 239.2 до 239.0 нм и длинноволно-
размеры, но ее структура в целом повторяется: фи-
вой с 720.5 до 720.0 нм, но величина смещения при
бриллярная часть (углеводородный радикал С10Н21 —
этом значительно меньше. Такой характер изменения
гидрофобная группа) и глобулярная [оксиэтилирован-
полос поглощения, очевидно, связан с взаимодей-
ная часть (С2Н4О)7ОН — гидрофильная группа]. Что
ствием в растворе гидратированных ионов никеля
касается молекулы синтанола АЛМ-2 (рис. 5, б), то
с молекулами синтанола, что соответствует резуль-
она имеет несколько иную структуру за счет меньших
татам аналогичных исследований для этилендиами-
размеров глобулярной части (С2Н4О)2ОН.
новых и оксалатных комплексов Ni2+ [11]. Характер
В табл. 1 приведены значения ряда квантово-хи-
изменения спектральных полос для водного раствора
мических дескрипторов молекул изученных соеди-
нитрата никеля и синтанола АЛМ-7 аналогичен пре-
нений.
дыдущей системе.
Энергии верхних занятых (ВЗМО) и нижних сво-
Молекула синтанола марки ДС-10 по результатам
бодных молекулярных орбиталей (НСМО), как и
ранее проведенных расчетов в рамках полуэмпи-
разность между ними (∆НСМО-ВЗМО), для молекул
рического метода РМ3 [12, 13] представляет собой
исходных синтанолов имеют близкие значения, что
достаточно сложную структуру [14], состоящую из
свидетельствует об их схожем электронном строе-
двух частей: фибриллярной (углеводородный ради-
нии. Основной вклад в ВЗМО молекул синтанолов
Рис. 5. Структура молекул синтанолов АЛМ-7 (а) и АЛМ-2 (б) по данным квантово-химического расчета методом
HF/6-31G**.
Белым цветом выделены атомы кислорода, темно-серым — углерода, светло-серым — водорода.
610
Макрушин Н. А. и др.
Таблица 1
Некоторые дескрипторы молекул синтанолов и их ассоциатов с ионами Ni2+, рассчитанные методом
HF/6-31G**
ВЗМО
НСМО
Длина связи, пм
Валентный угол, град
∆НСМО-ВЗМО,
Соединение
эВ
эВ
С
Г-О1
О1-СФ
ССГО1
СГО1СФ
О1СГСФ
АЛМ-2
-10.43
5.99
16.42
1.43
1.45
112.4
116.4
110.8
[АЛМ-2…Ni]2+
-17.72
-5.01
12.71
1.47
1.50
105.5
118.1
112.3
АЛМ-7
-10.32
6.13
16.45
1.40
1.40
108.8
115.2
108.8
[АЛМ-7…Ni]2+
-14.54
-1.53
13.01
1.41
1.43
109.5
114.5
109.7
дает центральный атом кислорода (О1), разделяющий
ния d-орбиталей, так и стерическими затруднениями
глобулярную и фибриллярную части молекулы и со-
между атомами, входящими в состав независимых
единенный с соответствующими атомами углерода
лигандов [15]. Следует отметить, что при этом су-
(СГ) и (СФ), расположенными по обе стороны от него.
щественно изменяется и природа основных вкладов
Состав нижней свободной молекулярной орбитали
как в ВЗМО, так и в НСМО молекул синтанолов: в
(НСМО) определяется преимущественно вкладами
обоих случаях вместо ожидаемого заметного вклада
концевой группировки атомов C-О-Н оксиэтилиро-
в ВЗМО n-электронов атомов кислорода это — вкла-
ванной части молекул (рис. 5).
ды атомов углерода и водорода фибриллярной части
При взаимодействии синтанолов с ионом Ni2+
молекулы. Причиной этого, вероятно, является стаби-
структура молекул изменяется существенным об-
лизация n-электронов атомов кислорода в результате
разом (рис. 6). Ион координируется на расстоянии
их взаимодействия с ионом Ni2+. Существенное по-
180-190 пм с атомами кислорода оксиэтилированной
нижение энергий ВЗМО, НСМО, а также уменьшение
группы молекулы, которые в результате искажения
значения разности между ними (∆НСМО-ВЗМО, табл. 1)
структуры фибриллярной части молекулы АЛМ-7
подтверждают данный факт.
(рис. 6, б) образуют почти правильный тетраэдр.
Специфика строения синтанолов наблюдается при
Это соответствует данным [15], согласно которым
сравнении геометрических дескрипторов их молекул
комплексные соединения никеля с органическими
и их ассоциатов с ионами Ni2+ (табл. 1) для следую-
лигандами довольно часто образуют комплексы те-
щих молекулярных фрагментов:
траэдрического и квадратного строения. Причина
— фрагмент, расположенный на границе между
такого явления может быть связана как с достаточно
глобулярной и фибриллярной частями молекулы, об-
низким по симметрии полем лигандов для расщепле-
разованный атомом кислорода (О1), который окружен
Рис. 6. Структура ассоциатов молекул синтанолов АЛМ-2 (а) и АЛМ-7 (б) с ионами Ni2+ по данным квантово-хи-
мического расчета методом HF/6-31G**.
Использование поверхностно-активных веществ в производстве катализаторов конверсии метана
611
Таблица 2
Заряды на некоторых атомах в молекулах синтанолов и их ассоциатов с ионами Ni2+, рассчитанные
методом HF/6-31G**
Заряд на атомах
Соединение
С
Г
О1
СФ
Н
О
С
Ni2+
АЛМ-2
-0.09
-0.66
-0.08
0.38
-0.68
-0.12
—
[АЛМ-2…Ni]2+
-0.15
-0.80
-0.11
0.51
-0.81
-0.16
1.30
АЛМ-7
-0.11
-0.65
-0.15
0.39
-0.69
-0.09
—
[АЛМ-7…Ni]2+
-0.09
-0.74
-0.12
0.49
-0.81
-0.05
1.50
с одной стороны атомом углерода глобулярной части
этиленгликоля (ЭГ), наиболее эффективного ПАВ по
(СГ), а с другой — фибриллярной (СФ);
результатам работы [2] (система [NiЭГ]2+, табл. 3). Во
— спиртовая группа С-О-Н, являющаяся конце-
всех случаях для молекул ПАВ рассчитанные величи-
вой частью глобулярной части молекулы синтанола.
ны ∆E значительно превышают энергию гидратации
Геометрические параметры исходных молекул
иона Ni2+.
и распределение зарядов на их атомах (табл. 2) в
Наряду с заметным изменением структуры глобу-
целом совпадают. Исключение составляют лишь ва-
лярной части молекулы синтанола изменяются и ее
лентные углы: НОС в конце глобулярной части и
геометрические параметры. Если в [14] отмечалось,
СОС — между фибриллярной и глобулярной частями.
что при образовании системы [SnС]2+ длина моле-
По-видимому, они наиболее чувствительны к дли-
кулы синтанола немного увеличивается (на ~15 пм)
не изучаемых молекул и являются ответственными
за счет раскрытия ее глобулярной части, то в случае
за упоминавшееся выше искажение структуры ее
образования системы [NiС]2+ длина молекулы син-
фибриллярной части в результате взаимодействия
танола уменьшается более чем на 200 пм, а ширина
молекулы с ионом Ni2+.
увеличивается на 350 пм. Все это свидетельствует об
В табл. 3 приведены значения энергий образова-
определенной чувствительности структуры данной
ния (∆E) некоторых комплексных соединений нике-
молекулы к природе частицы, которая координирует-
ля, рассчитанные методом РМ3. Из них следует, что
ся в ее глобулярной части. В случае ионов Sn2+ и Ni2+
молекулы синтанолов обеих марок, как АЛМ-2, так и
такую чувствительность можно объяснить их различ-
АЛМ-7, взаимодействуют с Ni2+ примерно одинако-
ным поляризующим действием (табл. 4), поскольку
во. Несмотря на существенную разницу в строении
радиус иона Sn2+ почти в 1.5 раза больше, чем радиус
и размерах глобулярной части их молекул, величина
Ni2+.* Это объясняет уменьшение расстояния между
∆E для АЛМ-2 меньше по сравнению с АЛМ-7 всего
ионом Sn2+ и атомами кислорода молекулы синтанола
на 2%.
(220 пм [14]) по сравнению с аналогичной величиной
Аналогичные результаты наблюдаются и для ас-
для иона Ni2+ (180 пм).
социата, образованного ионами Ni2+ с молекулами
Полученные данные согласуются с результатами
работы [16], в которой методом протонной магнитной
релаксации установлено, что молекулы органических
Таблица 3
спиртов входят в первую координационную сферу
Значения энергий образования ∆E некоторых
катионов никеля(II) даже в весьма разбавленных
комплексных соединений никеля
(2 мас%) по спирту растворах. Это свидетельствует
о высокой химической активности молекул спиртов
Структура комплекса
-∆E, кДж⋅моль-1
по отношению к никелю.
[Ni(H2O)6]2+
195
В процессе адсорбции макромолекул гомополиме-
ров установление равновесия протекает достаточно
[NiС]2+ (АЛМ-2)
4369
[NiС]2+ (АЛМ-7)
4283
* Краткий справочник физико-химических величин /
Под ред. А. А. Равделя и А. М. Пономаревой. 8-е изд.,
[NiЭГ]2+
2802
перераб. Л.: Химия, 1983. С. 200.
612
Макрушин Н. А. и др.
Таблица 4
Значения поляризующего действия ионов z/rИОН и энергий образования ∆E ассоциатов с молекулой
синтанола АЛМ-2 для ионов Ni2+ и Sn2+
Ион
rИОН, пм
z/rИОН·10-2
-∆E, кДж·моль-1
Ni2+
74
2.70
4369
Sn2+
102
1.96
2153
медленно [17] по причине длительного процесса диф-
Конфликт интересов
фузии макромолекул к поверхности. Из этого следует,
Авторы заявляют об отсутствии конфликта инте-
что основная часть молекул ПАВ, ассоциированных
ресов, требующего раскрытия в данной статье.
с ионами Ni2+ в виде активного адсорбированного
комплекса, находится в пропиточном растворе. После
Информация об авторах
окончания стадии пропитки носителя (катализатора)
ионы Ni2+ в составе указанного комплекса уносятся
Макрушин Николай Анатольевич, к.х.н., доцент,
из катализатора вместе с раствором. Очевидно, что
чем ниже концентрация ПАВ в растворе, тем меньше
Гартман Владимир Леонидович, к.т.н., ORCID:
должны быть и потери ионов Ni2+. Тогда в соответ-
ствии с изложенным выше применение в качестве
Замуруев Олег Викторович, к.х.н., ORCID: https://
ПАВ синтанола по сравнению с этиленгликолем по-
orcid.org/
зволяет уменьшить потери ионов металла примерно
Вейнбендер Александр Яковлевич, ORCID: https://
в 700 раз.
orcid.org/0000-0002-7277-8095.
Муравлянский Дмитрий Викторович, к.х.н.,
Выводы
Дульнев Алексей Викторович, к.т.н., ORCID:
Установлено, что использование синтанола для
снижения поверхностного натяжения пропиточного
раствора соли никеля значительно эффективнее, чем
этиленгликоля. Применение синтанола в качестве
Список литературы
ПАВ в пропиточных растворах в производстве нане-
[1] Технология катализаторов / Под ред. И. П. Мух-
сенных катализаторов конверсии метана позволяет
ленова. 2-е изд., перераб. Л.: Химия, 1979. 328 с.
существенно снизить вероятность зауглероживания
[2] Дульнев А. В., Обысов А. В., Головков В. И., Соко-
поверхности катализатора и возможный унос части
лов С. М., Левтринская Н. А. // Газохимия. 2008.
ионов металла с пропиточным раствором, а также
№ 3 (2). С. 82-89.
уменьшить токсичность и взрывоопасность внутри
[3] Израелашвили Д. Межмолекулярные и поверхност-
производственной зоны.
ные силы. М.: Науч. мир, 2011. 456 с.
По технологии с использованием синтано-
[4] Шенфельд Н. Поверхностно-активные вещества на
ла АЛМ-7 катализаторы конверсии углеводородов
основе оксида этилена / Пер. с нем. Л. В. Коваленко
(НИАП-03-01, НИАП-03-01Б, К-905D1, НИАП-04-02)
и др. М., 1982. 752 с. [Schönfeldt N. Grenzfläche-
производятся катализаторным производством ООО
naktive Äthylenoxid-Addukte. Stuttgart: Wissensch.
Verlagsges., 1976].
«НИАП-КАТАЛИЗАТОР» с 2010 г. К настоящему
[5] Аверин Е. В., Смирнов К. Н., Григорян Н. С., Харла-
времени около 600 т таких катализаторов было за-
мов В. И. // Успехи в химии и хим. технологии.
гружено на 18 установках 9 российских и зарубеж-
2007. Т. XXI. № 9 (77). С. 61-63.
ных предприятий, среди которых: филиал «Азот»
[6] Медведев Г. И., Макрушин Н. А., Дубенков А. Н.
АО «ОХК «УРАЛХИМ», г. Березники; АО «НАК
// Защита металлов. 2003. Т. 39. № 4. С. 424-427
«Азот», г. Новомосковск; ООО «Газпром нефте-
[Medvedev G. I., Makrushin N. A., Dubenkov A. N. //
хим Салават», г. Салават; ПАО «Куйбышев Азот»,
Protection Metals. 2003. V. 39. N 4. P. 381-384].
г. Тольятти; ОАО «Fargonaazot», г. Фергана; ОАО
[7] Медведев Г. И., Макрушин Н. А. // ЖПХ. 2012. Т. 85.
«Нафтан», г. Новополоцк; ТОО «КазАзот», г. Актау
№ 1. С. 55-59 [Medvedev G. I., Makrushin N. A. //
Russ. J. Appl. Chem. 2012. V. 85. N 1. P. 52-56].
Использование поверхностно-активных веществ в производстве катализаторов конверсии метана
613
[8] Бочаров В. В. // Бытовая химия. 2006. № 23. С. 22.
// Russ. J. Appl. Chem. 2004. V. 77. N 11. P 1781-
[9] Ершов Б. Г. // Рос. хим. журн. (ЖРХО им.
1785].
Д. И. Менделеева). 2001. Т. XLV. № 3. С. 20-30.
[15] Wells A. F. Structural Inorganic Chemistry / 5th Еd.
[10] Гафуров М. М., Атаев М. Б., Алиев А. Р., Ла-
Oxford [Oxfordshire]: Clarendon Press/© Oxford
рин С. В. // ЖСХ. 2007. Т. 48. № 1. С. 105-107.
University Press, 2012. 1416 c.
[11] Гуленина К.А ., Шляхова М. А., Горичев И. Г. //
[16] Носков А. В., Багровская Н. А., Шмуклер Л. Э.,
Успехи в химии и хим. технологии. 2011. Т. XXV.
Шмуклер М. В., Лилин С. А. // Защита металлов.
№ 2 (118). С. 7-11.
2001. Т. 37. № 1. С. 41-45 [Noskov A. V., Bagrov-
[12] Stewart J. J. P. // J. Comput. Chem. 1989. V. 10. N 2.
skaya N. A., Shmukler L. E., Shmukler M. V., Lilin S. A.
P. 209-220.
// Protection Metals. 2001. V. 37. N 1. P 35-39].
[13] Stewart J. J. P. // J. Comput. Chem. 1991. V. 12. N 3.
[17] Помогайло А. Д., Розенберг А. С., Уфлянд И. Е.
P. 320-341.
Наночастицы металлов в полимерах. М.: Химия,
[14] Медведев Г. И., Макрушин Н. А. // ЖПХ. 2004. Т. 77.
2000. 672 c.
№ 11. С. 1799-1803 [Medvedev G. I., Makrushin N. A.