622
Либерман Е. Ю. и др.
Журнал прикладной химии. 2019. Т. 92. Вып. 5
УДК 541.128:546.655
КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ ВЫСОКОДИСПЕРСНЫХ ТВЕРДЫХ
РАСТВОРОВ M2O3-Bi2O3-ZrO2-CeO2, ГДЕ M — Nd, Sm, Gd,
В РЕАКЦИИ ОКИСЛЕНИЯ МОНООКСИДА УГЛЕРОДА
© Е. Ю. Либерман1, Е. С. Подъельникова1, Е. А. Симакина1,
Т. В. Конькова1, Б. С. Клеусов2
1 Российский химико-технологический университет им. Д. И. Менделеева, Москва
2 АО «НИИ конструкционных материалов на основе графита «НИИ Графит», Москва
E-mail: el-liberman@mail.ru
Поступила в Редакцию 24 октября 2018 г.
После доработки 13 февраля 2019 г.
Принята к публикации 7 марта 2019 г.
Методом соосаждения с последующей термообработкой синтезированы высокодисперсные твердые
растворы M2O3-Bi2O3-ZrO2-CeO2, где M — Nd, Sm, Gd. Проведены исследования элементного и фазо-
вого составов, текстурных характеристик, дисперсности и морфологии. Синтезированные образцы
проявляют высокую активность в реакции окисления СО. Показано влияние природы допирующих
ионов (Bi3+, Nd3+, Sm3+, Gd3+) на каталитическую активность материалов. Наибольшая каталити-
ческая активность обнаружена для образца Gd0.05Bi0.05Zr0.18Ce0.72 O2.
Ключевые слова: диоксид церия; твердый раствор; окисление СО
DOI: 10.1134/S0044461819050116
Развитие энергетики, промышленности и транс-
Введение допантов в кристаллическую решетку
порта сопряжено с использованием углеводородных
диоксида церия приводит к образованию твердого
источников энергии, что приводит к увеличению объ-
раствора на основе кристаллической решетки диок-
ема токсичных веществ, к которым относятся продук-
сида церия, что сопровождается повышением кисло-
ты неполного сгорания — СО, углеводороды, оксиды
родонакопительной емкости за счет формирования
азота, сажа и т. д. [1-3]. Для решения этой проблемы
дефектной структуры и термостойкости материала,
применяют метод каталитической нейтрализации,
позволяющей сохранять активность при высоких
основанный на конверсии токсичных компонентов
температурах. Допирование диоксида церия ионами
в безопасные соединения. Несмотря на значитель-
редкоземельных элементов (Gd, Sm, Nd) приводит
ные успехи, достигнутые в области экологического
к генерированию анионных вакансий, образованию
катализа, по-прежнему остается открытым вопрос о
как поверхностных, так и объемных дефектов, что
снижении количества благородных металлов (Pt, Pd,
способствует увеличению мобильности кислорода в
Rh) в эксплуатируемых катализаторах и дальнейшем
кристаллической решетке и как следствие повыше-
переходе на активные композиции на основе оксидов
нию каталитической активности [4, 5]. В качестве
d- и f-элементов. Особый интерес представляют ка-
допантов перспективно использование ионов Bi3+,
тализаторы и носители на основе церийсодержащих
которые также применяются при создании катодных
твердых растворов. Основной компонент (диоксид
и анодных материалов для твердооксидных топлив-
церия) проявляет собственную каталитическую ак-
ных элементов (ТОТЭ) как добавка, увеличивающая
тивность, обладает кислородонакопительной спо-
электронную проводимость [6].
собностью благодаря наличию перехода Ce3+ в Ce4+,
Цель работы — синтез и исследование каталити-
а также механической прочностью и устойчивостью
ческих свойств M2O3-Bi2O3-ZrO2-CeO2, где M — Nd,
к воздействию высоких температур.
Sm, Gd, в реакции окисления монооксида углерода.
Каталитическая активность высокодисперсных твердых растворов...
623
Экспериментальная часть
Рус») на основе газов квалификации ос.ч. имела сле-
Синтез твердого раствора M2O3-Bi2O3-ZrO2-
дующий состав (об%): СО — 1.2, О2 — 10.0, N2 —
CeO2, где M — Nd, Sm, Gd, проводили методом
баланс. Для измерения концентрации газов на выходе
соосаждения. Исходные растворы нитратов редко-
применялся газовый хроматограф Chrom-5 (набивная
земельных элементов и висмута, хлорида циркони-
колонка, длина 5 м, внутренний диаметр 4 мм, фа-
ла (концентрация 0.5 моль·л-1) квалификации х.ч.
за — молекулярные сита 13Х, газ-носитель —гелий,
смешивали в заданном стехиометрическом соотно-
детектор — катарометр). Регенерация колонки при
шении. Осаждение проводили путем добавления
температуре 160°С проводилась в течение 90 мин.
концентрированного раствора гидроксида аммония
Обработку хроматографических пиков выполняли с
марки х.ч. до рН 10-11. Полученный осадок отфиль-
помощью программы Экохром.
тровывали, промывали водно-спиртовым раствором
Конверсию оксида углерода(II) Х рассчитывали,
(H2O/C2H5OH = 9 об.), сушили при 100°С в течение
используя следующее соотношение:
20 ч и прокаливали при температуре 600°С в тече-
ние 2 ч (скорость подъема температуры составляла
5 град·мин-1).
Исследование элементного состава образцов
где [CО]исх — начальная концентрация СО в исход-
проводили рентгенофлуоресцентным методом с
ной газовой смеси (об%), [CО]тек — текущая концен-
помощью прибора X-MAXINCA ENERGY (Oxford
трация СО (об%).
Instruments, Великобритания) в Центре коллективного
пользования им. Д. И. Менделеева.
Обсуждение результатов
Фазовый состав катализаторов изучали методом
рентгеновской дифракции на установке Bruker D8
Согласно данным рентгенофлуоресцентного
Advance (Bruker, Германия) с монохроматическим
анализа содержание компонентов в синтезирован-
CuKα-излучением (λ = 1.5418 Å) с шагом 0.01° и вре-
ных образцах соответствует номинальному составу
менем накопления 0.3 с/шаг. Расчет кристаллографи-
(рис. 1). Набор рефлексов 2θ, присутствующих на
ческих характеристик проводился методом полно-
дифрактограммах: 28.5, 33.1, 47.5, 56.3, 59.1, 69.4,
профильного анализа с применением программного
76.7 и 79.1°, — соответствует граням (111), (200),
обеспечения дифрактометра Topas R. Расчет размеров
(220), (311), (222), (400), (331) и (420) кристалли-
кристаллитов проводили по уравнению Селякова-
ческой решетки диоксида церия (JSPDS # 81-0792).
Шеррера.
При этом не наблюдается дифракционных макси-
Удельную поверхность и общую пористость
мумов, относящихся к соединениям Zr, Gd, Bi, Nd,
катализаторов определяли методом низкотемпера-
Sm. Наблюдаемый монофазный состав полученных
турной адсорбции азота на установке NOVA 1200e
соединений обусловлен формированием твердых рас-
(Quantachrome, США). Дегазацию образцов выпол-
творов замещения на основе кубической решетки
няли при температуре 200°С в течение 4 ч.
диоксида церия.
Электронно-микроскопические исследования об-
Так, введение в состав кристаллической решетки
разцов проводили на электронном микроскопе Carl
диоксида церия ионов Zr4+ протекает с образовани-
Zeiss LEO (Германия) при ускоряющем напряжении
ем твердого раствора Zr0.2Ce0.8O2, что обусловлено
100 кВ (разрешение 0.3 нм). Для устранения агломе-
рации частиц проводили предварительное ультразву-
ковое диспергирование материалов в изопропиловом
спирте.
Для определения каталитической активности
полученных образцов в реакции окисления СО ис-
пользовали реактор проточного типа. В U-образный
кварцевый реактор загружали 0.3 г катализатора.
Эксперименты проводили при объемной скорости
газовой смеси 1 мл·с-1 в интервале температур 20-
400°С. Температуру в реакционной зоне реактора
Рис. 1. Рентгенограммы синтезированных материалов.
определяли с помощью хромель-копелевой термопа-
1 — Zr0.2Ce0.8O2, 2 — Gd0.1Zr0.18Ce0.72O2, 3 —
ры, расположенной в центре каталитического слоя.
Nd0.05Bi0.05Zr0.18Ce0.72O2, 4 — Sm0.05Bi0.05Zr0.18Ce0.72O2,
Модельная смесь (производство ОАО «Линде Газ
5 — Gd0.05Bi0.05Zr0.18Ce0.72O2.
624
Либерман Е. Ю. и др.
Таблица 1
Кристаллографические параметры и дисперсность синтезированных материалов
Размер кристаллитов
Размер частиц
Образец
Параметр решетки а, Å
l, нм
по данным ПЭМ L, нм
Zr0.2Сe0.8O2
5.3915 ± 0.0001
19
10-14
Gd0.10Zr0.18Ce0.72O2
5.4173 ± 0.0003
19
8-10
Gd0.05Bi0.05Zr0.18Ce0.72O2
5.4163 ± 0.0002
18
8-10
Sm0.05Bi0.05Zr0.18Ce0.72O2
5.4201 ± 0.0001
15
8-10
Nd0.05Bi0.05Zr0.18Ce0.72O2
5.4293 ± 0.0002
17
8-12
близостью ионных радиусов Ce4+ и Zr4+ (88 и 86 пм
го типа (рис. 2). Частицы имеют форму, близкую к
по Бокию соответственно). При дальнейшем допи-
прямоугольной. Средний размер частиц Zr0.2Ce0.8O2
ровании раствора Zr0.2Ce0.8O2 трехвалентными ио-
составляет 15-20 нм, многокомпонентных твердых
нами редкоземельных металлов (Nd3+, Sm3+, Gd3+)
растворов — 8-10 нм.
и Bi3+ происходит небольшое увеличение параметра
Синтезированные материалы относятся к мезопо-
кристаллической решетки синтезированных образ-
ристым структурам, о чем свидетельствует наличие
цов. Введение ионов допантов большего размера
капиллярно-конденсационного гистерезиса на изотер-
(Gd3+ — 94 пм, Sm3+ — 97 пм, Nd3+ — 99 пм, Bi3+ —
мах адсорбции-десорбции азота (рис. 3). При допи-
102 пм) приводит к перестройке кристаллической
ровании твердого раствора ионами редкоземельных
структуры, образованию ионов Ce3+ (102 пм), гене-
металлов происходит формирование более дефектной
рированию анионных вакансий, что сопровождает-
структуры, о чем свидетельствует увеличение удель-
ся увеличением межплоскостного расстояния и как
ной поверхности и развитие пористости (табл. 2).
следствие параметра решетки (табл. 1) [7]. Расчет
Так, удельная поверхность для твердого раствора
размеров кристаллитов, проведенный по формуле
CeO2-ZrO2 составляет 63 м2·г-1, общая пористость —
Селякова-Шеррера, показал, что размер кристал-
0.101 см3·г-1. При введении ионов Nd3+, Sm3+, Gd3+ и
литов синтезированных материалов составляет 15-
Bi3+ удельная поверхность возрастает до 82-85 м2·г-1,
19 нм.
а пористость остается практически неизменной —
Исследования, проведенные методом просвечи-
0.106-0.108 см3·г-1.
вающей электронной микроскопии, подтверждают
Синтезированные материалы проявляют высо-
вышесказанное. Для синтезированных материалов
кую активность в реакции окисления монооксида
характерна агломерированная структура мозаично-
углерода.
Рис. 2. ПЭМ-снимок образцов Zr0.2Ce0.8O2 (а), Gd0.05Bi0.05Zr0.18Ce0.72O2 (б).
Каталитическая активность высокодисперсных твердых растворов...
625
Рис. 4. Зависимость конверсии СО от температуры ре-
акции на образцах Zr0.2Ce0.8O2 (1), Gd0.1Zr0.18Ce0.72O2
Рис. 3. Изотермы адсорбции-десорбции синтезирован-
(2), Gd0.05Bi0.05Zr0.18Ce0.72O2 (3).
ных материалов.
1 — Zr0.2Ce0.8O2, 2 — Gd0.1Zr0.18Ce0.72O2, 3 —
Nd0.05Bi0.05Zr0.18Ce0.72O2, 4 — Gd0.05Bi0.05Zr0.18Ce0.72O2
вании влияния природы допанта на каталитические
свойства M0.1Zr0.18Ce0.72O2, где М — редкоземельный
Результаты проведенных экспериментов сви-
элемент ряда Pr-Lu.
детельствуют о положительном влиянии допи-
Также к увеличению каталитической активности
рования на каталитическую активность образцов
приводит применение в качестве допирующей добав-
(рис. 4). Так, температура 50%-ного окисления твер-
ки смеси ионов Gd3+ и Bi3+ при мольном соотноше-
дого раствора Zr0.2Ce0.8O2 составляет 328°С, а для
нии 1:1. В данном случае температура 50%-ного окис-
Gd0.1Zr0.18Ce0.72O2 — 272°С (рис. 3, кривые 1, 2).
ления образца Gd0.05Bi0.05Zr0.18Ce0.72O2 значительно
Наблюдаемое повышение каталитической активно-
ниже и составляет 160°С по сравнению с аналогич-
сти, по-видимому, обусловлено следующими фак-
ным параметром для Gd0.1Zr0.18Ce0.72O2 (рис. 4, кри-
торами. При допировании Zr0.2Ce0.8O2 ионом Gd3+,
вая 3). По-видимому, рост каталитической активности
имеющим более низкий заряд, происходит образо-
обусловлен увеличением разупорядоченности кри-
вание анионных вакансий и Се3+, что способствует
сталлической решетки вследствие значительного раз-
повышению каталитической активности. Также свой
личия ионных радиусов Gd3+ (94 пм) и Bi3+ (102 пм),
вклад вносит и усиление искажений кристаллической
также за счет протекающего редокс-превращения:
решетки, возникающих при допировании ионами
Bi3+
Bi5+, что в свою очередь положительным об-
Gd3+, имеющими значительно больший ионный ради-
разом сказывается на каталитической активности [10].
ус по сравнению с ионами Ce4+ и Zr4+. Аналогичный
Исследование влияния природы редкоземельного
эффект был отмечен авторами [8-10] при исследо- допанта на каталитические свойства синтезирован-
Таблица 2
Текстурные характеристики и каталитическая активность синтезированных образцов
Удельная
Температура
Температура
Общая пористость
Образец
поверхность
50%-ной конверсии
90%-ной конверсии
VΣ, см3·г-1
Sуд, м2·г-1
Т50, °С
Т90, °С
Zr0.2Сe0.8O2
63
0.101
295
362
Gd0.10Zr0.18Ce0.72O2
78
0.106
272
326
Gd0.05Bi0.05Zr0.18Ce0.72O2
85
0.107
152
182
Sm0.05Bi0.05Zr0.18Ce0.72O2
83
0.108
256
343
Nd0.05Bi0.05Zr0.18Ce0.72O2
82
0.108
327
385
626
Либерман Е. Ю. и др.
Выводы
Синтезированы высокодисперсные твердые рас-
творы M2O3-Bi2O3-ZrO2-CeO2, где M — Nd, Sm,
Gd, на основе кристаллической решетки диоксида
церия, что подтверждено исследованиями, проведен-
ными методом рентгеновской дифракции. Средний
размер кристаллитов, рассчитанный по уравнению
Селякова-Шеррера, составляет 15-19 нм. Согласно
электронно-микроскопическим исследованиям образ-
цы имеют агломерированную структуру мозаичного
типа. Частицы имеют форму, близкую к сферической.
Средний размер составляет 8-10 нм.
Синтезированные материалы M2O3-Bi2O3-ZrO2-
CeO2, где M — Nd, Sm, Gd, обладают высокой удель-
Рис. 5. Зависимость конверсии СО от температуры
реакции на образцах Nd0.05Bi0.05Zr0.18Ce0.72O2 (1),
ной поверхностью (82-85 м2·г-1) и развитой пори-
Sm0.05Bi0.05Zr0.18Ce0.72O2 (2), Gd0.05Bi0.05Zr0.18Ce0.72O2
стой структурой (0.106-0.108 см3·г-1). Показано, что
(3).
допирование твердого раствора Zr0.2Ce0.8O2 ионами
редкоземельных металлов и Bi3+ приводит к увеличе-
нию удельной поверхности вследствие формирования
более дефектной структуры.
Синтезированные материалы проявляют высокую
активность в реакции окисления моноксида углерода.
Допирование твердого раствора Zr0.2Ce0.8O2 ионами
Bi3+, Nd3+, Sm3+ и Gd3+ приводит к увеличению ка-
талитической активности вследствие повышения де-
фектности кристаллической структуры. Установлена
зависимость каталитической активности материалов
M0.05Bi0.05Zr0.18Ce0.72O2, где M — Nd, Sm, Gd, от при-
роды иона редкоземельного металла. Показано, что
наибольшая каталитическая активность характерна
для образца Gd0.05Bi0.05Zr0.18Ce0.72O2, что, вероятно,
Рис. 6. Зависимость температуры 50%-ной конверсии от
является следствием формирования высокодефектной
радиуса иона-допанта для многокомпонентного твердо-
структуры.
го раствора М0.05Bi0.05Zr0.18Ce0.72O2, где M — Nd, Sm,
Gd.
Конфликт интересов
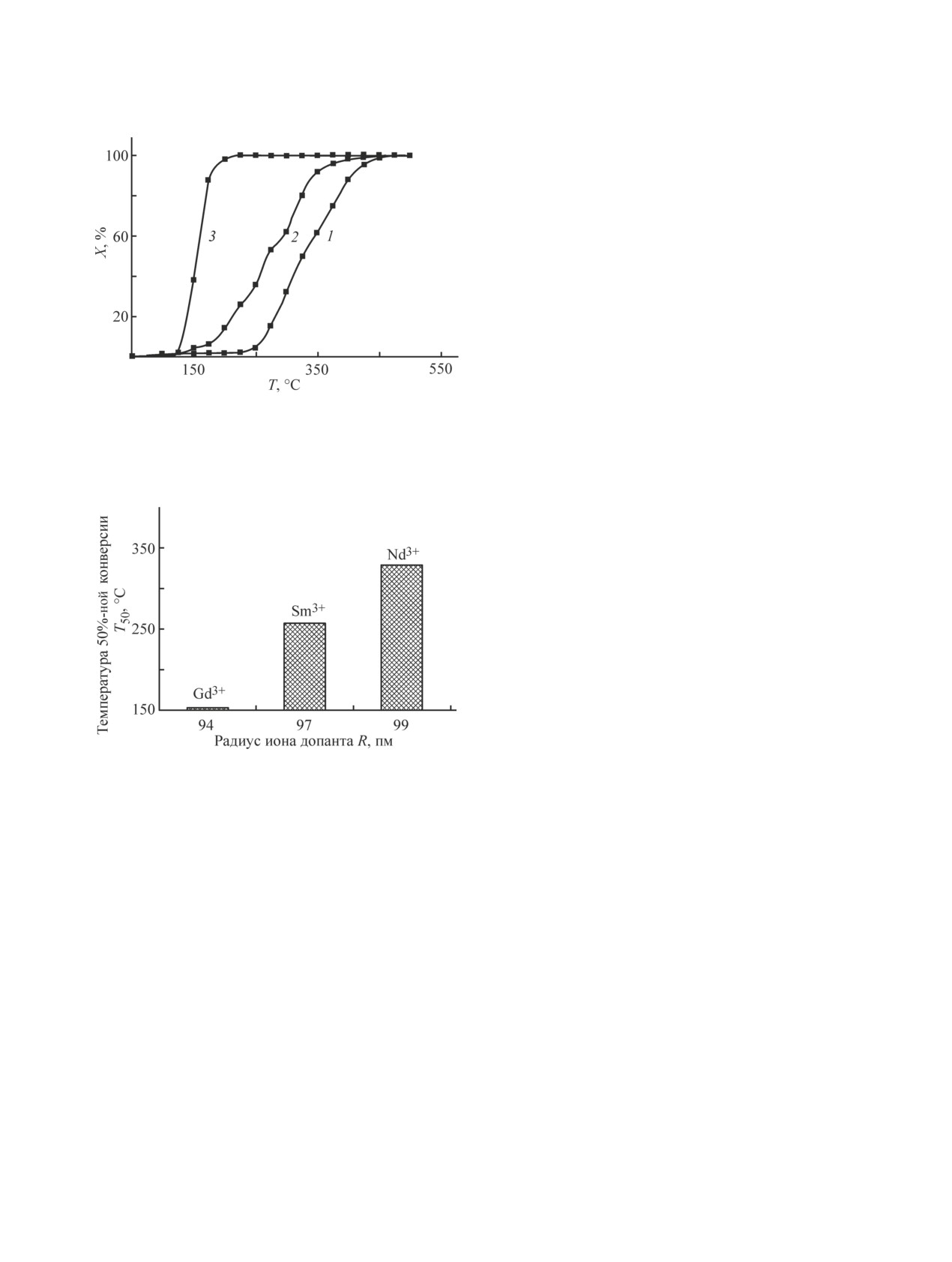
ных материалов M0.05Bi0.05Zr0.18Ce0.72O2, где M —
Авторы заявляют об отсутствии конфликта инте-
Nd, Sm, Gd, показало, что наиболее активным явля-
ресов, требующего раскрытия в данной статье.
ется образец, допированный ионами Gd3+ (рис. 5).
Температура 50%-ной конверсии составляет 150°С,
в то время как для Nd0.05Bi0.05Zr0.18Ce0.72O2 темпера-
Информация об авторах
тура 50%-ной конверсии значительно выше (332°С).
По-видимому, в данном случае наблюдается корреля-
Либерман Елена Юрьевна, к.х.н., доцент, ORCID:
ция между ионным радиусом допанта и температурой
50% конверсии, т. е. чем меньше радиус иона до-
Подъельникова Екатерина Сергеевна, магистрант
панта, тем выше каталитическая активность (рис. 6).
Вероятно, что в случае совместного допирования
Симакина Екатерина Александровна, аспирант
ионами Bi3+ и Gd3+ происходит формирование наи-
более дефектной структуры, которая в свою очередь
Конькова Татьяна Владимировна, д.т.н., доцент,
способствует снижению энергетического барьера
десорбции кислорода и как следствие повышению
Клеусов Борис Сергеевич, научный сотрудник,
каталитической активности.
Каталитическая активность высокодисперсных твердых растворов...
627
Список литературы
[Ostroushko A. A., Russkikh O. V., Porsin A. V., Piv-
chenko S. V. // Russ. J. Appl. Chem. 2011. V. 84. N 3.
[1] Попова Н. М. Катализаторы очистки газовых выбро-
P. 372-376].
сов промышленных производств. Алма-Ата: Наука
[6] Zagainov I. V., Fedorov S. V., Konovalov A. A., Anto-
КазССР, 1991. 176 с.
nova O. S. // Mater. Lett. 2017. V. 203. P. 9-12.
[2] Остроушко А. А. Технология изготовления катали-
[7] Lei C., Changiun N., Zhongshan Y. , Shudong W. //
заторов. Термокаталитическая очистка отходящих
Catal. Commun. 2009. N 10. P. 1192-1195.
газов в промышленности, энергетике, на транспор-
[8] Кузнецова Т. Г., Садыков В. А. // Кинетика и ката-
те. Екатеринбург: УрГУ, 2002. 26 с.
лиз. 2008. Т. 49. № 6. С. 886-905 [Kuznetsova T. G.,
[3] Крылов О. В., Миначев Х. М., Панчишный В. И. //
Sadykov V. A. // Kinet. Catal. 2008. V. 49. N 6. P. 840-
Успехи химии. 1991. Т. 60. Вып. 3. С. 634-648.
858].
[4] Иванов В. К., Щербаков А. Б., Баранчиков А. Е.,
[9] Малютин А. В., Либерман Е. Ю., Михайличен-
Козик В. В. Нанокристаллический диоксид церия:
ко А. И., Аветисов И. Х., Кошкин А. Г., Конько-
свойства, получение, применение. Томск: Том. ун-т.
ва Т. В. // Катализ в пром-сти. 2013. № 3. С. 54-59.
2013. 284 с.
[10] Zagainov I. V. // Appl. Nanosci. 2017. V. 2017. N 8.
[5] Остроушко А. А., Русских О В., Порсин А. В., Пив-
P. 871-874.
ченко С. В. // ЖПХ. 2011. Т. 84. № 3. С. 380-384