Осаждение нанокристаллического сульфида серебра из водных растворов со стабилизатором
837
Журнал прикладной химии. 2019. Т. 92. Вып. 7
УДК 546.654
ОСАЖДЕНИЕ НАНОКРИСТАЛЛИЧЕСКОГО СУЛЬФИДА СЕРЕБРА
ИЗ ВОДНЫХ РАСТВОРОВ СО СТАБИЛИЗАТОРОМ
© С. И. Садовников, А. А. Ремпель
Институт химии твердого тела УрО РАН, Екатеринбург
E-mail: sadovnikov@ihim.uran.ru
Поступила в Редакцию 8 мая 2018 г.
После доработки 1 апреля 2019 г.
Принята к публикации 25 мая 2019 г.
Химическим осаждением из водных растворов нитрата серебра и сульфида натрия в присутствии ци-
трата натрия как стабилизатора синтезированы порошки и коллоидные растворы сульфида серебра
Ag2S. Методами рентгеновской дифракции, динамического рассеяния света и низкотемпературной
адсорбции азота оценены размеры частиц сульфида серебра в осажденных порошках и коллоидных
растворах. Изменение соотношения концентраций реагентов в реакционных смесях позволило полу-
чить нанопорошки Ag2S со средним размером частиц в интервале ~1000÷40-50 нм. Размер наночастиц
Ag2S в полученных коллоидных растворах составляет 15-20 нм. Рассмотрено соотношение между
размером частиц сульфида серебра и пересыщением растворов, использованных для синтеза.
Ключевые слова: осаждение; сульфид серебра; пересыщенные водные растворы; размер наночастиц
DOI: 10.1134/S004446181907003X
Нанокристаллический сульфид серебра Ag2S яв-
Нанокристаллический сульфид серебра, включая
ляется одним из наиболее востребованных полупро-
нанопорошки и квантовые точки, получают разными
водниковых нанокристаллических сульфидов [1-3]
химическими и физическими методами. Согласно
наряду с сульфидами цинка, кадмия, меди, свинца и
[11], для получения наноструктурированных халько-
ртути [4-7]. Перспективность нанокристаллических
генидов наиболее применимы методы синтеза типа
сульфидов обусловлена их уникальными функцио-
«снизу вверх» (bottom-up), среди которых как эффек-
нальными физическими и химическими свойствами
тивный способ получения нанокристаллов с хорошо
(полупроводниковая или ионная проводимость, меха-
контролируемым размером и малой размерной дис-
ническая и термическая стабильность), которые мож-
персией рассматривается химическое осаждение из
но регулировать, изменяя размер наночастиц (зерен,
пересыщенных водных растворов [12-14].
кристаллитов).
Целью настоящей работы являлось определение
Крупнокристаллический сульфид серебра с разме-
параметров гидрохимического синтеза сульфида се-
ром частиц более 500 нм является полупроводником,
ребра в виде нанокристаллических порошков и кол-
чья ширина Eg запрещенной зоны при температуре
лоидных растворов наночастиц и сопоставление раз-
300 K равна ~0.88-0.90 эВ [8, 9]. Сульфид серебра
меров наночастиц сульфида серебра с пересыщением
Ag2S имеет в достаточно близких температурных
реакционных смесей, использованных для синтеза.
интервалах три полиморфные модификации: низ-
котемпературная полупроводниковая моноклинная
Экспериментальная часть
фаза акантит α-Ag2S, существующая при температуре
ниже ~450 K, суперионная объемноцентрированная
Порошки и коллоидные растворы сульфида се-
кубическая фаза аргентит β-Ag2S, равновесная в тем-
ребра Ag2S синтезировали при температуре 298 K в
пературном интервале 452-859 K, и высокотемпера-
темноте химическим осаждением из водных раство-
турная гранецентрированная кубическая фаза γ-Ag2S,
ров нитрата серебра AgNO3, сульфида натрия Na2S и
стабильная от ~860 K до температуры плавления [10].
цитрата натрия Na3C6H5O7 (Na3Cit). Цитрат натрия
838
Садовников С. И., Ремпель А. А.
при синтезе играет роль стабилизатора. Поскольку
пользовали реакционные смеси с небольшим относи-
в водных растворах с малым содержанием ионов
тельным избытком сульфида натрия Na2S. Осаждение
S2- цитрат натрия может восстанавливать ионы Ag+
нанокристаллического сульфида серебра происходит
с образованием наночастиц металлического серебра,
в нейтральной среде при pH ≈ 7 по следующей реак-
для осаждения сульфида серебра без примеси Ag ис-
ционной схеме:
2AgNO3 + (1+ δ)Na2S Na3C6H5O7 Ag2S↓ + 2NaNO3,
(1)
в которой концентрации ионов сульфида S2- и сере-
сначала чернеет, затем в течение 1 ч частицы Ag2S
бра Ag+ связаны соотношением cS2- = (1 + δ)cAg+/2,
оседают, и раствор становится прозрачным. Для пол-
где 0.01 ≥ δ ≥ 0.5 — небольшой избыток Na2S, необ-
ного прохождения реакции сульфидизации получен-
ходимый для синтеза коллоидных растворов и нано-
ный осадок в течение 1 сут находился в растворе.
порошков без примеси Ag.
Осажденный порошок Ag2S промывали дистилли-
Для синтеза использовали предварительно приго-
рованной водой, фильтровали и сушили на воздухе
товленные водные растворы AgNO3, Na2S и Na3Cit.
при 323 K.
Синтез проводили в следующей последовательно-
Порошки Ag2S с размером частиц от ~60 нм и
сти: к 50 мл раствора нитрата серебра приливали
менее синтезировали из реакционных смесей с кон-
50 мл раствора цитрата натрия (стабилизатора), за-
центрациями нитрата серебра и сульфида натрия
тем полученный раствор в течение 1-2 с смешивали
50 и 25 ммоль·л-1 соответственно (см. таблицу).
со 100 мл раствора Na2S. При сливании реагентов
Концентрация цитрата натрия Na3Cit в разных реак-
образование сульфида серебра происходит практиче-
ционных смесях составляла от 5 до 100 ммоль·л-1.
ски мгновенно, в результате чего реакционная смесь
С ростом концентрации цитрата натрия время синтеза
Состав реакционных смесей, удельная поверхность Ssp порошков, средний размер D частиц сульфида
серебра в порошках и коллоидных растворах
Концентрация реагентов
D, нм, в осажденных
D, нм,
в реакционной смеси, ммоль·л-1
порошках
Вид сульфида
№
Ssp,
в коллоидных
серебра
смеси
м2·г-1
растворах,
AgNO3
Na2S
Na3Cit
БЭТ
рентген
ДРС
Крупнокристал-
1
50
200
0
0.82 ± 0.02
1008
—
—
лический
2
50
500
5
1.6 ± 0.1
515
—
—
порошок
3
50
100
25
1.9 ± 0.1
430
—
—
4
50
50
100
5.1 ± 0.1
163
85 ± 7
—
Наночастицы
5
50
25.5
12.5
14.9 ± 0.2
56 ± 5
46 ± 8
55 ± 10
6
50
25.4
25
19.0 ± 0.2
44 ± 5
43 ± 6
60 ± 10
7
50
25.1
100
15.6 ± 0.2
53 ± 5
49 ± 8
66 ± 10
Квантовые точки
8
0.3125
0.165
5
—
Стабильный коллоид
2.3 ± 1
9
0.3125
0.168
2.5
—
»
»
2.7 ± 1
10
0.3125
0.170
1
—
»
»
3.1 ± 1
11
0.625
0.313
5
—
»
»
4.2 ± 2
12
0.625
0.325
3.75
—
»
»
5.6 ± 2
13
2.5
1.30
1
—
»
»
8.0 ± 2
14
1.25
0.635
1.25
—
»
»
8.2 ± 2
15
0.625
0.330
2.5
—
»
»
9.2 ± 2
16
0.625
0.335
1.25
—
»
»
10.0 ± 2
17
2.5
1.35
2.5
—
»
»
15.0 ± 3
18
0.625
0.350
15
—
»
»
16.0 ± 4
19
1.25
0.630
7.5
—
—
—
17.0 ± 5
Осаждение нанокристаллического сульфида серебра из водных растворов со стабилизатором
839
сульфида серебра увеличивается, а размер частиц
по величине Ssp оценивали средний размер частиц
уменьшается. Для уменьшения агломерации наноча-
D = 6/ρSsp (ρ = 7.25 г·см-3 — плотность сульфида
стиц водные растворы в течение 30 мин подвергали
серебра).
воздействию ультразвука в ванне Reltec ultrasonic
Размер (гидродинамический диаметр DДРС) нано-
bath USB-1/100-TH.
частиц Ag2S непосредственно в коллоидных раство-
Осадить нанокристаллический порошок сульфида
рах определяли методом динамического рассеяния
серебра с размером частиц меньше 20 нм при исполь-
света (ДРС) на приборе Zetasizer Nano ZS (Malvern
зовании Na3Cit не удалось, так как наночастицы раз-
Instruments Ltd) при температуре 298 K. Длина волны
мером f20 нм образуют стабильный коллоидный рас-
He-Ne-лазера составляла 633 нм, угол детектирова-
твор и не оседают в нем на протяжении 3 лет и более.
ния обратно рассеянного света равен 173°. Для вос-
Стабильные коллоидные растворы сульфида сере-
производимости результатов рассеяние света и размер
бра были получены из реакционных смесей № 8-19 с
частиц в каждом растворе измеряли не менее 3 раз.
концентрациями нитрата серебра сAgNO3 от 0.3125 до
2.5 ммоль·л-1 (см. таблицу).
Обсуждение результатов
Осажденные порошки исследовали методом рент-
геновской дифракции на дифрактометре Shimadzu
Рентгенограммы синтезированных порошков
XRD-7000 в CuKα1,2-излучении. Рентгеновские из-
сульфида серебра Ag2S, осажденных из реакцион-
мерения проводили в интервале углов 2θ = 20-95°
ных смесей № 2, 5, 6 и 7 (см. таблицу), показаны на
с шагом Δ(2θ) = 0.02° и временем сканирования
рис. 1.
10 с в каждой точке. Определение параметров кри-
Pазмер D частиц крупнокристаллического порошка
сталлической решетки и окончательное уточнение
№ 2 был определен по измеренной величине его удель-
структуры синтезированных порошков сульфида се-
ной поверхности Ssp, равной ~1.61 м2·г-1. Для уточне-
ребра проводили с помощью программного пакета
ния кристаллической структуры крупнокристалличе-
X′Pert HighScore Plus. Version 2.2e (2.2.5) (PANalytical
ского порошка была использована рентгенограмма 2
B. V. Almedo).
(рис. 1). Проведенный количественный анализ и срав-
Микроструктуру, размер частиц и элементный
нение с данными [17] показали, что наблюдаемый
химический состав порошков Ag2S изучали методом
набор дифракционных отражений соответствует од-
сканирующей электронной микроскопии (СЭМ) на
нофазному стехиометрическому сульфиду серебра с
микроскопе JEOL-JSM LA 6390 с энергодисперсион-
моноклинной (пр. гр. P21/c) структурой типа акантита
ным рентгеновским анализатором JED 2300 Energy
α-Ag2S: фактор сходимости Ритвелда RI (RB) = 0.0247.
Dispersive X-ray Analyzer и методом просвечиваю-
Согласно результатам энергодисперсионного рентге-
щей электронной микроскопии (ПЭМ) на микро-
новского анализа после промывки в дистиллирован-
скопе JEOL JEM-2010. Средний размер D частиц
ной воде и вакуумной сушки содержание серебра Ag и
[средний размер областей когерентного рассеяния
серы S в синтезированном высушенном порошке суль-
(ОКР)] в синтезированных порошках сульфида се-
фида серебра со средним размером частиц ~500 нм
ребра определяли рентгенодифракционным мето-
составляет 86.8 ± 0.4 и 12.9 ± 0.1 мас%, что соответ-
дом по уширению дифракционных отражений,
ствует сульфиду стехиометрического состава Ag2S.
используя зависимость приведенного уширения от-
Рентгенограммы нанопорошков сульфида серебра
ражений β*(2θ) = [β(2θ)cosθ]/λ от вектора рассеяния
с разным средним размером частиц, осажденных
s = (2sinθ)/λ [15, 16]. Величину уширения β(2θ) опре-
из реакционных смесей № 5-7, показаны на рис. 1.
деляли путем сопоставления экспериментальной ши-
Количественное уточнение рентгенограмм нанопо-
рины FWHMexp каждого дифракционного отражения
рошков проводили с учетом варьирования заполнения
с инструментальной функцией разрешения FWHMR
кристаллографических позиций атомами серебра и
дифрактометра.
серы, что позволило заметно повысить сходимость.
Удельную поверхность Ssp синтезированных
Уточнение структуры нанопорошков сульфида се-
порошков сульфида серебра после вакуумного от-
ребра и сравнение с данными [18] показали, что на-
жига находили по изотермам адсорбции паров мо-
блюдаемый набор дифракционных отражений со-
лекулярного азота при температуре 77 K [методом
ответствует моноклинному (пр. гр. P21/c) сульфиду
Брунауэра-Эммета-Теллера (БЭТ)]. Измерения про-
серебра, причем координаты атомов Ag и S и пара-
водили на анализаторе удельной поверхности Gemini
метры элементарной ячейки нанопорошков близки к
VII 2390t Surface Area Analyzer. В приближении оди-
таковым для крупнокристаллического сульфида Ag2S.
накового размера и шарообразной формы всех частиц
Однако степени заполнения кристаллографических
840
Садовников С. И., Ремпель А. А.
Рис. 1. Рентгенограммы порошков сульфида серебра, осажденных из реакционных смесей № 2, 5, 6 и 7 (см. таблицу).
Крупнокристаллический порошок № 2 со средним размером частиц ~500 нм имеет стехиометрический состав Ag2S.
Нанопорошки 5-7 со средним размером частиц менее 50 нм являются нестехиометрическими и имеют состав ~Ag1.93S.
Все порошки имеют моноклинную (пр. гр. P21/c) структуру типа акантита.
Рентгенограммы записана в излучении CuKα1,2.
позиций 4(e) атомами серебра Ag1 и Ag2 в нанопо-
торы сходимости Ритвелда, равные RI (RB) = 0.0555,
рошках оказались несколько меньше 1. В частности,
Rp = 0.1165, ωRp = 0.1431. Количественное уточнение
для нанопорошка № 6 степени заполнения позиций
рентгенограмм нанопорошков с учетом варьирования
4(e) атомами серебра Ag1 и Ag2 равны ~0.97 и ~0.96
заполнения кристаллографических позиций атома-
соответственно. Это означает, что наночастицы суль-
ми Ag и S показало, что нанопорошки являются не-
фида серебра размером менее ~50-60 нм являются
стехиометрическими и имеют составы от Ag1.93 до
нестехиометрическими, имеют состав ~Ag1.93S и
Ag1.97S. Дифракционные отражения нанопорошков
содержат вакантные узлы в металлической подре-
уширены и вследствие этого отражения, близкие по
шетке. При этом были достигнуты улучшенные фак-
положению, перекрываются. На вставках к рентге-
Осаждение нанокристаллического сульфида серебра из водных растворов со стабилизатором
841
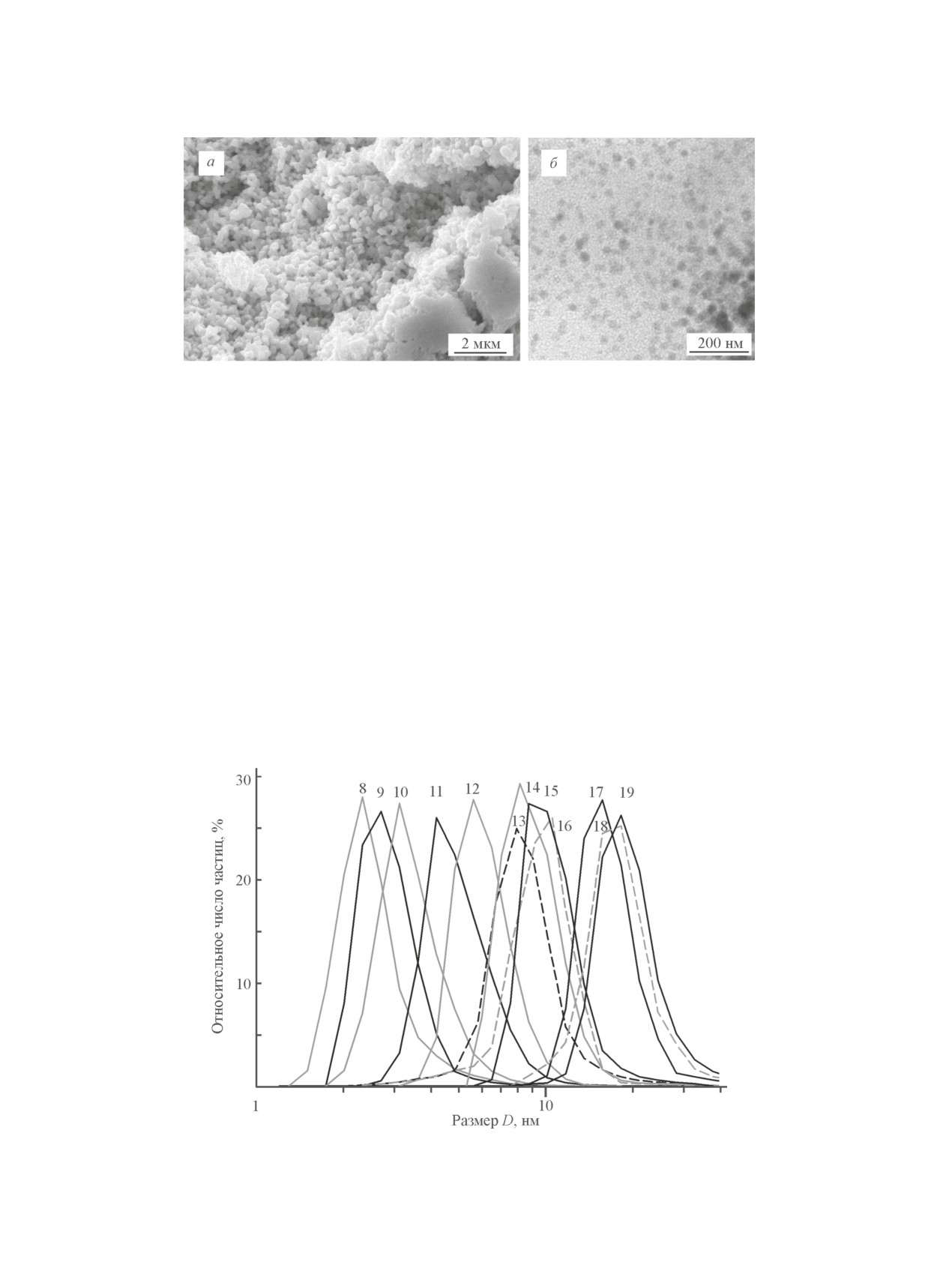
Рис. 2. СЭМ-изображение крупнокристаллического порошка № 2 (а) и ПЭМ-изображение нанопорошка № 5
сульфида серебра (б).
нограммам нанопорошков Ag2S показаны оценки
рис. 2 показаны СЭМ-изображение крупнокристалли-
среднего размера D областей когерентного рассеяния
ческого порошка № 2 и ПЭМ-изображение нанопо-
по уширению неперекрывающихся дифракционных
рошка № 5. Размер частиц в крупнокристаллическом
отражений (-102), (110), (-113), (-104), (031) и (014).
порошке № 2 составляет 400-500 нм, в нанопорошке
Согласно этим оценкам в изученных нанопорошках
№ 5 — от 40 до 60 нм.
Ag2S средний размер D составляет 46 ± 8, 43 ± 6 и
По данным ДРС размер наночастиц Ag2S в кол-
49 ± 8 нм. Размер наночастиц сульфида серебра, най-
лоидных растворах № 8-19 не превышает 20 нм (см.
денный по уширению дифракционных отражений,
таблицу), поэтому их можно рассматривать как кван-
хорошо согласуется с размером частиц, оцененным
товые точки, т. е. частицы, на полупроводниковых
методом БЭТ (см. таблицу).
свойствах которых благодаря малому размеру наблю-
Электронно-микроскопическое изучение синтези-
даются квантовые размерные эффекты. Размерные
рованных порошков сульфида серебра подтвердило
распределения частиц для коллоидных растворов с
величины среднего размера частиц, найденных мето-
№ 8 по 19 с разным средним размером квантовых
дами рентгеновской дифракции и БЭТ. Как пример на
точек сульфида серебра показаны на рис. 3.
Рис. 3. Размерные распределения частиц, измеренные динамическим рассеянием света в коллоидных растворах
№ 8-19 (см. таблицу) с разным средним размером квантовых точек Ag2S.
842
Садовников С. И., Ремпель А. А.
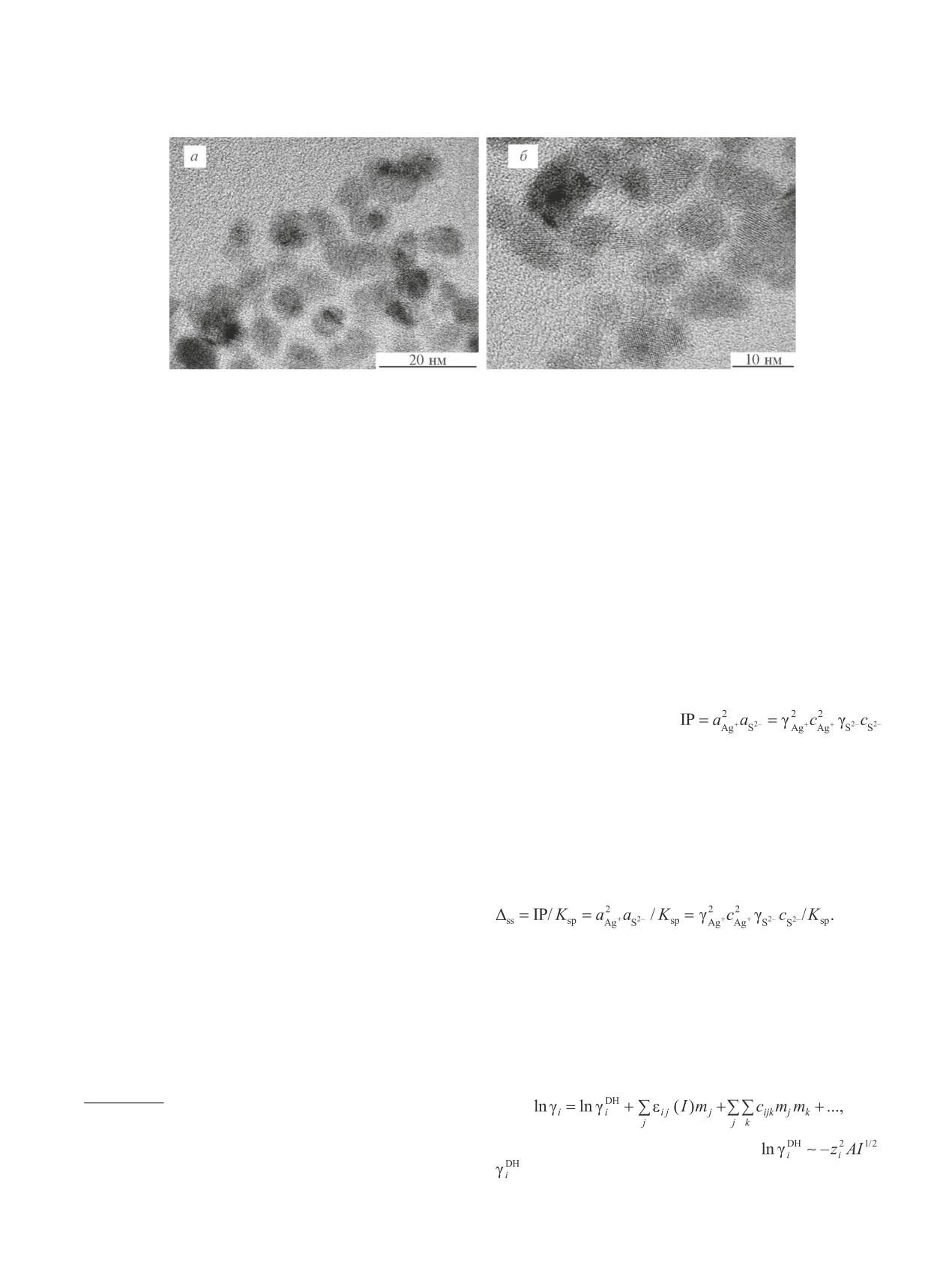
Рис. 4. ПЭМ-изображения частиц в коллоидных растворах № 17 и 13 (см. таблицу).
ПЭМ-изображения коллоидных растворов № 13 и
ионов серебра ~5.0·10-17 моль·л-1. Произведение рас-
17, показанные как пример на рис. 4, подтверждают
творимости Ag2S в ~1023-28 раз меньше, чем произве-
результаты ДРС-измерений размера наночастиц.
дения растворимости сульфидов кадмия, свинца или
Синтезированные коллоидные растворы на про-
цинка, равные 7.9·10-27, 2.5·10-27 и 2.5·10-22, для ко-
свет (в прямом проходящем свете) имеют светло-ко-
торых концентрации ионов металлов тоже очень ма-
ричневую окраску и являются полностью прозрач-
лы, но немного больше концентрации ионов серебра
ными, но со стороны выглядят полупрозрачными и
и соответствуют ~8.89·10-14, ~5.0·10-14 и 1.58·10-11
голубоватыми. Опалесценция растворов свидетель-
моль·л-1. Ясно, что растворимости указанных суль-
ствует о заметных флуктуациях их плотности, на ко-
фидов крайне малы и их водные растворы являются
торых происходит рассеяние света. Сами флуктуации
пересыщенными. Осаждение Ag2S при такой ничтож-
обусловлены присутствием в растворах наночастиц
ной растворимости и достаточном содержании Na2S
размером менее 20 нм.
в реакционной смеси происходит почти мгновенно,
Показателем стабильности коллоидных си-
за доли секунды.
стем является ζ-потенциал наночастиц в растворе.
Образование сульфида серебра возможно, если
Абсолютные значения ±(35 ± 15) мВ ζ-потенциала
его ионное произведение
служат признаком электростатической стабильности
больше произведения растворимости Ksp. Поскольку
коллоидных растворов. Частицы с большим отрица-
произведение растворимости Ksp сульфида серебра
тельным или положительным поверхностным элек-
очень мало, реакционные смеси, использованные для
трическим зарядом рассматриваются как устойчивые.
получения порошков и квантовых точек сульфида
Измерения методом ДРС показали, что через три
серебра, являются пересыщенными. Количественно
дня после синтеза растворов № 8-19 их ζ-потенциал
величина пересыщения, характеризующая превы-
составлял от -45 до -28 мВ, а размер наночастиц
шение ионного произведения соединения над его
был равен 2-13 нм. ζ-Потенциал и размер наноча-
произведением растворимости, равна
стиц Ag2S, измеренные через 100 сут после синтеза
(2)
коллоидных растворов, почти не изменились. Малое
изменение ζ-потенциала при длительном хранении
В общем случае, когда ионная сила I раствора
коллоидных растворов и большая отрицательная ве-
больше нуля (I > 0), при расчете ионного произведе-
личина ζ-потенциала растворов № 8-19 подтвержда-
ния нужно учитывать коэффициенты активности γi
ют их стабильность.
соответствующих ионов. В работе [19], являющейся
Произведение растворимости Ksp сульфида се-
наиболее развитой моделью учета взаимодействия
ребра Ag2S очень мало (при температуре 298 K
ионов, коэффициенты активности γi представляют в
Ksp = 6.3·10-50),* что соответствует концентрации
виде разложения
(3)
* Лурье Ю. Ю. Справочник по аналитической хи-
мии. М.: Химия, 1967. С. 63; Patnaik P. Dean′s Analytical
где m — моляльная концентрация;
,
Chemistry Handbook. New York: McGraw-Hill, 2004. Table
4.2.
— коэффициент активности, полученный по урав-
Осаждение нанокристаллического сульфида серебра из водных растворов со стабилизатором
843
нению Дебая-Хюккеля, zi — заряд иона, A — const;
Активность, или долю незакомплексованных ио-
εij(I) и cijk — коэффициенты разложения, первый из
нов серебра, способных вступать в реакцию с иона-
которых зависит, а второй не зависит от ионной силы
ми серы, можно оценить, если известны константы
раствора.
нестойкости разных комплексных форм серебра.
Однако в литературе для большинства ионов ко-
В литературе нет сведений об образовании серебром
эффициенты εij(I) и cijk отсутствуют, и использовать
комплексов с цитратом, однако серебро образует мо-
теоретическое выражение (3) для оценки коэффици-
но-, ди- и тригидроксокомплексы Ag(OH),
ентов активности не удается.
и
, имеющие следующие константы нестой-
кости K (pK = -lgK):
(pK11 = 2.3, pK12 = 4.0, pK13 = 5.2).* Наличие гидрок-
концентрация всех растворимых форм серебра, т. е.
сокомплексов снижает концентрацию свободных
свободных ионов металла и его гидроксокомплексов,
ионов Ag+, участвующих в образовании сульфида
то с учетом констант нестойкости
серебра. Если концентрация cAg,Σ есть суммарная
(4)
В соответствии с (4) зависимость долевой концентрации α свободных ионов Ag+ от pH раствора можно
найти как
(5)
c
Поскольку в нейтральной среде [OH-] = [H+] = 10-7, из (5) следует, что концентрация [Ag+] ионов Ag+,
участвующих в образовании Ag2S, равна
(6)
Осаждение нанокристаллического сульфида сере-
ных равновесий в системе S2- - H2O,** рассчитанной
бра происходит в нейтральной среде при pH ≈ 7, поэ-
по методике, предложенной авторами [20], в области
тому из (6) получим, что концентрация [Ag+] = cAg+ ≈
pH ≈ 7 долевая концентрация cS2- ионов S2- состав-
≈ cAg,Σ. Таким образом, наличие гидроксокомплексов
ляет около 0.01 от cS,Σ.
пренебрежимо мало снижает концентрацию свобод-
Как отмечено, серебро не образует комплексов с
ных ионов Ag+, участвующих в образовании сульфи-
цитратом, поэтому в данной работе в уравнении (2)
да серебра.
для перехода от концентраций cAg+ и cS2- к актив-
Ионы серы могут существовать в водных раство-
ностям свободных ионов Ag+ и S2- использовали
рах в форме S2-, HS- и H2S. Согласно диаграмме ион- справочные значения коэффициентов активности.
Коэффициенты активности зависят от ионной силы I
растворов. В разбавленных растворах, каковыми яв-
* Stability constants of metal-ion complexes / Eds E. Hög-
ляются использованные реакционные смеси, коэффи-
feldt, D. D. Perrin. Oxford; New York: Int. Union Pure Appl.
циенты активности близки к единице. В реакционных
Chem., 1983. P. 145; Critical Stability Constants / Eds R. M.
Smith, A. E. Martell. Heidelberg; Berlin: Springer, 1989.
P. 362.
844
Садовников С. И., Ремпель А. А.
Рис. 5. Соотношение между пересыщением Δss исходных реакционных смесей и размером частиц сульфида серебра
в коллоидных растворах (а) и порошках (б).
Пересыщение Δss представлено в логарифмических координатах lgΔss.
смесях (cм. таблицу), использованных для синтеза
9 и 10. Таким образом, при прочих равных условиях
сульфида серебра, присутствуют ионы Ag+, S2-, Na+,
в области концентраций сNa3Cit f 5 ммоль·л-1 увели-
и
. Ионная сила использованных рас-
чение концентрации цитрата натрия в реакционной
смеси способствует синтезу меньших по размеру
творов, приближенно оцененная как
, где
частиц сульфида серебра.
ci — концентрация соответствующего иона, слабо
изменяется от 0.03 до 0.12 и в среднем составляет
~0.1. При такой ионной силе значения коэффициен-
Выводы
тов активности составляют γAg+ = 0.75 и γS2- = 0.38.*
Методом гидрохимического осаждения из водных
Величины пересыщения Δss, рассчитанные по (2)
растворов нитрата серебра, сульфида натрия и ци-
с учетом cAg+ ≈ cAg,Σ, cS2- ≈ 0.01cS,Σ и коэффициентов
трата натрия синтезированы однофазные порошки
γAg+ = 0.75, γS2- = 0.38, являются приближенными и
позволяют только качественно судить о влиянии пе-
сульфида серебра Ag2S. На основе рентгенодифрак-
ционных данных установлено, что сульфид серебра
ресыщения на размер частиц порошков и коллоидных
имеет моноклинную (пр. гр. P21/c) структуру типа
растворов сульфида серебра.
акантита α-Ag2S. Пошаговое изменение соотноше-
На рис. 5 показаны зависимости размера D частиц
ния концентраций реагентов в реакционных смесях
коллоидных растворов и порошков сульфида серебра
позволяет осаждать частицы Ag2S с заданным сред-
от пересыщения Δss (для удобства изображения пере-
ним размером частиц в интервале ~1000÷40-50 нм.
сыщение представлено в логарифмических коорди-
Крупнокристаллический сульфид серебра с размером
натах lgΔss). Видно, что увеличение размера частиц
частиц более 100 нм имеет стехиометрический со-
сульфида серебра происходит с ростом пересыщения
реакционных смесей.
став Ag2S, тогда как нанокристаллический сульфид
Влияние концентрации цитрата натрия как стаби-
серебра с размером частиц менее 60 нм является не-
стехиометрическим вследствие наличия структурных
лизатора на размер частиц сульфида серебра наиболее
вакансий в металлической подрешетке и имеет состав
отчетливо наблюдается для коллоидных растворов с
Ag1.93-1.97S.
одинаковой концентрацией AgNO3 и изменяющейся
Получены стабильные водные коллоидные раство-
концентрацией сNa3Cit. Например, в коллоидных рас-
ры квантовых точек сульфида серебра, имеющих раз-
творах № 11, 12, 15 и 16 (см. таблицу) уменьшение
мер от 2-3 до 15-20 нм. Размер частиц сульфида сере-
концентрации Na3Cit от 5 до 3.75, 2.5 и 1.25 ммоль·л-1
бра в полученных порошках и коллоидных растворах
сопровождается ростом размера квантовых точек от
связан с пересыщением исходных реакционных сме-
4.2 до 5.6, 9.2 и 10.0 нм вследствие уменьшения ста-
билизирующего эффекта цитрата натрия. Такой же
сей по содержанию ионов серебра и серы. В области
эффект наблюдается для коллоидных растворов № 8,
малых концентраций увеличение содержания цитрата
натрия в реакционной смеси стабилизирует рост на-
ночастиц и способствует синтезу меньших по размеру
* Лурье Ю. Ю. Справочник по аналитической химии.
М.: Химия, 1967. С. 104.
частиц сульфида серебра.
Осаждение нанокристаллического сульфида серебра из водных растворов со стабилизатором
845
Конфликт интересов
[8] Junod P. // Helv. Phys. Acta. 1959. V. 32. N 6-7.
P. 567-600.
Авторы заявляют об отсутствии конфликта инте-
[9] Junod P., Hediger H., Kilchör B., Wullschleger J. //
ресов, требующего раскрытия в данной статье.
Philos. Mag. 1977. V. 36. N 4. P. 941-958.
[10] Sharma R. C., Chang Y. A. // Bull. Alloy Phase
Информация об авторах
Diagrams. 1986. V. 7. N 3. P. 263-269.
[11] Schaefer H.-E. Nanoscience. The science of the
Садовников Станислав Игоревич, к.х.н., ORCID:
Small in Physics, Engineering, Chemistry, Biology
and Medicine. Heidelberg; Dordrecht; New York:
Ремпель Андрей Андреевич, д.ф.-м.н., проф.,
Springer, 2010. 772 p.
[12] Марков В. Ф., Маскаева Л. Н., Иванов П. Н. Гидро-
0543-9982
химическое осаждение пленок сульфидов метал-
лов: моделирование и эксперимент. Екатеринбург:
Список литературы
Изд-во УрО РАН, 2006. 217 с.
[1] Tang A., Wang Yu., Ye H., Zhou C., Yang C., Li X., Peng
[13] Kwon S. G., Hyeon T. // Accounts Chem. Res. 2008.
H., Zhang F., Hou Y., Teng F. // Nanotechnology. 2013.
V. 41. N 12. P. 1696-1709.
V. 24. N 35. Paper 355602. 12 p.
[14] Fedorova E. A., Bazanova E. A., Maskaeva L. N.,
[2] Sadovnikov S. I., Gusev A. I. // J. Mater. Chem. A. 2017.
Markov V. F. // Chim. Techno Acta. 2014. V. 1. N 2.
V. 5. N 34. P. 17676-17704.
P. 76-81.
[3] Садовников С. И., Гусев А. И., Ремпель А. А. // Успехи
[15] Williamson G. K., Hall W. H. // Acta Metal. 1953. V. 1.
химии. 2018. Т. 87. С. 303-327 [Sadovnikov S. I.,
N 1. P. 22-31.
Rempel A. A., Gusev A. I. // Russ. Chem. Rev. 2018.
[16] Кривоглаз М. А. Теория рассеяния рентгеновских
V. 87. N 4. P. 303-327].
лучей и тепловых нейтронов реальными кристал-
[4] Shi X., Zheng S., Gao W., Wei W., Chem M., Deng F.,
лами. М.: Наука, 1967. C. 127-129. 336 p.
Liu X., Xiao Q. // J. Nanopart. Res. 2014. V. 16. N 12.
[17] Sadovnikov S. I., Gusev A. I., Rempel A. A. // Superlatt.
Paper 2741. 9 p.
Microstr. 2015. V. 83. P. 35-47.
[5] Goel S., Chen F., Cai W. // Small. 2013. V. 10. N 4.
[18] Sadovnikov S. I., Gusev A. I., Rempel A. A. // Phys.
P. 631-645.
Chem. Chem. Phys. 2015. V. 17. N 19. P. 12466-
[6] Садовников С. И., Кожевникова Н. С., Ремпель А. А.
12471.
// ФТП. 2010. Т. 44. С. 1394-1400 [Sadovnikov S. I.,
[19] Activity Coefficients in Electrolyte Solutions. / Ed.
Kozhevnikova N. S., Rempel A. A. // Semiconductors.
K. S. Pitzer. Boca Raton: CRC Press, 1991. 552 p.
2010. V. 44. P. 1349-1356].
[20] Bhagavatula U. R., Pulipaka S., Atreyapurapu S. //
[7] Mahapatra A. K., Dash A. K. // Physica E. 2006. V. 35.
Int. Res. J. Pure Appl. Chem. 2016. V. 11. N 2. Paper
N 1. P. 9-15.
24028. 10 p.