860
Дубков К. А. и др.
Журнал прикладной химии. 2019. Т. 92. Вып. 7
УДК 544.478,547-311
ИЗОМЕРИЗАЦИЯ 1-БУТЕНА В 2-БУТЕНЫ
В ПРИСУТСТВИИ КИСЛОТНО-ОСНОВНЫХ КАТАЛИЗАТОРОВ
© К. А. Дубков, Л. В. Пирютко, А. С. Харитонов
Институт катализа им. Г. К. Борескова СО РАН, Новосибирск
E-mail: dubkov@catalysis.ru
Поступила в Редакцию 2 октября 2018 г.
После доработки 24 марта 2019 г.
Принята к публикации 22 мая 2019 г.
Исследована возможность достижения равновесия при структурной изомеризации 1-бутена на
кислотно-основных катализаторах в интервале температур 20-100°С. Эта реакция может исполь-
зоваться для увеличения выхода 2-бутена и селективности последующего превращения полученной
смеси изомеров в алкилат или метилэтилкетон. Amberlyst 15 и HZSM-5 (Si/Al = 11.5) наиболее актив-
ны, причем активность HZSM-5 растет с увеличением содержания Al. MgO и γ-Аl2О3 малоактивны.
Цеолиты HY обладают высокой начальной активностью, но быстро дезактивируются. Дезактивация
Amberlyst 15 не обнаружена.
Ключевые слова: изомеризация; 1-бутен; 2-бутен; Amberlyst 15; цеолиты; HY, HZSM-5
DOI: 10.1134/S0044461819070065
В процессе нефтепереработки от 5 до 20 мас% ис-
рых среди С8-продуктов в случае 2-бутена достигает
ходного сырья превращается в углеводородные газы.
92% [4].
Наиболее востребованными компонентами углеводо-
Перспективным направлением использования
родных газов являются олефины, содержание кото-
олефинов является их селективное окисление ок-
рых в процессах каталитического крекинга достигает
сидом азота(II) в карбонильные соединения [5-10].
80%. В частности, С4-олефины используются для
Разработка в 2009-2010 гг. процессов получения ци-
получения высокооктановых компонентов топлива
клопентанона и циклододеканона стало первым при-
(алкилатов, метил- и этил-трет-бутилового эфиров),
мером промышленного использования N2O в качестве
бутадиеновых каучуков, полиолефинов, метилэтилке-
селективного окислителя [11], что открыло широкие
тона (МЭК) и других ценных продуктов [1].
перспективы для разработки новых технологий полу-
Для обеспечения селективного превращения С4-
чения кислородсодержащих продуктов из олефинов.
олефинов обычно требуется их выделение из бу-
Окисление бутенов N2O сопровождается образо-
тан-бутеновой фракции в виде отдельных компонен-
ванием кетонов и альдегидов [12], которые исполь-
тов. На практике отработаны процессы выделения
зуются как растворители и интермедиаты для син-
1,3-бутадиена, изобутана и бутена-1. Например,
теза разнообразных химических продуктов [13, 14].
1,3-бутадиен выделяют методом экстрактивной дис-
Продукты окисления бутенов могут также найти при-
тилляции [2], а изобутен — путем экстракции серной
менение в качестве высокооктановых компонентов
кислотой или путем адсорбции на цеолитах [1].
моторных топлив [15]. Наибольший практический
В ряде случаев 2-бутен является более предпоч-
интерес, в частности, представляет получение ме-
тительным сырьем для дальнейшей переработки в
тилэтилкетона путем окисления бутенов с помощью
целевые продукты. Так, алкилирование изобутана
N2O [12, 16]. При этом более высокий выход метил-
2-бутеном в присутствии HF позволяет получать ал-
этилкетона достигается при использовании в качестве
килаты с более высокими октановыми числами по
исходного сырья 2-бутена [12].
сравнению с алкилированием 1-бутеном за счет более
Очевидно, что выход целевых продуктов как в
высокого выхода триметилпентанов [3, 4], доля кото- реакции аликилирования, так и в реакции окисления
Изомеризация 1-бутена в 2-бутены в присутствии кислотно-основных катализаторов
861
может быть увеличен путем структурной изомериза-
Тип FAU представлен цеолитами Y в Н-форме:
ции 1-бутена в 2-бутен, при использовании которого
CBV-720 (Si/Al ~ 15, Sуд = 780 м2·г-1) и CBV-500
эти продукты образуются с более высокой селектив-
(Si/Al = 2.6, Sуд = 750 м2·г-1). Цеолиты структуры
ностью. Согласно расчетным и экспериментальным
MFI (типа ZSM-5) c различным содержанием Al ис-
данным [17-19], равновесие такой изомеризации в
пользовали как в Na-, так и Н-форме: NaZSM-5 (Si/
области сравнительно низких температур (до 100°С)
Al = 40, Sуд = 450 м2·г-1), CBV-2314 (Si/Al = 11.5,
сдвинуто в сторону 2-бутена. Например, при 25°С
Sуд= 425 м2·г-1), CBV-8014 (Si/Al = 40, Sуд=425 м2·г-1)
равновесная смесь изомеров бутена содержит лишь
CBV-28014 (Si/Al ~ 150, Sуд = 400 м2·г-1). MgO гото-
2.6-3% 1-бутена [17, 18], с увеличением температуры
вили согласно [34] путем прокаливания Mg(OH)2 в
равновесная доля 1-бутена в смеси растет. При 80-
вакууме при 500°С. Все катализаторы предваритель-
100°С она составляет 6-6.2% [17, 19], а при 200°С —
но прокаливали на воздухе при 450°С в течение 2 ч.
10.4% [17]. Это показывает, что для изомеризации
Непосредственно перед реакцией γ-Аl2О3 подвер-
1-бутена в 2-бутен предпочтительны более низкие
гали вакуумной тренировке в реакторе при 320°С,
температуры.
остальные катализаторы — при 100°С в течение 3 ч.
Кинетика и механизм структурной изомеризации
Обозначение цеолитных катализаторов, принятое
1-бутена в интервале температур 0-100°С исследо-
далее, показывает тип цеолита и его силикатный мо-
вались в проточных или статических условиях, на-
дуль. Например, образец HY (Si/Al ~ 15) обозначен
пример, в присутствии MgO [20, 21], Аl2О3 [18, 22],
как HY(15), а HZSM-5 (Si/Al = 40) — как HZSM-5(40).
La2О3 [23-25], ZnO [18, 26], алюмосиликатов [22],
На примере цеолита HZSM-5(40) было показа-
цеолитных катализаторов: HZSM-5 [27-29], HZSM-11
но, что после вакуумной тренировки при 320 или
[29], ferrierite [29], HY [27, 28], 13X, NaX, KX, RbX
при 100°С катализатор имеет близкую активность.
[30], CsX [30, 31], сульфатированного сополимера
В качестве катализатора изомеризации также
Amberlyst 15 [32, 33]. В этих работах реакция в ос-
использовали сильнокислотную катионообменную
новном проводилась при низких конверсиях 1-бутена
смолу — сульфированный сополимер стирола и ди-
с целью определения констант скоростей реакций
винилбензола Amberlyst 15 dry (Aldrich, Н-форма,
взаимного превращения изомеров бутена или тести-
Sуд = 45 м2·г-1). Его тренировали перед реакцией в
рования активных центров катализаторов. Авторы ис-
вакууме при 60°С в течение 1 ч.
пользовали разные условия реакции, что затрудняет
Газофазную изомеризацию 1-бутена проводили
сопоставление полученных результатов. Равновесие
в статическом реакторе-автоклаве (фирма Parr) объ-
реакции 1-бутен
2-бутены при температурах до
емом 100 см3 при температуре 20-100°С (преиму-
100°С исследовалось лишь в присутствии несколь-
щественно при 60°С). Катализатор (0.5 г, фракция
ких гетерогенных катализаторов, например, 0.03%
0.5-0.25 мм) загружали в реактор и подвергали ва-
Pd/Аl2О3 при 0-84°С [19] и 1% Pd на носителях (SiО2,
куумной тренировке. Затем реактор охлаждали до
Аl2О3, TiO2, HZSM-5, H-BEA) при 25°С [3].
20°С, вводили 15.3 ммоль 1-бутена и быстро нагрева-
Целью данной работы являлась оценка возмож-
ли реактор (10 град·мин-1) до температуры реакции.
ности использования традиционных гетерогенных
Газовую фазу интенсивно перемешивали с помощью
кислотно-основных катализаторов для превращения
мешалки (скорость вращения 300 об·мин-1). Во время
1-бутена в 2-бутены, позволяющих достигать близкое
реакции периодически отбирали пробу газовой фазы
к равновесному распределение изомеров в области
(10 мкл) через пробоотборник (объем 1 см3) с помо-
умеренных температур до 100°С.
щью шприца объемом 50 мкл для последующего ана-
лиза. В случае проведения последовательных циклов
изомеризации на одной навеске катализатора образец
Экспериментальная часть
вакуумировали после каждого цикла при температуре
В опытах использовали 1-бутен (Aldrich, чи-
реакции в течение 5 мин.
стота 99.2%), который по данным хроматографи-
Состав газовой фазы в ходе реакции анализирова-
ческого анализа содержал 99.2 мол% 1-бутена,
ли с использованием хроматографа Кристалл 2000,
0.56 мол% транс-2-бутена и 0.24 мол% цис-2-бу-
снабженного пламенно-ионизационным детектором
тена. Изомеризацию 1-бутена проводили в при-
и капиллярной колонкой PlotU (длина 30 м, диаметр
сутствии MgO (Sуд = 220 м2·г-1), γ-Аl2О3 (ЗАО
0.32 мм, температура 120-160°C, газ-носитель — ге-
«Промышленные катализаторы», Рязань, Sуд =
лий, расход 30 см3·мин-1). Из данных анализа рассчи-
250 м2·г-1) и ряда цеолитных катализаторов струк-
тывали доли 1-бутена, транс-2-бутена и цис-2-бутена
турных типов FAU и MFI производства Zeolyst Co.
в смеси, а также конверсию 1-бутена. Отметим, что
862
Дубков К. А. и др.
в использованных условиях изобутен не образуется.
выше равновесной доли 1-бутена, которая при 100°С
Это вполне согласуется с результатами работ [35,
составляет около 6% [17].
36], которые показывают, что скелетная изомериза-
Активность цеолитных катализаторов HY(15) и
ция 1-бутена на цеолитных катализаторах протекает
HY(2.6) в изомеризации 1-бутена значительно выше
при значительно более высоких температурах (300-
(табл. 1). Например, в присутствии HY(15) уже через
480°С) с выходом изобутена до 40%.
2 ч реакции конверсия 1-бутена достигает 89.6%, а
его доля в смеси с 2-бутенами снижается до 10.4%
(табл. 1). Однако с увеличением времени реакции до
Обсуждение результатов
5 ч эти показатели изменяются незначительно, оче-
Результаты изомеризации 1-бутена в присутствии
видно, вследствие дезактивации катализатора. Кроме
MgO, γ-Аl2О3 и цеолитов HY показаны в табл. 1.
того, через 19 ч реакции смесь бутенов израсходо-
Видно, что катализаторы MgO и γ-Аl2О3 неактивны
валась, а выгруженный катализатор имел темно-ко-
в реакции при 60 и 20°С соответственно. При 100°С
ричневый цвет. Это свидетельствует о протекании
γ-Аl2О3 показывает низкую активность — после 62 ч
побочных реакций, приводящих к отложению «кокса»
реакции конверсия 1-бутена составляет 79.3%, а его
на катализаторе.
доля в смеси с транс- и цис- 2-бутенами снижается от
Цеолит HY(2.6) также изменяет цвет и дезактиви-
исходного значения 99.2% до 20.5%, что значительно руется в ходе реакции (табл. 1). В этом случае кон-
Таблица 1
Изомеризация 1-бутена в присутствии γ-Аl2О3, MgO и цеолитов HY
Распределение изомеров бутена, мол%
Продолжи-
Другие
Катали-
Темпе-
Конверсия
Тренировка
тельность
продукты,
затор
ратура, °С
1-С4H8, %
транс-
цис-
транс/
опыта, ч
1-С
4H8
мол%
С4H8
С4H8
цис
MgO
Воздух 450°С
60
0
0
99.2
0.56
0.24
2.33
0.2
2 ч, вакуум
1
0.4
98.8
0.85
0.35
2.4
100°С 3 ч
3.5
0.4
98.8
0.85
0.35
2.4
18.5
0.7
98.5
1.05
0.45
2.3
0.2
γ-Аl2О3
Воздух 500°С
20
0
0
99.2
0.56
0.24
2.33
0.2
2 ч, вакуум
1
0.1
99.1
0.65
0.25
2.6
0.2
320°С 3 ч
2
0
99.2
0.56
0.24
2.3
0.2
6
0.1
99.3
0.5
0.2
2.5
0.2
γ-Аl2О3
Воздух 500°С
100
0
0
99.2
0.56
0.24
2.33
0.2
2 ч, вакуум
14.25
41.3
58.2
27.9
13.9
2.01
0.1
320°С 3 ч
37.67
67
32.7
45
22.3
2.02
47.5
74.3
25.5
49.8
24.8
2.01
62
79.3
20.5
52.9
26.6
2.0
0.1
HY(15)
Воздух 500°С
60
0
0
99.2
0.56
0.24
2.33
0.2
2 ч, вакуум
1
83.8
16.1
47.3
36.6
1.3
1.1
100°С 3 ч
2
89.6
10.4
54.6
35
1.56
3
90.3
9.6
57.5
32.8
1.75
1.2
5
90.8
9.1
60.7
30.2
2.01
1.5
19
—
—
—
—
—
—
HY(2.6)
Воздух 500°С
60
0
0
99.2
0.56
0.24
2.33
0.2
2 ч, вакуум
1
79.1
20.7
39.2
40.1
0.98
100°С 3 ч
2.67
87.4
12.5
47.5
40
1.19
5.5
89.6
10.3
53.3
36.4
1.47
17
90.7
9.2
60.4
30.4
1.99
0.8
Изомеризация 1-бутена в 2-бутены в присутствии кислотно-основных катализаторов
863
версия 1-бутена и его доля в смеси изомеров бутена
уже мало меняется, составляя 7.5-7.1%. Это пока-
мало изменяются с увеличением времени реакции от
зывает, что параллельно с изомеризацией 1-бутена
5.5 до 17 ч. Даже через 17 ч реакции доля 1-бутена
в цис- и транс-изомеры 2-бутена протекает более
снижается лишь до 9.2%, не достигая равновесного
медленная изомеризация цис-2-бутена в транс-2-
значения.
бутен. Скорость этой реакции должна возрастать с
Наиболее вероятной причиной дезактивации об-
увеличением доли цис-2-бутена в смеси, что приводит
разцов HY(15) и HY(2.6) являются побочные реак-
к росту отношения транс/цис в конце реакции при
ции олигомеризации/полимеризации бутенов, кото-
приближении системы к равновесию. Зависимость
рые могут протекать с участием кислотных центров,
доли цис-2-бутена в смеси от времени реакции про-
расположенных в сравнительно крупных полостях
ходит через максимум (табл. 2). Аналогичные зави-
цеолитов HY (диаметр полости достигает 11.8 Å, ди-
симости отношения транс/цис от времени реакции
аметр окон — 7.4 Å [37, 38]). Эти реакции приводят
наблюдаются в присутствии цеолитов HZSM-5(40)
к образованию нелетучих продуктов, блокирующих
(табл. 2) и HY (табл. 1).
активные центры катализатора. Дезактивацию цеоли-
Согласно данным работы [28], константа ско-
тов HY и образование полимерных отложений в ходе
рости для изомеризации цис-2-бутена в транс-2-
структурной изомеризации 1-бутена также наблюдали
бутен в присутствии цеолита HZSM-5 (Si/Al = 40,
в работах [39, 40]. Наряду с топологическими особен-
Sуд = 450 м2·г-1) при 50°С примерно на порядок ниже,
ностями цеолитов Y образованию олигомерных мо-
чем константы скорости для изомеризации 1-бутена в
лекул может способствовать и сравнительно высокая
цис- и транс- 2-бутены, что качественно согласуется
концентрация кислотных центров.
с нашими результатами.
В табл. 2 приведены результаты изомеризации
Для менее активного катализатора HZSM-5(150)
1-бутена в присутствии цеолитов ZSM-5 при 60°С.
в ходе реакции наблюдается очень низкое отноше-
Видно, что NaZSM-5(40) неактивен в реакции в от-
ние транс/цис, составляющее 0.56 через 1 ч реакции
личие от цеолитов ZSM-5 в Н-форме. Следовательно,
(табл. 2). Это также свидетельствует о более высо-
изомеризация 1-бутена протекает с участием бренсте-
кой скорости изомеризации 1-бутена в цис-2-бутен.
довских кислотных центров (БКЦ) цеолитов, что со-
Последующий небольшой рост этого отношения до
гласуется с данными [28, 39, 40]. Такие центры пред-
0.68 с увеличением времени реакции до 26 ч, оче-
ставляют собой мостиковые гидроксильные группы
видно, связан с очень медленной изомеризацией
Si-OH-Al, связанные с решеточными атомами Al в
цис-2-бутена в транс-2-бутен, скорость которой зна-
каналах цеолита [36, 41, 42].
чительно ниже по сравнению с другими цеолитными
В случае образцов HZSM-5(150), HZSM-5(40) и
катализаторами, содержащими большее количество
HZSM-5(11.5) конверсия 1-бутена, например, через
Al и соответственно большее количество БКЦ.
1 ч реакции составляет соответственно 13.2, 80.4 и
Активность цеолита HZSM-5(40) заметно снижа-
89.1%. Таким образом, активность цеолитов HZSM-5
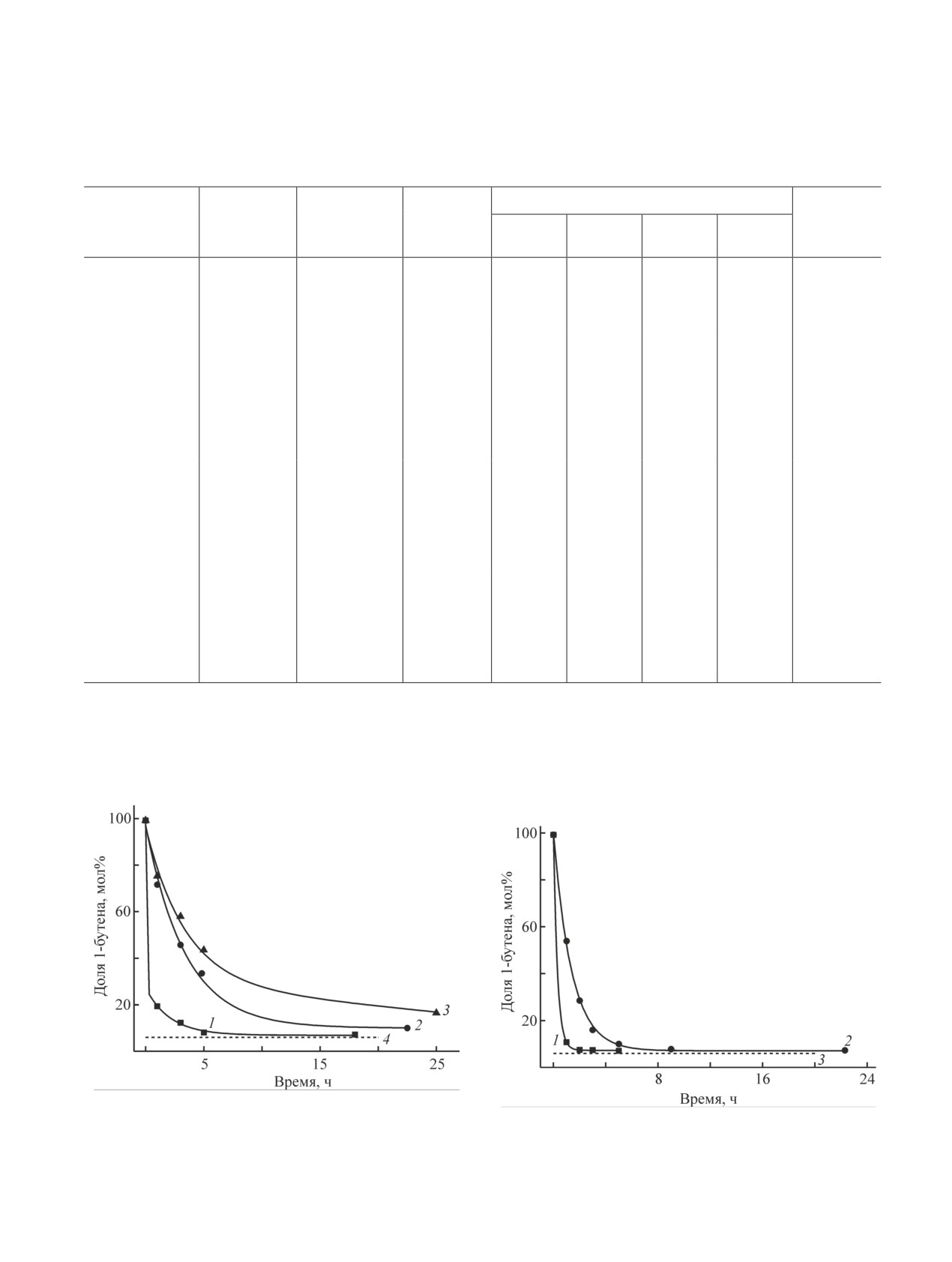
ется в ходе повторных циклов изомеризации 1-бутена
растет с понижением силикатного модуля. Очевидно,
(рис. 1), т. е. катализатор медленно дезактивируется
что это связано с ростом концентрации БКЦ с уве-
в ходе реакции. Например, через 3 ч реакции в цикле
личением содержания Al в решетке цеолита [41, 43,
1 конверсия 1-бутена составляет 87.6%, в цикле 2 —
44]. В присутствии самого активного катализато-
53.9%, в цикле 3 — 41.5%. Доля 1-бутена в смеси
ра HZSM-5(11.5) через 5 ч реакции доля 1-бутена в
изомеров во втором и третьем циклах не достигает
смеси уменьшается до 7.1% (табл. 2), что близко к
равновесного значения даже через 22.5-25 ч реакции
равновесному значению.
и составляет 10-16.5%.
Обращает на себя внимание, что в случае этого
Результаты двух повторных циклов изомеризации
катализатора отношение доли транс-2-бутена к доле
1-бутена в присутствии более активного катализатора
цис-2-бутена в смеси (отношение транс/цис) умень-
HZSM-5(11.5) (рис. 2) показывают, что этот катализа-
шается в начальный период реакции от исходного
тор также дезактивируется, но, очевидно, в меньшей
значения 2.33 до 1.62 через 1 ч реакции (табл. 2).
степени. В этом случае через 3 ч реакции в цикле 1
Следовательно, изомеризация 1-бутена в цис-2-бутен
конверсия 1-бутена составляет 92.5%, в цикле 2 —
протекает с более высокой скоростью, чем изомери-
83.8%. Состав смеси изомеров бутена, близкий к рав-
зация 1-бутена в транс-2-бутен. При дальнейшем
новесному, достигается через 5 ч реакции в первом
увеличении времени реакции отношение транс/цис
цикле и через 22.3 ч во втором.
возрастает, достигая 1.83 через 2 ч и 2.28 через 5 ч
Интересно, что активность образца HZSM-5(11.5)
реакции (табл. 2). При этом доля 1-бутена в смеси
(табл. 2) выше по сравнению с цеолитом HY(15)
864
Дубков К. А. и др.
Таблица 2
Изомеризация 1-бутена в присутствии цеолитов ZSM-5 (тренировка: вакуум 100°С 3 ч)
Распределение изомеров бутена, мол%
Продолжи-
Другие
Температура,
Конверсия
Катализатор
тельность
продукты,
°С
1-С4H8, %
транс-
транс/
опыта t, ч
1-С4H8
цис-С4H8
мол%
С4H8
цис
NaZSM-5(40)
60
0
0
99.2
0.56
0.24
2.33
0.2
2
0.8
98.4
1
0.4
2.5
0.2
26.5
1.8
97.7
1.5
0.8
1.82
0.3
HZSM-5(150)
60
0
0
99.2
0.56
0.24
2.33
0.2
1
13.2
86.1
5
8.9
0.56
0.4
3
18.1
81.2
7
11.8
0.59
5
22.2
77.2
8.6
14.2
0.56
19
30.1
69.3
12.3
18.4
0.67
26
32.6
66.9
13.5
19.6
0.68
0.3
HZSM-5(40)
60
0
0
99.2
0.56
0.24
2.33
0.2
1
80.4
19.4
43.2
37.4
1.16
0.1
3
87.6
12.3
51.5
36.2
1.42
0.2
5
91.8
8.1
57.2
34.7
1.65
18
92.7
7.2
63.7
29.1
2.19
HZSM-5(11.5)
60
0
0
99.2
0.56
0.24
2.33
0.2
1
89.1
10.8
55.1
34.1
1.62
0.1
2
92.4
7.5
59.8
32.7
1.83
3
92.5
7.4
62.6
29.7
2.12
0.2
5
92.9
7.1
64.6
28.3
2.28
0.4
(табл. 1) структурного типа FAU c близким значением
47]. Кроме того, образцы HZSM-5 более стабильны.
Si/Al. Это, вероятнее всего, связано с более высокой
В их присутствии в отличие от образцов HY не на-
силой кислотных центров в цеолитах HZSM-5 [45-
блюдается значительного расходования бутенов. Это
Рис. 1. Повторные циклы изомеризации 1-бутена в при-
сутствии HZSM-5(40) при 60°C.
Рис. 2. Повторные циклы изомеризации 1-бутена в при-
сутствии HZSM-5(11.5) при 60°C.
1 — цикл 1, 2 — цикл 2, 3 — цикл 3, 4 — равновесная
доля 1-бутена.
1 — цикл 1, 2 — цикл 2, 3 — равновесная доля 1-бутена.
Изомеризация 1-бутена в 2-бутены в присутствии кислотно-основных катализаторов
865
свидетельствует о лишь небольшом вкладе побочных
В табл. 3 показано влияние температуры в интер-
реакций олигомеризации/полимеризации, которые
вале 20-60°С на изомеризацию 1-бутена в 2-бутен
также могут протекать на цеолитах со структурой
в присутствии Н-формы сульфированного сополи-
MFI [48].
мера Amberlyst 15. Видно, что с ростом температу-
В общем случае концентрация и сила кислотных
ры активность катализатора значительно возрастает.
центров цеолита наряду с особенностями его струк-
Например, через 1 ч реакции при 20°С конверсия
туры определяют направление реакций, протекаю-
1-бутена составляет всего 6%, при 40°С — 35.1%,
щих при превращениях олефинов на цеолитных ка-
при 60°С — 87.9%. Наблюдаемая энергия активации
тализаторах. Общепринято, что сильные кислотные
для изомеризации 1-бутена, оцененная из этих дан-
центры способствуют протеканию реакций крекин-
ных, составляет около 60 кДж·моль-1. Это значение
га-олигомеризации, а более слабые центры пред-
близко к энергии активации для изомеризации 1-бу-
почтительны для изомеризации двойной связи [49,
тена в транс- и цис-изомеры 2-бутена в присутствии
50]. Полученные данные позволяют заключить, что
Amberlyst 15 (62.8-69.4 кДж·моль-1), полученной
пористая структура цеолита является более важным
ранее [32]. Довольно высокая энергия активации по-
фактором, влияющим на увеличение селективности и
казывает, что в использованных нами условиях ре-
стабильности катализатора в изомеризации 1-бутена
акция протекает в кинетической области. При 60°С
в 2-бутены, по сравнению с кислотностью цеоли-
конверсия 1-бутена уже через 3 ч реакции достигает
та. Очевидно, что пространственные затруднения
92.6%, а его доля в смеси изомеров уменьшается до
в среднепористом цеолите структуры MFI, имею-
7.3%, что близко к равновесному значению.
щем каналы диаметром 5.1-5.6 Å [36], способствуют
Аналогично цеолиту HZSM-5(11.5) (табл. 2), в
уменьшению вклада таких нежелательных реакций и
присутствии катализатора Amberlyst 15 зависимость
увеличению селективности в структурной изомериза-
отношения транс/цис от времени реакции при 40°С
ции 1-бутена по сравнению с широкопористыми це-
проходит через минимум (табл. 3), что также свиде-
олитами Y. Аналогичное влияние структуры цеолита
тельствует о более высокой скорости изомеризации
на селективность реакции наблюдалось в работах [51,
1-бутена в цис-2-бутен в начальный период реакции.
52] для скелетной изомеризации 1-бутена в изобутен.
Последующее увеличение отношения транс/цис, как
Таким образом, поиск более активных и селективных
и в случае других катализаторов, очевидно, связано
цеолитных катализаторов должен включать оптимиза-
с параллельным протеканием более медленной изо-
цию как кислотных свойств, так и структуры цеолита.
меризации цис-2-бутена в транс-2-бутен. При 60°С
Таблица 3
Изомеризация 1-бутена в присутствии Amberlyst 15 (тренировка: вакуум 60°С 1 ч)
Распределение изомеров бутена, мол%
Продолжи-
Другие
Температура,
Конверсия
тельность
продукты,
°С
1-С4H8, %
транс-
опыта t, ч
1-С4H8
цис-С4H8
транс/цис
мол%
С4H8
20
0
0
99.2
0.56
0.24
2.33
0.2
1
6
93.2
3.8
3
1.34
2
9.6
89.7
5.7
4.6
1.22
19
40
59.5
24.3
16.2
1.51
0.3
40
0
0
99.2
0.56
0.24
2.33
0.2
1
35.1
64.4
21.5
14.1
1.52
0.4
2
56.6
43
36.1
20.9
1.73
4
73.2
26.6
49.8
23.6
2.11
18
92.8
7.1
67.6
25.3
2.68
0.4
60
0
0
99.2
0.56
0.24
2.33
0.2
1
87.9
12
62.1
25.9
2.4
0.4
2
92.1
7.8
65.1
27.1
2.4
3
92.6
7.3
65.4
27.3
2.4
0.6
866
Дубков К. А. и др.
кое содержание Al и связанная с ним бренстедовская
кислотность этих цеолитов. Оба фактора ответствен-
ны за протекание нежелательных реакций олигомери-
зации/полимеризации с образованием полимерных
отложений, приводящих к дезактивации катализатора.
3. Активность цеолитов HZSM-5 при 60°С растет в
ряду HZSM-5(150), HZSM-5(40) и HZSM-5(11.5), что,
очевидно, связано с увеличением концентрации БКЦ
с уменьшением силикатного модуля (Si/Al) цеолита.
Даже при близком содержании Al их стабильность
выше по сравнению с цеолитами HY, что, вероятнее
всего, обусловлено пространственными затруднени-
ями для образования крупных молекул олигомеров
в микропористом пространстве цеолитов HZSM-5
(внутренний диаметр каналов не превышает 5.6 Å, а
их пересечений — 9 Å).
Рис. 3. Повторные циклы изомеризации 1-бутена в при-
сутствии Amberlyst 15 при 40°C.
4. Среди исследованных катализаторов Amberlyst
15 и HZSM-5(11.5) являются наиболее активными
1 — цикл 1, 2 — цикл 2, 3 — цикл 3, 4 — равновесная
доля 1-бутена.
в изомеризации 1-бутена в 2-бутены. В их присут-
ствии состав смеси изомеров, близкий к равновесно-
му, устанавливается через 3-5 ч реакции при 60°С.
отношение транс/цис быстро достигает равновесного
значения уже через 1 ч реакции и далее не изменяется
Однако в отличие от HZSM-5(11.5), который медлен-
(табл. 3). Следовательно, при этой температуре все
но дезактивируется в ходе повторных циклов изоме-
реакции взаимного превращения изомеров бутена,
ризации 1-бутена, катализатор Amberlyst 15 стабилен
включая цис/транс-изомеризацию, протекают с вы-
в условиях реакции.
5. Показано, что на всех катализаторах параллель-
сокой скоростью.
но с изомеризацией 1-бутена в цис- и транс-изомеры
Катализатор Amberlyst 15 довольно стабилен в
2-бутена протекает более медленная изомеризация
условиях реакции (рис. 3). Его активность во втором
цис-2-бутена в транс-2-бутен.
и третьем циклах изомеризации при 40°С оказывает-
ся даже выше, чем в первом цикле. Например, через
2 ч реакции в цикле 1 конверсия 1-бутена составляет
Благодарности
56.6%, а в циклах 2 и 3 — 70 и 64.5% соответственно.
Работа выполнена в рамках государственного за-
Во втором цикле близкое к равновесному распреде-
дания Института катализа СО РАН.
ление изомеров бутена достигается примерно через
20 ч реакции.
Конфликт интересов
Выводы
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
1. Исследована возможность достижения равнове-
сия в реакции структурной изомеризации 1-бутена в
интервале температур 20-100°С в присутствии ряда
Информация об авторах
гетерогенных кислотно-основных катализаторов.
Дубков Константин Александрович, д.х.н., ORCID:
2. Полученные результаты показывают, что образ-
цы MgO и γ-Аl2О3 малоактивны в этой области тем-
Пирютко Лариса Владимировна, к.х.н., ORCID:
ператур. Цеолитные катализаторы HY(15) и HY(2.6),
несмотря на сравнительно высокую начальную актив-
Харитонов Александр Сергеевич, д.х.н., ORCID:
ность при 60°С, довольно быстро дезактивируются
в ходе реакции уже в первом цикле изомеризации.
Этому способствуют геометрия микропористого про-
Список литературы
странства широкопористых цеолитов структуры FAU,
содержащих большие полости (диаметр до 11.8 Å) с
[1] Calamur N., Carrera M. E., Wilsak R. A. // Kirk-Othmer
окнами диаметром 7.4 Å, а также сравнительно высо-
Encyclopedia of Chemical Technology. 4th Ed. New
Изомеризация 1-бутена в 2-бутены в присутствии кислотно-основных катализаторов
867
York: John Wiley & Sons, Inc., 1994. V. 4. P. 361-
[16] Пат. РФ 2570818 С1 (опубл. 2015). Способ получе-
376.
ния карбонильных соединений С2-С4.
[2] Sun H. N., Wristers J. P. // Kirk-Othmer Encyclopedia
[17] Stull D. R., Westrum E. F., Sinke G. C. The Chemical
of Chemical Technology. 4th Ed. New York: John
Thermodynamics of Organic Compounds, New York:
Wiley & Sons, Inc., 1994. V. 4. P. 340-354.
John Wiley & Sons Inc., 1969. 882 p.
[3] Li Y., Ma C., Yang H., Zhang Z., Zhang X., Qiao N.,
[18] Dent A. L., Kokes R. J. // J. Phys. Chem. 1970. V. 76.
Wang J., Hao Z. // Chem. Eng. J. 2016. V. 299. P. 1-7.
N 4. P. 487-491.
[4] Corma A., Martínez A. // Catal. Rev. Sci. Eng. 1993.
[19] Meyer E. F., Stroz D. G. // JACS. 1972. V. 94. N 18.
V. 35. N 4. P. 483-570.
P. 6344-6347.
[5] Starokon E. V., Dubkov K. A., Babushkin D. E., Par-
[20] Matsuda T., Tanabe J., Hayashi N., Sasaki Y., Miu-
mon V. N., Panov G. I. // Adv. Synth. Catal. 2004.
ra H., Sugiyama K. // Bull. Chem. Soc. Jap. 1982.
V. 346. P. 268-274.
V. 55. P. 22-31.
[6] Hermans I., Moens B., Peeters J., Jacobs P., Sels B. //
[21] Baird M. J., Lunsford J. H. // J. Catal. 1972. V. 26.
Phys. Chem. Chem. Phys. 2007. V. 9. P. 4269-4274.
P. 440-450.
[7] Hermans I., Janssen K., Moens B., Philippaerts A.,
[22] Gerberich H. R., Hall W. K. // J. Catal. 1966. V. 5.
Van Berlo B., Peeters J., Jacobs P. A., Sels B. // Adv.
P. 99-110.
Synth. Catal. 2007. V. 349. P. 1604-1608.
[23] Rosynek M. P., Fox J. S., Jensen J. L. // J. Catal. 1981.
[8] Panov G. I., Dubkov K. A., Kharitonov A. S. // Modern
V. 71. P. 64-77.
Heterogeneous Oxidation Catalysis: Design, Reactions
[24] Rosynek M. P., Fox J. S. // J. Catal. 1977. V. 49.
and Characterization / Ed. N. Mizuno. Weinheim:
P. 285-293.
WILEY-VCH Verlag GmbH & Co. KGaA, 2009.
[25] Goldwasser J., Hall W. K. // J. Catal. 1980. V. 63.
Р. 217-252.
P. 520-522.
[9] Newman S. G., Lee K., Cai J., Yang L., Green W. H.,
[26] Chang C. C., Conner W. C., Kokes R. J. // J. Phys.
Jensen K. // Ind. Eng. Chem. Res. 2015. V. 54.
Chem. 1973. V. 77. N 16. P. 1957-1964.
P. 4166-4173.
[27] Tsuchiya S., Kawasaki S., Mikami M., Imamura H. //
[10] Дубков К. А., Панов Г. И., Пармон В. Н. // Успехи
Zeolites. 1987 V. 7. P. 4-6.
химии. 2017. Т. 86. № 6. С. 510-529 [Dubkov K. A.,
[28] Tsuchiya S., Ito S. // Zeolites. 1983. V. 3. P. 193-
Panov G. I., Parmon V. N. // Russ. Chem. Rev. 2017.
194.
V. 86. N 6. P. 510-529].
[29] Harrison I. D., Leach H. F., Whan D. A. // Zeolites.
[11] BASF Starts Up A New Production Facility For
1987. V. 7. 21-27.
Intermediates (BASF News Release, 01.12.2009).
[30] Tsuji H., Yagi F., Hattori H. // Chem. Lett. 1991. V. 20.
N 11. P. 1881-1884.
BASF-Starts-Up-A-New-Production-Facility-
[31] Li J. H., Davis R. J. // Appl. Catal. A: General. 2003.
For-0001 (дата обращения: 21.09.2018).
V. 239. P. 59-70.
[12] Семиколенов С. В., Дубков К. А., Староконь Е. В.,
[32] Slomkiewicz P. M. // Appl. Catal. A: General. 2006.
Бабушкин Д. Э., Панов Г. И. // Изв РАН. Сер. хим.
V. 301. N 2. P. 232-240.
2005. № 5. С. 925-933 [Semikolenov S. V., Dub-
[33] Slomkiewicz P. M. // React. Funct. Polym. 1997. V. 33.
kov K. A., Starokon E. V., Babushkin D. E., Panov G. I.
N 2-3. P. 299-304.
// Russ. Chem. Bull. 2005. V. 54. N 4. P. 948-
[34] Chesnokov V. V., Bedilo A. F., Heroux D. S., Misha-
956].
kov I. V., Klabunde K. J. // J. Catal. 2003. V. 218.
[13] Sheldon R. A., Kochi J. K. Metal-Catalyzed Oxidations
P. 438-446.
of Organic Compounds. London: Acad. Press, 1981.
[35] Simon M., Suib S., O′Young C. L. // J. Catal. 1994.
446 p.
V. 147. P. 484-493.
[14] Hudlicky M. Oxidation in Organic Chemistry.
[36] Wichterlova B., Zilkova N., Uvarova E., Cejka J.,
Washington DC: ACS, 1990. 433 p.
Sarv P., Paganini C., Lercher J. A. // Appl. Catal. A:
[15] Харитонов А. С., Иванов Д. П., Парфенов М. В.,
General. 1999. V. 182. P. 297-308.
Пирютко Л. В., Семиколенов С. В., Дубков К. А.,
[37] Hensen E. J. M., van Veen J. A. R. // Catal. Tod. 2003.
Перейма В. Ю., Носков А. С., Кондрашев Д. О.,
V. 86. P. 87-109.
Клейменов А. В., Ведерников О. С., Кузнецов С. Е.,
[38] Qiao Z.A., Huo Q.-S. // Modern Inorganic Synthetic
Галкин В. В. Абрашенков П. А. // Катализ в пром-
Chemistry. 2nd Ed. / Eds R. Xu, Y. Xu. Amsterdam:
сти. 2016. № 6. С. 48-56 [Kharitonov A. S., Iva-
Elsevier, 2017. P. 389-428.
nov D. P., Parfenov M. V., Piryutko L.V., Semikole-
[39] Weeks T. J., Bolton A. P. // J. Chem. Soc. Faraday
nov S. V., Dubkov K. A., Pereima V. Y., Noskov A. S.,
Trans. 1. 1974. V. 70. P. 1676-1684.
Kondrashev D. O., Kleymenov A. V., Vedernikov O. S.,
[40] Jacobs P. A., Declerck L. J., Vandamme L. J., Uytter-
Kuznetsov S. E., Galkin V. V., Abrashenkov P. A. //
hoeven J. B. // J. Chem. Soc. Faraday Trans. 1. 1975.
Catal. Ind. 2017. V. 9. N 3. P. 204-211].
V. 71. P. 1545-1556.
868
Дубков К. А. и др.
[41] Haag W. O., Lago R. M., Weisz P. B. // Nature. 1984.
[46] Hidalgo C. V., Tadashi H. I., Niwa H. M., Murakami Y.
V. 309. P. 589-591.
// J. Catal. 1984. V. 85. P. 362-369.
[42] Woolery G. L., Kuehl G. H., Timken H. C., Ches-
[47] Wang H., Liu Z., Sun C., Wang G. // Stud. Surf. Sci.
ter A. W., Vartuli J. C. // Zeolites. 1997. V. 19. P. 288-
Catal. 2004. V. 154. P. 2773-2780.
296.
[48] Harrison I. D., Leach H. F., Whan D. A. // Zeolites.
[43] Costa C., Dzikh I. P., Lopes J. M., Lemos F., Ri-
1987. V. 7. P. 21-27.
beiro F. R. // J. Mol. Catal. A: Chemical. 2000. V. 154.
[49] O′Young C. L., Xub W.-Q., Simonb M., Suib S. L. //
P. 193-201.
Stud. Surf. Sci. Catal. 1994. V. 84. P. 1671-1676.
[44] Benito P.-L., Gayubo A. G., Aguayo A. T., Olazar M.,
[50] Byggningsbacka R., Lindfors L.-E., Kumar N. // Ind.
Bilbao J. // J. Chem. Tech. Biotechnol. 1996. V. 66.
Eng. Chem. Res. 1997. V. 36. P. 2990-2995.
P. 183-191.
[51] Asensi M. A., Corma A., Martinez A. // J. Catal. 1996.
[45] Auroux A., Bolis V., Wierzchowski P., Gravelle P. C.,
V. 158. P. 561-569.
Vedrine J. C. // J. Chem. Soc. Faraday Trans. 1. 1979.
[52] van Donk S., Bitter J. H., de Jong K. P. // Appl. Catal.
V. 75. P. 2544-2555.
A: General. 2001. V. 212. P. 97-116.