90
Луговицкая Т. Н. и др.
Журнал прикладной химии. 2020. Т. 93. Вып. 1
УДК 547.458.1:541.1
ПОЛУЧЕНИЕ И СВОЙСТВА
АСПАРАГИНОВОКИСЛЫХ РАСТВОРОВ ХИТОЗАНА
© Т. Н. Луговицкая, И. В. Зудина, А. Б. Шиповская
Саратовский национальный исследовательский государственный университет
им. Н. Г. Чернышевского,
410012, г. Саратов, ул. Астраханская, д. 83
E-mail: tlugovitskaja@mail.ru
Поступила в Редакцию 4 марта 2019 г.
После доработки 21 мая 2019 г.
Принята к публикации 20 сентября 2019 г.
Обсуждены условия получения растворов хитозана в L-аспарагиновой кислоте: растворение поли-
мера с формированием аспарагината хитозана происходит в диапазоне рН 3.6-3.8 при минимальном
стехиометрическом отношении [кислота]/[хитозан(-NH2)] ~ 0.43. Исследованы гидродинамические,
электрохимические, оптические и биологические свойства водных растворов аспарагиновокислой соли
хитозана. Установлено, что в водной среде макромолекулы полисоли проявляют свойства полиэлек-
тролита с частично компенсированным зарядом. Рассчитаны константы Хаггинса и температурные
коэффициенты вязкости, свидетельствующие о повышенной жесткости макроцепей хитозана в
исследуемых растворах и ухудшении взаимодействия полимер-растворитель с повышением темпе-
ратуры. Выделены порошки аспарагината хитозана, имеющие форму пластинчатых микрочастиц
с фрактальным упорядочением. Показаны биосовместимость и антибактериальная активность
полисоли, позволяющие рекомендовать получение на ее основе медико-биологических препаратов.
Ключевые слова: хитозан; L-аспарагиновая кислота; степень протонирования; растворы; полиэлек-
тролит
DOI: 10.31857/S0044461820010090
Хитозан относится к классу линейных полужест-
К последним относится и одна из 20 протеиногенных
коцепных полиcахаридов сополимерного строения.
кислот организма — алифатическая L-аспарагиновая
В связи с его высокой температурой плавления, зна-
аминокислота (Asp). В водном растворе Аsp суще-
чительно превышающей температуру термического
ствует в виде равновесной смеси диполярного иона,
разложения, исследование свойств и переработку
катионной и анионной форм. Значения констант дис-
данного полимера в изделия проводят в растворе.
социации составляют pKа 2.1, 3.9 и 9.8 [11].
Хитозан растворяется в водно-кислых средах при
Природа кислоты оказывает немаловажное влия-
рН < 5.5-6.0 вследствие протонирования ионоген-
ние как на процесс растворения хитозана в водно-кис-
ных аминогрупп с формированием водорастворимых
лотной среде, так и на физико-химические характе-
солевых комплексов (полисолей). Для растворения
ристики полисолей и их растворов [12]. Например,
хитозана чаще всего используют водные растворы
в сильной соляной кислоте степень протонирования
одноосновных карбоновых кислот — уксусной, му-
(α) макромолекул хитозана составляет 90%. В случае
равьиной, реже — минеральной соляной кислоты [1,
использования слабого электролита — уксусной кис-
2]. Возможно растворение хитозана и в присутствии
лоты α = 50-60% [13].
непредельных карбоновых кислот — олеиновой, ли-
Благодаря наличию двух типов функциональных
нолевой [3], кислот ароматического ряда — бензой-
групп, композиционной неоднородности, возможно-
ной [4], салициловой [5], а также перспективных в
сти формирования внутри- и межмолекулярных водо-
медицинских приложениях биологически активных
родных контактов, влияющих на конформацию цепи,
кислот — аскорбиновой [6, 7], лимонной [8], азела-
макромолекулы хитозана характеризуются весьма
иновой, янтарной, адипиновой [9], угольной [10].
сложным поведением в растворе [1, 14]. Как полу-
Получение и свойства аспарагиновокислых растворов хитозана
91
жесткоцепной полимер хитозан имеет высокие значе-
изводства ЗАО «Биопрогресс» (г. Щелково); Asp про-
ния предельного числа вязкости, константы Хаггинса
изводства ЗАО «Биоамид» (г. Саратов) аналитической
и температурного коэффициента вязкости [13, 15, 16].
степени чистоты; дистиллированную воду, дегазиро-
В зависимости от ионной силы среды макромолекулы
ванную от СО2 и О2 кипячением при 373 K в течение
хитозана могут проявлять полиэлектролитные свой-
1 ч; NaCl (х.ч.). Объектами исследования выбраны
ства, в большей степени выраженные в растворах с
водные суспензии хитозана, свежеприготовленные
низкой I. Вследствие малой подвижности поликати-
водные растворы хитозана в Asp и воздушно-сухие
она растворы полисолей хитозана характеризуются
образцы аспарагината хитозана, выделенные из со-
пониженной электропроводностью по сравнению с
ответствующих растворов.
растворами минеральных электролитов [17].
Суспензии хитозана концентрации c′ХТЗ = 0.05-
Растворимость в воде воздушно-сухих образцов
0.3 г·дл-1 готовили по стандартной методике с пред-
полисолей хитозана зависит от рKа кислоты, диэлек-
варительным набуханием порошка полимера в ди-
трической постоянной растворяющей смеси, а также
стиллированной воде в течение 20 мин при 293 K.
способа выделения [18]. Так, солевые комплексы
Гидромодуль суспензий варьировали в интервале
хитозана с карбоновыми кислотами и соляной кис-
83-500 мл·г-1. Водные растворы Asp концентрации
лотой, выделенные из раствора путем упаривания,
сАsp = 0.02-0.80 г·дл-1 готовили согласно методике
водорастворимы, а путем осаждения — избирательно
[23]. Исходный аспарагиновокислый раствор хито-
растворимы в воде. Например, солянокислый хито-
зана концентрацией сХТЗ = 1.2 г·дл-1 получали рас-
зан, выделенный из водного раствора органическим
творением порошков полимера и Asp в дистилли-
осадителем (метанол, изопропанол, ацетон, диоксан),
рованной воде при перемешивании на магнитной
сохраняет растворимость в воде, а уксуснокислый —
мешалке в течение 2 ч при 293 K. Рабочие растворы
в воде не растворяется.
cХТЗ = 0.04-1.20 г·дл-1 получали разведением исход-
Природа кислоты влияет также на структуру и
ного раствора хитозана раствором Asp. Воздушно-
свойства получаемых из растворов пленок хитозана
сухие образцы аспарагината хитозана выделяли из
солевой формы [19, 20]. Замена противоиона, варьи-
растворов высушиванием на стеклянной подложке
рование физико-химических параметров и внешних
при 293 K.
условий (температура, скорость испарения раствори-
Водородный показатель (рН) измеряли на рН-ме-
теля и т. д.) позволяют сформировать как однородные
тре рН-150 МИ, оптическую плотность (А) — на
прозрачные, так и композиционные пленки [4, 21].
КФК-3-ЗОМЗ, диапазон длин волн λ = 315-590 нм.
В отдельных случаях наблюдается образование ден-
Вязкостные свойства растворов (число вязкости
дритоподобных структур [4, 22].
ηуд/cХТЗ, дл·г-1; предельное число вязкости [η], дл·г-1)
Ранее сообщалось о возможности растворения
оценивали в капиллярном вискозиметре Уббелоде с
хитозана в водном растворе L-аспарагиновой кис-
диаметром капилляра 0.56 мм при 298-328 K, элек-
лоты с формированием солевого комплекса аспара-
тропроводность (æ, См·м-1) определяли на кондук-
гината хитозана [23]. Однако процесс растворения
тометре переменного тока Анион 4120, показатель
хитозана в водной среде в присутствии Asp и свой-
преломления (nD25) — на рефрактометре RM-40.
ства получаемых растворов в литературе не описаны.
Ионную силу (I, моль·л-1) рассчитывали по формуле
Исследования в данном направлении представляют-
I = 0.5∑сiZi2, где сi — молярная концентрация отдель-
ся весьма актуальными, поскольку биологическая
ных ионов, Zi — заряд иона; мутность (τ, см-1) — по
активность Asp позволяет рассматривать ее водные
формуле τ = 2.3А/l, где l — длина оптического пути
растворы как биосовместимую среду для растворения
(см); константу Хаггинса (KХ) и температурный ко-
хитозана.
эффициент вязкости (-δТ, K-1) — согласно [15]; эк-
Целью настоящей работы явилось получение рас-
вивалентную электропроводность (λ, См·моль-1·м2),
твора аспарагиновокислого хитозана и исследование
степень (α′, %) и условную константу диссоциа-
его гидродинамических, электрохимических, оптиче-
ции (Kд) — [24]; степень протонирования (α, %) —
ских и биологических свойств.
[1]. Морфологию воздушно-сухих порошков оце-
нивали на растровом электронном микроскопе РЭМ
MIRA II LMU. На образец предварительно напыля-
Экспериментальная часть
ли слой золота толщиной 5-10 нм на установке
В качестве исходных реагентов использовали
Emitech K 4.
порошкообразный хитозан с молекулярной массой
Биосовместимость исследовали in vitro на моде-
200 кДа, степенью деацетилирования 82 мол% про-
ли клеточной линии человеческих фибробластов.
92
Луговицкая Т. Н. и др.
Во флаконы с питательной средой ДМЕМ вносили
тозаном. Поэтому на первом этапе целесообразно
аспарагиновокислый раствор хитозана и суспензию
исследовать процессы растворения полимера.
фибробластов (300 тыс. клеток на 1 см2). Клетки
Растворение хитозана в водной среде в присут-
культивировали в течение 3-4 сут в СО2-инкубаторе
ствии Asp изучали посредством дробного введения
при постоянных температуре (310 K), влажности
раствора кислоты в суспензию полимера. В одной
(90%) и содержании СО2 (5%). Наблюдение за рас-
серии опытов варьировали концентрацию раствора
пластыванием и пролиферацией клеток осущест-
Asp при постоянном гидромодуле суспензий [во-
вляли на инвертированном микроскопе Биолам
да] / [хитозан], в другой — изменяли гидромодуль,
П-3 (ЛОМО, Россия). Питательную среду во фла-
а концентрацию Asp задавали постоянной. При этом
конах не меняли до окончания срока наблюдения.
контролировали изменение кислотности среды и мут-
Антибактериальную активность определяли методом
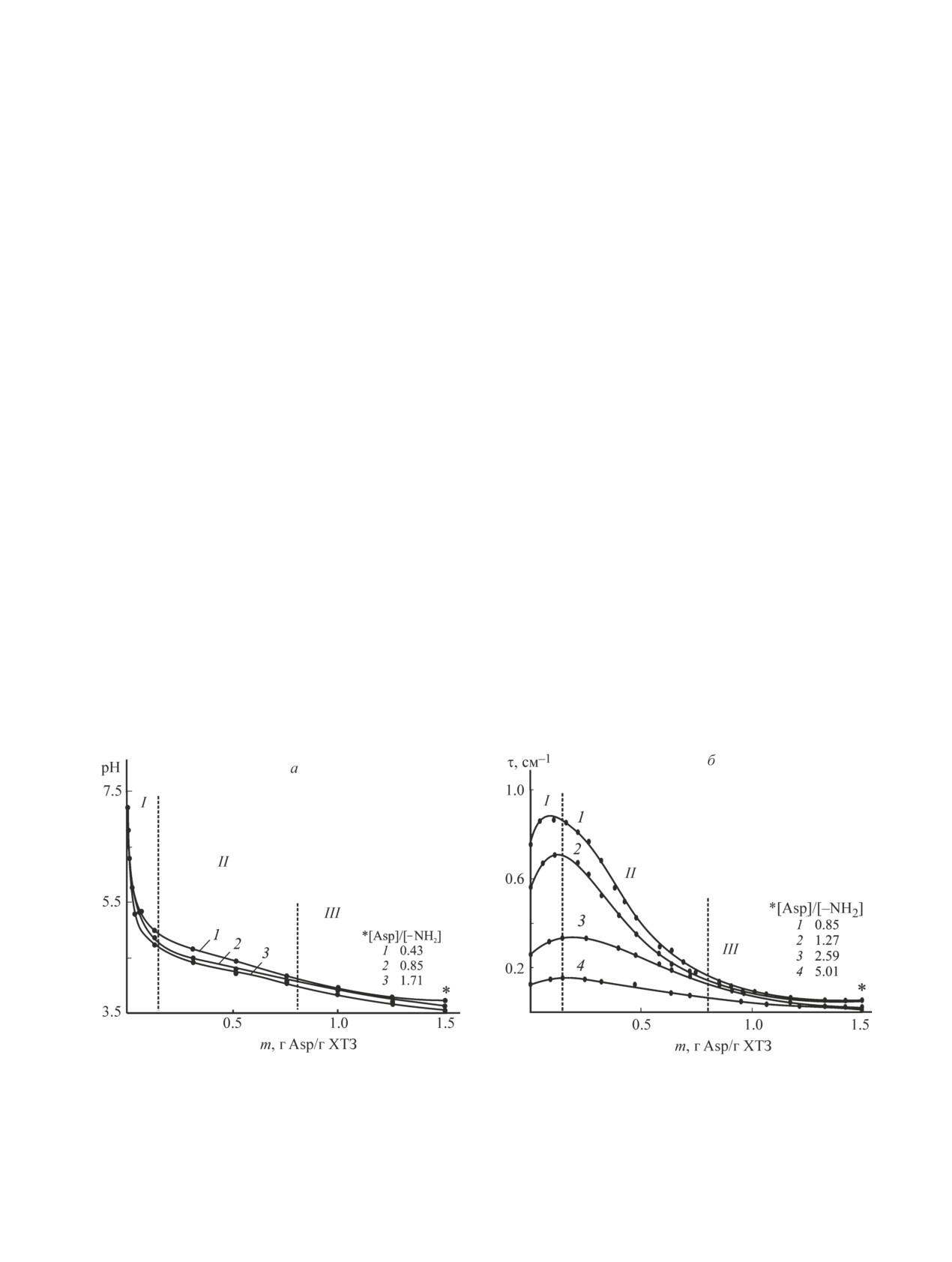
ности системы (рис. 1). Количественное изменение
диффузии в агар с суточной культурой референтного
состава системы выражали массовым соотношением
штамма Staphylococcus aureus 209 P. Использовали
кислота/хитозан.
агаровую среду для культивирования микроорганиз-
Добавление в суспензию хитозана первых порций
мов и растворы с cХТЗ = 0.04-1.20 г·дл-1. В лунки
раствора Asp (m ~ 0.08-0.13 г Asp/г ХТЗ) сопрово-
агаровой среды вносили равные аликвоты раствора
ждается резким уменьшением рН с 7.3 до 4.7-5.0
аспарагиновокислого хитозана разной концентрации,
и возрастанием мутности системы в степени тем
выдерживали 1 ч при комнатной температуре для
большей, чем выше c′ХТЗ (рис. 1, область I). Первое
диффузии полисоли в агар, термостатировали при
является следствием изменения концентрации ионов
310 K в течение 18-20 ч и измеряли зоны задержки
водорода при добавлении кислоты, второе — уве-
роста тест-штамма.
личения размера частиц дисперсной фазы в силу
набухания порошка полимера. Вполне возможно, на
этом этапе происходит и частичное протонирование
Обсуждение результатов
аминогрупп хитозана, но реализуемые значения α еще
L-аспарагиновая кислота в отличие от традици-
недостаточны для его растворения. При дальнейшем
онных растворяющих сред хитозана — водных рас-
добавлении Asp и соответственно увеличении со-
творов минеральных и одноосновных карбоновых
отношения кислота/хитозан уменьшается не только
кислот относится к классу аминокислот, что может
рН, но и τ системы (область II). В совокупности дан-
отразиться и на процессе ее солеобразования с хи-
ные результаты свидетельствуют о формировании
Рис. 1. Зависимость рН (а) и мутности (б) системы хитозан + Asp + Н2О от массового отношения кислота/хитозан
при дробном введении раствора Asp в суспензию хитозана.
а — c′ХТЗ = 0.3 г·дл-1, cAsp = 0.2 (1), 0.4 (2) и 0.8 г·дл-1 (3); б — cAsp = 0.4 г·дл-1, c′ХТЗ = 0.3 (1), 0.2 (2), 0.1 (3)
и 0.05 г·дл-1 (4).
* Мольное отношение [Asp]/[-NH2] (моль/осново-моль) рассчитано с учетом изменения объема системы при добавлении
раствора Asp.
Получение и свойства аспарагиновокислых растворов хитозана
93
протонированной формы хитозана и соответственно
Таблица 1
ее растворении в водной среде. При таком смеще-
Степень протонирования макромолекул хитозана
нии кислотно-основного равновесия дисперсионная
в водном растворе L-аспарагиновой кислоты
среда обогащается солевыми комплексами хитоза-
α, %, при сAsp, г·дл-1
на с соответствующими противоионами ~-NH3+ +
сХТЗ, г·дл-1
0.40
0.80
+ -ООС-СН2-СН(NH2)-СООН. При m ~ 0.80-1.25 г
Asp/г ХТЗ значения рН и τ продолжают уменьшаться,
0.04
46.8
94.8
но уже не столь интенсивно (область III). Введение бо-
0.08
23.1
47.4
лее 1.25 г Asp/г ХТЗ приводит к полному растворению
0.15
12.2
25.1
полимера. Система становится оптически прозрачной,
0.30
6.10
12.2
мутность не превышает 0.03 см-1, а рН достигает
значений 3.5-3.8. Наряду с этим в интервале сAsp =
= 0.2-0.4 и сХТЗ = 0.05-0.30 г·дл-1 (отмечено *) моль-
Данные ИК-спектроскопии подтверждают элек-
ное отношение [Asp]/[-NH2] варьируется в интервале
тростатический характер взаимодействия хитозана с
0.43-5.01. Закономерно, что растворение хитозана
L-аспарагиновой кислотой, приводящего к образова-
интенсифицируется повышением концентрации Asp и
нию солевого комплекса в виде аспарагиновокислого
гидромодуля суспензий, поскольку повышается моль-
хитозана [23].
ное отношение [Asp]/[-NH2] и соответственно доля
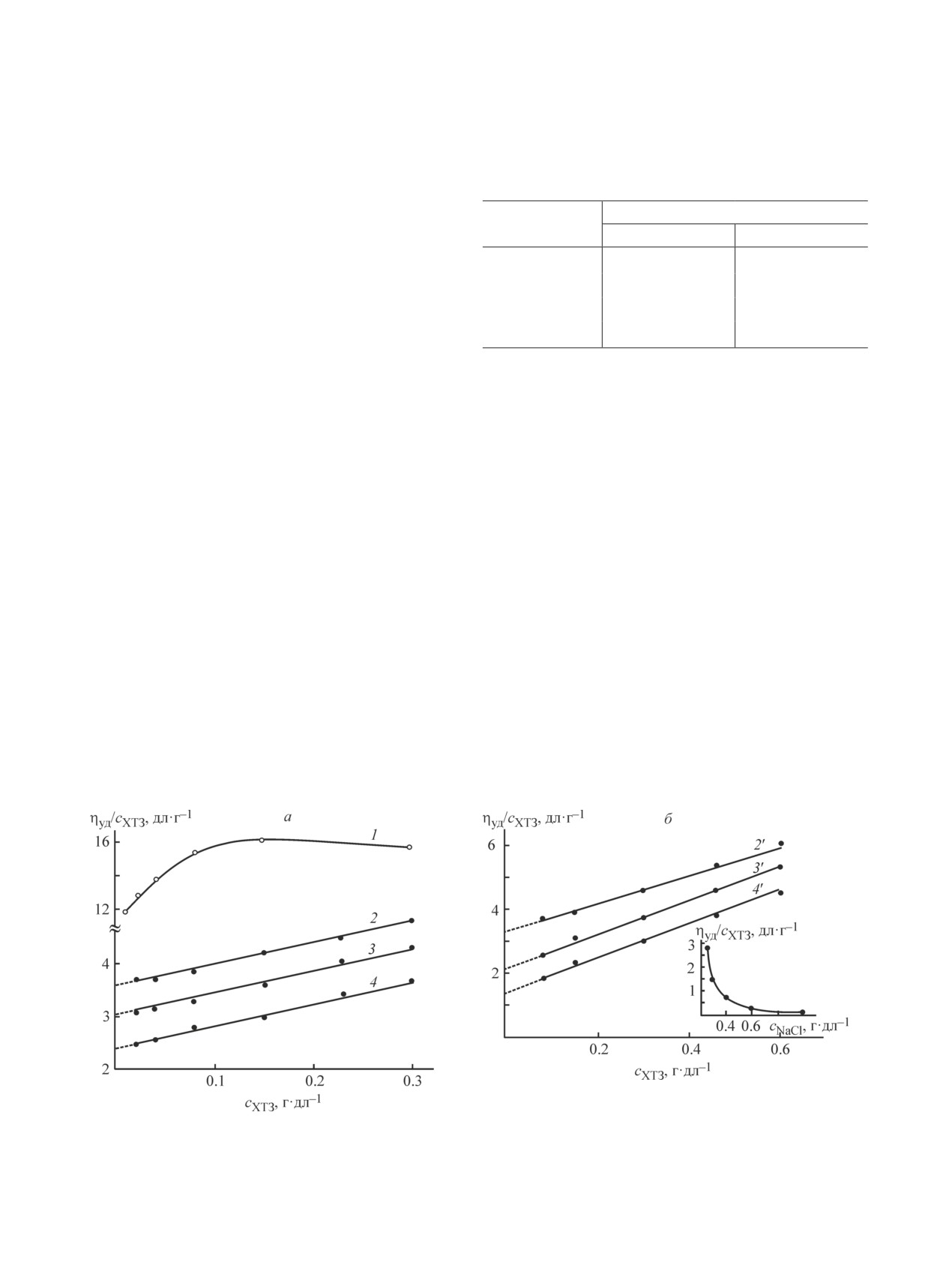
Изучение гидродинамических свойств водных рас-
протонированных аминогрупп полимера (табл. 1).
творов хитозана в Аsp показало, что макромолекулы
Таким образом, хитозан в водном растворе Asp
аспарагината хитозана проявляют свойства поли-
растворяется при рН 3.5-3.8, минимальном стехио-
электролита с частично компенсированным зарядом:
метрическом отношении [Asp]/[-NH2] ~ 0.43 (рис. 1)
число вязкости ηуд/сХТЗ возрастает при понижении
и минимальной степени протонирования ~6.1%
сХТЗ, при этом зависимость ηуд/сХТЗ = f(сХТЗ) про-
(табл. 1). Считается, что хитозан растворяется в
ходит через максимум и имеет ниспадающую ветвь
водно-кислотной среде при степени протонирования
(рис. 2, а, кривая 1). Вероятно, присутствие свобод-
≥50%, однако приведенные данные свидетельствуют
ных ионов Аsp [Kд(I) = 1.29·10-2] вызывает некото-
о возможноcти образования раствора полимера и при
рое экранирование заряда поликатиона. Вдобавок
более низком значении α. По-видимому, это связано
макромолекулы полисоли демонстрируют смешанное
с природой L-аспарагиновой кислоты, склонной к
полиэлектролит-иономерное поведение, когда лишь
биполярной ионизации в водной среде в зависимости
часть низкомолекулярных противоионов находится
от рН-раствора.
в «связанном» состоянии с макроионом. Это явление
Рис. 2. Концентрационная зависимость числа вязкости водных растворов хитозана в Asp с cАsp = 0.4 (а)
и 0.8 г·дл-1 (б) без (1) и с добавлением 0.17 М NaCl (2-4, 2′-4′) при 298 (1, 2, 2′), 308 (3, 3′) и 328 K (4, 4′).
На вставке — зависимость ηуд/cХТЗ растворов хитозана в Asp от концентрации NaCl, 298 K.
94
Луговицкая Т. Н. и др.
имеет много общего с эффектом формирования «за-
ряженных микрогелей» полисахаридов [25].
Добавление низкомолекулярной соли NaCl в рас-
твор аспарагината хитозана приводит к подавлению
полиэлектролитного эффекта и компактизации (под-
жатию) макромолекулярных клубков вплоть до пере-
хода к иономерному состоянию. При концентрации
фонового электролита cNaCl ≥ 0.8 г·дл-1 наблюдает-
ся полное подавление полиэлектролитного набуха-
ния (рис. 2, б, вставка). Зависимости числа вязкости
«нейтрализованных» макромолекул хитозана имеют
прямолинейный характер (рис. 2, а, б, кривые 2 и 2′),
который не изменяется при повышении температуры
(кривые 3, 3′, 4, 4′).
Величина предельного числа вязкости водно-со-
левого раствора аспарагината хитозана закономерно
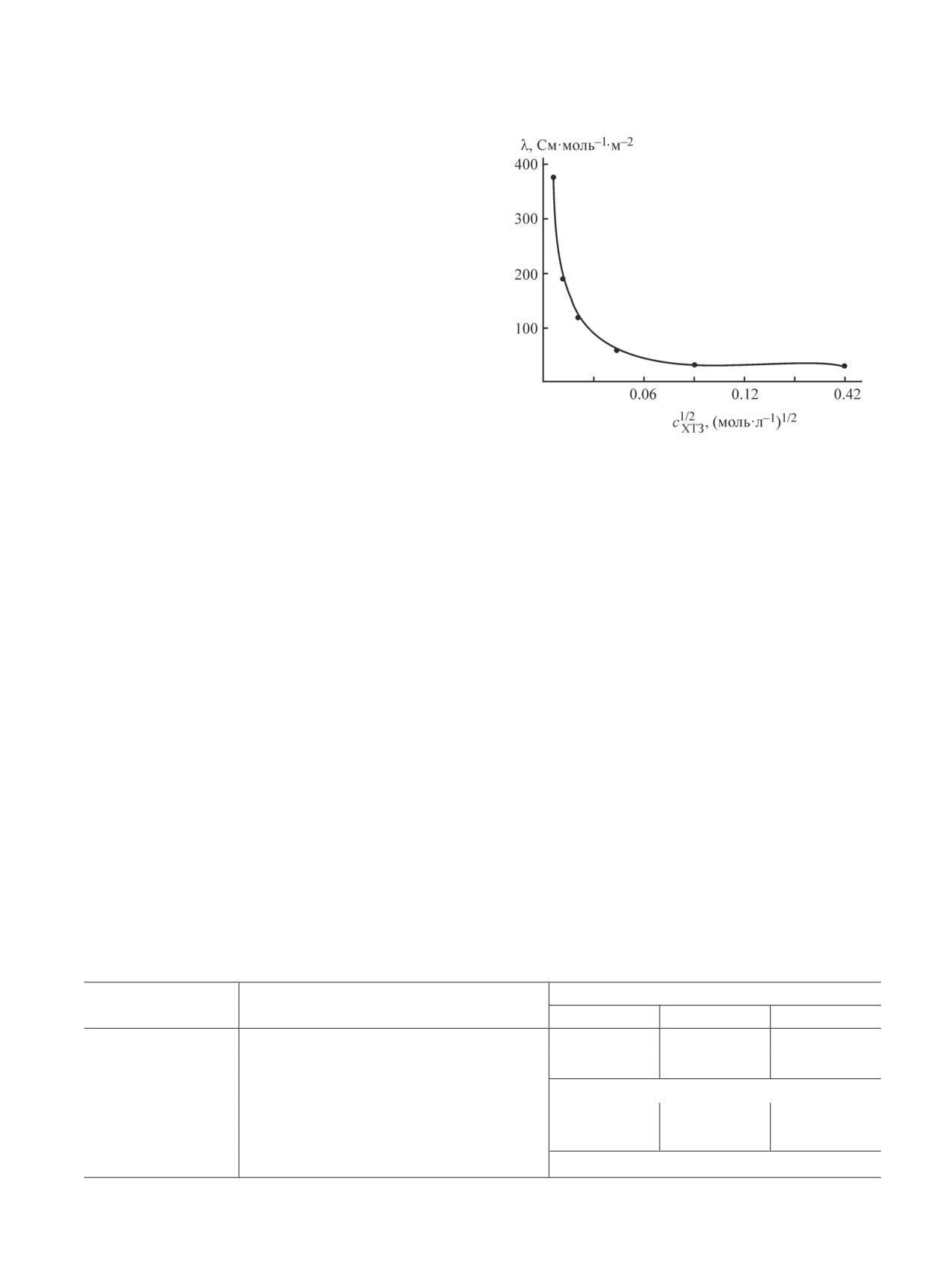
Рис. 3. Зависимость эквивалентной электропровод-
уменьшается с увеличением концентрации Аsp и тем-
ности аспарагиновокислых растворов хитозана
пературы (табл. 2), что типично для растворов хитоза-
от концентрации полимера, сАsp = 0.8 г·дл-1.
на с высокой ионной силой [15], а также неионоген-
ных полужесткоцепных природных полисахаридов
и их производных. Значения [η] растворов хитозана
Полиэлектролитная природа солевой формы хито-
в Asp во всем интервале исследуемых температур
зана обусловливает электропроводность его раство-
достаточно высокие, что обусловлено повышенной
ров. Концентрационная зависимость эквивалентной
жесткостью макроцепей хитозана. Увеличение тем-
электропроводности аспарагиновокислых растворов
пературы от 298 до 328 K приводит к возрастанию
хитозана в координатах уравнения Кольрауша типич-
константы Хаггинса.
на для слабых полиэлектролитов (рис. 3).
Температурный коэффициент предельного числа
Рассчитанные степень и условная константа дис-
вязкости растворов характеризуется отрицательны-
социации также подтверждают, что исследуемая по-
ми и большими по модулю значениями δТ (табл. 2).
лимерная соль относится к малодиссоциирующим
Отрицательный знак температурного коэффициен-
полиэлектролитам. С повышением концентрации
та [η] обусловлен уменьшением размеров макромо-
хитозана значения α′ и Kд уменьшаются, а показатель
лекулярных клубков при повышении температуры.
преломления, рН и оптическая плотность растворов
В совокупности зависимости [η] = f(Т), KХ = f(Т),
возрастают (табл. 3).
отрицательный знак δТ водно-солевых растворов ас-
Морфология порошков исходного хитозана и вы-
парагината хитозана свидетельствуют об ухудшении
деленного из аспарагиновокислого раствора суще-
взаимодействия полимер-растворитель с увеличени-
ственно различается (рис. 4). Полисоль характеризу-
ем температуры.
ется плотно упакованными микрочастицами в форме
Таблица 2
Гидродинамические параметры макромолекул хитозана в водном растворе L-аспарагиновой кислоты,
I = 0.17 моль·л-1
Температура, K
сАsp, г·дл-1
Гидродинамический параметр
298
308
328
0.4
[η], дл·дл-1
3.56
3.10
2.40
KХ
0.32
0.80
1.06
δТ·10-2, K-1
-2.1
0.8
[η], дл·дл-1
3.35
2.25
1.40
KХ
0.48
1.13
1.19
δТ·10-2, K-1
-2.0
Получение и свойства аспарагиновокислых растворов хитозана
95
Таблица 3
Физико-химические характеристики водных растворов хитозана в L-аспарагиновой кислоте концентрации
0.8 г·дл-1
Константа
Оптическая плотность
Степень
Показатель
сХТЗ, г·дл-1
диссоциации
рН
диссоциации α′, %
преломления nD
25
Kд∙103
λ = 364 нм
λ = 400 нм
0.04
60.5
3.29
1.3337
3.17
0.05
0.04
0.08
29.9
0.74
1.3337
3.25
0.08
0.05
0.15
19.3
0.45
1.3339
3.24
0.12
0.06
0.30
9.10
0.19
1.3341
3.30
0.21
0.09
0.60
5.70
0.14
1.3346
3.52
0.42
0.19
1.20
3.40
0.09
1.3357
4.82
0.99
0.45
Рис. 4. Изображения воздушно-сухих порошков, полученные с использованием растровой электронной
микроскопии: а — исходного хитозана; б, в — аспарагината хитозана, выделенного из раствора состава
сХТЗ = 0.6 г·дл-1, сАsp = 0.8 г·дл-1.
а, б — обзорный вид; в — увеличенный фрагмент участка, отмеченного на рис. 4, б.
96
Луговицкая Т. Н. и др.
Рис. 5. Фибробласты через 1 (а, в) и 72 ч (б, г) культивирования в отсутствие (контроль) и в присутствии ас-
парагиновокислого раствора хитозана, увеличение 100.
пластин размером от 45 до 80 мкм. Следует отметить
В заключение можно констатировать, что в резуль-
также однородность частиц по толщине, их взаимную
тате взаимодействия хитозана с Asp в водной среде
ориентацию и фрактальную укладку.
образуется визуально гомогенный молекулярный
В отдельной серии опытов изучена биосовме-
раствор соответствующей соли. Значения степени
стимость и антибактериальная активность водных
протонирования макромолекул зависят как от кон-
растворов аспарагината хитозана. Установлено, что
центрации хитозана в системе, так и от концентрации
добавка в питательную среду раствора полисоли по-
кислоты. Аспарагиновокислый хитозан проявляет в
ложительно влияет на скорость распластывания и
водной среде свойства полужесткоцепного полимера
пролиферацию человеческих фибробластов (рис. 5).
с высокой биологической активностью. Особенность
Так, через 1 ч культивирования в среде с добавкой
(хитозан + Аsp) наблюдалось в 4 раза больше рас-
пластанных клеток, чем в контроле (рис. 5, а, в). В те-
чение последующих 72 ч в присутствии аспарагината
хитозана формирование монослоя клеток шло также
более быстрыми темпами (рис. 5, б, г). На четвертые
сутки форма и размеры клеток зрелого монослоя
соответствовали норме, что свидетельствует о высо-
кой совместимости аспарагиновокислого хитозана с
тканями человека и об отсутствии у него цитотокси-
ческого действия.
Выявлено, что аспарагиновокислый хитозан про-
являет высокую антибактериальную активность в
отношении условно-патогенной культуры золоти-
стого стафилококка (рис. 6). Все изученные раство-
ры этой полисоли успешно угнетали рост колоний
Staphylococcus aureus 209 P. При этом формировались
Рис. 6. Зоны угнетения роста колоний референтного
чистые зоны просветления бактериального газона,
штамма Staphylococcus aureus 209 P растворами аспара-
радиус которых уменьшался по мере снижения кон-
гиновокислого хитозана концентрации 0.04 (1), 0.08 (2),
центрации аспарагиновокислого хитозана.
0.16 (3), 0.32 (4), 0.64 (5) и 1.20 г·дл-1 (6).
Получение и свойства аспарагиновокислых растворов хитозана
97
морфологии воздушно-сухих порошков полисоли при
Список литературы
их выделении из раствора проявляется в локально-на-
[1] Rinaudo M. Chitin and chitosan: properties and
правленном формировании пластинчатых ориентиро-
applications // Progress Polym. Sci. 2006. V. 31. N 7.
ванных частиц. Установленные в экспериментах хо-
P. 603-632.
рошие биологические свойства аспарагиновокислого
хитозана позволяют предполагать, что препараты из
[2] Михайлов Г. П., Тучков С. В., Лазарев В. В.,
этой полисоли будут широко востребованы в медици-
Кулиш Е. И. Комплексообразование хитозана с ук-
не, в частности, в заместительной терапии для сти-
сусной кислотой по данным Фурье-спектроскопии
муляции ткане- и остеогенеза, а также профилактики
комбинационного рассеяния света // ЖФХ. 2014.
развития раневого инфекционного процесса.
S0044453714060193 [Mikhailov G. P., Tuchkov S. V.,
Lazarev V. V., Kulish E. I. Complexation of chitosan
with acetic acid according to Fourier transform Raman
Выводы
spectroscopy data // Russ. J. Phys. Chem. 2014. V. 88.
N 6. P. 936-941.
Хитозан растворяется в водном растворе L-аспа-
рагиновой кислоты при рН 3.5-3.8 и минимальном
[3] Chaouat C., Balayssac S., Malet-Martino M., Belaubre F.,
стехиометрическом отношении [Asp]/[-NH2] ~ 0.43.
Questel E., Schmitt A. M., Poigny S., Franceschi S.,
Повышение концентрации Asp и гидромодуля суспен-
Perez E. Green microparticles based on a chitosan/
зий [вода]/[хитозан] интенсифицирует его растворе-
lactobionic acid/linoleic acid association. Characterisation
ние. Аспарагиновокислый хитозан в водной среде
and evaluation as a new carrier system for cosmetics
проявляет свойства полиэлектролита с частично ком-
// J. Microencapsul. 2017. V. 34. N 2. P. 162-170.
пенсированным зарядом. Увеличение концентрации
Asp и температуры приводит к уменьшению гидро-
[4] Федосеева Е. Н., Федосеев В. Б. Взаимодействие
динамического размера макромолекул и ухудшению
хитозана и бензойной кислоты в растворе и плен-
взаимодействия полимер-растворитель. С увеличе-
ках // Высокомолекуляр. соединения. 2011. Т. 53А.
нием концентрации водных растворов хитозана в
№ 11. С. 1900-1907 [Fedoseeva E. N., Fedoseev V. B.
Interaction of chitosan with benzoic acid in solution and
Asp уменьшаются степень протонирования, степень
films // Polym. Sci. Ser. A. 2011. V. 53. N 11. P. 1040-
и константа диссоциации, возрастают показатель
преломления, рН и оптическая плотность растворов.
[5] Sanli O., Karaca I., Isiklan N. Preparation, сharac-
Морфология выделенного из раствора аспарагиново-
terization, and salicylic acid release behavior of
кислого хитозана характеризуется плотно упакован-
chitosan/poly(vinyl alcohol) blend microspheres // J.
ными однородными микрочастицами (45-80 мкм),
Appl. Polym. 2009. V. 111. N 6. P. 2731-2740.
имеющими форму пластин с фрактальной упаковкой.
Водные растворы аспарагината хитозана проявляют
[6] Gegel N. O., Zhuravleva Yu. Yu., Shipovskaya A. B.,
антибактериальную активность и могут быть исполь-
Malinkina O. N., Zudina I. V. Influence of сhitosan
зованы для получения перспективных биологически
ascorbate chirality on the gelation kinetics and properties
активных препаратов и хитозансодержащих матери-
of silicon-chitosan-containing glycerohydrogels //
алов.
Polymers. 2018. V. 10. N 3. Р. 259-275.
[7] Гегель Н. О., Зудина И. В., Малинкина О. Н., Шипов-
Конфликт интересов
ская А. Б. Влияние изомерной формы аcкорбиновой
кислоты на антибактериальную активность ее солей
Авторы заявляют об отсутствии конфликта инте-
с хитозаном // Микробиология. 2018. Т. 87. № 5.
ресов, требующего раскрытия в данной статье.
С. 618-623.
[Gegel N. O., Zudina I. V., Malinkina O. N.,
Информация об авторах
Shipovskaya A. B. Effect of ascorbic acid isomeric
forms on antibacterial activity of its chitosan salts //
Луговицкая Татьяна Николаевна, к.т.н., вед. инж.,
org/10.1134/S0026261718050107].
Зудина Ирина Витальевна, к.б.н., вед. инж.,
[8] Bеgin А., Van Calsteren M.-R. Antimicrobial
films produced from chitosan // Int. J. Biological
Шиповская Анна Борисовна, д.х.н., проф., ORCID:
Macromolec. 1999. V. 26. N 1. P. 63-67.
98
Луговицкая Т. Н. и др.
[9] Sedyakina N. E., Zakharov A. N., Krivoshchepov A. F.,
[17]
Бобрешова О. В., Бобылкина О. В., Кулинцов П. И.,
Pribytkova A. P., Bogdanova Y. A., Feldman N. B.,
Бобринская Г. А., Варламов В. П., Немцов С. В.
Lutsenko S. V., Avramenko G. V. Effect of carbon chain
Электропроводность водных растворов низкомо-
length of dicarboxylic acids as cross-linking agents
лекулярного хитозана // Электрохимия. 2004. Т. 40.
on morphology, encapsulation, and release features
№ 7. С. 793-797 [Bobreshova O. V., Bobylkina O. V.,
of protein-loaded chitosan microparticles // Colloid
Kulintsov P. I., Bobrinskaya G. A., Varlamov V. P.,
Polym. Sci. 2017. V. 295. N 10. P. 1915-1924.
Nemtsev S. V. Conductivity of aqueous solutions of
low-molecular chitosan // Russ. J. Electrochem. 2004.
[10] Чащин И. С., Абрамчук С. С., Никитин Л. Н.
V. 40. N 7. P. 694-697.
Влияние давления на структуру композитных
хитозановых пленок, получаемых из растворов в
[18]
Васнев В. А., Тарасов А. И., Маркова Г. Д. Водо-
угольной кислоте // ДАН. 2017. Т. 475. № 3. С. 286-
нерастворимые соли хитозана с карбоновыми
кислотами // Высокомолекуляр. соединения.
[Chashchin I. S., Abramchuk S. S., Nikitin L. N. Effect
2003. Т. 45Б. № 10. С. 1791-1792 [Vasnev V. A.,
of pressure on the structure of composite chitosan
Tarasov A. I., Markova G. D. Water-insoluble chitosan
films obtained from solutions in carbonic acid // Dokl.
salts with carboxylic acids // Polym. Sci. Ser. B. 2003.
Phys. Chem. 2017. V. 475. N 1. Р. 134-137.
V. 45. N 9-10. P. 319-320].
[19]
Агеев Е. П., Вихорева Г. А., Зоткин М. А., Матуш-
[11] Rafey A., Shrivastavaa K. B. L., Iqbal S. A., Khan Z.
кина Н. Н., Герасимов В. И., Зезин С. Б., Оболон-
Growth of Ag-nanoparticles using aspartic acid in
кова Е. С. Структура и транспортные свойства
aqueous solutions // J. Сolloid Interface Sci. 2011.
хитозановых пленок, модифицированных тер-
V. 354. N 1. P. 190-195.
мообработкой // Высокомолекуляр. соединения.
2004. Т. 46А. № 12. С. 2035-2041 [Ageev E. P.,
[12] Li Q., Song B., Yang Z., Fan H. Electrolytic
Vikhoreva G. A., Zotkin M. A., Matushkina N. N.,
conductivity behaviors and solution conformations
Gerasimov V. I., Zezin S. B., Obolonkova E. S.
of chitosan in different acid solutions // Carbohydrate
Structure and transport behavior of heat-treated
Polym. 2006. V. 63. P. 272-282.
chitosan films // Polym. Sci. Ser. A. 2004. V. 46. N 12.
P. 1245-1250].
[13] Кузина Л. Г., Мурзагильдина А. С., Чернова В. В.,
[20]
Касаткина М. А., Буданцева Н. А., Кильдеева Н. Р.
Кулиш Е. И. Влияние степени протонирования хи-
Получение биологически активных пленочных ма-
тозана на некоторые его свойства // Вестн. Башкир.
териалов на основе хитозана, модифицированных
ун-та. 2012. Т. 17. № 2. С. 902-905.
полифосфатами // Хим.-фарм. журн. 2016. Т. 50.
[14] Михайлов Г. П., Лазарев В. В. Оценка энергии вну-
№ 4. С. 32-39 [Kasatkina M. A., Kil′deeva N. R.,
тримолекулярных водородных связей олигомеров
Budantseva N. A. Preparation of biologically active
// ЖФХ. 2016. Т. 90. № 7. С. 1013-1019.
film-forming materials based on polyphosphate-
modified chitosan // Phartical Chem. J. 2016.
[Mikhailov G. P., Lazarev V. V. Estimating the
V. 50. N 4. P. 250-257.
energy of intramolecular hydrogen bonds in chitosan
oligomers // Russ. J. Phys. Chem. 2016. V. 90. N 7.
[21]
Shipovskaya A. B., Rudenko D. A, Fomina V. I.,
P. 1367-1373.
Ostrovsky N. V. Structure and properties of chitosan-
based films for biomedical purposes // Eur. J. Nat.
[15] Кулиш Е. И., Чернова В. В., Володина В. П., Коле-
Hist. 2012. N 6. P. 7-12.
сов С. В. О возможных причинах «непостоянства»
[22]
Аксенова Н. А., Тимофеева В. А., Роговина С. З.,
значений характеристической вязкости хитозана //
Тимашев П. С., Глаголев Н. Н., Соловьева А. Б.
Высокомолекуляр. соединения. 2015. Т. 57А. № 5.
Особенности фотокаталитических свойств и струк-
С. 390-396.
туры порфиринсодержащих систем на основе хито-
зана // Высокомолекуляр. соединения. 2010. Т. 52Б.
[Kulish E. I., Chernova V. V., Volodina V. P.,
№ 2. С. 314-320 [Aksenova N. A., Timofeeva V. A.,
Kolesov S. U. Possible causes of «inconstancy» in the
Rogovina S. Z., Timashev P. S., Glagolev N. N.,
intrinsic viscosity of chitosan // Polym. Sci. Ser. A.
Solov′eva A. B. Photocatalytic properties and structure
2015. V. 57. N 5. P. 508-514.
of chitosan-based porphyrin-containing systems //
Polym. Sci. Ser. B. 2010. V. 52. N 1-2. P. 67-72.
[16] Kasaai M. R., Arul J. Fragmentation of сhitosan
by acids // The Scientific World J. 2013. Article ID
[23]
Луговицкая Т. Н., Шиповская А. Б. Физико-
химические свойства водных растворов L-аспара-
Получение и свойства аспарагиновокислых растворов хитозана
99
гиновой кислоты с добавкой хитозана // ЖОХ.
1985. Т. 27А. № 4. С. 857-862 [Gamzazadea A. I.,
2017. Т. 87. № 4. С. 650-656 [Lugovitskaya T. N.,
Sklyar A. M., Rogozhin S. V., Pavlova S.-S. A. Some
Shipovskaya A. B. Physicochemical properties
physico-chemical properties of solutions of hydrogen-
of aqueous solutions of L-aspartic acid containing
chloride chitosan salts // Polym. Sci. U.S.S.R. 1985.
chitosan // Russ. J. Gen. Chem. 2017. V. 87. N 4.
V. 27. N 4. P. 936-941.
P. 782-787.
[25] Rumyantsev A. M., Kramarenko E. Yu. Two regions
[24] Гамзазаде А. И., Скляр А. М., Рогожин С. В.,
of microphase separation in ion-containing polymer
Павлова С.-С. А. Некоторые физико-химиче-
solutions // Soft Matter. 2017. V. 13. Р. 6831-6844.
ские свойства растворов хлористоводородной
соли хитозана // Высокомолекуляр. соединения.