1454
Проценко В. С. и др.
Журнал прикладной химии. 2020. Т. 93. Вып. 10
УДК 544.65:621.3
ФУНКЦИОНАЛЬНЫЕ КОМПОЗИЦИОННЫЕ ПОКРЫТИЯ Ni-TiO2,
ОСАЖДЕННЫЕ ИЗ ЭЛЕКТРОЛИТА
НА ОСНОВЕ ХОЛИНСОДЕРЖАЩЕЙ ИОННОЙ ЖИДКОСТИ
© В. С. Проценко1, Д. А. Богданов1, А. А. Китык1,
С. А. Корний1,2, Ф. И. Данилов1
1 Украинский государственный химико-технологический университет,
49005, Украина, г. Днепр, пр. Гагарина, д. 8
2 Физико-механический институт им. Г. В. Карпенко НАН Украины,
79060, Украина, г. Львов, ул. Научная, д. 5
Поступила в Редакцию 24 июня 2019 г.
После доработки 3 августа 20202 г.
Принята к публикации 5 августа 2020 г.
Исследован процесс электроосаждения композиционных покрытий никель-диоксид титана из элект-
ролита на основе холинсодержащей ионной жидкости. Показано, что для повышения содержания
дисперсной фазы в композите в электролит целесообразно вводить добавку воды. Установлено воз-
растание микротвердости при включении частиц диоксида титана в никелевую матрицу. Выявлена
электрокаталитическая активность полученных покрытий в реакциях выделения водорода и кисло-
рода в щелочном водном растворе, что может быть использовано в процессах электролитического
разложения воды.
Ключевые слова: электроосаждение композиционных покрытий; ионная жидкость; покрытие ни-
кель-диоксид титана; микротвердость; электролиз воды
DOI: 10.31857/S0044461820100060
Электрохимическое осаждение металлопокрытий
скому соотношении [5, 6]. Вследствие интенсивно-
является одним из наиболее распространенных и эф-
го межмолекулярного взаимодействия компонентов
фективных способов модификации поверхности раз-
(как правило, в результате образования водородных
личных изделий и узлов, позволяющих существенно
связей) температура замерзания смеси существенно
улучшить комплекс таких функциональных свойств,
снижается в сравнении с индивидуальными состав-
как твердость, устойчивость к коррозии, износу и ряд
ляющими, и происходит электролитическая диссоци-
других. Традиционные гальванотехнические техно-
ация органических компонентов системы. Показано,
логии, как правило, основываются на использовании
что низкотемпературные эвтектические растворители
водных электролитов, достоинства которых очевид-
как специфический тип ионных жидкостей могут
ны. Однако в последнее время наметился устойчивый
быть успешно использованы для электроосаждения
интерес к разработке неводных систем, в частно-
разнообразных металлопокрытий [5, 7].
сти, на основе ионных жидкостей [1]. Так, напри-
Среди широкого спектра различных типов гальва-
мер, весьма перспективным направлением развития
ноосадков, которые можно получать с использова-
гальванотехники является разработка электролитов
нием систем на основе низкотемпературных эвтек-
для осаждения металлопокрытий на основе низко-
тических растворителей, особое место занимают
температурных эвтектических растворителей [2-4].
композиционные электролитические покрытия.
Низкотемпературные эвтектические растворители
Использование данного типа ионных жидкостей
представляют собой жидкие смеси ряда компонентов,
позволяет заметно повысить агрегативную стой-
взятых в эвтектическом или близком к эвтектиче-
кость коллоидных и суспензионных электролитов,
Функциональные композиционные покрытия Ni-TiO2, осажденные из электролита...
1455
используемых для осаждения композиционных по-
Источником дисперсной фазы TiO2 в электроли-
крытий, а также целенаправленно воздействовать на
те служил порошок Degussa P 25 (Evonik), частицы
кинетику электродных процессов и, следовательно,
которого имели средний диаметр 25-30 нм. Навеску
на комплекс физико-химических и эксплуатацион-
порошка TiO2 вводили непосредственно в приготов-
ных свойств получаемых осадков. Композиционные
ленный электролит никелирования. После этого элек-
покрытия Ni-TiO2 являются перспективным типом
тролит перемешивали механической мешалкой в те-
гальваноосадков, электроосаждение которых из вод-
чение 1 ч, затем проводили ультразвуковую обработку
ных систем неоднократно описано в литературе [8,
с помощью ультразвукового диспергатора УЗДН-А в
9]. Ранее нами [10] была показана возможность осаж-
течение 1 ч (22.4 кГц, 340 Вт·дм-3). Такая обработка
дения композитов Ni-TiO2 из электролита на основе
позволяла обеспечить равномерное распределение
низкотемпературных эвтектических растворителей и
коллоидных частиц в электролите и разрушить агре-
охарактеризованы некоторые свойства образующихся
гаты, образовавшиеся при слеживании и хранении
покрытий. Следует, однако, отметить, что серьезным
порошка [10]. Вязкость электролита измеряли при
недостатком описанных систем является довольно
помощи капиллярного вискозиметра ВПЖ-1.
малое значение содержания дисперсной фазы TiO2 в
Электроосаждение покрытий проводили на золо-
никелевой матрице (не более 2.35 мас%) [10].
той пластинке (3.54 см2), закрепленной в пластиковой
Для того чтобы повысить содержание диоксида
кассете. Перед каждым экспериментом поверхность
титана в электроосажденной Ni-матрице, целесо-
Au-электрода обрабатывали водной кашицей оксида
образным представляется добавление в электролит
магния, несколько минут протравливали в водном
на основе низкотемпературных эвтектических рас-
растворе соляной кислоты (1:1 об.) и тщательно про-
творителей определенного количества воды, что, как
мывали дистиллированной водой.
показано ранее [11, 12], благоприятно сказывается на
Электрохимический синтез покрытий, физико-хи-
процессе электроосаждения ряда металлов и сплавов.
мические свойства которых изучались в дальнейших
Цель работы — установление основных законо-
экспериментах, осуществляли путем электролиза
мерностей электроосаждения композиционных элек-
в гальваностатическом режиме по двухэлектрод-
тролитических покрытий Ni-TiO2 из электролита
ной схеме в термостатированной стеклянной ячей-
на основе низкотемпературного эвтектического рас-
ке (40°С) с использованием никелевых анодов.
творителя, содержащего добавки воды. В качестве
Применяли стабилизированный источник питания
функциональных свойств гальванопокрытий, оха-
Electronics. Электроосаждение проводили в услови-
рактеризованных в работе, выбраны микротвердость
ях непрерывного перемешивания электролита маг-
и электрокаталитическая активность в отношении
нитной мешалкой. Продолжительность электролиза
реакций выделения водорода и кислорода при элект-
подбирали таким образом, чтобы толщина получен-
ролизе воды.
ного осадка составляла около 20 мкм. Все поляри-
зационные измерения проводили с использованием
потенциостата Potentiostat/Galvanostat Reference 3000
Экспериментальная часть
(Gamry) в потенциодинамическом режиме со скоро-
При приготовлении электролитов все использо-
стью развертки потенциала 5 мВ·с-1.
ванные реактивы имели квалификацию х.ч. Низко-
Для изучения поляризационного катодного пове-
температурный эвтектический растворитель син-
дения систем при осаждении никелевых и компози-
тезировали перемешиванием хлорида холина и
ционных покрытий использовали трехэлектродную
этиленгликоля, взятых в эвтектическом соотношении,
стеклянную ячейку, термостатированную при 40°С.
равном 1:2 (мол.) соответственно [13]. К полученно-
Рабочим электродом служил свежеосажденный никель,
му растворителю (примерно половинный объем от
вспомогательный электрод — никелевая пластина,
конечного) прибавляли расчетное количество твердо-
электрод сравнения — насыщенный хлорсеребряный.
го кристаллогидрата NiCl2·6H2O и смесь тщательно
Особенности морфологии поверхности получен-
перемешивали на магнитной мешалке при 70°C до
ных покрытий изучали при помощи метода скани-
образования однородного раствора. Затем в электро-
рующей электронной микроскопии (электронный
лит вводили необходимое количество воды, пере-
микроскоп Zeiss EVO 40XVP в комплекте с пристав-
мешивали и доводили объем до заданного значения
кой для энергодисперсионной рентгеновской спект-
введением низкотемпературного эвтектического рас-
роскопии EDX, Oxford INCA Energy 350, которая
творителя. Содержание ионов Ni(II) во всех случаях
использовалась для определения химического состава
составляло 1 моль·дм-3.
полученного покрытия).
1456
Проценко В. С. и др.
Электрокаталитические характеристики получен-
ется транспорт частиц к электродной поверхности, ко-
ных композиционных покрытий на золотой подложке
торый для коллоидных частиц осуществляется главным
оценивали в реакциях катодного выделения водоро-
образом по механизму конвективной диффузии [14-16].
да и анодного выделения кислорода в электролите,
Поэтому снижение вязкости электролита, сопровожда-
содержащем 1 M NaOH, при температуре 25°С. Для
ющее введение воды в систему (табл. 1), приводит к
этого использовали трехэлектродную стеклянную
ускорению конвективного переноса и тем самым объяс-
ячейку с электродными пространствами, разделенны-
няет наблюдаемый рост содержания TiO2 в покрытии.
ми пористой стеклянной диафрагмой. Растворенный
Ранее установлено, что для внедрения в метал-
атмосферный кислород удаляли продуванием по-
лическую матрицу коллоидная частица должна за-
тока очищенного электролитического водорода.
держаться на поверхности электрода в течение неко-
Вспомогательный электрод — платиновая проволока,
торого времени [16]. По-видимому, при достаточно
электрод сравнения — насыщенный хлорсеребряный.
высоком содержании воды в системе (~12 моль·дм-3)
Электродные потенциалы приведены относительно
время задержки частиц на поверхности катода снижа-
стандартного водородного электрода.
ется (тормозится их адсорбция) из-за конкурирующей
Микротвердость осадков измеряли с помощью
адсорбции молекул воды на поверхности растущего
прибора ПМТ-3 (нагрузка 100 г), при этом покрытия
гидрофильного никеля, что и ведет к прекращению
толщиной 20 мкм осаждали на медные пластинки.
дальнейшего роста содержания TiO2 в композицион-
ных электролитических покрытиях.
При повышении концентрации частиц TiO2 в
Обсуждение результатов
электролите их концентрация в осадке возрастает
Комплекс функциональных свойств композици-
(рис. 1, а) и достигает некоторого предельного зна-
онных электролитических покрытий в значительной
чения (порядка 10 мас%). Такая зависимость естест-
степени определяется содержанием в них дисперсной
венным образом вытекает из ленгмюровского типа
фазы, включенной в металлическую матрицу, поэто-
изотермы адсорбции частиц дисперсной фазы на
му в первую очередь следует рассмотреть влияние
поверхности растущего металлического покрытия,
условий электролиза на концентрацию частиц TiO2
который, как правило, реализуется при электроосаж-
в гальваноосадке.
дении композиционных электролитических покрытий
Введение воды в электролит никелирования вы-
[14, 15, 17, 18].
зывает существенное возрастание концентрации дис-
Зависимость содержания частиц диоксида тита-
персной фазы в покрытии (табл. 1). Однако после
на в покрытиях от скорости перемешивания элект-
достижения концентрации воды около 12 моль·дм-3
ролита имеет экстремальный характер (рис. 1, б).
дальнейший рост ее содержания практически не при-
В интервале сравнительно невысоких скоростей пе-
водит к повышению содержания дисперсной фазы в
ремешивания (300-500 об·мин-1) увеличение скоро-
композиционных электролитических покрытиях. Для
сти перемешивания приводит к заметному возраста-
интерпретации полученной зависимости следует при-
нию содержания TiO2 в покрытии, что объясняется
нять во внимание, что обязательной стадией вхождения
увеличением скорости конвективного переноса к
дисперсной фазы TiO2 в металлическую матрицу явля-
электродной поверхности. Однако при дальнейшем
повышении интенсивности перемешивания происхо-
Таблица 1
дит снижение содержания диоксида титана в покры-
тии. Этот эффект может быть связан с тем, что при
Влияние концентрации воды в электролите
на содержание дисперсной фазы в покрытии
достаточно интенсивной скорости перемешивания
и вязкость электролита
радиальные потоки раствора уносят частицы дис-
в электролите 5 г·дм-3, температура
Содержание TiO2
персной фазы с поверхности, тем самым не позволяя
40°С, плотность тока 10 мА·см-2
им задержаться на ней достаточно продолжительное
Содержание воды
Содержание
Динамическая
время, необходимое для внедрения в формирующееся
в электролите,
частиц TiO2
вязкость электроли-
покрытие. Такое явление неоднократно наблюдалось
моль·дм-3
в покрытии, мас%
та, мПа·с
при электроосаждении композиционных покрытий
6
2.6
59.18
из электролитов различного состава [10, 14, 16, 19].
Наибольшее содержание TiO2 достигается при
9
8.4
48.97
плотности тока, равной 10 мА·см-2; при большей
12
10.0
42.91
либо меньшей плотности тока количество диоксида
15
10.1
17.72
титана, включающегося в осадок, снижается (табл. 2).
Функциональные композиционные покрытия Ni-TiO2, осажденные из электролита...
1457
Рис. 1. Зависимость содержания частиц диоксида титана в покрытии от концентрации дисперсной фазы в электро-
лите (а) и от скорости перемешивания электролита (б).
Плотность тока 10 мА·см-2.
а — содержание воды в электролите 12 моль·дм-3, скорость перемешивания 500 об·мин-1; б — концентрация дисперсной
фазы в электролите 5 г·дм-3, содержание воды 12 моль·дм-3.
Следует отметить, что подобного рода экстремальные
электрохимической реакции осаждения матрицы уве-
зависимости описаны в литературе для процессов
личивается в большей степени, чем скорость внедре-
электрохимического синтеза композиционных по-
ния частиц в покрытие, поэтому содержание дисперс-
крытий в условиях гальваностатического электролиза
ной фазы в композиционных покрытиях снижается.
[14]. В работе [20] влияние плотности тока на состав
Введение в низкотемпературный эвтектический
композиционных электролитических покрытий ин-
растворитель коллоидных частиц диоксида титана
терпретировано с позиции изменения соотношения
приводит к возрастанию катодной поляризации выде-
скорости включения электрохимически инертных
ления водорода и возможного электровосстановления
частиц дисперсной фазы в осадок и скорости электро-
компонентов ионной жидкости (рис. 2, кривые 1 и 2),
осаждения металлической матрицы. По-видимому,
при этом на поляризационной кривой не наблюдается
при невысоких плотностях тока увеличение плот-
возникновение дополнительных волн тока, связанных
ности тока, а значит, и катодной поляризации суще-
с разрядом титансодержащих частиц. Таким образом,
ственно ускоряет перемещение в электрическом поле
частицы диоксида титана играют роль своеобразной
коллоидных частиц, заряженных за счет адсорбции
поверхностно-активной добавки, тормозящей элек-
ионов металла на их поверхности. В результате на-
трохимическую реакцию. Отметим, что мы не наблю-
блюдается рост содержания дисперсной фазы в осад-
дали образования какого-либо осадка при электроли-
ке. Однако по мере возрастания плотности тока, на-
зе низкотемпературного эвтектического растворителя,
чиная с некоторого ее порогового значения, скорость
содержащего коллоидные частицы TiO2. Разряд ионов
никеля в этих системах протекает при потенциалах,
Таблица 2
которые более положительны, чем соответствующие
Влияние плотности тока на содержание дисперсной
восстановлению компонентов фона (рис. 2, кривая 3).
фазы в покрытии
По этой причине осаждение никелевой матрицы про-
O в электролите 5 г·дм-3
Содержание TiO2 и H2
текает с выходом по току, приближающимся к 100%
и 12 моль·дм-3 соответственно, температура 40°С,
[7, 10].
скорость перемешивания 500 об·мин-1
Введение в состав электролита никелирования на
Плотность тока,
Содержание частиц TiO2
основе низкотемпературного эвтектического раство-
мА·см-2
в покрытии, мас%
рителя добавок коллоидных частиц диоксида титана,
5
4.5
а также воды (рис. 2, кривые 4-6) приводит к некото-
рому торможению электродного процесса осаждения
10
10.0
никеля, что согласуется с приведенной выше интер-
12
9.0
претацией роли коллоидных частиц TiO2, адсорбиру-
15
5.4
ющихся на электродной поверхности, а также литера-
1458
Проценко В. С. и др.
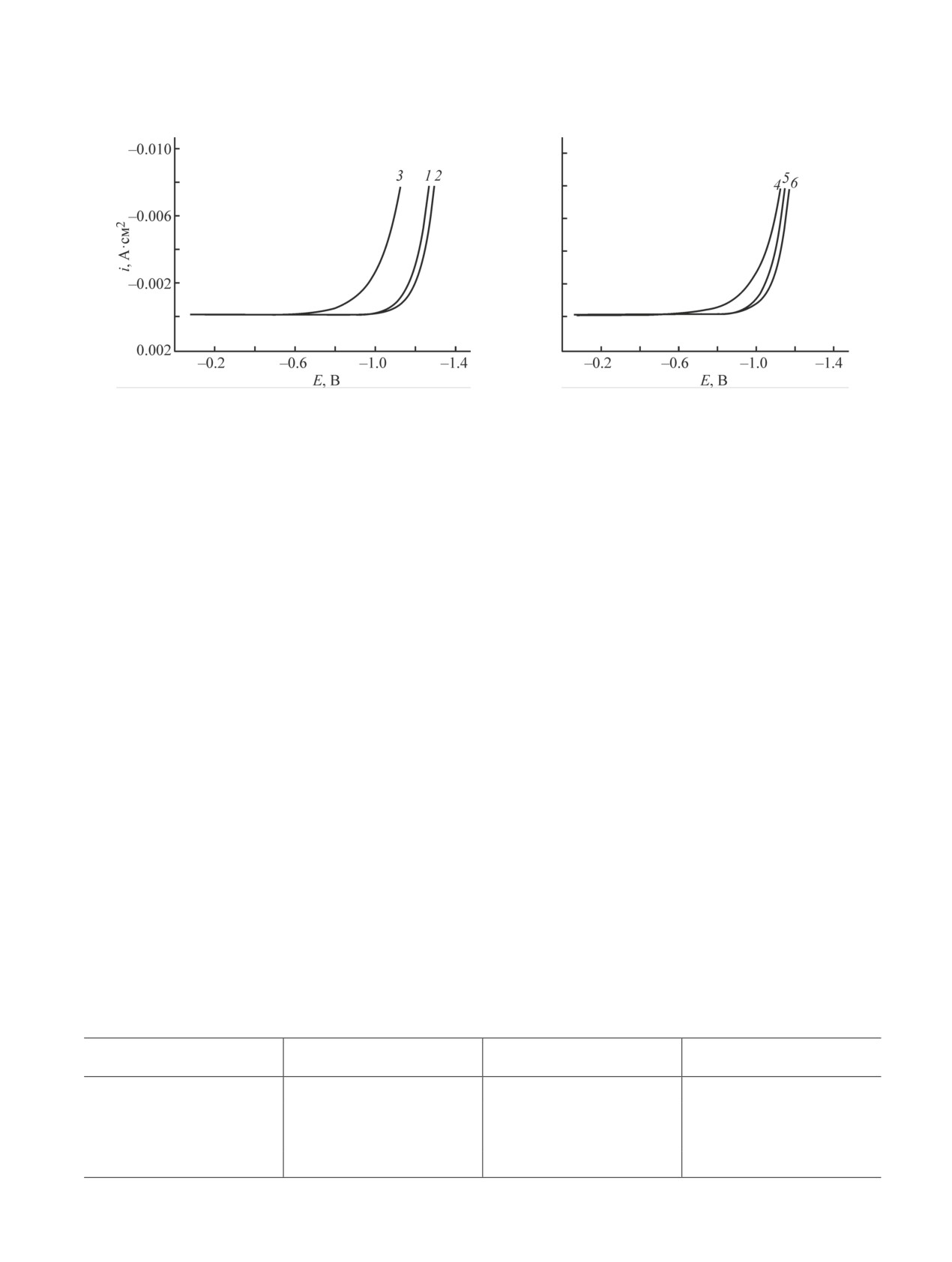
Рис. 2. Поляризационные кривые никелевого электрода в различных электролитах.
Скорость перемешивания электролита 500 об·мин-1, плотность тока 10 мА·см-2.
1 — низкотемпературный эвтектический растворитель; 2 — низкотемпературный эвтектический растворитель + 5 г·дм-3
TiO2; 3, 4 — электролит никелирования на основе низкотемпературного эвтектического растворителя без добавок;
5 — электролит никелирования на основе низкотемпературного эвтектического растворителя, содержащий 5 г·дм-3 TiO2;
6 — электролит никелирования на основе низкотемпературного эвтектического растворителя, содержащий 5 г·дм-3 TiO2
и 12 моль·дм-3 воды.
турными данными по ингибирующему влиянию воды
никеля) ведет к заметному сглаживанию поверхности
на разряд ионов никеля в данном растворителе [7].
и повышению однородности морфологии (рис. 3, г).
Таким образом, основным фарадеевским процессом
Типичный энергодисперсионный рентгеновский
при электроосаждении композиционных покрытий
спектр покрытия Ni-TiO2 (рис. 3, д) показывает при-
Ni-TiO2 является разряд ионов никеля(II).
сутствие на поверхности никеля, титана, кислорода,
Поверхность никелевого осадка, полученного из
а также следовых количеств хлора (последний, по-ви-
электролита на основе низкотемпературного эвтек-
димому, включается в осадок путем окклюзии не-
тического растворителя без введения дополнитель-
большого количества хлорид-ионов из электролита).
ного количества воды, состоит из большого числа
Поверхностная микротвердость никелевого
сфероидов, средний размер которых находится в
осадка существенно увеличивается при введении
интервале ~2-10 мкм (рис. 3, а). Также на поверх-
дополнительной воды в электролит (табл. 3), что,
ности присутствует сетка трещин. Введение воды
по-видимому, обусловлено уменьшением степени
в электролит существенно изменяет характер мор-
дефектности поверхности осадка (рис. 3, а, б). Ана-
фологии поверхности: она становится существенно
логичный эффект наблюдается и для композитов
более равномерной, сглаженной, размер зерен снижа-
Ni-TiO2. Сопоставление микротвердости никелевых
ется и практически исчезает сетка трещин (рис. 3, б).
и никель-диоксидно-титановых покрытий обнару-
Поверхность композитов Ni-TiO2 включает большое
живает существенное возрастание микротвердости
число агрегатов дисперсной фазы субмикрометрового
при электроосаждении композита (в сравнении с
размера (рис. 3, в). Введение дополнительной воды в
металлической матрицей). Такой эффект является
случае осаждения композитов (как и для «чистого»
типичным для композиционных гальваноосадков и
Таблица 3
Влияние состава электролита на микротвердость покрытий
Плотность тока 10 мА·см-2, скорость перемешивания 500 об·мин-1
Концентрация воды
Концентрация TiO2
Тип покрытия
Микротвердость, ГПа
в электролите, моль·дм-3
в электролите, г·дм-3
Ni
6
0
3.97
12
0
4.28
Ni-TiO2
6
5
5.39
12
5
7.14
Функциональные композиционные покрытия Ni-TiO2, осажденные из электролита...
1459
Рис. 3. Микрофотографии, полученные методом сканирующей электронной микроскопии, поверхности покрытий:
Ni (а, б), Ni-TiO2 (в, г); д — энергодисперсионный рентгеновский спектр поверхности образца композиционного
покрытия, изображенного на рис. 3, г.
Концентрация TiO2 электролите (г·дм-3): а, б — 0; в, г — 5; содержание воды в электролите (моль·дм-3): а, в — 6;
б, г — 12; скорость перемешивания электролита 500 об·мин; плотность тока 10 мА·см-2.
описан в литературе для разнообразных типов осад-
матрице и препятствуют движению дислокаций, тем
ков [14, 15, 18, 21, 22]. Предполагается, что причиной
самым приводя к увеличению твердости материала.
возрастания микротвердости электроосажденных
Одним из перспективных направлений практичес-
композиционных покрытий является так называемый
кого использования гальванопокрытий никелем и
эффект дисперсионного упрочнения [23-25]. Это
композитами на его основе является их применение в
явление заключается в том, что частицы внедренной
качестве электрокатализаторов, в частности, для про-
дисперсной фазы распределяются в металлической
цесса электролиза воды [26, 27]. К достоинствам тако-
1460
Проценко В. С. и др.
Рис. 4. Поляризационные кривые катодного выделения водорода (а) и анодного выделения кислорода (б) в водном
растворе 1 M NaOH при 25°С.
Концентрация TiO2 электролите 5 г·дм-3, содержание воды в электролите 12 моль·дм-3, скорость перемешивания
500 об·мин-1, плотность тока 10 мА·см-2.
Электродный материал: 1 — никелевое покрытие из водного хлоридного электролита никелирования, 2 — никелевое
покрытие из электролита на основе низкотемпературного эвтектического растворителя, 3 — композиционное покрытие
Ni-TiO2 из электролита на основе низкотемпературного эвтектического растворителя.
го типа электрокатализаторов следует отнести низкую
i > 0.1 A·см-2). Таким образом, проявляется селек-
стоимость (по сравнению с катализаторами, содержа-
тивность электрокатализатора Ni-TiO2 в отношении
щими металлы платиновой группы), достаточно вы-
различных электрохимических процессов.
сокую активность, коррозионную стойкость никеля
Достаточно высокие электрокаталитические харак-
в щелочных средах и возможность их использования
теристики композиционных гальванических осадков
как для катодной реакции выделения водорода, так
Ni-TiO2, проявляемые в реакциях электровыделения
и для анодной реакции выделения кислорода [27].
как водорода, так и кислорода, в сочетании с улучшен-
Как следует из вольт-амперных зависимостей, по-
ными механико-эксплуатационными характеристика-
лученных в 1 M NaOH (рис. 4), никелевое покрытие,
ми (повышенная твердость) позволяют предполагать,
осажденное из электролита на основе низкотемпе-
что такого рода покрытия могут быть перспективными
ратурного эвтектического растворителя, проявляет
при разработке новых электролизеров для разложе-
заметную электрокаталитическую активность в от-
ния воды, в том числе с биполярными электродами.
ношении реакций выделения водорода и кислорода.
Аналогичное явление при катодном выделении H2 бы-
Выводы
ло отмечено в работе [28], авторы которой связывают
повышенную каталитическую активность с особой
Для увеличения содержания TiO2 в композици-
нанокристаллической структурой гальваноосадка.
онных гальванопокрытиях никель-диоксид титана,
Полученные данные свидетельствуют также о том,
полученных из электролита на основе низкотемпера-
что включение частиц диоксида титана в никелевую
турного эвтектического растворителя (эвтектической
матрицу приводит к усилению электрокаталитиче-
смеси этиленгликоля и хлорида холина), целесообраз-
ской активности в отношении реакции выделения
но вводить в электролит определенное количество
водорода, что согласуется с имеющимися литератур-
воды. Установлено, что из исследуемого электролита
ными данными [29, 30]. Каталитическое действие
образуются композиционные покрытия Ni-TiO2 с од-
частиц TiO2, внедренных в металлическую электро-
нородной морфологией поверхности. Включение час-
осажденную фазу, принято связывать с наличием на
тиц диоксида титана в никелевую матрицу приводит
поверхности окислительно-восстановительных пар
к существенному возрастанию микротвердости — от
TiO2
Ti2O3
TiOOH [31].
~4 до ~5-7 ГПа.
Однако включение частиц TiO2 в никелевую мат-
Обнаружено заметное ускорение реакции элек-
рицу не приводит к возрастанию электрокаталити-
тровыделения водорода при электролизе воды при
ческой активности в реакции выделения кислорода
использовании в качестве катодов композиционных
(рис. 4, б), хотя существенно и не ослабляет его (при
покрытий Ni-TiO2, осажденных из электролита на
Функциональные композиционные покрытия Ni-TiO2, осажденные из электролита...
1461
основе низкотемпературного эвтектического раство-
Список литературы
рителя. Полученные результаты могут быть исполь-
[1]
Plechkova N. V., Seddon K. R. Applications of ionic
зованы при разработке новых типов электрокатали-
liquids in the chemical industry // Chem. Soc. Rev.
заторов для процессов электролиза воды, в том числе
2008. V. 37. P. 123-150.
и биполярных электродных материалов.
[2]
Abbott A. P., McKenzie K. J. Application of ionic
Финансирование работы
liquids to the electrodeposition of metals // Phys.
Работа проведена при финансовой поддержке
Chem. Chem. Phys. 2006. V. 8. N 37. P. 4265-4279.
Министерства образования и науки Украины (проект
[3]
Abbott A. P., Ryder K. S., König U. Electrofinishing of
0118U003398).
metals using eutectic based ionic liquids // Trans. Inst.
Met. Finish. 2008. V. 86. N 4. P. 196-204.
Конфликт интересов
Авторы заявляют об отсутствии конфликта инте-
[4]
Tomé L. I. N., Baião V., da Silva W., Brett C. M. A.
ресов, требующего раскрытия в данной статье.
Deep eutectic solvents for the production and
application of new materials // Appl. Mater. Today.
2018. V. 10. P. 30-50.
Информация о вкладе авторов
В. С. Проценко и Ф. И. Данилов спланировали
[5]
Smith E. L., Abbott A. P., Ryder K. S. Deep eutectic
эксперимент и сформулировали цель и задачи ис-
solvents (DESs) and their applications // Chem. Rev.
следования. Д. А. Богданов и А. А. Китык провели
2014. V. 114. N 21. P. 11060-11082.
эксперименты по осаждению и изучению электрока-
талитических свойств и микротвердости покрытий, а
[6]
Abbott A. P., Capper G., Davies D. L., Rasheed R. K.,
Tambyrajah V. // Chem. Commun. 2003. N 1. P. 70-
также обработали полученные данные. С. А. Корний
выполнил исследование морфологии поверхности с
[7]
Данилов Ф. И., Проценко В. С., Китык А. А.,
использованием сканирующей электронной микро-
Шайдеров Д. А., Васильева Е. А., Прамод Кумар У.,
скопии и интерпретировал полученные результаты.
Джозеф Кеннеди К. Электроосаждение нано-
В. С. Проценко занимался написанием текста статьи.
кристаллических никелевых покрытий из глу-
Все авторы участвовали в обсуждении результатов и
боко эвтектического растворителя с добавкой
формулировке выводов.
воды // Физикохимия поверхности и защита ма-
териалов. 2018. Т. 54. № 1. С. 69-77 [Danilov F. I.,
Информация об авторах
Protsenko V. S., Kityk A. A., Shaiderov D. A.,
Vasil′eva E. A., Pramod Kumar U., Joseph Kennady C.
Проценко Вячеслав Сергеевич, д.х.н., проф., про-
Electrodeposition of nanocrystalline nickel coatings
фессор кафедры физической химии Украинского госу-
from a deep eutectic solvent with water addition //
дарственного химико-технологического университета,
Prot. Met. Phys. Chem. Surf. 2017. V. 53. N 6. P. 1131-
Богданов Дмитрий Анатольевич, аспирант кафед-
[8]
Thiemig D., Bund A. Characterization of
ры физической химии Украинского государственного
electrodeposited Ni-TiO2 nanocomposite coatings //
химико-технологического университета,
Surf. Coat. Technol. 2008. V. 202. N 13. P. 2976-2984.
Китык Анна Адамовна, к.х.н., доцент, доцент ка-
[9]
Chen W., He Y., Gao W. Electrodeposition of sol-
enhanced nanostructured Ni-TiO2 composite coatings
федры физической химии Украинского государствен-
// Surf. Coat. Technol. 2010. V. 204. N 15. P. 2487-
ного химико-технологического университета,
[10]
Danilov F. I., Kityk A. A., Shaiderov D. A.,
Корний Сергей Андреевич, д.т.н., ст.н.с. Физико-
Bogdanov D. A., Korniy S. A., Protsenko V. S.
механического института им. Г. В. Карпенко НАН
Electrodeposition of Ni-TiO2 composite coatings
Украины,
using electrolyte based on a deep eutectic solvent //
Surf. Eng. Appl. Electrochem. 2019. V. 55. N 2. P. 138-
Данилов Феликс Иосифович, д.х.н., проф., дирек-
тор НИИ гальванохимии Украинского государствен-
[11]
Du C., Zhao B., Chen X.-B., Birbilis N., Yang H. Effect
ного химико-технологического университета,
of water presence on choline chloride-2urea ionic
liquid and coating platings from the hydrated ionic
1462
Проценко В. С. и др.
coatings. A review // Prot. Met. Phys. Chem. Surf.
2016. V. 52. N 2. P. 254-266.
[12]
Li R., Dong Q., Xia J., Luo C., Sheng L., Cheng F.,
Liang J. Electrodeposition of composition controllable
[22]
Baghery P., Farzam M., Mousavi A. B., Hosseini M.
ZnNi coating from water modified deep eutectic
Ni-TiO2 nanocomposite coating with high resistance
solvent // Surf. Coat. Technol. 2019. V. 366. P. 138-
to corrosion and wear // Surf. Coat. Technol. 2010.
V. 204. N 23. P. 3804-3810.
[13]
Kityk A. A., Shaiderov D. A., Vasil′eva E. A.,
Protsenko V. S., Danilov F. I. Choline chloride
[23]
Wang W., Hou F.-Y., Wang H., Guo H.-T. Fabrication
based ionic liquids containing nickel chloride:
and characterization of Ni-ZrO2 composite nano-
Physicochemical properties and kinetics of Ni(II)
coatings by pulse electrodeposition // Scr. Mater. 2005.
electroreduction // Electrochim. Acta. 2017. V. 245.
V. 53. N 5. P. 613-618.
P. 133-145.
[24]
Hou F., Wang W., Guo H. Effect of the dispersibility
[14]
Low C. T. J., Wills R. G. A., Walsh F. C.
of ZrO2 nanoparticles in Ni-ZrO2 electroplated
Electrodeposition of composite coatings containing
nanocomposite coatings on the mechanical properties
nanoparticles in a metal deposit // Surf. Coat. Technol.
of nanocomposite coatings // Appl. Surf. Sci. 2006.
2006. V. 201. N 1-2. P. 371-383.
V. 252. N 10. P. 3812-3817.
[15]
Walsh F. C., Ponce de Leon C. A review of the
[25]
Mokabber T., Rastegari S., Razavizadeh H. Effect of
electrodeposition of metal matrix composite coatings
electroplating parameters on properties of Zn-nano-TiO2
by inclusion of particles in a metal layer: An
composite coatings // Surf. Eng. 2013. V. 29. N 1. P. 41-45.
established and diversifying technology // Trans. Inst.
Met. Finish. 2014. V. 92. N 2. P. 83-98.
[26]
Safizadeh F., Ghali E., Houlachi G. Electrocatalysis
developments for hydrogen evolution reaction in
[16]
Eroglu D., West A. C. Mathematical modeling of
alkaline solutions — a review // Int. J. Hydrogen
Ni/SiC co-deposition in the presence of a cationic
Energy. 2015. V. 40. N 1. P. 256-274.
dispersant // J. Electrochem. Soc. 2013. V. 160. N 9.
[27]
Jamesh M. I. Recent progress on earth abundant
[17]
Guglielmi N. Kinetics of the deposition of inert
hydrogen evolution reaction and oxygen evolution
particles from electrolytic baths // J. Electrochem.
reaction bifunctional electrocatalyst for overall water
Soc. 1972. V. 119. N 8. P. 1009-1012.
splitting in alkaline media // J. Power Sources. 2016.
V. 333. P. 213-236.
[18]
Васильева Е. А., Сменова И. В., Проценко В. С.,
Константинова Т. Е., Данилов Ф. И. Электро-
[28]
Wang S., Zou X., Lu Y., Rao S., Xie X., Pang Z., Lu X.,
осаждение твердых композиционных покрытий
Xu Q., Zhou Z. Electrodeposition of nano-nickel in
железо-диоксид цирокния из метансульфонатного
deep eutectic solvents for hydrogen evolution reaction
электролита // ЖПХ. 2013. Т. 86. № 11. С. 1786-
in alkaline solution // Int. J. Hydrogen Energy. 2018.
1791 [Vasil′eva E. A., Smenova I. V., Protsenko V. S.,
V. 43. N 33. P. 15673-15686.
Konstantinova T. E., Danilov F. I. Electrodeposition
of hard iron-zirconia dioxide composite coatings
[29]
Kullaiah R., Elias L., Hegde A. C. Effect of TiO2
from a methanesulfonate electrolyte // Russ. J. Appl.
nanoparticles on hydrogen evolution reaction activity
Chem. 2013. V. 86. N 11. P. 1735-1740. https://
of Ni coatings // Int. J. Miner. Metall. Mater. 2018.
V. 25. N 4. P. 472-479.
[19]
Maurin G., Lavanant A. Electrodeposition of nickel/
silicon carbide composite coatings on a rotating disc
[30]
Protsenko V. S., Bogdanov D. A., Korniy S. A.,
electrode // J. Appl. Electrochem. 1995. V. 25. N 12.
Kityk A. A., Baskevich A. S., Danilov F. I. Application
of a deep eutectic solvent to prepare nanocrystalline
[20]
Ahmad Y. H., Mohamed A. M. A. Electrodeposition of
Ni and Ni/TiO2 coatings as electrocatalysts for the
nanostructured nickel-ceramic composite coatings:
hydrogen evolution reaction // Int. J. Hydrogen
A review // Int. J. Electrochem. Sci. 2014. V. 9. N 1.
Energy. 2019. V. 44. N 45. P. 24604-24616.
P. 1942-1963.
[21]
Целуйкин В. Н. О структуре и свойствах компози-
[31]
Gierlotka D., Rówiński E., Budniok A., Łagiewka E.
ционных электрохимических покрытий. Обзор //
Production and properties of electrolytic Ni-P-TiO2
Физикохимия поверхности и защита материалов.
composite layers // J. Appl. Electrochem. 1997. V. 27.
2016. Т. 52. № 2. С. 171-184 [Tseluikin V. N. On the
N 12. P. 1349-1354.
structure and properties of composite electrochemical