Журнал прикладной химии. 2020. Т. 93. Вып. 10
ОРГАНИЧЕСКИЙ СИНТЕЗ И ТЕХНОЛОГИЯ ОРГАНИЧЕСКИХ ПРОИЗВОДСТВ
УДК 547.481:547.28.02
ПОЛУЧЕНИЕ ГЛИОКСАЛЕВОЙ КИСЛОТЫ ОКИСЛЕНИЕМ ГЛИОКСАЛЯ
В ПРИСУТСТВИИ ГАЛОГЕНОВОДОРОДНЫХ КИСЛОТ
© М. А. Поздняков, И. В. Жук, А. C. Саликов, В. В. Ботвин*, А. Г. Филимошкин
Национальный исследовательский Томский государственный университет,
634050, г. Томск, пр. Ленина, д. 36
* E-mail: v.v.botvin@gmail.com
Поступила в Редакцию 28 августа 2019 г.
После доработки 3 августа 2020 г.
Принята к публикации 10 августа 2020 г.
Разработан способ синтеза глиоксалевой кислоты окислением глиоксаля азотной кислотой в при-
сутствии галогеноводородных кислот и предложен селективный способ ее выделения из реакционной
смеси в виде магниевых и кальциевых солей. Показаны особенности синтеза глиоксалевой кислоты
и определены оптимальные условия для каждой стадии процесса. Наибольший выход глиоксалевой
кислоты был получен при окислении глиоксаля смесью HNO3:HCl. Окисление в присутствии HF и HBr
характеризуется более низкими выходами вследствие их низких констант диссоциации и протекаю-
щих параллельно побочных окислительно-восстановительных реакций соответственно. Разбавленные
растворы глиоксалевой кислоты получали в ходе обменной реакции ее кальциевой соли и раствора
плавиковой кислоты при комнатной температуре. Отмечено, что увеличение температуры реакции
приводит к увеличению содержания гликолевой и щавелевой кислот, образующихся при диспропорци-
онировании глиоксалевой кислоты на начальном этапе обменной реакции.
Ключевые слова: окисление глиоксаля; глиоксалевая кислота; щавелевая кислота; соли щелочнозе-
мельных металлов
DOI: 10.31857/S0044461820100102
Глиоксалевая кислота — одна из наиболее важ-
ческие соединения: глиоксаль, малеиновую, гликоле-
ных альдегидокислот, содержащая в структуре од-
вую, щавелевую, дихлоруксусную, винную кислоты,
новременно альдегидную и карбоксильную группы.
этиленгликоль, этиловый спирт и дигалогенацетаты
Именно бифункциональность обусловливает широкое
серебра [1]. В настоящее время окисление водных
применение глиоксалевой кислоты, которая представ-
растворов глиоксаля концентрированной азотной
ляет большой интерес как для фундаментальной нау-
кислотой в присутствии соляной кислоты как спо-
ки, так и для различных отраслей промышленности.
соб получения глиоксалевой кислоты представляет
С использованием глиоксалевой кислоты производят
интерес для промышленности [2]. Процесс харак-
лекарственные препараты (метициллин, аллантоин,
теризуется довольно высокими выходами глиокса-
атенолол), ванилин, который применяют в парфюмер-
левой кислоты — около 75-90%, но в то же время в
ной, пищевой промышленности и в фармацевтике, а
литературе отсутствует информация об особенностях
также глифосат, использующийся в агрохимии [1].
протекания этого процесса в присутствии других
Для получения глиоксалевой кислоты в качестве
галогеноводородных кислот — фтороводородной и
исходных реагентов используют различные органи- бромоводородной.
1482
Получение глиоксалевой кислоты окислением глиоксаля в присутствии галогеноводородных кислот
1483
Другой сложной технологической задачей явля-
ления глиоксаля азотной кислотой в присутствии
ется разделение полученных продуктов и селектив-
галогеноводородных кислот и способа превращения
ное выделение глиоксалевой кислоты. Сложность
полученных солей в водные растворы глиоксалевой
процесса обусловлена одновременным наличием в
кислоты требуемой концентрации.
водном растворе продуктов окисления глиоксаля,
исходных и вспомогательных реагентов, целевых
Экспериментальная часть
и побочных продуктов реакции, которые зачастую
обладают схожими химическими свойствами [3].
В работе использовали: глиоксаль (38.6 мас%,
Наряду с остатками непрореагировавших глиоксаля
ρ = 1.26 г·мл-1; ООО «Новохим»), глиоксалевую кис-
и азотной кислоты основным побочным продуктом
лоту моногидрат (98 мас%; Merck), CaCl2 (ч.; ЗАО
окисления в реакционной смеси является щавелевая
«Вектон»), MgO (ч.; ЗАО «Вектон»), HNO3 (х.ч.,
кислота. Таким образом, разделение смеси целевой
с = 14.17 моль·л-1; ООО «Биохим-Реагент»), HCl
глиоксалевой кислоты и побочной щавелевой и по-
(х.ч., с = 12.07 моль·л-1; ООО «Сигма Тек»), HBr
следующее выделение глиоксалевой кислоты в виде
(ч.д.а., с = 6.15 моль·л-1; ЗАО «Вектон»), HF (ос.ч.,
водного раствора или кристаллического моногидрата
с = 28.64 моль·л-1; ООО «Сигма Тек»). Концентрации
является актуальной фундаментальной и технологи-
кислот определяли титрованием 0.1 M раствором
ческой проблемой.
NaOH с метиловым оранжевым (для HNO3 и HCl),
Одним из способов выделения глиоксалевой кис-
метиловым красным (для HBr) и фениловым красным
лоты является осаждение некоторых продуктов окис-
(для HF).
ления, основанное на малой растворимости солей
Для проведения реакции окисления глиоксаля ис-
глиоксалевой и щавелевой кислот [4]. В некоторых
пользовали стеклянный реактор с мешалкой (Globe
случаях растворимость осажденных солей может
Syrris, 0.5 л), температуру процесса устанавлива-
различаться между собой на несколько порядков, что
ли с помощью жидкостного термокриостата Termex
позволяет отделить одну соль от другой. Несмотря на
КРИО-BТ-12-1. Концентрирование водного раствора
высокую эффективность этого метода, он имеет неко-
глиоксалевой кислоты проводили в роторном испа-
торые недостатки: необходимость добавления точного
рителе Heidolph Hei-VAP Advantage, необходимое
количества осадителя в реакционную смесь, недоста-
давление устанавливали вакуумным насосом Buchi
точную селективность разделения глиоксалевой и ща-
V-710. На разных стадиях синтеза глиоксалевой
велевой кислот, а также большое количество стадий
кислоты использовались сушильный шкаф Utenos
процесса получения глиоксалевой кислоты, что вле-
Elektrotechnika, магнитная мешалка IKA C-MAG HS 4.
чет за собой неизбежные потери целевого продукта.
Анализ методом высокоэффективной жидкост-
Для устранения этих недостатков был предложен
ной хроматографии проводили на хроматографе
способ разделения глиоксалевой и щавелевой кис-
Agilent 1200 с колонкой Rezex ROA Organic Acid H +
лот как продуктов окисления глиоксаля, в котором
(300 × 7.8 мм, Phenomenex Inc.). Скорость потока
в качестве реагента-осадителя применяется MgO.
составляла 0.5 мл·мин-1, объем вводимой пробы —
В результате взаимодействия MgO с продуктами окис-
10 мкл, температура колонки — 55°С. В качестве
ления глиоксаля в реакционной смеси образуется
элюирующего растворителя использовали водный
малорастворимый осадок оксалата магния и в неболь-
раствор серной кислоты (5.0·10-3 М). ИК-спектры
ших количествах осадок Mg(OH)2, которые отделяли
регистрировали на спектрометре Agilent Cary 630
фильтрованием, а также растворимый глиоксалат
FTIR в диапазоне 4000-500 см-1, спектры ЯМР —
магния [5]. Фильтрат, содержащий глиоксалат магния,
на спектрометре Bruker AVANCE III HD (400 МГц,
обрабатывали раствором хлорида кальция для образо-
растворитель D2O).
вания малорастворимого осадка глиоксалата кальция,
Синтез глиоксалевой кислоты проводили в реак-
который отделяли фильтрованием от раствора, со-
торе с рубашкой. Реактор заполняли не более чем на
держащего остатки непрореагировавшего глиоксаля,
половину его объема. Реактор объемом 0.5 л последо-
азотной и щавелевой кислот. Также было предложено
вательно заполняли 38.6%-ным раствором глиоксаля
использовать HF на стадии превращения глиоксалата
и добавляли необходимое количество дистиллирован-
кальция в целевую глиоксалевую кислоту, что позволи-
ной воды для получения 20%-ного раствора. Смесь
ло избежать образования промежуточных продуктов.
перемешивали в течение 30 мин, затем добавляли
Цель исследования — разработка способа селек-
рассчитанное количество выбранной галогеноводо-
тивного выделения глиоксалевой кислоты в форме ее
родной кислоты (HHal) (табл. 1). В случае окисления
магниевых и кальциевых солей из продуктов окис-
в присутствии HF стеклянную колбу реактора допол-
1484
Поздняков М. А. и др.
Таблица 1
Рассчитанные объемы реагентов исходной реакционной смеси при окислении глиоксаля в присутствии
различных галогеноводородных кислот
Мольное соотношение
V(глиоксаль)
V(H2O)
V(HHal)
V(HNO3)
HHal
HHal:глиоксаль
мл
HF
0.6:1.0
85.1
99.7
14.9
50.3
1.0:1.0
81.8
95.9
24.0
48.4
1.4:1.0
78.8
92.4
32.3
46.6
HBr
0.6:1.0
69.8
81.8
57.1
41.3
1.0:1.0
60.6
71.0
82.6
35.8
1.4:1.0
53.5
62.7
102.2
31.6
HCl
0.6:1.0
78.6
92.2
32.8
46.5
1.0:1.0
72.4
84.8
50.0
42.7
1.4:1.0
66.9
78.5
65.1
39.6
нительно защищали тонким слоем полиэтиленовой
заданного значения. После достижения смесью необ-
пленки. Реактор был оборудован обратным холо-
ходимой температуры ее дополнительно перемеши-
дильником и термометром, погруженным в раствор.
вали 10 мин, затем перемешивание останавливали и
Реакционную смесь нагревали до 40 или 60°С. После
давали взвеси соли осесть в течение 30 мин, при этом
достижения требуемой температуры рассчитанное ко-
нагрев смеси не прекращали. Дозатором с наконечни-
личество HNO3 добавляли одной порцией. По оконча-
ком, предварительно нагретым до температуры сме-
нии синтеза реакционную смесь охлаждали, понижая
си, на часовые стекла переносили по 5 мл жидкости,
температуру теплоносителя с помощью термокрио-
которые высушивали в сушильном шкафу при 60°С
стата. Смесь образующихся NOх газов удаляли из
до постоянной массы. Далее смесь нагревали до сле-
реактора потоком азота, который при этом охлаждал
дующего значения температуры и отбор проб повто-
реакционную смесь и не позволял температуре повы-
ряли. Часовые стекла после 3 ч в сушильном шкафу
шаться более чем на 10-15°С.
переносили в вакуумный эксикатор и выдерживали в
По окончании выделения NOx газов при пере-
вакууме над P2O5 в течение 12 ч. Высушенные осадки
мешивании добавляли сухой MgO до достижения
взвешивали на часовых стеклах и определяли сред-
pH 7-8. Осадок, содержащий оксалат магния, а так-
нюю растворимость соли.
же избыток MgO [в том числе в форме Mg(OH)2]
Для получения разбавленного водного раствора
фильтровали. К фильтрату, содержащему глиоксалат
глиоксалевой кислоты и его дальнейшего концентри-
магния, добавляли 50%-ный водный раствор CaCl2 в
рования в пластиковый стакан объемом 1 л вносили
количестве, равном половине молярного эквивалента
50.5 г глиоксалата кальция, выделенного из продуктов
глиоксаля. Образовавшийся осадок глиоксалата каль-
окисления глиоксаля, и добавляли 505 мл дистилли-
ция фильтровали, промывали на фильтре дистилли-
рованной воды. К полученной суспензии с помощью
рованной водой, сушили и анализировали методом
дозатора по каплям при перемешивании добавляли
высокоэффективной жидкостной хроматографии.
7.9 мл концентрированного раствора HF. Осадок СаF2
Для получения 100 г глиоксалата кальция, исполь-
и непрореагировавший глиоксалат кальция фильтро-
зуемого для определения его растворимости, 84.6 г
вали, а раствор глиоксалевой кислоты концентриро-
твердого кристаллогидрата глиоксалевой кислоты
вали при 60°С и давлении 50 мбар до достижения
растворяли при перемешивании в 150 мл дистиллиро-
раствором кислоты плотности 1.34 г·мл-1, соответ-
ванной воды. Раствор обрабатывали MgO и CaCl2 по
ствующей 50%-ному водному раствору кислоты.
методике, описанной выше. Выход чистого глиокса-
лата кальция составил 98%. Для определения раство-
Обсуждение результатов
римости глиоксалата кальция 70 г соли, высушенной
до постоянной массы, вносили в 0.5 л реактор Globe
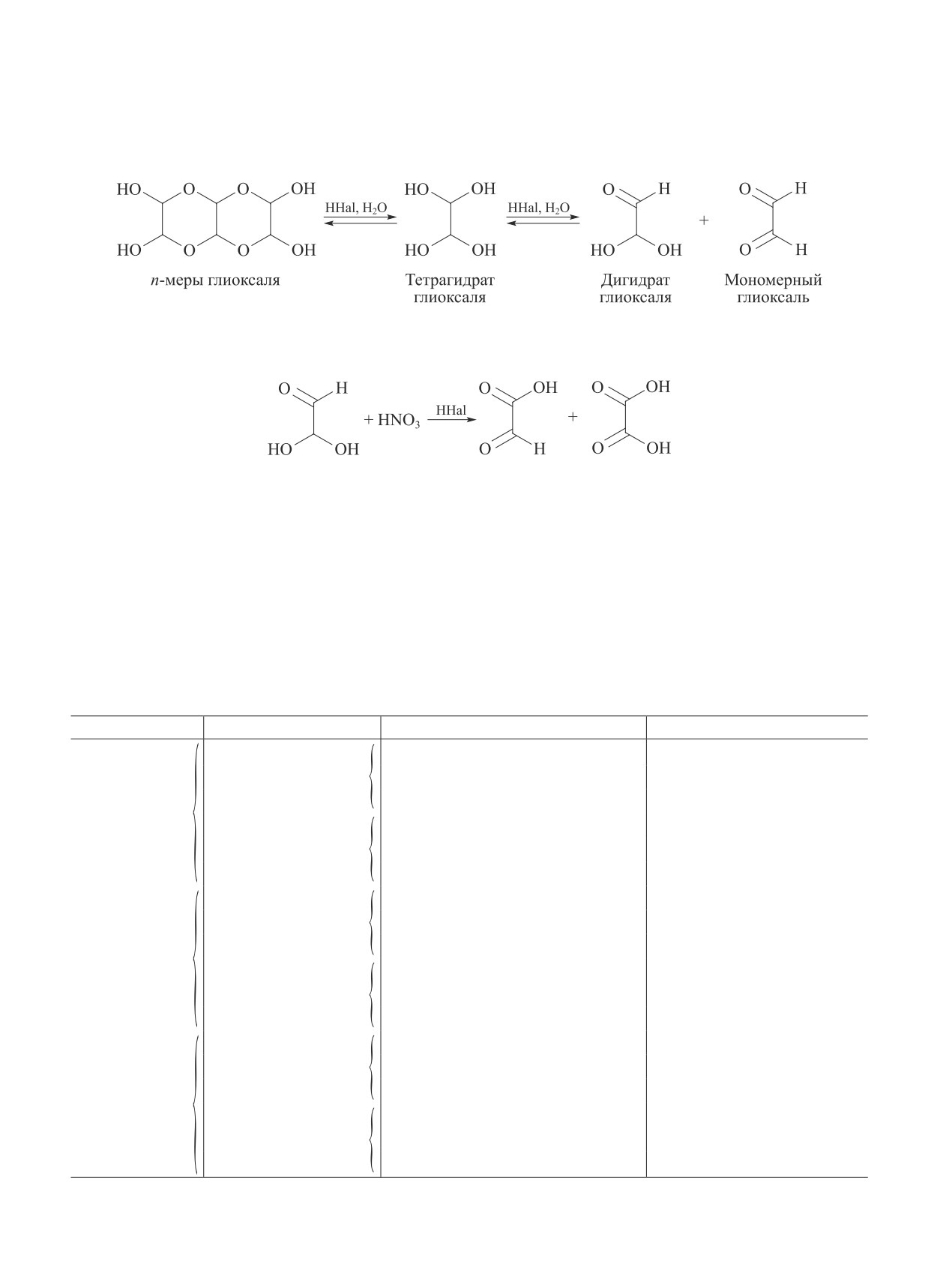
Из всех реакционноспособных форм глиоксаля
Syrris, добавляли 250 мл дистиллированной воды,
наиболее вероятной формой, которая подвергается
перемешивали и доводили температуру раствора до
окислению, является дигидрат глиоксаля, что харак-
Получение глиоксалевой кислоты окислением глиоксаля в присутствии галогеноводородных кислот
1485
Схема 1
Разрушение n-меров глиоксаля в присутствии галогеноводородных кислот
Схема 2
Окисление глиоксаля HNO3 в присутствии галогеноводородных кислот
+
терно для реакций окисления альдегидов азотной
в различных соотношениях (табл. 2). В ряду галогено-
кислотой [6]. В результате окисления дигидрата гли-
водородных кислот HF имеет самую низкую констан-
оксаля до глиоксалевой кислоты в среде HHal проис-
ту диссоциации (табл. 3), что и вызывает снижение
ходит накопление новых порций дигидрата глиоксаля
выхода глиоксалата кальция до 55.8 ± 5.7% по срав-
из тетрагидрата глиоксаля и мономерного глиоксаля
нению с синтезом с HCl (75.0 ± 2.2%). Различие в вы-
из-за смещения равновесия реакции (схема 1).
ходах глиоксалата кальция при окислении глиоксаля
Был проведен ряд экспериментов по окислению
в присутствии HHal свидетельствует о том, что сила
глиоксаля в присутствии ряда HHal (схема 2), взятых HHal, которая выступает в качестве донора протонов,
Таблица 2
Выход глиоксалата кальция при различных условиях
HHal
Температура, °С
Мольное соотношение HHal:глиоксаль
Выход глиоксалата кальция, %
0.6:1.0
28.2 ± 2.6
40
1.0:1.0
32.4 ± 3.8
1.4:1.0
34.2 ± 3.1
HF
0.6:1.0
23.0 ± 2.6
60
1.0:1.0
34.0 ± 3.3
1.4:1.0
55.8 ± 5.7
0.6:1.0
9.4 ± 0.6
40
1.0:1.0
9.7 ± 0.5
1.4:1.0
13.2 ± 1.1
HBr
0.6:1.0
12.2 ± 1.6
60
1.0:1.0
21.7 ± 2.1
1.4:1.0
32.5 ± 3.3
0.6:1.0
47.6 ± 4.2
40
1.0:1.0
51.9 ± 5.6
1.4:1.0
61.9 ± 3.7
HCl
0.6:1.0
51.7 ± 5.5
60
1.0:1.0
68.4 ± 3.5
1.4:1.0
75.0 ± 2.2
1486
Поздняков М. А. и др.
Таблица 3
HCl:HNO3. Мольное соотношение компонентов реак-
Константы диссоциации в ряду галогеноводородных
ционной смеси глиоксаль:HCl:HNO3, равное 1:1.4:1,
кислот*
позволяет достичь наибольшего выхода глиоксалата
кальция. Это обусловлено тем, что достаточная си-
HHal
Константа диссоциации
ла HCl позволяет эффективно разрушать олигомер-
HF
6.6·10-4
ные структуры глиоксаля, увеличивая содержание
HCl
1.0·107
реакционноспособных форм (дигидрата глиоксаля
HBr
1.0·109
и мономерного глиоксаля), в то же время хлорид--
анион не обладает такой сильной восстановитель-
ной способностью, как бромид-анион, что позволяет
напрямую влияет на ее способность разрушать олиго-
минимизировать вклад побочных реакций в процесс
мерные/циклические формы глиоксаля, переводя их в
окисления глиоксаля.
реакционноспособные формы (дигидрат глиоксаля и
Близость природы глиоксалевой и щавелевой кис-
мономерный глиоксаль), подвергающиеся окислению
лот, имеющих схожие химические свойства, является
(схема 1) [7]. Несмотря на наши ожидания, что HBr
причиной их сложного разделения. Тем не менее они
как наиболее сильная кислота из используемых HHal
могут быть разделены и выделены в виде солей ще-
будет способствовать увеличению выхода глиокса-
лочноземельных металлов. Согласно литературным
лата кальция за счет большей скорости накопления
данным, растворимости оксалата и глиоксалата маг-
мономерного глиоксаля, в действительности ее при-
ния в исследуемом диапазоне температур существен-
менение в процессе синтеза глиоксалевой кислоты
но различаются. Так, растворимость глиоксалата маг-
приводит к еще более низким выходам по сравнению
ния в воде при 25°С составляет 80 г в 100 мл [5], а
с окислением глиоксаля в присутствии HCl. Это мо-
растворимость оксалата магния — 0.038 г в 100 мл.**
жет быть связано с протеканием наряду с основной
Такое различие в растворимости позволило бы се-
реакцией побочной реакции окисления бромид-анио-
лективно отделять нерастворимый оксалат магния от
на Br- нитрат-анионом NO3- до молекулярного брома
растворимых продуктов реакции окисления глиокса-
[уравнение (1)] [8], что способствует, с одной сторо-
ля, включающих в себя хорошо растворимый глиокса-
ны, одновременному нецелевому расходованию сразу
лат магния. В качестве реагента-осадителя нами был
двух компонентов окисляющей смеси, приводящему
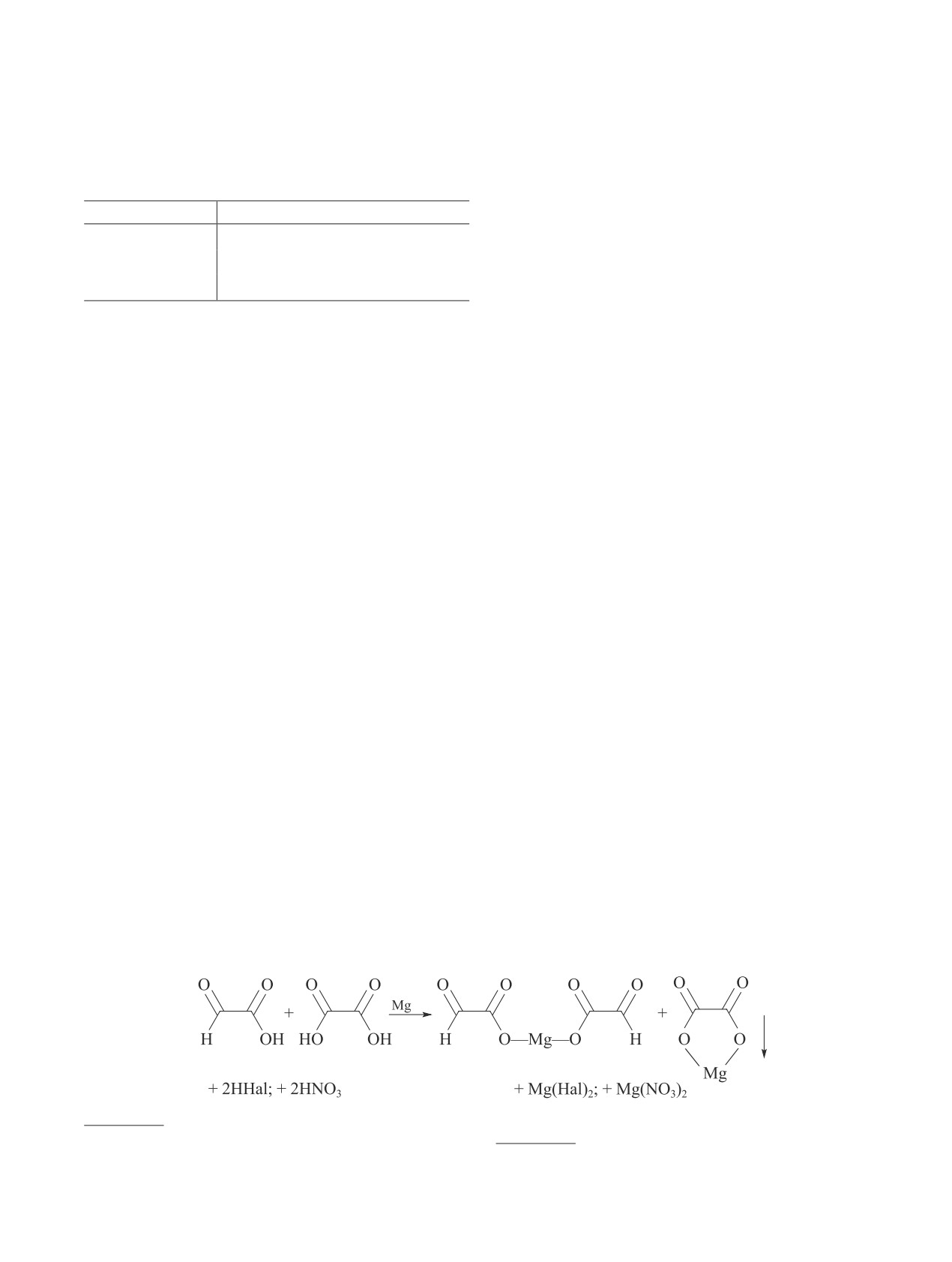
выбран MgO, который в процессе нейтрализации про-
к неполному окислению глиоксаля, с другой — не-
дуктов окисления глиоксаля переводит глиоксалевую
селективному окислению глиоксаля молекулярным
и щавелевую кислоты в их магниевые соли (схема 3).
бромом, что в совокупности и снижает выход глиок-
Оксид магния как реагент-осадитель в рассма-
салата кальция до 32.5 ± 3.3%.
триваемом процессе имеет ряд преимуществ. Он яв-
ляется нетоксичным, дешевым и доступным реаген-
2HNO3 + 2HBr = Br2 + 2H2O + 2NO2.
(1)
том. При использовании оксида магния отсутствует
Исходя из полученных данных можно предполо-
необходимость в точном расчете его количества при
жить, что оптимальными условиями для проведения
осаждении. Загрязнение осадка осадителем не влияет
процесса гомогенного окисления глиоксаля являются
на чистоту конечного продукта, так как его избыток
температура реакции 60°С и окислительная система
отделяют фильтрованием вместе с нерастворимыми
Схема 3
Нейтрализация продуктов окисления глиоксаля и выделение глиоксалевой кислоты в виде ее магниевой соли
O
* Симанова С. А. Новый справочник химика и техно-
лога. Химическое равновесие. Свойства растворов. СПб:
** Lide D. R. CRC Handbook of Chemistry and Physics.
АНО НПО «Профессионал», 2004. C. 52-55.
CRC Press, Taylor and Francis, 2009. P. 770.
Получение глиоксалевой кислоты окислением глиоксаля в присутствии галогеноводородных кислот
1487
Схема 4
Образование кальциевой соли глиоксалевой кислоты
оксидом, гидроксидом и оксалатом магния. Фильтрат,
1600 [ν(С О)]; 1388, 1315 [ν(С—О)]; 1067 см-1
содержащий преимущественно глиоксалат магния,
[δ(СН)]. Как и ожидалось, с увеличением темпера-
обрабатывают раствором хлорида кальция и выделя-
туры растворимость глиоксалата кальция возрастает
ют чистую глиоксалевую кислоту в виде ее кальцие-
(табл. 4).
вой соли (схема 4).
На основании данных о растворимости был вы-
Ранее [4] нами было предложено использовать
бран ряд температур 25, 40 и 70°С для оценки влияния
щавелевую кислоту на этапе выделения глиоксалевой
температуры на выход и чистоту глиоксалевой кис-
кислоты из ее кальциевой соли. Данный способ имеет
лоты при обработке суспензии глиоксалата кальция
существенный недостаток — при комнатной темпе-
в воде раствором HF. Образующийся при заданных
ратуре можно приготовить только 10%-ный раствор
условиях раствор глиоксалевой кислоты, полученный
щавелевой кислоты [9], что приведет к необходимо-
в ходе обменной реакции, анализировали методом
сти длительного концентрирования раствора глиок-
ЯМР-спектроскопии. На спектре ЯМР 1Н сигнал в
салевой кислоты. Для получения растворов глиокса-
области 5.0 ppm принадлежит протону метиновой
левой кислоты большей концентрации в настоящей
группы. В спектре ЯМР 13С сигнал в области 173 ppm
работе было предложено обрабатывать суспензию
принадлежит атому углерода карбоксильной группы,
глиоксалата кальция при перемешивании раствором
а сигнал между 85.5 ppm — атому углерода метино-
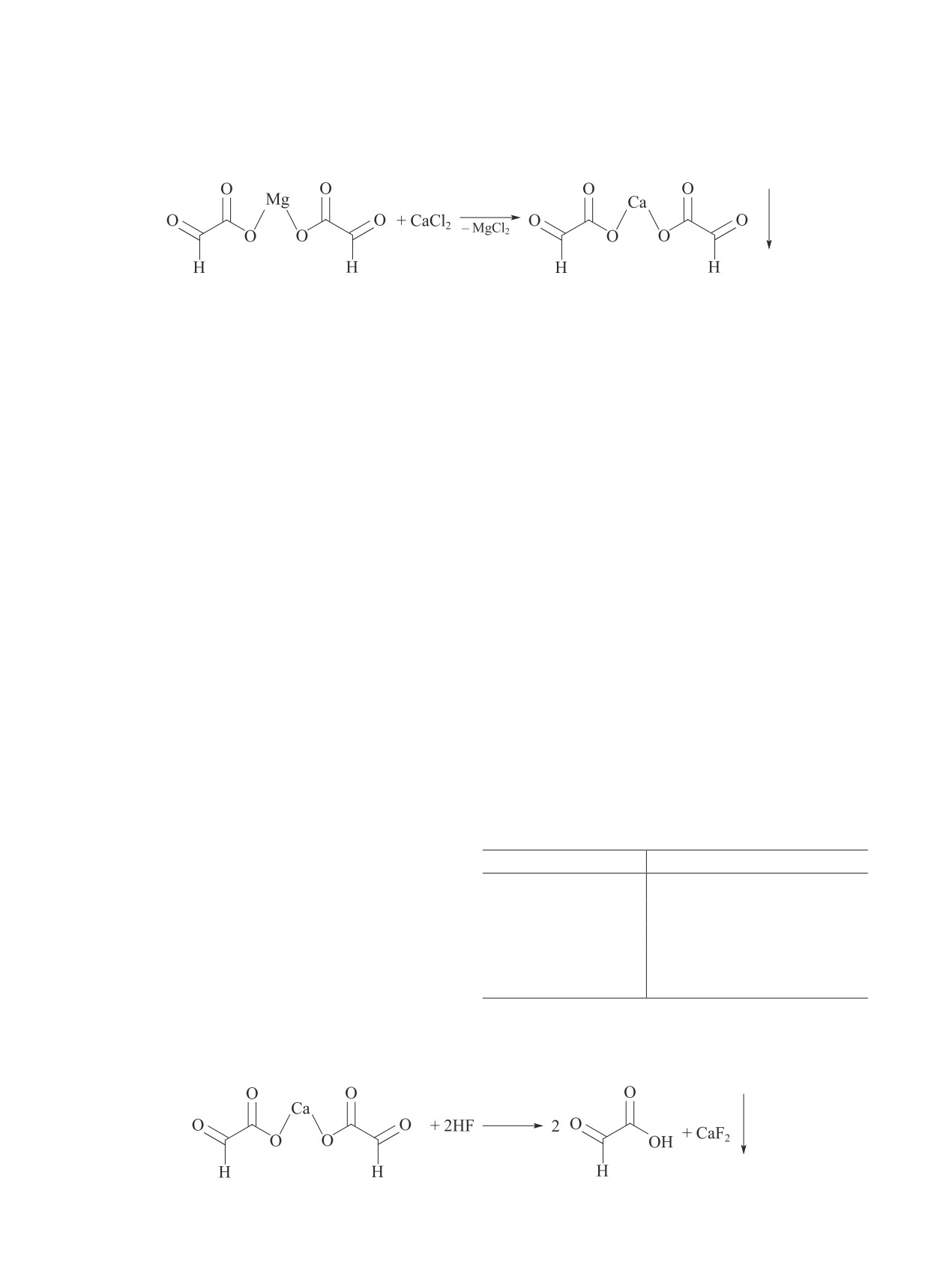
HF, который добавляется по каплям (схема 5). В ре-
вой группы глиоксалевой кислоты, существующей в
зультате такого взаимодействия образуется осадок
водном растворе в диольной форме. В растворе ме-
CaF2, который отделяют фильтрованием, а фильтрат,
тодом высокоэффективной жидкостной хроматогра-
содержащий раствор глиоксалевой кислоты, допол-
фии зафиксировано появление гликолевой кислоты,
нительно концентрируют.
хроматограммы также содержат пики, относящие-
Учитывая характер взаимодействия глиоксалата
ся к щавелевой и глиоксалевой кислотам (табл. 5).
кальция и HF, мы предположили, что полнота ре-
Наибольшее содержание глиоксалевой кислоты в
акции будет зависеть от растворимости соли глиок-
растворе наблюдается при проведении обменной ре-
салевой кислоты. Известно, что для большинства
органических и неорганических солей увеличение
Таблица 4
температуры способствует увеличению их раствори-
Растворимость глиоксалата кальция при 30-70°С
мости. К сожалению, для глиоксалата кальция есть
Температура, °С
Растворимость, г·л-1
данные о его растворимости только при 25°С [5]. Для
определения растворимости при других температу-
30
5.01 ± 0.08
рах использовали глиоксалат кальция, полученный
40
10.41 ± 0.08
из товарного моногидрата глиоксалевой кислоты.
50
13.23 ± 0.11
Структуру синтезированного глиоксалата кальция
60
15.77 ± 0.13
подтверждали методом ИК-спектроскопии в диапа-
70
19.97 ± 0.16
зоне 4000-500 см-1: 3343 [ν(ОН)]; 2767, 2702 [ν(СН)];
Схема 5
Получение водного раствора глиоксалевой кислоты
1488
Поздняков М. А. и др.
Таблица 5
Содержание кислот в растворах, полученных при различных температурах
Содержание кислоты, мас%
Tреакции, °C
глиоксалевая
щавелевая
гликолевая
25
94.5 ± 1.6
2.2 ± 0.2
3.3 ± 0.2
40
87.9 ± 1.2
5.1 ± 0.3
7.0 ± 0.5
70
78.4 ± 1.5
4.5 ± 0.4
17.1 ± 0.8
Схема 6
Диспропорционирование глиоксалевой кислоты до щавелевой и гликолевой кислот
акции при 25°C. При увеличении температуры синте-
Выводы
за происходит значительное увеличение содержания
При окислении глиоксаля в присутствии галогено-
щавелевой и гликолевой кислот в растворе, вероятно
водородных кислот наибольший выход глиоксалевой
связанное с протекающей при увеличении темпера-
кислоты может быть получен при окислении в при-
туры реакцией диспропорционирования Канницаро
сутствии HCl. Снижение выхода глиоксалевой кисло-
глиоксалевой кислоты за счет создания слабоще-
ты при окислении глиоксаля в присутствии HF и HBr
лочной среды вследствие частичной растворимости
обусловлено низкой скоростью накопления реакцион-
глиоксалата кальция (схема 6). Установлено, что pH
носпособных форм глиоксаля и протеканием побоч-
суспензии глиоксалата кальция как соли слабой кис-
ных реакций окисления соответственно. Получаемые
лоты и сильного основания на начальном этапе об-
при окислении глиоксалевая и щавелевая кислоты
менной реакции с HF в зависимости от температуры
могут быть селективно разделены обработкой реак-
находится в интервале 8.4-9.
ционной смеси оксидом магния благодаря различию
Стехиометрия реакции диспропорционирования
в растворимости их магниевых солей. Последующая
предполагает образование эквимолярного количества
обработка раствора глиоксалата магния раствором
щавелевой и гликолевой кислот. Соотношение кис-
хлорида кальция позволяет отделить глиоксалевую
лот в разбавленных растворах глиоксалевой кислоты
кислоту от остатков продуктов окисления глиоксаля в
различается вследствие различной растворимости их
виде глиоксалата кальция, обменное взаимодействие
кальциевых солей, имеющих следующие значения
которого с HF приводит к образованию водного рас-
растворимости: оксалат кальция (0.00067 г·л-1),*
твора целевой глиоксалевой кислоты. Глиоксалевая
фторид кальция (0.016 г·л-1),** глиоксалат кальция
кислота может быть получена при 25°C с высоким
(5 г·л-1), гликолят кальция (15 г·л-1) [10].
выходом и чистотой не менее 94%, тогда как уве-
В результате обменной реакции образующаяся
личение температуры обменной реакции приводит
щавелевая кислота связывается со свободными ио-
к увеличению содержания гликолевой кислоты в
нами Ca2+, образуя менее растворимый оксалат каль-
растворе вследствие протекания побочной реакции
ция, который впоследствии вместе с CaF2 отделяют
диспропорционирования глиоксалевой кислоты на
фильтрованием, что и приводит к уменьшению кон-
начальном этапе процесса.
центрации щавелевой кислоты в конечном растворе
глиоксалевой кислоты.
Финансирование работы
Работа выполнена при финансовой поддерж-
* Лурье Ю. Ю. Справочник по аналитической химии.
ке Министерства науки и высшего образования
М., Химия, 1971. С. 96.
Российской Федерации в рамках Федеральной це-
** Симанова С. А. Новый справочник химика и техно-
левой программы «Исследования и разработки по
лога. Химическое равновесие. Свойства растворов. СПб:
АНО НПО «Профессионал», 2004. C. 190.
приоритетным направлениям развития научно-тех-
Получение глиоксалевой кислоты окислением глиоксаля в присутствии галогеноводородных кислот
1489
нологического комплекса России на 2014-2020 годы»
Список литературы
(соглашение № 14.575.21.0170, уникальный иденти-
[1]
Поздняков М. А., Жук И. В., Ляпунова М. В., Са-
фикатор работ (проекта) RFMEFI57517X0170).
ликов А. C., Ботвин В. В., Филимошкин А. Г.
Глиоксалевая кислота. Способы ее получения,
выделения и кристаллизации // Изв. АН. Сер.
Конфликт интересов
хим. 2019. № 3. С. 472-479 [Pozdniakov M. A.,
Zhuk I. V., Lyapunova M. V., Salikov A. S., Botvin V. V.,
Авторы заявляют об отсутствии конфликта инте-
Filimoshkin A. G. Glyoxylic acid: Synthesis, isolation,
ресов, требующего раскрытия в данной статье.
and crystallization // Russ. Chem. Bull. 2019. V. 68.
N 3. P. 472-479.
Информация о вкладе авторов
[2]
Pat. US 8754255 B2 (publ. 2008). Process of
А. Г. Филимошкин разработал концепцию и план
preparation of glyoxylic acid aqueous solution.
экспериментов по синтезу глиоксалевой кислоты и ее
[3]
Mattioda G., Christidis Y. Glyoxylic acid // Ullmann´s
выделению из реакционной смеси продуктов окисле-
Encyclopedia of Industrial Chemistry. 2002. V. 17.
ния глиоксаля. И. В. Жук проводил эксперименты по
окислению глиоксаля в присутствии различных гало-
[4]
Pozdniakov M., Rubtsov K., Botvin V., Sorvanov A.,
геноводородных кислот при различных условиях син-
Knyazev A., Filimoshkin A. Exchange reactions
теза. В. В. Ботвин проводил эксперименты по выделе-
control for selective separation of glyoxylic acid in
нию глиоксалевой кислоты из продуктов окисления
technological mixtures of glyoxal oxidation // Sep.
глиоксаля в виде солей щелочноземельных металлов,
Sci. Technol. 2017. V. 52. N 5. P. 876-882.
интерпретировал результаты ЯМР-спектроскопии.
М. А. Поздняков выполнял эксперименты по превра-
[5]
Pat. US 8426632 B2 (publ. 2013). Crosslinking agent,
щению глиоксалата кальция в разбавленные растворы
crosslinked polymer, and uses thereof.
[6]
Ogata Y. Oxidations with nitric acid or nitrogen oxides
глиоксалевой кислоты при варьировании температу-
// Org. Chem. Part C. 1978. V. 381. P. 295-342.
ры и ее последующему концентрированию, интерпре-
тировал результаты высокоэффективной жидкостной
[7]
Поздняков М. А., Саликов А. C., Ботвин В. В.,
хроматографии и ИК-спектроскопии. А. С. Саликов
Полещук О. Х., Филимошкин А. Г. Особенности
проводил эксперименты по определению раствори-
гомогенного окисления глиоксаля до глиоксалевой
мости глиоксалата кальция при различных темпера-
кислоты // Изв. АН. Сер. хим. 2019. № 4. С. 802-
турах. Все авторы участвовали в обсуждении резуль-
808 [Pozdniakov M. A., Salikov A. S., Botvin V. V.,
татов и написании текста статьи.
Poleshchuk O. K., Filimoshkin A. G. Features of
homogeneous oxidation of glyoxal to glyoxylic acid
// Russ. Chem. Bull. 2019. V. 68. N 4. P. 802-808.
Информация об авторах
Поздняков Максим Александрович,
[8]
Lengyel I., Nagy I., Bazsa G. Kinetic study of the
autocatalytic nitric acid-bromide reaction and its
reverse, the nitrous acid-bromine reaction // J. Phys.
Жук Илья Вячеславович,
Chem. 1989. V. 93. N 7. P. 2801-2807.
Саликов Алексей Сергеевич,
[9]
Srinivasakannan C., Vasanthakumar R., Iyappan K.,
Rao P. G. A study on crystallization of oxalic acid in
Ботвин Владимир Викторович,
batch cooling crystallizer // Chem. Biochem. Eng. Q.
2002. V.16. N 3. P. 125-129.
Филимошкин Анатолий Георгиевич, д.х.н., проф.,
[10]
Пат. РФ 2541790 (опубл. 2015). Способ получения
гликолевой кислоты.