Синтез мономеров полиалкиленсилоксанов — перспективных мембранных материалов
1543
Журнал прикладной химии. 2020. Т. 93. Вып. 11
УДК 542.952, 547.89
Памяти Николая Викторовича Ушакова (04.02.1937-08.11.2019)
Николай Викторович Ушаков внес значимый вклад в развитие химии элементоуглеродных
гетероциклов. Он был великолепным экспериментатором и наставником, открывшим путь в хими-
ческую науку многим молодым исследователям. Главной его научной заслугой являются работы,
связанные с созданием методов синтеза и оценкой свойств напряженных циклических углеводо-
родных структур, включающих атом кремния в кольце. Совместно с проф. В. М. Вдовиным они
показали, что полимеризация таких систем в зависимости от строения мономера приводит к полу-
чению высокомолекулярных и олигомерных продуктов высокой ценности — низкозастывающих
эластомеров, газопроницаемых мембран, жидкокристаллических материалов. В последнее время
Николай Викторович успешно работал над созданием новых прекурсоров для кремнийуглеродных
волокон и синтезом полиметилсилаалкиленсилоксановых мембран для термопервапорационного
выделения. Следует также отметить его заслуги в методическом отношении: ему удалось усовер-
шенствовать методику проведения некоторых магнийорганических реакций, а также процессов
гидросилилирования олефинов и платиновой полимеризации силациклобутанов.
СИНТЕЗ МОНОМЕРОВ ПОЛИАЛКИЛЕНСИЛОКСАНОВ —
ПЕРСПЕКТИВНЫХ МЕМБРАННЫХ МАТЕРИАЛОВ
©
Н. В. Ушаков
, Е. Ш. Финкельштейн, Е. А. Грушевенко,
В. В. Волков, И. Л. Борисов*
Институт нефтехимического синтеза им. А. В. Топчиева РАН,
119991, г. Москва, Ленинский пр., д. 29
* E-mail: boril@ips.ac.ru
Поступила в Редакцию 5 июня 2019 г.
После доработки 2 августа 2020 г.
Принята к публикации 18 сентября 2020 г.
Синтез мономеров — ключевая и самая трудоемкая часть создания высокоселективных мембранных
полимеров. Для задач выделения паров органических компонентов из газовых смесей перспективным
является такой класс полимеров, как полиалкиленсилоксаны. В настоящей работе рассмотрены
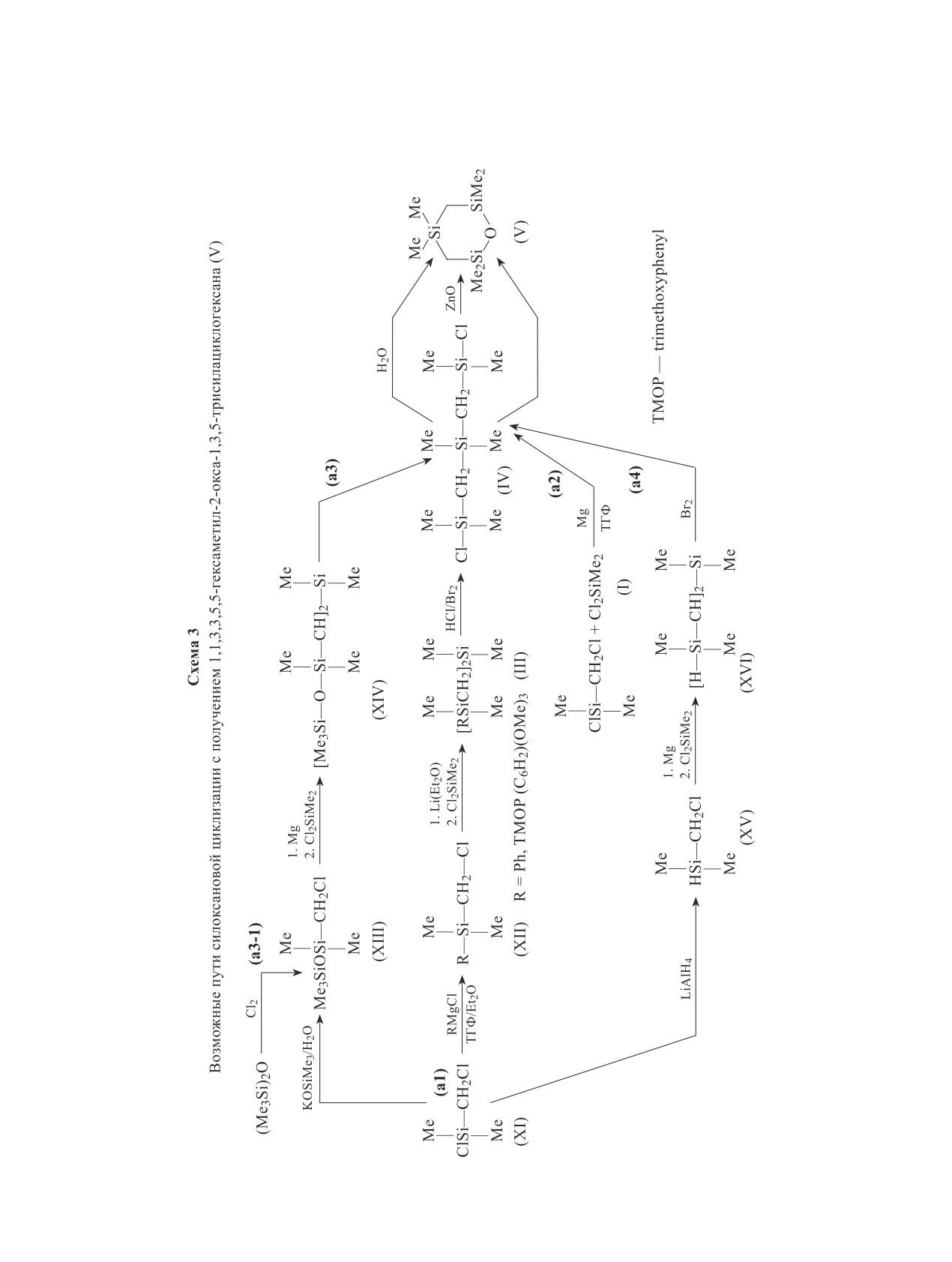
возможности двух подходов к синтезу 1,1,3,3,5,5-гексаметил-2-окса-1,3,5-трисилациклогексана мо-
номера для получения поли-бис(диметилсилметилен)диметилсилоксана — перспективного полимера
для формования газоразделительных и первапорационных мембран. Предложены модифицированные
методики синтеза, использующие оба подхода — замыкание шестичленного цикла путем образования
Si—O—Si-связи и связи Si—C. Сравнительный анализ показал, что среди методов магнийорганической
циклизации следует предпочесть одностадийный метод синтеза в растворе диэтилового эфира или
дибутилдиглима. Предложенная методика позволила достичь высоких выходов мономера — 75-80%
и выше.
Ключевые слова: синтез мономеров; 1,1,3,3,5,5-гексаметил-2-окса-1,3,5-трисилациклогексан; силок-
сановая циклизация; магнийорганическая циклизация; мембранные материалы
DOI: 10.31857/S0044461820110031
1544
Ушаков Н. В. и др.
Мембранные технологии, в частности мембранное
тиловый эластомер ДВ-5 с толщиной пленки 25 мкм,
газоразделение, активно развиваются в последние
газ-носитель — гелий, скорость подачи 0.8 мл·мин-1.
десятилетия и в настоящее время уже составляют
Исходные соединения (хлорметилдиметилхлор-
конкуренцию традиционным разделительным техно-
силан (98%, Sigma-Aldrich), диметилдихлорсилан (I)
логиям [1]. Одной из ключевых задач, стоящих перед
(98%, Sigma-Aldrich) использовались без предвари-
учеными, исследующими мембраны, является созда-
тельной подготовки. 1,3-Бис(3-хлорметил)-1,1,3,3-
ние высокоселективных мембранных материалов для
тетраметилдисилоксан (II) (97%, Alfa Aesar) пред-
конкретных разделительных задач: выделение кислых
варительно сушили гидридом кальция (93%, Acros),
газов (СО2 [2-4], SOx [5]), получение чистого водоро-
а перед употреблением перегоняли. Растворители
да [6], улавливание органических паров [7], очистка
диэтиловый эфир (х.ч., Химмед), тетрагидрофуран
сточных вод [8, 9] и др.
(х.ч., Химмед) и дибутиловый эфир диэтиленглико-
Наибольший интерес вызывают новые мембран-
ля (дибутилдиглим) (99%, Merck) абсолютировали
ные материалы, которые позволяют увеличить се-
обычными методами и перегоняли непосредственно
лективность выделения целевых компонентов при
перед использованием. Высушенный над безводным
высокой проницаемости. Примером такого рода
хлоридом кальция этилацетат также перед употреб-
материалов являются поликарбосиланы [10]. Как
лением перегоняли. При перегонке н-гексана для
было показано в работе [11] на примере полидиме-
экстракции аргон не использовали. Все операции
тилсилдиметилен- и полидиметилсилтриметиленди-
проводили в атмосфере аргона особой чистоты.
метилсилоксана (ПДМТМС), введение метиленовых
Бис(фенилдиметилсилилметил)диметилсилан (III)
групп в основную цепь полимера позволяет почти
и бис(диметилхлорсилилметил)диметилсилан (IV)
вдвое повысить селективность мембраны по смеси
были синтезированы по методу [15].
1-бутанол-вода [полидиметилсилоксан (ПДМС) —
Синтез 1,1,3,3,5,5-гексаметил-2-окса-1,3,5-три-
1.9, ПДМТМС — 3.3] при сохранении порядка ве-
силациклогексана методом силоксановой циклиза-
личины проницаемости по 1-бутанолу (ПДМС —
ции. Порошкообразный оксид цинка (ч.д.а., Химмед)
3170 Баррер, ПДМТМС — 1940 Баррер). Было
(3.0 г; 37.5 ммоль) загружали в круглодонную колбу,
отмечено, что длина метиленового мостика суще-
снабженную обратным холодильником и капельной
ственно влияет на рост селективности разделения.
воронкой, и вакуумировали 20 мин при 200°С. После
Дизайну поликарбосиланов посвящено мало работ
остывания колбу заполняли аргоном и вливали 25 мл
[12-14], поскольку синтез мономеров для дальнейшей
этилацетата (99.8%, Sigma Aldrich). В капельную во-
полимеризации и получения мембранного материа-
ронку помещали раствор 6.8 г (25 ммоль) (IV) в 12 мл
ла — сложный и трудоемкий процесс. Таким образом,
этилацетата и в течение 25 мин добавляли его в колбу
разработка и оптимизация методов синтеза новых
при перемешивании магнитной мешалкой, после чего
мономеров поликарбосилоксанов является перспек-
перемешивали еще 1 ч при комнатной температуре и
тивной с научной и практической точки зрения.
кипятили 40 мин. Остывшую смесь разбавляли 50 мл
Цель работы — оптимизация существующих
н-гексана (х.ч., Химмед), фильтровали и к фильтрату
подходов к синтезу 1,1,3,3,5,5-гексаметил-2-ок-
добавляли воду. Органический слой отделяли, а вод-
са-1,3,5-трисилациклогексана — мономера для по-
ный трижды по 40 мл экстрагировали н-гексаном.
лучения поли-бис(диметилсилметилен)диметилси-
Объединенные органические слои сушили безводным
локсана.
хлоридом кальция (ч., Ленреактив) и после удале-
ния растворителей перегоняли (т. кип. 179.5-180°С).
Выход 1,1,3,3,5,5-гексаметил-2-окса-1,3,5-трисилаци-
Экспериментальная часть
клогексана (V) 71.5%, чистота 99.5%.
Контроль чистоты полученных соединений осу-
Синтез 1,1,3,3,5,5-гексаметил-2-окса-1,3,5-три-
ществляли методом газожидкостной хроматографии
силациклогексана методом магнийорганической
на приборе Finnigan MAT 95 XL (капиллярная колон-
циклизации. В трехгорлую круглодонную колбу,
ка длиной 50 м, газ-носитель — гелий, неподвижная
снабженную обратным холодильником, термомет-
фаза OV-101) и методом хроматомасс-спектроме-
ром и градуированной капельной воронкой, по-
трии с использованием прибора Hewlet-Packard HP
мещали 5 г (0.21 г-ат) металлического магния
5971 (капиллярная колонка длиной 30 м и диаметром
(МГС-99, Вектон) и вакуумировали в течение 20 мин
0.032 см). Анализ проводили в режиме программиро-
при 250°С. Остывшую колбу заполняли аргоном и
ванного подъема температуры от 50 до 300°С со ско-
добавляли к магнию 50 мл диэтилового эфира. В гра-
ростью 7 град·мин-1, неподвижная фаза — фенилме-
дуированную капельную воронку помещали раствор
Синтез мономеров полиалкиленсилоксанов — перспективных мембранных материалов
1545
14.5 г (0.065 моль) 1,3-бис(3-хлорметил)-1,1,3,3-те-
более 3·105 г·моль-1). Структуры данных соединений
траметилдисилоксана (II) и диметилдихлорсилана (I)
приведены на схеме 1.
(0.06 моль) в 50 мл диэтилового эфира, а также 2 мл
Полимеры (VIII) и (IX) обладают высокой газо-
1,2-дибромэтана (98%, Sigma-Aldrich). В колбу вноси-
проницаемостью и селективностью в отношении
ли ~1 мл 1,2-дибромэтана и после активации магния
разделения углеводородных газов (по паре бутан/
из капельной воронки при перемешивании магнитной
метан селективность α ~ 40), а селективность поли-
мешалкой вливали 1/30 часть от объема раствора, что
мера (VIII) α = 27.2 [17]. Однако упомянутые мате-
приводило к закипанию диэтилового эфира. Когда
риалы — вязкотекучие полимеры, не содержащие
температура снижалась до 25-27°С, смесь кипятили
функциональных групп. Таким образом, они не могут
10 мин и после остывания реакционной смеси до-
образовывать устойчивые тонкие полимерные слои.
бавляли следующую порцию. Когда был добавлен
По этой причине на их основе невозможно созда-
весь раствор и реакционная смесь остыла, к ней до-
ние композиционных мембран с высокой производи-
бавляли примерно за 10 мин 1.5 мл 1,2-дибромэтана,
тельностью, подобных мембранам на основе ПДМС.
перемешивали 1.5 ч, а затем еще 50 мл н-гексана и
Нетрудно видеть, что полимерная цепь поликарбо-
фильтровали. После удаления растворителей остаток
силоксана (VI), подобно полимеру (VIII), имеет в ка-
перегоняли в инертной атмосфере при атмосферном
ждом звене между атомами кремния триметиленовую
давлении (т. кип. 179-180°С). Выход 63%, чистота
группу. Именно это обстоятельство определяет более
после еще одной перегонки 99.8%.
высокую по сравнению с ПДМС селективность (VI)
Аналогично были проведены синтезы (V) в тетра-
[16, 17]. В то же время этот полимер имеет концевые
гидрофуране и дибутилдиглиме (выходы 65 и 77%
силанольные группы и может быть вулканизирован
соответственно).
стандартными коммерчески доступными отвер-
дителями, например, на основе тетраэтоксисилана и
оловянного катализатора [16, 17]. Кроме того, нали-
Обсуждение результатов
чие силоксановой связи в основной цепи увеличивает
Гибридный — перметилированный по крем-
проницаемость полимера (VI) по сравнению с (VIII).
нию полициклокарбосилоксан - поли-бис(диме-
Таким образом, если разместить в звене полиме-
тилсилметилен)диметилсилоксан (VI) может быть
ра (IX) кислород [структура (X) на схеме 1], можно
получен двумя способами — гидролитической или
будет ожидать дальнейшего увеличения как селек-
гетерофункциональной поликонденсацией соответ-
тивности, так и проницаемости мембранного мате-
ствующих α,ω-дикремнийфункциональных произ-
риала. Поскольку для формирования мембран требу-
водных (дихлор-, диалкокси-, дигидро- и др.) (мо-
ются полимерные материалы с довольно высокими
лекулярные массы обычно до 4·104-5·104 г·моль-1)
молекулярными массами, полимер (X) желательно
и полимеризацией с раскрытием цикла соответству-
получать путем полимеризации с раскрытием цикла
ющего шестичленного 1,1,3,3-тетраметил-2-окса-1,3-
1,1,3,3,5,5-гексаметил-2-окса-1,3,5-трисилациклогек-
дисилациклогексана (VII) [16] (молекулярные массы
сана [мономера (V)] в соответствии со схемой 2.
Схема 1
Структуры поли-бис(диметилсилметилен)диметилсилоксана (VI), полидиметилсилтриметилена (VIII),
полидиметилсилметилена (IX), полидиметилсилметиленадиметилсилоксана (X)
Me
Me
Me
—Si—CH2CH2CH2—Si—O—
—Si—CH2CH2CH2—
Me
Me
x
Me
x
(VI)
(VIII)
Me
Me
Me
Me
Me
Me
—Si—CH2—Si—CH2— или —Si—CH2—
—Si—CH2—Si—CH2—Si—O—
Me
Me
x
Me
x
Me
Me
Me
x
(IX)
(X)
1546
Ушаков Н. В. и др.
Схема 2
Полимеризация 1,1,3,3,5,5-гексаметил-2-окса-1,3,5-трисилациклогексана (V) с раскрытием цикла
Существуют два основных подхода к синтезу
получения (III) используется Ph(Me2)SiCH2Li — фе-
(V), принципиально различающиеся типом реакции
нилдиметилсилилметиллитий [15] (схема 3). В ка-
завершающей стадии замыкания цикла. В первом
честве защитной группы может быть использован
подходе циклизация происходит через образование
также гидридный водород (связь Si—Н — схема 3,
Si—O—Si-связи (силоксановая циклизация) и мо-
путь a4). Образование (IV) в этом случае проходит
жет быть реализована с использованием различных
в характерной для этого метода последовательно-
исходных веществ с различными промежуточными
сти — постановка защиты [соединение (XV)], реак-
стадиями. Во втором подходе на завершающей ста-
ция реагента Гриньяра из (XV) с (I), снятие защиты.
дии циклизация происходит с образованием связи
В работе [23] была продемонстрирована возможность
Si—C (магнийорганическая циклизация). На схеме 3
замены групп, содержащих связи Si—H или Si—Ph,
в обобщенном виде представлены все известные пути
на группу Si—Br. Были протестированы четыре со-
циклизационного синтеза (V), отражающие первый
единения только со связью Si—Ph, семь соединений
подход — через образование Si—O—Si-связи.
только со связью Si—H и два соединения, содержа-
Для получения (V) (как и других циклокарбо-
щие обе защищающие связи в молекуле — Si—H и
силоксанов) замыканием цикла путем образова-
Si—Ph. Эффективным является метод защиты ато-
ния внутрициклической Si—O—Si-связи требуют-
ма кремния 4-метоксифенильной, 2,4-диметокси-
ся α,ω-дифункциональные диметилсилметилены
фенильной и 2,4,6-триметоксифенильной группами
[X(Me2)SiCH2Si(Me2)CH2(Me2)SiX], имеющие атомы
(соответственно метоксифенил, диметоксифенил
галогена или иные гидролизуемые группы (X = Cl,
и триметоксифенил) [24-26] (схема 3, путь a1, R =
Br, OMe, OEt), среди которых дигалогенпроизводные
= триметоксифенил). Однако введение этой защит-
наиболее реакционноспособны. Такие предшествен-
ной группы требует синтеза литийорганических со-
ники (V) c X = Cl, Br (IV) удобнее всего получать
единений для металлирования триметоксибензола в
путем защиты связи Si—Cl замещением хлора на
орто-положение между двумя метоксигруппами. Эти
фенильную или другую легко отщепляемую группу
операции проводятся в атмосфере инертных газов
с последующим снятием защиты (схема 3, путь a1).
особой чистоты, занимают значительное время, и для
Образование реагентов Гриньяра из хлорметильных
получения ClSi(Me2)CH2Si(Me2)Cl (XVII) (схема 3)
производных кремния осложняется их легкой окисля-
и Cl(Me2)SiCH2SiCH2(Me2)Si(Me2)Cl (IV) (схема 3)
емостью при контакте с воздухом [18] и склонностью
требуется по пять стадий (если исходить из 2,4,6-три-
к реакции сдваивания радикалов, приводящих к воз-
метоксибензола и покупного бутиллития). В резуль-
никновению соединений с группировками SiOCH2
тате общие выходы конечных продуктов (IV) и (XIV)
и SiCH2CH2Si
[19-21]. В связи с этим реакции
с чистотой более 99% составляют соответственно
нуклеофильного замещения галогена у кремния под
только ~38 и ~31%.
действием (триорганилсилилметил)магнийхлоридов
В процессе синтеза
1,1,3,3-тетраме-
следует проводить добавлением хлорметилсилильно-
тил-1,3-дисилациклобутана взаимодействием
го производного к смеси всего количества хлорсилана
ClCH2(Me2)Si(Me2)CH2Cl, Cl2SiMe2 и магния в те-
и магния. Однако этот прием не способствует замеще-
трагидрофуране одновременно реализуется путь a2
нию обоих атомов хлора в диметилдихлорсилане (I)
(схема 3) [27], и (IV) образуется с выходом 42%. Еще
на фенилдиметилсилилметильную группу действием
одной группой, защищающей связь Si—Cl, может
соответствующего реагента Гриньяра: при кипячении
служить триметилсилоксигруппа в хлорметилпента-
реакционной смеси в течение 14 дней выход (III)
метилдисилоксане (XIII), и этот метод применялся
(при R = Ph) немногим более 10% [22]. Поэтому для
в 40-50-х годах прошлого века (схема 3, путь a3).
Синтез мономеров полиалкиленсилоксанов — перспективных мембранных материалов
1547
1548
Ушаков Н. В. и др.
Схема 4
Возможные пути синтеза 1,1,3,3,5,5-гексаметил-2-окса-1,3,5-трисилациклогексана (V)
по пути образования Si—C-связи
Me
Me
Me
Mg
Cl—CH2SiCH2—Cl
+ Cl—Si—O—Si—Cl
(BuOCH2CH2)2O
(b4)
Me
Me Me
(XVII)
(XVIII)
+ (I) + Mg
(BuOCH2CH2)2O
(b3) Me Me
Me
Cl Cl
Si
H2O
+ (I) + Mg
(b1)
ClSi—CH2Cl
Et2O/ТГФ
Me2Si
SiMe2
Me2Si
SiMe2
O
Me
O
(V)
(XI)
+ (I) + Na
(b2)
(II)
PhMe Cl Cl
(b5)
Si
Si/C
MeMgX
370-390°C
Me2Si
SiMe2
O
(XIX
Защита может быть введена либо согидролизом хлор-
[14]. Если при гидролизе α,ω-дигалогенпроизводных
метилдиметилхлорсилана (XI) и триметилхлорсилана
приходится решать задачу отделения (V) от побочно
(при значительном избытке последнего), либо вза-
образующихся линейных и циклических олигомеров,
имодействием (XI) с триметилсиланолятом щелоч-
то при действии Na2O и ZnO такой проблемы не воз-
ного металла [28] (схема 3, путь a2), либо прямым
никает, так как выход (V) обычно около 90%. В экс-
хлорированием гексаметилдисилоксана в жидкой и
периментальной части приведен модифицированный
газовой фазах [29-31] (схема 3, путь a3-1). Выходы в
нами наиболее удобный метод циклизации под дей-
таких условиях составили от 20 до 65%. (XIII) легко
ствием ZnO. Оказалось, что если реакционный сосуд
образует реагент Гриньяра, который без осложнений
вместе с помещенным в него оксидом цинка прогреть
реагирует с диметилдихлорсиланом (I). Введение
перед реакцией в вакууме (250-300°С, 30-40 мин) и
галогена вместо триметилсилоксигрупп может быть
загрузку дигалогенида (IV) и растворителя (сухой
осуществлено действием эфирата трехфтористого
этилацетат) проводить после остывания и заполнения
бора [32, 33] или тионилхлорида [34].
аргоном, то выход (V) близок к количественному.
Наконец, простой одностадийный спо-
Синтезы, отражающие возможные пути получения
соб получения силметиленовых соединений
(V), когда при замыкании цикла образуется связь
ClSi(Me2)CH2Si(Me2)Cl
(XVII)
и
Si—C, приведены на схеме 4. В металлоорганических
ClSi(Me2)CH2Si(Me2)CH2(Me2)SiCl (X) (схема 3,
методах получения (V) (пути b1-b3) исходными ве-
путь a3) заключается в добавлении смеси (XI) с (XVI)
ществами являются 1,3-бис(3-хлорметил)-1,1,3,3-те-
к магнию в тетрагидрофуране [35] (схема 4, путь b1).
траметилдисилоксан (II) и диметилдихлорсилан (I).
Длительность процесса весьма велика, выходы (XVI)
Путь b1 — это магнийорганическая циклизация в
менее 15%, но используемый как один из исходных
обычно применяемых растворителях (диэтиловый
для синтеза (IV) по пути b4 (схема 4) (XVII) образу-
эфир, тетрагидрофуран), которые по уже отмеченным
ется с выходом более 40%.
ранее причинам не способствуют высоким выходам
В итоге завершающая стадия синтеза (V) — за-
(V) (около 30%) [38]. При конденсации (II) и (I) дей-
мыкание цикла с образованием связи Si—O—Si —
ствием металлического натрия в кипящем толуоле
может быть реализована тремя основными метода-
(путь b2) выход (V) также не превышает 26% [39, 40].
ми: гидролизом [36], действием оксидов щелочных
Так как выход димагнийорганического соединения из
металлов [37] и по аналогии c (VII) оксида цинка
(II), менее 20%, то при синтезах с его участием между
Синтез мономеров полиалкиленсилоксанов — перспективных мембранных материалов
1549
образованием C—Mg-связи и ее взаимодействием с
порционном добавлении смеси (II) и (I) к магнию.
Si—Cl-связью должно пройти меньшее время. Это
Десятиминутное прогревание реакционной смеси по-
можно реализовать проведением синтеза в одну ста-
сле снижения температуры от экзотермического эф-
дию, т. е. прибавлять (II) к реакционной смеси, когда
фекта при добавлении каждой порции обеспечивает
все требуемые количества металлического магния и
завершение всех реакций, приводящих к циклизации:
(I) вместе с растворителем уже находятся в реакто-
трех бимолекулярных (последовательного гетероген-
ре. Разработанная нами модификация этого метода
ного образования двух С—Mg-связей, гомогенного
(описание в экспериментальной части) заключается
нуклеофильного замещения одного атома хлора) и
в порционном добавлении смеси (II) с (I) к активи-
собственно циклизации. При этом образующийся (V)
рованному магнию и существенно повышает выход
инертен в этих условиях и разбавляет реакционную
(V) (до 70-75% чистого вещества). Путь b3 (схема 4)
смесь, так как уменьшает концентрацию исходных,
принципиально отличается от других использованием
вносимых в следующей порции смеси, что также
такого растворителя как дибутилдиглим. Еще в сере-
способствует внутримолекулярному процессу цикли-
дине 90-х годов прошлого века было установлено,
зации. Выходы (V) при проведении реакции в диэти-
что в отличие от дибутилового и других диалкиловых
ловом эфире 60-63%, в тетрагидрофуране не более
эфиров использование этого растворителя значитель-
65%, а в дибутилдиглиме достигают 75-80% и выше.
но повышает выход реагентов Гриньяра и делает
растворы магнийорганических соединений более ста-
Выводы
бильными при хранении [41]. Патент [42] содержит
примеры получения в дибутилдиглиме (т. е. по пути
Изучены различные подходы к синтезу мономера
b3 схемы 4) 1,1,3,3,5-пентаметил-2-окса-1,3,5-три-
поли-бис(диметилсилметилен)диметилсилоксана,
силациклогексана [аналога (V), выход 75%] и даже
который представляет большой интерес как потенци-
диалкил-, алкилвинил- и алкилхлорпроизводых 1-си-
альный мембранный первапорационный и газоразде-
лациклобутана — напряженного четырехчленного
лительный материал.
кремнийуглеродного гетероцикла (выходы 60-75%).
Установлено, что для получения значительных
В этом патенте предусмотрена возможность синтеза
количеств 1,1,3,3,5,5-гексаметил-2-окса-1,3,5-три-
(V) исходя из бис(хлорметил)диметилсилана (XVII)
силациклогексана путем силоксановой циклизации
и 1,1,3,3-тетраметил-1,3-дихлордисилоксана (XVIII).
наиболее приемлемым методом является синтез из
Подборка примеров, иллюстрирующих преимущества
хлорметил-пентаметилдисилоксана (c защитной три-
эфиров диглима как растворителей для реакций маг-
метилсилоксановой группой).
нийорганической циклизации представлена в работе
Другим перспективным методом синтеза явля-
[43]. Авторы [42, 43] объясняют более высокие выхо-
ется циклизация с образованием связей Si—C. Для
ды силакарбоциклов и циклокарбосилоксанов промо-
того чтобы снизить вероятность образования побоч-
тирующим действием дибутилдиглима, имеющего в
ных продуктов при магнийорганической циклизации
своей молекуле три атома кислорода, а не один, как в
1,1,3,3,5,5-гексаметил-2-окса-1,3,5-трисилациклогек-
диалкиловых эфирах или тетрагидрофуране. Не ис-
сана разработана методика синтеза, путем добавления
ключено, что образование эфиратов по двум или трем
смеси 1,3-бис(3-хлорметил)-1,1,3,3-тетраметилдиси-
атомам кислорода создает хелатирующий эффект,
локсана и диметилдихлорсилана к активированному
способствующий циклизации. Наконец, последняя из
магнию, которая позволяет достичь выхода целевого
представленных на схеме 4 возможностей получения
соединения 70-75%. Проведение данной реакции
(V) (путь b5) включает прямой синтез 1,1,3,3-тетра-
в дибутиловом эфире диэтиленгликоля приводит к
метил-5,5-дихлор-2-окса-1,3,5-трисилациклогеса-
выходам 1,1,3,3,5,5-гексаметил-2-окса-1,3,5-триси-
на (XIX) (кремний-медный сплав, 370-390°С) [вы-
лациклогексана 75-80% и выше.
ход (XIX) по газожидкостной хроматографии 58%,
Представленная в настоящей статье информа-
но выделение весьма затруднительно и приводит к
ция о путях получения 1,1,3,3,5,5-гексаметил-2-ок-
большим потерям] и реакцию последнего с MeMgX.
са-1,3,5-трисилациклогексана не охватывает все воз-
Кроме уже упомянутой модификации метода по-
можные варианты. Например, несомненный интерес
лучения (V) действием ZnO на силандихлорид (IV)
представлял бы синтез двух изомерных несимме-
(путем образования Si—O—Si-связи) нами пред-
тричных силоксанов с различным удалением хлор-
ложена модификация синтеза (V) магнийоргани-
метильной группы и Si—Cl-связи от атома кремния,
ческой циклизацией в диэтиловом эфире (или те-
связанного с кислородом, проведенный путем маг-
трагидрофуране) и дибутилдиглиме, основанная на
нийорганической циклизации.
1550
Ушаков Н. В. и др.
Благодарности
[Apel P. Yu., Bobreshova O. V., Volkov A. V., Volkov V. V.,
Работа выполнена с использованием оборудования
Nikonenko V. V., Stenina I. A., Filippov A. N., Yampolskii
ЦКП «Аналитический центр проблем глубокой пере-
Yu. P., Yaroslavtsev A. B. Prospects of membrane science
работки нефти и нефтехимии» ИНХС РАН.
development // Membr. Membr. Technol. 2019. V. 1.
N 2. P. 45-63.
Финансирование работы
[2]
Akhmetshina A. I., Yanbikov N. R., Atlaskin A. A.,
Работа выполнена при финансовой поддержке
Trubyanov M. M., Mechergui A., Otvagina K. V.,
Российского фонда фундаментальных исследований,
Razov E. N., Mochalova A. E., Vorotyntsev I. V. Acidic
проект № 18-08-01099.
gases separation from gas mixtures on the supported
ionic liquid membranes providing the facilitated and
solution-diffusion transport mechanisms // Membranes.
Конфликт интересов
2019. V. 9. N 1. P. 9.
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
[3]
Borisov I., Bakhtin D., Luque-Alled J. M., Rybakova A.,
Makarova V., Foster A. B., Harrison W. J., Volkov V.,
Polevaya V., Gorgojo P., Prestat E. M., Budd P.,
Информаци о вкладе авторов
Volkov A. Synergistic enhancement of gas selectivity
Н. В. Ушаков — идея синтеза циклокарбосилокса-
in thin film composite membranes of PIM-1 // J. Mater.
на, разработка методик и синтез образцов циклокар-
Chem. A. 2019. V. 7. P. 6417-6430.
босилоксана, обработка полученных данных, участие
[4]
Сторожук И. П., Павлюкович Н. Г., Коробкина А. В.,
в написании статьи; Е. Ш. Финкельштейн — идея
Каграманов Г. Г. Полиарилат-полиэтиленоксидные
синтеза циклокарбосилоксана, обработка получен-
блок-сополимеры для мембранного выделения диок-
ных данных; Е. А. Грушевенко — синтез образцов
сида углерода из газовых смесей // Мембраны и мем-
циклокарбосилоксана, участие в написании статьи и
бран. технологии. 2020. Т. 10. № 2. С. 83-87. https://
ее подготовка к публикации; В. В. Волков — обработ-
ка полученных данных, участие в написании статьи;
Pavlukovich N. G., Korobkina A. V., Kagramanov G. G.
И. Л. Борисов — идея синтеза циклокарбосилоксана,
Polyarylate-poly(ethylene oxide) block copolymers
разработка методик и синтез образцов циклокарбоси-
for membrane separation of carbon dioxide from gas
локсана, написание текста статьи и ее подготовка к
mixtures // Membr. Membr. Technol. 2020. V.2. P. 71-
публикации. Все авторы участвовали в обсуждении
результатов.
[5]
Rasmussen S. B., Huang J., Riisager A., Hamm H.,
Rogez J., Winnick J., Wassserscheid P., Fehrmann R.
Flue gas cleaning with alternative processes and
Информация об авторах
reaction media // ECS Transactions. 2007. V. 3. N 35.
Ушаков Николай Викторович, к.х.н.,
[6]
Лыткина А. А., Орехова Н. В., Ермилова М. М.,
Петриев И. С., Барышев М. Г., Ярославцев А. Б.
Финкельштейн Евгений Шмерович, д.х.н, проф.,
Паровой риформинг метанола на катализаторах на
основе ZrO2 в традиционном и мембранном реакто-
Грушевенко Евгения Александровна, ORCID:
рах // Мембраны и мембран. технологии. 2017. Т. 7.
№ 6. С. 398-407.
Волков Владимир Васильевич, д.х.н., проф.,
[Lytkina A. A., Orekhova N. V., Ermilova M. M.,
Борисов Илья Леонидович, к.х.н.,
Yaroslavtsev A. B., Petriev I. S., Baryshev M. G.
Methanol steam reforming over ZrO2-supported
catalysts in conventional and membrane reactors //
Petrol. Chem. 2017. V. 57. N 13. P. 1219-1227.
Список литературы
[1] Апель П. Ю., Бобрешова О. В., Волков А. В., Вол-
[7]
Aydin S., Yesil H., Tugtas A. E. Recovery of mixed
ков В. В., Никоненко В. В., Стенина И. А., Филип-
volatile fatty acids from anaerobically fermented
пов А. Н., Ямпольский Ю. П., Ярославцев А. Б.
organic wastes by vapor permeation membrane
Перспективы развития мембранной науки // Мемб-
contactors // Bioresource Technol. 2018. V. 250. P. 548-
раны и мембран. технологии. 2019. Т. 9. № 2. С. 59-
Синтез мономеров полиалкиленсилоксанов — перспективных мембранных материалов
1551
[8]
Грушевенко Е. А., Подтынников И. А., Борисов И. Л.
umlagerung des 1,1,3,3,4,4-hexamethyl-1,3,4-
Высокоселективная первапорационная мембра-
trisilacyclopentan // Z. Anorg. Allgem. Chem. 1976.
на для выделения 1-бутанола из водных стоков //
V. 419. P. 249-252.
ЖПХ. 2019. Т. 92. № 11. С. 1488-1496.
[16]
Борисов И. Л., Ушаков Н. В., Волков В. В., Фин-
[Grushevenko E. A., Podtynnikov I. A., Borisov I. L.
кельштейн Е. Ш. Полидиметилсилдиметилен и
High-selectivity pervaporation membranes for
полидиметилсилтриметилендиметилсилокса-
1-butanol removal from wastewater // Russ. J. Appl.
ны — материалы для сорбционно селективных
Chem. 2019. V. 92. N 11. P. 1593-1601.
мембран // Изв. АН. Сер. хим. 2016. № 4. С. 1020-
1022 [Borisov I. L., Ushakov N. V., Volkov V. V.,
[9]
Смирнова Н. Н. Первапорационные мембраны на
Finkelshtein E. S. Polydimethylsildimethylen and
основе интерполиэлектролитных комплексов аро-
polydimethylsiltrimethylendimethylsiloxanes —
матического сополиамида, содержащего сульфо-
materials for sorbtion selective membranes // Russ.
натные и карбоксильные группы // ЖПХ. 2019.
Chem. Bull. 2016. V. 65. N 4. P. 1020-1022. https://
Т. 92. № 2. С. 191-196.
[17]
Финкельштейн Е. Ш., Ушаков Н. В., Крашенин-
[Smirnova N. N. Pervaporation membranes based
ников Е. Г., Ямпольский Ю. П. Новые поли-
on interpolyelectrolyte complexes of an aromatic
силалкилены, синтез и газоразделитель-
copolyamide containing sulfonate and carboxy groups
ные свойства // Изв. АН. Сер. хим. 2004. № 11.
// Russ. J. Appl. Chem. 2019. V. 92. N 2. P. 222-227.
С. 2497-2503 [Finkelshtein E. S., Ushakov N. V.,
Krasheninnikov E. G., Yampolskii Y. P. New
[10]
Finkelshtein E. S., Ushakov N. V., Gringolts M. L.
polysilalkylenes: Synthesis and gas-separation
Polycarbosilanes Based on Silicon-Carbon Cyclic
properties // Russ. Chem. Bull. 2004. V. 53. N 11.
Monomers // Silicon Polymers. Berlin: Springer, 2010.
P. 2604-2610.
[11]
Борисов И. Л., Ушаков Н. В., Волков В. В., Фин-
[18]
Eisch J. J., Hask G. R. Rearrangement of
кельштейн Е. Ш. Полидиметилсилалкилен-ди-
hydroperoxide salts in the oxidation of α-trialkysilyl
метилсилоксаны в качестве перспективных мем-
organometallic compounds // J. Org. Chem. 1964.
бранных материалов для термопервапорационного
V. 29. P. 254-256.
выделения оксигенатов из реакционных водных
сред // Нефтехимия. 2016. Т. 56. № 6. С. 578-
[19]
Wittenberg D., Gilman H. An Intramolecular
cleavage-cyclization reaction of silicon-containing
[Borisov I. L., Ushakov N. V., Volkov V. V.,
organolithium compounds // J. Am. Chem. Soc. 1958.
Finkelʹshtein E. Sh. Polydimethylsilalkylene-
V. 80. P. 2677-2680.
dimethylsiloxanes as advanced membrane materials
for thermopervaporative recovery of oxygenates from
[20]
Hauser C. R., Hance C. R. Preparation and reactions
aqueous reaction media // Petrol. Chem. 2016. V. 56.
of α-halo derivatives of certain tetra-substituted
N 9. P. 798-804.
hydrocarbon silanes. Grignard syntheses of some
silyl compounds // J. Am. Chem. Soc. 1952. V. 74.
[12]
Stern S. A., Shah V. M., Hardy B. J. Structure-
permeability relationships in silicone polymers // J.
[21]
Greber G., Metzinger L. Über oligomere
Polym. Sci. Phys. 1987. V. 25. N 6. P. 1263-1298.
siliciumverbindungen mit funktionellen gruppen.
4. Mitt. Über die grignardierung der bis-
[13]
Shah V. M., Hardy B. J., Stern S. A. Solubility of carbon
chlormethylpolysiloxanhomologen // Makromol.
dioxide, methane, and propane in silicone polymers.
Chem. 1960. V. 39. P. 226-233.
Effect of polymer backbone chains // J. Polym. Sci.
Phys. 1993. V. 31. N 3. P. 313-317.
[22]
Fritz G., Burdt H. Bildung siliciumorganischer
Verbindungen LXIII. Synthese und thermische
[14]
Interrante L. V., Shen Q., Li J. Poly(dimethyl-
Umlagerung des 1,1,3,3,4,4-Hexamethyl-1,3,4-
silylenemethylene-co- dimethylsiloxane): A regularly
trisilacyclopentan // Z.Anorg. Allgem. Chem. 1962.
alternating copolymer of poly(dimethylsiloxane) and
V. 314. P. 35-52.
poly(dimethylsilylenemethylene) // Macromolecules.
2001. V. 34. P. 1545-1547.
[23]
Fritz G., Burdt H. Eine quantitative bestimmung
der SiH- und Si-phenyl-gruppe // Z. Anorg. Allgem.
[15]
Fritz G., Grunert B. Bildung siliciumorganischer
Chem. 1962. V. 317. P. 35-40.
Verbindungen LXIII. Synthese und thermische
1552
Ушаков Н. В. и др.
[24]
Laskowski N., Reis E.-M., Kӧtzner L., Baus J. A.,
[33]
Pat. US 2850514 (publ. 1958). Organometalloids.
Burschka C., Tacke R. Synthesis of silicon-
[34]
Pat. US 2500761 (publ. 1958). Preparation of
functionalized (silylmethyl)silanes and
organosubstituted halogenesilanes.
α,ω-dichlorocarbosilanes using the TMOP
[35]
Greber G., Degler G. Über oligomere silicium-
(2,4,6-trimethoxyphenyl) protecting group: (TMOP)
verbindungen mit funktionellen gruppen.
6.
Me2SiCH2Cl and (TMOP)2MeSiCH2Cl as reagents
Mitt.: Über die herstellung der ω,ω′-dichlorpo-
to introduce the ClMe2SiCH2, MeOMe2SiCH2, or
lysilmethylenhomologen // Makromol. Chem. 1962.
Cl2MeSiCH2 group by nucleophilic substitution at
V. 52. P. 174-183.
silicon // Organometallics. 2013. V. 32. P. 3269-3278.
[36]
Goodwin J. T., Jr., Boldwin W. E., McGregor R. R. The
[25]
Fisher M., Burschka C., Tacke R. Synthesis of
use of sodium in the preparation of methylene-linked
4-silacyclohexan-1-ones and (4-silacyclohexan-1-yl)
silanes // J. Am. Chem. Soc. 1947. V. 69. P. 2247-
amines containing the silicon protecting groups MOP
(4-methoxyphenyl), DMOP (2,4-dimethoxyphenyl),
[37]
Barrau J., Hamida B., Satge J. Synthese et
or TMOP (2,4,6-trimethoxyphenyl): Versatile Si-
decomposition des nouveaux systemes cycliques: Oxa-
and C-functional building blocks for synthesis //
et thia-silagermetannes-1,2,4 // Synth. React. Inorg.
Organometallics. 2014. V. 33. P. 1020-1029. https://
Met.-Org. Chem. 1990. V. 20. N 10. P. 1373-1385.
[26]
Popp F., Nätscher J. B., Daiss J. O., Burschka C.,
[38]
Наметкин Н. С., Исламов Т. Х., Гусельников Л. Е.,
Tacke R. The 2,4,6-trimethoxyphenyl unit as a
Вдовин В. М. Циклокарбоксилоксаны // Успехи
unique protecting group for silicon in synthesis and
химии. 1972. Т. 41. № 2. С. 203-240 [Nametkin N. S.,
the silylation potential of (2,4,6-trimethoxyphenyl)
Islamov T. H., Guselʹnikov L. E., Vdovin V. M.
silanes // Organometallics. 2007. V. 26. N 24. P. 6014-
Cyclocarbosiloxanes // Russ. Chem. Rev. 1972.
[27]
ChoY. S., Yoo B. R., Ahn S., Jung I. N. Grignard
coupling reaction of bis (chloromethyl) diorgano-
[39]
Андрианов К. А., Якушкина С. Е. Синтез и полиме-
silanes with dichloro (diorgano) silanes: Syntheses
ризация некоторых органо-1-окса-3,5-дикарбоци-
of 1, 3-disilacyclobutanes // Bull. Korean Chem. Soc.
клогексасиланов // Изв. АН СССР. Cер. хим. 1962.
1999. V. 20. N 4. P. 427-430.
С. 1396-1400 [Andrianov K. A., Yakushkina S. E.
Synthesis and polymerization of some organo-1-OXA-
[28]
Копылов В. М., Федотов А. Ф., Школьник М. И.,
3,5-dicarbacyclohexasilanes // Russ. Chem. Bull.
Райгородский И. М. Исследование реакции пере-
1962. V. 11. N 8. P. 1311-1314.
распределения органодисилоксанов с различны-
ми заместителями у атома кремния // ЖОХ. 1989.
[40]
Наметкин Н. С., Гусельников Л. Е., Исламов Т. Х.,
Т. 59. № 11. С. 2515-2520.
Шишкина М. В., Вдовин В. М. Термическая пере-
[29]
Pat. US 2452895 (publ. 1948). Linear silmethy-
группировка 1,1,3,3,5,5,7,7-октаметил-2,6-диок-
lenesiloxane.
са-1,3,5,7-тетрасилациклосилоксана // ДАН СССР.
[30]
Bluestein B. A. Polysilmethylene compounds and their
1967. Т. 175. № 1. С. 136-139.
siloxy derivatives // J. Am. Chem. Soc.1948. V. 70.
[41]
Pat. US 5358670. (publ. 1994). Process for preparing
Grignard reagents in diethylene glycol dibutyl ether.
[31]
Pat. US 2510148 (publ. 1950). Chlorination of
[42]
Pat. EP 2086986 (publ. 2009). Synthetic process for
organosilicon compositions.
cyclic organosilanes.
[32]
Knoth W. H. Jr., Lindsey R. V. Jr. Notes: 1,1,3,3-Tetra-
[43]
Tang S., Zhao H. Glymes as versatile solvents for
methyl-13-disilacyclobutane // J. Org. Chem. 1958.
chemical reactions and processes: From the laboratory
V. 23. N 9. P. 1392-1393.
to industry // RSC Adv. 2014. V. 4. N 22. P. 11251-