Журнал прикладной химии. 2020. Т. 93. Вып. 11
ВОДОРОДНЫЕ ТЕХНОЛОГИИ
УДК 661.961.622
ИССЛЕДОВАНИЕ ЗАКОНОМЕРНОСТЕЙ ПОЛУЧЕНИЯ
ВОДОРОДСОДЕРЖАЩЕГО ГАЗА ИЗ МЕТАНА НА ПИЛОТНОЙ УСТАНОВКЕ
С ДВИЖУЩИМСЯ СЛОЕМ МИКРОСФЕРИЧЕСКОГО КАТАЛИЗАТОРА
И РАЗДЕЛЬНОЙ ПОДАЧЕЙ СЫРЬЯ И ОКИСЛИТЕЛЯ
© И. М. Герзелиев1, Е. В. Подопригора1, А. А. Пименов2
1 Институт нефтехимического синтеза им. А. В. Топчиева РАН,
119991, г. Москва, Ленинский пр., д. 29
2 Самарский государственный технический университет,
443100, г. Самара, ул. Молодогвардейская, д. 244, Главный корпус
Поступила в Редакцию 7 октября 2020 г.
После доработки 8 октября 2020 г.
Принята к публикации 13 октября 2020 г.
Представлена концепция новой технологии получения водородсодержащего газа из метана, в соот-
ветствии с которой процесс проводится в двух отдельных аппаратах — реакторе и регенераторе,
между которыми непрерывно циркулирует микросферический катализатор, содержащий активный
решеточный кислород. В экспериментах на пилотной установке с движущимся слоем микросфери-
ческого катализатора и раздельной подачей сырья и окислителя достигнуты следующие показатели
процесса окислительной конверсии метана: степень превращения метана 95%, мольное отношение
Н2/СО = 2, производительность (съем водорода) 0.072 кг водорода·ч-1·кг-1 катализатора. Показана
возможность получения метановодородной смеси, не содержащей оксидов углерода, в условиях низкой
конверсии метана при температуре реакции 550°С, объемной скорости подачи сырья 1.5 ч-1. При
этих условиях конверсия метана составляет 19.6%, концентрация водорода и метана 38 и 61 мол%
соответственно. Значение съема водорода при этих условиях составляет 0.038 кг водорода·ч-1·кг-1
катализатора.
Ключевые слова: метан; водород; окислительная конверсия; селективность; пилотная установка;
микросферический катализатор; перенос кислорода
DOI: 10.31857/S0044461820110146
Начальная стадия одного из основных промыш-
ния дорогостоящего технологического оборудования,
ленных методов производства водорода — получение
что приводит к высокой себестоимости синтез-газа,
синтез-газа (смесь оксида углерода и водорода) [1].
составляющей более 60% от затрат на получение целе-
Наиболее распространенным способом получения
вых продуктов [2, 3]. Поэтому востребован альтерна-
синтез-газа является паровой риформинг метана, про-
тивный способ повышения эффективности процесса
текающий по реакции CH4 + H2O → CO + 3H2 (∆H°298 =
получения синтез-газа — парциальное каталитиче-
= 206 кДж·моль-1). Проведение этого высокоэндотер-
ское окисление метана, который считается одним из
мического процесса в промышленных условиях требу-
перспективных способов получения синтез-газа [4,
ет подвода значительного количества тепла и примене-
5]. Однако несмотря на то, что этот процесс проте-
1633
1634
Герзелиев И. М. и др.
кает по слабо экзотермической реакции CH4 + O2 →
ны регенерации в зону реакции и окисляя метан до
→ CO + 2H2 (∆H°298 = -36 кДж·моль-1), производство
монооксида углерода и водорода (рис. 1). При этом
с помощью этого способа характеризуется рядом
отсутствует непосредственный контакт метана и га-
технологических проблем: в случае использования
зообразного кислорода, а продукты реакции не со-
чистого кислорода в качестве окислителя необходимы
держат азота. Катализатор переносит кислород от ре-
дополнительные затраты на его выделение из возду-
генератора к реактору и способствует превращению
ха, а также меры по предотвращению образования
метана в водородсодержащий газ. Непосредственный
взрывоопасных смесей СН4/О2, а применение
контакт сырья и газообразного окислителя отсутству-
воздуха приводит к разбавлению (на 40%) продукта азо-
ет. Окислителем в этом процессе выступает решеточ-
том и снижению производительности оборудования.
ный кислород, содержащийся в составе катализатора.
В последние годы получило распространение на-
Катализатор в реакторе взаимодействует с сырьем в
правление, связанное с использованием оксида ме-
течение необходимого времени реакции, после чего
талла в качестве переносчика кислорода (принцип
реокисляется в регенераторе с восстановлением со-
chemical looping — «химический цикл»). Процесс,
держания решеточного кислорода. Технологическое
в частности, направлен на выработку энергии в ви-
решение этой задачи достигается за счет реализации
де электричества или пара [6]. Применение «хими-
процесса с проведением реакции окислительной кон-
ческого цикла» возможно в различных процессах,
версии метана в водородсодержащий газ и регене-
таких как окислительная димеризация метана [7],
рации катализатора в двух отдельных аппаратах с
производство серной кислоты [8], окислительное
раздельной подачей сырья и окислителя. Такой прием
дегидрирование этана в этилен [9-11].
обеспечивает технологическое преимущество разра-
Перспективным способом производства синтез-га-
ботки за счет непрерывности протекания соответству-
за является окисление сырья решеточным кислоро-
ющих реакций в каждом отдельном аппарате, про-
дом метана, а в комбинации с блоками конверсии
стоты управления и гибкости процесса, исключается
СО, аминовой очисткой от СО2 и короткоцикловой
попадание балластного азота в продукты реакции.
адсорбции — производства водорода.
Тепло, необходимое для протекания эндотерми-
Аналогичный принцип предложен в ИНХС РАН
ческой реакции (1), поступает в реактор вместе с
для окислительной конверсии природного газа в
циркулирующим катализатором из регенератора, в
синтез-газ [12, 13]. Особенностью данной техноло-
котором происходит его восполнение воздухом по
гии является проведение процесса в системе с двумя
экзотермической реакции (2):
аппаратами — реактором и регенератором, между
CH4 + MeO → CO + 2H2 + nMe,
(1)
которыми непрерывно циркулирует оксиднометал-
лический твердый контакт в микросферической фор-
O2 + 2Me → 2MeO .
(2)
ме, переносящий кислород в своем составе из зо-
Отсутствие необходимости разделения воздуха, ис-
ключение возможности образования взрывоопасных
смесей метан-кислород, сбалансированная по теплу
система реактор-регенератор, а также возможность
дополнительного получения технического азота де-
лает разрабатываемый метод весьма перспективным.
Для оценки экономики процесса важным является
знание оптимальных параметров его осуществления.
Для исследуемого процесса окислительной конверсии
метана в водородсодержащий газ одними из основ-
ных независимых факторов являются температура и
массовая скорость подачи сырья.
Цель работы — исследование влияния температу-
ры и массовой скорости подачи сырья на конверсию
метана, концентрацию H2, CO, CH4 и производитель-
ность катализатора по водороду в реакции конвер-
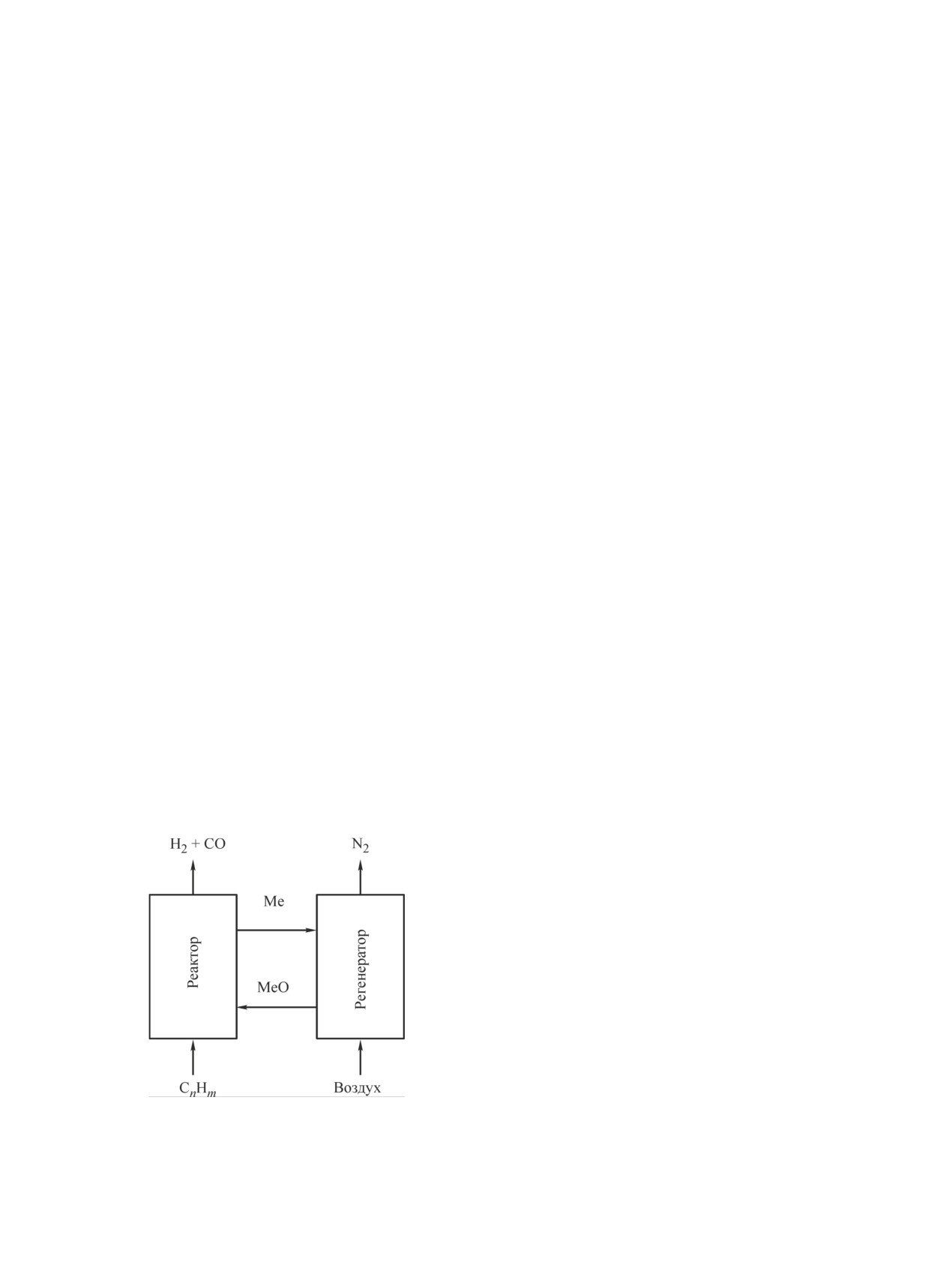
Рис. 1. Принципиальная схема получения синтез-газа
сии метана на микросферическом алюмооксидном
путем окисления метана решеточным кислородом ми-
кросферического катализатора с раздельной подачей
катализаторе с раздельной подачей сырья и окисли-
сырья и окислителя.
теля.
Исследование закономерностей получения водородсодержащего газа из метана...
1635
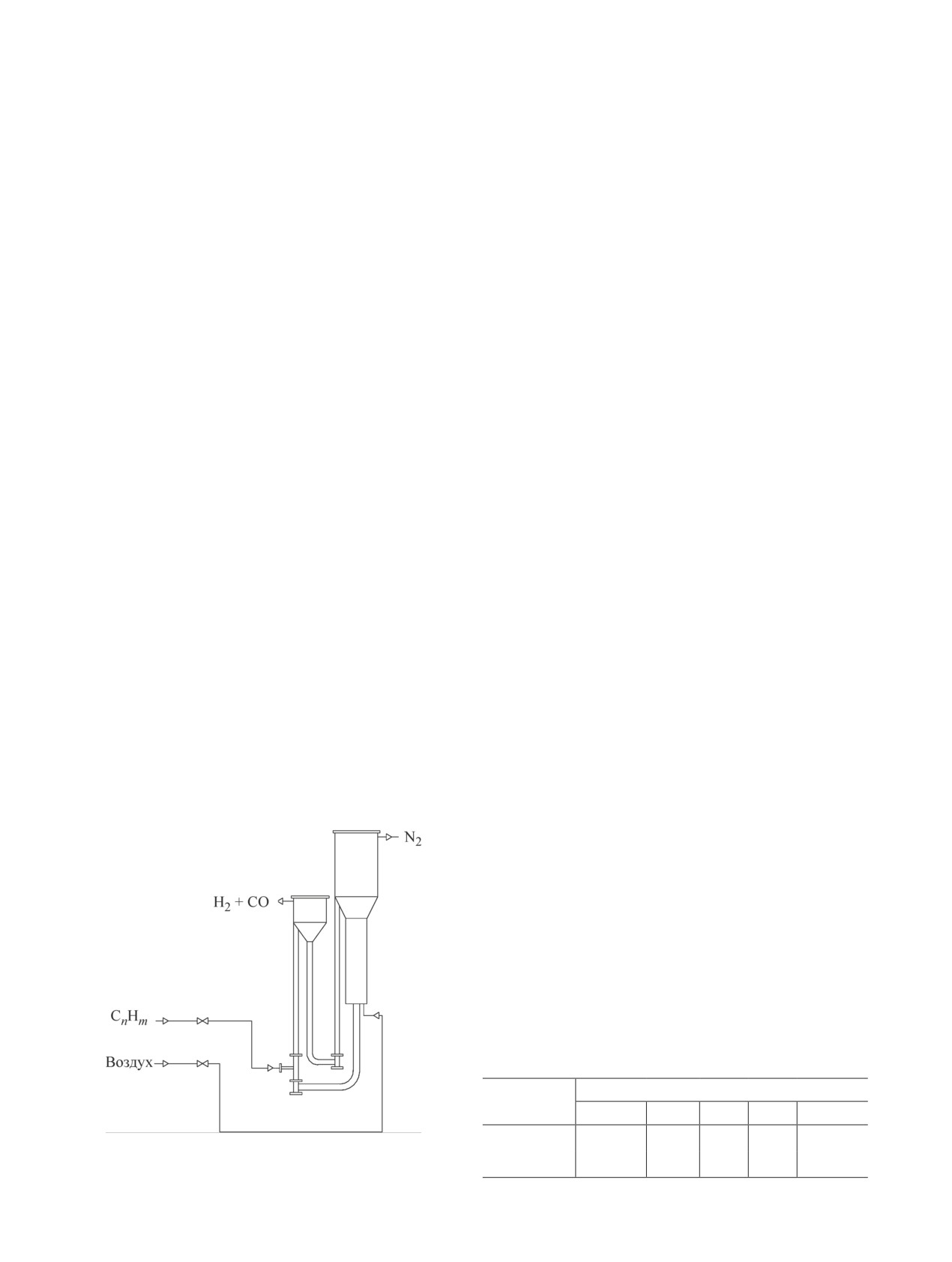
Экспериментальная часть
наличием избыточного гидравлического сопротив-
ления, что достигается уровнем катализатора в зоне
Эксперименты по конверсии метана с циркули-
десорбции, давлением вверху реактора и сопротив-
рующим микросферическим твердым контактом
лением системы сепарации на выходе паров из реак-
проводили на пилотной установке (рис. 2) с общей
тора. Таким образом осуществляется быстрая смена
загрузкой катализатора 2 л. Установка включает в
циклов окисление-восстановление.
себя реакторный блок (реактор конверсии), блок
Исследования по окислительной конверсии ме-
регенерации (реактор окисления), блок управления.
тана в водородсодержащий газ были проведены с
Сырье (метан) поступает из транспортной линии
использованием в качестве сырья метана чистотой
реактора окисления регенератора в нижнюю часть
99.9 мас%. Катализатор представлял собой смешан-
реактора окисления, где контактирует с микро-
ный оксид состава Ni—Co—O в количестве 10 мас%,
сферическим (порошкообразным) катализатором.
нанесенный методом безостаточной пропитки на
Продукты реакции вместе с катализатором поступают
микросферический (средняя фракция 70 мкм) γ-Al2O3
в сепаратор реактора конверсии, где происходит их
[14]. Методики анализа сырья, продуктов реакции и
разделение. Затем продукты реакции направляются
обработки результатов экспериментов описаны в [13].
в отстойник пыли, где осаждается катализаторная
В исследованиях по каталитической конверсии
пыль, и, пройдя счетчик газа, уходят в факельную
метана в водородсодержащий газ на пилотной уста-
линию.
новке с раздельной подачей сырья и окислителя для
Восстановленный катализатор попадает в десор-
определения оптимальных температуры (Т) и объем-
бер, затем поступает в захватывающее устройство,
ной скорости подачи сырья (W), а также установления
где подхватывается потоком азота, аэрируется и, дви-
аналитической зависимости между этими факторами
гаясь по пневмоподъемнику снизу вверх, поступает
применялось ротатабельное центральное композици-
в реактор окисления. При температурах от 650°С
онное планирование (ЦКП) эксперимента.
восстановленный катализатор окисляется кислоро-
Эксперименты проводили при температуре 525-
дом воздуха. Окисление катализатора происходит
875°С, массовой скорости подачи сырья 1.2-3.4 ч-1,
в подвижном слое, который поддерживается пото-
продолжительность каждого опыта составляла
ком воздуха. Далее катализатор по транспортной
240 мин, температура регенерации 650°С, кратность
линии поступает в реактор конверсии. Продукты
циркуляции катализатора 14, массовое отношение
окисления, содержащие в основном азот, отделяют-
окислитель:сырье 1. В качестве исходной точки в
ся от катализатора в сепараторе реактора окисления
факторном пространстве для построения плана экспе-
и после охлаждения уходят далее в факельную ли-
римента принята комбинация уровней независимых
нию. Предотвращение прорыва кислородсодержаще-
переменных x1 = 700°C и x2 = 2.6 ч-1. Режимные пре-
го агента из регенератора в реактор обеспечивается
делы испытаний, уровни и интервалы варьирования
факторов (табл. 1) были выбраны исходя из результа-
тов предварительных экспериментов.
На основании выбранных уровней и интервалов
варьирования факторов была составлена матрица
ротатабельного планирования эксперимента при ус-
ловии равенства и минимальности дисперсий значе-
ний выходной переменной для всех точек факторного
пространства (табл. 2).
В качестве зависимых переменных выбраны кон-
версия метана Х (%), концентрация H2, CO, CH4 в
Таблица 1
Уровни факторов
Уровень
Независимая
переменная
-1.41
-1
0
1
1.41
x1, °C
525
575
700
825
875
Рис. 2. Принципиальная схема пилотной установки
x2, ч-1
1.295
1.5
2.0
2.5
2.705
с раздельной подачей сырья и окислителя.
1636
Герзелиев И. М. и др.
Таблица 2
Матрица ротатабельного планирования
№ эксперимента
1
2
3
4
5(Ц)
6
7
8
9
План
T
-1
-1
+1
+1
0
-1.41
1.41
0
0
W
-1
+1
-1
+1
0
0
0
-1.41
1.41
продуктах реакции (мол%) и производительность
Полученные результаты (табл. 3) показали, что
катализатора по водороду G (кг водорода·ч-1·кг-1
в изученных пределах параметров процесса наблю-
катализатора).
даются три основные области конверсии метана: в
Расчет коэффициентов уравнения регрессии, ста-
первой области — при температурах выше 800°С
тистический анализ уравнения регрессии произво-
достигаются высокие значения конверсии метана,
дился с помощью методов регрессионного анализа с
мольное отношение H2/CO составляет 2.2-2.3, что
использованием программ Excel и Statistica.
соответствует ожидаемому стехиометрическому со-
Функция X = f(TW) описывается уравнением ре-
отношению для парциального окисления метана.
грессии общего вида
Вторая область — переходная. Конверсия метана сни-
жается, уменьшается концентрация оксида углерода в
y = A + Bx1 + Cx12 + Dx2 + Ex22 + Fx1x2,
продуктах реакции. Третья область — область низких
где y — зависимая переменная; x1 — T — температу-
конверсий метана, в продуктах реакции практически
ра в реакторе; x2 — W — массовая скорость подачи
отсутствуют оксиды углерода. Концентрация CO2 в
сырья; A-F — коэффициенты, рассчитанные по ре-
продуктах реакции во всех экспериментах не превы-
зультатам статистического анализа эксперименталь-
шает 1 мол%.
ных данных.
Газ регенерации состоял преимущественно из азо-
та с примесями непрореагировавшего кислорода и
диоксида углерода, образовавшегося в результате
Обсуждение результатов
окисления углерода, попавшего в регенератор вместе
С использованием полученных значений выход-
с твердым контактом из зоны реакции.
ных переменных был произведен расчет коэффици-
С учетом рассчитанных коэффициентов модель
ентов и статистический анализ уравнения регрессии. принимает вид
X = 38.695 + 29.574T + 9.312T2 - 4.618W + 0.435W2 - 1.65TW,
(3)
H2 = 61.798 + 11.8075T - 10.242T2 - 4.07W - 1.59W2 + 0.7TW,
(4)
CO = 2.077 + 14.253T + 10.107T2 + 0.102W + 0.776W2 - 0.475TW,
(5)
CH4 = 36.125 - 26.06T + 0.135T2 + 3.968W + 0.814W2 - 0.225TW,
(6)
G = 0.156 + 0.0217T - 0.05T2 + 0.0127W - 0.0163W2 + 0.0072TW .
(7)
Результаты статистического анализа показали,
адекватная квадратичная модель зависимости конвер-
что условие критерия Кохрена в сравнении с его та-
сии метана, концентрации H2, CO, CH4 в продуктах
бличным значением Gjp < Gт выполняется, S2ju —
реакции и производительности катализатора по во-
однородны, следовательно, можно сделать вывод,
дороду от температуры и массовой скорости подачи
что гипотеза об однородности дисперсий на каж-
сырья.
дом уровне факторов правомерна; по t-критерию
Стьюдента условие значимости коэффициентов ре-
Изучение влияния факторов проведения
грессии tbi > tт выполняется для b0, b1, b2, b3, b4, и
процесса на его показатели
bʹ0, bʹ1 в уравнениях для конверсии и селективности
соответственно. Также выполняется условие крите-
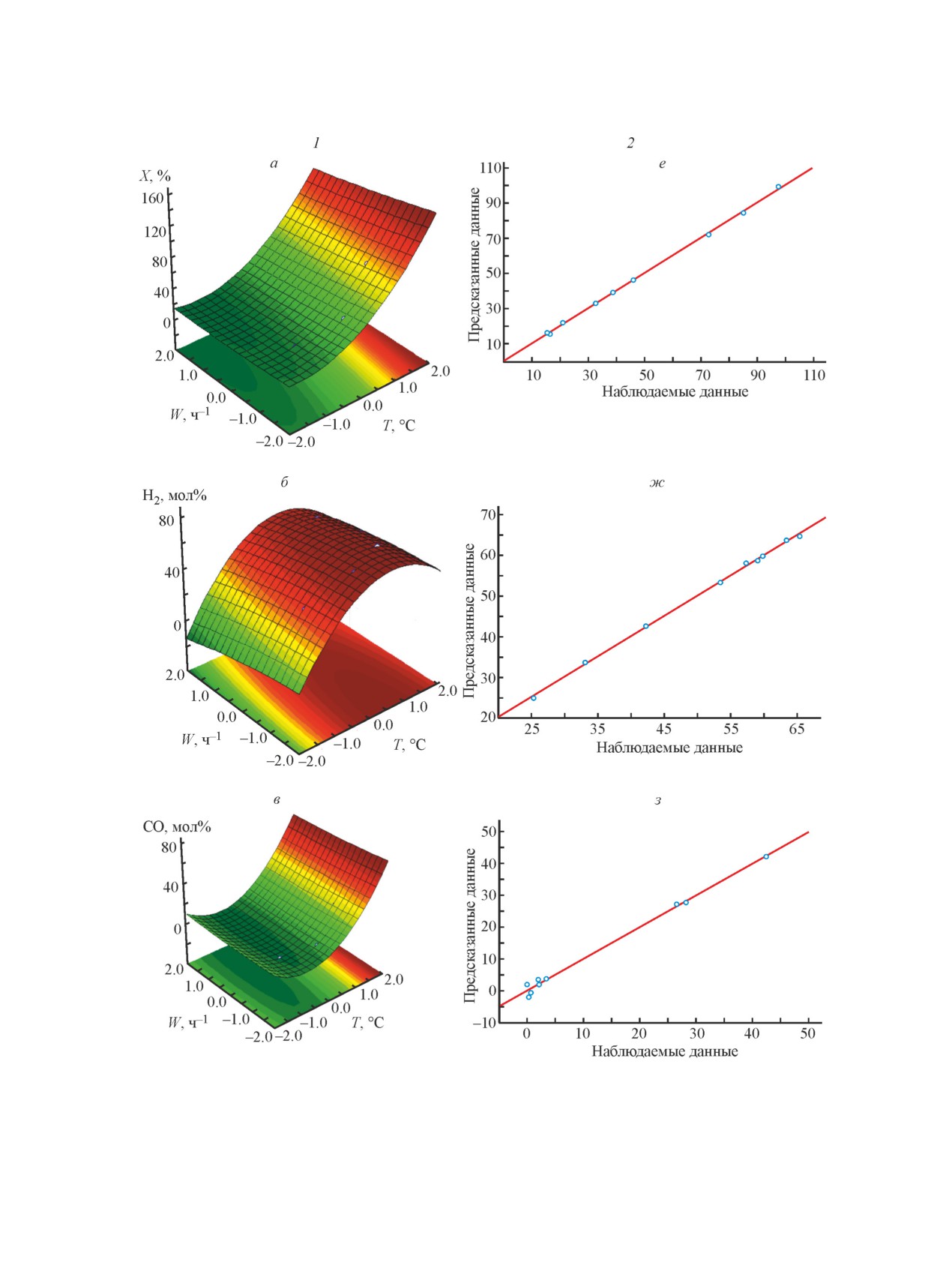
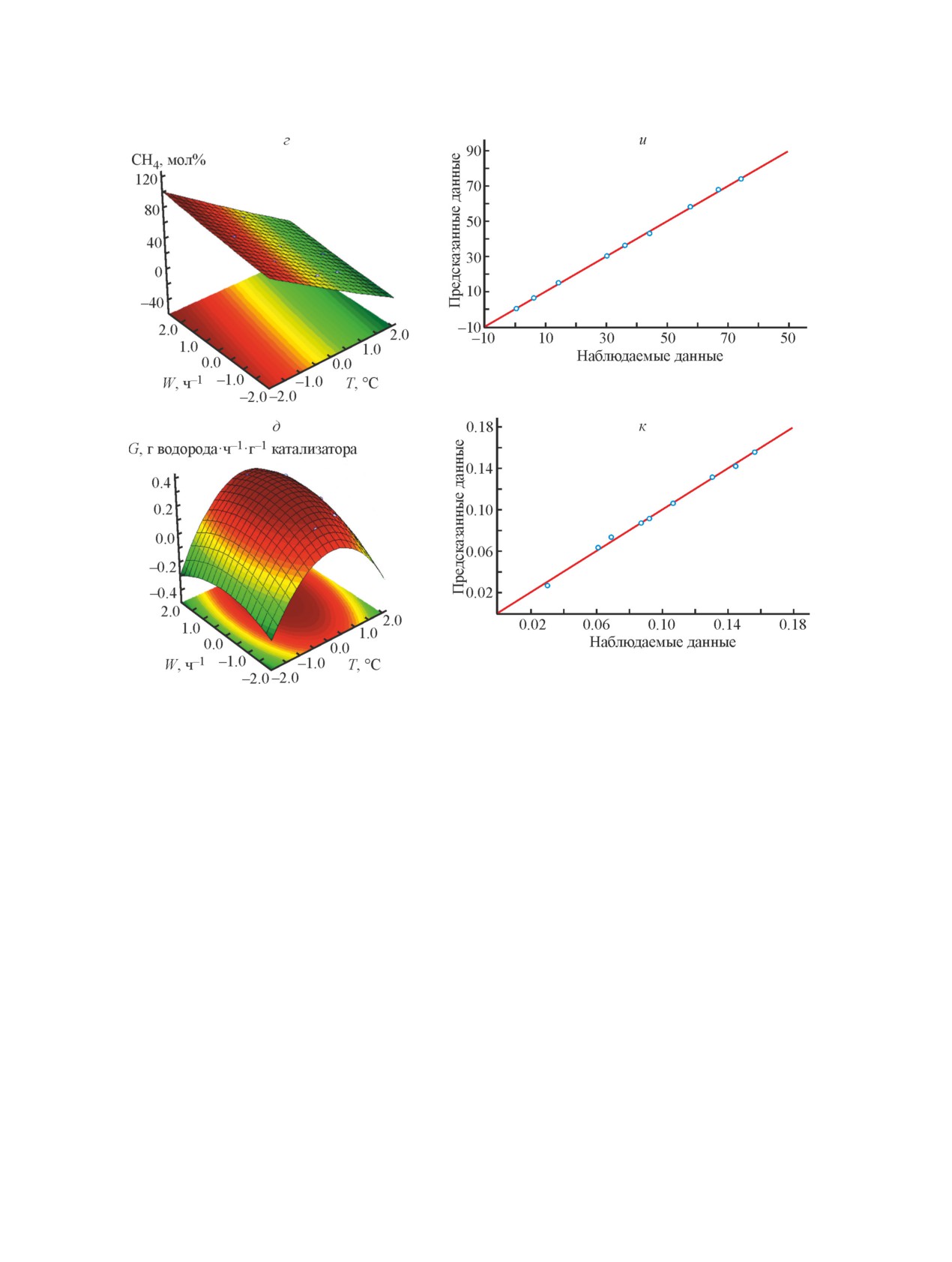
Для наглядного представления результатов экс-
рия Фишера в сравнении с его табличным значением
перимента последовательные значения фактора x1 и
Fjp < Fт. Экспериментальные и расчетные значения
x2 откладываются по оси X и Y, значения выходных
зависимых параметров находятся в пределах среднего
переменных y1, y2, y3 — по оси Z. Графически данная
отклонения (рис. 3, е-к). Таким образом, построена
модель представлена в виде поверхности в коорди-
Исследование закономерностей получения водородсодержащего газа из метана...
1637
Таблица 3
Результаты экспериментов по влиянию температуры и массовой скорости подачи сырья на конверсию метана,
концентрацию H2, CO, CH4 и производительность катализатора по водороду в реакции конверсии метана
на алюмооксидном катализаторе с раздельной подачей сырья и окислителя
План
Результаты
производительность
массовая
концентрация
концентрация
концентрация
катализатора
температура,
конверсия
скорость подачи
H2 в продуктах
CH4 в продуктах
CO в продуктах
по водороду,
°С
метана, %
сырья, ч-1
реакции, мол%
реакции, мол%
реакции, мол%
кг водорода·ч-1·кг-1
катализатора
575
1.5
21.1
57.4
42.3
0.3
0.0605
575
2.5
15.5
66.2
33.2
0.6
0.0691
825
1.5
85.1
6.3
65.5
28.2
0.0925
825
2.5
72.9
14.2
59.2
26.6
0.1305
700
2.0
38.7
36.1
61.8
2.1
0.1564
525
2.0
16.4
74.6
25.4
0
0.0302
875
2.0
97.6
0.3
57.3
42.4
0.0873
700
1.295
46.1
33.5
64.6
1.9
0.1065
700
2.705
32.6
44.1
52.5
3.4
0.1450
натах T-W-X, T-W-H2, T-W-CO, T-W-CH4, T-W-G
до 97.7 мас%. Оптимальная комбинация факторов,
(рис. 3, а-д). При использовании 3D-поверхностей
соответствующая максимальной конверсии метана,
между тремя переменными (двумя факторами и од-
определенная по модели (3): температура реакции
ним из двух зависимых выходных параметров) для
в интервале 850-860°С, объемная скорость подачи
представления центрального композиционного плана
сырья 1.5 ч-1. При этих условиях конверсия метана
эксперимента выявляется структура данных и слож-
достигает 95%. Рассчитанное по уравнению регрес-
ная нелинейная взаимосвязь. Экстремумы поверх-
сии (7) значение съема водорода при этих условиях
ностей на рис. 3, а-д — области, выделенные тем-
составляет 0.072 кг водорода·ч-1·кг-1 катализатора.
ным цветом, представляют собой точки, отвечающие
Оптимальная комбинация факторов, соответствую-
максимальным значениям зависимых переменных,
щая минимальной концентрации метана 1.8 мол%,
где выходные переменные принимают наилучшие
определенная по модели в соответствии (3): тем-
значения. Модель довольно хорошо описывает зави-
пература реакции 850-860°С, объемная скорость
симость соответствующих переменных от заданных
подачи сырья 1.5 ч-1. При этих условиях концен-
значений факторов. Результаты статистического ана-
трация Н2 и СО составляет 63 и 32 мол% соответ-
лиза экспериментальных данных показывают, что
ственно. Рассчитанное по уравнению регрессии зна-
и температура, и массовая скорость подачи метана
чение съема водорода при этих условиях составляет
оказывают большое влияние на значение функции
0.072 кг водорода·ч-1·кг-1 катализатора.
отклика (3)-(7). Знак коэффициентов при линейных
В области получения метановодородной смеси
членах уравнения регрессии (коэффициенты B, С,
оптимальная комбинация факторов, соответствующая
D, E, F соответственно) выявляет направление их
содержанию водорода и метана, определенная по
влияния на значение выходного параметра. Так, по-
моделям (4), (6): температура реакции в интервале
ложительный знак коэффициента при температуре
550-560°С, объемная скорость подачи сырья 1.5 ч-1;
(Т) в уравнении регрессии (3) свидетельствует о том,
температура реакции в интервале 550-560°С, объем-
что при увеличении температуры конверсия метана
ная скорость подачи сырья 1.5 ч-1. При этих условиях
увеличивается; в свою очередь отрицательный знак
конверсия метана составляет 19.6%, концентрация
коэффициента при массовой скорости подачи (W)
водорода и метана 38 и 61 мол% соответственно.
свидетельствует о том, что при eе увеличении кон-
Рассчитанное по уравнению регрессии (7) значе-
версия метана снижается. С уменьшением объемной
ние съема водорода при этих условиях составляет
скорости подачи сырья от 2.7 до 1.3 ч-1 при темпе-
0.038 кг водорода·ч-1·кг-1 катализатора.
ратуре 850°С конверсия метана возрастает с 79.2
1638
Герзелиев И. М. и др.
Рис. 3. Поверхности конверсии метана (а), концентраций в продуктах реакции H2 (б), CO (в), CH4 (г) и производи-
тельности катализатора по водороду (д) как функции температуры и массовой скорости подачи сырья (1) и cоотно-
шение наблюдаемых данных по конверсии метана (е), концентрации в продуктах реакции H2 (ж), CO (з), CH4 (и)
и производительности катализатора по водороду (к) и данных, предсказанных моделью X = f(T,τ) (2).
Исследование закономерностей получения водородсодержащего газа из метана...
1639
Рис. 3. Продолжение.
Сопоставление экспериментальных данных со
На основании изложенного предлагается два ре-
значениями (рис. 3, е-к), рассчитанными с приме-
жима проведения конверсии метана с раздельной
нением полученной модели, позволяет говорить об
подачей сырья и окислителя.
удовлетворительном прогнозе выходных данных,
Режим 1. Предусматривает получение водорода из
составленном с ее помощью. Расхождение между
синтез-газа с переводом оксида углерода в процессе
предсказанными и наблюдаемыми данными в иссле-
паровой конверсии в диоксид углерода и водород и
дуемом интервале в большинстве случаев не превы-
дальнейшим извлечением СО2 аминовой очисткой.
шает 5%.
При температуре 850°С и массовой скорости подачи
Оптимизация процесса конверсии метана в
сырья 1.5 ч-1 расчетное значение производительности
синтез-газ с учетом оптимальных с точки зрения
катализатора по водороду составляет 0.072 кг·ч-1·кг-1
технологии процесса значений конверсии и селектив-
катализатора в системе. При таких параметрах значе-
ности производится при помощи анализа данных по-
ния зависимых параметров будут следующими: кон-
верхностей регрессии и найденных уравнений регрес-
версия метана 95%, концентрация водорода, оксида
сии (3)-(7). Таким образом, при изменении факторов
углерода и метана 63, 32 и 1.8 мол% соответственно.
в пределах этих областей, положение осей которых
В итоге комплексной переработки синтез-газа про-
можно оценить графически, достигаются наибольшие
изводится водород концентрацией 97 мол% (осталь-
значения показателей. Варьируя параметры в вы-
ное — метан, диоксид углерода, азот, вода).
бранном диапазоне, можно подобрать оптималь-
Режим 2. Получение метановодородной смеси
ную пару значений независимых факторов исходя
за проход. Если исходить из требований получения
из технологических требований и экономической
метановодородной смеси, следует выбрать комби-
целесообразности по конверсии метана, съему
нацию факторов, соответствующую значениям тем-
водорода и массовой скорости подачи метана.
пературы 550°С и объемной скорости подачи метана
1640
Герзелиев И. М. и др.
от 1.5 ч-1. В этом диапазоне конверсия метана нахо-
лемы и перспективы конверсии углеводоро-
дится на уровне 19.6 мас%, концентрация водорода
дов в синтез-газ // Нефтехимия. 2011. Т. 51.
и метана 38 и 61 мол%, оксиды углерода отсутству-
ют, а съем водорода составляет 0.038 кг·ч-1·кг-1 ка-
A. S. Conversion of hydrocarbons to synthesis gas:
тализатора, или на объем метановодородной смеси
Problems and prospects // Petrol. Chem. 2011.
1660 нм3·ч-1·т-1 катализатора.
V. 51. N 2. P. 107-117. https://doi.org/10.1134/
[2]
Rostrup-Nielsen J. R. Syngas in perspective // Catal.
Выводы
Today. 2002. V. 71. P. 243-247.
В экспериментах на пилотной установке с дви-
жущимся слоем микросферического катализатора и
[3]
Арутюнов В. С., Крылов О. В. Окислительная кон-
раздельной подачей сырья и окислителя определен
версия метана // Успехи химии. 2005. Т. 74. № 12.
характер влияния значимых факторов на показатели
С. 1216-1245 [Arutyunov V. S., Krylov O. V. Oxidative
процесса конверсии метана. Выбраны оптимальные
conversion of methane // Russ. Chem. Rev. 2005.
V. 74. N 12. P. 1216-1245.
условия проведения процесса конверсии метана с
раздельной подачей сырья и окислителя в водородсо-
[4]
Gayan P., Dueso C., Abad A., Adanez J., de
держащий газ: при получении синтез-газа — темпера-
Diego L. F., García-Labiano F. NiO/Al2O3 xygen
тура 850°С, массовая скорость подачи сырья 1.5 ч-1.
carriers for chemical-looping combustion prepared
При получении метановодородной смеси — 550°С,
by impregnation and deposition-precipitation methods
массовая скорость подачи сырья 1.5 ч-1.
// Fuel. 2009. V. 88. P. 1016-1023.
Полученные результаты могут быть использованы
для проведения опытно-конструкторских и опыт-
[5]
Hossain M., de Lasa H. Reduction and oxidation
но-технологических работ, направленных на созда-
kinetics of Co-Ni/ Al2O3 oxygen carrier involved in
ние новой конкурентоспособной технологии полу-
a chemical-looping combustion cycles // Chem. Eng.
чения водорода, имеющего большое практическое
Sci. 2010. V.65. P. 98-106.
значение.
[6]
Mukherjee S., Kumar P., Yang A., Fennell P. Energy
and exergy analysis of chemical looping combustion
Конфликт интересов
technology and comparison with pre-combustion and
Авторы заявляют об отсутствии конфликта инте-
oxy-fuel combustion technologies for CO2 capture //
J. Environ. Chem. Eng. 2015. V. 3. N 3. P. 2104-2114.
ресов, требующего раскрытия в данной статье.
[7]
Fleischer V., Littlewood P., Parishan S., Schomäcker R.
Информация об авторах
Chemical looping as reactor concept for the
oxidative coupling of methane over a Na2WO4/Mn/
Герзелиев Ильяс Магомедович, к.х.н.,
SiO2 catalyst // Chem. Eng. J. 2016. V. 306. P. 646-
Подопригора Елена Викторовна,
[8]
García-Labiano F., de Diego L. F., Cabello A.,
Gayan P., Abad A., Adanez J., Sprachmann G.
Пименов Андрей Александрович, д.т.н.,
Sulphuric acid production via Chemical Looping
Combustion of elemental sulphur // Appl. Energy.
2016. V. 178. P. 736-745.
Финансирование работы
[9]
Bakare I. A., Mohamed S. A., Al-Ghamdi S.,
Работа выполнена при финансовой под-
Razzak S. A., Hossain M. M,, de Lasa H. I. Fluidized
bed ODH of ethane to ethylene over VOx—MoOx/
держке Минобрнауки РФ в рамках соглашения
γ-Al2O3 catalyst: Desorption kinetics and catalytic
№ 05.607.21.0311 от 02.12.19, уникальный иденти-
activity // J. Chem. Eng. 2015. V. 278. P. 207-216.
фикатор проекта RFMEFI60719X0311.
[10]
Al-Ghamdi S., Volpe M., Hossain M. M., de Lasa H.
VOx/c-Al2O3 catalyst for oxidative dehydrogenation
Список литературы
of ethane to ethylene: Desorption kinetics and catalytic
[1] Усачев Н. Я., Харламов В. В., Беланова Е. П.,
activity // Appl. Catal. A. 2013. V. 450. P. 120-130.
Казаков А. В., Старостин Т. С., Канаев С. А. Проб-
Исследование закономерностей получения водородсодержащего газа из метана...
1641
[11] Neal L. M., Yusuf S., Sofranko J. A., Li F. Oxidative
pilot plant with a riser reactor // Petrol. Chem. 2012.
dehydrogenation of ethane: A chemical looping
V. 52. N 5. P. 305-312.
approach // Energy Technol. 2016. V. 4. N 10. P. 1200-
[13] Герзелиев И. М., Усачев Н. Я., Попов А. Ю.,
[12] Герзелиев И. М., Усачев Н. Я., Попов А. Ю., Хад-
Хаджиев С. Н. Парциальное окисление низших
жиев С. Н. Парциальное окисление низших ал-
алканов активным решеточным кислородом оксид-
канов активным решеточным кислородом ок-
нометаллических систем: 1. Экспериментальные
сиднометаллических систем. Сообщение 2.
методы и установки // Нефтехимия. 2011. Т. 51.
Синтез контактов-оксидантов и получение син-
№ 6. С. 420-426 [Gerzeliev I. M., Usachev N. Y.,
тез-газа на пилотной установке с лифт-реакто-
Popov A. Yu., Khadzhiev S. N. Partial oxidation of
ром // Нефтехимия. 2012. Т. 52. № 5. С. 339-347
lower alkanes by active lattice oxygen of metal oxide
[Gerzeliev I. M., Usachev N. Ya., Popov A. Yu.,
systems: 1. Experimental methods and equipment //
Khadzhiev S. N. Partial oxidation of lower alkanes
Petrol. Chem. 2011. V. 51. N 6. P. 411-417.
by active lattice oxygen of metal oxide systems: 2.
Synthesis of solid contacts and syngas production in a
[14] Пат. РФ 2547845 (опубл. 2015). Катализатор, спо-
соб его получения и способ получения синтез-газа.