1642
Герзелиев И. М. и др.
Журнал прикладной химии. 2020. Т. 93. Вып. 11
УДК 542.973:943:66.094.3
К ВЫБОРУ МИКРОСФЕРИЧЕСКОГО КАТАЛИЗАТОРА
ПАРЦИАЛЬНОГО ОКИСЛЕНИЯ МЕТАНА В ВОДОРОДСОДЕРЖАЩИЙ ГАЗ
© И. М. Герзелиев1, Е. В. Подопригора1, А. А. Пименов2
1 Институт нефтехимического синтеза им. А. В. Топчиева РАН,
119991, г. Москва, Ленинский пр., д. 29
2 Самарский государственный технический университет,
443100, г. Самара, ул. Молодогвардейская, д. 244, Главный корпус
Поступила в Редакцию 7 октября 2020 г.
После доработки 8 октября 2020 г.
Принята к публикации 13 октября 2020 г.
На импульсной лабораторной установке с раздельной подачей сырья и окислителя изучено влияние
химического состава микросферических никель-кобальтовых катализаторов на алюмосиликатных
и алюмооксидных носителях на каталитические показатели реакции окислительной конверсии ме-
тана в водородсодержащий газ. Физико-химические и каталитические исследования показали, что
содержание суммарного количества оксидов никеля и кобальта на уровне 10 мас% достаточно для
получения катализатора, способного к неоднократным окислительно-восстановительным переходам.
Ключевые слова: оксиднометаллический катализатор; водородсодержащий газ; синтез-газ; окисли-
тельная конверсия метана; метановодородная смесь
DOI: 10.31857/S0044461820110158
Одним из перспективных способов получения
ет непосредственный контакт сырья и газообразного
синтез-газа является парциальное каталитическое
окислителя, а продукты реакции не содержат азота.
окисление метана кислородом [1, 2]. Однако прак-
Преимущества предлагаемого способа получения
тическая реализация этой технологии сдерживается
синтез-газа: высокая взрывобезопасность, снижение
из-за проблем, связанных с дорогостоящим выде-
капитальных затрат, так как отпадает необходимость
лением кислорода из воздуха и взрывоопасностью
разделения воздуха.
кислород-углеводородных смесей, а применение воз-
К оксиднометаллическим катализаторам, которые
духа приводит к разбавлению (на 40%) продукта азо-
могут быть применены в описанной выше системе,
том и снижению производительности оборудования.
предъявляются определенные требования: способ-
Дополнительным фактором, тормозящим распростра-
ность к многократным окислительно-восстанови-
нение данного метода, является отсутствие надежных
тельным переходам, наличие в составе активного
и селективных катализаторов [3].
кислорода, который влияет на производительность
В ИНХС им. А. В. Топчиева РАН показана воз-
катализатора, износоустойчивость, которая зависит
можность проведения конверсии метана в системе
от носителя и способа приготовления катализатора.
с циркулирующим оксиднометаллическим катали-
В комплексе катализатор должен обеспечивать высо-
затором [4]. Такая система предполагает наличие
кую конверсию углеводородного сырья [5]. В каче-
двух основных аппаратов — реактора и регенератора,
стве носителя катализатора наиболее часто исполь-
сообщающихся между собой. Оксиднометаллический
зуется оксид алюминия в альфа- и гамма-формах.
твердый контакт непрерывно циркулирует между
Свойства различных кристаллических форм оксида
ними, перенося кислород в своем составе от регене-
алюминия подробно описаны в [6].
ратора к реактору и окисляя углеводородное сырье до
Наиболее перспективными металлами для
водорода и монооксида углерода. При этом отсутству- применения в оксиднометаллических системах,
К выбору микросферического катализатора парциального окисления метана в водородсодержащий газ
1643
способных к многократной смене циклов окис-
Экспериментальная часть
ление-восстановление, являются Cu, Fe, Ni, Co.
Оксиднометаллические катализаторы на основе Cu
Катализаторы готовили методом пропитки по вла-
проявляют высокую активность в реакции конверсии
гопоглощению образцов микросферической γ-формы
метана и хорошую способность к окислительно-вос-
оксида алюминия (50-160 мкм). На первой стадии
становительным переходам [7]. Главным препятстви-
микросферы пропитывали водным раствором смеси
ем к использованию меди в оксиднометаллических
солей Ni(NO3)2·6H2O (ч.д.а.) и Co(NO3)2·6H2O (ч.д.а.)
системах является ее низкая температура плавле-
(ООО «Лабораторная техника»). После сушки при
ния [8]. Оксиднометаллические системы на основе
100°С в течение 2 ч полученный материал пропи-
железа показывают неудовлетворительные окисли-
тывали раствором модификатора и вновь сушили
тельно-восстановительные характеристики, однако
при 100°С до постоянной массы. Заключительная
применение Fe снижает стоимость катализатора [9].
стадия приготовления катализатора включала его
Наибольшее внимание уделяется оксиднометалли-
прокаливание при 460°С в течение 2 ч и при 650°С в
ческим системам на основе никеля, нанесенного на
течение 2 ч.
оксид алюминия. Такие системы характеризуются
Образцы № 1, 2 и 3 готовили в расчете на содержа-
высокой активностью в реакции с алканами, низкой
ние в составе около 10, 25 и 50 мас% активной фазы
скоростью износа в псевдоожиженном слое. Однако
Ni-Co-оксидов. В качестве носителя использовался
при использовании в качестве носителя γ-Al2O3 вос-
микросферический γ-Al2O3 производства АО «СКТБ
становительные свойства никеля могут быть затруд-
«Катализатор» (г. Новосибирск). Образец № 4 готови-
нены частичным переходом NiO в шпинель NiAl2O4,
ли в расчете на содержание около 10 мас% активной
имеющую низкую реакционную способность [10].
фазы Ni-Co-оксидов. В качестве носителя использо-
Образования шпинели можно избежать путем про-
вали микросферический катализатор каталитического
ведения фазового перехода γ-Al2O3 в α-Al2O3 при
крекинга марки REDUXION DMS (BASF).
1150°С или пассивации носителя нанесением на него
Физико-химические свойства образцов катализа-
соединений Mg, Ca, La, Co [11]. Использование в
торов определяли методами термопрограммируемого
составе катализаторов комбинаций оксидов металлов
восстановления водородом (ТПВ), рентгенофлуорес-
может привести к улучшению их характеристик. Так,
центного и рентгенофазового (РФА) анализа.
в [12] отмечается, что система CoO-NiO/Y-ZrO2, не-
Рентгенофазовый анализ проводили на рент-
смотря на небольшое снижение скоростей окисления
геновском дифрактометре ДРОН-3М (излучение
и восстановления по причине образования твердого
CuKα, никелевый фильтр) со скоростью скани-
раствора NiCoO2, значительно лучше регенериру-
рования 1 град·мин-1 в диапазоне углов 2θ 5-75°.
ется при смене окислительно-восстановительных
Рентгенографические данные получены обработ-
циклов по сравнению с индивидуальными оксида-
кой спектров методом Ритвельда с использованием
ми. Биметаллическая система CoO-NiO/Al2O3 была
программы RIETAN-2000. Размеры частиц оцени-
исследована в [13]. Сделан вывод о положительном
вали по полуширине пиков при помощи уравнения
влиянии кобальта на окислительно-восстановитель-
Шеррера.
ные свойства всей системы вследствие снижения
Исследование образцов методом термопрограм-
образования алюмината никеля. При приготовлении
мированного восстановления водородом было вы-
Ni-Co-содержащих биметаллических катализаторов,
полнено на проточной установке с детектором по
как правило, применяют метод совместной или по-
теплопроводности. Перед восстановлением образцы
следовательной пропитки [14]. В связи с важностью
были подвергнуты окислению в потоке смеси газов
решения проблемы окислительного дегидрирования
О2/Не до 500°С, скорость 15 град·мин-1, выдержаны
низших алканов с участием решеточного кислоро-
30 мин и охлаждены до комнатной температуры так-
да [15] во многих научных центрах продолжаются
же в потоке О2/Не.
интенсивные исследования, направленные на опти-
Расход восстановительной смеси 10% H2 + 90%
мизацию как состава, так и способа приготовления
Ar составлял 40 см3·мин-1 с программированием до
оксидных систем.
1000°С.
Цель работы — изучение закономерностей превра-
Тестовые испытания катализаторов проводили на
щения метана на композициях оксиднометаллических
лабораторной импульсной установке окислительной
катализаторов биметаллической системы CoO-NiO
конверсии метана с раздельной подачей сырья и окис-
на различных носителях с целью выбора перспектив-
лителя с чередующимися циклами обработки ката-
ного образца для укрупненных испытаний.
лизатора (три цикла) при следующих условиях: тем-
1644
Герзелиев И. М. и др.
пература 850°С, отношение катализатор/сырье = 80,
Можно выделить три основные области поглоще-
время контакта сырья с катализатором 3 с.
ния водорода:
Основные принципы проведения экспериментов:
— низкотемпературная (до 300°С), которая коли-
— реакция каталитической окислительной кон-
чественно соответствует удалению многослойного
версии метана протекает на оксиднометаллическом
покрытия поверхности кислородом; наблюдается у
катализаторе, содержащем решеточный кислород;
всех образцов, кроме № 3;
— пополнение катализатора решеточным кисло-
— с максимумами в области температур до 550°С,
родом осуществляется на стадии окисления катали-
количественно отвечающими восстановлению кати-
затора воздухом;
онов Со4+ и Со2+ до Со2+ и Со0 [16], а Ni2+ до Ni0.
— процессы конверсии метана и пополнения ка-
— область температур выше 550°С, количественно
тализатора решеточным кислородом проводятся по-
отвечающая восстановлению катионов Со2+ до Со0 и
следовательно с дозированной подачей (импульсов)
Ni2+ до Ni0.
специальным краном-дозатором;
Наличие высокотемпературного пика может быть
— в каждом эксперименте попеременно подается
отнесено к присутствию NiAl2O4 и CoAl2O4 в ре-
по три импульса метана и воздуха;
зультате взаимодействия оксидов никеля и кобальта
— газ-носитель, содержащий продукты реакции,
с носителем, что свидетельствует о наличии прочной
из реактора направляется непосредственно на анализ
связи кислород-катализатор. В то же время реакция
в разделительную колонку хроматографа, где проис-
парциального окисления метана в присутствии иссле-
ходит анализ продуктов реакции, и далее уходит на
дуемых катализаторов проводится при температурах
сброс в атмосферу.
выше 800°С вследствие высокой величины энергии
Во время прохождения импульса метана через
разрыва С—H-связи. Это позволяет предположить,
слой катализатора в реакторе протекает конверсия
что даже при наличии сильносвязанного кислорода
метана с образованием водородсодержащего газа.
катализаторы № 1, 2, 4 будут активны в процессе
конверсии метана в синтез-газ.
Окислительная конверсия метана протека-
Обсуждение результатов
ет с образованием оксида углерода и водорода
Согласно данным РФА (табл. 1) теоретически
CH4 + MeO → CO + 2H2 + nMe и сопровождается
возможное содержание активного решеточного кис-
образованием диоксида углерода и воды. При подаче
лорода [O]act, соответствующее количеству никеля
импульса воздуха протекает реакция окисления выс-
и кобальта в образцах катализаторов № 1, 2, 3, 4, со-
шего оксида металла, содержащегося в катализаторе,
ставляет (мас%): 1.36, 5.14, 9.76, 2.40 соответственно.
вновь до низшего оксида, таким образом, происходит
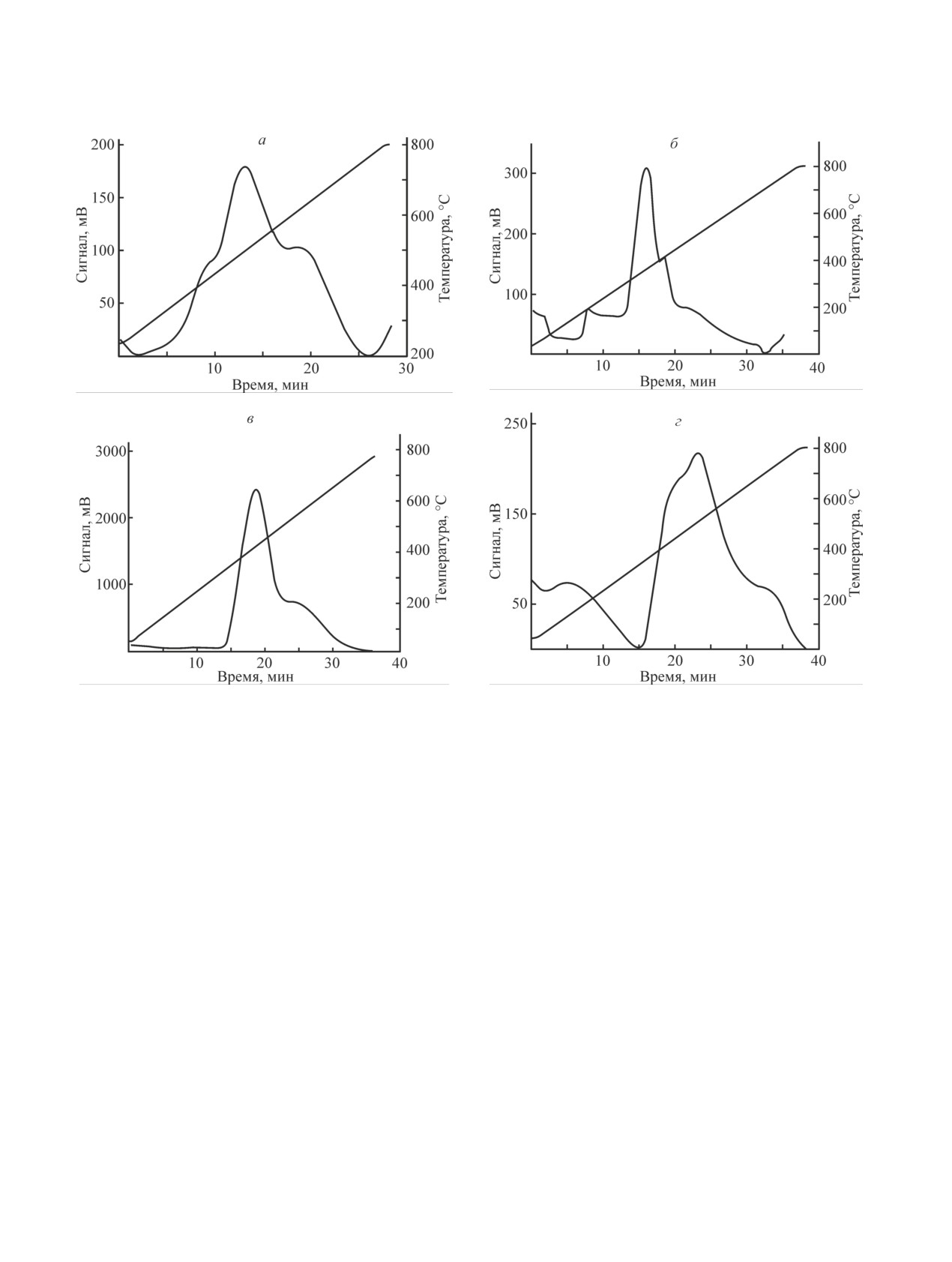
Вид кривых ТПВ (рис. 1) свидетельствует о том,
регенерация катализатора O2 + 2Me → 2MeO, и цикл
что восстановление водородом протекает в различ-
повторяется.
ных областях температур, что может быть связано как
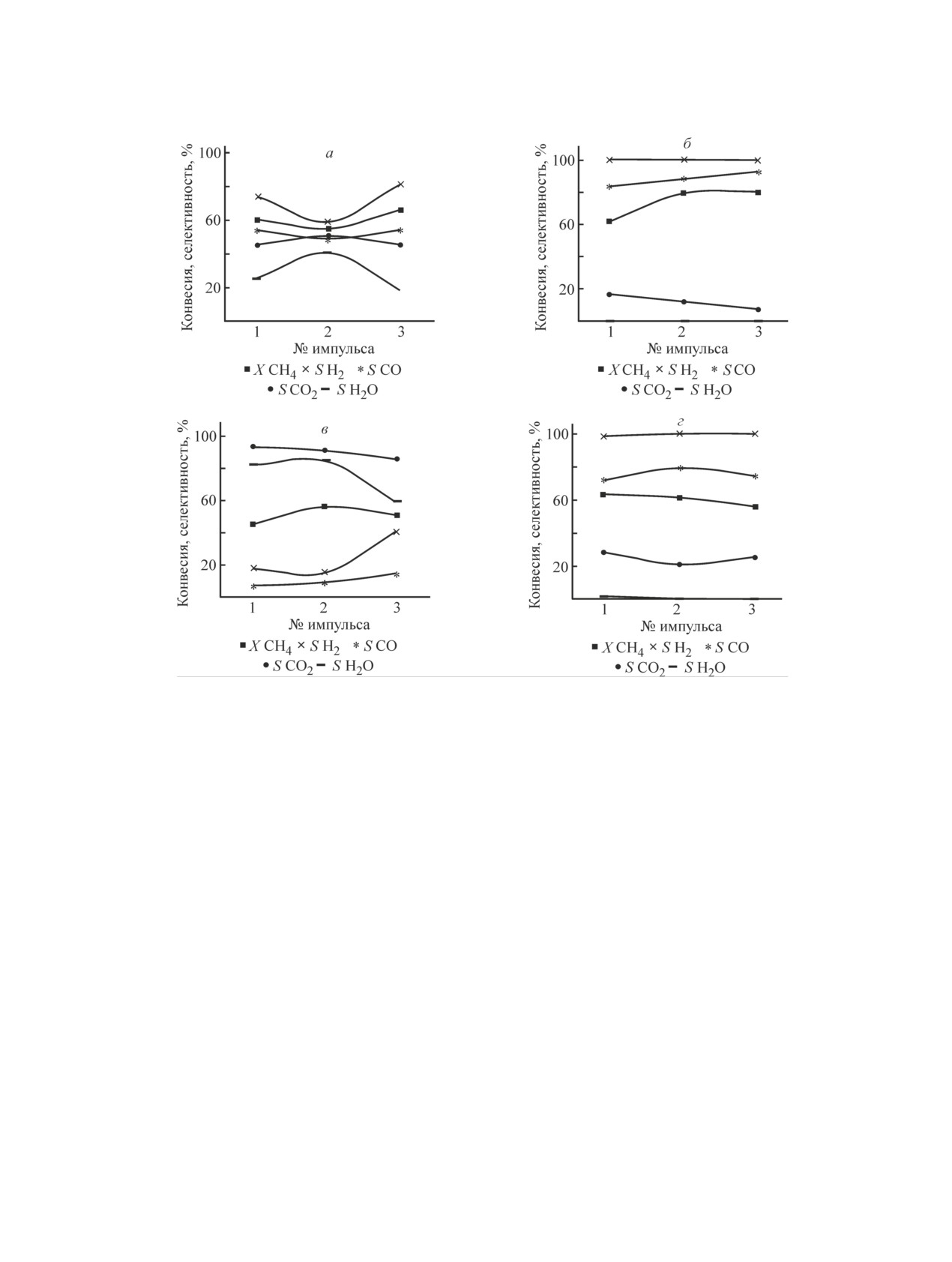
Конверсия метана (рис. 2) на образце № 1 состава
с разнообразием форм поверхностного и решеточного
10% (NiO + Co3O4)/γ-Al2O варьируется в пределах
кислорода в катализаторах, так и с их сложной ми-
55-66%, максимальная селективность по водоро-
кростуктурой.
ду 81.6% достигается на третьем импульсе подачи
Таблица 1
Химический состав образцов оксиднометаллических катализаторов
Химический состав, мас%, образца
Компонент
№ 1
№ 2
№ 3
№ 4
Al2O3
89.59
70.43
43.51
43.44
SiO2
0.32
0.23
0.89
41.56
NiO
4.88
14.13
27.32
7.19
Co3O4
4.61
14.29
26.61
6.50
Na2O
0.29
0.47
0.88
0.32
SO3
0.20
0.43
0.70
0.31
Fe2O3
0.11
0.02
0.09
0.68
К выбору микросферического катализатора парциального окисления метана в водородсодержащий газ
1645
Рис. 1. Кривые термопрограммируемого восстановления водородом.
Образец: а — № 1 [10% (NiO + Co3O4)/γ-Al2O3], б — № 2 [28% (NiO + Co3O4)/γ-Al2O3],
в — № 3 [50% (NiO + Co3O4)/γ-Al2O3], г — № 4 [14% (NiO + Co3O4)/AlSiOx].
сырья. Селективность по монооксиду углерода и ди-
Образец № 3 состава 50% (NiO + Co3O4)/γ-Al2O3,
оксиду углерода находится на уровне 50% в ходе
приготовленный с большим количеством активной
всего опыта. Заметна высокая селективность по воде,
фазы катализатора, нанесенной на оксид алюминия,
которая достигает 40% во втором импульсе метана,
однако показывает более низкие результаты конвер-
после чего на третьем импульсе сырья снижается до
сии метана в сравнении с результатами на катали-
18%, что свидетельствует о преимущественном про-
заторах с меньшим количеством оксидов никеля и
текании полного окисления метана.
кобальта в своем составе (рис. 2). Так, конверсия по
Влияние увеличения содержания активных метал-
СН4 варьировалась на уровне 50%. Селективность по
лов в составе оксиднометаллического катализатора
водороду в первом и втором импульсах метана невы-
показано на результатах окислительной конверсии
сока и составляет около 17%, хотя в третьем импульсе
на образце № 2 состава 28% (NiO + Co3O4)/γ-Al2O3.
подачи сырья наблюдается ее увеличение до 40%.
Конверсия по СН4 постепенно возрастает в ходе про-
Катализатор приводит к активному протеканию реак-
ведения эксперимента, достигая 80%. Селективность
ции полного окисления метана, о чем свидетельству-
по Н2 на протяжении всего опыта сохраняет свои зна-
ет высокая селективность по Н2О — около 82% на
чения на уровне 100%. Селективность по СО растет с
первом и втором импульсах подачи метана и 59% на
каждым импульсом от 83.7 до 92.8%, соответственно
третьем импульсе и 92%-ная селективность по СО2 в
постепенно снижается селективность по СО2 с 16.3
первом импульсе сырья, которая к третьему импульсу
в первом импульсе метана до 7.2% на третьем им-
снизилась лишь до 85.5%. Селективность по моно-
пульсе.
оксиду углерода хотя и растет с каждым импульсом
1646
Герзелиев И. М. и др.
Рис. 2. Зависимость конверсии метана и состава продуктов от числа импульсов СH4.
Образец: а — № 1 [10% (NiO + Co3O4)/γ-Al2O3], б — № 2 [28% (NiO + Co3O4)/γ-Al2O3],
в — № 3 [50% (NiO + Co3O4)/γ-Al2O3), г — № 4 [14% NiO + Co3O4/AlSiOx).
подачи СН4, но не превышает 20%. Возможно причи-
На образце № 1 в результате проведения окис-
ной наблюдаемого эффекта является перенасыщение
лительной конверсии метана наблюдается некото-
поверхности носителя модифицирующими оксидами
рое повышение содержания водорода и снижение
металла с образованием агломератов с меньшей ак-
концентрации метана. Полученная на образце № 2
тивностью фазы.
метановодородная смесь состоит преимущественно
В качестве носителя образца № 4 использовался
из водорода. Составы метановодородной смеси во
промышленный катализатор каталитического крекин-
втором и третьем импульсах подачи метана близ-
га. Состав образца № 4 — 14% NiO + Co3O4/AlSiOx.
ки. В составе продуктов окислительной конверсии
Конверсия по сырью на данном катализаторе по-
метана на оксиднометаллическом катализаторе № 3
степенно снижается, но незначительно, с 63 в пер-
содержится преимущественно метан с небольшим
вом импульсе метана до 53.8% в третьем импульсе
количеством водорода (табл. 2).
(рис. 1). Селективность по водороду составляет 100%.
Количество Н2 растет от импульса к импуль-
Селективность по монооксиду углерода принимает
су подачи метана, однако не превышает 11 мол%.
значения порядка 72%, а селективность по диокси-
Метановодородная смесь, получаемая в окислитель-
ду углерода — около 25%. Следовательно, возмож-
ной конверсии метана на образце № 4, содержит поч-
но использование в качестве носителя катализатора
ти двукратное содержание водорода по сравнению с
каталитического крекинга для синтеза оксидноме-
метаном. Н2 в образовавшемся газе более 60 мол%,
талического катализатора окислительной конверсии
остальную часть газа составляет СН4 в количестве
метана.
около 35 мол%. Можно отметить практически иден-
К выбору микросферического катализатора парциального окисления метана в водородсодержащий газ
1647
Информация об авторах
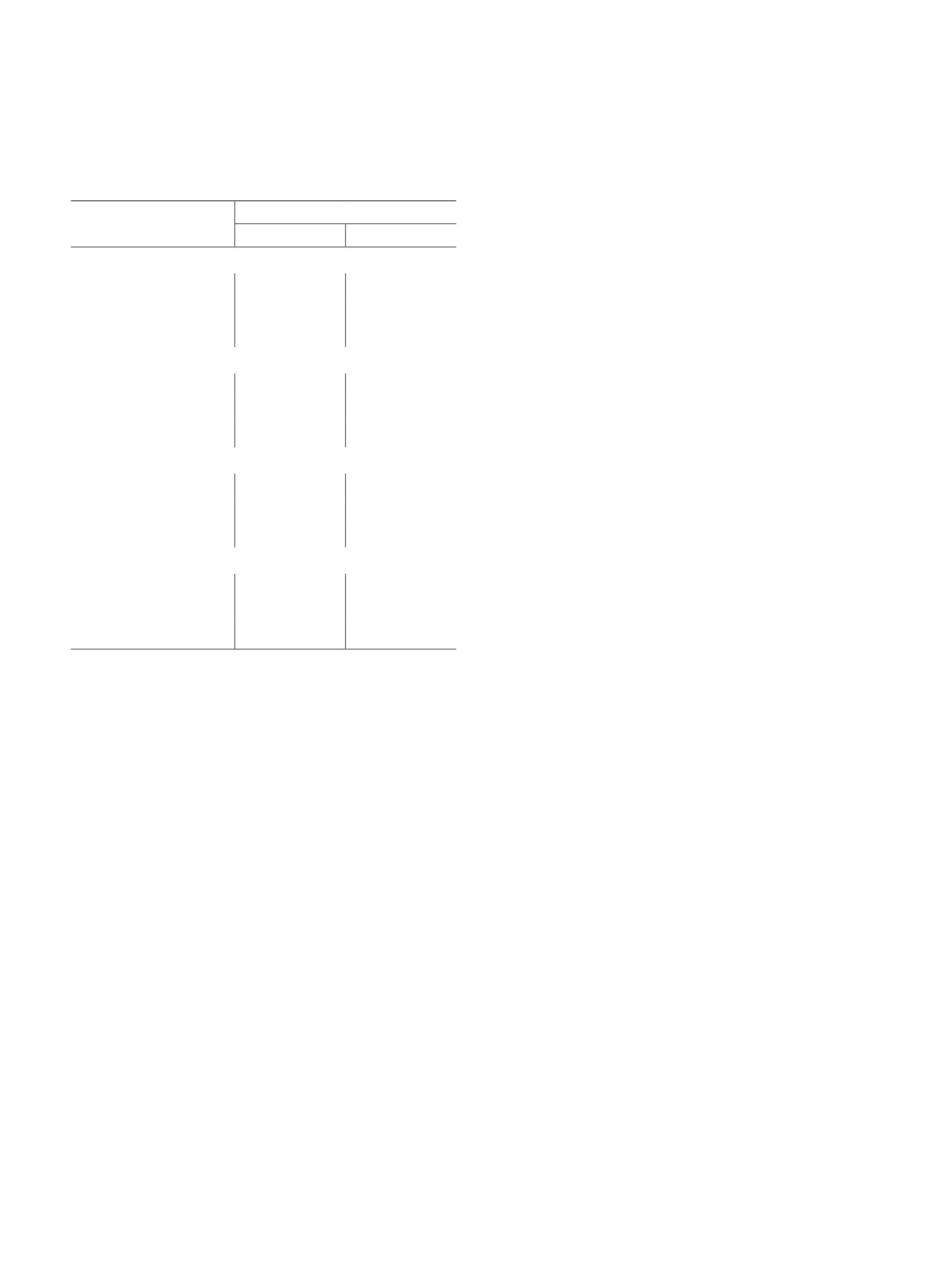
Таблица 2
Состав метановодородной смеси окислительной
Герзелиев Ильяс Магомедович, к.х.н.,
конверсии метана на оксиднометаллических образцах
Компонент, мол%
Подопригора Елена Викторовна,
№ импульса СН4
Н2
CH4
Пименов Андрей Александрович, д.т.н.,
Образец № 1
1
52.19
47.81
2
43.32
56.68
Финансирование работы
3
63.69
36.31
Работа выполнена при финансовой под-
Образец № 2
держке Минобрнауки РФ в рамках соглашения
1
71.83
28.17
№ 05.607.21.0311 от 02.12.19, уникальный иденти-
2
86.61
13.39
фикатор проекта RFMEFI60719X0311.
3
87.88
12.12
Образец № 3
Список литературы
1
5.16
94.84
[1]
Усачев Н. Я., Харламов В. В., Беланова Е. П., Каза-
2
8.07
91.93
ков А. В., Старостин Т. С., Канаев С. А. Проблемы
и перспективы конверсии углеводородов в син-
3
10.67
89.33
тез-газ // Нефтехимия. 2011. Т. 51. № 2. С. 107-
Образец № 4
1
65.81
34.19
of hydrocarbons to synthesis gas: Problems and
2
67.42
32.58
prospects // Petrol. Chem. 2011. V. 51. N 2. P. 107-117.
3
61.98
38.02
[2]
Билера И. В., Борисов А. А., Борунова А. Б.,
Колбановский Ю. А., Королев Ю. М., Россихин И. В.,
тичный состав метановодородной смеси на третьем
Трошин К. Я. Получение синтез-газа в процессе го-
импульсе подачи сырья с образцом № 1.
рения метана: образование сажи и ее физико-хими-
ческие характеристики // Нефтехимия. 2010. Т. 50.
Выводы
Результаты экспериментов по окислительной
конверсии метана в сопоставлении с данными
gas by the methane combustion process: The formation
термопрограммированного восстановления водо-
of soot and its physicochemical characteristics // Petrol.
Chem. 2010. V. 50. N 5. P. 351-355.
родом показали, что синтезированные образцы
Ni-Co-оксиднометаллической системы обладают
[3]
Hossain M., de Lasa H. Reduction and oxidation
способностью к неоднократным окислительно-вос-
kinetics of Co-Ni/Al2O3 oxygen carrier involved in a
становительным переходам (смене циклов реакция-
chemical-looping combustion cycles // Chem. Eng. Sci.
регенерация). Образцы состава 10% (NiO + Co3O4)/-
2010. V. 65. P. 98-106.
γ-Al2O3 и 14% (NiO + Co3O4)/AlSiOx с оптимальным
содержанием активных металлов могут быть реко-
[4]
Герзелиев И. М., Усачев Н. Я., Попов А. Ю., Хаджи-
мендованы для синтеза катализаторов конверсии
ев С. Н. Парциальное окисление низших алканов
метана с раздельной подачей сырья и окислителя в
активным решеточным кислородом оксидноме-
укрупненном масштабе.
таллических систем. Сообщение 2. Синтез контак-
тов-оксидантов и получение синтез-газа на пилот-
ной установке с лифт-реактором // Нефтехимия.
Конфликт интересов
2012. Т. 52. № 5. С. 339-347 [Gerzeliev I. M.,
Usachev N. Ya., Popov A. Yu., Khadzhiev S. N. Partial
Авторы заявляют об отсутствии конфликта инте-
oxidation of lower alkanes by active lattice oxygen of
ресов, требующего раскрытия в данной статье.
metal oxide systems: 2. Synthesis of solid contacts and
1648
Герзелиев И. М. и др.
syngas production in a pilot plant with a riser reactor
[13]
Hossain M., de Lasa H. Reactivity and stability of Co-
// Petrol. Chem. 2012. V. 52. N 5. P. 305-312.
Ni/Al2O3 oxygen carrier in multicycle CLC // AIChE
J. 2007. V. 53. P. 1817-1829.
[5]
Gayan P., Dueso C., Abad A., Adanez J., de
Diego L. F., García-Labiano F. NiO/Al2O3 oxygen
[14]
Дедов А. Г., Шляхтин О. А., Локтев А. С.,
carriers for chemical-looping combustion prepared by
Мазо Г. Н., Малышев С. А., Тюменова С. И.,
impregnation and deposition-precipitation methods //
Баранчиков А. Е., Моисеев И. И. Получение син-
Fuel. 2009. V. 88. P. 1016-1023.
тез-газа кислородной конверсией метана. Новые
катализаторы на основе сложнооксидных кобаль-
[6]
Ishida M., Jin H., Okamoto T. A fundamental study of
татов-никелатов неодима-кальция // Нефтехимия.
a new kind of medium material for chemical-looping
2018. Т. 58. № 1. С. 47-51 [Dedov A. G., Loktev A. S.,
combustion // Energy Fuels. 1996. V. 10. P. 958-963.
Tyumenova S. I., Moiseev I. I., Shlyakhtin O. A.,
Mazo G. N., Malyshev S. A., Baranchikov A. E. Partial
[7]
Cho P., Mattisson T., Lyngfelt A. Comparison of iron-,
nickel-, copper- and manganesebased oxygen carriers
for chemical-looping combustion // Fuel. 2004. V. 83.
P. 1215-1225.
P. 47-51.
[8]
Cao Y., Casenas C., Pan W.-P. Investigation of
[15]
Лугвищук Д. С., Кульчаковский П. И., Митберг Э. Б.,
chemical looping combustion by solid fuels. 2. Redox
Мордкович В. З. Сажеобразование в процессе пар-
reaction kinetics and product characterization with
циального окисления метана в условиях частично-
coal, biomass, and solid waste as solid fuels and СuО
го насыщения парами воды // Нефтехимия. 2018.
as an oxygen carrier // Energy Fuels. 2006. V. 20.
Т. 58. № 3. С. 324-331.
[9]
Abad A., Mattisson T., Lyngfelt A., Johansson M. The
use of iron oxide as oxygen carrier in a chemical-
Mordkovich V. Z
. Soot formation in the methane partial
looping reactor // Fuel. 2007. V. 86. P. 1021-1035.
oxidation process under conditions of partial saturation
with water vapor // Petrol. Chem. 2018. V. 58. N 5.
[10]
Gayan P., de Diego L. F., García-Labiano F.,
P. 427-433.
Adanez J., Abad A., Dueso C. Effect of support on
reactivity and selectivity of Ni-based oxygen carriers
[16]
for chemical-looping combustion // Fuel. 2008. V. 87.
кислорода и их реакционная способность в
P. 2641-2650.
замещенных перовскитах La1-xSRxCOO3-y
(x = 0-1), приготовленных механохимическим
[11]
Hossain M. M., Lopez D., Herrera J., de Lasa H. I.
способом // Кинетика и катализ. 2009. Т. 50.
Nickel on lanthanum-modified γ-Al2O3 oxygen carrier
№ 2. С. 290-299 [Yakovleva I. S., Isupova L. A.,
for CLC: Reactivity and stability // Catal. Today. 2009.
Rogov V. A. Oxygen species and their reactivity in the
143. P. 179-186.
mechanochemically prepared substituted perovskites
[12]
Jin H., Ishida M. Reactivity study on natural-gas-
fueled chemical-looping combustion by a fixed-bed
reactor // Ind. Eng. Chem. Res. 2002. V. 41. P. 4004-