Исследование адсорбции 1,2-дихлорбензола на углеродном наноматериале...
1779
Журнал прикладной химии. 2020. Т. 93. Вып. 12
УДК 544.723.2
ИССЛЕДОВАНИЕ АДСОРБЦИИ 1,2-ДИХЛОРБЕНЗОЛА
НА УГЛЕРОДНОМ НАНОМАТЕРИАЛЕ, ПОЛУЧЕННОМ В РЕЗУЛЬТАТЕ
РАЗЛОЖЕНИЯ 1,2-ДИХЛОРЭТАНА НА СПЛАВАХ НИКЕЛЯ
© Ю. И. Бауман1,3, О. В. Нецкина1,2, С. А. Муха1, И. В. Мишаков1,3,
Ю. В. Шубин2,4, В. О. Стояновский1, А. Ю. Наливайко3,
А. А. Ведягин1,3, А. А. Громов3
1 Институт катализа им. Г. К. Борескова СО РАН,
630090, г. Новосибирск, пр. Академика Лаврентьева, д. 5
2 Новосибирский национальный исследовательский государственный университет,
630090, г. Новосибирск, ул. Пирогова, д. 2
3 Национальный исследовательский технологический университет «МИСиС»,
119049, г. Москва, Ленинский пр., д. 4
4 Институт неорганической химии им. А. В. Николаева СО РАН,
630090, г. Новосибирск, пр. Академика Лаврентьева, д. 3
E-mail: bauman@catalysis.ru
Поступила в Редакцию 8 октября 2020 г.
После доработки 28 октября 2020 г.
Принята к публикации 6 ноября 2020 г.
Представлена концепция комплексной переработки хлорзамещенных углеводородов, включающая
каталитическое разложение 1,2-дихлорэтана на сплавах Ni-M с получением углеродного нанома-
териала (УНМ), который может служить в качестве эффективного сорбента для адсорбционной
очистки воды от 1,2-дихлорбензола. В работе синтезирована и исследована серия микродисперсных
сплавов Ni-Pd (5%) и Ni-Mo (5%). Образцы изучены в качестве катализаторов в реакции разложе-
ния паров C2H4Cl2 при 600°С с получением углеродного наноматериала. Показано, что добавление
5% второго металла к никелю способствует увеличению выхода углеродного наноматериала с 20.1
до 25.4 (Ni-Pd) и 31.8 гУНМ∙г-1кат (Ni-Mo). По данным электронной микроскопии и спектроскопии
комбинационного рассеяния, углеродный продукт представлен нановолокнами сегментированной
структуры, состоящими из плохо упорядоченной фазы графита. Удельная поверхность углеродного
наноматериала составила 230-280 м2∙г-1. Полученные образцы УНМ/Ni, УНМ/Ni-Pd и УНМ/Ni-Mo
испытаны в качестве адсорбентов, использующихся для очистки воды от растворенного 1,2-дихлор-
бензола (с0 = 73-880 мкмоль∙л-1) в режиме статической адсорбции. Построены изотермы адсорбции
1,2-дихлорбензола и установлено, что степень заполнения поверхности образцов углеродного нано-
материала адсорбатом при достижении равновесного состояния составляет 43-47%, что более
чем в 2 раза превышает эффективность использования активного угля АГ-2000 (SБЭТ = 1230 м2∙г-1).
Ключевые слова: углеродная эрозия; углеродные нановолокна; сплавы никеля; хлорорганические со-
единения; 1,2-дихлорэтан; каталитическое разложение; 1,2-дихлорбензол; адсорбция; адсорбционная
емкость; утилизация хлоруглеводородов; очистка воды
DOI: 10.31857/S0044461820120099
Хлорорганические соединения широко исполь-
масел, пестицидов, а также как промежуточные со-
зуются в промышленности и сельском хозяйстве в
единения при получении устойчивых красителей,
качестве реагентов для гидроразрыва нефте- и газо-
пигментов, антибактериальных препаратов [пропитка
носных пластов, растворителей, трансформаторных
для древесины, кожаных изделий] и лекарственных
1780
Бауман Ю. И. и др.
субстанций [1]. Алифатические хлорзамещенные
способ каталитического разложения хлороргани-
углеводороды [например, 1,2-дихлорэтан (1,2-ДХЭ)]
ческих соединений, позволяющий перерабатывать
применяются в крупнотоннажном синтезе мономе-
многокомпонентную смесь хлорзамещенных угле-
ров, использующихся в процессах полимеризации
водородов с получением углеродного наноматериала
(получение поливинилхлорида). Синтез винилхло-
в качестве основного продукта [8]. В наших недав-
рида из 1,2-дихлорэтана сопровождается накоплени-
них работах показана перспектива использования
ем значительного количества отходов, переработка
массивных сплавов Ni-M (M = Cr, Pd, Mo и т. д.) в
которых представляет серьезную проблему [2]. В то
качестве катализаторов для данного процесса [9].
же время хлорорганические соединения, особенно
Формирование активных частиц, катализирующих
ароматического ряда, обладают высокой токсично-
рост углеродных нитей, происходит в результате угле-
стью для живых организмов. Следует отметить, что
родной эрозии сплава, спонтанно протекающей в ходе
эти соединения очень медленно разлагаются в окру-
контакта Ni-M с коррозионно-агрессивной реакци-
жающей среде [3].
онной средой, содержащей пары хлоруглеводородов.
Вследствие высокой стабильности хлорсодержа-
Использование промотирующих добавок металлов в
щие ароматические соединения были отнесены к
составе сплавов с никелем позволяет обеспечивать
стойким органическим загрязнителям, которые при-
высокую производительность катализаторов по угле-
знаны опасными для здоровья человека и окружаю-
родному продукту — 100 г∙г-1кат и более. В недавних
щей среды [4]. Согласно Стокгольмской конвенции о
работах было показано, что палладий [10] и молибден
стойких органических загрязнителях,*1 промышлен-
[11] относятся к числу наиболее эффективных моди-
но-произведенные соединения данного типа должны
фикаторов, позволяющих повысить каталитическую
быть ликвидированы, а также уменьшено количество
активность и стабильность никеля на примере реак-
непреднамеренно образующихся выбросов стойких
ции каталитического пиролиза 1,2-дихлорэтана.
органических загрязнителей. Тем не менее полностью
Цель работы — исследование адсорбционной спо-
отказаться от использования хлорароматических со-
собности углеродного наноматериала, образующегося
единений невозможно, поэтому остро стоит вопрос
в качестве продукта каталитического разложения
разработки технологий очистки сточных вод от этих
1,2-дихлорэтана, по отношению к ароматическому
соединений. Отдельной задачей является ликвидация
хлорзамещенному углеводороду — 1,2-дихлорбен-
последствий выбросов хлорароматических соедине-
золу (1,2-ДХБ).
ний в окружающую среду, поскольку перед утилиза-
цией требуется их извлечение из природных объектов,
Экспериментальная часть
где они могут содержаться в чрезвычайно низкой
концентрации вследствие их плохой растворимости.
В качестве предшественников катализаторов были
Так, содержание в воде растворенного 1,2-дихлорбен-
приготовлены массивные микродисперсные спла-
зола не превышает 0.129 г∙л-1, или 880 мкмоль∙л-1,
вы на основе никеля — Ni-Pd и Ni-Mo, содержа-
при 20°С.**2
щие 5 мас% палладия и молибдена соответственно.
Основным способом очистки воды от хлорор-
Образцы сплавов были синтезированы методом осаж-
ганических соединений является их адсорбция на
дения с последующей прокалкой осадка в восстанови-
активных углях [5, 6]. Концентрирование данных
тельной среде [12]. Для получения сплавов Ni-Pd ис-
соединений на адсорбенте позволяет вернуть их в тех-
пользовали растворы K2PdCl4 (ОАО «Красцветмет»,
нологический цикл, в том числе в качестве исходного
х.ч.) и Ni(NO3)2·6H2O (ОАО «РЕАКТИВ», х.ч.), а в
сырья для синтеза углеродных материалов [7], кото-
качестве осадителя — раствор 0.1 М NaHCO3 (ЗАО
рые в дальнейшем можно использовать как адсорбен-
«Союзхимпром», х.ч.). Полученный осадок тщатель-
ты в очистке сточных вод от хлорорганических за-
но промывали, сушили и затем подвергали восстано-
грязнений, включая хлорароматические соединения.
вительной термообработке при 800°С в атмосфере
Наиболее привлекательным методом переработ-
водорода. Аналогичная методика была применена для
ки хлорорганических соединений представляется
приготовления образца сравнения Ni(100%).
Синтез никель-молибденовых сплавов прово-
дили из солей никеля и молибдена: [Ni(NH3)6]Cl2
* Стокгольмская конвенция о стойких органических
(синтезирован по методике***3) и (NH4)6Mo7O24 (АО
загрязнителях. Ратифицирована Федеральным законом
№ 164-ФЗ от 27.06.2011.
** Yalkowsky S. H., Yan H. Handbook of aqueous solubility
*** Ключников Н. Г. Руководство по неорганическому
data. CRC Press, 2003. P. 205-206.
синтезу. М.: Химия, 1965. С. 372.
Исследование адсорбции 1,2-дихлорбензола на углеродном наноматериале...
1781
«РЕАХИМ», х.ч.). Cоли-предшественники в необхо-
вого анализа на дифрактометре XRD-7000 (Shimadzu)
димом соотношении растворяли в 10%-ном растворе
с излучением CuKα (Ni-фильтр) при длине волны
NH3·H2O (ООО «Сигма Тек», х.ч.). Полученный рас-
1.54178 Å. Для определения фазового состава вы-
твор приливали к избытку ацетона (АО «РЕАХИМ»,
полняли сканирование в диапазоне углов 2θ 10°-120°
ос.ч.), предварительно охлажденного до 0°С.
с шагом 0.05°. Для уточнения параметров ячейки
Выпавший осадок отфильтровывали, промывали и
проводили дополнительное сканирование в дальних
сушили на воздухе в течение 12 ч, после чего про-
углах 2θ = 140°-147° [область рефлекса (331)] с ша-
каливали в токе водорода при температуре 800°С в
гом 0.02°. Средний размер первичных кристаллитов
течение 1 ч. Охлаждение образцов проводили в токе
(область когерентного рассеяния) оценивали по фор-
гелия.
муле Шеррера.
Полученные сплавы никеля (Ni, Ni-Pd и Ni-Mo)
Химический состав полученных сплавов контро-
были использованы в качестве предшественников
лировали методом атомно-абсорбционной спектроме-
для самоорганизующихся катализаторов разложения
трии на спектрофотометре ICE-3000 (Solaar). Перед
хлорзамещенных углеводородов. Каталитическое
измерением навеску образцов растворяли в азотной
разложение 1,2-дихлорэтана (ООО «Компонент-
кислоте.
Реактив», х.ч.) с получением углеродного нанома-
Исследование вторичной структуры исходных
териала (УНМ) осуществляли в проточном реакторе
сплавов и соответствующего углеродного продук-
с кварцевым вкладышем при 600°C. После загрузки
та проводили при помощи растровой электрон-
навески сплава в реактор-вкладыш проводили нагрев
ной микроскопии на приборе JSM-6460 (JEOL).
печи реактора в потоке инертного газа-носителя до
Морфологические особенности тонкой структуры
требуемой температуры реакции. Навеска предше-
углеродных наноматериалов были изучены методом
ственника катализатора составляла 2.00 ± 0.02 мг.
просвечивающей электронной микроскопии на ми-
Скорость нагрева печи составляла 15 град∙мин-1. По
кроскопе JEM-2010CX (JEOL).
достижении температуры реакции образец подверга-
Текстурные характеристики полученных углерод-
ли обработке в потоке водорода в течение 15-20 мин
ных наноматериалов определяли методом низкотем-
с целью активации поверхности.
пературной адсорбции/десорбции азота. Изотермы
По окончании стадии восстановления образца в
адсорбции измеряли при 77 K на автоматизированном
реактор подавали реакционную смесь, содержащую
приборе ASAP-2400 (Micromeritics). Температура
пары 1,2-дихлорэтана (6 об%), водород (38 об%) и
предварительной дегазации образцов углеродного
аргон (56 об%). В результате взаимодействия об-
наноматериала составляла 300°С.
разца сплава с реакционной смесью происходило
Спектры комбинационного рассеяния образцов
накопление углеродного продукта за счет разложения
регистрировали на спектрометре комбинационно-
C2H4Cl2. Время реакции составляло 2 ч. По заверше-
го рассеяния Horiba Jobin Yvon HR800 (Horiba), ос-
нии эксперимента реактор охлаждали в потоке аргона
нащенном микроскопом Olympus BX41 (Olympus),
до температуры окружающей среды и выгружали об-
1024-пиксельным CCD-детектором, решеткой
разец углеродного наноматериала. Количество обра-
1800 г·мм-1 и лазером Nd:YAG с длиной волны
зовавшегося углеродного продукта на образце сплава
532 нм и мощностью 15 мВт. Спектры регистриро-
определялось взвешиванием на аналитических весах.
вали в геометрии обратного рассеяния с использо-
Расчет выхода углеродного продукта проводили
ванием объектива SLMPlan N 50× с размером пятна
по формуле
в фокусе ~2 мкм. Мощность лазера дополнительно
ослаблялась для предотвращения термического раз-
(1)
ложения образцов до уровня ниже 0.8 мВт.
Изучение адсорбционных свойств синтезирован-
где χ — удельный выход углеродного продукта
ных образцов углеродного наноматериала по отно-
(гУНМ·г-1кат), mпрод — масса углеродного продукта
шению к 1,2-дихлорбензолу (Sigma-Aldrich, х.ч.)
после эксперимента (г),
— масса навески образца
проводили в равновесных условиях [13]. В качестве
сплава (г).
образца сравнения использовали активный уголь мар-
Образцы углеродного наноматериала, синтези-
ки АГ-2000 (АО «ЭНПО «Неорганика»). Процесс
рованные в результате разложения 1,2-дихлорэтана,
адсорбции изучали статическим методом. Растворы
обозначены: УНМ/Ni, УНМ/NiPd и УНМ/NiMo.
1,2-дихлорбензола готовили путем разбавления
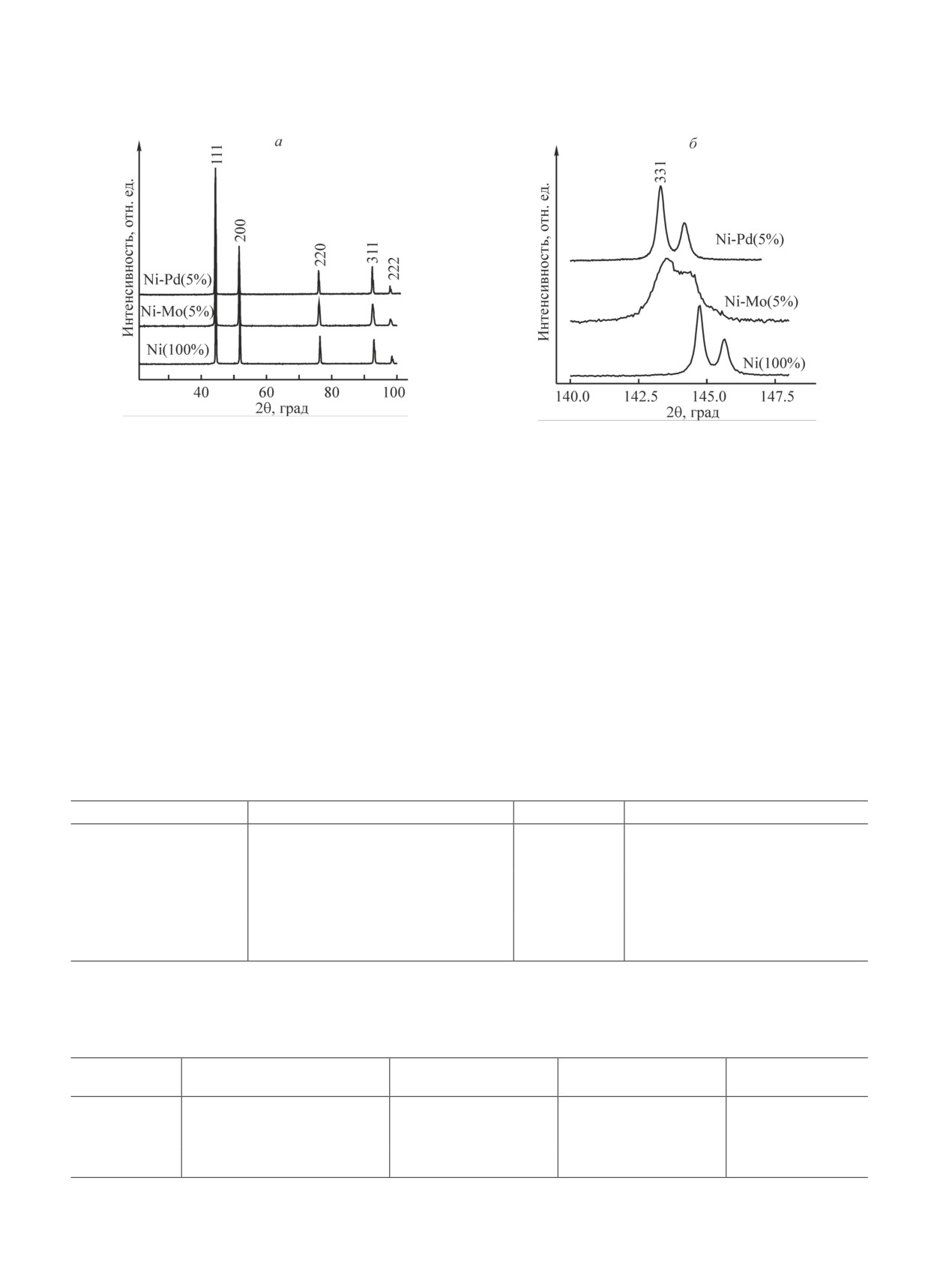
Фазовый состав образцов-предшественников Ni,
насыщенного водного раствора (880 мкмоль·л-1).
Ni-Pd и Ni-Mo исследовали методом рентгенофазо-
Навески углеродных материалов массой 0.006 г по-
1782
Бауман Ю. И. и др.
мещали в приготовленные растворы объемом 60 мл.
Дифрактограммы исходных сплавов в области
Во избежание влияния внутридиффузионного фак-
углов 2θ = 20°-100° представлены набором рефлек-
тора растворы с навеской углеродного наноматери-
сов, характерных для гранецентрированной кубиче-
ала равномерно встряхивали с помощью шейкера
ской решетки никеля (рис. 2, а). Дополнительных
(LS-110, LOIP). Продолжительность процесса адсо-
пиков, относящихся к палладию или молибдену, не
рбции составляла 24 ч при температуре 20°С [14].
обнаружено, что свидетельствует об образовании
Концентрацию водного раствора 1,2-дихлорбен-
однофазных твердых растворов (сплавов) на основе
зола до и после адсорбции определяли методом УФ-
никеля. О формировании твердых растворов Ni-Pd
спектроскопии (Cary 100, Varian) [15]. Следует отме-
и Ni-Mo также свидетельствует характерное смеще-
тить, что в спектре 1,2-дихлорбензола присутствуют
ние рефлексов в область малых углов. Наиболее оче-
три полосы поглощения, которые характерны для
видным образом этот эффект проявляется в области
бензола и всех его производных. Для расчета концен-
дальних углов, например, для пика (331) в области
трации 1,2-дихлорбензола в растворе использовали
145° (рис. 2, б).
значение оптической плотности при длинах волн 269
Согласно расчетам, при введении 5% палладия
и 276 нм, соответствующих максимальному поглоще-
или молибдена в состав сплава с никелем (исходный
нию. Значение концентрации определяли для каждой
параметр решетки а = 3.524 Å) происходит увеличе-
полосы поглощения по отдельности, после чего вы-
ние размера ячейки до 3.538 и 3.542 Å соответственно
числяли среднюю концентрацию 1,2-дихлорбензола
(табл. 1). По формуле Шеррера была произведена
в растворе.
оценка размера кристаллитов (областей когерент-
Величину адсорбции 1,2-дихлорбензола опреде-
ного рассеяния) для всех образцов (табл. 1). Размер
ляли по формуле
первичного кристаллита (область когерентного рас-
сеяния) для образцов Ni(100%) и Ni-Pd(5%) составил
(2)
70-90 нм, тогда как для сплава Ni-Mo(5%) данный
параметр оказался существенно меньше (12 нм), что
может быть связано со значительной разницей в тем-
где А — адсорбционная емкость углеродного нано-
пературе плавления металлического никеля (1453°C)
материала по 1,2-дихлорбензолу (мкмоль1,2-ДХБ·г-1);
и молибдена (2623°C).
∆с — разность концентраций раствора 1,2-ди-
Полученные однофазные сплавы Ni-Pd и Ni-Mo
хлорбензола до и после адсорбции (мкмоль·л-1);
и образец сравнения Ni(100%) были использованы в
Vраствора — объем раствора, содержащего адсорбат
качестве предшественников катализаторов в реакции
(л); mУНМ — масса углеродного наноматериала (г).
разложения 1,2-дихлорэтана в смеси с водородом
и аргоном. В результате воздействия агрессивной
Обсуждение результатов
реакционной среды происходит быстрый процесс
углеродной эрозии сплава, индукционный период для
Предшественники катализаторов Ni-M, синте-
которого составляет 10-20 мин в зависимости от со-
зированные методом соосаждения с последующим
става сплава Ni-M [9]. По окончании индукционного
спеканием в восстановительной атмосфере, представ-
периода процесс переходит в стадию дезинтеграции
ляют собой микродисперсные материалы со структу-
сплава, который сопровождается интенсивным ро-
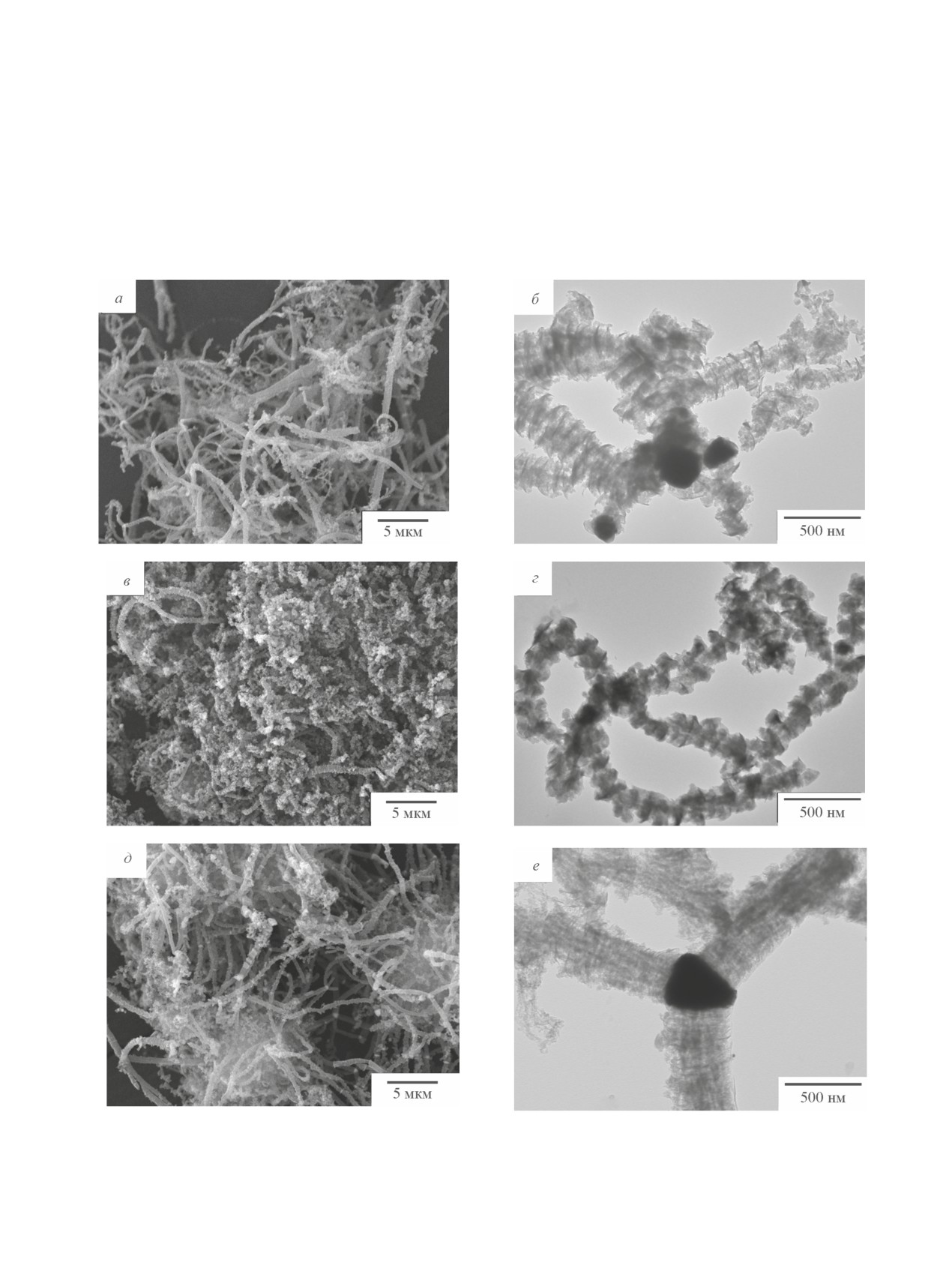
рой, подобной губке (рис. 1).
стом углеродных нитей на дисперсных металличских
Рис. 1. Изображения растровой электронной микроскопии предшественников катализаторов, синтезированных
методом соосаждения с последующим восстановлением: Ni (а), Ni-Pd(5%) (б) и Ni-Mo(5%) (в).
Исследование адсорбции 1,2-дихлорбензола на углеродном наноматериале...
1783
Рис. 2. Дифрактограммы образцов исходных сплавов Ni-Mo(5%) и Ni-Pd(5%) и образца сравнения Ni(100%).
а — обзорная картина в области 2θ = 20°-100°, б — пики (331) в области дальних углов.
частицах, формирующихся в ходе разрушения ис-
в состав никелевого сплава способствует увеличе-
ходного образца. Оценки показали, что полная де-
нию производительности катализатора на 25-50%.
зинтеграция 1 г массивного никеля приводит к об-
Полученные данные хорошо согласуются с ранее
разованию примерно 1012 активных частиц роста
опубликованными работами, в которых обнаружено
углеродных нитей со средним размером ~250 нм.
наличие значительного промотирующего эффекта до-
Следует отметить, что образцы сплавов Ni-Pd(5%)
бавки палладия и молибдена к никелевому катализа-
и Ni-Mo(5%) показали заметно больший выход угле-
тору [16, 17]. Синтезированный углеродный продукт
родного продукта (25.6 и 31.8 г·г-1кат соответствен-
представляет собой сравнительно легкий порошко-
но) по сравнению с чистым никелем (20.1 г·г-1кат).
образный материал (особенно в случае образца УНМ/
Таким образом, добавка молибдена или палладия
NiPd) с насыпной плотностью не более 0.20 г·мл-1.
Таблица 1
Рентгеноструктурные характеристики исходных Ni (100%), Ni—Mo (5%) и Ni—Pd (5%) сплавов (данные метода
рентгенофазового анализа)
Состав предшественника
Фазовый состав
a, Å
Область когерентного рассеяния, нм
Ni(100%)
Никель (гранецентрированная кубиче-
3.524(1)
90
ская решетка)
Ni-Pd(5%)
Твердый раствор Ni-Pd (гранецентри-
3.538(1)
73
рованная кубическая решетка)
Ni-Mo(5%)
Твердый раствор Ni-Mo (гранецентри-
3.542(3)
12
рованная кубическая решетка)
Таблица 2
Характеристики углеродных материалов, полученных в результате разложения 1,2-дихлорэтана на сплавах
Ni-M при 600°С
Выход углеродного
Насыпная плотность,
Удельная поверхность,
Образец
Объем пор, см3·г-1
наноматериала за 2 ч, г·г-1кат
г·мл-1
м2·г-1
УНМ/Ni
20.1
0.16
230
0.29
УНМ/NiPd
25.6
0.03
280
0.45
УНМ/NiMo
31.8
0.20
240
0.32
1784
Бауман Ю. И. и др.
По данным метода низкотемпературной адсорбции/
Вторичная структура и морфологические особен-
десорбции азота, полученные образцы углеродных
ности полученного углеродного продукта были изу-
наноматериалов характеризуются развитой удельной
чены при помощи методов растровой и просвечива-
поверхностью — от 230 до 280 м2·г-1. Максимальный
ющей электронной микроскопии (рис. 3).
объем пор (0.45 см3·г-1) зафиксирован для образца
Морфология углеродных отложений представ-
УНМ/NiPd (табл. 2).
лена преимущественно волокнами, диаметр кото-
Рис. 3. Морфология и структура углеродного продукта, полученного на самоорганизующихся катализаторах:
Ni(100%) (а, б), Ni-Mo(5%) (в, г) и Ni-Pd(5%) (д, е) разложением смеси C2H4Cl2/H2/Ar при 600°C.
Изображения растровой (а, в, д) и просвечивающей (б, г, е) электронной микроскопии.
Исследование адсорбции 1,2-дихлорбензола на углеродном наноматериале...
1785
рых не превышает 0.5 мкм (рис. 3, а, в, д). В случае
использования образцов Ni и Ni-Pd формируются
достаточно длинные углеродные нити, тогда как об-
разец УНМ/NiMo состоит в основном из коротких
нановолокон. Рост наблюдаемых углеродных нитей
осуществляется за счет каталитического действия
активных металлических частиц, сформировавшихся
в результате спонтанной углеродной эрозии сплава.
Металлические частицы, катализирующие рост
углеродных волокон, можно видеть на снимках про-
свечивающей электронной микроскопии (рис. 3, б, е).
Следует отметить, что в составе всех образцов угле-
родные нити характеризуются весьма четко выра-
женным сегментированным строением. Данный факт
наблюдается для случая каталитического разложения
C2H4Cl2 практически на всех сплавах никеля Ni-M
Рис. 4. Спектры комбинационного рассеяния образцов
в схожих реакционных условиях. Данная структур-
УНМ/Ni, УНМ/NiPd и УНМ/NiMo, полученных раз-
ная особенность углеродных нитей объясняется от-
ложением смеси C2H4Cl2/H2/Ar на соответствующих
равляющим действием хемосорбированного хлора,
катализаторах при 600°С.
присутствующего на поверхности активных частиц,
На вставке — зависимость отношения интенсивностей
что привносит периодические флуктуации в характер
линий D и G.
диффузии атомов углерода к местам формирования и
роста графитоподобных нитей [18, 19]. В результате
были испытаны в качестве сорбентов для очистки
воздействия хлора наблюдается образование плохо
воды от растворенной примеси 1,2-дихлорбензола.
упорядоченных углеродных нитей с множеством де-
Адсорбционные свойства углеродных материалов,
фектов и пропусков в упаковке графеновых слоев,
традиционно используемых в адсорбционной очист-
что является общей закономерностью при каталити-
ке, в значительной степени зависят от их текстурных
ческом разложении хлорзамещенных углеводородов
характеристик [23], наличия примесей [24], а также
[7, 9].
состава и концентрации функциональных групп на
Спектр комбинационного рассеяния первого по-
поверхности [25, 26].
рядка для образца УНМ/Ni характеризуется интен-
Адсорбционные свойства синтезированных об-
сивными линиями двух типов: G-линия в области
разцов углеродных наноматериалов по отношению
~1583 см-1 (разрешенные колебания E2g гексаго-
к 1,2-дихлорбензолу исследовали в статическом ре-
нальной решетки графита [20]) и D-линия в области
жиме при варьировании концентрации адсорбата
1341 см-1 (деформационные колебания A1g [21, 22]).
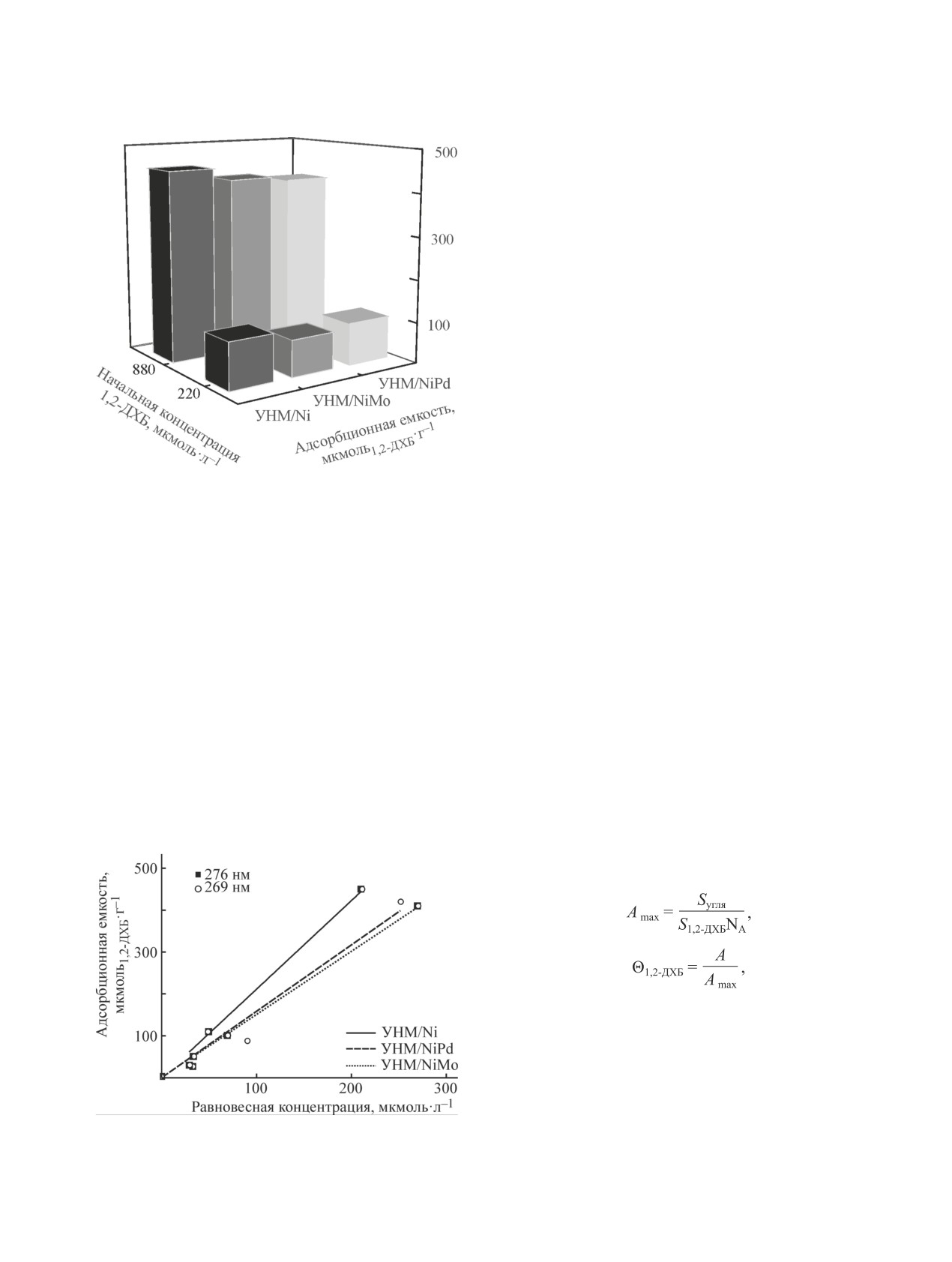
в водном растворе (рис. 5). Наиболее высокая ад-
Полуширина линии G на полувысоте (HWHM) со-
сорбционная емкость по отношению к 1,2-дихлор-
ставляет 70 см-1, для D-линии — ~65 см-1. Линии
бензолу достигается для углеродного продукта, по-
второго порядка 2D в области ~2682 см-1 выражены
лученного разложением 1,2-дихлорэтана на чистом
незначительно.
никеле (УНМ/Ni). Адсорбционная емкость образцов
Модифицирование никеля добавкой 5% второго
УНМ/NiMo и УНМ/NiPd по отношению к 1,2-дихлор-
металла (Pd или Mo) приводит к уменьшению пара-
бензолу оказалась несколько ниже (на 5-10%). При
метра ID/IG (отношение интенсивности линий D и
снижении начальной концентрации 1,2-дихлорбензо-
G), полуширин линий D и G, а также интенсивности
ла в 4 раза (до 220 мкмоль·л-1) наблюдается практи-
линий второго порядка 2D, что свидетельствует о
чески пропорциональное понижение адсорбционной
снижении степени упорядоченности графитоподоб-
емкости для всех образцов.
ного материала в составе углеродного продукта. По
Следует подчеркнуть, что наблюдаемые различия
сравнению с образцом УНМ/Ni наиболее сильные
в адсорбционных свойствах образцов УНМ/Ni, УНМ/
изменения спектров комбинационного рассеяния
NiMo и УНМ/NiPd несущественны. При этом также
наблюдаются для образца УНМ/NiMo: отношение
не прослеживается взаимосвязи адсорбционной ем-
ID/IG уменьшается с 1.91 до 1.47 (рис. 4, вставка).
кости с текстурными параметрами образцов (табл. 2).
Углеродные наноматериалы, полученные в резуль-
Возможно, при изменении природы второго металла
тате каталитического разложения 1,2-дихлорэтана,
изменяется состав функциональных групп на поверх-
1786
Бауман Ю. И. и др.
По классификации Гилеса [27], полученные зави-
симости являются изотермами класса С1, что свиде-
тельствует о недостижении насыщения поверхности
нановолокнистых углеродных материалов адсорбатом
в области концентрации 1,2-дихлорбензола от 880 до
73.3 мкмоль·л-1.
При аппроксимации экспериментальных данных
с помощью линейной модели были определены кон-
станты адсорбции (KГенри) (2.11, 1.59 и 1.51 л·г-1
для образцов УНМ/Ni, УНМ/NiPd и УНМ/NiMo со-
ответственно). Эти величины значительно меньше
константы адсорбции, вычисленной для образца срав-
нения АГ-2000 (KГенри = 6.20), поскольку активный
уголь обладает намного более развитой поверхностью
(табл. 3). В то же время если отнести величины адсо-
рбционной емкости к площади поверхности адсор-
бентов, то становится очевидным, что адсорбция
Рис. 5. Адсорбционная емкость образцов УНМ/Ni,
1,2-дихлорбензола протекает более эффективно на
УНМ/NiMo и УНМ/NiPd по отношению к 1,2-дихлор-
образцах углеродных материалов, чем на активиро-
бензолу при разной начальной концентрации адсорбата
ванном угле АГ-2000 (табл. 3).
в растворе.
Следует упомянуть, что изотерма Генри является
частным случаем изотермы Ленгмюра при малом
ности углеродных нитей, что в итоге отражается на
заполнении поверхности адсорбента из низкокон-
их адсорбционной способности.
центрированных растворов. Согласно монослойной
Для описания особенностей процесса адсорбции
модели адсорбции Ленгмюра, на поверхности ад-
1,2-дихлорбензола на образцах УНМ/Ni, УНМ/NiMo
сорбента может адсорбироваться лишь один слой
и УНМ/NiPd были получены изотермы адсорбции в
1,2-дихлорбензола, поэтому с увеличением концен-
равновесных условиях. Равновесную концентрацию
трации растворенного вещества происходит насыще-
1,2-дихлорбензола в растворе для расчета величин
ние поверхности углеродных материалов молекулами
адсорбции определяли методом УФ-спектроскопии
адсорбата, достигая максимальной адсорбционной
при длинах волн 269 и 276 нм. Следует отметить, что
емкости монослоя. Располагая сведениями о вели-
величины адсорбционной емкости, рассчитанные при
чине удельной поверхности адсорбентов и диаметре
данных длинах волн, хорошо совпадают с экспери-
молекулы 1,2-дихлорбензола (0.73 нм) [28], можно
ментальными изотермами адсорбции (рис. 6).
вычислить максимальную адсорбционную емкость
монослоя (Аmax) и степень заполнения (Q1,2-ДХБ) по-
верхности адсорбента молекулами 1,2-дихлорбензола
согласно следующим уравнениям:
(3)
(4)
где Sугля — удельная поверхность адсорбента (м2·г-1);
S1,2-ДХБ — площадь молекулы орто-дихлорбензола
(0.28 нм2), NА — число Авогадро (6.022·1023 1/моль).
Анализируя полученные значения степени за-
полнения поверхности адсорбента для образцов
УНМ/Ni, УНМ/NiMo, УНМ/NiPd и АГ-2000, можно
сделать вывод, что для адсорбции 1,2-дихлорбензо-
Рис. 6. Экспериментальные изотермы адсорбции
ла используется чуть меньше половины доступной
1,2-дихлорбензола на образцах УНМ/Ni, УНМ/NiMo
и УНМ/NiPd.
поверхности (табл. 3). Достигнуть максимальной
Исследование адсорбции 1,2-дихлорбензола на углеродном наноматериале...
1787
Таблица 3
Текстурные характеристики и адсорбционные свойства синтезированных образцов углеродных
наноматериалов УНМ/Ni, УНМ/NiMo, УНМ/NiPd и активированного угля АГ-2000
Максимальная
Максимально
Удельная
Объем
Константа
Адсорбционная
адсорбционная
достигнутая степень
Образец
поверхность,
пор,
адсорбции,
емкость,
емкость монослоя,
заполнения поверхности
м2·г-1
см3·г-1
л·г-1
мкмоль·м-2
мкмоль1,2-ДХБ·г-1
адсорбента, %
УНМ/Ni
230
0.29
2.11 ± 0,10
1.96
910
45
УНМ/NiMo
240
0.32
1.51 ± 0.05
1.71
950
47
УНМ/NiPd
280
0.45
1.59 ± 0.12
1.50
1090
43
АГ-2000
1230
0.90
6.20 ± 0.18
1.20
7350
20
величины адсорбции не удалось вследствие низкой
проявили достаточно высокую адсорбционную спо-
растворимости адсорбата в воде. Другой причиной
собность. Величина адсорбционной емкости в равно-
может служить присутствие на поверхности углерод-
весных условиях, отнесенная к единице поверхности
ных нановолокон функциональных групп гидрофиль-
образца углеродного наноматериала, составила 1.50-
ной природы (О-содержащие группы), которые могут
1.96 мкмоль·м-2, что соответствует эффективности
препятствовать адсорбции гидрофобных молекул
использования поверхности 43-47%. Для сравне-
дихлорбензола, как это наблюдали ранее в работе [29].
ния удельная адсорбционная емкость образца актив-
ного угля (АГ-2000, SБЭТ = 1230 м2·г-1) составила
1.96 мкмоль·м-2 при степени заполнения поверхности
Выводы
не более 20%.
В работе предпринята попытка объединить ката-
Таким образом, наноструктурированный углерод-
литический и адсорбционный подходы к утилизации
ный материал, образующийся в результате каталити-
1,2-дихлорэтана и 1,2-дихлорбензола, взятых в ка-
ческого пиролиза алифатических хлорзамещенных
честве модельных соединений из алифатического и
углеводородов на сплавах Ni-M, может быть вос-
ароматического ряда хлоруглеводородов. Для пере-
требован в качестве сорбента для очистки воды от
работки C2H4Cl2 и отходов на его основе наилучшим
примеси хлорароматических соединений.
образом подходит метод каталитического пиролиза с
использованием массивных сплавов Ni-M, играющих
роль предшественников катализатора. В результате
Благодарности
быстропротекающей углеродной эрозии сплава Ni-M
Авторы выражают признательность А. С. Сморы-
происходит формирование активной каталитической
гиной за изучение адсорбции 1,2-дихлорбензола
системы, которая перерабатывает хлорорганический
спектрофотометрическим методом, Д. В. Корнееву
субстрат в углеродный наноматериал, обладающий
за исследование образцов углеродного материала
уникальной сегментированной структурой и развитой
методом просвечивающей электронной микроскопии
поверхностью. Подбор металла М в составе сплава
и М. Ю. Ташланову за техническое сопровождение
Ni-M позволяет значительно увеличить удельный
процесса синтеза углеродного наноматериала.
выход углеродного продукта (в 1.5 раза в случае до-
бавки 5% Mo).
Нановолокнистый углеродный продукт, получен-
Финансирование работы
ный в результате пиролиза 1,2-дихлорэтана, в силу
Исследование выполнено в рамках государствен-
своих текстурных характеристик (удельная поверх-
ного задания № 075-00268-20-02 (идентификатор:
ность более 200 м2·г-1) может быть применен в ка-
0718-2020-0040).
честве эффективного адсорбента для удаления при-
меси 1,2-дихлорбензола из воды методом адсорбции.
Эксперименты в режиме статической адсорбции из
Конфликт интересов
водных растворов с различной начальной концен-
трацией 1,2-дихлорбензола показали, что все изу-
Авторы заявляют об отсутствии конфликта инте-
ченные образцы (УНМ/Ni, УНМ/NiPd и УНМ/NiMo)
ресов, требующего раскрытия в данной статье.
1788
Бауман Ю. И. и др.
Информация о вкладе авторов
[6]
Kirsanov M. P., Shishkin V. V. Evaluating and
improving the efficiency of the use of activated
Ю. И. Бауман — кинетические исследования про-
carbons for the extraction of organochlorine
цесса разложения дихлорэтана; О. В. Нецкина —
compounds in water treatment technology // Foods
обработка результатов адсорбционных исследова-
and Raw Materials. 2016. V. 4. P. 148-153.
ний; С. А. Муха — адсорбционные исследования;
И. В. Мишаков — написание текста статьи, подго-
[7]
Mishakov I. V., Chesnokov V. V., Buyanov R. A.,
товка иллюстрационного материала; Ю. В. Шубин —
Chuvilin A. L. Morphology and structure of carbon
исследование сплавов никеля методом рентгенофа-
resulting from decomposition of chlorohydrocarbons
зового анализа; В. О. Стояновский — исследование
on nickel and cobalt containing catalysts // React.
Kinet. Catal. Lett. 2002. V. 76. N 2. P. 361-367.
образцов методом спектроскопии комбинационного
рассеяния; А. Ю. Наливайко — получение образцов
[8]
Бауман Ю. И., Мишаков И. В., Ведягин А. А.,
сплавов; А. А. Ведягин — постановка задач иссле-
Дмитриев С. В. Переработка компонентов хлор-
дования; А. А. Громов — получение углеродного
органических отходов на массивных металличе-
материала для адсорбционных исследований.
ских катализаторах // Катализ в пром-сти. 2012.
№ 2. С. 18-24 [Bauman Yu. I., Mishakov I. V.,
Информация об авторах
Vedyagin A. A., Dmitriev S. V. Processing of
organochlorine waste components on bulk metal
Бауман Юрий Иванович, к.х.н.,
catalysts // Catal. Ind. 2012. V. 4. N 4. P. 261-266.
Нецкина Ольга Владимировна, к.х.н.,
[9]
Mishakov I. V., Vedyagin A. A., Bauman Y. I.,
Shubin Y. V., Buyanov R. A. Synthesis of carbon
Муха Светлана Алексеевна, к.х.н.,
nanofibers via catalytic chemical vapor deposition
of halogenated hydrocarbons // Carbon Nanofibers:
Мишаков Илья Владимирович, к.х.н., доцент,
Synthesis, Applications and Performance. Nova Sci.
Publ., 2018. P. 77-181.
Шубин Юрий Викторович, д.х.н.,
[10]
Bauman Y. I., Mishakov I. V., Rudneva Y. V.,
Plyusnin P. E., Shubin Y. V., Korneev D. V.,
Vedyagin A. A. Formation of active sites of carbon
Стояновский Владимир Олегович, к.ф.-м.н.,
nanofibers growth in self-organizing Ni-Pd
catalyst during hydrogen-assisted decomposition of
Наливайко Антон Юрьевич, к.х.н.,
1,2-dichloroethane // Ind. Eng. Chem. Res. 2019.
V. 58. N 2. P. 685-694.
Ведягин Алексей Анатольевич, к.х.н., доцент,
[11]
Bauman Y. I., Rudneva Y. V., Mishakov I. V.,
Громов Александр Александрович, д.х.н., проф.,
Plyusnin P. E., Shubin Y. V., Korneev D.V.,
Stoyanovskii V. O., Vedyagin A. A., Buyanov R. A.
Effect of Mo on the catalytic activity of Ni-based self-
organizing catalysts for processing of dichloroethane
Список литературы
into segmented carbon nanomaterials // Heliyon. 2019.
[1] Муганлинский Ф. Ф., Трегер Ю. А., Люшин М. М.
V. 5. ID e02428.
Химия и технология галогенорганических соедине-
ний. М.: Химия, 1991. С. 168-173.
[12]
Руднев А. В., Лысакова А. С., Плюснин П. Е.,
[2] Флид М. Р., Трегер Ю. А. Винилхлорид: химия и тех-
Бауман Ю. И., Шубин Ю. В., Мишаков И. В.,
нология. В 2 кн. Кн.1. М.: Калвис, 2008. С. 548-552.
Ведягин А. А., Буянов Р. А. Синтез, структура и ката-
[3] Zhou Y., Tigane T., Li X., Truu M., Truu J., Mander U.
литическая активность при разложении хлоругле-
Hexachlorobenzene dechlorination in constructed
водородов сплавов никеля с медью или кобальтом
wetland mesocosms // Water Res. 2013.V. 47. N 1.
// Неорган. материалы. 2014. Т. 50. № 6. С. 613-
[4] Юфит С. С. Яды вокруг нас: Вызов человечеству.
[Rudnev A. V., Lysakova A. S., Plyusnin P. E.,
М.: Классик Стиль, 2002. С. 75-85.
Bauman Yu. I., Shubin Yu. V., Mishakov I. V.,
[5] Pelech R., Milchert E., Wrobel R. Adsorption dynamics
Vedyagin A. A., Buyanov R. A. Ni-Cu and Ni-Co
of chlorinated hydrocarbons from multi-component
alloys: Synthesis, structure, and catalytic activity for
aqueous solution onto activated carbon // J. Hazard.
the decomposition of chlorinated hydrocarbons //
Mater. 2006. V. 137. N 3. P. 1479-1487.
Inorg. Mater. 2014. V. 50. N 6. P. 566-571.
Исследование адсорбции 1,2-дихлорбензола на углеродном наноматериале...
1789
[13]
Peng X., Li Y., Luan Z., Di Z., Wang H., Tian B., Jia Z.
Adsorption of 1,2-dichlorobenzene from water to
[23]
Derylo-Marczewska A., Marczewski A. W., Winter Sz.,
carbon nanotubes // Chem. Phys. Lett. 2003. V. 376.
Sternik D. Studies of adsorption equilibria and kinetics
N 1-2. P. 154-158.
in the systems: Aqueous solution of dyes-mesoporous
carbons // Appl. Surf. Sci. 2010. V. 256. N 17. P. 5164-
[14]
Li X., Chen G.-H. Surface modified graphite nanosheets
used as adsorbent to remove 1,2-dichlorobenzene from
[24]
Oliveira L. C. A., Rios R. V. R. A., Fabris J. D., Garg
water // Mater. Lett. 2009. V. 63. N 11. P. 930-932.
V., Sapag K., Lago R. M. Activated carbon/iron
oxide magnetic composites for the adsorption of
[15]
Negrea P., Sidea F., Negrea A., Lupa L., Ciopec M.,
contaminants in water // Carbon. 2002. V. 40. N 12.
Muntean C. Studies regarding the benzene, toluene
P. 2177-2183.
and o-xylene removal from waste water // Buletinul
Stiintific al Universitatii «Politehnica» din Timisoara.
[25]
Derylo-Marczewska A., Buczek B., Swiatkowski A.
2008. V. 53. N 1-2. P. 144-146.
Effect of oxygen surface groups on adsorption of
[16]
Kazakova M. A., Kuznetsov V. L., Bokova-Sirosh S. N.,
benzene derivatives fromaqueous solutions onto
Krasnikov D. V., Golubtsov G. V., Romanenko A. I.,
active carbon samples // Appl. Surf. Sci. 2011. V. 257.
Prosvirin I. P., Ishchenko A. V., Orekhov A. S.,
P. 9466-9472.
Chuvilin A. L., Obraztsova E. D. Fe-Mo and Co-Mo
catalysts with varying composition for multi-walled carbon
[26]
Kaneko Y., Abe M., Ogino K. Adsorption characteristics
nanotube growth // Phys. Status Solidi B. 2018. V. 255.
of organic compounds dissolved in water on surface-
improved activated carbon fibres // Colloids Surf.
[17]
Bayat N., Rezaei M., Meshkani F. Hydrogen and
1989. V. 37. P. 211-222.
carbon nanofibers synthesis by methane decomposition
over Ni-Pd/Al2O3 catalyst // Int. J. Hydrogen Energy.
[27]
Giles C. H., MacEwan T. H., Nakhwa S. N., Smith D.
2016. V. 41. P. 5494-5503.
A System of classification of solution adsorption
isotherms, and its use in diagnosis of adsorption
[18]
Grabke H. J., Spiegel M., Zahs A. Role of alloying
mechanisms and in measurement of specific surface
elements and carbides in the chlorine-induced corrosion
areas of solids // J. Chem. Soc. 1960. V. 111. P. 3973-
of steels and alloys // Mater. Res. 2004. V. 7. P. 89-95.
3993.
[28]
Sule M. N., Templeton M. R., Bond T. Rejection of
[19]
Chambers A., Baker R. T. K. Influence of chlorine on
organic micro-pollutants from water by a tubular,
the decomposition of ethylene over iron and cobalt
hydrophilic pervaporative membrane designed for
particles // J. Phys. Chem. B 1997. V. 101. P. 1621-
irrigation applications // Environ. Technol. 2015.
V. 37. N 11. P. 1382-1389.
[20]
Nemanich R. J., Solin S. A. First- and second-order
Raman scattering from finite-size crystals of graphite
[29]
Netskina O. V., Komova O. V., Tayban E. S.,
// Phys. Rev. B. 1979. V. 20. P. 392-401.
Oderova G. V., Mukha S. A., Kuvshinov G. G.,
Simagina V. I. The influence of acid treatment of
[21]
Tuinstra F., Koenig J. L. Raman spectrum of graphite
carbon nanofibers on the activity of palladium
// J. Chem. Phys. 1970. V. 53. P. 1126-1130.
catalysts in the liquid-phase hydrodechlorination
of dichlorobenzene // Appl. Catal. A. 2013. V. 467.
[22]
Ferrari A. C., Robertson J. Interpretation of Raman
P. 386-393.
spectra of disordered and amorphous carbon // Phys.
Rev. B. 2000. V. 61. P. 14095-14107.