Журнал прикладной химии. 2020. Т. 93. Вып. 4
СОРБЦИОННЫЕ И ИОНООБМЕННЫЕ ПРОЦЕССЫ
УДК 546.814-31+549.65
ИОНООБМЕННЫЕ СВОЙСТВА ГЮНТЕРБЛАССИТА И ГМЕЛИНИТА —
ПРОТОТИПОВ МИКРОПОРИСТЫХ МАТЕРИАЛОВ ДЛЯ ОЧИСТКИ ВОД
© Н. В. Чуканов1,2, Н. А. Червонная1, О. Н. Кажева1, В. Н. Ермолаева3,
Д. А. Варламов1,3, К. В. Ван3
1 Институт проблем химической физики РАН,
142432, г. Черноголовка Московской обл., пр. Академика Семёнова, д. 1
2 Московский государственный университет, 119899, г. Москва, Воробьевы Горы
3 Институт экспериментальной минералогии РАН,
142432, г. Черноголовка Московской обл., ул. Академика Осипьяна, д. 4
Е-mail: chukanov@icp.ac.ru
Поступила в Редакцию 17 ноября 2018 г.
После доработки 14 августа 2019 г.
Принята к публикации 8 февраля 2020 г.
Изучены
процессы
и
продукты
ионного
обмена
гюнтерблассита
(K,Ca,Ba,Na)3-xFe1-y[(Si,Al)13O25(OH,O)4]·7H2O (микропористого силиката, в структурном отно-
шении промежуточного между смектитами и цеолитами) и трех образцов цеолита гмелинита
(Na,K,Ca,Mg)x[(Si,Al)12O24)·nH2O разного состава с катионами различных металлов. Показано, что
гюнтерблассит проявляет высокую активность и сорбционную емкость по отношению к катионам
Rb+, Cs+, Ag+ и в меньшей степени Pb2+ и Ba2+: уже при комнатной температуре в течение 1 ч
концентрация M2O (M = Rb, Cs, Ag) в сорбенте достигает 10-13 мас%. Ионный обмен в гмелините
происходит по фронтальному механизму, распространяясь от периферии кристалла к его центру.
В реакциях с Pb2+ активность гмелинита возрастает с ростом содержания в нем натрия и пада-
ет с ростом содержания калия. Изучена кристаллическая структура Pb-замещенного гмелинита и
показано, что ионы Pb2+ заселяют оба цеолитных канала. Синтетический гмелинит, получаемый
из дешевого природного сырья и золы уноса теплоэлектроцентралей, может быть использован для
очистки вод от свинца.
Ключевые слова: микропористые материалы; цеолиты; трехслойные силикаты; ионный обмен;
очистка вод
DOI: 10.31857/S0044461820040143
В ходе полевых работ 2010 г. на палеовулканах
циации этот силикат был утвержден в качестве нового
Айфеля (Германия) одним из авторов настоящей ста-
минерального вида с названием гюнтерблассит [1].
тьи (Н. В. Чукановым) были обнаружены кристаллы
Рентгеноструктурный анализ позволил устано-
силиката, не имеющего аналогов по совокупности
вить, что гюнтерблассит относится к новому топо-
физических свойств, рентгеновских дифракционных
логическому типу микропористых соединений, в
характеристик и химического состава. Решением
основе кристаллических структур которых лежит
Комиссии по новым минералам, номенклатуре и клас-
трехслойный пакет, сложенный связанными через
сификации Международной минералогической ассо-
общие вершины тетраэдрами (Si,Al)O4 и содержащий
591
592
Чуканов Н. В. и др.
ном материале не ставилась. Ионообменные свойства
цеолитов с каркасом гмелинитового типа в реакциях
с растворами солей меди и свинца ранее также не
исследовались.
Выбор гмелинита в качестве объекта исследова-
ний связан с возможностью его многотоннажного
синтеза с использованием доступных и дешевых ма-
териалов. В частности, в работе [11] гмелинит-Ca был
синтезирован из смеси галлуазита, доломита и обси-
диана. Показано также [12], что гмелинит является
Рис. 1. Трехслойный тетраэдрический пакет в структуре
главным продуктом реакций золы уноса теплоэлек-
гюнтерблассита.
троцентралей с растворами гидроксидов щелочных
металлов в гидротермальных условиях.
две системы пересекающихся цеолитных каналов
шириной 5.7 Å [2] (рис. 1). Гюнтерблассит ромбиче-
Экспериментальная часть
ский (пространственная группа Pnm21) с параметра-
ми элементарной ячейки a = 6.522(8), b = 6.972(8),
Гюнтерблассит, использованный для экспери-
c = 37.21(4) Å. Его кристаллохимическая формула [2]
ментов по ионному обмену, происходит из базаль-
(K,Ca,Ba,Na)3-xFe1-y[(Si,Al)13O25(OH,O)4]·7H2O, где
та, вскрытого карьером на горе Ротер Копф (Rother
квадратными скобками выделен состав трехслойного
Kopf) близ города Герольштайн (Gerolstein) в земле
модуля.
Рейнланд-Пфальц, Германия. Он образует таблитча-
Вскоре были открыты еще два представите-
тые кристаллы, образованные гранями пинакоидов
ля данного класса — минералы хиллесхаймит
{001} (главная габитусная форма), {010}, {100} и
(K,Ca,)2(Mg,Fe,Ca,)2[(Si,Al)13O23(OH)6](OH)·8H2O
имеющие размеры до 0.1 × 0.3 × 0.6 мм (рис. 2). В ас-
[3] и умбрианит K7Na2Ca2[Al3Si10O29]F2Cl2 [4] и по-
социации с гюнтербласситом присутствуют цеолиты
казано, что гюнтерблассит и хиллесхаймит являются
(шабазит, филлипсит), а также минералы, относящи-
продуктами выщелачивания анионов галогенов и
еся к более ранней высокотемпературной стадии [1].
части крупных катионов из фазы типа умбрианита.
В экспериментах по ионному обмену были ис-
Процесс выщелачивания сопровождался гидратацией.
пользованы также следующие образцы гмелинита
Целью выполненных в настоящей работе исследо-
(табл. 1):
ваний являлось выяснение способности микропори-
— образец 1 — гмелинит-Na из Соколовского же-
стых материалов со структурами гюнтербласситового
лезорудного месторождения (Казахстан), образую-
типа проявлять ионообменные свойства по отноше-
щий гексагональные дипирамидальные кристаллы
нию к катионам различных токсичных металлов.
размером до 3 мм и эпитаксию на кристаллах шаба-
Силикаты с трехслойным пакетом гюнтерблассито-
зита-Ca;
вого типа до сих пор не синтезированы. Поэтому в
— образец 2 — гмелинит-Ca из поствулкани-
настоящей работе в качестве модели для исследова-
ческой гидротермальной ассоциации региона Усти
ния ионообменных свойств подобных соединений
(Ústí) в Чехии, образующий гексагональные дипира-
использован природный гюнтерблассит.
мидальные кристаллы размером до 2 мм в ассоциа-
Другая задача, которая решалась в рамках дан-
ции с другими цеолитами;
ной работы, заключалась в установлении связи меж-
— образец 3 — гмелинит-Ca с относительно вы-
ду составом внекаркасных катионов в структуре
соким содержанием калия из поствулканической ги-
гмелинита и его способностью к ионному обмену.
дротермальной ассоциации острова Гран Канария,
Использование в качестве электролитов растворов
образующий гексагональные дипирамидальные кри-
солей свинца и меди актуально с точки зрения поиска
сталлы размером до 3 мм, эпитаксически нарастаю-
сорбентов, пригодных для очистки вод от токсичных
щие на кристаллы шабазита-Ca.
тяжелых металлов [5-7]. Отметим, что ионообменные
В качестве электролитов были использованы 0.1 М
свойства гмелинита изучали и ранее [8-10], однако
водные растворы AgNO3, RbCl2, CsCl2, CaCl2, CuSO4
большая часть таких работ выполнена на синтети-
и Pb(NO3)2 (в случае гмелинита — только два послед-
ческих образцах (в основном на гмелините-Na), и
них). Эксперименты по ионному обмену проводили
задача исследования зависимости ионообменных
при комнатной температуре (для гюнтерблассита) и
свойств от состава внекаркасных катионов в исход-
при 50 и 90°C (для гмелинита).
Ионообменные свойства гюнтерблассита и гмелинита — прототипов микропористых материалов для очистки вод
593
от 302 до 1670 в сканирующем режиме при диаметре
электронного пучка 60 нм.
ИК-спектры образцов, предварительно растертых
в агатовой ступке и запрессованных в таблетки с
KBr, получены на Фурье-спектрометре ALPHA FTIR
(Bruker Optics, Германия) в диапазоне волновых чи-
сел 360-3800 см-1 при разрешающей способности
4 см-1 и числе сканирований, равном 16. В качестве
образца сравнения использовалась аналогичная та-
блетка из чистого KBr.
Рентгеноструктурное исследование Pb-замещен-
ного гмелинита проведено при 100 K на дифракто-
метре Xcalibur (MoKα-излучение, ω-сканирование).
Кристаллическая структура решена прямыми мето-
дами с последующими Фурье-синтезами и уточнена
МНК в анизотропном полноматричном приближе-
нии для всех неводородных атомов по программе
SHELX-97. Координаты атомов водорода не лока-
лизованы. Была введена эмпирическая поправка на
Рис. 2. Типичные кристаллы гюнтерблассита в полости
поглощение.
щелочного базальта.
Обсуждение результатов
Исследование химического состава исходных об-
разцов и продуктов ионного обмена проводили мето-
Гюнтерблассит уже при комнатной температуре
дом рентгеноспектрального микроанализа с приме-
активно вступает в ионообменные реакции с рас-
нением растрового электронного микроскопа Tescan
творами солей крупных одновалентных катионов
Vega-II XMU и системы регистрации рентгеновского
(Ag+, Rb+, Cs+) и проявляет значительно меньшую
излучения и расчета состава образца INCA Energy
активность по отношению к двухвалентным кати-
450 (режим EDS, ускоряющее напряжение 20 кВ,
онам (Pb2+, Ca2, Cu2+). Реакции протекают практи-
ток электронного пучка 400 пА). Время накопления
чески равномерно по объему кристалла. При этом
сигнала составляло 100 с. Диаметр зоны возбуждения
замещению подвергаются в основном ионы H+, K+
не превышал 5 мкм. Диаметр электронного пучка
и Na+, тогда как атомарные содержания остальных
при электронно-зондовых анализах был в пределах
компонентов изменяются незначительно (табл. 2).
157-180 нм. Изображения получены с увеличением
Степень замещения внекаркасных катионов и прото-
Таблица 1
Химический состав (мас%) исходных образцов гмелинита и продуктов их ионного обмена с раствором Pb(NO3)2
при 90°C в течение 1 сут
Исходные образцы
Продукты ионного обмена
Компонент
1
2
3
1
2
3*
Na2O
9.84
1.89
1.16
—
—
0.15
K2O
0.15
2.59
3.95
—
0.05
2.04
MgO
0.25
0.18
0.38
—
0.23
0.28
CaO
1.01
9.35
7.79
0.27
—
3.59
PbO
—
—
—
34.33
39.18
22.55
Al2O3
18.57
22.08
20.76
15.37
17.49
17.17
SiO2
49.14
43.57
46.01
40.00
33.40
39.53
Сумма
78.96
79.66
80.05
89.97
90.35
85.31
* Краевая зона кристалла.
594
Чуканов Н. В. и др.
Таблица 2
Химический состав исходного гюнтерблассита и продуктов его ионного обмена*
Обменные катионы в растворе электролита
Компонент
нет**
Ag+
Rb+
Cs+
Ca2+
Cu2+
Pb2+
Ba2+***
содержание компонентов, мас%
Na2O
0.40
0
0.16
0
0.16
0.18
0.15
0
K2O
5.18
1.18
0.60
1.17
5.27
4.51
4.87
2.85
MgO
0.58
0.52
0.46
0.68
0.65
0.67
0.54
0.81
CaO
3.58
2.71
3.84
3.28
3.88
3.90
3.86
2.98
BaO
4.07
4.51
3.89
3.60
3.75
4.17
4.47
8.84
FeO
3.06
2.86
2.79
3.03
2.97
3.19
2.82
3.45
Al2O3
13.98
12.84
14.43
13.85
13.75
13.24
12.86
13.56
SiO2
52.94
51.13
52.88
52.99
53.46
53.42
52.26
53.59
Ag2O
—
12.24
—
—
—
—
—
—
Rb2O
—
—
9.74
—
—
—
—
—
Cs2O
—
—
—
12.63
—
—
—
—
CuO
—
—
—
—
—
0.43
—
—
PbO
—
—
—
—
—
—
3.19
—
Сумма
83.79
87.99
85.02
91.23
83.89
83.71
85.02
86.08
* Эксперименты проводили с 0.1 М растворами электролитов в течение 1 ч при комнатной температуре.
** Исходный гюнтерблассит (фрагмент голотипного образца), содержит также 15.2 мас% H2O.
*** Продукт природного ионного обмена.
нов силанольных групп в гюнтерблассите составляет
филлита, описан ранее в работе [15]. Этот процесс
55% для Ag, 52 для Rb, 45 для Cs, 7.2 для Pb и 2.7
сопровождается выщелачиванием части компонентов
для Cu.
из дельхайелита и приводит к образованию изострук-
В табл. 2 приведен также состав продукта природ-
турной с ним фазы с кристаллохимической форму-
ного ионного обмена гюнтерблассита с ионами Ba2+,
лой (Ba0.42K0.340.24)(Ca0.88Fe0.12)2(0.90Mg0.10)2×
перешедшими в водный раствор в результате частич-
×[Si6(Al0.5Si0.5)2O17(OH0.71O0.29)2]·6H2O.
ного выщелачивания из расположенных рядом кри-
Из трех образцов гмелинита, изученных в насто-
сталлов лилейита Ва2(Na,Fe,Ca)3MgTi2(Si2O7)2O2F2
ящей работе, наиболее высокую активность в про-
[13] — минерала группы лампрофиллита. Процессы
цессах ионного обмена проявил образец 1. Однако
выщелачивания и ионного обмена происходили в те-
и этот образец не вступает в реакцию с раствором
чение длительного периода (со времени последнего
сульфата меди при 50°C. При 90°C медью обога-
извержения прошли десятки тысяч лет), и, следова-
щается только периферическая часть кристалла, в
тельно, концентрация бария в водном растворе посто-
которой можно выделить две зоны — внешнюю,
янно оставалась на очень низком уровне. Несмотря на
не содержащую натрия (рис. 3, зона 1) и промежу-
это, около половины K + Na заместилась барием, что
точную (рис. 3, зона 2), в которых типичные содер-
свидетельствует о высокой сорбционной способности
жания компонентов, измеряемых микрозондовым
гюнтерблассита по отношению к Ba2+. Этот вывод
методом, равны соответственно (мас%): Na2O — 0
хорошо согласуется с данными работы [14], где по-
и 4.26, K2O — 0.30 и 0.16, CaO — 0.55 и 0.34, CuO —
казано, что гюнтерблассит может накапливать до 1.6
12.11 и 5.77, Al2O3 — 18.51 и 18.04, SiO2 — 47.89 и
иона бария на формулу в результате ионного обмена
49.51, что соответствует эмпирическим формулам
с 1 н раствором соли бария при 30°С в течение 7 сут.
[(H3O)0.25Cu1.58Ca0.10K0.07]×(Si8.24Al3.76O24)·nH2O и
Аналогичный природный обмен между дельхайели-
[(H3O)0.57Cu0.74Na1.40Ca0.06K0.04](Si8.39Al3.61O24)×
том K4Na2Ca2[AlSi7O19]F2Cl (двухслойным аналогом
×nH2O (формульные коэффициенты H3O вычислены
минералов группы гюнтерблассита) и ионами Ba2+,
из условия баланса зарядов). Присутствие H3O+ в
выщелачивающимися из минерала группы лампро-
продуктах ионного обмена представляется естествен-
Ионообменные свойства гюнтерблассита и гмелинита — прототипов микропористых материалов для очистки вод
595
Рис. 3. Фрагменты кристалла гмелинита-Na (образец 1) после ионного обмена с раствором CuSO4 при 90°С в те-
чение 24 ч (слева, стрелками указаны внешняя 1 и промежуточная 2 зоны) и после ионного обмена с раствором
Pb(NO3)2 при 50°С в течение 24 ч.
Аншлифы, изображения в отраженных электронах.
ным с учетом кислотного характера водного раствора
структуру гмелинита приводит к сдвигу большин-
сульфата меди.
ства полос поглощения в низкочастотную область,
Ионный обмен гмелинита с раствором Pb(NO3)2
что может быть связано как с увеличением массы
носит фронтальный характер (рис. 3): граница меж-
внекаркасного катиона, так и с уменьшением сило-
ду исходной (темная центральная часть на рисун-
ке) и Pb-замещенной фазами резкая и постепенно
распространяется от границ кристалла к его центру.
В течение 1 сут при 90°С ионный обмен образцов 1
и 2 с раствором соли свинца завершается, тогда как
в образце 3 замещение затрагивает лишь узкие зоны
в периферической части кристалла и вдоль трещин
(светлые на рис. 4). Составы продуктов ионного об-
мена образцов 1-3 приведены в табл. 1. Доля Pb2+
среди внекаркасных катионов составляет 96, 92 и
50-60% для образцов 1, 2 и внешней зоны образца 3
соответственно.
Причина пониженной активности образца 3 в ре-
акции с раствором Pb(NO3)2 не ясна. Возможно, этот
эффект связан с присутствием в этом образце повы-
шенных количеств калия, обладающего наибольшим
ионным радиусом среди обменных катионов исход-
ных образцов: известно, например, что подвижность
внекаркасных компонентов в каналах цеолитов силь-
но зависит от их химического состава, что, в частно-
сти, проявляется в явлении сверхгидратации в водных
средах при высоких давлениях [16, 17].
Рис. 4. Фрагмент кристалла гмелинита-Сa (образец 3)
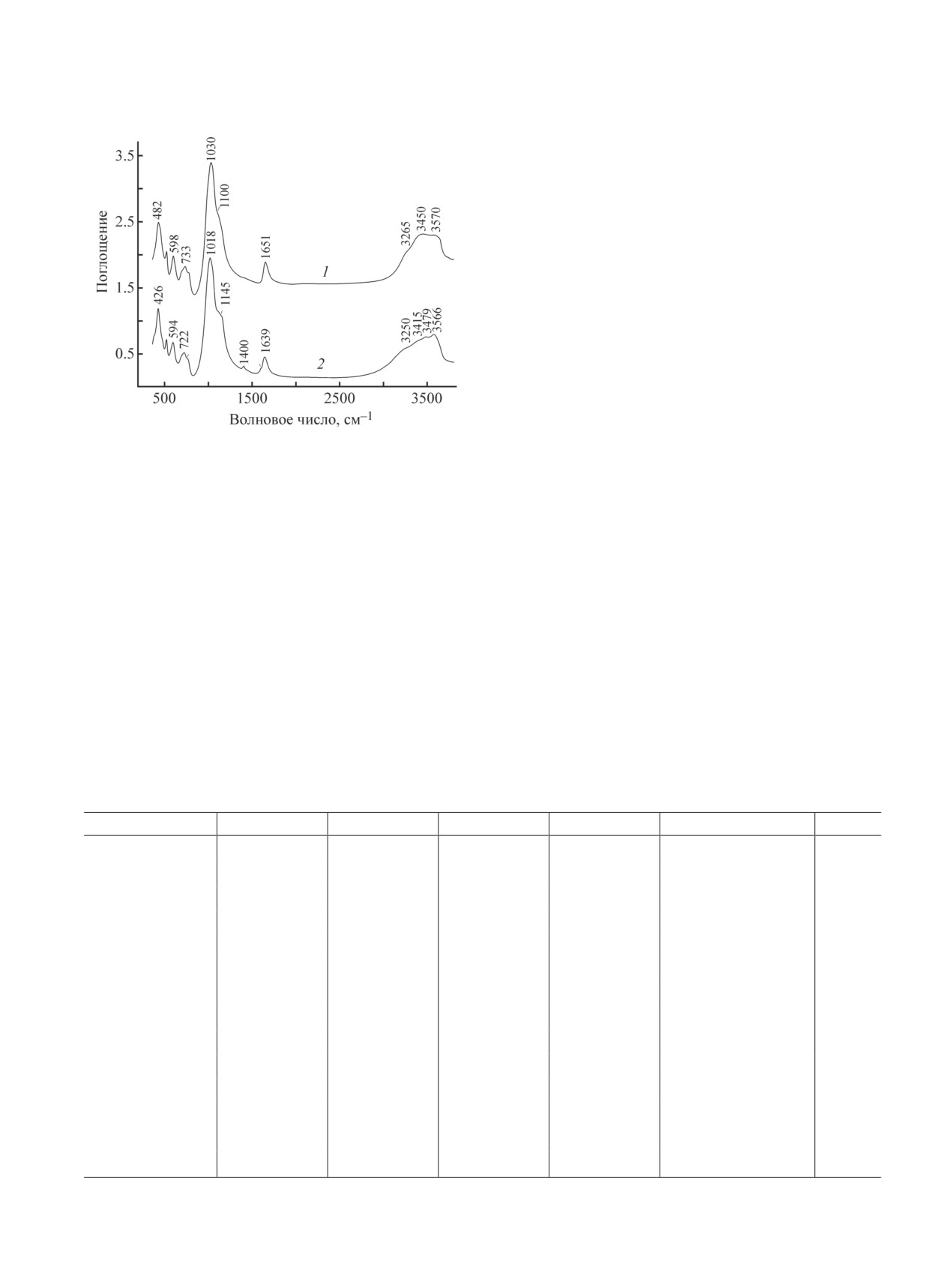
Сравнение ИК-спектров исходного гмелинита-Na
после частичного ионного обмена с раствором Pb(NO3)2
и продукта его ионного обмена с раствором Pb(NO3)2
при 90°С в течение 24 ч.
(рис. 5) показывает, что вхождение ионов свинца в
Аншлиф, изображение в отраженных электронах.
596
Чуканов Н. В. и др.
K и Pb исключается, поскольку отвечающие им по-
лосы наблюдаются соответственно при 1358, 1380
и 1373 см-1 [18]. Отсюда можно заключить, что
в процесс ионного обмена гмелинита-Na с раство-
ром нитрата свинца вовлекаются не только катионы,
но и (в значительно меньшей степени) нитратные
анионы.
Присутствие последних подтверждается также
избытком положительного заряда в эмпириче-
ских формулах продуктов ионного обмена гме-
линитов с раствором Pb(NO3)2. Например, сбалан-
сированная по зарядам формула Pb-замещенного
образца 1 (табл. 1) может быть записана в виде
(Pb1.91Ca0.06)(Si8.26Al3.74O24)(NO3)0.20·nH2O.
Основные кристаллографические и эксперимен-
Рис. 5. ИК-спектры исходного гмелинита-Na (1) и
тальные данные для продукта ионного обмена гме-
продукта его ионного обмена с 0.1 М раствором
линита-Na с раствором нитрата свинца при 90°С сле-
Pb(NO3)2
(2) при 90°С в течение 24 ч.
дующие: гексагональный, P63/mmc, a = 13.834(2) Å,
c = 9.918(2) Å, V = 1643.9(5) Å3, Dвыч = 2.51 г·см-3,
вых постоянных связей (Si,Al)-O вследствие увели-
m = 9.633 мм-1, (2θ)макс = 63.08°, пределы h, k, l:
чения объема кристалла. Кроме того, в ИК-спектре
-14 < h < 15, -17 < k < 19, -5 < l < 14, общее число
продукта ионного обмена понижена интенсивность
отражений 4429, независимых отражений 985, коли-
поглощения в области 3400-3500 см-1, которое об-
чество уточняемых параметров 77, R = 0.060 для 656
условлено O-H-валентными колебаниями молекул
отражений с F0 > 4σ(F0). Полученная в результате
H2O, образующих относительно прочные водород-
уточнения кристаллохимическая формула (Z = 1):
ные связи. Наконец, можно отметить присутствие в
(Pb3.56Ca0.12)(Al7.44Si16.56O48)·19.4H2O.
спектре гмелинита-Pb слабой полосы асимметричных
Кристаллическая структура Pb-замещенного гме-
валентных колебаний ионов NO3- при 1400 см-1.
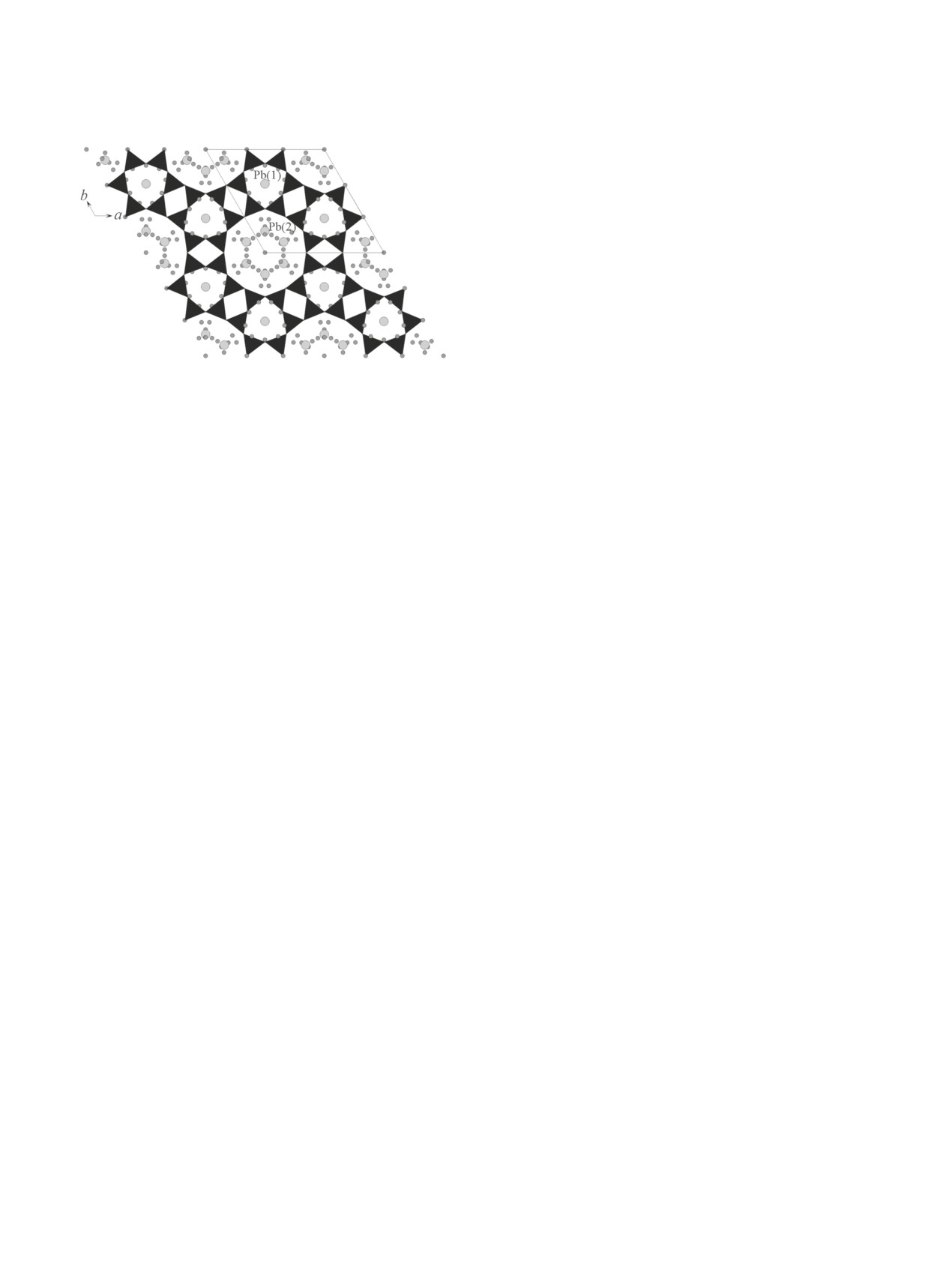
линита (табл. 3, рис. 6) в целом аналогична структуре
Отнесение этой полосы к примесям нитратов Na,
Ba-замещенного гмелинита [19] и имеет две системы
Таблица 3
Координаты, кратность (Q), заселенность (q) позиций и эквивалентные изотропные параметры атомных
смещений (Uэкв) Pb-замещенного гмелинита
Атом
x/a
y/b
z/c
Uэкв, Å2
q
Q
Pb1
0.6667
0.3333
-0.1240(1)
0.0591(4)
0.50Pb
4
Pb2
0.1045(2)
0.2089(4)
0.0486(4)
0.083(1)
0.13Pb + 0.01Ca
12
T
0.43946(9)
0.10475(9)
0.0909(1)
0.0174(3)
0.69Si + 0.31Al
24
O1
0.3460(3)
0.0000
0.0000
0.028(1)
1
12
O2
0.5674(2)
0.1348(4)
0.0481(4)
0.0252(9)
1
12
O3
0.4134(4)
0.0687(5)
0.2500
0.045(1)
1
12
O4
0.4258(4)
0.2129(2)
0.0544(6)
0.046(1)
1
12
OW5
0.845(2)
0.422(1)
-0.2500
0.065(6)
0.44
6
OW6
0.813(1)
0.518(2)
-0.2500
0.105(8)
0.44
12
OW7
0.128(2)
0.324(3)
0.2500
0.14(1)
0.40
12
OW8
0.1274(5)
0.255(1)
0.125(1)
0.020(3)
0.34
12
OW9
0.0000
0.0000
0.07(1)
0.03(3)
0.05
4
OW10
0.177(5)
0.089(3)
0.214(6)
0.06(2)
0.10
12
OW11
0.141(6)
0.173(6)
0.147(7)
0.04(2)
0.05
24
Ионообменные свойства гюнтерблассита и гмелинита — прототипов микропористых материалов для очистки вод
597
очистки вод от ионов Rb+ и Cs+ и для извлечения
серебра из разбавленных растворов (например, рас-
творов, получаемых путем бактериального выщела-
чивания бедных руд). Возможность синтезировать
гмелинит в значительных количествах из дешевого
и доступного сырья (из смеси галлуазита, доломита
и обсидиана или в реакциях золы уноса ТЭЦ с рас-
творами гидроксидов щелочных металлов) делает
этот цеолит перспективным материалом для очистки
водоемов от тяжелых металлов.
Активность гмелинита зависит от исходного со-
держания в нем обменных катионов: наиболее актив-
Рис. 6. Кристаллическая структура Pb-замещенного
ным ионитом является гмелинит-Na. Существенным
гмелинита в проекции на плоскость [001].
результатом настоящей работы является вывод о том,
что в ионообменных реакциях гмелинита с раствора-
Выделена элементарная ячейка. Кружки малого размера
ми CuSO4 и Pb(NO3)2 участвуют не только катионы
обозначают статистически занятые позиции молекул
воды.
металлов, но и соответственно ионы H3O+ и NO3-.
каналов, ширина которых составляет 4.0 и 6.4 Å.
Благодарности
Атомы Si и Al неупорядоченно занимают общую те-
Работа частично (в части сбора и исследования
траэдрическую позицию. Расстояния Si(Al)-O карка-
исходного материала) выполнена в соответствии с
са находятся в интервале 1.640(1)-1.658(1) Å, диапа-
темой государственного задания, номер государствен-
зон углов O-Si-O составляет 106.5(1)-112.4(2)°. Как
ного учета ААА-А19-119092390076-7. Исследования
и в случае Ba-замещенного гмелинита, в гмелини-
ионообменных свойств гюнтерблассита и гмелинита
те-Pb найдено семь неэквивалентных позиций воды.
выполнены при поддержке РФФИ (соответствен-
Позиция Pb(1), заселенная наполовину, имеет ко-
но проекты 18-29-12007_мк и 18-55-18003-Болг_а).
ординационное число 6 и расположена в центре узко-
Авторы благодарны Г. В. Шилову за предоставленные
го канала, на оси третьего порядка. Координационный
данные монокристального дифракционного экспери-
полиэдр Pb(1) представляет собой искаженную три-
мента и Н. В. Зубковой за помощь в интерпретации
гональную призму, три вершины которой занимают
структурных данных.
атомы О(2) каркаса с расстоянием Pb(1)-О(2), равным
2.93(1) Å. Остальные вершины этого полиэдра —
молекулы воды OW5 и OW6; степень заполнения
Конфликт интересов
этих позиций такова, что суммарное число молекул
Авторы заявляют об отсутствии конфликта инте-
воды, координирующих Pb(1), равно в среднем 2.64.
ресов, требующего раскрытия в данной статье.
Расстояния Pb(1)-ОW(5) и Pb(1)-ОW(6) находятся в
диапазоне 2.47(1)-2.65(1) Å.
Позиция Pb(2) находится в широком канале у
Информация об авторах
его стенок, на плоскости симметрии. Заселенность
этой позиции ионами Pb2+ составляет 13%. Пред-
Чуканов Никита Владимирович, д.ф.-м.н., г.н.с.,
положительно в Pb(2) присутствует также небольшая
примесь кальция. К координационному окружению
Червонная Надежда Анатольевна, н.с., к.х.н.,
Pb(2) относятся три атома О каркаса и семь молекул
воды на расстояниях от 2.47 до 3.14 Å.
Кажева Ольга Николаевна, с.н.с., к.х.н.,
Ермолаева Вера Никитична,
Выводы
Полученные результаты показывают, что микро-
Варламов Дмитрий Анатольевич, с.н.с.,
пористые силикатные материалы со структурами на
основе трехслойных тетраэдрических пакетов могут
Ван Константин Владимирович,
быть использованы как эффективные иониты для
598
Чуканов Н. В. и др.
Список литературы
Micropor. Mesopor. Mater. 1998. V. 20. N 1. P. 119-
[1] Чуканов Н. В., Расцветаева Р. К., Аксенов С. М.,
[8] Sacerdoti M., Passaglia E., Carnevali R. Structural
Пеков И. В., Зубкова Н. В., Бритвин С. Н., Белаков-
refinements of Na-, K-, and Ca-exchanged
ский Д. И., Шюллер В., Тернес Б. Гюнтерблассит
gmelinites // Zeolites. 1995. V. 15. N 3. P. 276-281.
(K,Ca)3-xFe[(Si,Al)13O25(OH,O)4]·7H2O — но-
вый минерал, первый филлосиликат с трой-
[9] Chiyoda O., Davis M. Adsorption studies with
ным тетраэдрическим слоем // Зап. РМО.
gmelinite zeolites containing mono-, di- and trivalent
2012. Т. 58. № 11. С. 71-79 [Chukanov N. V.,
cations // Micropor. Mesopor. Mater. 2000. V. 38. N 2.
Rastsvetaeva R. K., Aksenov S. M., Pekov I. V.,
P. 143-149.
Zubkova N. V., Britvin S. N., Belakovskiy D. I.,
Schüller W., Ternes B. Günterblassite, (K,Ca)3-xFe×
[10] Chatterjee M., Ganguli D., Saha P. Synthesis and
×[(Si,Al)13O25(OH,O)4]·7H2O, a new mineral: The
characterization of gmelinite-and chabazite-type
first phyllosilicate with triple tetrahedral layer // Geol.
molecular sieve zeolites // Trans. Indian Ceram. Soc.
2014. V. 35. N 5. P. 99-105.
org/10.1134/S1075701512080065 ].
[2] Расцветаева Р. К., Аксенов С. М., Чуканов Н. В.
[11] Мамедова Г. А. Синтез цеолита с гмелинитовой
Кристаллическая структура гюнтерблассита —
структурой в системе доломит-галлуазит-обсидиан
первого минерала с трехслойным тетраэдриче-
// Физика и химия стекла. 2016. Т. 42. № 5. С. 688-
ским пакетом // ДАН. 2012. Т. 442. № 6. С. 766-770
691 [Mamedova G. A. Synthesis of zeolite with a
[Rastsvetaeva R. K., Aksenov S. M., Chukanov N. V.
gmelinite structure in the dolomite-halloysite-obsidian
Crystal structure of günterblassite, a new mineral with
system // Glass Phys. Chem. 2016. V. 42. N 5. P. 518-
a triple tetrahedral layer // Dokl. Chem. 2012. V. 442.
N 2. P. 57-62.
[12] Sugiyama T., Inoba S., Otsuka T., Hiei Y., Yamamoto T.
The microstructure and cation exchange ability of
[3] Чуканов Н. В., Зубкова Н. В., Пеков И. В., Белаков-
zeolite composed hardened material // J. Soc. Mater.
ский Д. И., Шюллер В., Тернес Б., Бласс Г., Пущаров-
Sci. Japan. 2015. V. 64. N 8. P. 634-640.
ский Д. Ю. Хиллесхаймит (K,Ca,)2(Mg,Fe,Ca,)2×
×[(Si,Al)13O23(OH)6](OH)·8H2O — новый
[13] Chukanov N. V., Pekov I. V., Rastsvetaeva R. K.,
слоистый силикат группы гюнтербласси-
Aksenov S. M., Zadov A. E., Van K. V., Blass G.,
та // Зап. РМО. 2012. Т. 141. № 3. С. 29-39
Schüller W., Ternes B. Lileyite, Ва2(Na,Fe,Ca)3×
[Chukanov N. V., Zubkova N. V., Pekov I. V.,
×MgTi2(Si2O7)2O2F2, a new lamprophyllite-group
Belakovskiy D. I., Schüller W., Ternes B., Blass G.,
mineral from the Eifel volcanic area, Germany // Eur.
Pushcharovsky D. Yu. Hillesheimite, (K,Ca,)2×
J. Mineral. 2012. V. 24. P. 181-188.
×(Mg,Fe,Ca,)2[(Si,Al)13O23(OH)6](OH)·8H2O, a
new phyllosilicate mineral of the günterblassite group
[14] Lykova I. S., Pekov I. V., Chukanov N. V.,
// Geol. Ore Deposits. 2013. V. 55. N 7. P. 549-557.
Yapaskurt V. O., Varlamov D. A., Zolotarev A. A., Jr.
Ion exchange in lomonosovite, murmanite and
[4] Sharygin V. V., Pekov I. V., Zubkova N. V.,
günterblassite: experimental data // Abstr. of the Int.
Khomyakov A. P., Stoppa F., Pushcharovsky D. Yu.
Conf. «Minerals as Advanced Materials III», Kirovsk,
Umbrianite, K7Na2Ca2[Al3Si10O29]F2Cl2, a new
June 23-30, 2013. P. 11-12.
mineral species from melilitolite of the Pian di Celle
[15] Zubkova N. V., Chukanov N. V., Pekov I. V.,
volcano, Umbria, Italy // Eur. J. Mineral. 2013. V. 25.
Turchkova A. G., Lykova I. S., Schüller W., Ternes B.,
P. 655-669.
Pushcharovsky D. Yu. Crystal chemistry of a Ba-
dominant analogue of hydrodelhayelite and natural
[5] Jain S. K. Protective role of zeolite on short- and long-
ion-exchange transformations in double- and triple-
term lead toxicity in the teleost fish Heteropneustes
layer phyllosilicates in post-volcanic systems of the
fossilis // Chemosphere. 1999. V. 39. N 2. P. 247-251.
Eifel region, Germany // Mineral. Petrol. 2016. V. 110.
[6] Pansini M., Colella C., Caputo D., de′Gennaro M.,
P. 885-893.
Langella A. Evaluation of phillipsite as cation
exchanger in lead removal from water // Micropor.
[16] Seryotkin Yu. V., Likhacheva Yu., Rashchenko S. V.
Mater. 1996. V. 5. P. 357-364.
Structural evolution of Li-exchaned natrolite at
pressure-induced over-hydration: An X-ray diffraction
[7] Torracca E., Galli P., Pansini M., Colella C. Cation
study // J. Struct. Chem. 2016. V. 57. P. 1377-1385.
exchange reactions of a sedimentary chabazite //
Ионообменные свойства гюнтерблассита и гмелинита — прототипов микропористых материалов для очистки вод
599
[17] Seryotkin Y. V., Bakakin V. V., Likhacheva A. Y.,
[19] Вигдорчик А. Г., Малиновский Ю. А. Кристал-
Dementiev S. N., Rashchenko S. V. Structural behavior
лическая структура Ba-замещенного гмелини-
of Tl-exchanged natrolite at high pressure depending
та Ba4[Al8Si16O48]·nH2O // Кристаллография.
on the composition of pressure-transmitting medium //
1986. T. 31. № 5. С. 879-881 [Vigdorchik A. G.,
Phys. Chem. Minerals. 2017. V. 44. P. 615-626.
Malinovskii Yu. A. Crystal structure of Ba-substituted
gmelinite Ba4[Al8Si16O48]·nH2O // Sov. Phys.
[18] Miller F. A., Wilkins C. H. Infrared spectra and
Crystallogr. 1986. V. 31. N 5. P. 519-521].
characteristic frequencies of inorganic ions // Anal.
Chem. 1952. V. 24. N 8. P. 1253-1294.