Журнал прикладной химии. 2020. Т. 93. Вып. 5
УДК 661.961.6:66.092-977
ПИРОЛИЗ МЕТАНА ВОДОРОДНОГО НАПРАВЛЕНИЯ:
ОСОБЕННОСТИ ПРИМЕНЕНИЯ МЕТАЛЛИЧЕСКИХ РАСПЛАВОВ (обзор)
© В. Е. Парфенов1, Н. В. Никитченко1, А. А. Пименов1, А. Е. Кузьмин2,
М. В. Куликова2, О. Б. Чупичев2, А. Л. Максимов2
1 Самарский государственный технический университет,
443100, г. Самара, ул. Молодогвардейская, д. 244
2 Институт нефтехимического синтеза им. А. В. Топчиева РАН,
119991, г. Москва, Ленинский пр., д. 29
E-mail: parfenovve@gmail.com
Поступила в Редакцию 13 апреля 2020 г.
После доработки 13 апреля 2020 г.
Принята к публикации 13 апреля 2020 г.
Проведен анализ литературных источников, посвященных исследованиям процессов некаталити-
ческого пиролиза природного газа в жидкометаллических средах. Описаны наиболее показательные
экспериментальные результаты, полученные за последние 20 лет. Показано, что использование
расплавов металлов в качестве среды для проведения реакции позволяет решить проблему закоксо-
вывания реакторов пиролиза за счет флотации образующегося углерода к поверхности реакционного
объема. Рассмотрено применение жидкометаллических барботажных реакторов, позволяющих вести
процесс в температурных пределах вплоть до 1200°С. Максимальное описанное значение конверсии
составило 78% при 1175°С и расходе исходного газа 50 мл·мин-1. Основными факторами, способ-
ствующими повышению конверсии природного газа в рассматриваемых процессов, являются подъем
температуры, уменьшение размеров газовых пузырьков за счет использования барботажных систем
различного типа, а также увеличение времени пребывания газа в теплоносителе за счет увеличения
длины реактора или использования насадок различного типа.
Ключевые слова: пиролиз; природный газ; производство водорода; жидкометаллические барботаж-
ные реакторы; расплавы металлов
DOI: 10.31857/S0044461820050011
Введение
CH4 + H2O
→ 3H2 + CO
Почти 96% мировых запасов водорода произво-
CO + H2O
→ CO2 + H2
дится на основе ископаемых топлив, и лишь остав-
шиеся 4% получают электролизом [1, 2]. При этом
CH4 + 2H2O → 4H2 + CO2 .
половина производимого в мире водорода получается
по технологии паровой конверсии метана из природ-
В соответствии с приведенными уравнениями ре-
ного газа или в процессе газификации угля.
акций в процессе конверсии метана образуется как
Основными реакциями, протекающими при паро-
минимум 0.25 моль CO2 на 1 моль получаемого водо-
вом риформинге метана, являются
рода. Эмиссия CO2 для современной промышленной
611
612
Парфенов В. Е. и др.
Таблица 1
Термодинамические характеристики реакции пиролиза*
Температура реакции T, K
298
400
600
800
1000
1200
1400
1600
Энтальпия реакции ∆H°, кДж·моль-1
74.9
78.0
83.3
87.3
89.9
91.5
92.3
92.7
Энергия Гиббса реакции ∆G°, кДж·моль-1
50.8
42.1
22.9
2.12
-19.5
-41.5
-63.8
-86.1
* Расчет характеристик выполнен по данным NIST-JANAF Thermochemical Tables / NIST Standard Reference Database
установки без применения технологии по улавлива-
Изначально некаталитический вариант процес-
нию и хранению углекислого газа (Carbon Capture
са осуществляли в печах для производства сажи из
and Storage, CCS) составляет около 10 кг углекислого
огнеупорного кирпича при 1500°С [6]. В литературе
газа на 1 кг производимого водорода [3], что соответ-
представлены экспериментальные исследования нека-
ствует 0.45 моль CO2 на 1 моль H2. Такое количество
талитического разложения метана в широких темпе-
выбросов включает в себя часть CO2, образующегося
ратурных пределах (600-2000°С) при использовании
при сжигании природного газа для производства пара
реакторов различных конструкций [7]. Использование
и подвода тепла для сильноэндотермической реакции
металлических или углеродных катализаторов позво-
°
= 206 кДж·моль-1).
ляет снизить температуру реакции вплоть до 500°С
Термическое разложение (пиролиз) метана являет-
[8-10].
ся альтернативным подходом к получению водорода
Значительным препятствием к промышленному
из природного газа без образования CO2 в ходе уме-
внедрению пиролиза метана для получения водорода
ренно эндотермической реакции (табл. 1)
является удаление твердого углеродного продукта
CH4 → C↓ + 2H2↑.
из зоны реакции. При разложении метана в колон-
ных реакторах в отсутствие катализаторов твердый
Образующийся при этом углерод может исполь-
углерод осаждается на стенках разогретого реакто-
зоваться в качестве наполнителя или армирующего
ра, что препятствует прохождению газового потока
агента при производстве резиновых изделий, авто-
или даже приводит к полной его блокировке [11].
мобильных шин, а также в качестве пигмента для
Каталитический пиролиз метана в насадочных ре-
различных технологий. Мировой рынок углерода
акторах или реакторах с псевдоожиженным слоем
относительно невелик и составляет около 18 млн
приводит к осаждению углерода на поверхности ка-
тонн. По стехиометрии реакции разложения метана
тализатора, приводя к дезактивации каталитической
такое количество углерода пропорционально полу-
системы. Регенерация дезактивированного катализа-
чению всего 6 млн тонн водорода, в то время как
тора выжиганием углерода приводит к эмиссии CO2,
мировое производство водорода оценивается различ-
сравнимой с эмиссией при паровом риформинге [1, 9].
ными источниками от 55 до 87 млн тонн [2, 3]. Таким
Очевидно, утилизация выделяющегося углерода
образом, при обеспечении значительной части миро-
становится намного проще, если в процесс пироли-
вого производства водорода за счет пиролиза метана
за будет имплементирован технологический прием,
огромное количество углерода останется невостре-
позволяющий избежать связывание такого углерода
бованным. В то же время изолировать твердый пиро-
с какими бы то ни было твердыми поверхностями
лизный углерод намного проще, чем CO2, образован-
(стенками аппаратуры, гранулами катализатора).
ный в результате осуществления паровой конверсии.
Таким приемом может являться осуществление пи-
Кроме того, имеются предпосылки к развитию новых
ролиза металла в жидкометаллической среде. При
рынков углеродных материалов. Так, например, высо-
этом барботаж метана осуществляется через среду
кая твердость и прочность турбостратного углерода,
плавящегося при температурах пиролиза металла, а
представляющего собой неупорядоченные графито-
образующийся углерод агрегируется на поверхности
вые слои, и углеродных волокон, получаемых пиро-
пузырьков и далее поднимается на поверхность ме-
лизом метана, позволяют использовать их в композит-
таллического слоя.
ных строительных материалах. В случае удешевления
Целью настоящего обзора являлся анализ литера-
рассматриваемого процесса это может способство-
турных данных по использованию расплавов метал-
вать уменьшению выбросов углекислого газа, со-
лов в качестве реакционной среды пиролиза природ-
провождающих производство стали и цемента [4, 5].
ного газа для получения водорода.
Пиролиз метана водородного направления: особенности применения металлических расплавов (обзор)
613
Некаталитический пиролиз метана
Исследования по поиску оптимальной конструк-
в жидкометаллических средах
ции реактора для осуществления непрерывного тех-
нологического процесса проводились, как правило,
Впервые использование слоя расплавленного ме-
безотносительно какого-то конкретного способа на-
талла для отделения пиролизного углерода в процессе
грева. В них в основном изучались реакторы раз-
термического разложения метана было предложено
личных конфигураций в условиях электронагрева.
Д. Тайрером в 1931 г. [12]. В качестве жидкометал-
Для всех существующих концептуальных решений
лической среды в агрегате было предложено исполь-
газофазных реакторов при использовании как непод-
зовать расплавленное железо. Однако предложенное
вижного насадочного слоя, так и псевдоожиженного
Д. Тайером решение осталось без должного внима-
слоя высоки риски необратимой закупорки реактора
ния, и до 90-х годов XX века экспериментальные
образующимся углеродом [27].
исследования по пиролизу в жидкометаллических
Наиболее показательные экспериментальные ре-
средах не проводились.
зультаты в области жидкометаллического пиролиза
Началом нового этапа исследований по примене-
метана, как представляется к настоящему моменту,
нию расплавленного металла для решения проблемы
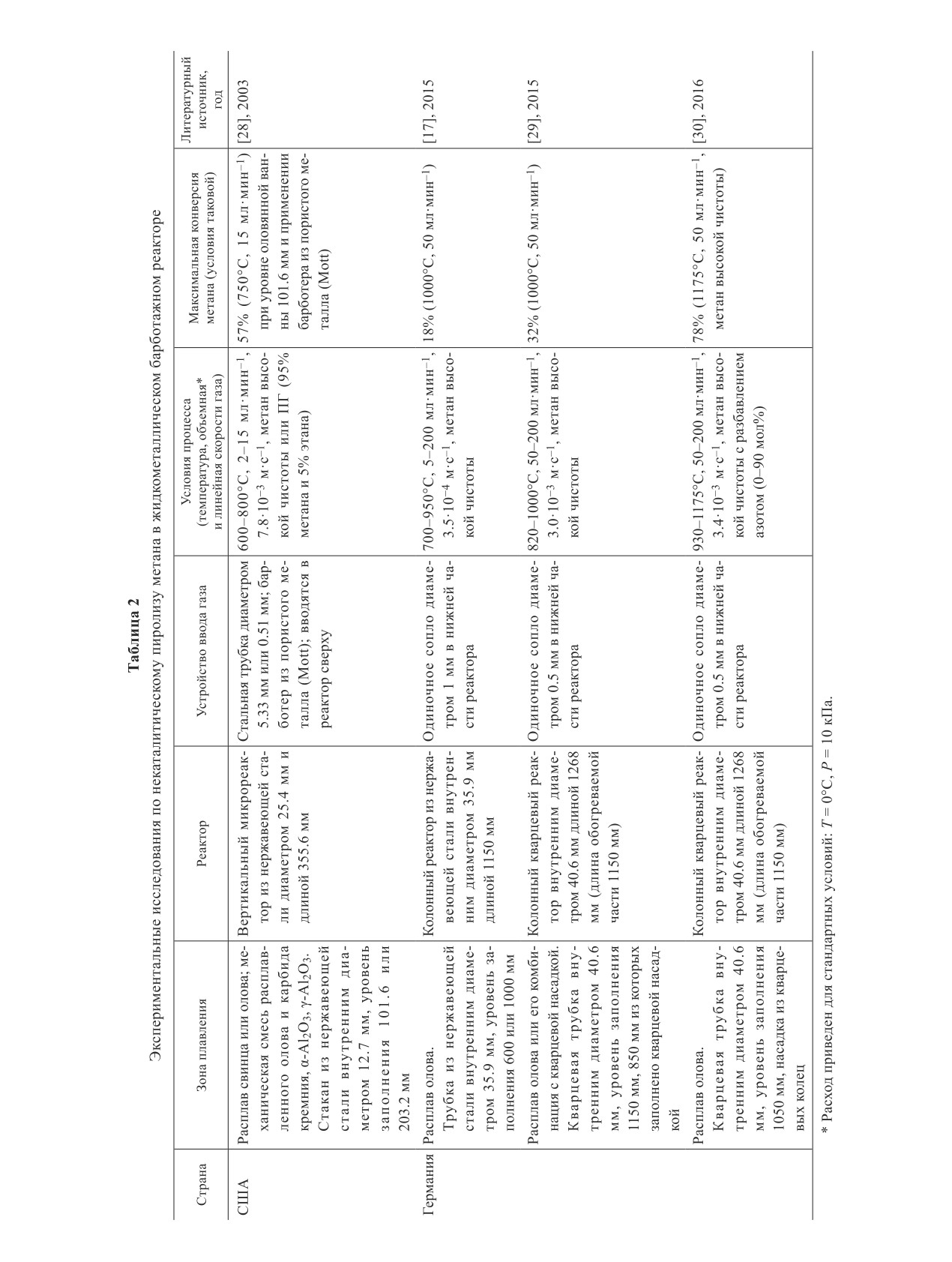
описаны в работах [17, 28-30] (табл. 2). В [28] метан
осаждения углерода в реакционном объеме при нека-
или природный газ (95% CH4 и 5% C2H6) барботиро-
талитическом пиролизе метана можно считать работы
вали через механическую смесь низкоплавкого ме-
М. Штейнберга [13, 14]. Метан вводился в нижнюю
талла (свинца или олова) и твердого материала (SiC,
часть реактора, образуя пузырьки, которые поднима-
Al2O3, NiMo/Al2O3). Выбор свинца и олова обосно-
лись сквозь расплавленный металл. Процесс пироли-
ван низкими температурами плавления и отсутстви-
за протекал внутри пузырьков. Образующийся при
ем склонности к образованию карбидов. В качестве
этом углерод поднимался к поверхности расплавлен-
единственного продукта при барботировании при-
ного металла, формируя слой, который непрерывно
родного газа через жидкометаллический теплоноси-
удалялся. Этот процесс основан на большом различии
тель в областях температур от 600 до 900°С авторы
плотностей образующегося углерода (2.11 г·см-3 для
работы [28] указывают водород. Никаких других га-
графита при 1100°С [15]) и жидкометаллического
зообразных продуктов в отходящих газах не обнару-
теплоносителя (6.41 г·см-3 для расплавленного олова
живалось.
при 1100°С [16]). Кроме того, низкая вязкость жидких
Понижение расхода исходного природного газа,
металлов (0.695 мПа·с для расплавленного олова при
а также увеличение уровня металла в агрегате при-
1100°С [16]) благоприятствует хорошему перемеши-
водили к увеличению конверсии сырья. Это скорее
ванию и соответственно эффективному теплоперено-
всего можно объяснить в обоих случаях увеличением
су между газовой и жидкой фазами.
времени контакта между исходным природным газом
Одним из важных технологических аспектов
и жидким металлом.
разработки процесса пиролиза метана является ис-
Для подтверждения значимости продолжительно-
пользуемый источник тепла, что во многом обуслов-
сти контакта между природным газом и теплоноси-
ливает конструкцию реактора. Концентрированное
телем были проведены сравнительные эксперименты
солнечное тепло является преимущественной формой
с использованием в качестве насадки частиц карбида
энергии, предлагаемой в ряде разработок исследова-
кремния (0.6 мм), что, согласно интерпретации ав-
тельских институтов Испании, Швейцарии, США,
торов [28], позволило увеличить время контакта в
Франции, Канады, Катара и др. [17]. В качестве дру-
40 раз. При температуре 750°С и расходе 2 мл·мин-1
гих источников тепла предлагалось микроволновое
конверсия исходного природного газа увеличилась
нагревание метана в объеме [18-20] или применение
почти в 1.5 раза. Увеличение объемного расхода сы-
плазменного нагрева [21-25]. В контексте проблемы
рья до 9 мл·мин-1 практически нивелировало разницу
пиролиза метана в среде жидкого металла следу-
в конверсии метана для зоны плавления с насадкой и
ет отметить технологические решения, предложен-
без нее. Похожие результаты получались при исполь-
ные в патенте [26]. В ходе производства метанола
зовании в качестве насадки непористого α-Al2O3 с не-
из природного газа тепло, генерируемое ядерными
развитой поверхностью (~0.1 м2·г-1, 0.2 мм). Лучшая
реакторами IV поколения, применялось для получе-
конверсия метана наблюдалась при использовании
ния водорода и углерода путем прямого контактного
насадок из γ-Al2O3 (284 м2·г-1, 0.5 мм) — 26% при
пиролиза метана или исходного газа с вовлечением
расходе 5 мл·мин-1.
образующегося водорода в реакцию с диоксидом
Другим способом повышения конверсии метана
углерода.
является уменьшение размеров газовых пузырьков.
Пиролиз метана водородного направления: особенности применения металлических расплавов (обзор)
615
Сравнительные эксперименты при использовании
метана рассмотрено и экспериментально апробиро-
сопел различного диаметра показали, что при умень-
вано несколько механизмов реакции. Принимая во
шении размеров пузырьков в 10 раз конверсия метана
внимание, что детальный механизм реакции пиро-
увеличивалась почти в 5 раз, что авторы [28] интер-
лиза очень сложен и до сих пор до конца не изучен,
претируют как следствие увеличения эффективности
большинство авторов соглашаются с механизмом сту-
межфазного теплопереноса и более равномерного
пенчатого дегидрирования, предложенного М. Бэком
нагрева газовой среды внутри пузырьков. Однако
[34], где на первой стадии образуется этан, на вто-
авторы [28] отмечают, что тонкое сопло (d = 0.51 мм)
рой — этилен, на третьей — ацетилен:
полностью забивалось пиролизным углеродом уже
через 8 ч работы.
CH4 -H2 C2H6 -H2 C2H4 -H2 C2H2 -H2 2C.
Еще более значительная конверсия метана на-
блюдалась при использовании в качестве распре-
В результате проведенных исследований было
делительного устройства для введения исходного
выяснено, что использование кинетики реакции пер-
сырья пористых металлических фильтров (размер пор
вого порядка для всего процесса пиролиза метана
0.5 мкм). Максимальная конверсия метана при этом
возможно только для экспериментов с низкими кон-
составила 57% для оловянного расплава с насадкой
центрациями водорода.
из карбида кремния и 51% для того же расплава без
В рассматриваемых в работе [17] температурных
насадок (750°С, 15 мл·мин-1).
пределах (750-900°С) олово не оказывает каталити-
Обнаруженные в работе [28] закономерности по-
ческого влияния на процесс пиролиза метана, однако
казали возможность создания эффективного непре-
образование промежуточных продуктов в присут-
рывного процесса производства водорода пиролизом
ствии олова уменьшается.
метана в жидкометаллическом барботажном реакто-
Кроме того, в работе [17] было показано, что кон-
ре.
версия метана в жидкометаллическом барботажном
Как и ожидалось, пиролизный углерод отделяет-
реакторе протекает преимущественно в газофазной
ся от жидкого металла за счет разности плотностей
части над зоной плавления. Для выяснения влияния
[29-31] и собирается в виде слоя на поверхности рас-
жидкого олова на процесс пиролиза метана необхо-
плавленного металла. При использовании кварцевых
димо большее время контакта газа с жидкой фазой и
насадок для заполнения зоны плавления показано,
меньшее время пребывания газа в газофазной части
что пиролизный углерод частично осаждается в пу-
реактора.
стотах насадок, но само жидкое олово пиролизным
Экспериментальные исследования по термохи-
углеродом не загрязнено [29, 30]. Практически все
мическому моделированию получения водорода в
исследования показывают, что пиролизный углерод
жидкометаллическом барботажном реакторе были
осаждается на разогретых стенках реактора, но его
продолжены в работе [29]. Для расширения темпера-
слой остается достаточно тонким (около 10 мкм за 15
турных пределов исследования и устранения влияния
дней работы [30]), а скорость осаждения со временем
коррозии для реактора был подобран новый матери-
уменьшается [31].
ал — кварцевое стекло. Новое устройство реактора
В работе [17] проведены кинетические исследова-
также позволило улучшить распределение темпера-
ния и построена термохимическая модель процесса
туры вдоль реактора, что избавило от необходимости
пиролиза. Ввод газа осуществлялся через одиночное
разбиения реактора на отдельные температурные
сопло в нижней части реактора из нержавеющей ста-
подсистемы для термохимического моделирования
ли, заполненного расплавленным оловом без исполь-
процесса. Наряду с этим зона плавления реактора
зования насадок. В описанных условиях (температура
заполнялась насадкой, которая позволила увеличить
реакции 900°С, скорость подачи исходного метана
время контакта газа с жидкометаллическим тепло-
50 мл·мин-1) максимальная степень конверсии метана
носителем, что привело к увеличению выхода водо-
составила 18%.
рода.
В результате проведения экспериментов была по-
После непрерывной эксплуатации эксперимен-
строена численная модель, описывающая тепловое
тальной установки в течение двух недель на стенках
и химическое поведение метана, проходящего через
реактора было зафиксировано относительно неболь-
реактор, с учетом слепых горячих зон выше и ниже
шое количество углеродных отложений. В работе
зоны плавления. Химическая часть модели основы-
исследовалось семь температурных режимов в об-
валась на литературных данных по пиролизу метана
ласти от 820 до 1000°С при расходе чистого метана
[27, 32, 33]. Для моделирования кинетики пиролиза
50-200 мл·мин-1.
616
Парфенов В. Е. и др.
Как и в работе [17], выход водорода увеличивался
В работах [35, 36] описан процесс получе-
с повышением температуры и увеличением времени
ния водорода с использованием в зоне плавления
контакта (уменьшением объемного расхода мета-
тяжелых жидкометаллических теплоносителей
на). Максимальный выход водорода составил 30%
(Pb-Bi). Отличием данной модификации являлось
при конверсии метана 32% при температуре реакции
осуществление подачи метана в нижнюю часть ре-
1000°С и линейной скорости подачи исходного мета-
актора.
на 50 мл·мин-1. Основными компонентами отходяще-
В работе [37] опубликованы теоретические иссле-
го газа были метан и водород, содержание побочных
дования пиролиза метана в жидкометаллическом бар-
продуктов составляло менее 1.6 мол%. В описанных
ботажном реакторе с различным типом инжекторов
условиях на отводной трубке жидкометаллического
для ввода газа (трубки диаметром 6 и 3 мм, пористые
реактора и на газовом фильтре было зафиксировано
барботеры с порами 7 и 0.5 мкм).
образование следовых количеств полиароматических
Авторами [38] представлена идея по получению
углеводородов. Для оценки времени контакта были
водорода в жидких металлах при использовании ка-
проведены натурные испытания с деминерализован-
пиллярного реактора. В первых экспериментах при
ной водой. Образующийся в экспериментах элемен-
1100°С была достигнута средняя конверсия метана
тарный углерод откладывался в виде тонкой плен-
32%. Следует отметить, что после 5 ч непрерывной
ки на стенках реактора, а в самом расплаве металла
работы установки на горячих стенках капилляров
следов углерода не наблюдалось. Каталитического
не отмечалось образования отложений пиролизного
влияния жидкого олова и образующегося углерода
углерода.
на процесс разложения метана авторами работы [29]
Возможен пиролиз метана в жидком магнии [39].
обнаружено не было.
Максимальная конверсия метана достигала 30% при
Выход водорода при разложении метана в аппа-
700°С. Более высокие конверсии оказались недости-
ратах с насадкой из кварцевых колец с порозностью
жимы вследствие активного испарения магния при
84 об% и в аппаратах с насадкой из осколков кварце-
повышении температуры.
вого стекла с порозностью 76 об% был практически
одинаковым [29]. Большая часть образующегося угле-
Заключение
рода скапливалась на поверхности жидкого металла в
виде порошка с размерами частиц 15-20 мкм. Также
Повышение конверсии метана для некаталитиче-
тонкий слой, содержащий углеродные нанотрубки,
ских процессов в жидкометаллическом барботажном
осаждался в зоне плавления между расплавом метал-
реакторе достигается за счет подъема температуры,
ла и стенкой кварцевого реактора.
что ожидаемо в соответствии с кинетикой термиче-
Основными особенностями эксперимента, описан-
ского разложения метана. Большая часть исследо-
ного в работе [30], являются высокая рабочая темпе-
ваний показывает, что для достижения существен-
ратура 1175°С, различная геометрия используемых
ной конверсии метана требуются температуры выше
в зоне плавления насадок и разбавление исходного
900°С. Заметным исключением является работа [28],
газа азотом.
авторы которой сообщают о 57%-ной конверсии ме-
Эксперимент проводился в температурном интер-
тана при относительно невысокой температуре 750°С
вале 930-1175°С при значениях линейной скорости
в расплавленном олове. Авторы объясняют такую вы-
подачи исходного сырья 50-200 мл·мин-1. В экспе-
сокую конверсию метана использованием металличе-
риментах на неразбавленном метане максимальный
ских пористых фильтров в качестве рассекателей для
выход водорода составил 78% при температуре ре-
ввода газа в нижнюю часть реактора. Из-за образова-
акции 1175°С, линейной скорости подачи метана
ния мелких пузырьков из тысяч пор на поверхности
50 мл·мин-1. Разбавление метана азотом в пределах
фильтров увеличивается эффективная поверхность
от 0 до 90 об% не оказало существенного влияния
раздела газовой и жидкой фаз и улучшается межфаз-
на выход водорода в изучаемых температурных пре-
ный тепло- и массоперенос.
делах.
Дальнейшие исследования пиролиза метана в жид-
Наконец, целесообразно указать на некоторые ра-
ких металлических средах, как можно ожидать, будут
боты, в которых охарактеризованы другие подходы к
направлены в немалой степени именно на выяснение
данному процессу: применение нетипичных метал-
влияния вышеупомянутых факторов на эффектив-
лических сред или оригинальных технологических
ность процесса. Явления межфазного массопереноса
приспособлений для структурирования газожидкост-
могут оказаться в особенности важными в случае
ной среды.
введения в процесс гетерогенных или наноразмерных
Пиролиз метана водородного направления: особенности применения металлических расплавов (обзор)
617
катализаторов; важным может оказаться и вопрос о
[3] Митрова Т., Мельников Ю., Чугунов Д.,
том, до какой степени можно изменять растворимость
Глаголева А. Водородная экономика — путь к низ-
метана в жидкометаллических носителях (в особен-
коуглеродному развитию. М.: СКОЛКОВО, 2019.
С. 8, 21.
ности — сложного состава) и в какой степени реак-
[4] Muradov N. Z., Veziroǧlu T. N. From hydrocarbon
ция пиролиза может протекать непосредственно в
to hydrogen-carbon to hydrogen economy // Int. J.
объеме металлической фазы.
Hydrogen Energy. 2005. V. 30. N 3. P. 225-237.
[5] Halloran J. W. Extraction of hydrogen from fossil
Финансирование работы
fuels with production of solid carbon materials // Int.
J. Hydrogen Energy. 2008. V. 33. N 9. P. 2218-2224.
Работа выполнена при финансовой под-
держке Минобрнауки РФ в рамках соглашения
[6] Muradov N. Z. How to produce hydrogen from fossil
№ 05.607.21.0311 от 02.12.19, уникальный иденти-
fuels without CO2 emission // Int. J. Hydrogen Energy.
фикатор соглашения RFMEFI60719X0311.
1993. V. 18. N 3. P. 211-215.
[7] Trottier D., Flynn M.R., Kostiuk L., Secanell M.
Конфликт интересов
Experimental and numerical analysis of a methane
thermal decomposition // Int. J. Hydrogen Energy.
А. Л. Максимов является главным редактором
2017. V. 42. N 40. P. 25166-25184.
Журнала прикладной химии. У остальных авторов
конфликта интересов, требующего раскрытия в дан-
[8] Amin A. M., Croiset E., Amin A. M., Epling W.
ной статье, нет.
Review of methane catalytic cracking for hydrogen
production // Int. J. Hydrogen Energy. 2011. V. 36.
N 4. P. 2904-2935.
Информация об авторах
[9] Abbas H. F., Wan Daud W. M. A. Hydrogen production
Парфенов Виктор Евгеньевич,
by methane decomposition: A review // Int. J.
Hydrogen Energy. 2010. V. 35. N 3. P. 1160-1190.
Никитченко Наталья Викторовна, к.х.н.,
[10] Yan W., Hoekman S. K. Production of CO2-free
Пименов Андрей Александрович, д.т.н., доцент,
hydrogen from methane dissociation: A review //
Environ. Prog. Sustainable Energy. 2014. V. 33. N 1.
Кузьмин Алексей Евгеньевич, к.х.н.,
[11] Abánades A., Ruiz E., Ferruelo E.M., Hernández F.,
Куликова Майя Валерьевна, к.х.н.,
Cabanillas A., Martínez-Val J. M., Rubio J. A.,
López C., Gavela R., Barrera G., Rubbia C.,
Чупичев Олег Борисович, к.т.н.,
Salmieri D., Rodilla E., Gutiérrez D. Experimental
analysis of direct thermal methane cracking // Int. J.
Hydrogen Energy. 2011. V. 36. N 20. P. 12877-12886.
Максимов Антон Львович, д.х.н., проф. РАН,
чл.-корр. РАН,
[12] Pat. US 1803221 A (publ. 1931). Production of
hydrogen.
[13] Steinberg M. The Carnol process for CO2 mitigation
from power plants and the transportation sector //
Список литературы
Energy Convers. Manage. 1996. V. 37. N 6. P.843-
[1] Muradov N. Low to near-zero CO2 production of
hydrogen from fossil fuels: Status and perspectives //
[14] Steinberg M. Fossil fuel decarbonization technology
Int. J. Hydrogen Energy. 2017. V. 42. N 20. P. 14058-
for mitigating global warming // Int. J. Hydrogen
Energy. 1999. V. 24. N 8. P. 771-777.
[2] Catalan L. J. J., Rezaei E. Coupled hydrodynamic
and kinetic model of liquid metal bubble reactor
[15] Senchenko V. N., Belikov R. S. Experimental
for hydrogen production by noncatalytic thermal
investigation of linear thermal expansion of pyrolytic
decomposition of methane // Int. J. Hydrogen Energy.
graphite at high temperatures // J. Phys.: Conf. Ser.
2020. V. 45. N 4. P. 2486-2503.
2017. V. 891. P. 12338.
618
Парфенов В. Е. и др.
[16] Assael M. J., Kalyva A. E., Antoniadis K. D., Michael
[27]
Rodat S., Abanades S., Coulié J., Flamant G. Kinetic
Banish R., Egry I., Wu J., Kaschnitz E., Wakeham W. A.
modelling of methane decomposition in a tubular solar
Reference data for the density and viscosity of liquid
reactor // Chem. Eng. J. 2009. V. 146. N 1. P. 120-127.
copper and liquid tin // J. Phys. Chem. Ref. Data.
2010. V. 39. N 3. P. 33105.
[28]
Serban M., Lewis M. A., Marshall C. L., Doctor R. D.
Hydrogen production by direct contact pyrolysis of
[17] Abánades A., Mehravaran K., Rathnam R. K.,
natural gas // Energy Fuels. 2003. V. 17. N 3. P. 705-
Rubbia C., Salmieri D., Stoppel L., Stückrad S.,
Wetzel Th. Thermal cracking of methane in a liquid
[29]
Geißler T., Plevan M., Abánades A., Heinzel A.,
metal bubble column reactor: Experiments and kinetic
Mehravaran K., Rathnam R.K., Rubbia C.,
analysis // Int. J. Hydrogen Energy. 2015. V. 40. N 25.
Salmieri D., Stoppel L., Stückrad S., Weisenburger A.
P. 8020-8033.
Wenninger H., Wetzel Th. Experimental investigation
and thermo-chemical modeling of methane pyrolysis
[18] Domínguez A., Fidalgo B., Fernández Y., Pis J. J.,
in a liquid metal bubble column reactor with a packed
Menéndez J. A. Microwave-assisted catalytic
bed // Int. J. Hydrogen Energy. 2015. V. 40. N 41.
decomposition of methane over activated carbon for
P. 14134-14146.
CO2-free hydrogen production // Int. J. Hydrogen
Energy. 2007. V. 32. N 18. P. 4792-4799.
[30]
Geißler T., Abánades A., Heinzel A., Mehravaran K.,
Müller G., Rathnam R.K., Rubbia C., Salmieri D.,
[19] Fidalgo B., Fernández Y., Domínguez A., Pis, J. J.,
Stoppel L., Stückrad S., Weisenburger A.,
Menéndez J. A. Microwave-assisted pyrolysis of CH4/
Wenninger H., Wetzel Th. Hydrogen production via
N2 mixtures over activated carbon // J. Anal. Appl.
methane pyrolysis in a liquid metal bubble column
Pyrol. 2008. V. 82. N 1. P. 158-162.
reactor with a packed bed // Chem. Eng. J. 2016.
V. 299. P. 192-200.
[20] Chen W.-H., Liou H.-J., Hung Ch.-I. A numerical
approach of interaction of methane thermocatalytic
[31]
Upham D. C., Agarwal V., Khechfe A., Snodgrass Z. R.,
decomposition and microwave irradiation // Int. J.
Gordon M. J., Metiu H., McFarland E. W. Catalytic
Hydrogen Energy. 2013. V. 38. N 30. P. 13260-13271.
molten metals for the direct conversion of methane
to hydrogen and separable carbon // Science. 2017.
[21] Fulcheri L., Schwob Y. From methane to hydrogen,
V. 358. N 6365. P. 917.
carbon black and water // Int. J. Hydrogen Energy.
1995. V. 20. N 3. P. 197-202.
[32]
Kozlov G. I., Knorre V. G. Single-pulse shock tube
studies on the kinetics of the thermal decomposition
[22] Fulcheri L., Probst N., Flamant G., Fabry F., Grivei E.,
of methane // Combust. Flame. 1962. V. 6. P. 253-263.
Bourrat X. Plasma processing: A step towards the
production of new grades of carbon black // Carbon.
[33]
Kevorkian V., Heath C. E., Boudart M. The
2002. V. 40. N 2. P. 169-176.
Decomposition of vethane in shock waves 1 // J. Phys.
Chem. 1960. V. 64. N 8. P. 964-968.
[23] Muradov N., Smith F., Bockerman G., Scammon K.
Thermocatalytic decomposition of natural gas over
[34]
Chen C. J., Back M. H., Back R. A. The Thermal
plasma-generated carbon aerosols for sustainable
decomposition of methane. I. Kinetics of the primary
production of hydrogen and carbon // Appl.
decomposition to C2H6 + H2; rate constant for the
Catal. A. 2009. V. 365. N 2. P. 292-300.
homogeneous unimolecular dissociation of methane
and its pressure dependence // Canad. J. Chem. 1975.
[24] Tsai C.-H., Chen K.-T. Production of hydrogen and nano
V. 53. N 23. P. 3580-3590.
carbon powders from direct plasmalysis of methane //
[35]
Martynov P. N., Gulevich A. V., Orlov Yu. I.,
Int. J. Hydrogen Energy. 2009. V. 34. N 2. P. 833-
Gulevsky V. A. Water and hydrogen in heavy liquid
metal coolant technology // Prog. Nucl. Energ. 2005.
[25] Dors M., Nowakowska H., Jasiński M., Mizeraczyk J.
V. 47. N 1. P. 604-615.
Chemical kinetics of methane pyrolysis in microwave
plasma at atmospheric pressure // Plasma Chem.
[36]
Gulevich A. V., Martynov P. N., Gulevsky V. A.,
Plasma Process. 2014. V. 34. N 2. P. 313-326.
Ulyanov V. V. Technologies for hydrogen production
based on direct contact of gaseous hydrocarbons and
[26] Pat. US 5767165 A (publ. 1998). Method for
evaporated water with molten Pb or Pb-Bi // Energ.
converting natural gas and carbon dioxide to methanol
Convers. Manage. 2008. V. 49. N 7. P. 1946-1950.
and reducing CO2 emissions.
Пиролиз метана водородного направления: особенности применения металлических расплавов (обзор)
619
[37] Paxman D., Trottier S., Nikoo M., Secanell M.,
Fluid wall flow reactor and molten metal capillary
Ordorica-Garcia G. Initial experimental and
reactor // Int. J. Hydrogen Energy. 2015. V. 40. N 35.
theoretical investigation of solar molten media
P. 11422-11427.
methane cracking for hydrogen production // Energy
Procedia. 2014. V. 49. P. 2027-2036.
[39] Wang K., Li W. S., Zhou X. P. Hydrogen generation
by direct decomposition of hydrocarbons over molten
[38] Schultz I., Agar D. W. Decarbonisation of fossil energy
magnesium // J. Mol. Catal. A: Chemical. 2008.
via methane pyrolysis using two reactor concepts:
V. 283. N 1. P. 153-157.