Синтез, гербицидная и антиокислительная активность ряда...
705
Журнал прикладной химии. 2020. Т. 93. Вып. 5
УДК 547.424
СИНТЕЗ, ГЕРБИЦИДНАЯ И АНТИОКИСЛИТЕЛЬНАЯ АКТИВНОСТЬ РЯДА
ГЕТЕРО- И КАРБОЦИКЛИЧЕСКИХ ПРОИЗВОДНЫХ
МОНОХЛОРУКСУСНОЙ КИСЛОТЫ
© Е. А. Яковенко1, Ю. Л. Баймурзина2, Г. З. Раскильдина1*, С. С. Злотский1
1 Уфимский государственный нефтяной технический университет,
450064, Республика Башкортостан, г. Уфа, ул. Космонавтов, д. 1
2 Башкирский государственный медицинский университет,
450000, Республика Башкортостан, г. Уфа, ул. Заки Валиди, д. 47
* E-mail: graskildina444@mail.ru
Поступила в Редакцию 20 октября 2018 г.
После доработки 4 сентября 2019 г.
Принята к публикации 8 февраля 2020 г.
Синтезированы эфиры и амиды монохлоруксусной кислоты, содержащие карбо- и гетероциклы, а
также гетероциклические эфиры и амиды на основе хлорангидридов промышленных арилуксусных
кислот. Методами ЯМР 1Н, 13С спектроскопии описаны структуры выделенных соединений. Изучена
гербицидная активность полученных веществ на одно- и двудольных растениях. Методом регистрации
люминолзависимой хемилюминесценции исследована их относительная антиоксидантная активность.
Экспериментальные данные в целом подтверждают целесообразность и перспективность создания
гербицидов, содержащих ацетальные и гем-дихлорциклопропановые фрагменты.
Ключевые слова: амины; эфиры и амиды монохлоруксусной кислоты; циклоацетальный и гем-дихлор-
циклопропановый фрагменты; гербицидная и антиокислительная активности
DOI: 10.31857/S0044461820050126
Производные монохлоруксусной кислоты, в пер-
Экспериментальная часть
вую очередь эфиры и амиды арилоксиуксусных кис-
лот, проявляют высокую гербицидную активность
Хроматографический анализ продуктов реакции
и широко применяются в качестве химических
выполняли на хроматографе HRGS 5300 Mega Series
средств защиты растений [1, 2]. Этим определяется
Carlo Erba с пламенно-ионизационным детектором,
важность и актуальность синтеза новых гетеро- и
газ-носитель — гелий, расход 30 мл·мин-1, колон-
карбоциклических производных монохлоруксусной
ка длиной 25 м, температура анализа 50-280°С с
кислоты и оценка их гербицидной и биологической
программированным нагревом 8 град·мин-1, тем-
активности.
пература детектора 250°С, температура испарителя
Ранее было показано, что присутствие циклоаце-
300°С. Хроматомасс-спектры записывали на прибо-
тального и гем-дихлорциклопропанового фрагментов в
рах Fisons (капиллярная кварцевая колонка DB 560
структуре молекул повышает их биологическую актив-
50 м) и Focus c масс-спектрометрическим детекто-
ность и способность регулировать рост растений [3].
ром Finingan DSQII (температура ионного источ-
Целью настоящей работы являлся синтез эфиров
ника 200°С, температура прямого ввода 50-270°С,
и амидов монохлоруксусной кислоты, содержащих
скорость нагрева 10 град·мин-1, колонка Thermo
1,3-диоксалановый и гем-дихлорциклопропановый
TR-5MS 50 × 2.5·10-4 м, расход гелия 0.7 мл·мин-1).
фрагменты, и оценка их биологической и гербицид-
Для получения масс-спектров соединений использо-
ной активности.
вали ионизацию электронным ударом. Спектры ЯМР
706
Яковенко Е. А. и др.
регистрировали на спектрометре Bruker AVANCE-500
(5 мм рт. ст.). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.05 т
(1H 300.13 МГц) в CDCl3.
(6H, 2C13H3, 2J = 7.2), 1.31 c (3H, C7H3), 1.39 c (3H,
В работе использовались свежеперегнанные рас-
C6H3), 2.61 дд (4H, 2C11H2, 2J = 7.1), 3.32 c (2H,
творители фирмы ООО «Техресурс»: ацетонитрил
C10H2), 3.71 м (1H, C4H1), 4.05 дд (1H, C5Hb, 2J = 6.0),
(х.ч.), диметилсульфоксид (х.ч.), пиридин (х.ч.),
4.15 дд (2H, C8H2, 2J = 4.3, 3J = 7.1), 4.29 дд (1H, C5Ha,
хлорангидрид монохлоруксусной кислоты фир-
2J = 6.0). Спектр ЯМР 13C, δС, м. д.: 12.08 (2C12),
мы Sigma-Aldrich, свежепрокаленные соли фирмы
25.31 (C7), 26.65 (C6), 47.66 (2C11), 53.73 (C10), 64.58
ООО «Стеклоприбор»: K2CO3 («чистый»), MgSO4
(C8), 65.80 (C5), 73.50 (C4), 109.82 (C2), 171.12 (C9).
(«чистый»), гетероциклический спирт — 2,2-диме-
Масс-спектр, m/e (Iотн, %): [M]+ 245 (2), 230 (6.5), 86
тил-4-оксиметил-1,3-диоксолан и эфир монохлорук-
(100), 43 (10).
сусной кислоты — (2,2-диметил-1,3-диоксолан-4-ил)-
Бис[(2,2-диметил-1,3-диоксолан-4-ил)метил]2,2′-
метил хлорацетат (1), полученные по методике [4].
пиперазин-1,4-диилацетат (5). Выход 57%, Тпл =
Общая методика получения соединений (2,2-ди-
= 152-154°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.30
метил-1,3-диоксолан-4-ил)метилморфолин-4-
c (6H, 2C7H3), 1.39 c (6H, C6H3), 2.52 c (4H, C1′H2,
илацетата (2), (2,2-диметил-1,3-диоксолан-4-ил)-
C1″H2), 3.20 c (4H, 2C10H2), 3.75 c (4H, C2′H2, C2″H2),
метилпиперазин-1-илацетата (3), 2,2-диме-
3.71 м (1H, C4H1), 4.14 д (1H, C5Ha, 2J = 2.8), 4.27 д
тил-1,3-диоксолан-4-ил)метил-N,N-диэтилглици-
(1H, C5Hb, 2J = 2.8). Спектр ЯМР 13C, δС, м. д.: 25.73
ната (4), бис[(2,2-диметил-1,3-диоксолан-4-ил)ме-
(2C7H3), 26.94 (2C6H3), 52.45 (4C2′ + C2″, C1′ + C1″),
тил]2,2′-пиперазин-1,4-диилацетата (5). В смесь,
58.59 (C10), 64.69 (C8), 65.80 (C4), 73.49 (C5), 109.22
состоящую из 20 мл ацетонитрила, 0.15 моль (20.7 г)
(C2), 170.15 (C9).
K2CO3, добавили 0.1 моль (8.7 г) морфолина, или
Общая методика получения соединений метил-
0.1 моль (8.6 г) пиперазина, или 0.1 моль (7.3 г) ди-
пиперазин-1-илацетата (6) и диметил-2,2′-пипера-
этиламина. Реакционную смесь кипятили в течение
зин-1,4-диилацетата (7). В трехгорлую колбу, осна-
2 ч. Затем добавляли 0.12 моль (20.8 г) соединения
щенную обратным холодильником, термометром и
(1) и кипятили в течение 7 ч. Реакционную смесь
механической мешалкой, загружали 0.03 моль (2.58 г)
фильтровали в горячем виде, фильтрат упаривали
пиперазина, 15 мл ДМСО, 0.01 моль (2.08 г) метило-
и перегоняли при пониженном давлении в вакууме.
вого эфира монохлоруксусной кислоты. Реакционную
(2,2-Диметил-1,3-диоксолан-4-ил)метилморфо-
смесь перемешивали в течение необходимого време-
лин-4-илацетат (2). Выход 37%, Ткип = 160°С (2 мм
ни при температуре 70-75°C. По завершении реакции
рт. ст.). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.30 c (3H,
всю реакционную массу промывали 20%-ным раство-
C7H3), 1.39 с (3H, C6H3), 2.52 c (4H, C3′H2, C3′H2),
ром NaOH, экстрагировали эфиром. Верхний органи-
3.20 c (2H, C10H2), 3.75 c (4H, C2′H2, C2″H2), 3.70-
ческий слой промывали водой до нейтральной среды,
3.74 м (1H, C4H1), 4.14 д (1H, C5Ha, 2J = 2.8), 4.26 д
сушили безводным карбонатом калия. Растворитель
(1H, C5Hb, 2J = 2.8). Спектр ЯМР 13C, δС, м. д.: 25.23
упаривали на роторном испарителе, остаток перего-
(C7), 26.57 (C6), 53.14 (C3′ + C3″), 59.21 (C10H2), 64.52
няли при пониженном давлении в атмосфере азота.
(C8H2), 64.71 (C5H2), 66.10 (C2′ + C2″), 73.72 (C4H1)
Метилпиперазин-1-илацетат (6). Выход 48%,
109.77 (C2), 169.77 (C9). Масс-спектр, m/e (Iотн, %):
Тпл = 122-124°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц):
[M]+ 259 (1), 193 (50), 101 (24), 77 (24), 72 (14), 57
2.51 с (1H, NH), 2.63 с (8H, C4H2, C4′H2, C5H2, C5′H2),
(20), 43 (100).
3.36 с (2H, C1H2), 3.69 с (3H, C3H3). Спектр ЯМР 13C,
(2,2-Диметил-1,3-диоксолан-4-ил)метилпипера-
δС, м. д.: 47.01 (C5 + C5′), 52.13 (C3), 54.10 (C1), 57.32
зин-1-илацетат (3). Выход 31%, Тпл = 135-137°С.
(C4 + C4′), 176.71 (C2). Масс-спектр, m/e (Iотн, %):
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.32 c (3H, C7H3),
[M]+ 158 (8), 116 (20), 99 (100), 88 (8), 70 (18), 56 (34).
1.38 c (3H, C6H3), 2.31 c (1H, NH), 2.53 c (4H, C2′H2,
Диметил 2,2′-пиперазин-1,4-диилацетат (7).
C2″H2), 3.11 c (4H, 2CH2), 3.20 c (2H, C10H2), 3.72 д
Выход 70%, Тпл = 134-136°С. Спектр ЯМР 1Н, δ,
(1H, C4H1, 2J = 4.6, 3J = 7.8, 3J = 4.1), 4.02 д (2H, C8H2,
м. д. (J, Гц): 2.65 c (8H, C4H2, C4′H2, C5H2, C5′H2),
2J = 4.1, 3J = 4.6), 4.15 д (1H, C5Hb, 2J = 7.8, 3J = 4.6),
3.25 (4H, 2C1H2), 3.71 c (6H, 2C3H3). Спектр ЯМР
4.25 д (1H, C5Ha, 2J = 7.8, 3J = 4.6). Спектр ЯМР 13C,
13C, δС, м. д.: 51.73 (2C3), 52.76 (C4 + C4′, C5 + C5′),
δС, м. д.: 25.41 (C7), 26.35 (C6), 46.91 (C3′ + C3″), 55.74
59.33 (2C1), 170.65 (2C2). Масс-спектр, m/e (Iотн, %):
(C2′ + C2″), 56.22 (C10), 64.10 (C8), 64.46 (C5), 73.70
[M]+ 230 (10), 171 (100), 98 (58), 80 (8) 70 (12), 56 (28).
(C4), 107.97 (C2), 173.01 (C9).
Общая методика получения соединений
2,2-Диметил-1,3-диоксолан-4-ил)метил-N,N-ди-
2,2-диметил-1,3-диоксолан-4-ил)метил-N-бен-
этилглицинат
(4). Выход
58%, Ткип = 142°С
зил-N-[(2,2-дихлороциклопропил)метил]глицината
Синтез, гербицидная и антиокислительная активность ряда...
707
(8) и метил-N-бензил-N-[(2,2-дихлороциклопропил)-
(2,2-Диметил-1,3-диоксолан-4-ил)метил фенокси-
метилглицината (9). В смесь, состоящую из 20 мл
ацетат (10). Выход 67%, Ткип = 180°С (4 мм рт. ст.).
ацетонитрила, 0.15 моль (20.7 г) K2CO3, добавили
Спектр ЯМР 1Н (CDCl3, δ, м. д., J, Гц): 1.20 c (3H,
0.1 моль (23 г) N-бензил-1-(2,2-дихлороциклопро-
C7H3), 1.50 c (3H, C6H3), 3.65 дд (1H, C4H, 2J = 5.6,
пил)-метанамина и 0.12 моль (24.9 г) (2,2-диме-
3J = 6.9, 3J = 4.9), 3.95 дд (2H, C5H2, 2J = 6.9, 3J = 5.6),
тил-1,3-диоксолан-4-ил)метил хлорацетата (1) или
4.20 дд (2H, C8H2, 2J = 4.9, 3J = 5.6), 4.60 с (2H,
0.12 моль (12.9 г) метилового эфира монохлоруксус-
C10H2), 6.80-7.40 (5H, Ph-). Спектр ЯМР 13С (CDCl3,
ной кислоты и перемешивали при микроволновом
δ, м. д.): 25.24 (C7), 26.61 (C6), 63.14 (C8), 65.45 (C4),
излучении в течение 1 ч. Реакционную смесь филь-
69.77 (C10), 71.12 (C5), 109.88 (C2), 114.56-129.60 (5H,
тровали в горячем виде, фильтрат упаривали и пере-
Ph-), 157.64 (CPh), 168.79 (C9). Масс-спектр, m/e (Iотн,
гоняли при пониженном давлении в вакууме.
%): [M]+ 266 (18), 251 (68), 117 (17), 107 (100), 101
2,2-Диметил-1,3-диоксолан-4-ил)метил-N-бен-
(32), 79 (14), 77 (50), 72 (12), 59 (10), 51 (9).
зил-N-[(2,2-дихлороциклопропил)метил]глицинат
2,2-Диметил-1,3-диоксолан-4-ил)метил(2,4-дихло-
(8). Выход 78%, Ткип = 270°С (3 мм рт. ст.). Спектр
рофенокси)ацетат (11). Выход 33%, Ткип = 215°С
ЯМР 1Н, δ, м. д. (J, Гц): 1.18 т (1H, C1Ha, 2J = 7.5),
(3 мм рт. ст.). Спектр ЯМР 1Н (CDCl3, δ, м. д., J, Гц):
1.36 с (3H, C7H3), 1.39 с (3H, C6H3), 1.68 т (1H, C1Hb,
1.34 c (3H, C7H3), 1.42 c (3H, C6H3), 3.72 д (1H, C4H1,
2J = 2.8), 1.78-1.84 м (1H, C3H1), 2.95 дд (2Н, С11Н2,
2J = 5.7, 3J = 7.2, 3J = 5.9), 4.19 дд (2H, C5H2, 2J = 7.2,
2J = 7.3), 3.45 с (2Н, С10Н2), 3.62 м (1H, C4H1), 3.71
3J = 5.7), 4.25 д (2H, C8H2, 2J = 5.9, 3J = 5.7), 4.75 с
д (2H, C12H2, 2J = 7.3), 4.01 дд (2H, C8H2, 2J = 6.9,
(2H, C10H2), 6.75-7.45 (3H, Ph-). Спектр ЯМР 13С
3J = 5.6), 4.15 дд (2H, C5H2, 2J = 4.9, 3J = 5.6), 7.13-
(CDCl3, δ, м. д.): 25.25 (C7), 26.62 (C6), 63.13 (C8),
7.65 (5Н, Ph-). Спектр ЯМР 13C, δС, м. д.: 24.63 (C3),
66.02 (C5), 66.26 (C10), 73.22 (C4), 109.99 (C2), 114.70-
25.31 (C7), 26.01 (C6), 26.58 (C2), 56.74 (C12), 60.29
130.36 (Ph-), 152.25 (CPh), 167.88 (C9). Масс-спектр,
(C), 61.31 (C10), 64.18 (C5), 64.26 (C8), 66.10 (C11),
m/e (Iотн, %): M+ нет, 334/336/338 (10/6/2), 319/321/323
73.71 (C4), 107.94 (C2), 127.11-130.37 (Ph-), 140.21
(100/72/8), 175/177/179 (66/38/8), 145/147/149 (14/9/2),
(CPh), 170.46 (C).
133/135/137 (8/14/2), 109/111/113 (8/14/2), 101 (44), 73
Метил-N-бензил-N-[(2,2-дихлороциклопропил)
(28), 57 (14), 43 (96).
метил]глицинат (9). Выход 88%, Ткип = 182°С
Общая методика получения соединений 1-[(2,2-ди-
(2 мм рт. ст.). Спектр ЯМР 1Н, δ, м. д. (J, Гц): 1.16 т
хлороциклопропил)метил]-4-(феноксиацетил)пипе-
(1H, C1Ha, 2J = 7.5), 1.66 т (1H, C1Hb, 2J = 2.8), 1.79-
разина (12), N-[(2,2-дихлороциклопропил)-метил]-
1.85 м (1H, C3H1), 2.95 дд (2Н, С4Н2, 2J = 7.3), 3.45 с
N-(1,3-диоксолан-4-илметил)-2-феноксиацетамида
(2Н, С6Н2), 3.65 с (3Н, С8Н3), 3.91 дд (2Н, С5Н2,
(13) и N-[(2,2-дихлороциклопропил)метил]-2-фен-
2J = 13.5), 7.15-7.65 (5Н, Ph-). Спектр ЯМР 13C, δС,
окси-N-(тетрагидрофуран-2-илметил)ацетамида
м. д.: 25.22 (C3), 29.23 (C1), 51.23 (C8), 53.46 (C4),
(14). В смесь соответствующего амина 0.02 моль
57.96 (C6), 60.75 (C5), 127.20-129.27 (Ph-), 138.52
(4.18 г) 1-[(2,2-дихлороциклопропил)метил]пипера-
(C2), 171.51 (C7). Масс-спектр, m/e (Iотн, %): [M]+ нет,
зина, 0.02 моль (5.21 г ) [(2,2-дихлороциклопропил)
242/244/246 (28/20/3), 91 (100), 65 (10).
метил](1,3-диоксолан-4-илметил)амина или 0.02 моль
Общая методика получения сложных эфиров
(5.08 г) [(2,2-дихлороциклопропил)метил](тетраги-
(2,2-диметил-1,3-диоксолан-4-ил)метил фенокси-
дрофуран-2-илметил)амина и 0.02 моль (1.58 г) све-
ацетата (10) и 2,2-диметил-1,3-диоксолан-4-ил)ме-
жеперегнанного пиридина при охлаждении до 0°С и
тил(2,4-дихлорофенокси)ацетата (11). Смесь 0.03
при перемешивании прибавляли 0.02 моль (3.41 г)
моль (3.96 г) 2,2-диметил-4-оксиметил-1,3-диоксола-
хлорангидрида феноксиуксусной кислоты. Смесь
на, 0.03 моль (5.1 г) хлорангидрида феноксиуксусной
нагревали до 35°С при постоянном перемешивании
или 0.03 моль (7.17 г) 2,4-дихлорфеноксиуксусной кис-
в течение 1 ч и оставляли на ночь. Далее промывали
лоты и 0.03 моль (2.37 г) свежеперегнанного пиридина
ледяной водой до нейтральной реакции. Выпавшие
перемешивали в течение 9 ч. Выделившееся масло-
хлопья отфильтровывали на воронке Бюхнера,
образное вещество при охлаждении и перемешивании
промывали водой, отделяли, сушили на воздухе.
стеклянной палочкой оставляли закристаллизовы-
1-[(2,2-Дихлороциклопропил)метил]-4-(фенокси-
ваться на 1 сут. Затем в реакционную массу выливали
ацетил)пиперазин (12). Выход 31%, Тпл = 142-144°С.
смесь из 15 г льда и 30 мл 1 М HCl и перемешивали
Спектр ЯМР 1Н (CDCl3, δ, м. д., J, Гц): 1.12 т (2Н,
до тех пор, пока не образуется суспензия. Сырой
С1Н2, 2J = 6.8, 3J = 4.8), 1.76 д (1H, C3H1, 2J = 4.8,
продукт отфильтровывали, промывали ледяной водой,
3J = 6.7, 3J = 4.9), 2.57 дд (4H, C5H2, C5′H2, 2J = 6.8,
сушили над MgSO4 и остаток перегоняли в вакууме.
3J = 5.4), 2.66 дд (C4H2, 2J = 4.9, 3J = 4.8), 3.66 дд
708
Яковенко Е. А. и др.
(4H, C6H2, C6′H2, 2J = 5.4, 3J = 6.8), 4.59 c (2H, C8H2,
Выход 53%, Тпл = 133-135°С. Спектр ЯМР 1Н, δ, м. д.
2J = 27.3), 6.85-7.35 (5H, Ph-). Спектр ЯМР 13С (CDCl3,
(J, Гц): 1.25 д (2H, C3′H2, 2J = 7.0, 3J = 5.7), 1.65 д (1H,
δ, м. д.): 25.12 (C1), 28.04 (C3), 41.89 (C5), 45.17 (С5′),
C1′H1, 2J = 7.5, 3J = 6.0), 1.95 д (2H, C4H2, 2J = 5.7,
52.31 (C4), 57.61 (C6 + C6′), 60.61 (C1), 67.60 (C8),
3J = 6.0), 2.05 д (1H, C3H1, 2J = 6.0, 3J =5.7), 3.55 д (2H,
114.54-129.60 (Ph), 157.71 (CPh), 166.38 (C7). Масс-
C2′H2, 2J = 7.3), 3.60 д (2H, C6H2, 2J = 7.3), 3.75 д (2H,
спектр, m/e (Iотн, %): [М]+ 355 (1), 342/344/346 (2/1/0.5),
C5′H2, 2J = 6.7, 3J = 5.7), 4.10 д (1H, C4′H1, 2J = 4.5,
307/309/311 (18/6.5/0.5), 233/235/237 (26/1/0.5),
3J = 7.0), 4.85 c (2H, C8H2, 2J = 6.5), 6.85-7.35 (5H, Ph-).
205/207/209 (4.5/50/10), 178/180/182 (100/36/5),
Спектр ЯМР 13C, δС, м. д.: 25.34 (C1), 25.70 (C3′),
123/125/127 (14/10/6.5), 107/109/111 (24/1.5/8), 85/87/89
29.35 (C3), 29.92 (C4), 47.38 (C6), 51.13 (C2), 60.52
(4/26/10), 77 (52), 54/56/58 (8/46/4), 42/44 (30/36).
(C8), 67.72 (C2′), 76.80 (C4′), 114.58-129.62 (Ph-),
N-[(2,2-Дихлороциклопропил)метил]-N-(1,3-диок-
157.99 (CPh), 168.85 (C7). Масс-спектр, m/e (Iотн, %):
солан-4-илметил)-2-феноксиацетамид (13). Выход
[M]+ 358 (0.3), 322/324 (1/0.4), 274/276/278 (25/20/5),
53%, Тпл = 138-140°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц):
152/154/156 (5/3/0.8), 123/125/127 (9/6/1), 107 (76), 84
1.65 т (2H, C1H2, 2J = 7.5, 3J = 6.0), 1.95 д (1H, C3H2,
(55), 71 (100), 43 (27).
2J = 5.7, 3J = 6.0), 3.11 д (2H, C6H2, 2J = 5.7), 3.25 д
(2H, C4H2, 2J = 7), 3.75 д (2H, C5′H2, 2J = 7.3), 4.10 д
Обсуждение результатов
(1H, C4′H1, 2J = 4.5, 3J = 7.0), 4.35 д (2H, C2′H2), 4.59 c
(2H, C8H2, 2J = 27.3), 6.85-7.35 (5H, Ph-). Спектр ЯМР
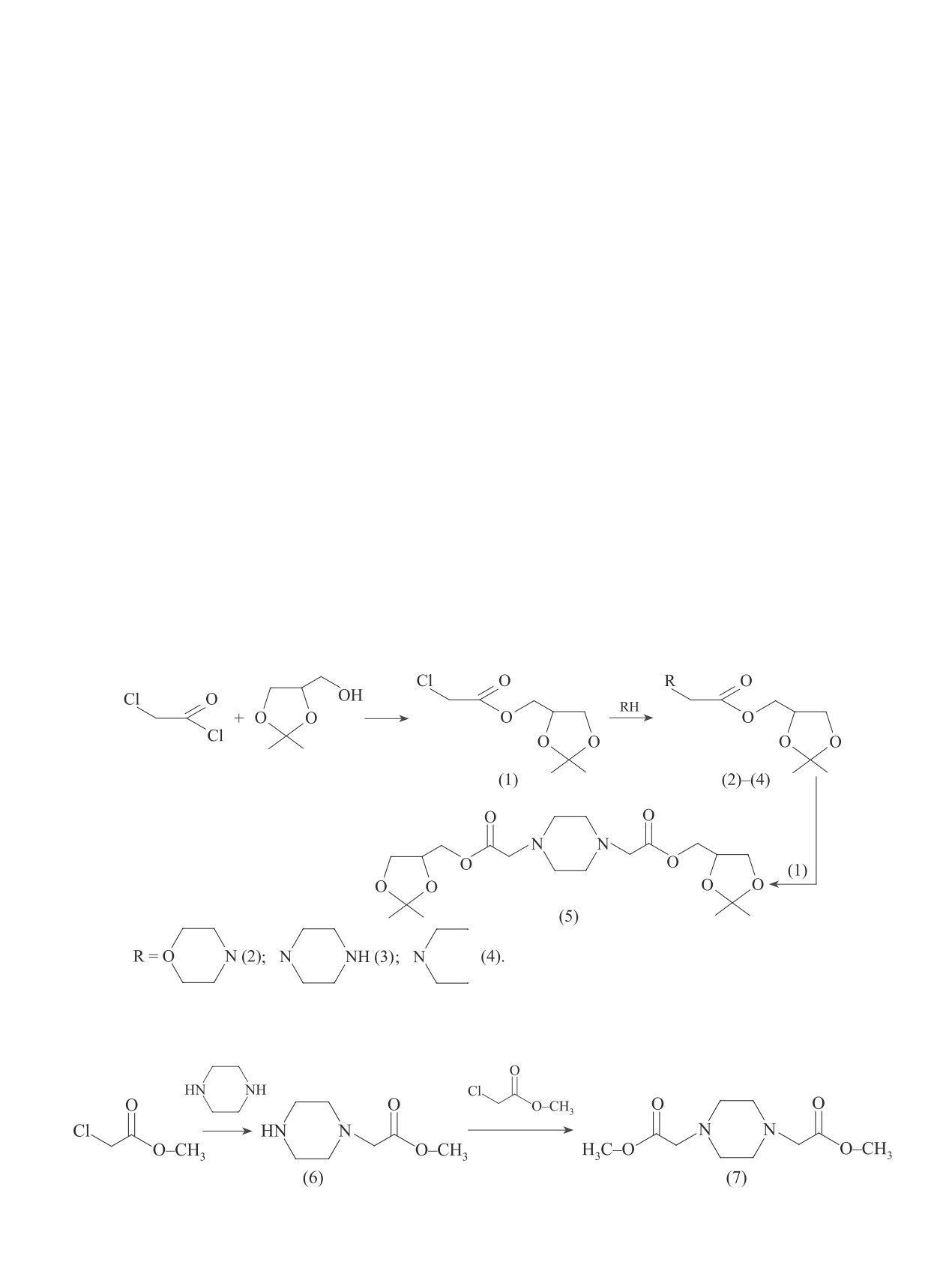
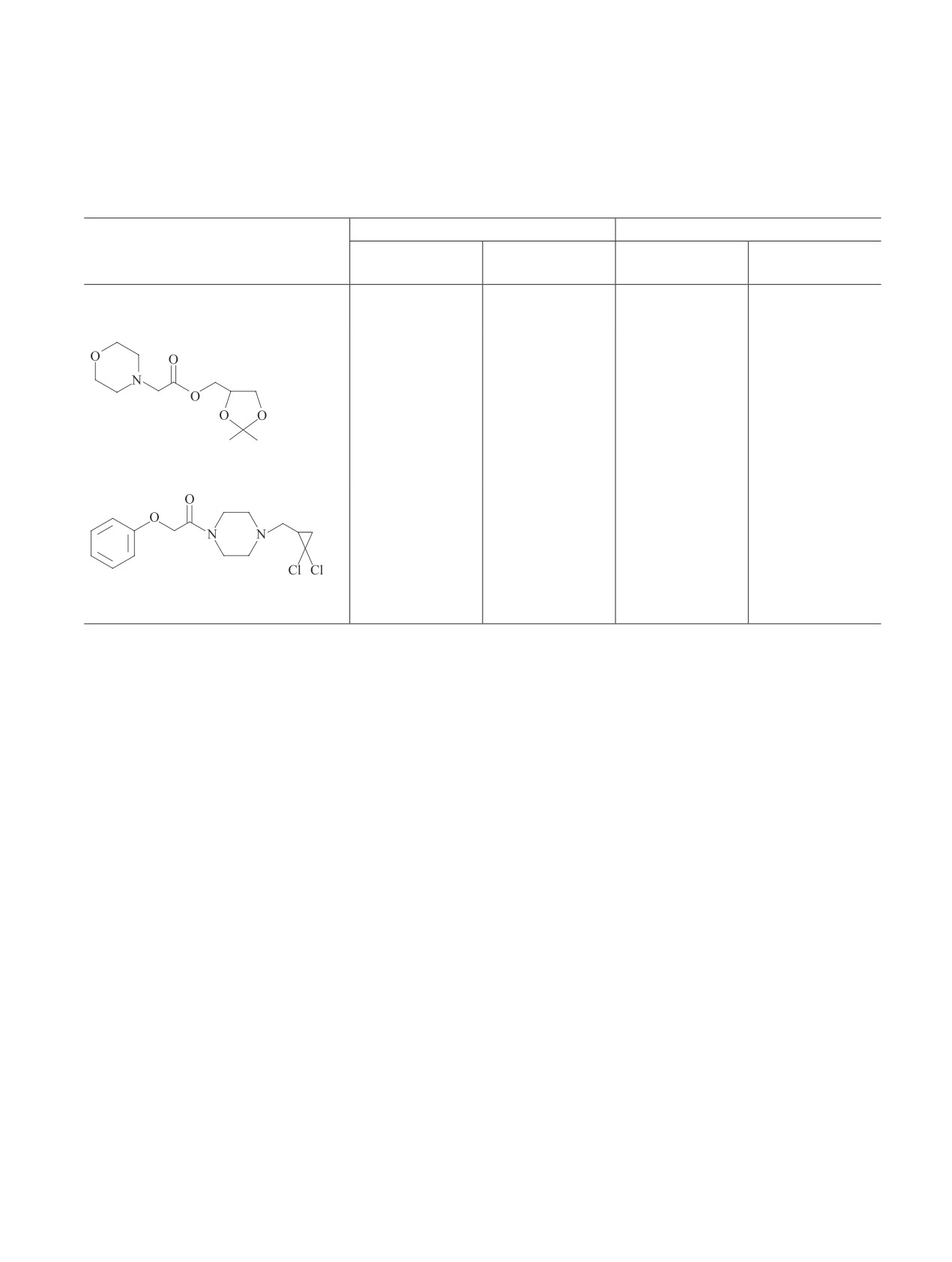
Реакцией хлорангидрида монохлоруксусной кис-
13C, δС, м. д.: 25.34 (C1), 25.70 (C3), 29.35 (C4), 29.92
лоты и спирта — (2,2-диметил-1,3-диоксолан-4-ил)-
(C6), 47.38 (C2), 51.13 (C8), 60.52 (C5′), 77.72 (C4′),
метанола (изопропилиденовое производное глицери-
94.80 (C2′), 114.58-129.62 (Ph-), 157.99 (CPh), 168.85
на) с количественным выходом был получен эфир (1)
(C7). Масс-спектр, m/e (Iотн, %): [M]+ нет, 274/276/278
[4]. Его реакции со вторичными аминами привели к
(25/20/5), 152/154/156 (5/3/0.8), 123/125/127 (9/6/1),
соответствующим эфирам аминокислот (2)-(4). На
107 (76), 84 (55), 73 (100), 43 (27).
глубоких стадиях алкилирования пиперазина при
N-[(2,2-Дихлороциклопропил)метил]-2-фенок-
3-5-кратном избытке эфира (1) наряду с монозаме-
си-N-(тетрагидрофуран-2-илметил)ацетамид (14). щенным соединением (3) был получен димер (5):
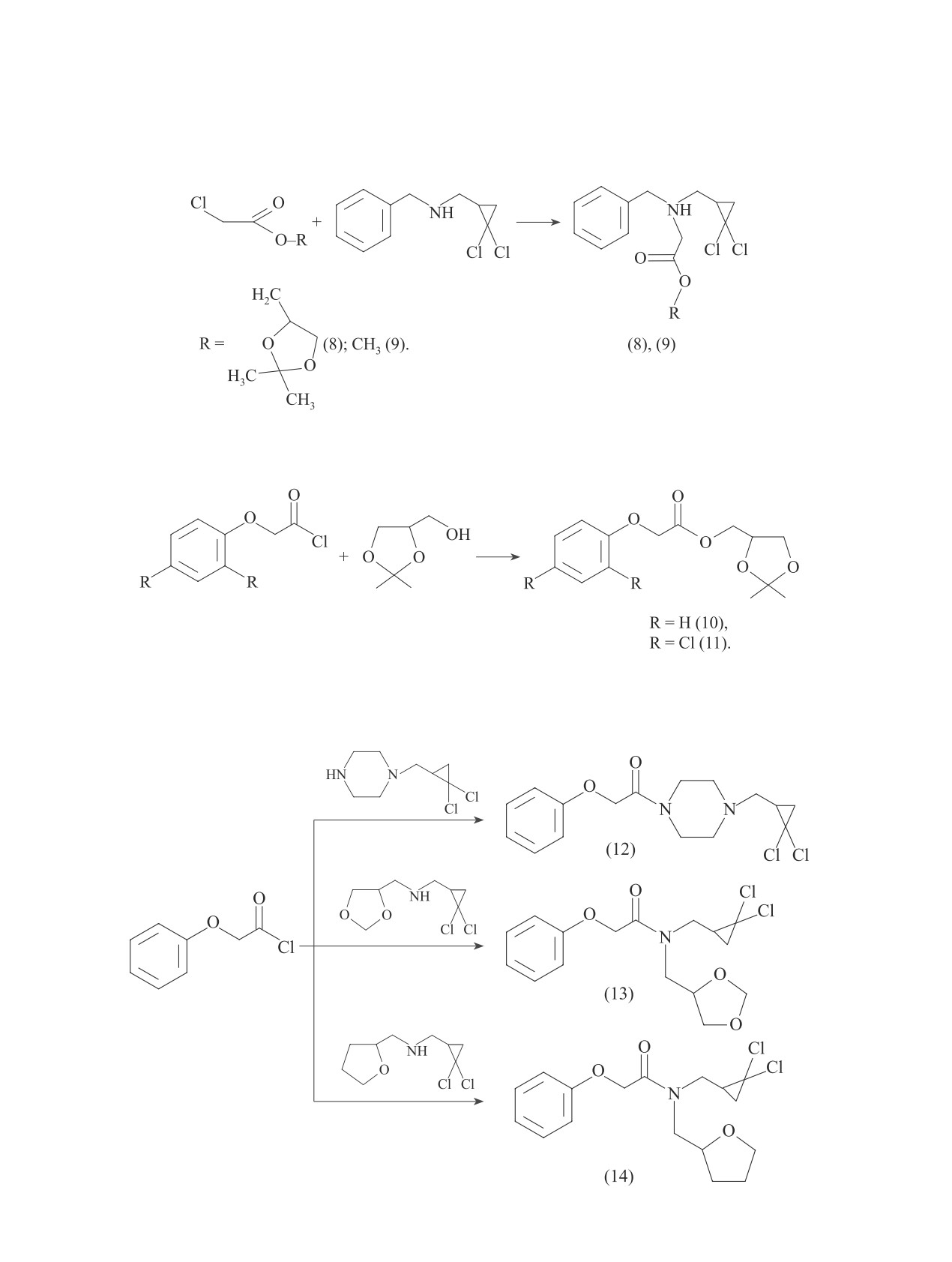
Для сравнения гербицидной активности алкило-
ствующие производные пиперазина (6) и (7) (выход
вых и циклоацетальных эфиров синтезировали на
продуктов 47 и 57% соответственно), которые явля-
основе промышленного метилхлорацетата соответ-
ются аналогами соединений (3) и (5):
Синтез, гербицидная и антиокислительная активность ряда...
709
Реакцией эфиров хлоруксусной кислоты с ранее описанным вторичным амином [5] были получены с вы-
ходом более 90% эфиры аминокислот (8), (9):
Исходя из хлорангидридов промышленных арилуксусных кислот с выходом 75-85% были синтезированы
гетероциклические эфиры (10), (11):
Взаимодействие хлорангидрида феноксиуксусной
менты, привело к соответствующим амидам (12)-(14)
кислоты с вторичными аминами, содержащими гете-
с выходом 30-60%:
роциклические и гем-дихлорциклопропановые фраг-
710
Яковенко Е. А. и др.
Согласно результатам тестирования производных
лоты (рег. номер 068(116)-03-605)]. Доза препарата
монохлоруксусной кислоты, биологическую актив-
(100 мг·л-1) повышает эффективность ингибирования
ность проявили вещества (2), (11), (12) и (14). На
длины и массы проростков пшеницы. Соединение
этом основании данные соединения были выбраны
(11) максимально ингибирует развитие двудольных
для подробного экспериментального изучения. Была
растений (пшеницы), лучшее ингибирующее дей-
определена гербицидная и ростстимулирующая ак-
ствие на однодольные культуры (горох) оказало про-
тивность соединений (2), (11), (12) и (14) на пророст-
изводное пиперазина, содержащее гем-дихлорцикло-
ках пшеницы и гороха по ранее описанной методике
пропановый фрагмент (12). Соединения (2) и (14)
[6, 7].
умеренно активны по отношению как к пшенице, так
Эффективность действия синтезированных сое-
и к гороху.
динений (табл. 1) определяли через 3 сут экспозиции
Результаты (ингибирование массы побега), близ-
по отношению к эталону [Октапон экстра (С8) —
кие к эталону, получены при действии производного
октиловый эфир 2,4-дихлорфеноксиуксусной кис-
морфолина (2), содержащего диоксолановый фраг-
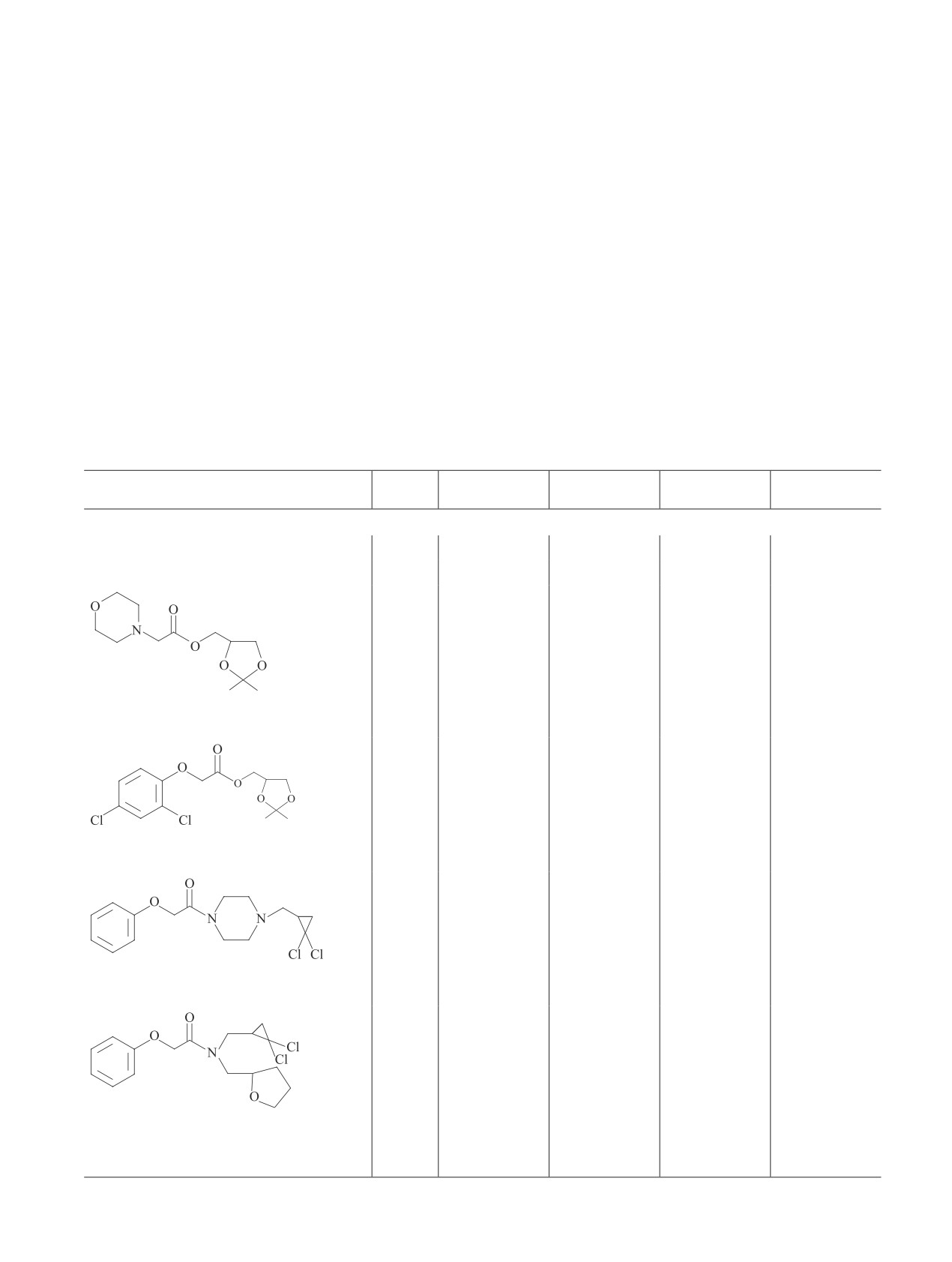
Таблица 1
Гербицидная активность препаратов (Т = 24-25°С)
Доза,
Средняя длина
Ингибирование
Средняя масса
Ингибирование
Препарат
мг·л-1
проростка, мм
длины, %
проростка, г
массы, %
Пшеница
Контроль
—
69.7
—
14.1
—
Эталон
50
12.8
81.6
9.6
31.9
50
71.5
+2.6
13.5
4.0
(2,2-диметил-1,3-диоксолан-4-ил)метил-
100
54.8
21.4
11.4
4.3
морфолин-4-илацетат (2)
50
11.5
83.5
9.9
29.8
2,2-диметил-1,3-диоксолан-4-ил)метил-
100
10.0
85.6
8.7
38.3
(2,4-дихлорофенокси)ацетат (11)
50
73.7
31.8
13.2
25.4
1-[(2,2-дихлороциклопропил)метил]-4-
100
36.8
65.9
10.9
38.4
(феноксиацетил)пиперазин (12)
50
65.9
39.0
13.3
24.9
N-[(2,2-дихлороциклопропил)метил]-2-
100
51.3
52.5
10.7
39.5
фенокси-N-(тетрагидрофуран-2-илме-
тил)ацетамид (14)
Синтез, гербицидная и антиокислительная активность ряда...
711
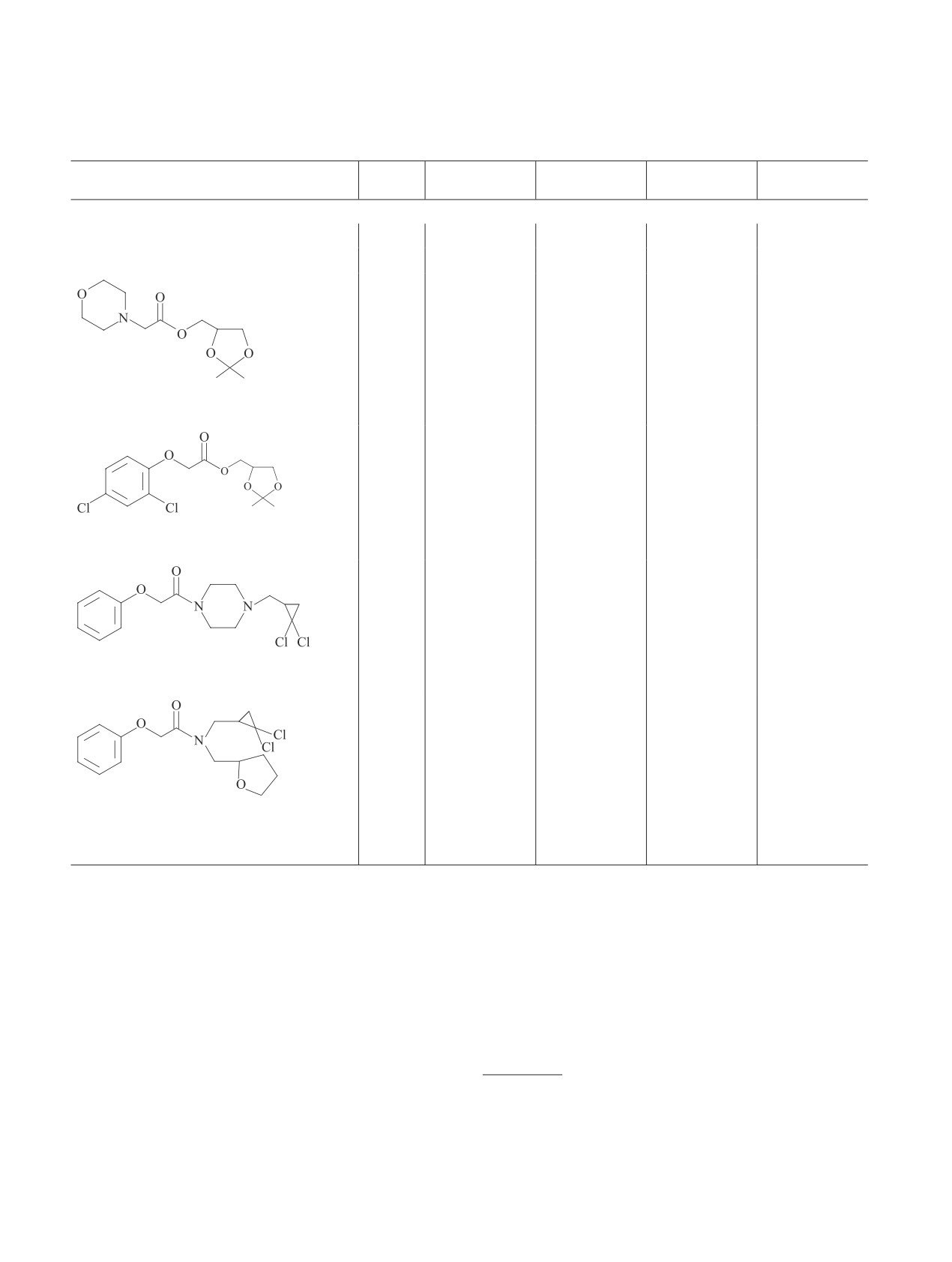
Таблица 1 (продолжение)
Доза,
Средняя длина
Ингибирование
Средняя масса
Ингибирование
Препарат
мг·л-1
проростка, мм
длины, %
проростка, г
массы, %
Горох
Контроль
—
18.4
—
72.1
—
Эталон
5
13.0
29.3
60.0
16.8
5
18.4
0
63.5
11.9
(2,2-диметил-1,3-диоксолан-4-ил)метил-
морфолин-4-илацетат (2)
5
7.0
62.0
65.6
9.0
2,2-диметил-1,3-диоксолан-4-ил)метил-
(2,4-дихлорофенокси)ацетат (11)
5
36.7
34.3
6.9
72.2
1-[(2,2-дихлороциклопропил)метил]-4-
(феноксиацетил)пиперазин (12)
5
45.9
17.9
28.8
16.1
N-[(2,2-дихлороциклопропил)метил]-2-
фенокси-N-(тетрагидрофуран-2-илме-
тил)ацетамид (14)
мент, на горох. Наличие гем-дихлорциклопропильно-
несценции по методике [10, 11]. В контрольных изме-
го фрагмента в амидах феноксиуксусной кислоты (12)
рениях антиоксидант отсутствовал. Для сравнения в
и (14) оказывает незначительное влияние на длину
качестве эталона использовали ингибитор свободно-
побега как двудольных, так и однодольных растений.
радикального окисления в биологических системах
Лучшие результаты показали соединения (2) и
5-гидрокси-6-метилурацил [12, 13]. Основными ха-
(12), они могут представлять интерес в плане созда-
рактеристиками хемилюминесценции служили све-
ния новых полифункциональных химических средств
тосумма свечения (S) и интенсивность максимальной
защиты растений [8, 9]. Мы оценили действие этих
вспышки (Imax).* Реагенты (2) и (12) обладают незна-
соединений на процессы свободнорадикального окис-
ления in vitro на модельных системах, генерирующих
* Фархутдинов Р. Р. Методики исследования хеми-
люминесценции биологического материала на хемилю-
активные формы кислорода, и системах, модулиру-
минометре ХЛ-003. Методы оценки антиоксидантной
ющих реакции пероксидного окисления липидов.
активности биологически активных веществ лечебного
Антиокислительную активность изучали в растворе
и профилактического назначения: Сб. докл. / Под ред.
диметилсульфоксида методом измерения хемилюми-
Е. Б. Бурлаковой. М.: Изд-во РУДН, 2005. С. 147-154.
712
Яковенко Е. А. и др.
Таблица 2
Изменение светосуммы и максимальной интенсивности хемилюминесценции модельной системы,
генерирующей активные формы кислорода и имитирующей пероксидные окисления липидов в присутствии
соединений (2) и (12)
Модель активных форм кислорода
Модель пероксидного окисления липидов
Соединение
Imax (максимальная
Imax (максимальная
S (светосумма), %
S (светосумма), %
светимость), %
светимость), %
Контроль (без антиоксиданта)
100
100
100
100
Эталон (5-гидрокси-6-метилурацил)
5
7
44
49
45
65
113
132
(2,2-диметил-1,3-диоксолан-4-ил)ме-
тилморфолин-4-илацетат (2)
53
66
109
116
1-[(2,2-дихлороциклопропил)метил]-
4-(феноксиацетил)пиперазин (12)
чительным антиоксидантным действием (табл. 2) в
УФИЦ РАН, за оказанное содействие в идентифика-
модельной системе активных форм кислорода, тогда
ции структуры соединений.
как в модельной системе пероксидного окисления
липидов они проявляют прооксидантное действие.
Финансирование работы
В литературе отмечается важность поиска ве-
ществ, обладающих не только антиоксидантными
Исследования выполнены при поддержке РФФИ
свойствами [14, 15], но и прооксидантными [16].
конкурса мол_эв_а (Эврика! Идея), по договору
Разнонаправленное воздействие синтезированных
№ 19-33-80002\19 от 07.12.2018.
соединений (2) и (12) определяет перспективность
поиска на основе изученных карбо- и гетероциклов
Конфликт интересов
новых биоактивных реагентов.
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
Выводы
По результатам биологических испытаний среди
Информация об авторах
синтезированных соединений выявлены вещества,
обладающие гербицидной и противомикробной ак-
Яковенко Евгения Андреевна, инженер-лаборант
тивностью, антиоксидантными свойствами, что дает
кафедры «Общая, аналитическая и прикладная хи-
основание рекомендовать полученные вещества для
мия» ФГБОУ ВО «Уфимский государственный не-
дальнейшего изучения областей их эффективного
фтяной технический университет»,
использования.
Баймурзина (Борцова) Юлия Львовна, к.б.н., заве-
дующая центральной научной исследовательской ла-
Благодарности
бораторией ФГБОУ ВО «Башкирский государствен-
Авторы выражают огромную благодарность
ный медицинский университет»,
Синтез, гербицидная и антиокислительная активность ряда...
713
Раскильдина Гульнара Зинуровна, к.х.н., доцент ка-
[7] Казакова А. Н., Кузнецов В. М., Мусавирова Л. Р.,
федры «Общая, аналитическая и прикладная химия»
Михайлова Н. Н., Богомазова А. А., Мудрик Т. П.,
ФГБОУ ВО «Уфимский государственный нефтяной
Злотский С. С. Гербицидная активность замещен-
ных гем-дихлорциклопропанов // Баш. хим. журн.
технический университет»,
2013. Т. 20. № 1. C. 8-10.
[8] Ганиев М. М., Недорезков В. Д. Химические сред-
Злотский Семен Соломонович, д.х.н., заведую-
ства защиты растений. М.: КолосС, 2006. С. 21-27.
щий кафедрой «Общая, аналитическая и прикладная
[9] Гривенникова В. Г., Виноградов А. Д. Генерация ак-
химия» ФГБОУ ВО «Уфимский государственный
тивных форм кислорода митохондриями // Успехи
нефтяной технический университет»,
биол. химии. 2013. Т. 53. С. 245-296.
[10] Кольтовер В. К. Антиоксидантная биомедицина:
от химии свободных радикалов к системно-био-
логическим механизмам // Изв. АН. Сер. хим.
Список литературы
2010. № 1. С. 37-43 [Koltover V. K. Antioxidant
[1] Ганиуллина Э. Р., Вороненко Б. И., Кузнецов В. М.,
biomedicine: From the chemistry of free radicals to
Мазитов Р. М., Злотский С. С., Дехтярь Т. Ф.
system-biological mechanisms // Bull. Russ. Acad.
Гербицидная и биологическая активность гем-
Sci. Div. Chem. Sci. 2010. N 1. P. 37-42].
дихлорциклопропанов на основе арилаллиловых
[11] Бурлакова Е. Б., Храпова Н. Г. Перекисное окисле-
эфиров // Баш. хим. журн. 2008. Т. 15. № 3. С. 53-56.
ние липидов мембран и природные антиоксидан-
[2] Раскильдина Г. З., Борисова Ю. Г., Валиев В. Ф.,
ты // Успехи химии. 1985. Т. 54. С. 1540-1558.
Михайлова Н. Н., Злотский С. С., Заиков Г. Е.,
[12] Петрова И. В., Катаев В. А., Мещерякова С. А.,
Емелина О. Ю. Замещенные простые эфиры и аце-
Николаева К. В., Мунасипова Д. А., Фархутди-
тали, обладающие биологической активностью //
нов Р. Р. Влияние вновь синтезированных произ-
Вестн. Казан. техн. ун-та. 2014. Т. 17. № 15. С. 166-
водных урацила на образование активных форм
169.
кислорода // Мед. вестн. Башк. 2013. Т. 8. № 4.
[3] Кузнецов В. М., Богомазова А. А., Шириаздано-
С. 64-67.
ва А. Р., Михайлова Н. Н., Злотский С. С. Герби-
[13] Петрова И. В., Катаев В. А., Мещерякова С. А.,
цидная активность некоторых кислородсодержащих
Николаева К. В., Мунасипова Д. А., Фархутди-
соединений // Баш. хим. журн. 2010. Т. 17. № 3.
нов Р. Р. Биологические свойства новых производ-
С. 33-35.
ных урацила // Мед. вестн. Башк. 2013. Т. 8. № 6.
[4] Яковенко Е. А., Байбуртли А. В., Раскильдина Г. З.
С. 163-165.
О-ацилирование диоксановых спиртов хлорангидри-
[14] Лалетин В. С., Колесниченко Л. С. Липоевая кис-
дами // Баш. хим. журн. 2017. Т. 24. № 2. С. 52-56.
лота как потенциальный прооксидант // Сиб. мед.
[5] Яковенко Е. А., Булатова Ю. И., Миракян С. М.,
журн. 2010. № 1. С. 72-74.
Валиев В. Ф., Борисова Ю. Г., Михайлова Н. Н.,
[15] Варданян Р. Л., Варданян Л. Р., Айрапетян С. А.,
Раскильдина Г. З. Производные спиртов и аминов,
Арутюнян Л. Р., Арутюнян Р. С. Антиоксидантное
содержащих циклопропановый и циклоацеталь-
и прооксидантное действие аскорбиновой кисло-
ный фрагмент // Баш. хим. журн. 2016. Т. 23. № 4.
ты // Химия раст. сырья. 2015. № 1. С. 113-119.
С. 94-98.
[6] Тимофеева С. А., Гиниятуллина Э. Х., Кузнецов В. М.,
[16] Узбеков М. Г. Перекисное окисление липидов и
Удалова Е. А., Шавшукова С. Ю., Злотский С. С.
антиоксидантные системы при психических забо-
Гербицидная активность ряда замещенных цикли-
леваниях. Сообщение I // Соц. и клин. псих. 2014.
ческих ацеталей // Баш. хим. журн. 2011. Т. 18. № 3.
T. 24. № 4. С. 97-103.
C. 71-73.