Журнал прикладной химии. 2020. Т. 93. Вып. 5
КАТАЛИЗ
УДК 65.018:547.133;547.518;543.422.27
КИНЕТИЧЕСКИЕ ЗАКОНОМЕРНОСТИ ЖИДКОФАЗНОГО
ОКИСЛЕНИЯ СТИРОЛА ПЕРОКСИДОМ ВОДОРОДА В ПРИСУТСТВИИ
ПОЛИОКСОВОЛЬФРАМАТА, МОДИФИЦИРОВАННОГО КАТИОНАМИ ЦЕРИЯ
© Х. М. Алимарданов, Ф. М. Велиева, Н. И. Гарибов, Э. С. Мусаева
Институт нефтехимических процессов им. Ю. Г. Мамедалиева НАН Азербайджана,
AZ102, г. Баку, Хатаинский район, Ходжалы пр., д. 30
E-mail:hafiz_alimardanov@yahoo.com
Поступила в Редакцию 11 июня 2019 г.
После доработки 20 ноября 2019 г.
Принята к публикации 14 декабря 2019 г.
Рассмотрены результаты жидкофазного окисления стирола пероксидом водорода в присутствии
каталитической системы, приготовленной на основе (NH4)10W12O41 + Ce(NO3)3 + H3PO4, нанесенной
на микроструктурированный углеродный материал и обработанной водным раствором Н2О2. Основ-
ными продуктами реакции являются фенилоксиран и бензальдегид. В оксидате содержатся также
фенилуксусный альдегид,1-фенилэтан-1,2-диол и бензойная кислота. Исследованы кинетические за-
кономерности и предложена кинетическая модель процесса, согласно которой первичным продуктом
реакции является фенилоксиран. Накопление альдегидов в системе протекает по параллельной схеме
путем окисления фенилоксирана или продукта его гидролиза 1-фенилэтан-1,2-диола. При повышении
молярного соотношения стирол:Н2О2 альдегиды преимущественно образуются окислением 1-фе-
нилэтан-1,2-диола.
Ключевые слова: окисление; стирол; пероксид водорода; фенилоксиран; бензальдегид; церийполиок-
совольфрамат; кинетическая модель
DOI: 10.31857/S004446182005014X
Окислительная функционализация непредель-
сидами с участием различных соединений молиб-
ных углеводородов пероксидом водорода является
дена и вольфрама [4, 5]. С целью эпоксидирования
одним из приоритетных направлений органическо-
или окисления стирола (Ст) и его производных в
го и нефтехимического синтеза [1, 2]. Продукты
присутствии различных гомогенных и гетерогенных
окисления (эпоксиды, спирты, кетоны, альдегиды,
каталитических систем применяются такие окислите-
эфиры) применяются для получения фармацевтиче-
ли, как пероксид водорода [6-8], NaClO [9] и NaYO4
ских, душистых, биологически активных соедине-
[10]. Высокую активность и избирательность при
ний, в производстве эпоксидных смол и пластифи-
окислении непредельных углеводородов проявляют
каторов.
полиоксокомплексы вольфрама или молибдена [11,
Эпоксидирование олефинов в промышленном мас-
12]. Образующиеся из этих комплексов пероксоволь-
штабе проводится либо молекулярным кислородом в
фраматы или пероксомолибдаты являются активными
присутствии катализатора, содержащего наночастицы
интермедиатами при введении кислородсодержащих
оксида серебра [3], либо органическими гидроперок-
фрагментов в состав исходного субстрата.
722
Кинетические закономерности жидкофазного окисления стирола пероксидом водорода...
723
Исследованию кинетических закономерностей
материал выделяли из смеси фильтрацией, осадок
окисления стирола и его производных в литературе
промывали CCl4, сушили в токе азота при 80-120°С и
посвящены лишь единичные работы с использовани-
подвергали термообработке при 200-250°С до полно-
ем в качестве окислителя молекулярного кислорода
го прекращения выделения НCl и сублимации AlCl3
или NaYO4 [10, 13]. Однако следует отметить, что
(рис. 1).
механизм окисления данного субстрата пероксидом
Перед использованием полученной каталитиче-
водорода существенно отличается от реакции, проте-
ской системы в реакции окисления стирола ее выдер-
кающей с участием кислорода.
живали в растворе 35%-ного Н2О2 при соотношении
Цель работы — изучение кинетических законо-
КС:Н2О2 = 1:200 (рис. 2). Согласно данным [11, 12],
мерностей реакции жидкофазного окисления стирола
такая каталитическая система состоит из различных
с участием пероксида водорода и полиоксоволь-
пероксокомплексов общей формулы [РkWmOn(O2)p]x.
фрамата, модифицированного катионами церия, и
Окисление стирола осуществляли в термоста-
разработка кинетической модели многомаршрутного
тированном стеклянном реакторе объемом 50 мл,
процесса.
снабженном термометром, магнитной мешалкой,
обратным холодильником, капельными воронками
и устройством для отбора проб при температуре
Экспериментальная часть
60-80°С. В реактор одновременно загружали стирол
Для жидкофазного окисления стирола исполь-
(0.1-0.15 моль), пероксид водорода (35%-ный водный
зована каталитическая система (КС), полученная
раствор, 0.1-0.3 моль), катализатор и толуол (10 мл).
смешиванием и кипячением в течение 2 ч водных
С целью предотвращения окислительной олигоме-
растворов (NH4)10W12O41, Ce(NO3)3 (Siqma-Aldrich,
ризации стирола в реакционную смесь добавляли
99.9%), 85%-ного раствора H3PO4 и микрострукту-
н-бутанольный раствор H3BO3 или α-нафтол (0.5% от
ированного углеродного материала, с последующим
смеси). После окончания реакции органический слой
выпариванием раствора, сушкой твердого остатка
отделяли, водный слой экстрагировали этилацетатом,
при 100-120°С и термообработкой при 180-200°С
эфирные экстракты объединяли с органическим сло-
[14]. В качестве носителя использован углеродный
ем. После отгонки растворителя оксидат подвергали
материал, полученный путем перемешивания при
анализу.
75-76°С избыточного количества CCl4 cо стружкой
Идентификацию продуктов окисления стиро-
металлического алюминия по уравнениям [15]
ла осуществляли методами газожидкостного хро-
матографического анализа, масс-спектрометрии и
2Al + 3CCl4 → 2AlCl3 + C2Cl6 + C,
ИК-спектроскопии.
Эффективное разделение продуктов окисления
2Al + C2Cl6 → 2AlCl3 + 2C.
стирола достигнуто на хроматографе Цвет-100 м с
Реакцию проводили до полного израсходования
детектором по теплопроводности, газ-носитель —
алюминия в течение 3-4 ч. Полученный углеродный
гелий, колонка 1 м × 2 мм с неподвижной фазой
Рис. 1. 3D-Изображение (а) и гистограмма поверхности (б) синтезированного углеродного материала, полученные
с помощью атомно-силовой микроскопии.
724
Алимарданов Х. М. и др.
Рис. 2. Изображения поверхности образцов Се-пероксовольфрамата, обработанного фосфорной кислотой (а)
и пероксидом водорода (б), полученные методом электронной микроскопии.
апиезон-L, нанесенной на Chromaton N-AW-HMDS
589, 561 см-1 относятся к валентным колебаниям
O
(15 мас%). ИК-спектры оксидата и катализатора ре-
пероксидной связи W
. ИК-спектры гетерогени-
гистрировали на ИК-Фурье-спектрометре Alpha в
O
области 400-4000 см-1 или Vertex (Bruker) в области
зированных образцов содержат все вышеуказанные
100-700 см-1. Отнесение соответствующих полос
полосы поглощения. Изменение (аморфизация) кри-
поглощения осуществлено в соответствии с литера-
сталлической структуры синтезированного образца
турными данными. Элементный анализ выполняли
при обработке Н2О2 определено также с помощью
на анализаторе TruSpes Micro Leco Corporration USA.
сканирующего электронного микроскопа (СЭМ)
Снимки образцов церий-полиоксовольфрамата и
(рис. 2) и рентгенофазного анализа.
церий-полиоксопероксовольфрамата получены на
Элементный состав катализатора (мас%): C —
сканирующем электронном микроскопе (СЭМ), при-
24.58, Ce — 3.55, P — 1.57, W — 56.0, О — 18.3; (ат%):
бор Oxford Instruments Nano analysis (OINA) 5-3400N.
C — 53.0, Ce — 0.77, P — 1.56, W — 9.4, О — 35.3.
Исследование рельефа поверхности микрострук-
туированного углеродного материала проводили на
Обсуждение результатов
сканирующем атомно-силовом микроскопе марки
NC-AMF.
Литературные данные последних лет, касающи-
Хроматомасс-спектры снимали на приборе GC
еся реакции окисления стирола пероксидом водоро-
7890A-MSD5975C фирмы Agilent Technologies, ко-
да, весьма противоречивы, что объясняется исполь-
лонка HP5-MS, температурный режим 40-280°С с
зованием различных каталитических систем [6-8,
программированным подъемом нагрева, газ-носи-
16-18]. C учетом этого нами предварительно были
тель — гелий.
проведены опыты без катализатора. В стеклянном
В ИК-спектрах синтезированных образцов ка-
реакторе 0.05 моль стирола, 6 г 35%-ного Н2О2 и
тализатора полосы поглощения при 406, 486, 566,
30 мл толуола перемешивали при 80°С в течение 3 ч.
587, 603, 620 и 775 см-1 характеризуют фрагмент
Конверсия стирола составляет 4.0%, т. е. в отсут-
-О-Се-О. Полосы поглощения при 980, 925, 880 и
ствие катализатора окисление стирола практически
871 см-1 относятся к валентным колебаниям фраг-
не происходит. При использовании каталитической
ментов WO4+ и W=O. В Фурье-ИК-спектрах поли-
системы пероксополивольфрамата конверсия стиро-
оксофосфорвольфраматного комплекса имеются
ла и состав оксидата в зависимости от температуры
полосы поглощения при 1015, 1030 и 1065 см-1, ха-
реакции и скорости перемешивания реакционной
рактеризующие валентные колебания PO43--группы.
смеси варьируются в широком диапазоне. Поскольку
При взаимодействии данных образцов катализатора
изменение скорости перемешивания реакционной
с 35%-ным водным раствором Н2О2 образуется смесь
смеси в пределах 700-900 об·мин-1 (рис. 3) не вли-
по меньшей мере двух пероксокомплексов золоти-
яет на конверсию стирола, кинетические исследова-
сто-желтого цвета. Полосы поглощения при 890, 680,
ния проводили при 700 об·мин-1. При этих условиях
Кинетические закономерности жидкофазного окисления стирола пероксидом водорода...
725
бензальдегиду. Однако наиболее высокая конверсия
стирола достигается в присутствии каталитической
системы, предварительно обработанной пероксидом
водорода (табл. 1).
При кинетических исследованиях реакции окисле-
ния стирола в присутствии гетерогенных катализато-
ров внутреннее диффузионное торможение определя-
ется путем изменения размера частиц катализатора.
По данным СЭМ размер частиц используемого нами
катализатора составляет 1-3 мкм, что не позволя-
ет установить влияние внутреннего диффузионного
торможения на скорость реакции. В работе [19] пред-
лагается судить о влиянии внутренней диффузии по
формуле
Рис. 3. Зависимость конверсии стирола от скорости
перемешивания реакционной смеси при 70°С (мольное
отношение Ст:H2O2 = 1, растворитель — толуол).
где r — скорость реакции (моль∙гкт·л-1∙мин-1), dp —
внешнее диффузионное торможение для этой реакции
размер частицы катализатора (см), сs — концентрация
отсутствует.
В зависимости от модификации полиоксоволь-
субстрата (моль·л-1), De —коэффициент диффузии
фрамата степень окисления стирола и состав про-
исходного соединения в растворителе (см2·мин-1).
дуктов реакции существенно различаются (табл. 1).
Согласно литературным данным при Φ < 1/[n] вли-
Так, в случае использования немодифицированного
янием диффузии на порядок реакции n можно пре-
полиоксовольфрамата в условиях, принятых за стан-
небречь.
дартные (температура 80°С, продолжительность опы-
С увеличением начальных концентраций стирола,
та 5 ч, мольное соотношение стирол:Н2О2 = 1:1.2),
пероксида водорода (табл. 2) и катализатора (рис. 4)
при постоянном значении концентрации остальных
конверсия стирола составляет 29.5%, основными
компонентов накопление продуктов окисления линей-
продуктами реакции являются фенилоксиран и 1-фе-
но возрастает. Скорость реакции окисления стирола
нилэтан-1,2-диол. При использовании ненанесенного
церий-полиоксовольфрамата конверсия стирола до-
(rСт) определена по формуле
стигает 42.7% и наблюдается рост содержания альде-
гидов в оксидате (табл. 1). Применение катализатора,
нанесенного на углеродный материал, способствует
повышению конверсии стирола до 45.0% и увели-
где rСт — скорость превращения стирола (моль·л-1·ч-1),
чению селективности реакции по фенилоксирану и
— начальная концентрация стирола (моль·л-1),
Таблица 1
Результаты каталитического окисления стирола пероксидом водорода в присутствии различных форм
полиоксовольфрамата (Т = 80°С, τ = 5 ч, стирол:Н2О2 = 1:1.2)
Состав оксидата, мас%
Конверсия
олиго-
Катализатор
фенил-
бенз-
фенил-
фенилэтан-
бензойная
стирола, %
стирол
мерные
оксиран
альдегид
ацетальдегид
диол
кислота
продукты
(NH4)10W12O41⋅nН2О (I)
29.5
67.3
17.7
2.6
3.0
9.4
—
—
(NH4)10W12O41 + H3PO4 (II)
32.6
4.4
14.5
6.2
4.0
8.2
1.7
1.0
(NH4)10W12O41 + Ce(NO3)3 +
42.7
4.5
14.4
8.8
6.0
9.3
4.1
2.9
+ H3PO4 (III)
Катализатор (III) + углерод-
45.0
1.9
18.4
8.7
6.9
10.4
2.0
1.7
ный материал (IV)
Катализатор (IV) + Н2О2 (V)
54.0
3.2
27.3
9.8
7.8
4.7
3.7
3.5
726
Алимарданов Х. М. и др.
Кинетические закономерности жидкофазного окисления стирола пероксидом водорода...
727
— концентрация стирола после опыта (моль·л-1),
Kс1 — конверсия стирола (усл. ед.), τ — длительность
опыта (ч).
В отсутствие катализатора скорость реакции не-
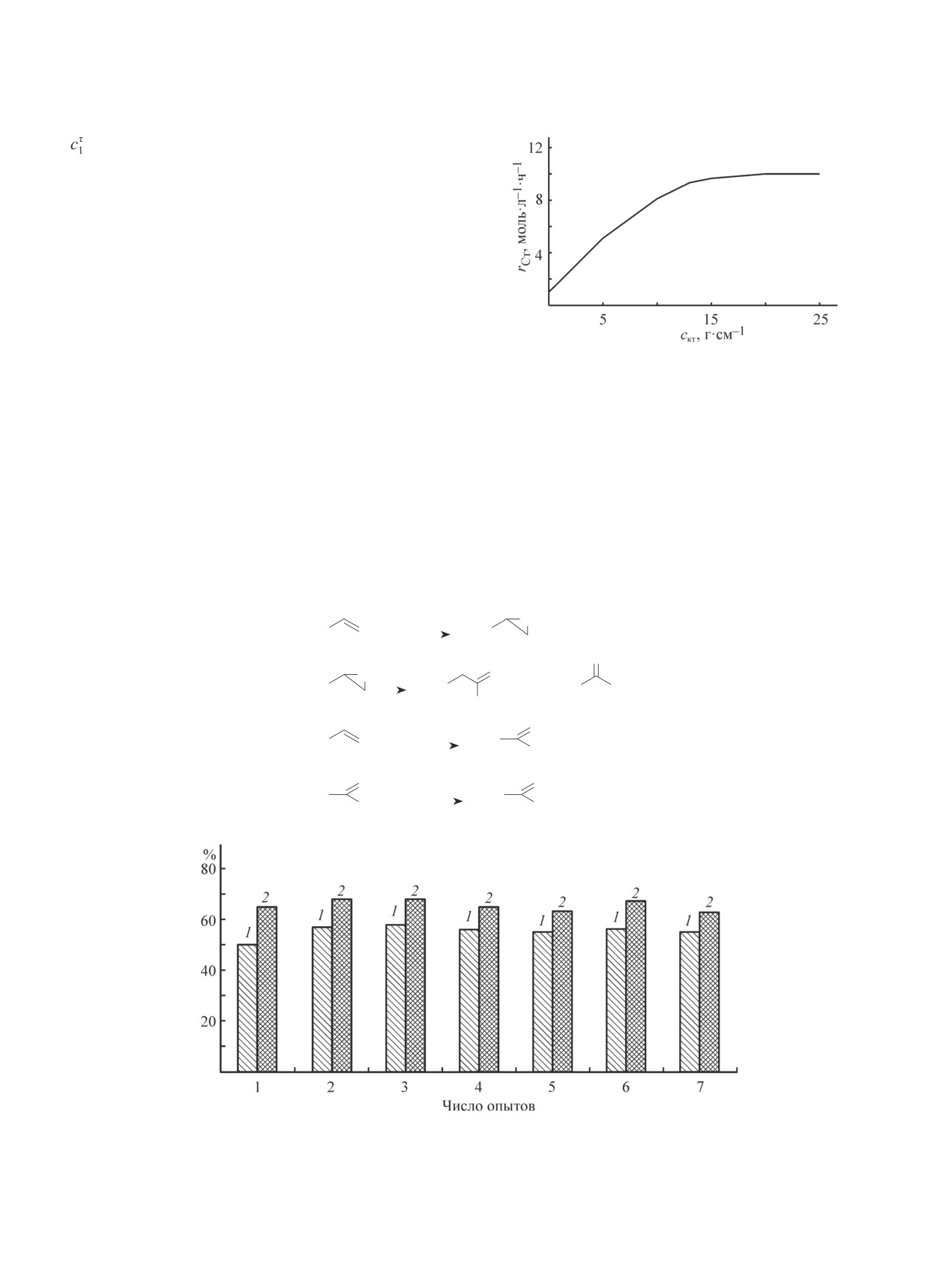
значительна. По мере увеличения концентрации ка-
тализатора от 0 до 11.0 г·л-1 порядок реакции по
катализатору приближается к единице (рис. 4). В ин-
тервале 11.0-12.5 г·л-1 этот показатель изменяется
от нуля до единицы, а выше 12.5 г·л-1 равен нулю.
Катализаторы, нанесенные на углеродный материал,
сохраняют свою активность в течение длительного
времени (рис. 5).
Рис. 4. Влияние концентрации катализатора на скорость
окисления стирола.
В исследуемой области изменения начальных кон-
центрации стирола и пероксида водорода скорость
расхода их в зависимости от изменения концентра-
c1 и c2 — концентрации стирола и пероксида водоро-
ции исходных компонентов изменяется линейно.
да (моль·л-1), КАТ — количество катализатора (г·л-1).
Следовательно, формальная скорость реакции опре-
На основании экспериментальных данных
деляется по формуле
(табл. 2) предложены два варианта схемы протекания
окислительного превращения стирола и накопления
WСт = k[c1][c2·КАТ],
продуктов реакции:
где WСт — формальная скорость превращения стирола
(моль·л-1·ч-1), k — константа скорости (л·моль-1·ч-1),
I вариант:
I
C6H5
+ H2O2 K1 C6H5
O + H2O,
O
O K
O
2
II
C6H5
C6H5
(или C6H5
),
H
O
3
III
C6H5
+ 2H2O2 K
C6H5
H + CH2O + 2H2O,
O
O
4
C6H5
IV C6H5 H + H2O2 K
OH + H2O,
Рис. 5. Изменение активности катализатора (V) в зависимости от кратности его использования (продолжительность
каждого опыта 5 ч).
1 — конверсия стирола, 2 — селективность по сумме продуктов окисления.
728
Алимарданов Х. М. и др.
O
5
V C6H5
O + H2O2 K
C6H5
OH
+ CH2O + H2O,
OH
VI C6H5
O +H2O K6 C6H5
,
OH
O
VII C6H5
+ H2O2 K7 C6H5
H + H2O,
VIII C6H5
+ H2O2 K8 продукты окислительной олигомеризации;
II вариант:
I
C6H5
+ H2O2 K1 C6H5
O + H2O,
OH
II
C6H5
O + H2O2 K2 C6H5
,
OH
O
3
III
C6H5
+ 2H2O2 K
C6H5
H + CH2O + 2H2O,
OH
O
K
4
IV C6H5
C6H5
H + H2O,
OH
O
O
O K
5
V C6H5
C6H5
H (C6H5
),
O
O
6
C6H5
VI C6H5 H +H2O2 K
H + H2O,
O
7
VII C6H5
O + H2O2 K
C6H5
H + CH2O + H2O,
VIII C6H5
+ H2O2 K8 продукты окислительной олигомеризации.
Окисление непредельных углеводородов перокси-
зованием пероксокомплексов вольфрама с различной
дом водорода протекает по многомаршрутной схеме
структурой, активность которых различается в дан-
через стадии образования соответствующего эпок-
ной реакции. Вероятность образования таких продук-
сида. Следовательно, можно предполагать, что ре-
тов окисления стирола, как бензальдегид, фенилаце-
акция протекает по последовательной схеме путем
дальнейшего превращения полученных эпоксидов.
C целью проверки этой версии были построены кон-
версионные кривые превращения стирола (рис. 6) в
координатах S→K (S — селективность по эпоксиду,
K — конверсия стирола). Фенилоксиран при K→0 не
является единственным продуктом окисления стиро-
ла (найдено путем экстраполяции кривых при различ-
ных температурах) (рис. 6).
Наряду с эпоксидом образуются также фенил-
ацетальдегид, бензальдегид и фенилэтан-1,2-диол.
Результаты проведенных исследований показывают,
что реакция протекает через параллельно-последо-
Рис. 6. Зависимость селективности реакции по фенилок-
вательную схему превращения стирола и продуктов
сирану от конверсии стирола при 50 (1), 70 (2), 75 (3),
окисления. Такая схема, вероятно, обусловлена обра-
80°С (4).
Кинетические закономерности жидкофазного окисления стирола пероксидом водорода...
729
тальдегид и фенилэтан-1,2-диол, только через стадии
V, VII. И в первом (маршруты III, VII), и во втором
превращения эпоксидного интермедиата можно счи-
варианте (маршрут III) указаны маршруты окисления
тать необоснованной. Накопление этих продуктов в
стирола в альдегиды в одну стадию.
реакционной смеси может быть осуществлено также
Согласно литературным данным [20, 21] при
непосредственно путем окисления самого стирола.
гидроксилировании бензола в фенол высокую ак-
Первая стадия обеих схем процесса относится не-
тивность проявляет ванадийзамещенная гетеропо-
посредственно к реакции эпоксидирования стирола.
лимолибденовая кислота [21, 22], а при окислении фе-
Однако если в первом варианте маршруты II, V и VI
нола в гидрохинон — гетерополисоединение состава
иллюстрируют стадии превращения образующего-
(NH4)8[La(PMo9V2O39)]·6H2O [22]. Предполагается,
ся оксирана в бензальдегид, фенилацетальдегид и
что при окислении углеводородов эти системы рабо-
фенилэтан-1,2-диол, то во втором — образование
тают аналогично реактиву Фентона (Fe2 + H2O2) [23,
вышеуказанных альдегидов из фенилэтан-1,2-диола
24]. С учетом этого было принято, что катионы Се3+
и фенилоксирана иллюстрируется маршрутами IV,
участвуют в образовании О2Н′ радикала по схеме
Ce3+ +H2O2
Ce4+ + OH- + ȮH,
Ce4+ + H2O2
Ce3+ + Ȯ2H + Ḣ+,
O
2+
[WO]4+ + O2H + ȮH
WO
+ H2O,
O
O
2+
C6H5-CH=CH2 +
C6H5-CH-CH2 +[WO]4+.
WO
O
O
С целью уточнения кинетических закономерно-
r7 = k7[с2][с6]
(7)
стей были проведены эксперименты с бинарными
r8 = k8[с1][с2]
(8)
смесями стирол + фенилоксиран, стирол + бензальде-
гид, стирол + фенилацетальдегид, стирол + бензойная
где k1-k8 — константы скорости реакции по маршру-
кислота в различных соотношениях. Установлено,
там I-VIII, r1-r8 — скорости накопления продуктов
что при степени окисления стирола не более 40-45%
реакции по соответствующим стехиометрическим
вышеуказанные продукты не оказывают тормозящего
уравнениям, c1-c6 — концентрации соединений
действия на скорость данной реакции. Исключение
(моль·л-1) (табл. 2).
составляет бензойная кислота, которая, войдя в ли-
Скорость превращения стирола и продуктов окис-
гандное окружение катализатора, церийсодержаще-
ления, полученных по маршрутам I-VIII, рассчитаны
го полиоксовольфрамата, снижает его активность.
с использованием следующих уравнений:
Однако учитывая, что бензойная кислота образуется
при более жестких условиях, влияние ее на механизм
ω1 = r1 - r3 - r8,
(9)
реакции жидкофазного окисления стирола не рассма-
ω2 = r1 - 2r3 - r6 - r7,
(10)
тривали.
ω3 = r1 - r2 - r5,
(11)
Наиболее близкая сходимость расчетных и опыт-
ω4 = r3 - r6 + r7,
(12)
ных данных (табл. 3) достигается при использовании
следующих кинетических уравнений, составленных
ω5 = r4 + r5,
(13)
с учетом независимых маршрутов, приведенных в
ω6 = r2 - r4 - r7,
(14)
варианте II:
ω7 = r6,
(15)
r1 = k1[с1][с2]
(1)
ω8 = r8,
(16)
r2 = k2[с3]
(2)
где ω1, ω2 — экспериментально определенные ско-
r3 = k3[с1][с2]2
(3)
рости расходования стирола и активного кислорода
r4 = k4[с6]
(4)
пероксида водорода, ω3-ω8 — скорости накопления
фенилоксирана, бензальдегида, фенилацетальдегида,
r5 = k5[с3]
(5)
фенилэтан-1,2-диола, бензойной кислоты и продукта
r6 = k6[с2][с4]
(6)
окислительной олигомеризации (табл. 3).
730
Алимарданов Х. М. и др.
Таблица 3
Наблюдаемая скорость накопления ключевых веществ в реакции окисления стирола пероксидом водорода
при различных температурах
ωi, моль·л-1⋅ч-1
ω5
ω6
ω7
ω8
-ω1
-ω2
ω3
ω4
фенилацеталь-
фенил-
бензойной
олигомерных
стирола
Н2О2
фенилоксирана
бензальдегида
дегида
этандиола
кислоты
продуктов
Температура 60°С
5.05
10.85
3.8
0.75
0.31
—
—
—
4.92
8.0
3.5
1.067
0.247
—
—
—
5.16
5.6
2.842
1.02
0.327
—
—
—
4.70
5.35
2.35
1.408
0.410
—
—
—
Температура 70°С
4.56
9.695
3.825
0.55
0.185
—
—
—
5.60
7.833
4.00
0.817
0.383
—
—
0.4
5.52
6.60
3.48
0.902
0.400
0.20
—
0.538
4.90
5.91
2.947
0.875
0.452
0.18
—
0.271
Температура 70°С
10.2
12.65
6.50
1.60
0.80
0.5
—
0.3
9.88
12.78
5.44
1.883
0.81
0.633
0.217
0.783
8.064
9.30
3.60
1.90
0.96
0.47
0.220
0.86
7.543
8.57
3.77
1.81
0.754
0.377
0.186
0.644
Температура 70°С
11.52
17.08
6.00
2.55
1.235
0.475
0.21
0.105
11.20
13.79
5.82
2.63
1.113
0.420
0.32
0.90
9.408
10.33
4.77
1.86
1.02
0.628
0.21
0.92
8.52
8.77
4.06
1.89
0.95
0.68
0.18
0.76
Температура70°С
12.24
14.325
7.25
3.21
1.29
0.49
—
—
12.68
13.87
6.91
3.09
1.20
0.34
0.33
0.8
10.848
11.85
6.16
2.84
1.16
0.31
0.26
0.112
9.017
9.446
5.17
2.34
0.91
0.26
0.19
0.143
Температура 75°С
13.02
14.92
7.55
2.205
1.05
0.75
0.5
0.665
12.72
14.95
6.40
2.62
1.43
0.70
0.6
0.963
11.28
12.146
5.12
2.48
1.49
0.64
0.62
0.926
9.34
9.76
4.78
1.94
1.18
0.51
0.31
0.61
Температура 80°С
15.9
17.94
8.225
2.41
1.42
1.05
1.10
1.695
17.24
18.86
7.157
3.60
2.16
1.53
1.42
1.367
12.96
13.46
6.082
2.57
1.66
0.92
0.83
0.90
11.78
12.11
5.323
2.75
1.47
0.80
0.69
0.742
Для расчета констант скоростей был использован
графически, используя метод начальных скоростей,
модифицированный метод Рунге-Кутта четвертого
и уточняли путем минимизации среднеквадратичных
порядка с использованием программы Matlab-6.5.
отклонений между наблюдаемыми и расчетными
Экспериментальные значения констант определяли
данными для уравнений (9)-(16).
Кинетические закономерности жидкофазного окисления стирола пероксидом водорода...
731
Таблица 4
Вычисленные значения констант скоростей для
Расчетные значения предэкспоненциальных
маршрутов I-VIII (табл. 4) соответствуют экспери-
множителей k0i и энергий активации Ei
констант
ментально найденным их значениям. Среднеквадра-
скоростей окислительного превращения стирола
тичное отклонение погрешности вычисления по
(по маршрутам I-VIII, вариант II)
основным маршрутам реакции (I-IV) составило 9.2-
Константа скорости
k0i
Ei, Дж·моль-1
11.4, а по побочным (V-VIII) — 14.6-18.0%. Другие
предполагаемые модели процесса окисления стирола
k1, л⋅моль-1⋅ч-1
1.02⋅109
74200
приводят к значительному увеличению погрешности
k2, ч-1
1.16⋅108
44724
вычисления.
k3, л⋅моль-1⋅ч-1
1.41⋅108
55788
С учетом полученных результатов процесс жид-
k4, ч-1
1.96⋅107
40802
кофазного окисления стирола может быть описан
k5, ч-1
3.32⋅106
25939
стадийной схемой (табл. 5). В качестве лимитиру-
ющей выбрана стадия, ответственная за взаимодей-
k6, л⋅моль-1⋅ч-1
6.76⋅106
42751
ствие стирола с образующимся каталитическим ком-
k7, л⋅моль-1⋅ч-1
3.32
16488
плексом. Остальные стадии принимаются быстрыми
k8, л⋅моль-1⋅ч-1
2.25
26988
или равновесными. Согласно правилу Хариути [25],
Таблица 5
Стадийная схема окисления стирола пероксидом водорода в присутствии CePO4 ∙PW12O41∙nH2O/углеродный
материал
Число стадий по стехиометрическим маршрутам
№
Маршрут*
стадии
I
II
III
IV
V
VI
VII
VIII
1
O
1
0
1
0
0
0
0
0
C6H5
+ ZOn+1
C6H5
·ZOn
2
O
O
1
0
1
0
0
0
0
0
C6H5
·ZOn
C6H5
ZOn
3
OH
0
1
1
0
1
0
1
0
O
C6H5
+ ZOn + H2O C6H5
·ZOn
OH
4
OH
OH
0
1
1
0
1
0
1
0
OH
OH
C6H5
·ZOn
C6H5
+ ZOn
5
OH
0
0
1
0
0
0
1
0
OH
C6H5
+ ZOn+1
C6H5-CHO·ZOn + CH2O + H2O
6
C6H5-CHO·ZOn C6H5-CHO + ZOn
0
0
1
0
0
0
1
0
7
OH
0
0
0
1
1
0
0
0
OH
O
C6H5
+ ZOn C6H5
·ZOn + H2O
H
8
O
O
0
0
0
1
1
0
0
0
C6H5
·ZOn
C6H5
+ ZOn
H
H
9
O
0
0
0
0
1
0
0
0
O
C6H5
+ ZOn+1
C6H5
·ZOn+1
H
10
O
O
0
0
0
0
1
0
0
0
C6H5
·ZOn+1
C6H5
+ ZOn
H
H
11
C6H5-CHO + ZOn+1 + H2O2 C6H5COOH·ZOn+1 + H2O
0
0
0
0
0
1
0
0
12
C6H5COOH·ZOn+1 C6H5COOH + ZOn+1
0
0
0
0
0
1
0
0
13
C6H5
+ H2O2 промежуточный окисленный олигомер
0
0
0
0
0
0
0
1
14
ZOn + H2O2 ZOn+1 + H2O
1
0
2
0
0
0
1
0
* ZOn и ZOn+1 — оксо- и пероксовольфраматы, содержащие катионы Сen+.
732
Алимарданов Х. М. и др.
число стехиометрических маршрутов (Р), отвеча-
Информация о вкладе авторов
ющее стадийной схеме, определяется уравнением
Авторы Х. М. Алимарданов, Н. И. Гарибов,
Р = S - J = 8, где S — число стадий; J — число про-
Э. С. Мусаева принимали участие в разработке и
межуточных соединений, образующих комплекс с
исследовании химико-технологических закономер-
катализатором. Таким образом, выбранная стадийная
ностей, режимных параметров процесса, а также
схема полностью описывает многообразие протекаю-
выборе каталитической системы, Ф. М. Велиева —
щих в системе реакций [25].
в исследовании кинетики процесса, расчете кинети-
Разработанная кинетическая модель процесса
ческих констант. По полученным данным авторами
жидкофазного окисления стирола пероксидом водо-
была выбрана лимитирующая стадия процесса.
рода в присутствии полиоксовольфрамата может быть
использована для математического моделирования и
оптимизации данного процесса, а также при изучении
Информация об авторах
кинетических закономерностей других многомарш-
Алимарданов Хафиз Муталлим, зав. лаб. али-
рутных окислительных процессов.
циклических соединений Института нефтехими-
ческих процессов имени Ю. Г. Мамедалиева НАН
Азербайджана, д.х.н., чл.-корр. НАНА, ORCID:
Выводы
Изучены кинетические закономерности и меха-
Велиева Фируза Мовсум, зав. лаб. математического
низм жидкофазного окисления стирола пероксидом
моделирования Института нефтехимических процес-
водорода в присутствии полиоксовольфрамата, моди-
сов имени Ю. Г. Мамедалиева, д.т.н., доцент, ORCID:
фицированного катионами церия. Окисление стирола
протекает по сложной схеме, преимущественно с
Гарибов Неймат Исмайыл, к.х.н., в.н.с.
образованием смеси фенилоксирана и бензальдеги-
Института нефтехимических процессов имени
да. Составлены кинетические уравнения накопления
Ю. Г. Мамедалиева,
продуктов реакции, вычислены значения кинетиче-
ских параметров и предложена модель, включающая
Мусаева Эльнара Сахиб, н.с., аспирант
основные маршруты протекания реакции. Согласно
Института нефтехимических процессов имени
предлагаемой модели, первичным продуктом окисле-
Ю. Г. Мамедалиева,
ния стирола является фенилоксиран, подвергающий-
ся далее гидролизу, изомеризации и окислению по
последовательно-параллельной схеме. Соотношение
Список литературы
эпоксида и альдегидов может быть изменено путем
варьирования температуры и мольного соотношения
[1] Пай З. П., Бердникова П. В., Толстиков А. Г.,
субстрат:окислитель.
Хлебникова Т. Б., Селиванова Н. В. Межфазное
каталитическое окисление органических сое-
динений пероксидом водорода в присутствии
пероксополиоксометаллатов // Катализ в пром-
Благодарности
сти. 2006. № 5. С. 12-23 [Pai Z. P., Berdnikova P. V.,
Работа выполнена в рамках государственного за-
Tolstikov A. G., Khlebnikova T. B., Selivanova N. V.
дания Института нефтехимических процессов имени
Catalytic oxidation of α, β- and β,γ-unsaturated bicyclic
Ю. Г. Мамедалиева НАН Азербайджана.
ketones by hydrogen peroxide // Catal. Ind. 2006. N 5.
P. 105-109].
[2] Sadigov O. A., Alimardanov H. M., Garibov N. I.,
Babayev N. R., Almardanova M. B. Liquid phase
Финансирование работы
oxidative functionalization of organic compounds by
Работа выполнена при финансовой поддержке
hydrogen peroxide in a system inducing electrophilic
Национальной академии наук Азербайджана.
reagents // Processes Petrochem. Oil Refining. 2017.
V. 18. N 2. P. 89-143.
[3] Пат. РФ 2328491 (опубл. 2006). Способ эпоксиди-
рования олефинов и катализатор для применения в
Конфликт интересов
способе.
Авторы заявляют об отсутствии конфликта инте-
[4] Касьян Л. И. Эпоксидирование замещенных норбор-
ресов, требующего раскрытия в данной статье.
ненов. Стереохимические аспекты и сопутствующие
Кинетические закономерности жидкофазного окисления стирола пероксидом водорода...
733
внутримолекулярные превращения // Успехи хи-
Kustova G. N. Epoxidation of cycloolefins with
мии. 1998. Т. 67. № 4. С. 299-309 [Kasyan L. I.
hydrogen peroxide in the presence of heteropoly acids
Epoxidation of substituted norbornenes. Stereo-
combined with phase transfer catalyst // Russ. Chem.
chemical aspects and accompanying intramolecular
Bull. 2003. V. 52. N 2. P. 480-486.
transformations // Russ. Chem. Rev.
1998.
[13] Чжан С., Цзэн Ч., Чжан Л., Сш Н. Макрокинетика
RC1998v067n04ABEH000355].
окисления стирола, катализируемого Co2+-
[5] Матиенко Л. И., Мосолова Л. А., Заиков Г. Е.
обменом X // Кинетика и катализ. 2009. Т. 50. № 2.
Селективное каталитическое окисление угле-
С. 212-217 [Zhang X., Zeng C., Zhang L., Xu N.
водородов. Новая перспектива // Успехи хи-
Macro-kinetics of styrene oxidation catalyzed by
мии. 2009. № 78 (3). С. 227-247 [Matienko L. I.,
Co2+-exchanged X // Kinet. Catal. 2009. V. 50. P. 199-
Mosolova L. A., Zaikov G. E. Selective catalytic
oxidation of hydrocarbons. New prospects // Russ.
[14] Гарибов Н. И., Абдуллаева М. Я., Садыгов О. А.,
Chem. Rev. 2009. V. 67. N 3. P. 211-231. http://
Алимарданов Х. М. Структурированные молиб-
dx.doi.org/10.1070/RC2009v078n03ABEH003919].
денсодержащие углеродные материалы — ката-
[6] Hulea V., Dumitriu E. Styrene oxidation with H2O2
лизаторы жидкофазного окисления непредель-
over Ti-containing molecular sieves with MFI, BEA
ных углеводородов // VI Междунар. симпозиум.
and MCM-41 topologies // Appl. Catal. A: General.
Сб. науч. статей «Фуллерены и наноструктуры в
2004. V. 277. N 1-2. P. 99-106.
конденсированных средах». Минск, БГУ, 2011.
С. 248-256.
[7] Duarte T. A. G., Estrada A. C., Simões M. M. Q.,
[15] Алимарданов Х. М., Алиева А. А., Абасов С. И.,
Santos I. C. M. S.,
Cavaleiro A. M. V.,
Аббасов М. Ф., Кулиев А. Д. Влияние иммобилизи-
Neves G. P. M. S., Cavaleiro J. A. S. Homogeneous
рованных наночастиц углерода на активность цео-
catalytic oxidation of styrene and styrene derivatives
литов в окислительном дегидрировании 4-винилци-
with hydrogen peroxide in the presence of transition
клогексена и этилбензола в стирол // Нефтехимия.
metal-substituted polyoxotungstates // Catal. Sci.
2012. Т. 52. № 2. С. 116-123. [Alimardanov Kh. M.,
Technol. 2015. V. 5. P. 351-363.
Alieva A. A., Abasov S. I., Abbasov M. F., Kuliev A. D.
Effect of immobilized carbon nanoparticles on the
[8] Wang Y., Zhang Q., Shishido T., Takehira K.
activity of zeolites in the oxidative dehydrogenation
Characterizations of iron-containing MCM-41 and
of 4-vinylcyclohexene and ethylbenzene to styrene
its catalytic properties in epoxidation of styrene with
// Petrol. Chem. 2012. V. 52. N 2. P. 97-104.
hydrogen peroxide // J. Catal. 2002. V. 209. N 1. P.
[16] Liu H., Bai J., Wang Sh., Li Ch., Guo L., Liang H.,
[9] Monti D., Pastorini A., Mancini G., Borocci S.,
Xu T., Sun W., Li H. The preparation of silver
Tagliatesta P. Structural effects on the NaOCl
nanoparticles/carbon nanofibers as catalyst in the
epoxidation of styrene in micellar media catalysed
styrene epoxidation // Colloids and Surfaces A:
by amphiphilised Mn(III)metalloporphyrins // J. Mol.
Physicochem. Eng. Aspects. 2014. V. 448. P. 154-159.
Catal. A: Chemical. 2002. V. 179. N 1-2. P. 125. http://
dx.doi.org/10.1016/S1381-1169(01)00406-X
[17] Long Y., Zhao Z., Wu L. Distinctive ligand effects of
[10] Xinrong L., Jinyu X., Huizhang L., Bin Y., Songlin J.,
functionalized magnetic microparticles immobilizing
Gaoyang X. Studies on styrene oxidation reaction
palladium acetate as heterogeneous coordination
catalyzed by ruthenium substituted polyoxotungstates:
catalysts for selective oxidation of styrene to
Kinetics and phase transfer effect // J. Mol. Catal. A:
acetophenone // Mol. Catal. 2017. V. 433. P. 291-300.
Chemical. 2000. V. 161. N 1-2. P. 163.
[18] Pawara R. Y., Adhyapak P. V., Pardeshia S. K.
[11] Benjamin L. S., Burgess K. A. Cheap, catalytic,
Effect of chemical composition of SrxCa1-xFe2O4
scalable, and environmentally benign method for
(0.0 ≤ x ≤ 1.0) catalyst and alkali towards efficient and
alkene epoxidations // J. Am. Chem. Soc. 2001. V. 123.
selective epoxidation of styrene // Catal. A: General.
N 12. P. 2933-2937.
2014. V. 478. P. 129-137.
[12] Тимофеева М. Н., Пай З. П., Толстиков А. Г.,
[19] Sarbak Z., Lewandowski M. Catalytic elimination of
Кустова Г. Н. Эпоксидирование циклоолефинов
nitrogen organic compounds from the coal-liquid and
перекисью водорода в присутствии гетеропольных
structural properties of NiMo catalysts supported on
кислот в сочетании с катализатором фазового пере-
NaX and NaY zeolites modified with transition metal
хода // Изв. РАН. Сер. хим. 2003. Т. 52. № 2. С. 458-
cations //Appl. Catal. A. 2001. V. 208. N 1-2. P. 317.
463 [Timofeeva M. N., Pai Z. P., Tolstikov A. G.,
734
Алимарданов Х. М. и др.
[20] Tang Y., Zhang I. Direct oxidation of benzene
catalysts // Prezem. Chem. 2008. V. 81. N 8. P. 515-
to phenol catalyzed by a vanadium-substituted
518 .
heteropolymolybdic acid catalyst // J. Serb. Chem.
[23] Mетелица Д. И. Механизмы гидроксилирования
Sol. 2006. V. 71. N 2. P. 111.
ароматических соединений // Успехи химии.1971.
[21] Namiya K., Memot Y, Haseyama T., Matsuoka S.
RC1971v040n07ABEH001939
Multicenter active sites of vanadium-substituted
[24] Нагиев Т. М. Сопряженные реакции окисле-
polyoxometalate catalysts on benzene hydroxylation
ния перекисью водорода // Успехи химии. 1985.
with hydrogen peroxide and two reaction types with
and without an induction period // J. Mol. Catal. A.
RC1985v054n10ABEH003152
2000. V. 152. N 1-2. P. 55-68.
[25] Снаговский Ю. С., Островский Г. М. Модели-
рование кинетики гетерогенных каталитических
[22] Woroblewska A., Mileher E. Hydroxylation of phenol
процессов. М.: Химия, 1976. С. 152-173.
with hydrogen peroxide over titanium silicalite