952
Сахабутдинова Г. Н. и др.
Журнал прикладной химии. 2020. Т. 93. Вып. 7
УДК 547.22
СИНТЕЗ И КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ
ЧЕТВЕРТИЧНЫХ АММОНИЙНЫХ СОЛЕЙ,
СОДЕРЖАЩИХ гем-ДИХЛОРЦИКЛОПРОПАНОВЫЙ
И 1,3-ДИОКСОЛАНОВЫЙ ФРАГМЕНТЫ
© Г. Н. Сахабутдинова, Е. А. Яковенко, Г. З. Раскильдина, С. С. Злотский
Уфимский государственный нефтяной технический университет,
450062, г. Уфа, ул. Космонавтов, д. 1
Поступила в Редакцию 22 сентября 2019 г.
После доработки 17 марта 2020 г.
Принята к публикации 8 апреля 2020 г.
Синтезированы с высоким выходом четвертичные аммонийные соли, содержащие гем-дихлорцикло-
пропановые и 1,3-диоксолановые группы. Изучены реакции дихлоркарбенирования стирола и О-ал-
килирования 2,2-диметил-4-оксиметил-1,3-диоксолана в присутствии четвертичных аммонийных
солей. Установлено, что в реакции О-алкилирования максимальной эффективностью в ряду изученных
катализаторов обладают соединения, содержащие циклоацетальные и аллильные группы. Структуры
выделенных солей были доказаны методами ЯМР 1Н и 13С спектроскопии.
Ключевые слова: четвертичная аммонийная соль; гем-дихлорциклопропановый и 1,3-диоксолановый
фрагменты; гексаметилентетрамин; 4-[(аллилокси)метил]-2,2-диметил-1,3-диоксолан
DOI: 10.31857/S004446182007004X
Четвертичные аммонийные соли являются одним
ния стирола и О-алкилирования 2,2-диметил-4-окси-
из наиболее часто применяемых классов дезинфи-
метил-1,3-диоксолана.
цирующих средств в медицине, текстильной, лако-
красочной и пищевой промышленности благодаря
Экспериментальная часть
их относительно низкой токсичности для человека
и животных [1-3]. Этим определяется важность и
Хроматографический анализ продуктов реакции
актуальность синтеза новых четвертичных аммоний-
выполняли на хроматографе HRGС 5300 Mega Series
ных солей и оценка их каталитической активности в
Carlo Erba с пламенно-ионизационным детектором,
реакциях.
газ-носитель — гелий, расход 30 мл·мин-1, колон-
В работе [4] предложен способ получения четвер-
ка капиллярная длиной 25 м, фаза SE-30. Условия
тичных солей из легкодоступных соединений пири-
анализа: программирование температуры от 50 до
дина в качестве исходных реагентов. Недостатками
280°С со скоростью подъема 8 град·мин-1, темпе-
данного способа являются многостадийность синтеза
ратура детектора 250°С, испарителя — 300°С, газ--
и продолжительность реакции.
носитель — гелий, 30 мл·мин-1. Идентификацию
Ранее нами было показано, что присутствие
продуктов осуществляли по известным значениям
гем-дихлорциклопропанового и циклоацетального
времени удерживания. Масс-спектры получали на
фрагментов в структуре молекул повышает их био-
приборе Кристалл-5000М (капиллярная колонка
логическую активность [5]. Целью настоящей работы
длиной 30 м, температура в колонке от 80 до 280°С,
являлось получение новых четвертичных аммоний-
температура переходной линии 300°С, температу-
ных солей, содержащих гем-дихлорциклопропановый
ра источника ионов 300°С). Повышение температу-
и 1,3-диоксолановый фрагменты, и оценка их катали-
ры происходило со скоростью 20 град·мин-1. Газ-
тической активности в реакциях дихлоркарбенирова-
носитель — гелий. Спектры ЯМР регистрировали на
Синтез и каталитическая активность четвертичных аммонийных солей...
953
спектрометре Bruker AVANCE-500 (1H 500.13 МГц)
59.01 (C13H2), 59.93 (2C9,11H2), 62.23 (C6H2), 65.13
в CDCl3.
(2C4,5H2), 97.52 (C2H), 125.52 (C14H), 128.70 (C15H2).
В работе использовались свежеперегнанные рас-
4-(1,3-Диоксолан-4-илметил)-4-пропен-2-
творители фирмы ООО «Техресурс»: хлористый ме-
илморфолиниум-4 бромид (1в) или хлорид (2в). Белый
тилен (х.ч.), хлороформ (х.ч.), петролейный эфир
порошок, выход (1в) — 50, (2в) — 40%; Тпл 65 (1в) и
(х.ч.), бензол (х.ч.), толуол (х.ч.); свежепрокален-
61°С (2в). Спектр ЯМР 1Н, δ, м. д.: 3.43-3.55 м (1Н,
ные соли фирмы ООО «Стеклоприбор»: CaCl2 («чи-
2С8,12Н2), 3.62 д (2H, C6H2, J 4.3 Гц), 3.66-4.10 м (2H,
стый»), MgSO4 («чистый»); третичные амины —
C4H2), 3.90-3.98 м (4H, 2C9,11H2), 4.33 д (2H, C13H2,
4-[(2,2-дихлороциклопропил)метил]морфолин,
J 7.1 Гц), 4.57 к (1H, C5H, J 7.0 Гц), 4.93 с (2H, C2H2),
4-(1,3-диоксолан-2-илметил)морфолин, 4-(1,3-диоксо-
5.62 д (1H, C15H2a, J 10.3 Гц), 5.70 д (1H, C15H2b, J
лан-4-илметил)морфолин, полученные по методике [6].
10.3 Гц), 5.96-6.00 м (1H, C14H). Спектр ЯМР 13С, δ,
Общая методика получения четвертичных ам-
м. д.: 60.52 (2C8,12H2), 61.50 (C13H2), 61.60 (2C9,11H2),
монийных солей (4-[(2,2-дихлорциклопропил)ме-
63.53 (C6H2), 75.03 (C4H2), 75.74 (C5H), 93.83 (C2H2),
тил]-4-пропен-2-илморфолиниум-4 бромида или
125.52 (C15H2), 131.80 (C14H).
хлорида, 4-(1,3-диоксолан-2-илметил)-4-пропен-2-ил-
4-Бензил-4-(1,3-диоксолан-2-илметил)морфоли-
морфолиниум-4 бромида или хлорида, 4-(1,3-диок-
ниум-4 бромид (1г) или хлорид (2г). Белый порошок,
солан-4-илметил)-4-пропен-2-илморфолиниум-4
выход (1г) — 83, (2г) — 79%; Тпл 56 (1г) и 53°С (2г).
бромида или хлорида, 4-бензил-4-(1,3-диоксолан-2-ил-
Спектр ЯМР 1Н, δ, м. д.: 1.56 т (1H, C10H2a, J 7.6 Гц),
метил)морфолиниум-4 бромида или хлорида). В круг-
1.64 т (1H, C10H2b, J 7.6 Гц), 1.78-2.12 м (1H, C8H),
лодонную колбу емкостью 100 мл загружали 0.5 г
3.35 т (4H, 2C3,5H2, J 8.6 Гц), 3.710-3.77 м (2H, C7H2),
(0.002 моль) 4-[(2,2-дихлороциклопропил)метил]-
4.07 т (4H, 2C2,6H2, J 8.6 Гц,), 4.84 с (1H, C11H2), 7.30 т
морфолина, либо 0.3 г (0.002 моль) 4-(1,3-диоксо-
(2H, 2C14,16H, J 9.7 Гц), 7.33 т (1H, C15H, J 9.7 Гц),
лан-2-илметил)морфолина, либо 0.3 г (0.002 моль)
7.45 т (2H, 2C13,17H, J 9.7 Гц). Спектр ЯМР 13С, δ,
4-(1,3-диоксолан-4-илметил)морфолина и 0.002 моль
м. д.: 27.32 (C10H2), 29.05 (C8H), 58.51 (C7H2), 61.66
бромистого (либо хлористого) аллила (либо бензила).
(С9), 62.27 (2C2,6H2), 63.50 (C11H2), 63.53 (2C3,5H2),
Реакционную массу выдерживали 2 ч при комнатной
127.04 (C12), 129.44 (2C14,16H), 130.34 (C15H), 134.69
температуре. Продукт, первоначально выпавший в
(2C13,17H2).
виде масла, полностью закристаллизовывался. Смесь
Общая методика получения 1-[(2,2-дихлорцик-
отфильтровывали, остаток на фильтре промывали
лопропил)метил]-3,5,7-триаза-1-азониатрицик-
бензолом (2 × 100 мл) и сушили в вакууме.
ло[3,3,1,1]декан бромида и хлорида. В круглодон-
4-[(2,2-Дихлорциклопропил)метил]-4-пропен-2-ил-
ную колбу емкостью 100 мл, снабженную обратным
морфолиниум-4 бромид (1а) или хлорид (2а). Белый
холодильником с хлоркальциевой трубкой, помеща-
порошок, выход (1а) — 87, (2а) — 70%; Тпл 60 (1а) и
ли раствор 1 г (0.007 моль) гексаметилентетрамина
53°С (2а). Спектр ЯМР 1Н, δ, м. д.: 1.67 т (1H, C10H2a,
(уротропина) в 10 мл хлороформа и при перемеши-
J 7.7 Гц), 2.03 т (1H, C10H2b, J 7.7 Гц), 2.30-2.41 м (1H,
вании прибавляли раствор 0.007 моль 2-(бромме-
C8H), 3.76 т (4H, 2C3,5H2, J 8.6 Гц), 3.83-3.89 м (2H,
тил)-1,1-дихлорциклопропана либо 2-(хлорме-
C7H2), 4.03-4.09 м (2H, C13H2), 4.19 т (4H, 2C2,6H2,
тил)-1,1-дихлорциклопропана в 10 мл хлороформа.
J 8.6 Гц), 5.75 д (1H, C15H2a, J 9.7 Гц), 5.95 д (1H,
Реакционную смесь кипятили на водяной бане при
C15H2b, J 9.7 Гц), 6.10-6.14 м (1H, C14H). Спектр
60°С в течение 4 ч, затем охлаждали и добавляли
ЯМР 13С, δ, м. д.: 23.33 (C8H), 26.32 (C10H2), 56.84
равное по объему количество сухого петролейного
(2C3,5H2), 57.27 (C7H2), 60.51 (2C2,6H2), 60.58 (C9),
эфира. Выпавший осадок отфильтровывали, тщатель-
61.24 (C13H2), 123.54 (C14H), 130.83 (C15H2).
но промывали сухим эфиром и высушивали в вакууме
4-(1,3-Диоксолан-2-илметил)-4-пропен-2-
при температуре 35-40°С.
илморфолиниум-4 бромид (1б) или хлорид (2б).
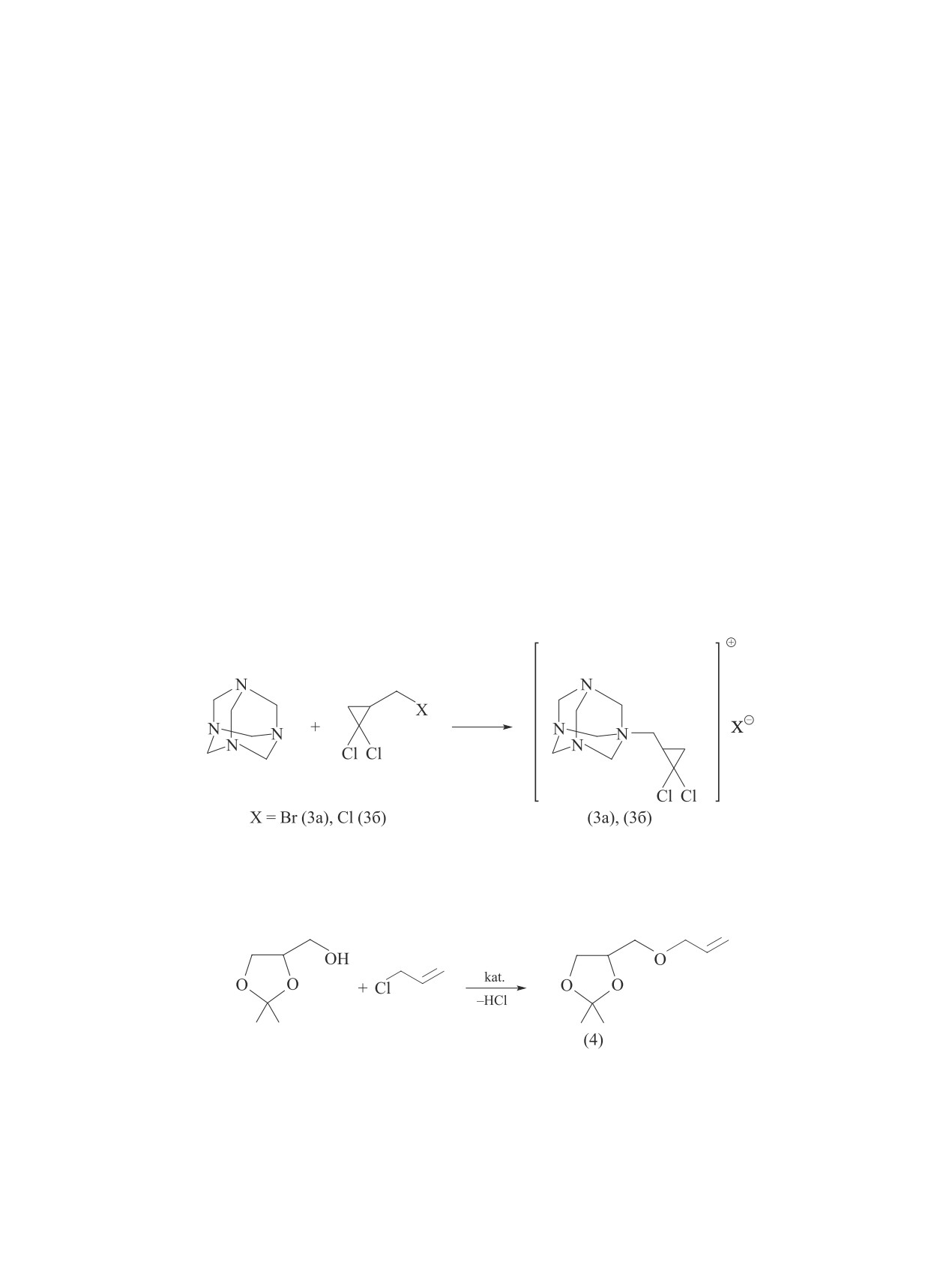
1-[(2,2-Дихлорциклопропил)метил]-3,5,7-три-
Белый порошок, выход (1б) — 81, (2б) — 66%; Тпл
аза-1-азониатрицикло[3,3,1,1]декан бромид (3а)
63 (1б) и 60°С (2б). Спектр ЯМР 1Н, δ, м. д.: 3.47-3.59
или хлорид (3б). Желтый порошок, выход (3а) — 68,
м (1Н, 2С8,12Н2), 3.67 д (2H, C6H2, J 4.3 Гц), 3.86
(3б) — 55%; Тпл 48 (3а) и 39°С (3б). Спектр ЯМР
т (2H, C5H2, J 7.0 Гц), 3.93-3.96 м (4H, 2C9,11H2),
1Н, δ, м. д.: 0.89 т (1H, C14H2a, J 7.7 Гц), 1.06 т (1H,
3.98 т (2H, т, C4H2, J 7.0 Гц), 4.34 д (2H, C13H2, J
C14H2, Hb, J 7.7 Гц), 1.56-1.68 м (1H, C12H), 2.31 д.д
7.1 Гц), 5.50 т (1H, C2H, J 4.2 Гц), 5.64 д (1H, C15H2a,
(1H, C11H2a, J 13.8 Гц, J 8.7 Гц), 2.54 д.д (1H, C11H2b,
J 10.3 Гц), 5.72 д (1H, C15H2b, J 10.3 Гц), 5.99-6.09 м
J 13.8 Гц, J 8.7 Гц), 3.70-3.79 м (6H, 3C2,8,10H2), 4.61-
(1H, C14H). Спектр ЯМР 13С, δ, м. д.: 58.62 (2С8,12Н2),
4.68 м (6H, 3C4,6,9H2). Спектр ЯМР 13С, δ, м. д.: 21.06
954
Сахабутдинова Г. Н. и др.
(C12H), 25.87 (C14H2), 55.18 (C3H2), 59.07 (C9), 69.64
72.44 (С8), 74.65 (С4), 109.35 (С2), 117.31 (С10), 134.41
(3C2,8,10H2), 78.10 (3C4,6,9H2).
(С9). Масс-спектр, m/z (Iотн, %): 172 (нет), 157 (100),
Методика получения 4-[(аллилокси)метил]-2,2-ди-
101(81), 73 (9), 55 (16), 43 (45).
метил-1,3-диоксолана. К раствору 4 г (0.03 моль)
2,2-диметил-4-оксиметил-1,3-диоксолана в 30 мл
Обсуждение результатов
толуола и 0.003 моль катализатора (1б), либо (1в),
либо триэтиламмония бромида, либо (1а), либо (1г),
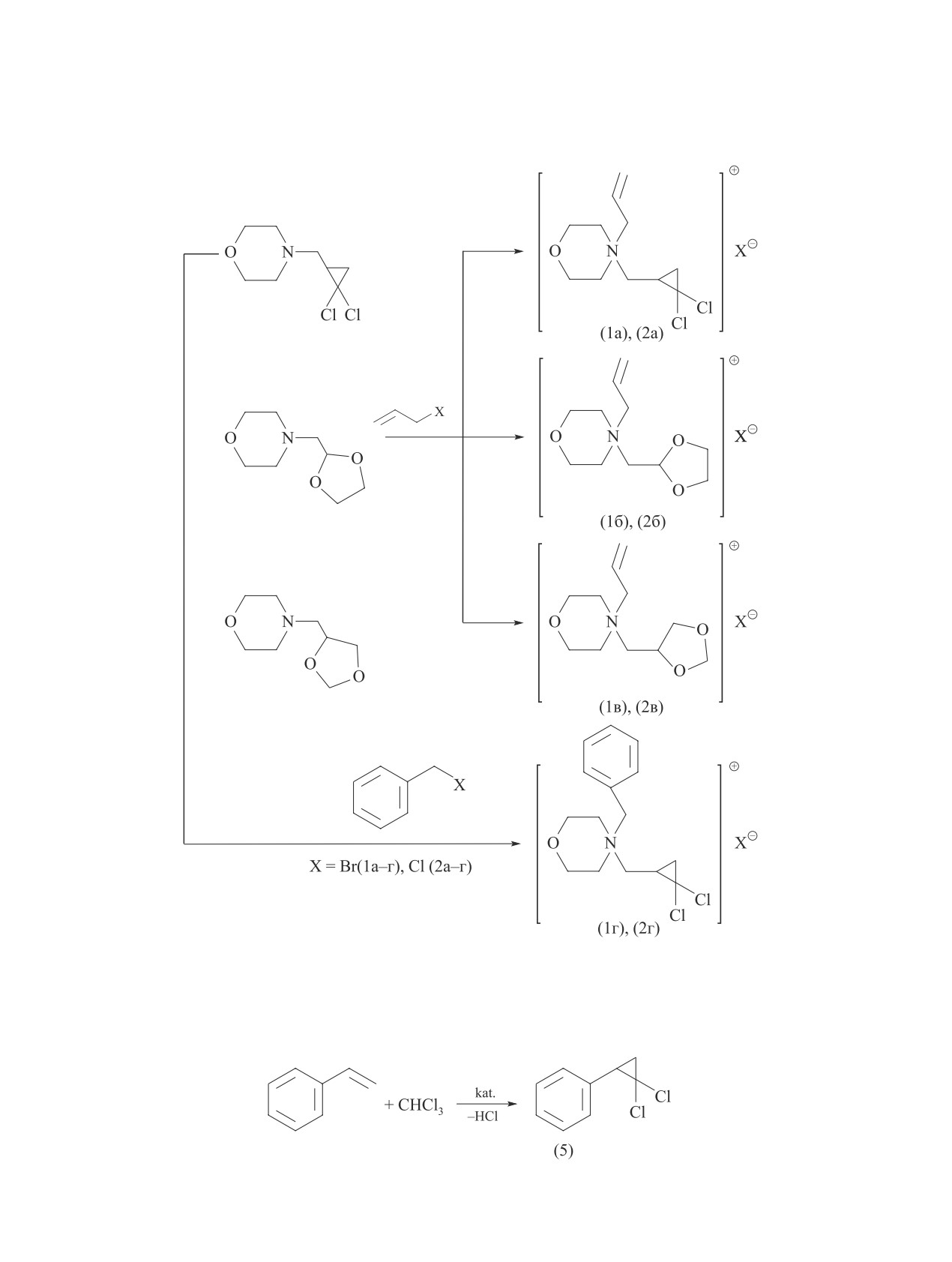
Реакцией третичных аминов на основе морфолина
либо (3а) при интенсивном перемешивании при 30°С
и галогенпроизводных аллила или бензила с количе-
прибавляли 50 г 50%-ного раствора NaOH. Затем
ственным выходом были получены соответствующие
через 2 ч прикапывали 11.5 г (0.15 моль) хлористого
четвертичные аммонийные соли. Лучшие результаты
аллила. Пробу отбирали каждый час. По завершении
[выход солей (1а-г) 80-90%] получены при использо-
реакции смесь промывали водой, экстрагировали
вании аллил- и бензилбромидов. Выход четвертичных
хлористым метиленом (3 × 30 мл), сушили над без-
солей (2а-г) из соответствующих хлоридов не пре-
водным MgSO4 и удаляли растворитель.
вышал 10%. Амины, содержащие 1,3-диоксолановые
4-[(Аллилокси)метил]-2,2-диметил-1,3-диок-
группы, образуют соли (1б,в) с близким выходом (84
солан (4). Выход 94%, бесцветная жидкость, Ткип
и 88% соответственно) и более активны, чем произ-
74°С (5 мм рт. ст.). Спектр ЯМР 1Н, δ, м. д.: 1.32 с
водное гем-дихлорциклопропана [выход солей (1а) и
(3Н, С2″Н3), 1.40 с (3Н, С2′Н3), 3.43 д.д (1Н, С6Hа, J
(1г) — 76 и 72% соответственно] (см. схему).
9.9 Гц, J 5.5 Гц), 3.50 д.д (1Н, С6Hb, J 9.8 Гц, J 5.8 Гц),
В этих же условиях на основе хорошо известного
3.71 т (1Н, С5Hа, J 8.3 Гц, J 6.5 Гц), 3.97-4.06 м (3Н,
гексаметилентетрамина (уротропина) мы получили
С5Hb, С8Н2), 4.26 т (1Н, С4H, J 5.9 Гц), 5.16 д (1Н,
бромид (3а) и хлорид (3б), содержащие гем-дихлор-
С10Hа, J 1.3 Гц, J 10.4 Гц), 5.26 д (1Н, С10Hb, J 1.4 Гц,
циклопропановый фрагмент с выходом 68 и 55%
J 15.6 Гц), 5.83-5.93 м (1Н, С9H). Спектр ЯМР 13С,
соответственно:
δ, м. д.: 25.34 (С2″), 26.70 (C2′), 66.77 (С5), 71.02 (С6),
Была определена каталитическая активность
оксолана) хлористым аллилом. Ранее мы нашли, что
полученных бромидов (1а-в), (3а) в реакции
эфир (4) обладает гербицидными свойствами [7] и на
О-алкилирования хорошо известного гетероцикли-
его основе могут быть получены полифункциональ-
ческого спирта (2,2-диметил-4-оксиметил-1,3-ди-
ные гликоли — полупродукты синтеза лекарств [8, 9]:
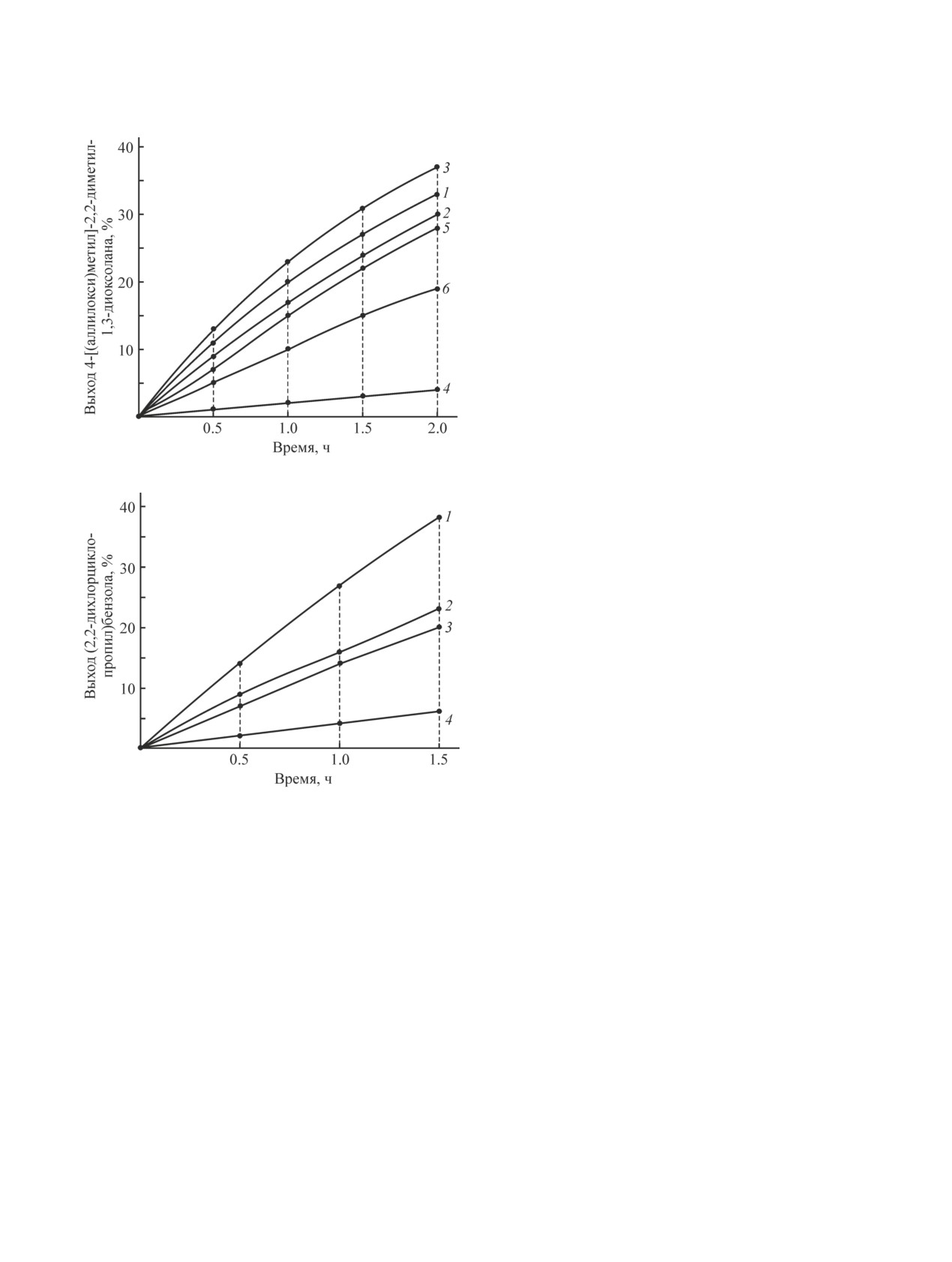
Из полученных данных (рис. 1) следует, что макси-
предположить, что в ряду изученных солей (1а) и (1б)
мальной эффективностью в ряду изученных катализа-
лучше ассоциируются с молекулами оксиметилкеталя
торов обладают четвертичные соли (1б, в), в которых
и хлористого аллила, что повышает эффективность
присутствуют циклоацетальная и аллильная группы,
О-алкилирования и способствует росту выхода целе-
аналогичные реагентам — спирту и олефину. Можем
вого простого эфира (4). Известный катализатор три-
Синтез и каталитическая активность четвертичных аммонийных солей...
955
Схема
этилбензиламмоний бромид и четвертичная соль (1а),
В дихлоркарбенировании стирола в условиях
содержащая гем-дихлорциклопропановый фрагмент,
межфазного катализа [10] лучшие результаты по-
по активности близки, а производное уротропина в
лучены при использовании соли (1г), содержащей
этих условиях наименее активно.
гем-дихлорциклопропановый фрагмент (рис. 2).
956
Сахабутдинова Г. Н. и др.
Рис. 1. Активность четвертичных аммонийных солей
в синтезе 4-[(аллилокси)метил]-2,2-диметил-1,3-диок-
солана.
Мольное соотношение 2,2-диметил-4-оксиметил-1,3-ди-
оксолан:хлористый аллил = 1:5, 50%-ный раствор NaOH,
10 мас% катализатора, температура 30°С.
1 — триэтилбензиламмоний бромид; 2 — 4-[(2,2-дихлор-
циклопропил)метил]-4-пропен-2-илморфолиниум-4
бромид; 3 — 4-(1,3-диоксолан-2-илметил)-4-про-
пен-2-илморфолиниум-4 бромид, 4-(1,3-диоксолан-4-ил-
метил)-4-пропен-2-илморфолиниум-4 бромид; 4 — без
катализатора; 5 — 4-бензил-4-(1,3-диоксолан-2-илметил)-
морфолиниум-4 бромид; 6 — 1-[(2,2-дихлорциклопро-
пил)метил]-3,5,7-триаза-1-азониатрицикло[3.3.1.1]декан
бромид.
Рис. 2. Активность четвертичных аммонийных солей в
синтезе (2,2-дихлорциклопропил)бензола.
Мольное соотношение стирол:CHCl3 = 1:10, 50%-ный
раствор NaOH, 10 мас% катализатора, температура 0°С.
1 — 4-бензил-4-(1,3-диоксолан-2-илметил)морфолини-
ум-4 бромид, 2 — триэтилбензиламмоний бромид, 3 —
1-[(2,2-дихлорциклопропил)метил]-3,5,7-триаза-1-азони-
атрицикло[3.3.1.1]декан бромид, 4 — без катализатора.
Соль уротропина (3а) по активности близка к из-
илморфолиниум-4 бромид и 4-(1,3-диоксолан-4-ил-
вестному катализатору триэтилбензиламмоний бро-
метил)-4-пропен-2-илморфолиниум-4 бромид, в ко-
миду (рис. 2).
торых присутствуют циклоацетальная и аллильная
Полученные данные показывают, что присутствие
группы, обладают максимальной эффективностью в
в молекулах четвертичных солей заместителей, стро-
ряду изученных катализаторов. Введение в реакцию
ение которых совпадает со структурой реагентов,
дихлоркарбенирования стирола в условиях межфаз-
увеличивает их каталитическую активность.
ного катализа 4-бензил-4-(1,3-диоксолан-2-илметил)-
морфолиниум-4 бромида, содержащего гем-дихлор-
циклопропановый фрагмент, повысило активность
Выводы
до 35%.
На основе третичных аминов, содержащих
гем-дихлорциклопропановый и циклоацетальный
Благодарности
фрагменты, синтезированы новые четвертичные ам-
монийные соли с выходом 40-87%. Установлено,
Авторы выражают благодарность Л. В. Спирихину,
что в реакции О-алкилирования 2,2-диметил-4-
заведующему лабораторией ФХМА УФИЦ РАН, за
оксиметил-1,3-диоксолана хлористым аллилом
оказанное содействие в идентификации структуры
соли — 4-(1,3-диоксолан-2-илметил)-4-пропен-2-
соединений.
Синтез и каталитическая активность четвертичных аммонийных солей...
957
Финансирование работы
quaternary ammonium compounds: Pyridinium and
quinolinium stilbene benzenesulfonates // Eur. J. Med.
Исследования выполнены при поддержке РФФИ
Chem. 2010. V. 45. P. 4199-4208.
конкурса мол_эв_а (Эврика! Идея) по договору
№ 19-33-80002\19 от 07.12.2018.
[3]
Dopierala K., Prochaska K. The effect of molecular
structure on the surface properties of selected
quaternary ammonium salts // J. Colloid Interface
Конфликт интересов
Sci. 2008. V. 479. N 1. P. 28-31.
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
[4]
Ng C. L. L., Singhal V., Widmer F., Wright L. C.,
Sorell T. C., Jolliffe K. A. Synthesis, antifungal and
hemolytic activity of a series of bis(pyridinium)
Информация о вкладе авторов
alkanes // Bioorg. Med. Chem. 2007. V. 15. N 10.
P. 3422-3429.
Все авторы участвовали во всех стадиях исследо-
вания, подготовки и в обсуждении результатов статьи.
[5]
Валиев В. Ф., Яковенко Е. А., Булатова Ю. И.,
Миракян М. С., Борисова Ю. Г., Михайлова Н. Н.,
Раскильдина Г. З. Производные спиртов и аминов,
Информация об авторах
содержащих циклопропановый и циклоацетальный
Сахабутдинова Гульнур Назифулловна, преподава-
фрагменты // Баш. хим. журн. 2016. Т. 23. № 4.
тель кафедры «Общая, аналитическая и прикладная
C. 94-98.
химия» ФГБОУ ВО «Уфимский государственный
[6]
Казакова А. Н., Тимофеева С. А., Юмакаева Ю. М.,
нефтяной технический университет»,
Хайруллина А. Ф., Злотский С. С. Синтез аминов,
содержащих циклопропановый и 1,3-диоксолано-
вый фрагменты // Баш. хим. журн. 2010. Т. 17. № 4.
Яковенко Евгения Андреевна, инженер-лаборант
С. 19-23.
кафедры «Общая, аналитическая и прикладная хи-
[7]
Валиев В. Ф., Раскильдина Г. З., Мудрик Т. П.,
мия» ФГБОУ ВО «Уфимский государственный не-
Богомазова А. А., Злотский С. С. Синтез поли-
фтяной технический университет»,
функциональных вицинальных гликолей // Баш.
хим. журн. 2014. Т. 21. № 3. C. 25-27.
Раскильдина Гульнара Зинуровна, к.х.н., доцент ка-
[8]
Раскильдина Г. З., Борисова Ю. Г., Валиев В. Ф.,
федры «Общая, аналитическая и прикладная химия»
Михайлова Н. Н., Злотский С. С., Заиков Г. Е.,
ФГБОУ ВО «Уфимский государственный нефтяной
Емелина О. Ю. Замещенные простые эфиры и аце-
технический университет»,
тали, обладающие биологической активностью //
Вест. Казан. техн. ун-та. 2014. Т. 17. № 15. C. 166-
Злотский Семен Соломонович, д.х.н., заведую-
169.
щий кафедрой «Общая, аналитическая и прикладная
[9]
Gage J. L., Branchaud B. P. Exploratory studies
on reactions of cobaloxime π-cations with
химия» ФГБОУ ВО «Уфимский государственный
C-nucleophiles: Irreversible alkene decomplexation
нефтяной технический университет»,
versus nucleophilic capture // J. Org. Chem. 1996.
V. 61. P. 831-837.
[10]
Валиев В. Ф., Раскильдина Г. З., Злотский С. С.
Список литературы
Синтез третичных аминов, содержащих гем-
[1] Block S. S. Disinfection, Sterilization and Preservation.
дихлорциклопропановый и циклоацетальный
Lippincott, Williams & Wilkins, Philadelphia, U.S.A.,
фрагменты // ЖПХ. 2016. Т. 89. № 5. С. 619-
2001. P. 283-319.
623 [Valiev V. F., Raskil′dina G. Z., Zlotskii S. S.
Synthesis of tertiary amines containing gem-
[2] Chanawanno K., Chantrapromma S., Anantapong Т.,
dichlorocyclopropane and cycloacetal fragments //
Kanjana-Opas A., Fun Н.-K. Synthesis, structure and in
Russ. J. Appl. Chem. 2016. V. 89. N 5. P. 753-757.
vitro antibacterial activities of new hybrid disinfectants