Журнал прикладной химии. 2020. Т. 93. Вып. 7
ФИЗИКО-ХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ СИСТЕМ И ПРОЦЕССОВ
УДК 544.43
ОСОБЕННОСТИ ОКИСЛЕНИЯ МЕТИЛЛИНОЛЕАТА
В МИЦЕЛЛЯРНЫХ БУФЕРНЫХ РАСТВОРАХ Triton X-100
© Д. В. Лошадкин, Е. М. Плисс*, О. Т. Касаикина
Ярославский государственный университет им. П. Г. Демидова,
150000, г. Ярославль, ул. Советская, д. 14
Поступила в Редакцию 22 августа 2019 г.
После доработки 8 апреля 2020 г.
Принята к публикации 28 апреля 2020 г.
Исследована кинетика поглощения кислорода при окислении метиллинолеата в мицеллах Triton X-100.
Порядок реакции по инициатору снижается от 1 до 0.6 с ростом брутто-концентрации Triton X-100,
поскольку к моменту достижения максимальной скорости поглощения кислорода система представ-
ляет собой смешанные мицеллы, которые обеспечивают перехват радикалов, генерируемых инициа-
тором. Результаты проведенного анализа можно использовать для оценки динамики солюбилизации
гидрофобных субстратов при создании методики тестирования антиоксидантной активности
биологически важных соединений.
Ключевые слова: метиллинолеат; Triton X-100; окисление; мицеллы
DOI: 10.31857/S0044461820070178
Разрушение биологических мембран приводит к
и успешно применяются водные мицеллярные рас-
ряду патологий и заболеваний, в числе которых ате-
творы LH [7-11]. Несмотря на различные условия
росклероз, рак, диабет, а также нейродегенеративные
развития цепного процесса окисления в микрогетеро-
расстройства [1-3]. Начальным актом разрушения
генных и гомогенных системах, кинетику окисления
клеточной мембраны зачастую становится пероксид-
LH в мицеллярных большей частью рассматривают
ное окисление входящих в ее структуру липидных
в рамках принципиальной схемы радикально-цепного
соединений. Результаты интенсивных исследований
окисления, детально разработанной для гомогенных
этого процесса [1-8] пока не получили промышлен-
систем, включающей стадии инициирования радика-
ного внедрения, что обусловлено отсутствием количе-
лов, продолжения и обрыва цепей [2, 5]:
ственной информации о многих аспектах протекания
I → r• (+LH, O2) → L•,
процессов кислородного метаболизма, его экспери-
ментального исследования и теоретического анализа.
L• + O2 → LO2•,
Окисление метиллинолеата (LH) широко исполь-
LO2• + LH → LOOH + L•,
зуется в качестве модельной реакции окисления
LO2• + LO2• → products + O2,
ненасыщенных липидов [2-6]. Для тестирования
разнообразных биоантиоксидантов и их смесей в
где r•, L•, LО2• — свободные радикалы; I — инициа-
качестве кинетической модели биологического про-
тор; LH — метиллинолеат; LOOH — гидропероксид,
цесса пероксидного окисления липидов более удобны
первичный продукт окисления.
1051
1052
Лошадкин Д. В. и др.
Скорость цепного окисления с квадратичным об-
как перспективное направление создания методиче-
рывом цепей описывается уравнением
ской базы исследований в области биотехнологий.
W = a[LH]Wi0.5,
(1)
Экспериментальная часть
где a = kp·2kt-0.5 характеризует окисляемость LH,
Реактивы: инициатор 2,2′-азобис(2-метилпропи-
Wi — скорость инициирования.
онамид) дигидрохлорид (CAS № 2997-92-4) (Sigma-
Однако многие авторы отмечают отклонения по-
Aldrich), метиллинолеат (CAS № 112-63-0) (Sigma)
лучаемых значений от рассчитанных по уравнению
(Sigma-Aldrich), Triton X-100 — трет-октилфенол
(1). Показатель степени при Wi, являющийся поряд-
полиэтиленгликоль, содержащий в среднем 9.5 окси-
ком скорости окисления по инициатору, обычно выше
этиленовой единицы в молекуле (CAS № 9002-93-1)
0.5 и изменяется от 0.6 до 1, что предполагает вклад
(Sigma-Aldrich), — использовали без дополнитель-
линейного обрыва цепей или его имитацию. Кроме
ной очистки. Фосфатный буферный раствор полу-
того, при одинаковых концентрациях инициатора и
чали смешением 0.05 М растворов NaH2PO4 (CAS
LH скорость окисления уменьшается с ростом кон-
№ 7558-80-7) и Na2HPO4 (CAS № 7558-79-4) (оба
центрации введенных поверхностно-активных ве-
Merck), очищенных от следов металлов перемен-
ществ (ПАВ) [6, 10].
ной валентности с помощью смолы Chelex-100 (CAS
В данной работе изучена кинетика поглощения
№ 11139-85-8) (Bio-Rad). Растворы инициатора и TН
кислорода при инициированном окислении LH в ми-
готовили в фосфатном буферном растворе. Опорные
целлярных растворах неионного ПАВ (Triton X-100,
растворы ТН имеют большую концентрацию (0.3-
ТH). В качестве инициатора использован водораст-
0.5 моль·л-1), поэтому необходимо учитывать изме-
воримый 2,2′-азобис(2-метилпропионамид) дигид-
нение объема раствора при добавлении Triton X-100
рохлорид (AAPH). TH — нетоксичное неионное ПАВ,
в фосфатный буферный раствор. Для этого после
широко используется в биохимических исследовани-
полного растворения TН взвешивали известный объ-
ях [1-4]. В Triton X-100 гидрофобная октилфенольная
ем приготовленного раствора и определяли его плот-
группа связана с гидрофильной полиэтиленоксидной
ность. Полученное значение учитывалось при расчете
цепочкой из 9-10 звеньев. TH хорошо смешивается с
молярной концентрации.
водой, а при концентрациях 0.05-0.15 моль·л-1 (что
Кинетические закономерности поглощения кис-
существенно выше критической концентрации ми-
лорода при окислении LH в мицеллярном растворе
целлобразования) его молекулы образуют мицеллы.
ТН изучали с помощью компьютеризированного био-
Форма и размеры этих мицелл, а также концентраци-
логического кислородного монитора Yellow Springs
онные и температурные зависимости скорости окис-
Instruments Co. Model 5300A (США) с электродом
ления исследованы разными методами [12-17]. Triton
Кларка в качестве датчика. Скорость окисления изме-
X-100 применяется в качестве мицеллообразующего
ряли как наклон кинетических кривых уменьшения
ПАВ при работе с ферментами и в сочетании с LH
[O2] в реакционной смеси. Эксперименты проводи-
или другими липидами при тестировании про- и ан-
ли при 37.0 ± 0.1°C. Реакционные смеси готовили
тиокислительных свойств различных биодобавок [7].
аналогично методикам, описанным в [6, 8]. К 3 мл
При этом отмечено, что, подобно другим неионным
предварительно термостатированного мицеллярного
ПАВ с этиленоксидными полярными группами, Triton
раствора ТН и ААРН в буферном растворе микрош-
X-100 может окисляться по радикально-цепному ме-
прицем добавляли 5-45 мкл LH, включали переме-
ханизму [18, 19].
шивание и через 2-3 мин приступали к измерению
Целью работы является получение кинетической
скорости окисления.
информации о роли гидрофобной структуры ПАВ в
механизме окисления LH, необходимой:
Обсуждение результатов
— для оценки динамики солюбилизации гидро-
фобных субстратов в процессе изготовления фарм-
При окислении LH в гомогенной системе про-
препаратов с амфифильными носителями, на что
цесс развивается с постоянной скоростью. Однако
непосредственно указывают работы [20-22];
при окислении мицеллярных растворов LH и TН в
— для разработки методики тестирования биоан-
течение нескольких часов скорость поглощения кис-
тиоксидантов с учетом особенностей окисления в ми-
лорода [W(O2)] возрастает, а в ряде опытов достигает
целлярных системах [23], что отмечено в «Прогнозе
максимального значения, после чего относительно
научно-технологического развития России: 2030» [24]
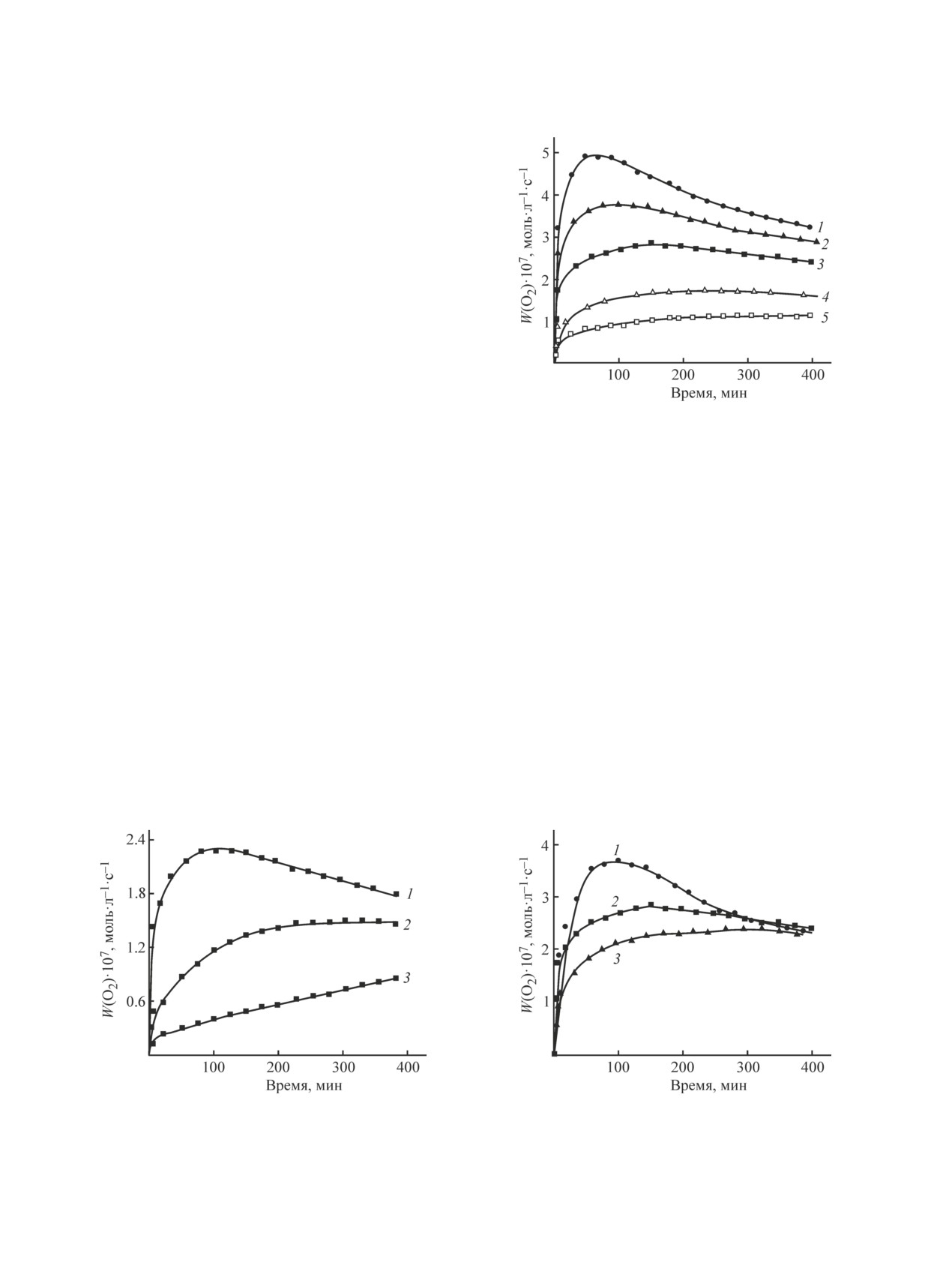
медленно уменьшается (рис. 1-3).
Особенности окисления метиллинолеата в мицеллярных буферных растворах Triton X-100
1053
Начальная и максимальная скорости окисления
возрастают с увеличением концентрации инициато-
ра (рис. 1) и количества добавленного LH (рис. 2).
Увеличение [ТН] при одинаковых концентрациях
инициатора и содержании LH приводит к уменьше-
нию скорости окисления (рис. 3). При этом во всех
случаях W(O2) значительно превышает Wi.
В реакциях жидкофазного окисления рост ско-
рости реакции во времени обычно связывают с вы-
рожденным разветвлением цепей за счет распада
гидропероксидов на радикалы [2, 25]. В настоящей
работе расчетная концентрация гидропероксидов на
участках возрастания скорости не превышает концен-
трацию кислорода, поглощенного ко времени дости-
Рис. 2. Влияние концентрации LH на изменение ско-
жения максимальной скорости: [LOOH]max < DO2(мах).
рости поглощения О2 в ходе окисления; [TН] = 100,
Значения DO2(мах) наряду с другими кинетическими
[ААРН] = 4 ммоль·л-1.
параметрами, которые характеризуют полученные
[LH]0 (ммоль·л-1): 1 — 40, 2 — 30, 3 — 20, 4 — 10, 5 — 5.
данные по измерению скоростей поглощения О2 при
окислении LH в мицеллярных растворах ТН с разным
исходным содержанием компонентов, представлены
происходит его окисление. Молекулярно-дисперсные
в таблице.
концентрации ААРН и ТН равномерно распределе-
Если принять, что эффективная константа скоро-
ны в объеме реакционной среды. Концентрация TH
соответствует критической концентрации мицелло-
сти распада LOOH в мицеллярных растворах такая
образования — 0.23-0.25 ммоль·л-1 [12-17], а основ-
же, как в гомогенном растворе (2.9·10-8 с-1 при 40°С
ная масса мицеллярно-организованного Triton X-100
[24]), то скорость вырожденного разветвления соста-
составляла в наших экспериментах 50-150 ммоль·л-1.
вит не более (1-7)∙10-11 моль·л-1∙c-1, что на 1-2 по-
рядка меньше скорости инициирования при распаде
Согласно [12, 26], число агрегации для мицелл Triton
инициатора: Wi = 1·10-6[ААРН] моль·л-1∙c-1 [7, 26].
X-100 равно 250, средний гидродинамический ра-
В мицеллярном растворе с водорастворимым
диус мицелл при 30°C составляет ~6 нм, а радиус
инициатором стадии генерирования радикалов и
гидрофобного ядра — ~3 нм. Простой расчет пока-
инициирования цепного процесса пространственно
зывает, что при [ТН] = 50 ммоль·л-1 в растворе со-
существуют 0.23 ммоль·л-1 молекул и 0.2 ммоль·л-1
разделены. Практически нерастворимый в воде LH
мицелл ТН. 3 мл реакционной смеси содержат Nmic =
солюбилизирован в неполярном ядре мицелл, где и
Рис. 1. Влияние концентрации инициатора на изменение
Рис. 3. Влияние концентрации ТН на изменение ско-
скорости поглощения О2 в ходе окисления; [TН] = 100,
рости поглощения О2 в ходе окисления; [ААРН] = 4,
[LH] = 10 ммоль·л-1.
LH = 20 ммоль·л-1.
[ААРН] (ммоль·л-1): 1 — 4, 2 — 1, 3 — 0.4.
[TН] (ммоль·л-1): 1 — 50, 2 — 100, 3 — 150.
1054
Лошадкин Д. В. и др.
Кинетические параметры цепного окисления LH, инициированного ААРН, в водно-мицеллярных растворах
Triton X-100 при Wi = 4·10-9 и [TH] = 50 ммоль·л-1
W(нач)∙108
W(мах)∙108
Количество О2, поглощенное к моменту
Объем LH, добавленный
V,* мкл
в реактор, V(LH), мкл
установления W(мах), DO2(мах), ммоль·л-1
моль·л-1∙c-1
2.5
5.11
7.8
0.8
72
5
8.35
12.6
1.2
195
10
14.4
22.8
1.4
218
15
24
37.2
1.7
246
* V — объем мицеллярной фазы при W(мах); Vcor/Vmic = 40 мкл/320 мкл, где Vcor — суммарный объем гидрофобной
части мицелл в 3 мл, Vmic — суммарный объем мицелл в 3 мл вместе с гидратированными полярными головками.
= 6·10-7 моль мицелл. Следовательно, суммарный
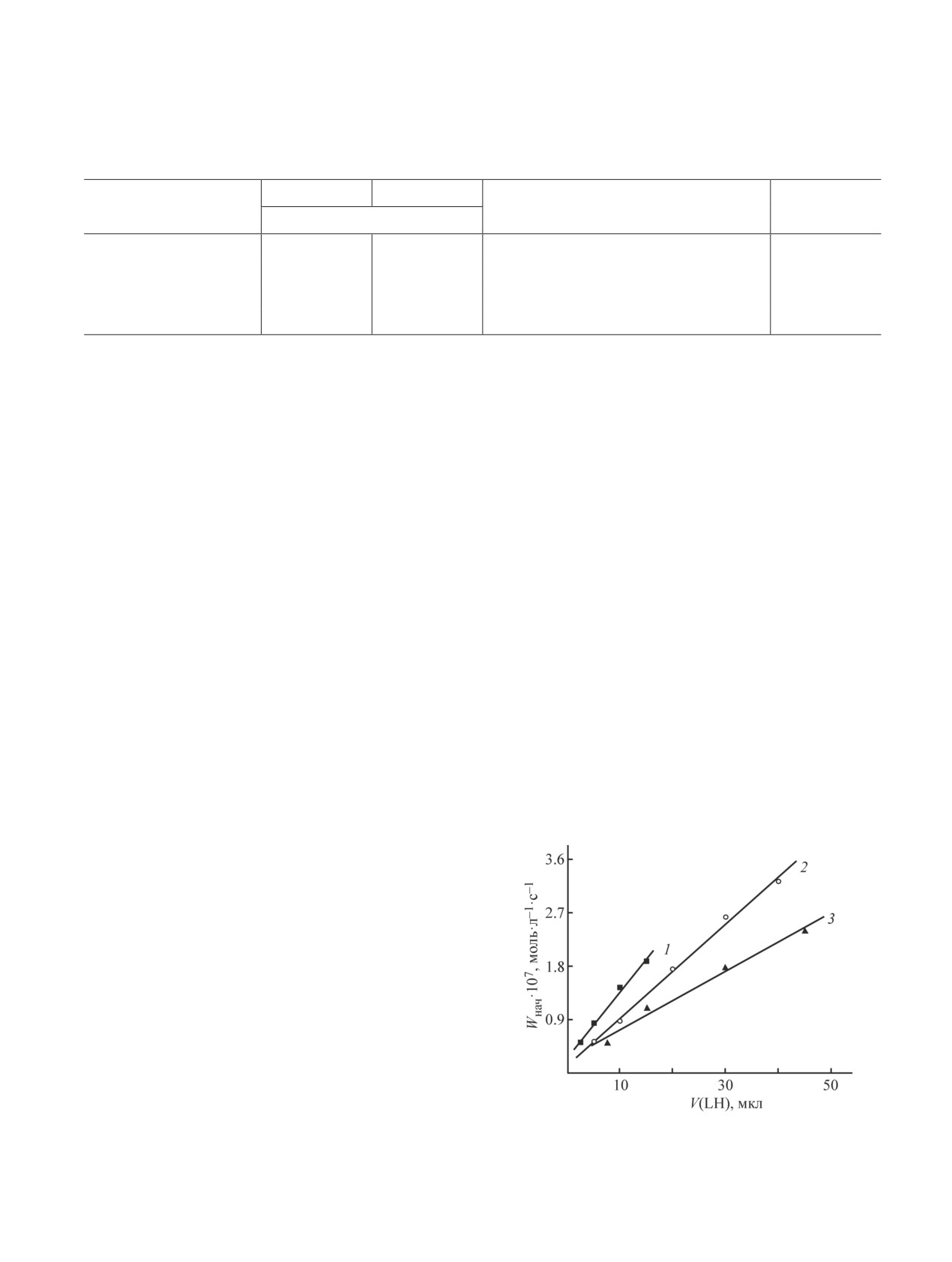
При одинаковом содержании ТН и LH начальная
объем гидрофобной части мицелл в 3 мл 50 мМ
скорость поглощения О2 линейно возрастает с уве-
раствора Triton X-100 (мицеллярной псевдофа-
личением скорости инициирования, а максимальная
зы) составляет Vcor = NANmic·4/3·π·33 = 6·1023·6×
скорость окисления пропорциональна Wi0.5 (рис. 2).
×10-7·113 = 4.07·1019 нм3 = 40 мкл, а суммарный
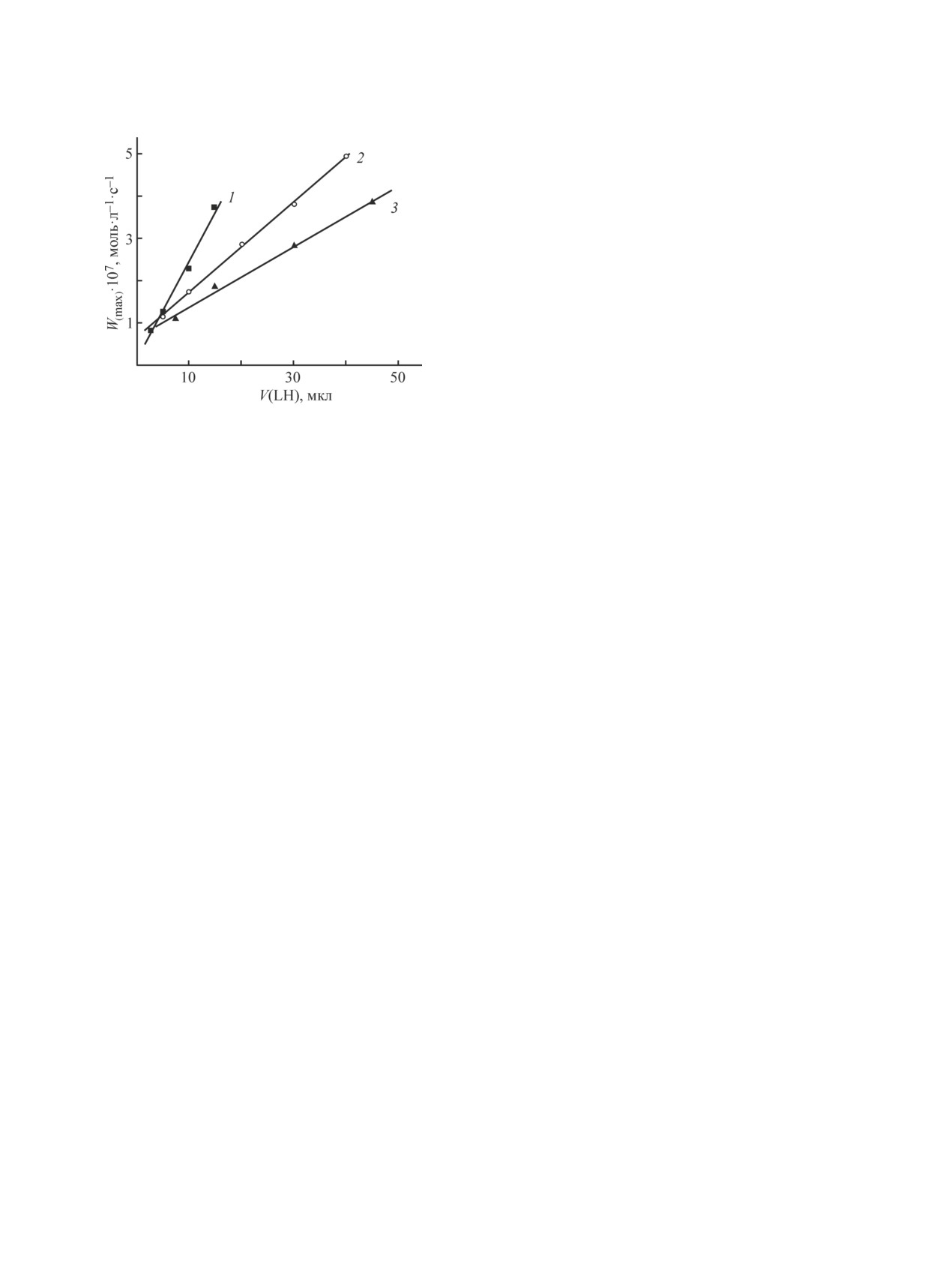
Начальная и максимальная скорости пропорциональ-
объем мицелл вместе с гидратированными полярны-
ны содержанию LH в смеси (рис. 4, 5).
ми головками — Vmic = 320 мкл. При более высоких
Из рис. 4 и 5 видно, что скорости окисления
брутто-концентрациях ТН (100 и 150 ммоль·л-1) соот-
уменьшаются с ростом содержания TH. На основании
ветствующие объемы в 2 и 3 раза выше. В отсутствие
этих зависимостей кинетическое уравнение для W(мах)
LH радикалы, образующиеся из инициатора, присое-
можно представить следующим образом:
диняют О2 в водной фазе и реагируют с молекулами и
W(max) = F(TH)∙[LH]*·Wi0.5,
(2)
мицеллами ТН, запуская последовательность реакций
(см. схему).
где [LH]* — концентрация LH в мицеллярной фазе;
F(TH) — параметр окисляемости, зависящий от брут-
Схема цепного окисления Triton X-100
то-концентрации ТН и отражающий соокисление LH
1) I → r• → rO2•,
и TH.
Уравнение (2) аналогично уравнению (1) для жид-
2) rO2• + TH → rO2H + T• → TO2•,
кофазного окисления с квадратичным обрывом цепей.
3) rO2• + THmic → rO2H + T•mic,
С увеличением [LH] и ростом W(max) ΔO2(мах) возрас-
тает от 0.8 до 1.7 ммоль·л-1 (см. таблицу). Можно
4) TO2• + THmic → ТО2Н + T•mic,
5) T•mic + О2 → TmicO2•,
6) TO2•mic + THmic → TO2Hmic + T•mic,
7) rO2• + rO2• → products,
8) rO2• + TO2• → products,
9) rO2• + TO2•mic → products,
10) TO2• + TO2• → products,
11) TO2• + TO2•mic → products,
12) TO2•mic + TO2•mic → products.
Реакции 1-3 — инициирование цепного процесса
окисления TH, 4-6 — продолжение цепей, 7-12 —
квадратичная гибель ведущих цепи радикалов.
Рис. 4. Зависимость начальной скорости поглощения
Индекс mic обозначает радикал или молекулу Triton
О2 от объема добавленного LH, [ААРН] = 4 ммоль·л-1.
X-100, находящиеся в мицеллах.
Содержание ТН (ммоль·л-1): 1 — 50, 2 — 100, 3 — 150.
Особенности окисления метиллинолеата в мицеллярных буферных растворах Triton X-100
1055
от Triton X-100), в гидрофобном интерьере которых
солюбилизирован LH.
Проведем оценку объема V* мицеллярной фазы, в
которой солюбилизирован LH, использовав данные
таблицы. Например, при введении 10 мкл LH моляр-
ная концентрация которого составляет 3.02 моль·л-1,
в 3 мл реакционной смеси вводится 3.02∙10-5 моль
LH. К моменту установления W(max) поглощается
1.4 ммоль·л-1 О2, т. е. в 3 мл реакционной смеси
образуется 4.2∙10-6 моль гидропероксида (LOOH).
Амфифильные гидропероксиды образуют смешанные
мицеллы с мицеллообразующими ПАВ и облегчают
солюбилизацию гидрофильных соединений в обрат-
ных мицеллах и гидрофобных в водной среде (анало-
Рис. 5. Зависимость максимальной скорости поглощения гично [19, 28]). Полученная величина ΔO2(мах) состав-
от объема добавленного LH, [ААРН] = 4 ммоль·л-1. ляет ~2% от брутто-концентрации ТН. По-видимому,
О2
Содержание ТН (ммоль·л-1): 1 — 50, 2 — 100, 3 — 150.
этого количества гидропероксидов достаточно для
облегчения солюбилизации LH в интерьере смешан-
предположить, что к моменту достижения максималь-
ных мицелл ТН. Эффективная концентрация метил-
ной скорости поглощения кислорода реакционная
линолеата в мицеллярной фазе при W(мах) при объеме
смесь представляет собой смешанные мицеллы Triton
V* равна: [LH]* = {3.02V(LH) — (ΔO2мах·3·10-3)}/V*.
X-100 с образовавшимися гидропероксидами (~2%
Тогда, учитывая, что основной вклад в W(max) вносит
окисление LH, можно предположить:
W(max) = а{[3.02V(LH) - (ΔO2мах·3·10-3)]/V*}Win,
(3)
где а = 3·10-2 (л·моль-1·с-1)0.5 [4-6] — кинетический параметр окисляемости LH при 37°C.
Из уравнения (3) следует, что
V* = а[3.02·V(LH) - (ΔO2мах·3·10-3)]Win/W(max).
(4)
Из сопоставления V* с объемом добавленно-
быть связано с расходованием метиллинолеата как
го LH и с объемами гидрофобной части мицелл и
основного субстрата окисления.
суммарным объемом мицелл вместе с гидратиро-
В пересчете на весь объем реакционной смеси
ванными полярными головками видно, что объема
скорость окисления LH в мицеллярном растворе
мицеллярной фазы вполне достаточно для солюби-
выше, чем в гомогенном растворе с такой же брут-
лизации LH.
то-концентрацией. Зависимость скорости окисления
Проведенная относительно грубая оценка кинети-
от скорости инициирования описывается функцией
ки поглощения кислорода в инициированном АAPH
W(O2) ~ Win, где n — порядок скорости процесса по
окислении LH в мицеллярных растворах ТН показы-
концентрации инициатора, который изменяется от
вает, что коллоидное растворение (солюбилизация)
n = 1 для начальной скорости поглощения кислорода
LH — не мгновенный процесс. При окислении свеже-
до n = 0.6. ТН также участвует в процессе цепного
приготовленного раствора LH в системе мицелл Triton
окисления, что приводит к уменьшению W(O2).
X-100 в начальный период наблюдается увеличение
скорости поглощения кислорода до значения W(max),
Выводы
длительность которого уменьшается с ростом коли-
чества добавленного LH и скорости инициирования.
Проведенный кинетический анализ поглощения
По-видимому, причиной такого эффекта является
О2 в мицеллярной системе с солюбилизированным
то, что с увеличением Wi и [LH] накопление гидро-
легкоокисляющимся субстратом позволил выявить
пероксидов происходит быстрее, а это приводит к
особенности динамики процесса, связанной с обра-
ускорению образования смешанных мицелл. Падение
зованием смешанных мицелл. Происходит полный
скорости окисления после достижения W(max) может
перехват радикалов, генерируемых инициатором,
1056
Лошадкин Д. В. и др.
т. е. увеличивается антиоксидантная активность со-
единений. Эти результаты можно использовать при
[Pliss E. M., Loshadkin D. V., Grobov A. M.,
разработке методики тестирования биоантиокси-
Kuznetsova T. S., Rusakov A. I. Kinetic study and
simulation of methyl linoleate oxidation in micelles //
дантов.
Russ. J. Phys. Chem. B. 2015. V. 9. N 1. P. 127-131.
Конфликт интересов
[10]
Barclay L. R. C., Baskin S. J., Locke S. J.
Авторы заявляют об отсутствии конфликта инте-
Schaefer T. D. Benzophenone-photosensitized
ресов, требующего раскрытия в данной статье.
autoxidation of linoleate in solution and sodium
dodecyl sulfate micelles // Canad. J. Chem. 1987.
V. 65. N 11. P. 2529-2541.
Информация об авторах
[11]
Castle L., Perkins M. J. Inhibition kinetics of chain-
Лошадкин Денис Владимирович, к.х.н., доцент,
breaking phenolic antioxidants in SDS micelles.
Evidence that intermicellar diffusion rates may be
Плисс Евгений Моисеевич, д.х.н., проф.,
rate-limiting for hydrophobic inhibitors such as alpha-
tocopherol // J. Am. Chem. Soc. 1986. V.108. P. 6381-
Касаикина Ольга Тарасовна, д.х.н., проф.,
[12]
Paradies H. Shape and size of a nonionic surfactant
micelle. Triton X-100 in aqueous solution // J. Phys.
Chem. 1980. V. 84. N 6. P. 599-607.
Список литературы
[13]
Jaiswal S., Mondal R., Paul D., Mukherjee S.
[1]
Меньщикова Е. Б., Ланкин В. З., Зенков Н. К.,
Investigating the micellization of the Triton-X
Бондарь И. А., Крутовых Н. Ф., Труфакин В. А.
surfactants: A non-invasive fluorometric and
Окислительный стресс. Прооксиданты и антиокси-
calorimetric approach // Chem. Phys. Lett.
2016.
данты. М.: Слово, 2006. 192 с.
V. 646. P. 18-24.
[2]
Frankel E. N. Lipid Oxidation. Glasgow: The Oily
Press, 2005. P. 259-297.
[14]
Uttam A., Chandrima J., Saptarshi M. Spectroscopic
[3]
Niki E. Lipid peroxidation // Encyclopedia of Radicals
determination of critical micelle concentration in
in Chemistry, Biology and Materials. Chichester, West
aqueous and non-aqueous media using a non-invasive
Sussex: John Wiley & Sons, Ltd, 2012. P. 1577-1598.
method // J. Colloid Interface Sci. 2011. V. 364. N 2.
P. 400-406.
[4]
Avendano C., Menendez J. C. Medicinal chemistry of
anticancer drugs. Amsterdam: Elsevier, 2015. 739 p.
[15]
Racz G., Csay T., Takacs E., Wojnarovits L.
[5]
Denisov E. T., Afanas′ev I. F. Oxidation and antioxidants
Degradation of Triton X-100 surfactant/lipid regulator
in organic chemistry and biology. Boca Raton, FL.:
systems by ionizing radiation in water // J. Radioanal
CRC Press Taylor & Francis Group, 2005. 992 p.
Nucl. Chem. 2017. V. 314. N 2. P.1189-1196. https://
[6]
Рогинский В. А. Кинетика цепного окисления ме-
тиллинолеата в водных растворах додецилсулфа-
[16]
Streletzky K., Phillies G. Temperature dependence of
та натрия // Кинетика и катализ. 1996. Т. 37. № 4.
Triton X-100 micelle size and hydration // Langmuir.
С. 521-527.
1995.V. 11 N 1. P. 42-47.
[7]
Roginsky V. Chain-breaking antioxidant activity of
natural polyphenols as determined during the chain
[17]
Tiller G., Mueller T., Docker M., Sturve W.
oxidation of methyl linoleate in Triton X-100 micelles //
Hydrogenation of Triton X-100 eliminates its
Archives Biochem. Biophys. 2003. V. 414. N 2. P. 261-
fluorescence and ultraviolet light absorption while
preserving its detergent properties // Anal Biochem.
[8]
Roginsky V. A., Tashlitsky V. N., Skulachev V. P.
1984. V. 141. N 1. P. 262-266.
Chain-breaking antioxidant activity of reduced forms
of mitochondria-targeted quinones, a novel type of
[18]
Valdes-Dıaz G., Rodrıgez-Calvo S., Perez-
geroprotectors // Aging. 2009. V. 1. N 5. P. 481-489.
Gramatges A., Rapado-Paneque M., Fernandez-
Lima F. A,. Ponciano C. R., da Silveira E. F. Effects
[9]
Плисс Е. М., Лошадкин Д. В., Гробов А. М., Кузнецо-
of gamma radiation on phase behaviour and critical
ва Т. С., Русаков А. И. Кинетическое исследование
micelle concentration of Triton X-100 aqueous
и моделирование окисления метиллинолеата в ми-
solutions // J. Colloid Interface Sci. 2007. V. 311. N 1.
целлах // Хим. физика. 2015. Т. 34. № 1. С. 67-72.
Особенности окисления метиллинолеата в мицеллярных буферных растворах Triton X-100
1057
[19]
Касаикина О. Т., Менгеле Е. А., Плащина И. Г.
и регистрация лекарственных средств. 2017. № 4.
Окисление неионных поверхностно-активных
С. 180-197.
веществ молекулярным кислородом // Коллоид.
[23]
Перевозкина М. Г. Тестирование антиоксидант-
журн. 2016. Т. 78. № 6. С. 730-734.
ной активности полифункциональных соединений
кинетическими методами. Новосибирск, СибАк,
[Kasaikina O. T., Mengele E. A., Plashchina I. G.
2014. 240 с.
Oxidation of nonionic surfactants with molecular
[24]
Гребенюк А. Ю., Кирпичников М. П., Матич Л. Ю.,
oxygen // Colloid J. 2016. V. 78. N 6. P. 767-771.
Попов В. О., Раввин Н. В., Скрябин К. Г., Соко-
лов А. В., Чулок А. А. Прогноз научно-технологи-
[20]
Нечаев А. П., Николаева Ю. В., Пилипенко О. В.,
ческого развития России: 2030. Биотехнологии /
Дубровин Г. А., Самойлов А. В. Пути повышения
Под ред. Л. М. Гохберга, М. П. Кирпичникова. М.:
стойкости низкожирных спредов к окислению с
Министерство образования и науки Российской
использованием природных антиоксидантов в ми-
Федерации, Национальный исследовательский уни-
целлированной форме // Пищ. пром-сть. 2018. № 3.
верситет «Высшая школа экономики», 2014. 48 с.
С. 11-14.
[25]
Рогинский В. А., Уткин И. В. Кинетика автоокисле-
[21]
Самойлов А. В. Новое слово в отечественной ин-
ния эфиров полиненасыщенных жирных кислот //
дустрии пищевых ингредиентов // Масла и жиры.
Кинетика и катализ. 1991. Т. 32. № 4. С. 814-819.
2016. № 3-4. С. 20-21.
[26]
Frei B., Stocker R., Ames B. Antioxidant defenses and
[22]
Тринеева О. В. Методы определения антиоксидант-
lipid peroxidation in human blood plasma // Proc.
ной активности объектов растительного и синте-
Natl. Acad. Sci. USA. 1988. V. 85. N 24. P. 9748-
тического происхождения в фармации // Разработка