Журнал прикладной химии. 2020. Т. 93. Вып. 8
УДК 541.11
СИСТЕМА КАЛИЙ-СЕРА: ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА,
ЭЛЕКТРОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ И ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ
В ХИМИЧЕСКИХ ИСТОЧНИКАХ ТОКА (обзор)*
© А. Г. Морачевский
Санкт-Петербургский политехнический университет Петра Великого,
195251, г. Санкт-Петербург, Политехническая ул., д. 29
Е-mail: morachevski@mail.ru
Поступила в Редакцию 9 мая 2020 г.
После доработки 18 мая 2020 г.
Принята к публикации 7 июля 2020 г.
В первые два десятилетия XXI века наблюдается значительный рост числа публикуемых исследований,
направленных на совершенствование существующих и разработку новых химических источников тока
(ХИТ) с участием щелочных металлов. В 1990-1991 гг. началось крупномасштабное производство
литий-ионных аккумуляторов. С того времени во многих сотнях, может быть тысячах, работ для
них предлагаются новые анодные и катодные материалы, электролиты, обладающие теми или иными
полезными качествами. Основополагающие исследования в этой области, выполненные в семидесятые--
восьмидесятые годы прошлого века, в 2019 г. отмечены присуждением Нобелевской премии по химии.
С начала XXI века большое число публикуемых работ посвящается также изучению натрий-ионных
аккумуляторов, перезаряжаемых ХИТ на основе систем литий-халькоген и натрий-халькоген, пригод-
ных для использования при комнатной температуре. Начиная с 2013 г. во все возрастающем количе-
стве публикуются экспериментальные исследования в области калий-ионных аккумуляторов, систем
калий-халькоген и калий-кислород (в 2017 г. по тематике, связанной с перезаряжаемыми калиевыми
батареями, опубликовано 72 работы). В данном небольшом обзоре рассмотрены термодинамические
и электрохимические исследования системы калий-сера разных лет, а также опубликованные в самые
последние годы сведения о ХИТ на основе системы калий-сера.
Ключевые слова: система калий-сера; термодинамика полисульфидов калия; термодинамика жидких
сплавов калий-сера; химические источники тока на основе системы калий-сера
DOI: 10.31857/S0044461820080010
Введение
температуры, наиболее информативным представ-
ляется обзор [1] (University of Texas, USA, 2014).
Очень кратко упомянем об основных этапах раз-
Авторы анализируют очень большое число иссле-
вития исследований в области создания перезаряжа-
дований, выполненных по 2013 г. (включительно),
емых ХИТ на основе систем щелочной металл-халь-
рассматривают историю создания ХИТ на основе
коген для комнатной температуры в XXI веке.
системы литий-сера для комнатной температуры,
Из числа различных обобщений, относящихся к
протекающие зарядно-разрядные процессы, катодные
ХИТ на основе системы литий-сера для комнатной материалы (сера и композиты на ее основе), кон-
струкции аккумуляторов, достигнутые технологи-
* Статья публикуется в авторской редакции.
ческие результаты. В обзоре почти исключительно
1067
1068
Морачевский А. Г.
используются работы XXI века, особенно много ра-
на работы разных лет, заметную роль играют публи-
бот, опубликованных в 2010-2013 гг. Достигнутый
кации 2016 (19.8%) и 2017 г. (26.6%).
прогресс в изучении литий-серных батарей и пер-
Большой обзор [11] (Republic of Korea), опублико-
спективы их дальнейшего развития обсуждаются
ванный в 2018 г., посвящен прогрессу, достигнутому
теми же авторами в работе [2].
в разработке перезаряжаемых батарей с участием ка-
Состоянию исследований, связанных с приме-
лия для комнатной температуры. Основное внимание
нением различных анодных и катодных материа-
уделено калий-ионным аккумуляторам, но отдельный
лов, перспективных электролитов, включая твердые
раздел обзора содержит анализ работ, связанных с
электролиты для батарей на основе системы литий-
изучением ХИТ на основе системы калий-сера, об-
сера, посвящены также работы [3, 4]. В обзоре [5]
суждаются работы, опубликованные в 2014-2018 гг.
(Singapore, USA, P. R. China, 2016) особое внимание
Достоинства калий-ионных аккумуляторов, анод-
уделено конструкционным материалам и констру-
ные, катодные материалы, электролиты, конструи-
ированию батарей на основе систем литий-сера с
рование ХИТ и механизм протекающих процессов
высокими энергетическими показателями. Авторами
рассмотрены в обзоре [12] (Australia). Авторами об-
рассмотрено 228 работ, преимущественно опублико-
суждается возможность допирования серой электрод-
ванных в 2010-2016 гг. (62%).
ных материалов, приводятся ссылки на исследования
В большом обзоре Адельгейма с соавторами [6]
перезаряжаемых источников тока на основе систем
(Germany, 2015) сопоставляются системы Li-O2 и
калий-сера и калий-селен. Обзоров, посвященных
Na-O2, Li-S и Na-S. Обзор содержит 267 ссылок в
ХИТ непосредственно на основе системы калий-се-
значительной степени на работы предшествующих
ра, нам пока не известно.
лет (75% ссылки на работы, опубликованные в 2010-
2014 гг.). Авторы очень обстоятельно, в табличной
Фазовая диаграмма системы калий-сера
форме сравнивают теоретические энергетические
характеристики для разрядно-зарядных процессов в
Диаграмма состояния системы калий-сера в обла-
системах на основе Li-S и Na-S.
сти составов K2S-S изучалась неоднократно различ-
В небольшом обзоре [7] кратко рассмотрены опу-
ными методами. По уточненным данным, включен-
бликованные с 2007 по 2017 г. основные исследования
ным в работы [13-15], в системе образуются шесть
в области создания аккумулятора на основе системы
соединений, причем все они плавятся конгруэнтно:
Na-S для комнатной температуры. В большинстве упо-
K2S (т. пл. 948 ± 20°С), K2S2 (487°С), K2S3 (302°С),
мянутых исследований достигается удельная емкость
K2S4 (154°С), K2S5 (206°С) и K2S6 (189°С). По край-
не менее 450-500 мA·ч·г-1 при стабильной циклиру-
ней мере у трех соединений, как это видно из рис. 1,
емости. В обзоре [8] основное внимание уделяется
пики на кривой ликвидуса проявляются очень не-
термодинамическим и электрохимическим исследова-
четко. В сводке [13] отмечается сложность препара-
ниям системы натрий-сера разных лет и применению
тивного синтеза большинства полисульфидов калия.
этой системы в перезаряжаемых ХИТ в расплавлен-
Реакция взаимодействия чистых компонентов начи-
ном состоянии с твердым электролитом и при ком-
нается при слабом их нагревании, сопровождается
натной температуре. В монографии [9] суммированы
большим экзотермическим эффектом и ведет к об-
термодинамические и электрохимические исследо-
разованию только наиболее высокотемпературного
вания систем Na-S и Li-S, рассматриваются области
их применения в перезаряжаемых ХИТ. Приводятся
также сведения о термодинамических свойствах
других систем литий-халькоген и натрий-халько-
ген: Li-Se, Li-Te, Na-Se, Na-Те, обсуждаются пер-
спективы использования их в перезаряжаемых ХИТ.
В 2017 г. появилось первое обобщение исследо-
ваний перезаряжаемых ХИТ с участием калия [10]
(USA, Spain), в основном рассматриваются калий--
ионные батареи для комнатной температуры, сопо-
ставляются их характеристики. Калий-ионные акку-
муляторы привлекают внимание благодаря низкой
цене исходных материалов, надежной ионной про-
водимости электролита, более высокому разрядному
напряжению. В обзоре [10] содержится 109 ссылок
Рис. 1. Фазовая диаграмма системы калий-сера.
Система калий-сера: термодинамические свойства...
1069
из полисульфидов — K2S. Наиболее детально синтез
вочнике [17] эти величины были лишь пересчитаны
полисульфидов калия со ссылками на первоисточни-
с учетом более новых данных о термодинамических
ки рассмотрен в монографии [14].
свойствах веществ, участвующих в рассматриваемом
Термические свойства полисульфидов ка-
процессе. Энтальпия образования в работе [19] полу-
лия в интервале составов от 45 до 82 мас% серы
чена методом фторной калориметрии.
(0.50 ≤ хS ≤ 0.85) при их плавлении и вблизи темпе-
Значения стандартных энтропий для соедине-
ратуры плавления (предплавление) изучались мето-
ний K2S, K2S3, K2S4 в справочнике [17] оценивали
дом дифференциальной сканирующей калориметрии
методом Латимера [20, 21]. Для K2S стандартная
[16]. Авторы отмечают выраженную склонность по-
энтропия рассчитана также методом, предложен-
лисульфидов калия к переохлаждению, что затруд-
° мето-
няет точное определение их температур плавления.
дом Келли [21] приводит к близкому результату:
Вероятная погрешность указанных выше величин
117 Дж·моль-1·K-1. Для соединения K2S5 величина
составляет ±5°С. Авторами подтверждено наличие
° вычислена на основании экспериментального
области расслоения в богатой калием части системы
определения теплоемкости Ср° в интервале темпе-
калий-сера. Границы обширной области расслоения
ратур 10-298 K [23]. Расчет методом Латимера дает
в богатой серой области составов надежно не уста-
° , равное 248.5 Дж·моль-1·K-1. На рис. 2
новлены (рис. 1).
приведена зависимость стандартной энтропии поли-
сульфидов калия от числа атомов серы в молекуле по-
лисульфида. Из графика путем экстраполяции получе-
Термодинамические свойства
° для K2S6, включенное в табл. 1 [15].
полисульфидов калия в твердом состоянии
Теплоемкость полисульфидов калия в твердом со-
Сведения о стандартных термодинамических
стоянии по данным работы [18] приведена в табл. 2.
свойствах полисульфидов калия суммированы в ра-
Экспериментально определенные значения тепло-
ботах [13-16]. В табл. 1 данные приводятся исходя из
емкости заметно выше рассчитываемых по прави-
оригинальных работ и сопоставляются с величинами,
лу аддитивности исходя из значений теплоемкости
рекомендуемыми в справочнике [17]. В работе [18]
чистых компонентов в соответствующем агрегатном
энтальпии образования полисульфидов калия опре-
состоянии.
делены из величин тепловых эффектов их взаимо-
В упоминавшейся монографии [14] со ссылками
действия с 0.1 н. раствором Н2SО4 при 25°С. В спра- на предшествующие справочные издания для эн-
Таблица 1
Термодинамические характеристики полисульфидов калия по данным различных исследований
K2Sх
°
, кДж·моль-1
°
, Дж·моль-1·K-1
° , кДж·моль-1
K2S
-381.0 ± 3.8 [18]
113.6 ± 12.6 [17]
16.1 [16]
-406.2 ± 2.9 [19]
113.0 [22]
-387.0 ± 3.8 [17]
-377.0 [15]
K2S2
-431.0 ± 2.9 [18]
146.4 ± 20.9 [17]
11.2 [23]
–436.8 ± 2.9 [17]
18.3 [16]
K2S3
-467.8 ± 2.1 [18]
179.9 ± 20.9 [17]
16.2 [23]
–473.6 ± 5.0 [17]
14.6 [23]
K2S
-465.7 ± 2.1 [18]
213.4 ± 20.9 [17]
8.31 [23]
–472.0 ± 2.1 [17]
14.2 [23]
11.6 [16]
K2S5
-496.0 ± 2.1 [18]
256.8 ± 2.5 [24]
7.2 [23]
–475.3 ± 1.7 [17]
25.1 [23]
27.0 [16]
K2S6
-468.2 ± 2.9 [18]
285 ± 5 [15]
25.9 [23]
–474.5 ± 2.9 [17]
26.4 [23]
27.6 [16]
1070
Морачевский А. Г.
Таблица 2
Теплоемкость полисульфидов калия в твердом состоянии
Ср, Дж·моль-1·K-1, при Т, K
Соединение
333
373
423
473
523
K2S2
114.35
116.94
120.16
123.39
126.62
K2S3
138.95
133.54
135.25
146.144
167.03
K2S4
172.42
189.45
—
—
—
K2S5
192.88
203.80
217.57
—
—
K2S6
210.71
227.82
249.20
—
—
тальпии образования K2S из чистых компонентов в
°
°
ΔGT
- TΔST
° приводится значение
°
-377 кДж·моль-1. Каких-либо сведений о величинах
=
стандартной энергии Гиббса ΔGT
° в работе [13] не
= -346 кДж для реакции (2), что близко к полученной
° реакции
выше величине (-341 кДж).
С помощью последнего из приведенных уравне-
2K(тв) + S(тв) = K2S(тв)
(1)
° для реакции
использовались следующие значения энтропии участ-
° , Дж·моль-1·K-1): для калия 64.67,
2K(ж) + 2S(ж) = K2S2(тв).
(3)
для серы 32.05, для K2S 113.6. В результате для реак-
ции (1) в соответствии с уравнением
Получены следующие величины: для K2S2 ве-
° равна -406.1 кДж·моль-1. Для моля
ΔGT
° = ΔHT° - TΔST°
K0.5S0.5 — -101.5 кДж·моль-1.
°
= -362.8 кДж·моль-1.
°
=
= -120.9 кДж·моль-1.
Термодинамические свойства жидких сплавов
Расчет для реакции
системы калий-сера
2K(ж) + S(ж) = K2S(тв)
(2)
Впервые активность калия в жидких сплавах с
серой изучалась в 1977 г. методом ЭДС с применени-
°
°
ем в качестве твердого электролита промышленных
для каждого из участников реакции (2) приводит
сортов стекол с содержанием 3.8-5.0 мас% K2O [25].
°
= -341 кДж·моль-1. Соответст-
Наличие в стеклах Na2O не сказывалось на результа-
венно для моля K0.667S0.333 эта величина равна
тах измерений. Исследовалась бедная калием часть
-113.7 кДж·моль-1.
системы: 0.023 ≤ хK ≤ 0.293 (13 составов, 350-450°С).
Расчет этой же величины без учета теплоемкостей
В области составов хK ≤ 0.245 при 450°С ЭДС цепи
компонентов реакции по уравнению
сохраняла практически постоянное значение 2.339
± 0.005 В (10 составов), что указывало на наличие
двухфазной области. Активность калия в жидких
сплавах с серой лежала в зависимости от температу-
ры в пределах (4.3-5.6)·10-17. За границами области
расслоения в работе [25] получены такие значения
ЭДС и термодинамических функций (450°С, ∆GK,
кДж·моль-1):
хK
Е, В
∆GK
аK
0.269
2.182
-210.6
6.2·10-16
Рис. 2. Зависимость стандартной энтропии
0.280
2.170
-209.4
7.4·10-16
S°298 (Дж·моль-1·K-1) полисульфидов калия от числа
атомов серы n в молекуле полисульфида.
0.293
2.128
-205.3
1.5·10-16
Система калий-сера: термодинамические свойства...
1071
Оценка парциальных молярных энтропии и эн-
тальпии компонентов в области расслоения всегда
затруднительна, с термодинамической точки зрения
это детально рассмотрено в монографии [26]. В слу-
чае системы K-S производная dxгр/dT со стороны
калия не равна нулю даже в относительно небольшом
интервале температур (xгр — содержание одного из
компонентов на границе разделе фаз). В системе K-S
температурный коэффициент ЭДС (dЕ/dT) отрицате-
лен при всех составах, с понижением температуры
величина ЭДС растет, что характерно для систем с
весьма сильным взаимодействием компонентов в
жидком состоянии. Зависимость ЭДС от состава в
изученном интервале при температуре 450°С по дан-
ным работы [25] приведена на рис. 3.
Рис. 3. Зависимость ЭДС цепи (-) K|твердый электро-
Позднее, в работе [27] система K-S также изуча-
лит|K, S(+) от состава сплава при температуре 450°С
лась методом ЭДС с применением в качестве твер-
по данным работы [25].
дого электролита с проводимостью по ионам калия
β-глинозема, что позволило охватить более широкий
(-) K|Твердый электролит|K, S (+)
интервал температур: 225-325°С. Изучалась богатая
серой часть системы хK ≤ 0.412.
независимо от природы твердого электролита при
В последней, третьей из известных нам работ по
нагреве и охлаждении ячейки совпадала, но наблю-
изучению термодинамических свойств сплавов калия
далось небольшое систематическое расхождение ре-
с серой (0.065 ≤ хK ≤ 0.412, 230-330°С) применялись
зультатов, полученных со стеклообразным и керами-
как стеклообразный, так и керамический электро-
ческим электролитами [28]. Расхождение достигало
литы [28]. Поскольку промышленные сорта стекол
2.5% в зоне расслоения и было значительно меньше
содержат относительно мало K2O и обладают срав-
в гомогенной области.
нительно высоким электрическим сопротивлением
На основании анализа и сопоставления результа-
при температуре ниже 400°С, было синтезировано
тов экспериментальных исследований [25, 27, 28] в
стекло с высоким содержанием оксида калия следу-
работе [15] для жидких сплавов системы калий-сера
ющего состава (мас%): K2O — 31-34, SiO2 — 56-58,
рекомендуются приводимые в табл. 3 величины.
В2O3 — 9-11. Керамический твердый электролит,
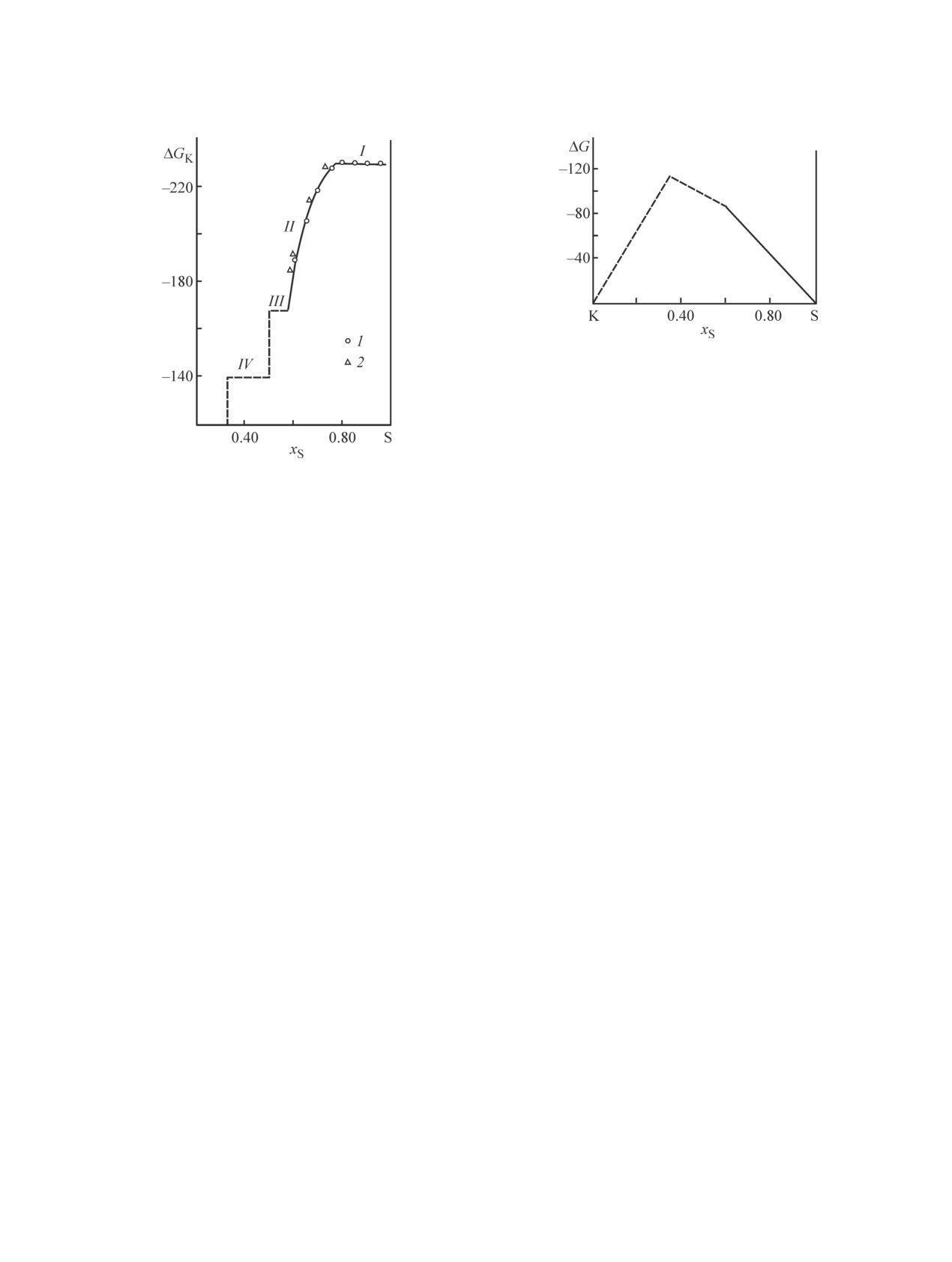
На основании экспериментальных данных для
калиевый β-глинозем, получали путем замены ионов
богатой серой области составов (хS ≥ 0.60) и выпол-
натрия в кристаллической структуре полиалюмината
ненных расчетов в работе [15] построена зависимость
натрия ионами калия [28]. ЭДС цепи
парциальной молярной энергии Гиббса калия ∆GK
Таблица 3
Термодинамические характеристики расплавов системы калий-сера при 325°С
∆GK
∆НK
∆G
∆Н
хK
аK
кДж·моль-1
0.05
8.68·10-21
-229.7
-231.9
-11.3
-11.6
0.10
8.68·10-21
-229.7
-232.0
-22.8
-23.1
0.15
8.68·10-21
-229.7
-232.2
-34.3
-34.6
0.20
8.68·10-21
-229.7
-232.7
-45.7
-46.3
0.25
1.33·10-20
-227.6
-232.8
-57.2
-57.9
0.30
8.25·10-20
-218.5
-227.7
-68.2
-69.4
0.35
1.11·10-18
-205.5
-219.4
-78.4
-80.4
0.40
7.25·10-17
-189.3
-208.9
-87.5
-90.7
1072
Морачевский А. Г.
Рис. 5. Зависимость интегральной молярной энергии
Гиббса ΔG (кДж·моль-1) от состава сплава при 325°С
по данным работы [15].
до 0.390. Для K2S5 при 570 K k = 0.133, а при 670 K —
0.334 Ом-1·см-1. При этом для всех полисульфидов
Рис. 4. Парциальная молярная энергия Гиббса калия
калия зависимость lnk = f(T-1) нелинейна.
ΔGK (кДж·моль-1) при 325°С в разных фазовых обла-
Для подтверждения полной аналогии в электрохи-
стях.
мическом поведении расплавленных полисульфидов
I — две жидкие фазы, II — жидкая фаза, III — K2S5(тв) +
калия и других ионных жидкостей, содержащих соли
+ жидкая фаза, IV — K2S5(тв) + K2S5(тв).
калия, в работе [30] была изучена катодная поляри-
Данные работы: 1 — [15], 2 — [27].
зация сурьмы в расплавленном полисульфиде ка-
лия K2S4 при 240°С. Ранее аналогичные измерения
(рис. 4) и соответствующей интегральной величины
проводились с рядом солевых систем, содержащих
∆G (рис. 5) от состава сплава при 325ºС. По данным
соли калия [31]. Поляризационные кривые снима-
работы [27] для ряда составов системы калий-сера
лись импульсным гальваностатическим методом. На
при 325°С величины ∆GK таковы:
исследуемый электрод последовательно налагались
импульсы тока с нарастающей амплитудой и реги-
Полисульфид Молярная доля
∆GK,
страцией потенциала в момент отключения. Теория
калия
серы xS
кДж·моль-1
метода изложена в монографии [32]. Записывались
K2S5.3
0.726
-228.4
также кривые выключения после поляризации элек-
K2S4
0.666
-215.1
трода током определенной плотности. Электродом
сравнения служил жидкий калий при температуре
K2S3
0.600
-190.8
эксперимента.
K2S2.86
0.588
-186.2
Калий с сурьмой образует ряд соединений: KSb2,
KSb, K5Sb4, K3Sb [14, 33-36]. Все они не имеют ви-
Как видно из рис. 4, величины ∆GK, указанные
димой области гомогенности. На катодной поляриза-
выше, хорошо согласуются с рекомендуемыми зна-
ционной кривой (рис. 6) четко фиксируются четыре
чениями (табл. 3).
участка III-VI, где потенциал остается постоянным,
и два начальных участка I, II, где он незначительно
Катодные процессы
изменяется. Потенциал на участке I соответствует
в полисульфидных расплавах
потенциалу индифферентного стеклоуглеродного
В литературе имеются сведения об электрической
электрода в полисульфидном расплаве данного со-
проводимости расплавленных полисульфидов калия.
става: (2.25 ± 0.01) B [27] (относительно калиевого
Полученные в работе [29] экспериментальные данные
электрода). Повышение плотности тока ведет к кон-
подробно обсуждаются в монографии [14]. Величина
центрационным изменениям у поверхности электро-
электропроводимости (k, Ом-1·см-1) сильно зависит
да и незначительному сдвигу потенциала в сторону
от температуры: для K2S3 при повышении темпера-
меньших значений. При этом на поверхности элек-
туры на 100°, с 570 до 670 K, величина k возрастает с
трода самопроизвольно формируется слой сульфи-
0.199 до 0.548 Ом-1·см-1, повышение температуры с
да сурьмы Sb2S3. Потенциал участка II связывается
560 до 660 K для K2S4 ведет к увеличению k с 0.153
нами с разрядом ионов калия при одновременном
Система калий-сера: термодинамические свойства...
1073
взаимодействии с сульфидом сурьмы, образующийся
полисульфид калия растворяется в полисульфидном
расплаве. Термодинамические расчеты показыва-
ют, что при 513 K (240°С) стандартный потенциал
этого процесса равен (l.84 ± 0.1) В, что близко к ве-
личине потенциала участка II. Строго вертикальные
участки поляризационной кривой III-VI обусловлены
существованием на поверхности электрода двухфаз-
ных областей, в пределах каждой из которых актив-
ность калия остается постоянной. В соответствии с
указанными выше соединениями последовательно
реализуются на поверхности электрода двухфаз-
ные области: Sb + KSb2, KSb2 + KSb, KSb + K5Sb4,
K5Sb4 + K3Sb. Их потенциалы соответственно равны
(В): 1.01 ± 0.02, 0.86 ± 0.02, 0.59 ± 0.01, 0.48 ± 0.01.
Снятие поляризационных кривых аналогичным мето-
дом с применением в качестве электролита солевых
смесей KNO3 + KOH, KNO2 + KNO3 + KOH, KNO2 +
Рис. 6. Катодная поляризационная кривая, полученная
+ KNO3 + CsNO3 привело к весьма близким результа-
на сурьмяном электроде в расплавленном полисульфиде
там, показав, что электрохимическое поведение поли-
калия при 240°С по данным работы [30].
сульфидных расплавов не отличается от обычных лег-
коплавких солевых систем [30, 34] (в кДж ·моль-1):
K2S3. Исходная удельная емкость ХИТ составляла
512.7 мА∙ч∙г-1, после 50 циклов разряда при плотно-
xK,
∆G513
∆G513
Соединение
сти тока 50 мА∙г-1 емкость была 202.3 мА∙ч∙г-1.
мол. доля K
[30]
[34]
В работе [38] (USA) изучалась возможность ис-
1/3KSb2
0.333
-32.4
-34.9
пользования твердого электролита с проводимостью
1/2KSb
0.500
-45.1
-45.3
по ионам калия β-Al2O3 (β-глинозем), его структура
и свойства подробно описаны в монографии [14].
1/9K5Sb4
0.556
-46.3
-47.1
Однако в этом случае процессы заряда и разряда
1/4K3Sb
0.750
-46.5
-50.5
следует проводить при достаточно высоких темпера-
турах, в работе [38] исследования выполнялись при
температурах 100, 150, 200, 240°С.
Применение системы калий-сера
В работе [39] (University of Texas, USA), вероятно,
в перезаряжаемых ХИТ
впервые предложено в качестве анода применять
для комнатной температуры
жидкий сплав K-Na, чтобы избежать образования
Исследования перезаряжаемых источников тока
дендритов при выделении калия в твердом состоя-
для комнатной температуры на основе систем ще-
нии (т. пл. калия 63.55°С), температура плавления
лочной металл-сера (Li-S, Na-S, K-S) в достаточно
эвтектической смеси в системе K-Nа довольно низ-
широких масштабах относятся к XXI веку и проводи-
кая (-12.6°С). Авторы в качестве анодного матери-
лись вслед за изучением соответственно литий-ион-
ала изучали сплавы в интервале составов от 9.2 до
ных, натрий-ионных и калий-ионных аккумуляторов.
58.2 мас% Nа, при 25°С в этом интервале составов
Как уже упоминалось во введении, начало актив-
сплавы были жидкими. Теоретическая удельная ем-
ных исследований перезаряжаемых ХИТ на основе
кость сплавов в жидкой зоне лежала в пределах от
системы калий-сера следует относить к 2013-2014 гг.
579 для чистого калия до 629 мА∙ч∙г-1 для жидкого
Ввиду относительно небольшого числа исследова-
натрия. Анодный сплав находился в пористой угле-
ний, мы кратко рассмотрим их в хронологическом
родной матрице и отделялся от электролита гибкой
порядке. В одной из первых работ, посвященных
пористой мембраной. Катодным материалом служило
непосредственно созданию аккумуляторов на основе
соединение Na2MnFe(CN)6, в которое обратимо вне-
системы калий-сера, были получены обнадеживаю-
дрялись как ионы калия, так и ионы натрия. Батарея
щие результаты [37] (P. R. China). Анодом служил
стабильно циклировалась (400 циклов).
металлический калий, катод — композиты S + C.
Цианоперовскит KхMnFe(CN)6 (0 ≤ х ≤ 2) в каче-
Конечным продуктом разряда был сульфид калия
стве катодного материала, пригодного для обрати-
1074
Морачевский А. Г.
мого внедрения ионов калия, подробно изучался в
тикой дальнейшего восстановительного процесса.
работе [40] (USA), отмечается его низкая стоимость
В работе [46] (Hong Kong) предлагается эффектив-
и достаточно высокие энергетические показатели.
ный катализатор (1-methylimidazole solvated-copper),
Рассматриваемый катодный материал пригоден также
ускоряющий процесс образования K2S. Это повы-
для обратимого внедрения ионов Li+ и Na+.
шает величину обратимой емкости в расчете на се-
Лиу с соавторами [41] (P. R. China) применили для
ру до 922 мА∙ч∙г-1 и величину разрядного напряже-
ХИТ на основе системы K-S при комнатной темпе-
ния до 1.93 В. Достигаемая удельная энергия равна
ратуре в качестве катодного материала нанокомпо-
1779 Вт∙ч∙кг-1 (в расчете на серу). Авторами выпол-
зит, включающий серу и продукты пиролиза поли-
нен комплекс структурных исследований.
акрилонитрила. Нанокомпозит обладает обратимой
По данным работы [47] (P. R. China), применение
емкостью 270 мА∙ч∙г-1 (710 мА∙ч∙г-1 в расчете на
при комнатной температуре и карбонатном электро-
чистую серу). Отмечаются высокие эксплутационные
лите в качестве катодного материала допированного
качества катодного материала, стабильная циклиру-
иодом сульфуризованного полиакрилонитрила (iodine
емость. Изученный катодный материал может быть
doped sulfurized polyacrylonitrile) позволяет полу-
использован как в батареях на основе системы K-S,
чить для батареи на основе системы K-S высокие энер-
так и в калий-ионных аккумуляторах.
гетические показатели при стабильном циклировании.
Хвангом и другими авторами из Республики Корея
В работе китайских авторов [48], как и в ранее
[42] изучена батарея на основе системы K-S, в кото-
рассмотренном исследовании [39], чтобы избежать
рой используется католит из полисульфидов калия
образования дендритов в батарее на основе системы
и анод, не содержащий свободного металла (калия).
K-S при комнатной температуре, применялся жидкий
Батарея характеризуется высокой степенью безо-
сплав K-Na. Его состав варьировался в пределах от
пасности при эксплуатации. В другой работе тех же
41.8 до 90.8 мас% калия. Катодом служил наноком-
корейских авторов [43] демонстрируются высокие
позит SPAN. Батарея имела емкость 513 мА∙ч∙г-1,
показатели при циклировании при комнатной темпе-
после циклирования (100 циклов) при плотности тока
ратуре батареи на основе системы K-S с катодом из
35 мА∙г-1 сохранялась емкость 490 мА∙ч∙г-1.
композита, включающего сульфуризованный поли-
Группой авторов из Китая и США [49] сообщается
акрилнитрил (sulfurized polyacrylonitril, SPAN).
об использовании в батарее на основе системы K-S
Работа [44] (University of Texas, USA) представляет
при комнатной температуре в качестве катодного
собой обстоятельное исследование зарядно-разряд-
материала микропористого углерода, пропитанного
ных процессов в элементе на основе системы K-S
серой. При этом по данным авторов молекулы серы
при комнатной температуре электрохимическими и
не S8, как это обычно считают, а Sn (n ≤ 3). В таком
спектроскопическими методами. Авторы подробно
случае обратимая емкость достигает 1198.3 мА∙ч∙г-1
описывают все материалы, используемые при кон-
и после 150 циклов составляет 869.9 мА∙ч∙г-1 (72%
струировании ячейки, методы исследования. Катодный
от исходной). Проведенное исследование должно
композит отделялся от электролита сепаратором, в
оказать влияние на последующую разработку ХИТ
состав электролита входило соединение KCF3SO3
на основе системы K-S. Обсуждается возможность
(1.0 M). Авторы особо отмечают высокую степень
образования K2S в качестве финального продукта
использования серы в зарядно-разрядных процессах.
разрядного процесса.
Проблеме наиболее полного использования серы,
В работе [50] (P. R. China) показана возможность
условиям достижения наиболее высокой удельной
значительного повышения энергетических характе-
емкости батареи на основе системы K-S посвящена
ристик батареи на основе системы K-S путем при-
также работа [45] (P. R. China, USA). Авторами опи-
менения высококонцентрированных электролитов (до
сан синтез полисульфидов K2S2 и K2S3, изучено их
5 М). Процесс разряда описывается последователь-
электрохимическое поведение, получены спектроско-
ными стадиями: S8 K2S6 K2S5 K2S4 K2S3.
пические характеристики ионов. Работа существенно
Высокая концентрация основного компонента в
дополняет имеющиеся сведения о механизме процес-
электролите способствует уменьшению самопроиз-
сов в аккумуляторах на основе системы K-S.
вольного растворения полисульфидов в электролите,
Причины достигаемых в батареях на основе си-
позволяет приблизить достигаемые энергетические
стемы K-S довольно малой величины удельной ем-
характеристики на каждой из стадий к теоретиче-
кости (около 560 мА∙ч∙г-1 в расчете на серу) и низкого
ским значениям, повысить суммарные показатели
разрядного напряжения (около 1.5 В) заключаются
батареи. Авторами [50] выполнен большой комплекс
в образовании при разряде полисульфида с высо-
электрохимических и спектроскопических исследо-
ким содержанием серы (K2S3) и замедленной кине-
ваний. Работа способствует углублению понимания
Система калий-сера: термодинамические свойства...
1075
процессов, происходящих при разряде батарей на ос-
Na, K) при комнатной температуре [52] (368 ссы-
нове системы K-S, подтверждает их перспективность.
лок, преимущественно на работы, опубликованные в
Китайскими авторами [51] описаны приготовление
2015-2017 гг., 61%). В другой работе в общем плане
серного катода (confined and covalent sulfur, CCS) и
рассматриваются энергетические характеристики
его применение в элементе калий-сера при комнат-
систем металл (Li, Na, K, Mg)-сера, возможноcти
ной температуре. При циклировании (300 циклов)
применения их в устройствах для хранения энер-
в интервале 0.8-3.0 В сохраняется 88.3% исходной
гии [53] (101 ссылка). К числу обобщений в этой же
емкости. Следует также отметить, что в работе [51]
области можно отнести работу [54] (mini-review).
приводится довольно обширный библиографический
В работе [55] проведен термодинамический анализ
список исследований ХИТ на основе систем щелоч-
широкого круга электрохимических систем, в кото-
ной металл (Li, Na, K-сера, 66 ссылок, 86% относится
рых в качестве анодного материала используются Li,
к работам, опубликованным в 2015-2018 гг.).
Na, Mg, Zn, в число катодных материалов включена
сера. Работа опубликована в 2011 г., когда системы
с калием еще не рассматривались. Мы упоминаем
Заключение
эту работу ввиду содержащейся в ней полезной ин-
Данный обзор посвящен прежде всего термодина-
формации об энергетических возможностях систем,
мическому описанию сплавов системы калий-сера в
конкурирующих с калиевыми системами.
твердом и жидком состояниях. Он продолжает цикл
Сопоставим энергетические характеристики про-
обобщающих работ термодинамической направлен-
цессов заряда и разряда для систем щелочной металл
ности, ранее опубликованных в Журнале прикладной
(Li, Na, K)-сера по данным работы [53], приняв для
химии (Russ. J. Appl. Chem.) в 2015-2020 гг. (указаны
всех трех металлов (Ме) одну и ту же схему:
год и номер журнала): Li-Si (2015, № 4), Li-Sn (2015,
Разряд
№ 7), Li-Sb (2015, № 11), Li-Se и Na-Se (2016, № 7),
2Me + 1/8S8
Me2S.
Заряд
Li-Ge (2016, № 10), Na-S (2017, № 5), Na-Те (2017,
№ 10), Na-Sn (2018, № 11), Na-Sb (2019, № 3), Li-Te
В табл. 4 приведены стандартная энергия Гиббса
(2020, № 3). В этих работах с максимальной полно-
(∆G°, кДж∙моль-1), теоретическое значение напряже-
той учтены и анализируются опубликованные ког-
ния (Е°, В), величины удельной энергии для единицы
да-либо исследования термодинамических свойств
массы и объема (Wтеор, В∙ч∙кг-1 и В∙ч∙л-1), величины
указанных систем и приводятся примеры их примене-
удельной емкости (qтеор, мА∙ч∙г-1 и мA∙ч∙см-3 в рас-
ния в ХИТ без попыток полноты охвата работ в этой об-
чете на металл).
ласти. Такой же подход относится и к данному обзору.
Как уже отмечалось во введении, благодаря ши-
В самые последние годы (2017-2019) перезаряжа-
рокой распространенности, низкой цене, высокой
емые батареи для комнатной температуры с участием
теоретической удельной емкости сера является весь-
калия (калий-ионные аккумуляторы, ХИТ на основе
ма привлекательным компонентом для ХИТ с уча-
систем калий-сера, калий-кислород) привлекают
стием щелочных металлов — лития, натрия или ка-
довольно большое внимание, появились не только экс-
лия. В настоящее время из числа систем щелочной
периментальные исследования, но и ряд обобщающих
металл-сера коммерциализированы в ограниченном
работ. Кроме уже упоминавшихся во введении обзоров
объеме только перезаряжаемые ХИТ на основе систе-
[10, 11] к их числу относятся обзоры, в которых основ-
мы Na-S для использования при температуре выше
ное внимание уделяется сопоставлению энергетиче-
300°С. Их основное назначение — стационарные
ских характеристик гибких батарей (flexible batteries)
батареи для аккумулирования энергии, выравнива-
на основе серы и различных щелочных металлов (Li,
ния графика нагрузок [7-9, 56-58]. При разработке
Таблица 4
Энергетические характеристики разрядно-зарядного процесса для систем щелочной металл-сера
(пояснения в тексте)
Wтеор
qтеор
Ме
∆G°
Е°
мас.
объем
мас.
объем
Li
-432.6
2.24
2615
4289
3861
2062
Na
-357.8
1.85
1273
2363
1166
1128
К
-362.7
1.88
914
1590
686
587
1076
Морачевский А. Г.
аккумуляторов Nа-S в «среднетемпературном» вари-
утилизации свинец многократно включается в сфе-
анте в семидесятые-восьмидесятые годы прошлого
ру материального производства, относительно мало
века предполагалось их широкое применение для
теряется в процессе промышленного использования
транспортных средств и в аэрокосмической технике,
[64, 65]. Сбор и переработка литиевых ХИТ представ-
однако в дальнейшем основным объектом приме-
ляются достаточно проблематичными.
нения стали считать только стационарные батареи
Анализ состояния исследований ХИТ на основе
для аккумулирования энергии [7-9]. Центральной
систем литий-сера и натрий-сера позволяет предпо-
задачей в направлении совершенствования такого
ложить, что в обозримом будущем замена литиевых
типа аккумуляторов является подбор твердого элек-
ХИТ на аналогичные по классу натриевые ХИТ хотя
тролита на неорганической или органический осно-
бы частично, вероятно, возможна. ХИТ на основе
ве, совместимого с расплавленными натрием и его
системы Na-S имеют больше шансов для коммерци-
полисульфидами и обладающего высокой ионной
ализации, чем ХИТ на основе литий-сера.
проводимостью [56-58]. Начиная приблизительно
В то же время коммерциализация калиевых ХИТ
с 2013 г. появилось большее число исследований,
на основе систем K-S и K-O2 даже для узкого кру-
показавших возможность применения системы на-
га стационарных объектов, несмотря на ценовые и
трий-сера для создания перезаряжаемых ХИТ, при-
некоторые энергетические преимущества, представ-
годных для работы при комнатной температуре. Был
ляется маловероятной. Батареи с использованием
устранен основной недостаток — необходимость
металлического калия или его сплавов с натрием в
работы при относительно высокой температуре и
жидком состоянии всегда будут более взрыво- и по-
сохранено главное достоинство — дешевые исходные
жароопасны, чем натриевые или литиевые ХИТ. Да
материалы, природные запасы которых практически
и промышленное производство калия существенно
не ограничены. Подробно это рассмотрено в работах
сложнее, чем натрия [14, 59].
[8, 9], содержащих большое число ссылок на ори-
гинальные исследования, выполненные преимуще-
Конфликт интересов
ственно в Китае и Японии. Технология производства
натрия высокой чистоты, пригодного для применения
А. Г. Морачевский заявляет, что он является чле-
в качестве теплоносителя в атомных реакторах, хоро-
ном редколлегии Журнала прикладной химии.
шо известна [59]. Наряду с уже упомянутыми обоб-
щениями [1-5, 9] аккумуляторам на основе системы
Информация об авторах
литий-сера посвящен отдельный раздел в большом
обзоре [60], обзоры [61, 62].
Морачевский Андрей Георгиевич, д.т.н., проф.,
Высокие значения удельной емкости системы Li-S
главный научный сотрудник СПбГУ,
(в расчете на серу) 1675 мА∙ч∙г-1 и удельной энергии
2300 Вт∙ч∙кг-1 в расчете на серный катод и литиевый
анод [60] делают эту систему весьма перспективной,
Список литературы
однако имеется целый ряд проблем с конструировани-
ем прежде всего серного катода. Одна из них заклю-
[1] Manthiram A., Fu Y., Chung S.-H., Zu C., Su Y.-S.
чается в довольно высокой растворимости высших
Rechargeable lithium-sulfur batteries // Chem. Rev.
полисульфидов лития (Li2Sn, n > 4) в обычно приме-
2014. V. 114. P. 11751-11787.
няемых растворах электролитов. Большее число ис-
[2] Manthiram A., Chung S.-H., Zu C. Lithium-sulfur
следований, рассмотренных в обзоре [60], посвящено
batteries: Progress and prospects // Adv. Mater. 2015.
изучению серного катода. Эта проблема имеет ре-
V. 27. P. 1980-2006.
шения. Главная проблема, связанная с литиевыми
[3] Nagao M., Imade Y., Narisawa H., Kobayashi T.,
Watanabe R., Yokoi T., Tatsumi T., Kanno R. // All-
батареями, заключается в высоких ценах на литий и
solid-state Li-sulfur batteries with mesoporous
его соли, ограниченности природных запасов лития.
electrode and thio-LISICON solid electrolyte // J.
Сделаем небольшое отступление. Свинец, запасы
Power Sourses. 2013. V. 222. P. 237-242.
которого в природе не беспредельны (по приводимым
[4] Rosenman A., Markevich E., Salitra G., Aurbach D.,
в справочнике [63] данным, содержание свинца в
Garuch A., Chesnau F. F. Review on Li-sulfur battery
земной коре 4∙10-3, лития — 6.5∙10-3 мас%), в широ-
systems: An integral perspective // Adv. Energy Mater.
чайших масштабах более ста лет используется для
2015. V. 5. Article N 1500212. P. 1-21.
производства свинцовых аккумуляторов. В цивили-
[5] Seh Z. W., Sun Y., Zhang Q., Cui Y. Designing high-
зованных странах благодаря хорошо поставленным
energy lithium-sulfur batteries // Chem. Soc. Rev.
сбору выработавших свой ресурс аккумуляторов и их
2016. V. 45. P. 5605-5634.
Система калий-сера: термодинамические свойства...
1077
[6]
Adelheim P., Hartmann P., Bender C.L., Busche
[21]
Морачевский А. Г., Сладков И. Б., Фирсова Е. Г.
M., Eufinger C., Janek J. From lithium to sodium:
Термодинамические расчеты в химии и металлур-
Cell chemistry of room temperature sodium-air and
гии. СПб: Лань, 2018. 208 с.
sodium-sulfur batteries // Beilstein J. Nanotechnol.
[22]
Воронин Г. Ф. Оценка стандартной энтропии хи-
2015. V. 6. P. 1016-1055.
мических соединений // ЖФХ. 1970. T. 44. № 12.
[7]
Морачевский А. Г., Попович А. А., Демидов А. И.
С. 3013-3017.
Натрий-серный аккумулятор: новые направления
[23]
Bousquet J., Letoffe J.-M., Diot M. Study of the
развития // Науч.-техн. ведомости СПбПУ. 2017.
thermal properties for K polysulfides between 298 and
Т. 23. № 4. С. 110-117.
700 K // J. Chim. Phys. 1974. T. 71. N 9. Р. 1180-1184.
[8]
Морачевский А. Г., Демидов А. И. Система натрий-
[24]
Diot M., Letoffe J.-M., Prost M., Bousquet J.
сера: фазовая диаграмма, термодинамические
Contribution to the study of K2S5 // Bull. Soc. Chim.
свойства, электрохимические исследования, при-
Fr. 1972. N 12. P. 4490-4493.
менение в химических источниках тока в расплав-
[25]
Майорова Е. А. Термодинамические свойства раз-
ленном и твердом состояниях // ЖПХ. 2017. Т. 90.
бавленных растворов натрия или калия в различ-
№ 5. С. 521-536 [Morachevskii A. G., Demidov A. I.
ных жидких металлах и халькогенах: Автореф.
Sodium-sulfur system: Phase diagram, thermodynamic
канд. дис. Л., 1977. 15 с.
properties, electrochemical studies und use in
[26]
Герасимов Я. И., Гейдерих В. А. Термодинамика
chemical current sources in the molten and solid states
растворов. M.: Изд-во Моск. ун-та, 1980. 184 с.
// Russ. J. Appl. Chem. 2017. V. 90. N 5. P. 651-675].
[27]
Crosbie G. M. Thermodynamic and physical properties
[9]
Морачевский А. Г., Демидов А. И. Термодинамика
of molten K polysulfides from open-circuit voltage
и электрохимия систем литий-халькоген и на-
measurements // J. Electrochem. Soc. 1982. V. 129.
трий-халькоген. СПб: Лань, 2019. 204 с.
N 12. Р. 2707-2711.
[10]
Kim H., Kim J. C., Bianchini M., Seo D.-H.,
[28]
Морачевский А. Г., Шаривкер В. С., Клебанов Е. Б.,
Rodriguez-Garcia J., Ceder G. Recent progress and
Майорова Е. А. Термодинамика взаимодействия
perspective in electrode materials for K-ion batteries //
калия с серой в расплавленном состоянии // ЖПХ.
Adv. Energy Mater. 2017. Article N 1702384. Р. 1-15.
1988. Т. 61. № 1. С. 2311-2314 [Morachevskii A. G.,
[11]
Hwang J.-Y., Myung S.-T., Sun Y.-K. Recent progress in
Sharivker V. S., Klebanov E. B., Maiorova E. A.
rechargeable potassium batteries // Adv. Funct. Mater.
Thermodynamics of potassium with sulfur in the
2018. Article N 1802938. Р. 1-45.
molten state // J. Appl. Chem. USSR. 1988. V. 61.
[12]
Zhang W., Liu Y., Guo Z. Approaching high-
N 10. Р. 2117-2119].
performance potassium-ion batteries via advanced
[29]
Cleaver B., Davies A. J., Hames M. D. The electrical
design strategies and engineering // Sci. Advances.
conductiviti of fused sodium and potassium
2019. V. 5. eaav 7412. P. 1-13.
polysulfides // Electrochim. Acta. 1973. V. 18. N 10.
[13]
Sangster J., Pelton A. D. The K-S (potassium-sulfur)
Р. 719-726.
system // J. Phase Equilib. 1997. V. 18. N 1. P. 82-88.
[30]
Морачевский А. Г., Клебанов Е. Б., Шаривкер В. С.,
[14]
Морачевский А. Г., Белоглазов И. Н. Касым-
Ерофеева Г. И. Катодная поляризация твердой
баев Б. А. Калий: свойства, производство, приме-
сурьмы в расплавленном полисульфиде калия
нение. М.: Руда и металлы, 2000. 192 с.
// Электрохимия. 1989. Т. 25. № 10. С. 1392-
[15]
Морачевский А. Г. Майорова Е. А. Термодинами-
1393.
ческий анализ взаимодействия компонентов в систе-
[31]
Клебанов Е. Б., Шибаловская И. И., Морачев-
ме калий-сера // ЖПХ. 2002. Т. 75. № 10. С. 1615-1619.
ский А. Г. Термодинамические свойства соедине-
[16]
Janz G. J., Rogers D. J. Melting and premelting
ний калия с сурьмой // Изв. вузов. Цв. металлургия.
properties for a series of K polysulfides // J. Chem.
1987. № 4. С. 35-37.
Eng. Data. 1983. V. 28. N 3. P. 331-335.
[32]
Морачевский А. Г., Воронин Г. Ф., Гейдерих В. А.,
[17]
Термические константы веществ / Под ред.
Куценок И. Б. Электрохимические методы иссле-
В. П. Глушко. Вып. 10. Ч. 2. М.: ВИНИТИ АН
дования в термодинамике металлических систем.
СССР, 1981. 441 с.
М.: ИКЦ «Академкнига», 2003. 334 с.
[18]
Letoffe J.-M., Joly R. D., Thoureu J., Perachon G.,
[33]
Sangster J., Pelton A. D. The K-Sb (Potassium-
Bousquet J. Determination of the enthalpies formation
Antimony) system // J. Phase Equilib. 1993. V. 14.
of K polysulfides // J. Chim. Phys. 1974. T. 71. N 3.
N 4. Р. 510-514.
Р. 427-430.
[34]
Морачевский А. Г., Бочагина Е. В. Термодинами-
[19]
Johnson G. K., Steele W. V. The standart enthalpy of
ческий анализ процессов сплавообразования в
formation of K2S by fluorine bomb calorimetry // J.
системе калий-сурьма // ЖПХ. 2000. Т. 73. № 11.
Chem. Thermodyn. 1981. V. 13. N 10. P. 985-990.
С. 1790-1794.
[20]
Латимер В. М. Окислительные состояния элемен-
[35]
Морачевский А. Г., Демидов А. И. Термодинамика
тов и их потенциалы в водных растворах. М.: ИЛ,
и электрохимия сплавов сурьмы со щелочными
1954. 397 с.
металлами. СПб: Политех-пресс, 2018. 146 с.
1078
Морачевский А. Г.
[36]
Schlesinger M. E. Thermodynamic properties of
sulfur cathodes // ACS Nano. 2019. V. 13. Р. 2536-
solid binary antimonides // Chem. Rev. 2013. V. 113.
2543.
Р. 8066-8092.
[50]
Wang L., Bao J., Liu Q., Sun C.-F. Concentrated
[37]
Zhao Q., Hu Y., Zhang K., Chen J. Potassium-sulfur
electrolytes unlock the full energy potential of
batteries: A new member of room-temperature
potassium-sulfur battery chemistry // Energy Storage
rechargeable metal-sulfur batteries // Inorg. Chem.
Mater. 2019. V. 18. Р. 470-475.
2014. V. 53. Р. 9000-9005.
[51]
Ma R., Fan L., Wang J., Lu B. Confined and covalent
[38]
Lu X., Bowden M. E., Sprenkle V. L., Liu J. A low cost,
sulfur for stable room temperature potassium-sulfur
high energy density, and long cycle life potassium-
battery // Electrochim. Acta. 2019. V. 293. Р. 191-198.
sulfur battery for grid-scale energy storage // Adv.
[52]
Peng H.-J., Huang J.-Q., Zhang Q. // A review of
Mater. 2015. V. 27. Р. 5915-5922.
flexible lithium-sulfur and analogous alkali metal-
[39]
Xue L., Gao H., Zhou W., Xin S., Park K., Li Y.,
chalogen rechargeable batteries // Chem. Soc. Rev.
Goodenough J. Liquid K-Na alloy enables dendrite-
2017. V. 46. Р. 5237-5288.
free potassium batteries // Adv. Mater. 2016. V. 28.
[53]
Medenbach L., Adelheim P. Cell consepts of metal-
Р. 9608-9612.
sulfur batteries (Metal = Li, Na, K, Mg): Strategies
[40]
Xue L., Li Y., Gao H., Zhou W., Lü X.,
for using sulfur in energy storage applications // Top.
Kaveevivitchai A., Manthiram A., Goodenough J. B.
Curr. Chem. (Z). 2017. 375:81. P. 1-25.
Low cost high energy potassium cathode // J. Am.
[54]
Eftekhari A., Jian Z., Ji X. Potassium secondary
Chem. Soc. 2017. V. 139. Р. 2164-2167.
batteries // ACS Appl. Mater. Interfaces. 2017. V. 9.
[41]
Liu Y., Wang W., Wang J., Zhang Y., Zhu Y., Chen Y.,
Р. 4404-4419.
Fu L., Wu Y. Sulfur nanocomposite as a positive
[55]
Zu C.-X., Li H. Thermodynamic analysis on energy
electrode material for rechargeable potassium-sulfur
densities of batteries // Energy Environ. Sci. 2011.
batteries // Chem. Commun. 2018. V. 54. Р. 2288-2291.
V. 4. Р. 2614-2624.
[42]
Hwang J.-Y., Kim H. M., Yoon C. S., Sun Y.-K.
[56]
Hueso K. B., Armand M., Rojo T. High temperature
Toward high-safety potassium-sulfur batteries using a
sodium batteries: Status, challenges and future trends
potassium polisulfides catholite and metal-free anode
// Energy Environ. Sci. 2013. V. 6. Р. 734-749.
// ACS Energy Lett. 2018. V. 3. N 3. Р. 540-541.
[57]
Kim H., Jeong G., Kim Y. U., Kim J. U., Park C. M.,
[43]
Hwang J.-Y., Kim H. M., Sun Y.-K. High performance
Sohn H. J. Metallic anodes for next generation
potassium-sulfur batteries based on a sulfurized
secondary batteries // Chem. Soc. Rev. 2013. V. 42.
polyacrylonitrite cathodes and polyacrylic acid binder
N 23. Р. 9011-9034.
// J. Mater. Chem. A. 2018. V. 6. N 30. Р. 14587-14593.
[58]
Kumar D., Kumar Rajouria S., Kuhar S. B.,
[44]
Yu X., Manthiram A. A reversible nonaqueous
Kanchan D. K. Progress and prospects of sodium
room-temperature potassium-sulfur chemistry for
batteries: A review // Solid State Ionics. 2017. V. 312.
electrochemical energy storage // Energy Storage
Р. 8-16.
Mater. 2018. V. 15. P. 368-373.
[59]
Морачевский А. Г., Шестеркин И. А., Буссе-Ма-
[45]
Gu S., Xiao N., Wu F., Bai Y., Wu C., Wu Y. Chemical
чукас В. Б., Клебанов Е. Б., Козин Л. Ф. Натрий.
syntesis of K2S2 and K2S3 for probing electrochemical
Свойства, производство, применение / Под ред.
mechanisms in K-S batteries // ACS Energy Lett.
А. Г. Морачевского. СПб: Химия, 1992. 312 с.
2018. V. 3. Р. 2858-2864.
[60]
Шиппер Ф., Аурбах Д. Прошлое, настоящее и буду-
[46]
Lai N.-С., Cong G., Lu Y.-C. A high-energy potassium-
щее литий-ионных аккумуляторов: краткий обзор
sulfur battery enabled by facile and effective
// Электрохимия. 2016. Т. 52. № 12. С. 1220-1258.
imidazole — solvated copper catalysts // J. Mater.
[61]
Yin Y.-X., Xin S., Guo Y.-G., Wan L.-J. Lithium-sulfur
Chem. A. 2019. V. 7. N 36. Р. 20584-20589.
batteries: Electrochemistry, materials, and prospects //
[47]
Ma S., Zuo P., Zhang H., Yu Z., Cui C., He M.,
Angew. Chem. Int. Ed. 2013. V. 52. N 23. Р. 13186-
Yin G. Iodine-doped sulfurized polyacrylonitrile with
13200.
enhanced electrochemical performance for room-
[62]
Lin Z., Liang C. Lithium-sulfur batteries: From liquid to
temperature sodium-potassium sulfur batteries //
solid cells // J. Mater. Chem. A. 2015. V. 3. Р. 936-958.
Chem. Commun. 2019. V. 55. Р. 5267-5270.
[63]
Свойства элементов: Справ. изд. В 2 кн. Кн. 1 / Под
[48]
Zhang Y., Lou J., Shuai Y., Chen K., He X., Wang Y.,
ред. М. Е. Дрица. М.: Металлургия, 1997. 432 с.
Li N., Zhang Z., Gan F. A novel rechargeable
[64]
Морачевский А. Г. Физико-химия рециклинга свин-
potassium sulfur battery based on liquid alloy anode
ца. СПб: Изд-во Политехн. ун-та, 2009. 209 с.
// Mater. Lett. 2019. V. 242. Р. 5-8.
[65]
Морачевский А. Г. Отработанные свинцовые ак-
[49]
Xiong P., Han X., Zhao X., Bai P., Liu Y., Sun J., Xu Y.
кумуляторы — важнейший источник вторичного
Room-temperature potassium-sulfur batteries enabled
свинца // Науч.-техн. ведомости СПбГПУ. 2014.
by microporous carbon stabilized small-molecule
№ 4. С. 127-137.