1098
Беспрозванных Н. В. и др.
Журнал прикладной химии. 2020. Т. 93. Вып. 8
УДК 544.2:544.723:544.47
СИНТЕЗ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА СЛОЖНЫХ ОКСИДОВ
K2MexTi8-xO16 (Me = Mg, Ni, Al) СО СТРУКТУРОЙ ТИПА ГОЛЛАНДИТА
© Н. В. Беспрозванных1*, О. Ю. Синельщикова1**, Н. А. Морозов1,
С. К. Кучаева1, А. Ю. Постнов2
1 Институт химии силикатов им. И. В. Гребенщикова РАН,
199034, г. Санкт-Петербург, наб. Макарова, д. 2
2 Санкт-Петербургский государственный технологический институт (технический университет),
190015, г. Санкт-Петербург, Московский пр., д. 26
Поступила в Редакцию 13 декабря 2019 г.
После доработки 24 февраля 2020 г.
Принята к публикации 27 мая 2020 г.
Изложены результаты физико-химического исследования материалов со структурой типа гол-
ландита, синтезированных двумя способами — твердофазным и пиролизом цитратно-нитратных
композиций, в системе K2O-MeO(Mе2O3)-TiO2 (Ме = Al, Ni, Mg). Применение метода пиролиза
позволило получить материалы с более развитой удельной поверхностью, чем при использовании
традиционного твердофазного синтеза и, как следствие, с повышенной сорбционной активностью в
отношении модельного красителя — метиленового голубого (для K2MgTi7O16 q = 18.75 мг·г-1). Наи-
лучшие каталитические свойства в реакциях окисления СО и Н2 показал образец K2Al2Ti6O16, также
полученный с использованием пиролиза. Окисление водорода на 95% происходило на данном составе
при температуре 355°С и соответствовало производительности ~0.21∙10-5 моль·г-1∙с-1, что в 2 раза
больше, чем при катализе на образце того же состава, но приготовленном твердофазным методом.
Проведенные эксперименты подтверждают перспективность применения голландитов в качестве
сорбентов и катализаторов газоочистки.
Ключевые слова: голландиты; сорбция; фотокатализ; окисление СО и Н2; ширина запрещенной зоны
DOI: 10.31857/S0044461820080046
Адсорбция с последующим гетерогенным фотока-
особенности структуры, позволяющей широко ва-
тализом — один из наиболее перспективных процес-
рьировать их состав, недостаточно изучена, однако
сов, применяемых в очистке сточных вод от органи-
имеющиеся исследования [8, 9] показывают актуаль-
ческих загрязнителей. В настоящее время наиболее
ность изучения фотокаталитических и оптических
активно используемым и изученным материалом для
свойств соединений данного типа. Также следует
этого процесса является диоксид титана. В последние
отметить, что полученные методом кристаллизации
годы многие исследования направлены на увеличение
в расплаве солей частицы калий-магниевого титаната
его фотокаталитической активности путем измене-
со структурой типа голландита обладают высоким
ния условий синтеза TiO2 и получения материалов
коэффициентом отражения в ближнем ИК-диапазоне,
с более развитой поверхностью [1] допированием
это важно для огнеупорных материалов и теплоотра-
различными элементами [2, 3], а также формировани-
жающих покрытий [10].
ем сложных оксидов [4-7]. Перечисленные подходы
Изучение электрофизических характеристик ке-
позволяют сдвинуть поглощение электромагнитного
рамики на основе целого ряда голландитовых фаз
излучения в видимую область солнечного спектра, а
показало низкие значения проводимости при ком-
также за счет формирования гетеропереходов снизить
натной температуре, а также достаточно высокую
вероятность электрон-дырочной рекомбинации.
K-ионную проводимость в районе 700-1000°С, со-
Фотокаталитическая активность сложных тита-
провождающуюся для некоторых составов аномально
натов со структурой типа голландита, несмотря на высоким ростом диэлектрической проницаемости
Синтез и физико-химические свойства сложных оксидов...
1099
[11-14]. Такое сочетание свойств делает, по мнению
Как и при твердофазном синтезе, соотношение ме-
авторов [11], керамику на основе голландитовых фаз
таллов соответствовало стехиометрии. Необходимый
перспективной для создания термоэлектрических
объем лимонной кислоты рассчитывали исходя из ко-
преобразователей тепловой энергии, позволяющих
личества групп NO3 в азотнокислых солях, входящих
не только генерировать электроэнергию за счет по-
в состав смеси компонентов. Для полного восстанов-
глощения рассеиваемого тепла промышленных печей,
ления азота, входящего в состав нитратов, необхо-
но и накапливать ее для последующего применения
димо, чтобы выполнялось следующее соотношение:
(керамический суперконденсатор).
n = 5(∑NO3)/m,
Интересно также применение титанатов группы
голландита в качестве гетерогенных катализаторов.
где n — количество молей восстановителя на 1 моль
В работах [15-18] был исследован ряд составов рас-
продукта, m — число окисляемых связей в 1 молеку-
сматриваемых сложных оксидов в реакциях окисле-
ле органического вещества (для лимонной кислоты
ния С, СО и Н2, а также при восстановлении NOх в
m = 20).
присутствии углеводородов.
В ходе эксперимента были приготовлены составы
Цель исследования — выявление взаимосвязи
с количеством восстановителя, соответствующим
между составом, методом синтеза и рядом функ-
расчетному, т. е. с условным отношением восстано-
циональных физико-химических свойств сложных
вителя к окислителю φ = 1.0.
оксидов со структурой типа голландита, кристаллизу-
После растворения смеси в лимонной кислоте
ющихся в системе K2O-MeO (Me2O3)-TiO2 (Me = Al,
сильноразбавленным водным раствором аммиака pH
Ni, Mg), для определения перспективы практического
раствора доводили до 6.5, что приводило к образова-
применения материалов на их основе.
нию золя, который в процессе выпаривания при 80°С
превращался в гель. Порошки голландитовых фаз бы-
ли получены сжиганием и последующей термообра-
Экспериментальная часть
боткой гелей при температуре 650°С в течение 1-2 ч.
Фазовый анализ образцов на различных стадиях
Синтез образцов осуществляли двумя способами:
синтеза проводили рентгеновским методом (РФА)
а) твердофазным методом; б) пиролизом цитратно-ни-
на дифрактометре ДРОН-3М с использованием
тратных композиций.
CuKα-излучения. Исследования пористой структуры
В первом случае для получения исходной сме-
проводили методом низкотемпературной сорбции
си использовали следующие карбонаты и оксиды:
азота (Quantachrome NOVA 1200e, США). Дегазацию
K2CO3 (х.ч.), Al2O3 (ос.ч.), NiCO3 (ч.), MgCO3 (ос.ч.),
осуществляли при температуре 300°С в течение 0.5 ч.
TiO2 (ос.ч.). Измельчение и смешивание исходных
Удельную площадь поверхности (Sуд) образов рассчи-
реагентов проводили вручную. Соотношение метал-
тывали методом Брунауэра-Эммета-Теллера (БЭТ).
лов соответствовало стехиометрии синтезируемого
Исследование параметров зонной структуры,
титаната: K2MexTi8-xO16, где x = 2 при Me = Al и x = 1
включая ширину запрещенной зоны (Eg) полученных
при Me = Mg, Ni. Полученную смесь прессовали при
составов, проводили путем математической обработ-
давлении 100 МПа и подвергали ступенчатому обжи-
ки спектров диффузного отражения, полученных с
гу при температуре 1000, 1100°С. В случае синтеза
использованием УФ-спектрометра с интегрирующей
голландита, содержащего алюминий, производился
сферой Shimadzu UV2600 в диапазоне длин волн
третий обжиг при 1250°С. Время выдержки каждой
220-850 нм. Измерения проводили c использованием
ступени термообработки составляло 6 ч.
уплотненных порошкообразных образцов. Ширину
Исходные смеси при использовании метода пиро-
запрещенной зоны Eg определяли экстраполяцией
лиза цитратно-нитратных композиций получали по
прямолинейных участков функции Кубелки-Мунка
схеме, описанной в статье [18]. В качестве реакти-
F(E) до пересечения с осью Е:
вов для приготовления исходных растворов брали:
KNO3 (ос.ч.), Al(NO3)3·9H2O (ос.ч.), MgO (ос.ч.),
F(E) = (1 - R)2/2R,
Ni3(OH)4CO3·4H2O (ч.д.а.), TiCl4 (ос.ч.). Раствор
нитрата магния получали реакцией MgO с разбав-
где R — коэффициент диффузного отражения,
ленной HNO3 (ос.ч.), никель вводили в состав сме-
E = hc/λ — энергия кванта света (эВ).
си в виде раствора цитрата, полученного реакцией
Каталитическую активность образцов в мо-
карбоната никеля основного с лимонной кислотой
дельных реакциях окисления СО (с0 = 2 об%) и Н2
(C6H8O7·H2O, ос.ч.).
(с0 = 3 об%) исследовали на проточных установках;
1100
Беспрозванных Н. В. и др.
объем гранул, сформированных прессованием иссле-
из ключевых факторов, связанных с гетерогенным
дуемых составов, фракции 1-2 мм составлял 2-3 см3;
характером перечисленных процессов, является
расход газовоздушной смеси V = 3.3 см3·с-1. Анализ
удельная поверхность. В данном исследовании при-
смеси проводили на хроматографе Цвет-500.
менение пиролиза цитратно-нитратных композиций
Производительность окисления СО (Н2) в расчете
при синтезе привело к увеличению вышеуказанного
на 1 г катализатора [моль СО (Н2)/с∙г] вычисляли по
параметра лишь до ~10 м2·г-1 (см. таблицу).
уравнению
Тем не менее структура голландита, представляю-
щая собой каркас из металл-кислородных октаэдров,
Пm = Vс0x/22.4m,
пронизанный в одном из направлений «туннелями»,
в которых расположены крупные одно- или двухва-
где x — степень превращения (об. доли), 22.4 — моль-
лентные катионы, позволяет рассматривать данные
ный объем (дм3·моль-1), m — масса катализатора (г),
соединения как одну из разновидностей молекуляр-
с0 — исходная концентрация окисляемого газа (об.
ных сит. В условиях невысоких значений удельной
доли), V — расход газовоздушной смеси (дм3·с-1).
поверхности поверхностные явления будут суще-
Для изучения сорбционной емкости полученных
ственно зависеть от физико-химического состояния
материалов в отношении органических красителей
последней, в том числе от дефектности кристалли-
в качестве модельного применяли метиленовый го-
ческой решетки, наличия координационно-ненасы-
лубой. Исходный раствор метиленового голубого
щенных катионов, кислотно-основного характера, что
готовили исходя из минимального значения светопро-
отражается на кривых сорбции красителя для рассма-
пускания, регистрируемого используемым спектро-
триваемых составов. В данном случае полученные
фотометром (ПЭ-5400 УФ), которое соответствовало
концентрации 210 мг·л-1. Подготовленный раствор
красителя отбирали в объеме 5 мл и приливали в
кварцевую кювету толщиной 10 мм с предваритель-
но помещенным туда исследуемым составом массой
0.015 г. Сразу после этого кювету устанавливали в
спектрофотометр, где проводили измерение светопро-
пускания каждые 2 с в течение 60 мин. Полученные
данные обрабатывали с учетом заранее построенных
градуировочных графиков.
Электрофизические свойства, включая мнимую и
действительную части комплексного сопротивления
(Z″, Z′), общую электропроводность σ, определяли с
помощью импедансметра Z-2000 по двухэлектродной
схеме в диапазоне частот 1 Гц-2 МГц с амплитудой из-
мерительного сигнала 125 мВ в интервале температур
600-700°C. Контакты на образцы керамики наносили в
виде серебряной проводниковой пасты (производства
«Элма-пасты») и отжигали при 700°C в течение 4 ч.
Обсуждение результатов
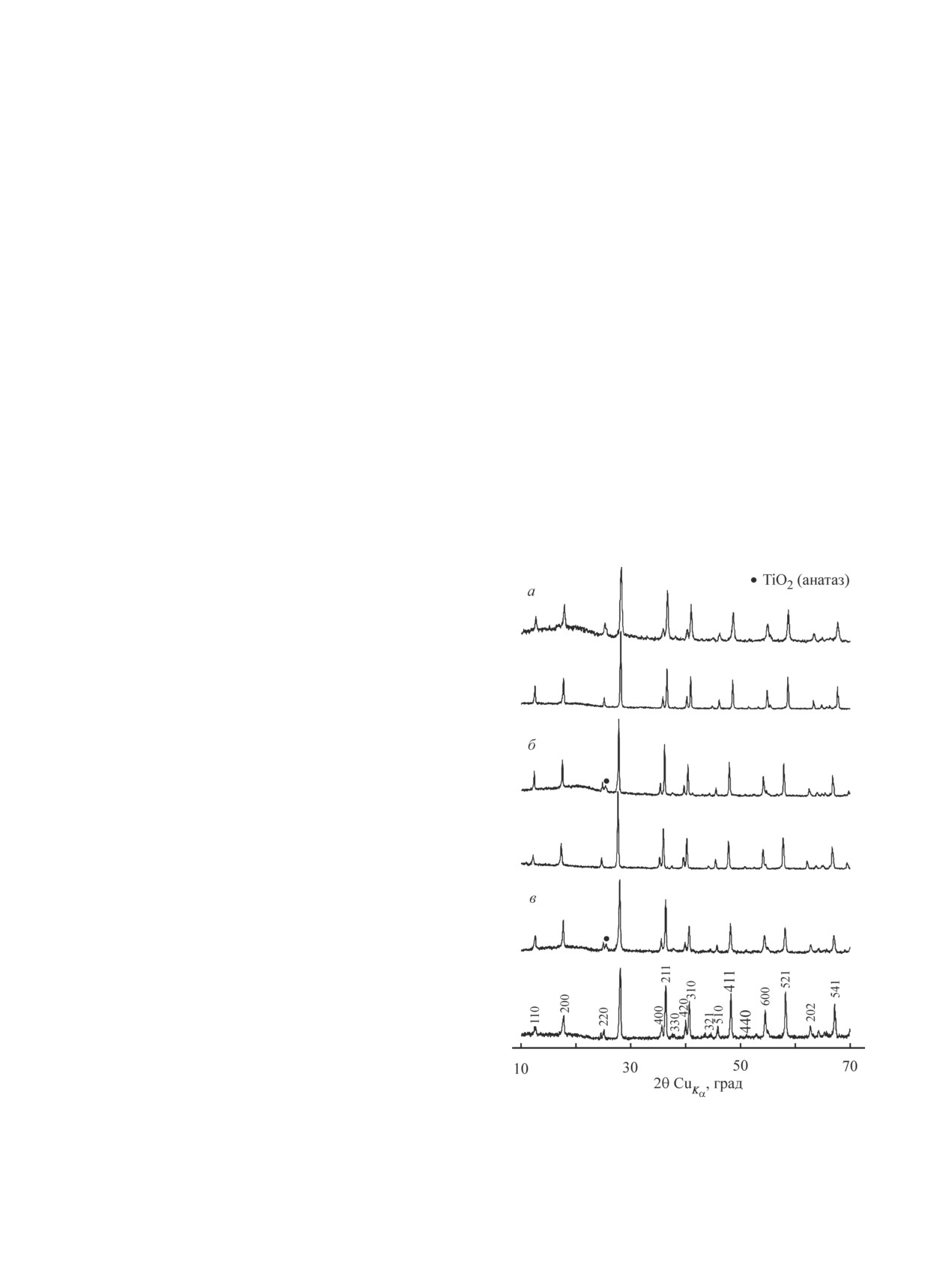
По результатам РФА (рис. 1) большинство полу-
ченных материалов являются однофазными и име-
ют кристаллическую структуру типа голландита
(K1.35Ti8O16, по данным порошковой дифракционной
картотеки PDF 47-0690). Однако при использовании
цитратно-нитратного метода синтеза в образцах с
магнием и никелем присутствует небольшое количе-
Рис. 1. Дифрактограммы образцов K2Al2Ti6O16 (а),
ство оксида титана в модификации анатаз.
K2MgTi7O16 (б), K2NiTi7O16 (в), полученных твердо-
При использовании материалов в сорбции, ката-
фазным методом (нижний график) и пиролизом цитрат-
лизе и ряде электрохимических применений одним
но-нитратных композиций (верхний график).
Синтез и физико-химические свойства сложных оксидов...
1101
Удельная поверхность образцов в зависимости от метода синтеза
Стехиометрический состав
Метод синтеза
Удельная поверхность, м2·г-1
K2NiTi7O16
0.268
K2MgTi7O16
Твердофазный
1.718
K2Al2Ti6O16
1.148
K2NiTi7O16
11.529
K2MgTi7O16
Цитратно-нитратный
11.128
K2Al2Ti6O16
12.457
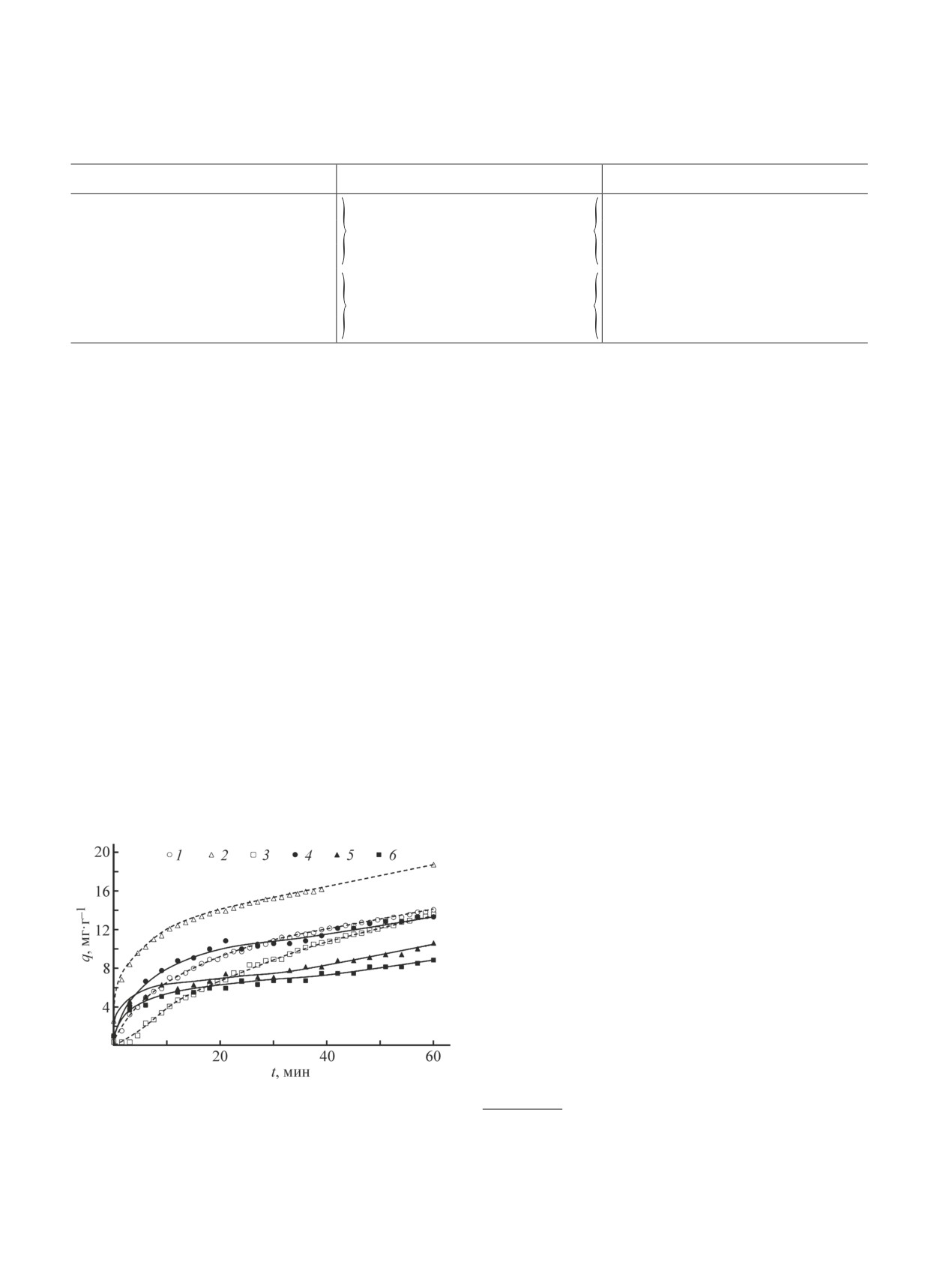
цитратно-нитратным методом керамические матери-
цитратно-нитратных композиций на поверхности
алы, содержащие Mg и Al, проявляют примерно в 2
материала увеличивается количество каталитически
раза большую сорбционную активность по сравнению
активных центров, способных обеспечивать акти-
с теми же составами, но приготовленными методом
вированную адсорбцию большего количества СО.
твердофазных реакций (рис. 2, кривые 2 и 3 по сравне-
Следовательно, образцы, полученные методом пиро-
нию с 5 и 6 соответственно). В случае же никелевого
лиза цитратно-нитратных композиций, могут быть
голландита повышения сорбционной емкости за счет
перспективны при применении в каталитических
применения пиролиза цитратно-нитратных компози-
процессах, в том числе и фотокаталитической очистке
ций не наблюдается. При этом следует отметить, что
сточных вод от токсичных компонентов. Наиболее
использование данного метода снижает скорость сорб-
высокую каталитическую активность в обеих модель-
ции в начальный период времени (рис. 2, кривые 1 и 4).
ных реакциях показал образец, полученный с исполь-
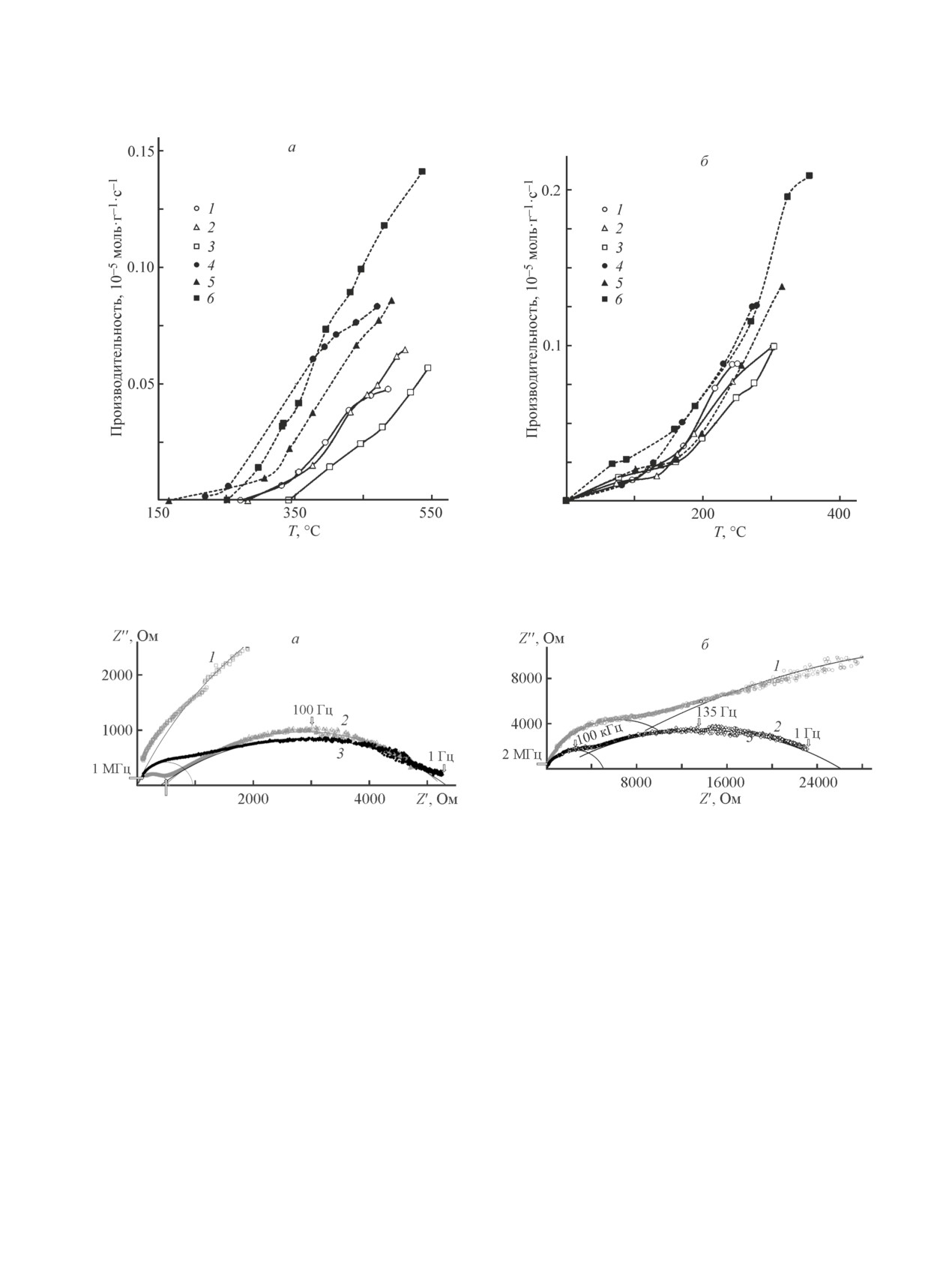
Тестирование катализаторов в модельных про-
зованием пиролиза и содержащий алюминий (рис. 3,
цессах показало (рис. 3), что окисление СО на всех
кривые 6). Так, окисление водорода на 95% происхо-
голландитах происходит в среднем интервале тем-
дило на нем при температуре 355°С и соответствова-
ператур: 250-540°С, а водорода — при температуре
ло производительности ~0.21∙10-5 моль·г-1∙с-1, что в
от 60 до 350°С. Применение метода пиролиза ци-
2 раза больше, чем при катализе на образце того же
тратно-нитратных композиций при синтезе образцов
химического состава, но приготовленном твердофаз-
позволяет существенно, примерно на 100°C, снизить
ным методом (рис. 3, б, кривая 3).
начальную температуру окисления СО (рис. 3, а), в
Методом импедансной спектроскопии были изу-
то время как в реакции окисления Н2 такого эффекта
чены электротранспортные свойства керамических
не наблюдается (рис. 3, б). Учитывая, что окисление
образцов, полученных твердофазным синтезом.
водорода и СО происходит по различным механиз-
Типичные годографы импеданса, характерные для
мам, можно предположить, что в процессе пиролиза
рассматриваемых соединений, приведены на рис. 4.
Показано, что они могут быть аппроксимированы
двумя частично перекрывающимися полуокруж-
ностями с центром, лежащим ниже оси абсцисс.
Особенно заметно данное искажение в низкочастот-
ной части импеданса, что, вероятно, связано с нали-
чием ограниченного диффузионного слоя, на эквива-
лентной схеме чаще всего описываемого элементом
постоянной фазы CPE.* Наименьшую электропро-
водность при 650°С имеет магниевый голландит:
σ ≈ 1.29∙10-5 См·см-1, никелевый и алюминиевый
образцы показывают соответственно 1.91∙10-4 и
1.92∙10-4 См·см-1. Рассчитанная на основании по-
лученных при различных температурах зависимо-
Рис. 2. Кинетические кривые сорбции метиленового го-
лубого образцами K2NiTi7O16 (1, 4), K2MgTi7O16
(2, 5),
* Impedance Spectroscopy. Theory, Experiment, and
K2Al2Ti6O16
(3, 6), полученных твердофазным методом
Applications. Second Ed. / Eds E. Barsoukov, J. Ross
(сплошные линии) и пиролизом цитратно-нитратных
Macdonald. Hoboken, New Jersey: John Wiley & Sons, Inc.,
композиций (пунктирные линии).
2005. P. 14-128.
1102
Беспрозванных Н. В. и др.
Рис. 3. Производительность окисления оксида углерода (a) и водорода (б) на голландитах состава K2NiTi7O16 (1,
4), K2MgTi7O16 (2, 5), K2Al2Ti6O16 (3, 6), полученных твердофазным методом (сплошные линии) и пиролизом ци-
тратно-нитратных композиций (пунктирные линии).
Рис. 4. Годографы импеданса, измеренные при 650°С, на голландитах состава K2MgTi7O16 (1), K2NiTi7O16 (2),
K2Al2Ti6O16 (3) (а), а также годограф K2MgTi7O16 при 650 (1) и 700°С (2) в другом масштабе (б).
стей энергия активации переноса заряда имеет зна-
значение F(R) (рис. 5, б). Вероятно, это связано с
чение для K2NiTi7O16 — 1.12, K2MgTi7O16 — 1.65,
меньшим размером частиц и, как следствие, большей
и K2Al2Ti6O16 — 0.82 эВ, что достаточно хорошо
величиной рассеивания падающего на них излуче-
согласуется с литературными данными [14].
ния. Для всех голландитов графическим методом
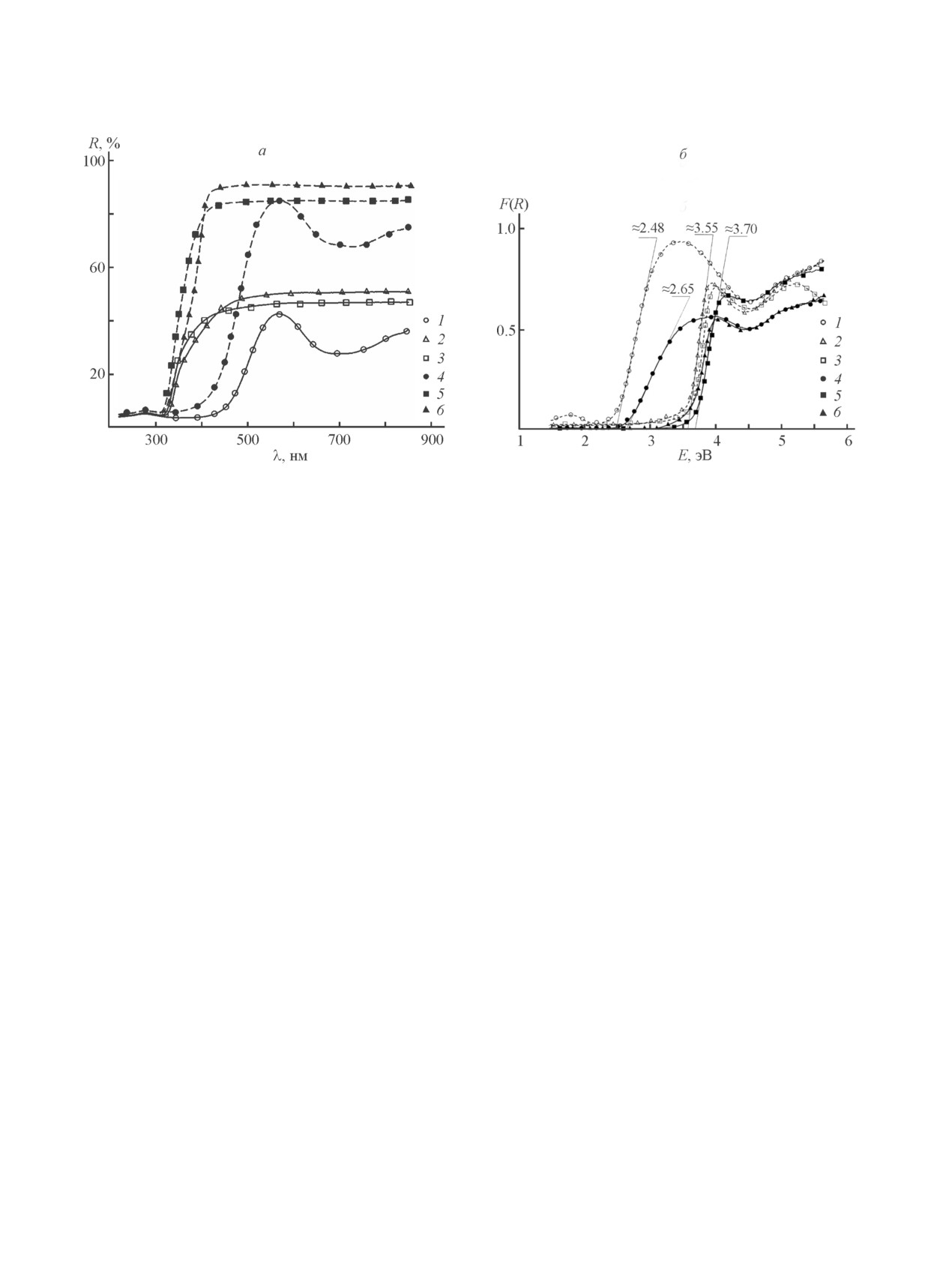
Как показали спектроскопические исследования
были определены края полос поглощения. Данные
(рис. 5, а), интенсивность отражения голландитов
значения можно принять близкими по величине к
K2MgTi7O16 и K2Al2Ti6O16 составляет 84 и 91% со-
энергии перехода электронов из валентной зоны в
ответственно в видимом и ближнем инфракрасном
зону проводимости, т. е. к ширине запрещенной зоны
диапазоне длин волн (>400 нм). У голландита состава
(Eg). В соответствии с представленными графиками
K2NiTi7O16 независимо от метода синтеза наблюда-
Eg образцов, содержащих алюминий и магний, нахо-
ются два пика диффузного отражения. На основании
дится в интервале 3.55-3.70 эВ. Только для никеле-
представленной зависимости функции Кубелки-
вого голландита край полосы поглощения смещен в
Мунка от энергии фотона можно сделать вывод, что у
видимый диапазон и соответствует значению ширины
образцов, содержащих магний и никель, полученных
запрещенной зоны для образца, синтезированного
цитратно-нитратным методом, наблюдается большее
твердофазным методом, — 2.65 эВ, а для полученно-
Синтез и физико-химические свойства сложных оксидов...
1103
Рис. 5. Спектры диффузного отражения (а) и графики функции Кубелки-Мунка (б) для образцов K2NiTi7O16 (1, 4),
K2MgTi7O16 (2, 5), K2Al2Ti6O16 (3, 6), полученных твердофазным методом (сплошные линии) и пиролизом цитрат-
но-нитратных композиций (пунктирные линии).
го с помощью пиролиза цитратно-нитратных компо-
Финансирование работы
зиций — 2.48 эВ, что свидетельствует о возможной
Работа выполнена в рамках государственного зада-
перспективности применения данного голландита в
ния Института химии силикатов РАН по Программе
качестве фотокатализатора, активируемого видимым
фундаментальных научных исследований государ-
светом.
ственных академий наук на 2019-2021 годы (тема
№ 0097-2019-0012).
Выводы
Конфликт интересов
Экспериментально показано преимущество ис-
пользования пиролиза цитратно-нитратных ком-
Авторы заявляют об отсутствии конфликта инте-
позиций перед твердофазным методом при син-
ресов, требующего раскрытия в данной статье.
тезе материалов со структурой типа голландита
общей формулы K2MexTi8-xO16 (Me = Mg, Ni, Al).
Информация об авторах
Полученные пиролизом материалы обладают бо-
Беспрозванных Надежда Владимировна, к.х.н.,
лее развитой удельной поверхностью и являются
c.н.с. ИХС РАН,
перспективными сорбентами и катализаторами га-
зоочистки. Кроме того, установлено, что образец
Синельщикова Ольга Юрьевна, к.х.н., с.н.с. ИХС
K2NiTi7O16, также полученный с помощью цитрат-
но-нитратного метода, имеет ширину запрещенной
Морозов Никита Андреевич, аспирант, м.н.с. ИХС
зоны, равную 2.48 эВ. Данный факт говорит о воз-
можности его применения в качестве эффективного
Кучаева Сания Касимовна, н.с. ИХС РАН, ORCID:
фотокатализатора, активируемого видимым светом.
Постнов Аркадий Юрьевич, к.т.н., доцент, заве-
Благодарности
дующий кафедрой общей химической технологии и
катализа СПбГТИ (ТУ),
Авторы благодарят н.с. Н. Ю. Ульянову и м.н.с.
Е. Ю. Бразовскую за помощь в исследовании тек-
стурных и оптических характеристик образцов (ИХС
РАН), а также Т. А. Вишневскую и Г. А. Галкину,
Список литературы
проводивших испытания образцов в процессах окис-
[1] Zhang Y., Jiang Z., Huang J., Lim L. Y., Li W., Deng J.,
ления СО и Н2 [инженеры СПбГТИ (ТУ), кафедра
Gong D., Tang Y., Lai Y., Chen Z. Titanate and titania
ОХТ и катализа].
nanostructured materials for environmental and energy
1104
Беспрозванных Н. В. и др.
applications: A review // RSC Advances. 2015. V. 97.
47 [Gorshkov N. V., Goffman V. G., Khoryukov A. S.,
P. 79479-79510.
Sevryugin A. V., Burmistrov I. N., Gorokhovskii A. V.
High-temperature engineering ceramic based on
[2]
Chen J., Ding T., Cai J., Wang Y., Wu M., Zhang H.,
complex titanates having a hollandite structure //
Zhao W., Tian Y., Wang X., Li X. Synergistic effects
Refract. Ind. Ceram. 2016. V. 57. N 4. P. 413-416.
of K addition and hydrogenation of TiO2 on
photocatalytic hydrogen production under simulated
[12]
Гороховский А. В., Третьяченко Е. В., Гофф-
solar light // Appl. Surf. Sci. 2018. V. 453. P. 101-109.
ман В. Г., Горшков Н. В., Федоров Ф. С., Севрю-
гин А. В. Синтез и диэлектрические свойства ке-
[3]
Здравков А. В., Горбунова М. А., Волкова А. В.,
рамики на основе сложных титанатов калия со
Химич Н. Н. Получение фотокаталитически актив-
структурой голландита // Неорган. материалы.
ного диоксида титана, допированного оксидами пе-
2016. Т. 52. № 6. C. 638-643.
реходных металлов // ЖОХ. 2018. Т. 88. № 3. С. 502-
505 [Zdravkov A. V., Gorbunova V. A., Volkova A. V.,
[Gorokhovsky A. V., Tretyachenko E. V., Goffman V. G.,
Khimich N. N. Preparation of photocatalytically active
Gorshkov N. V., Fedorov F. S., Sevryugin A. V.
titanium dioxide doped with transition metal oxides
Preparation and dielectric properties of ceramics
// Russ. J. Gen. Chem. 2018. V. 88. N 3. P. 528-
based on mixed potassium titanates with the hollandite
structure // Inorg. Mater. 2016. V. 52. N 6. P. 587-592.
[4]
Wang Q., Guo Q., Li B. Low temperature synthesis and
characterization of substitutional Na-modified K2Ti6O13
[13]
Khanna S. K., Griiner G., Orbach R., Beyeler H. U.
nanobelts with improved photocatalytic activity
Thermally activated microwave conductivity in the
under UV irradiation // RSC Advances. 2015. V. 5.
superionic conductor hollandite (K1.54Mg0.77Ti7.23O16)
// Phys. Rev. Lett. 1981. V. 47. N 4. P. 255-257.
[5]
Garay-Rodríguez L. F., Yoshida H., Torres-
Martínez L. M. Flux synthesis of Ba2Li2/3Ti16/3O13
[14]
Reau J.-M., Moali J., Hagenmuller P. Etude de
and its photocatalytic performance // Dalton Trans.
la conductivite ionique des solutions solides de
2019. V. 48. P. 12105-12115.
structure hollandite KxMx/2Ti8-x/2O16 (M = Mg, Zn)
et KxAlxTi8-xO16 // J. Phys. Chem. Solids. 1977. V. 38.
[6]
Li Q., Kako T., Ye J. Strong adsorption and effective
N 12. P. 1395-1398.
photocatalytic activities of one-dimensional nano-
structured silver titanates // Appl. Catal. A: General.
[15]
Liu T., Li Q., Xin Y., Zhang Z., Tang X., Zheng L.,
2010. V. 375. P. 85-91.
Gao P.-X. Quasi free K cations confined in hollandite-
type tunnels for catalytic solid (catalyst)-solid
[7]
Phoon B. L., Lai C. W., Juan J. C., Show P.-L.,
(reactant) oxidation reactions // Appl. Catal. B:
Pan G.-T. Recent developments of strontium titanate
Environmental. 2018. V. 232. P. 108-116.
for photocatalytic water splitting application // Int. J.
Hydrogen Energy. 2019. V. 44. N 28. P. 14316-14340.
[16]
Watanabe M. Mori T., Yamauchi S., Yamamura H.
Catalytic property of the hollandite-type 1-D ion-
[8]
Liu X., Xu L., Huang Y., Qin C., Seo H. J. Preparation
conductors: Selective reduction of NOx // Solid States
and photochemical properties of ferrotitanate
Ion. 1995. V. 79. P. 376-381.
NaFeTi3O8 nanoparticles // J. Taiwan Inst. Chem.
Eng. 2017. V. 76. P. 126-131.
[17]
Синельщикова О. Ю., Кучаева С. К., Дроздова И. Б.,
Уголков В. Л., Власов Е. А., Петров С. А. Синтез
[9]
Sanford S., Misture S. T., Edwards D. D. A comparis on
и исследование новых катализаторов на основе
of the photocatalytic activity of six tunneled titanates
голландита K2Ga2Ti6O16 // ФХС. 2011. Т. 37. № 4.
// J. Solid State Chem. 2013. V. 200. P. 189-196.
С. 112-122 [Sinelshchikova O. Y., Kuchaeva S. K.,
Drozdova I. A., Ugolkov V. L., Petrov S. A.,
[10]
Chen M., Wang Z., Liu H., Wang X., Ma Y., Liu J.
Vlasov E. A. Synthesis and study of novel catalysts
Synthesis of potassium magnesium titanate whiskers
based on hollandite K2Ga2Ti6O16 // Glass Phys. Chem.
with high near-infrared reflectivity by the flux method
2011. V. 37. N 4. P. 433-440.
// Mater. Lett. 2017. V. 202. P. 59-61.
[18]
Sinelshchikova O. Yu., Petrov S. A., Besprozvan-
[11]
Горшков Н. В., Гоффман В. Г., Хорюков А. С.,
nykh N. V., Kuchaeva S. K., Vlasov E. A. Features of
Севрюгин А. В., Бурмистров И. Н., Гороховский А. В.
sol-gel synthesis of new functional materials based on
Высокотемпературная техническая керамика на
complex oxides with tunnel structure // J. Sol-Gel Sci.
основе сложных титанатов, имеющих структуру
Technol. 2013. V. 68. N 3. P. 495-499.
голландита // Новые огнеупоры. 2016. № 8. С. 43-