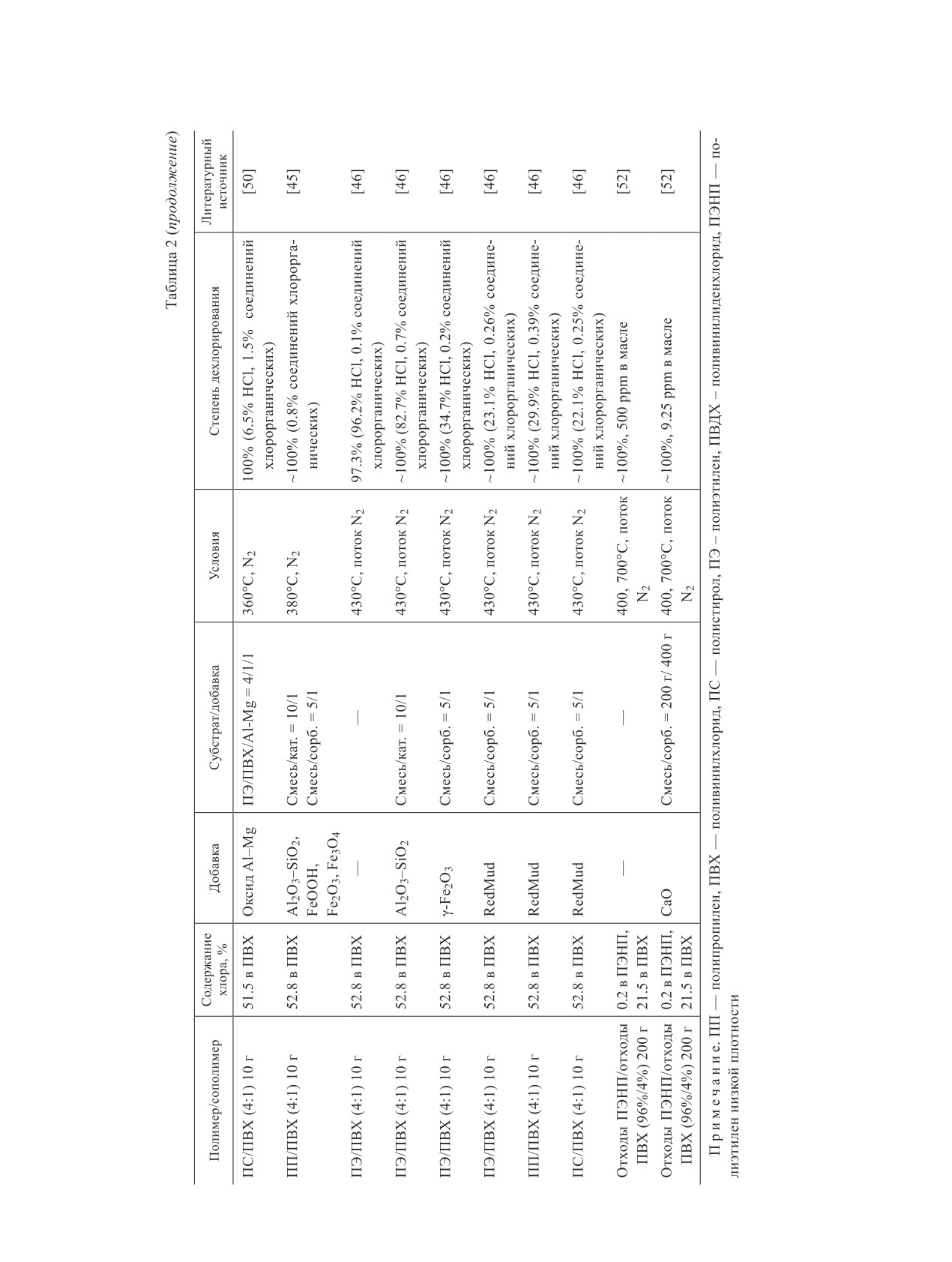
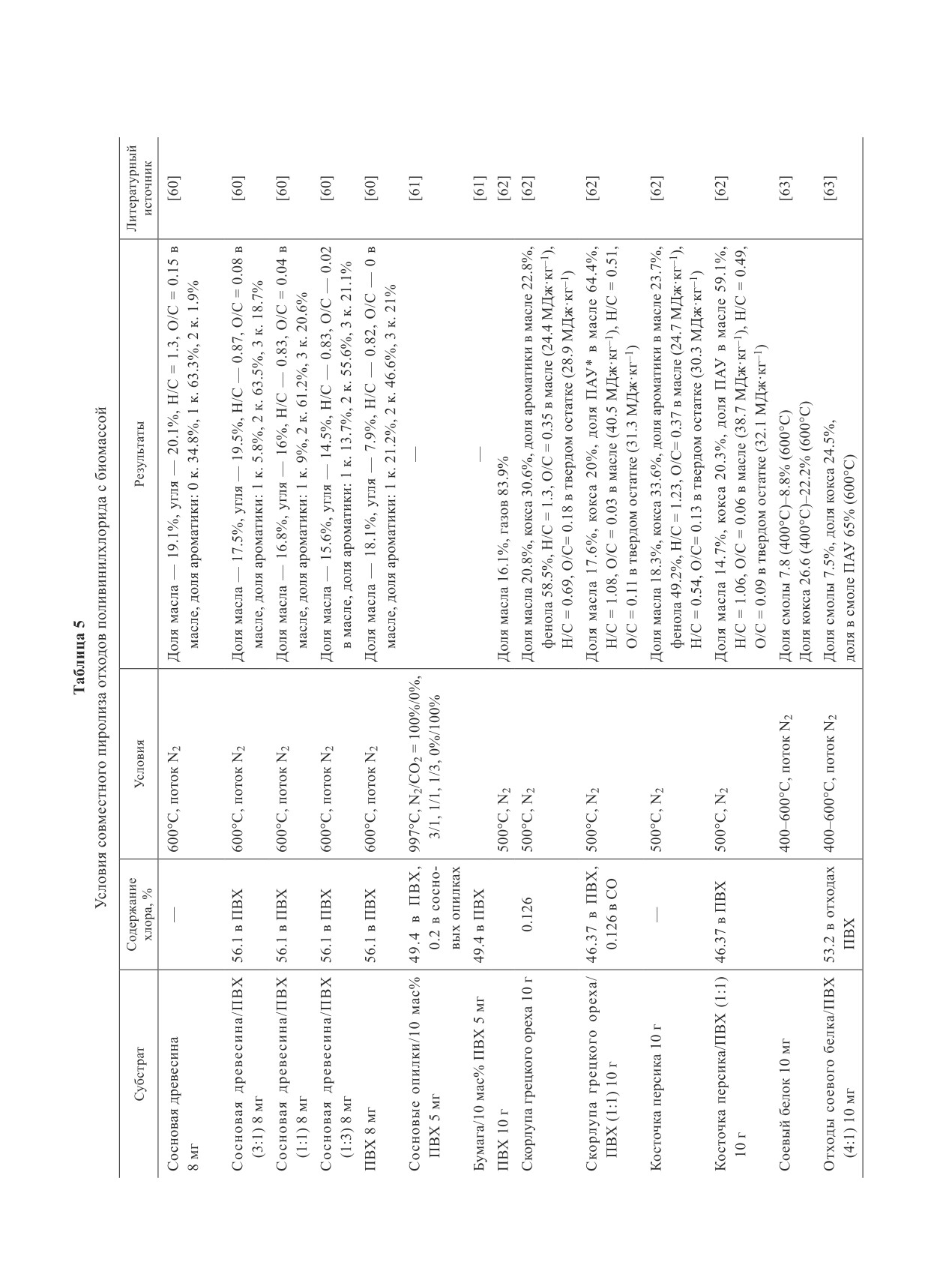
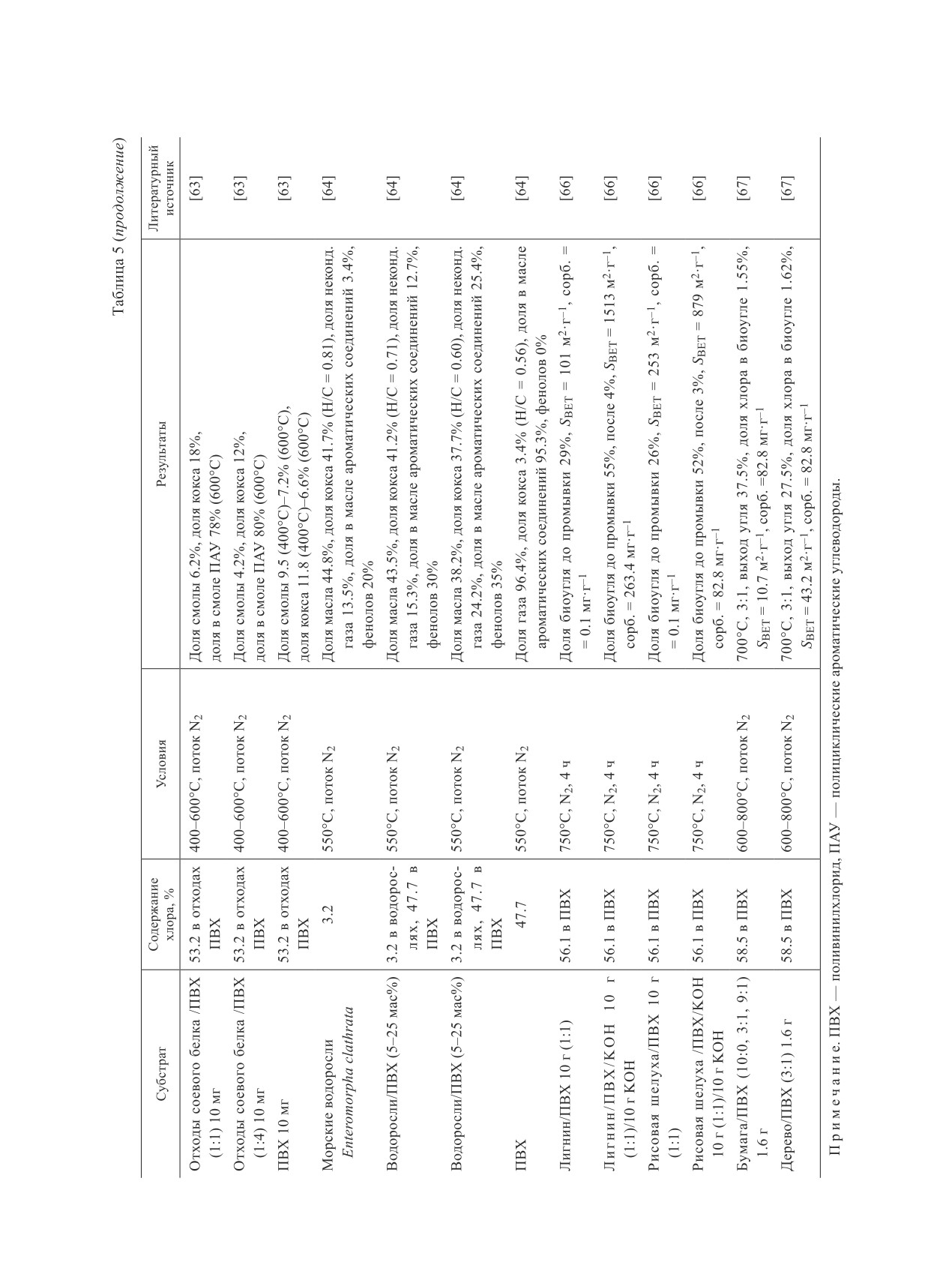
Журнал прикладной химии. 2020. Т. 93. Вып. 9
УДК 691.175.743:66.092-977
НАПРАВЛЕНИЯ ВТОРИЧНОЙ ХИМИЧЕСКОЙ ПЕРЕРАБОТКИ
ПОЛИВИНИЛХЛОРИДА (обзор). ЧАСТЬ 1
© Е. М. Захарян, Н. Н. Петрухина, А. Л. Максимов
Институт нефтехимического синтеза им. А. В. Топчиева РАН,
119991, г. Москва, Ленинский пр., д. 29
Поступила в Редакцию 13 мая 2020 г.
После доработки 26 мая 2020 г.
Принята к публикации 6 июля 2020 г.
Увеличение мощностей производства и потребления поливинилхлорида приводит к формированию
больших объемов хлорсодержащих отходов, как правило, в составе муниципальных отходов пластика.
Сжигание таких отходов с преобразованием в энергию приводит к выбросу токсичных газов (SO2,
NOx), тяжелых металлов и твердых частиц c дымовыми газами, а также к образованию полихлори-
рованных дибензодиоксинов и дибензофуранов и других коррозионно-агрессивных хлорорганических
соединений. В связи с этим встает вопрос о переработке отходов, содержащих хлорорганические
полимеры. В обзоре рассмотрены современные промышленные технологии сортировки муниципальных
отходов пластика, в том числе различные методы разделения полимерных отходов. Анализируются
процессы переработки хлорсодержащих отходов, основанные на технологии пиролиза и газификации,
описаны подходы к химической переработке поливинилхлорида, смесей полимеров и муниципальных
отходов, содержащих поливинилхлорид, — пиролиз и низкотемпературное каталитическое дехлори-
рование. Проанализировано влияние состава и вида полимерных отходов на степень дехлорирования.
Представлены принципы и механизмы механохимической переработки отходов поливинилхлорида в
смеси с химическими сорбентами, а также с биологическими и техническими отходами.
Ключевые слова: поливинилхлорид; отходы поливинилхлорида; муниципальные отходы пластика;
дехлорирование; пиролиз; биомасса; механохимическая переработка
DOI: 10.31857/S0044461820090017
Введение
особенности если извлекаемые из вторичного сырья
соединения вовлекаются в традиционные процессы
Усовершенствование применяемых в промыш-
нефтепереработки и нефтехимии, поскольку даже
ленности и внедрение новых методов химической
небольшая примесь галогенсодержащих соединений
переработки полимерных отходов в мономеры или
ведет к отравлению катализаторов и повреждению
химическое сырье для производства топлив и матери-
оборудования и необходимости использовать специ-
алов является актуальным направлением химической
альные меры, предотвращающие его коррозию.
технологии [1, 2]. Одной из существенных проблем,
Основную долю среди полимеров, содержащих
возникающих при использовании несортированных
галоген в отходах, составляет поливинилхлорид,
отходов как химического сырья, является присутствие
классифицирующийся на три типа — чистый, жест-
в них галогенсодержащих соединений и полимеров, в
кий и гибкий в зависимости от наличия/отсутствия
1218
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1219
каких-либо добавок [3]. Чистый полимер, как прави-
рида мономерами и циклическими соединениями.
ло, содержит 51-58 мас% атомов хлора. Структура
Сжигание и захоронение полимерных отходов при-
поливинилхлорида представляет собой линейную
чиняет значительный ущерб окружающей среде.
конфигурацию «голова к хвосту». Типичные средне-
Процесс механической переработки твердых бытовых
численные молекулярные массы составляют 50 000-
отходов, содержащих хлорированные пластмассы,
120 000 г·моль-1. Чистая смола поливинилхлори-
затруднен наличием таких примесей, как пищевые,
да — твердый, прочный материал, практически
строительные и другие отходы, а также их неодно-
неприменяемый на практике по причине неудовлетво-
родностью.
рительной устойчивости к воздействию высоких тем-
Благодаря использованию передовых технологий
ператур и ультрафиолетового излучения. Добавление
переработки полимерных отходов путем деполимери-
стабилизаторов, таких как соединения тяжелых ме-
зации на полимеры с меньшей массой либо мономеры
таллов (барий, олово, кадмий и свинец), значитель-
(пиролиз) или частичной деградации до вторичных
но повышает термо- и фотоустойчивость полимера.
ценных материалов (химическая деполимеризация)
Содержание хлора в жестком поливинилхлориде не
химическая переработка, так называемая третичная,
превышает 45-48% [4], поскольку доля чистого по-
становится все более актуальной.
ливинилхлорида в нем не более 90%. Такой полимер
Цель работы — анализ литературной и патентной
используется для производства труб, воздуховодов,
информации в области переработки хлорсодержа-
строительных панелей, напольных покрытий и дру-
щих полимерных отходов для выявления основных
гих строительных приложений. Смешивая смолу
тенденций развития технологий дехлорирования,
поливинилхлорида с различными пластификатора-
анализа механизма дехлорирования в различных
ми, обычно с органическими сложными эфирами
процессах, обобщения промышленного опыта пере-
(ди-2-этилгексилфталат, диоктилфталат), произво-
работки хлорсодержащих пластиков и оценки пер-
дители придают продуктам повышенную гибкость,
спектив получения мономеров из хлорсодержащих
необходимую для использования в пленках, трубах,
высокомолекулярных соединений. В первой части
изоляции проводки и т. д. В гибком поливинилхлори-
обзора поставлена задача анализа современных про-
де доля хлора значительно снижается (22-35%) [4].
мышленных технологий сортировки муниципальных
Добавление соединений брома, сурьмы или фосфора
отходов пластика, т. е. первичной переработки, и со-
делает продукт огнестойким.
временных процессов переработки хлорсодержащих
В 2013 г. объем производства поливинилхлори-
отходов: механохимической (вторичной) и химиче-
да составлял около 61 млн тонн [5], более полови-
ской (третичной), включающей пиролиз и низкотем-
ны объема приходилось на Китай (38.5 млн тонн).
пературное каталитическое дехлорирование.
Ожидается, что к 2023 г. мощность производства по-
ливинилхлорида достигнет 63.7 млн тонн при спросе
Промышленный опыт переработки
в 51.6 млн тонн. Основными производителями поли-
хлорсодержащих полимерных отходов
винилхлорида являются азиатские страны (48%) и
государства Северной Америки (13%), потребителя-
Отходы, состоящие из поливинилхлорида и поли-
ми — также страны Азии (58%), на европейские стра-
винилиденхлорида, так называемые постиндустри-
ны приходится 17% общего потребления. В России на
альные отходы [2], без каких-либо примесей и за-
2019 г. было произведено и потреблено около 1 млн
грязнений образуются лишь на специализированных
тонн поливинилхлорида.
производствах в качестве обрезков, стружки и др.
Промышленное значение поливинилхлорида пре-
Эти отходы можно без предварительной обработки
допределяет важность решения проблемы совместной
использовать для вторичной переработки [7].
химической переработки полимерных отходов [5],
Муниципальные отходы пластика, как правило,
содержащих, как правило, смесь поливинилхлорида
состоят из смешанного пластика и потенциально
с полиэтиленом, полипропиленом, полистиролом,
загрязненного органическими (остатки пищи) или
полиэтилентерефталатом и др. [6]. Хлороводород,
неорганическими фракциями (бумага, картон) [8], что
выделяющийся в результате термического разложе-
затрудняет этап дальнейшей переработки. Обычно
ния поливинилхлорида, вызывает коррозию обору-
пластиковые отходы представляют собой смеси по-
дования [5], при этом весьма вероятно протекание
липропилена, полистирола, полиэтилена, поливи-
побочной реакции образования хлорорганических
нилхлорида, акрилонитрил-бутадиен-стирольного
соединений за счет взаимодействия хлороводорода с
сополимера, поливинилиденхлорида, полиэтиленте-
образовавшимися в ходе разложения поливинилхло-
рефталата и др.
1220
Захарян Е. М. и др.
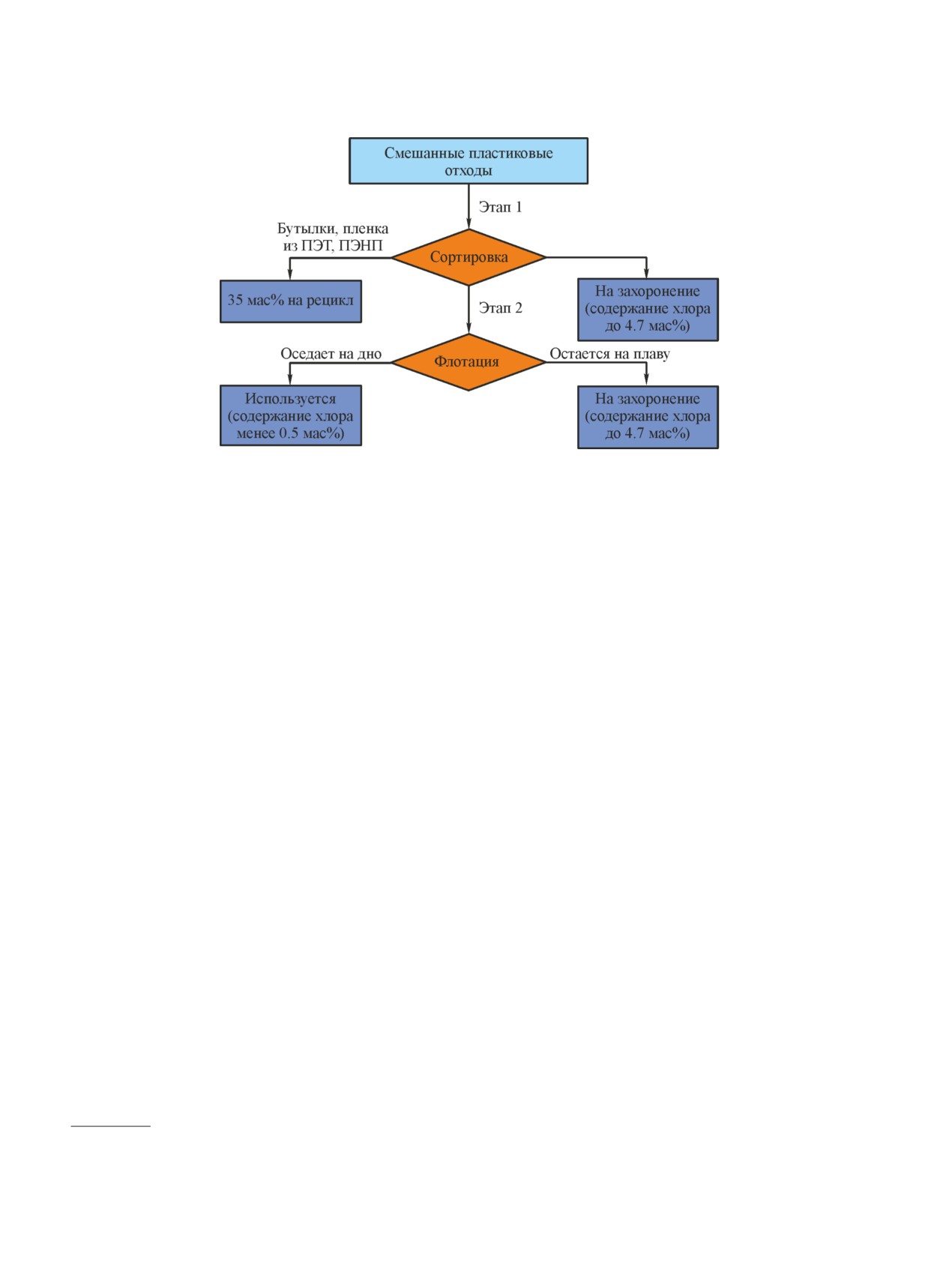
Наиболее распространенным методом переработ-
ции за счет различия в смачиваемости поверхности
ки пластиковых отходов, в том числе хлорсодержа-
полимеров разделяют полимеры с равными плотно-
щих полимеров, является механическая переработка
стями [13]. Гидрофобные полимеры из-за низкого
[9, 10], стадиями которой являются сбор, сортировка,
поверхностного натяжения оказываются на границе
мойка и измельчение материала. Только за 2015 г.
раздела воздух-вода и благодаря взаимодействию
в Европе из 25 млн тонн пластиковых отходов*
их поверхности с пузырьками воздуха не тонут и
29.7 мас% было переработано, 39.5 мас% — пре-
оказываются на поверхности воды; в случае же хо-
образовано в энергию, оставшиеся отходы — захо-
рошей смачиваемости полимера водой — оседают
ронены.
на дно. Большая часть поливинилхлорида относится
Авторы [11] предложили метод двухступенчатой
к полимерам первого типа и таким образом отделя-
переработки, с помощью которой удалось повысить
ется от полярных полимеров (рис. 1). Как правило,
долю пластиков с малым количеством хлорсодержа-
поливинилхлорид в смеси как единственный хлор-
щих компонентов (с 13 до 47.5%), утилизируемых
содержащий полимер обнаруживают методом рент-
путем сжигания, и уменьшилось количество бога-
генофлуоресцентного анализа.
тых поливинилхлоридом пластиков, утилизируемых
Основные проблемы, связанные с механической
путем захоронения (от 52 до 16.9%) (рис. 1). Отходы
переработкой, заключаются в том, что происходит
поливинилхлорида перерабатывали в смеси с неути-
деградация полимеров под действием термомехани-
лизируемыми полимерами, доля которых в отходах
ческой обработки, тепла, окисления, света, ионного
составляет 50-85 мас%.
излучения, гидролиза и др., ухудшающая физико--
Разделение и сортировку производят на основе
химические свойства полимеров для дальнейшей
плотности, размера, цвета и химического состава
переработки и использования [14].
полимеров. Отсортированные отходы из полиэти-
Различие температур плавления и, как следствие,
лентерефталата и полиэтилена низкой плотности
температуры обработки полимеров в смешанных
отправляют на вторичную переработку. После про-
пластмассах приводит к дополнительной сложности
водится мойка отходов с удалением органических,
в переработке смешанных пластиков. Часто процесс
пищевых отходов и измельчение отходов до хлопьев/
переработки проводится при температуре обработки
чешуек размером примерно 1-12 мм, которые вновь
более высокоплавкого полимера, входящего в состав
промываются. Второй этап разделения — флотация,
смеси, что приводит к перегреву и деградации не-
в основе которой лежит способность частиц к пла-
которых компонентов с более низкой температурой
вучести, зависящая от плотности полимеров [12].
плавления, что в свою очередь ухудшает их свойства.
В водяной бане при нагреве полипропилен и поли-
Это особенно актуально для смесей, содержащих по-
этилен всплывают на поверхность воды, тогда как
ливинилхлорид и полиэтилентерефталат, переработка
другие полимеры, характеризующиеся плотностью
которых проводится при повышенных температурах,
ниже 1 г·см-3, полиэтилентерефталат, полистирол,
при этом полиэтилентерефталат значительно ускоря-
акрилонитрил-бутадиен-стирольный сополимер и по-
ет дегидрохлорирование поливинилхлорида [6].
ливинилхлорид, наоборот, тонут. После сушки мягкие
Механохимическая переработка, в процессе ко-
отходы полипропилена и полиэтилена подвергают-
торой проводят измельчение хлорсодержащих поли-
ся окончательной регрануляции (с фильтрацией из
меров с наполнителем либо сорбентами, позволяет
расплава) с дальнейшим использованием в качестве
получать твердый остаток отходов, который в качестве
вторичного сырья.
альтернативы битума можно использовать в строи-
При электростатическом разделении за счет стал-
тельной области (для дорожного покрытия и др.) и в
кивания полимерных хлопьев друг с другом образу-
качестве синтетического топлива, если его теплотвор-
ется положительный заряд на поверхности одного
ная способность составляет более 30-35 МДж·кг-1.
полимера и отрицательный заряд на поверхности дру-
Поскольку сжигание отходов, содержащих хлор,
гого [9]. Таким методом можно разделить бинарные
приводит к образованию токсичных полихлориро-
смеси полистирола, поливинилхлорида, полиэтилен-
ванных дибензодиоксинов, дибензофуранов и других
терефталата и полиамида [12]. Путем пенной флота-
хлорорганических соединений, в некоторых странах
введены нормативы по сжиганию опасных отходов.
Так, например, в Финляндии восстановленное или
* PlasticEurope, 2015, Plastics the facts 2014/2015:
синтетическое топливо по содержанию хлорсодержа-
an Analysis of European plastics production. Demand and
щих соединений классифицируется на три типа: I —
Waste data, PlasticEurope Brussels, Belgium. https://
доля хлора менее 0.15%, II — менее 0.5% и III — менее
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1221
Рис. 1. Двухступенчатая переработка смешанных отходов пластика (адаптировано из работы [11]).
1.5%, из которых сжигать можно сырье I и II типа.*
тическом крекинге для производства бензина либо
Даже при малом количестве хлора, имеющемся в отхо-
непосредственно в качестве мазута. Также снизить
дах, хлорсодержащие соединения образуются в лету-
содержание хлора в муниципальных отходах пласти-
чей золе [15]. Так, при сжигании биомассы (~0.5 мас%
ка можно путем дехлорирования, иниицированного
Cl) его доля в золе будет составлять до 10 мас%, а после
микроволновым излучением при относительно низ-
сжигания твердых отходов — от 1.8 до 9.1 мас% [16].
ких температурах [18].
Наличие покрытий и красок на отходах полиме-
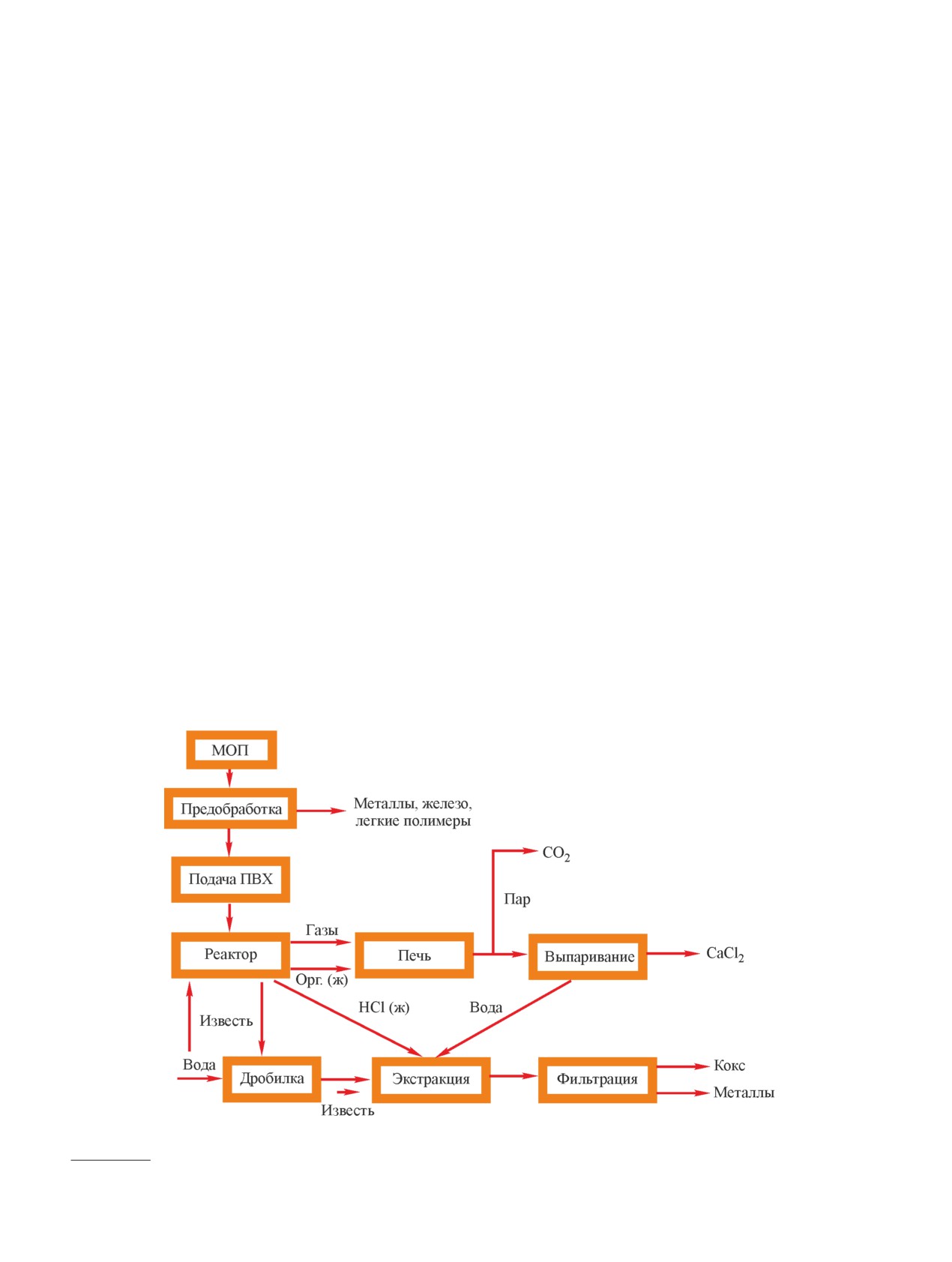
Основной технологией пиролиза является техно-
ров значительно усложняет процесс механической
логия BASF (рис. 2) [19], впервые проведенная на
переработки. Загрязняющие вещества могут быть не
установке мощностью 15 000 т в год (Badische Anilin
полностью растворимыми и могут вызывать разделе-
und Soda Fabrik, Людвигсхафен, Германия) в 1994 г.
ние фаз с негативным воздействием на механические
Переработка отходов начинается с этапа предвари-
свойства полимера [9].
тельной обработки, где смешанные пластики измель-
Основным методом химической переработки яв-
чаются и отделяются от металлов и агломерирован-
ляется пиролиз смешанных полимеров, с помощью
ных материалов. На следующем этапе полимерные
которого, как правило, получают мономеры и не-
отходы подвергают плавлению и дегалогенированию
фтехимическое сырье, которые можно использовать
для защиты сегментов оборудования от коррозии.
в дальнейшем производстве различных продуктов.
Основная часть хлора, выделенная в виде HCl, аб-
Присутствие даже небольшого количества хлорсо-
сорбируется и используется в производстве соляной
держащих соединений в пиролизном масле/восках не
кислоты, незначительная часть хлора удаляется в
дает возможности использовать пиролизные продук-
виде NaCl и CaCl2 через сточные воды. Газообразные
ты в качестве топлива или нефтехимического сырья,
органические продукты сжижаются и используются в
содержание хлорсодержащих соединений в жидких
качестве сырья в крекере. На следующих этапах раз-
продуктах не должно превышать 10 ppm [6]. Поэтому
жиженный пластиковый мусор нагревают до 400°С
пиролиз проводят либо при пониженных темпера-
и разбивают на компоненты различной длины цепи.
турах [6], либо в присутствии сорбентов в начале
Таким образом производится около 20-30% газов и
процесса либо в конце при двухступенчатом пиролизе
60-70% масел, которые впоследствии разделяются
[17] с дальнейшим удалением хлоридов из сточных
в ректификационной колонне. Нафту обрабатывают
вод осадительным методом с помощью CaCO3, CaO,
в паровой крекинг-установке, а мономеры (этилен,
NaHCO3, Na2(CO3)2 или NH3. Полученное таким
пропилен) восстанавливают. Высококипящие масла
образом пиролизное масло используется в катали-
могут быть переработаны в синтез-газ или полукокс
для дальнейшего использования.
Пиролитический процесс Akzo process (Нидер-
* VNp 1049/99 kaatopaikoista annetun valtioneuvoston
ланды), эффективно использующийся в переработке
богатых поливинилхлоридом пластиковых отходов,
1222
Захарян Е. М. и др.
Рис. 2. Схема процесса BASF (адаптировано из работы [19]).
с мощностью 30 кг·ч-1 основан на системе с цирку-
частицы отходов полимеров, доля поливинилхлорида
лирующим псевдоожиженным слоем (два реактора)
в которых составляет 2-4%. Образующиеся в про-
с последующим сжиганием, в котором основными
цессе крекинга полимеров углеводороды удаляются
продуктами являются HCl, CO, H2, CH4 и в зависимо-
псевдоожижающим газом. Полученный HCl в ходе
сти от состава сырья другие углеводороды и летучая
разложения поливинилхлорида нейтрализуется твер-
зола [20, 21].
дым известковым абсорбентом. Таким образом, в
Процесс NRC [9] основан на пиролизе отходов
ходе процесса образуется 5-8 мас% от веса пластика
поливинилхлорида (кабели, материалы, использу-
пиролизной жидкости, 15 мас% газов, состоящих из
ющиеся в строительной отделке, профили и т. д.) с
мономеров (этилен, пропилен), среди которых до
использованием кальциевых сорбентов с последу-
15% метана [22], и 0.2 кг·кг-1 полукокса от общего
ющим извлечением тяжелых металлов, в результа-
количества сухих веществ.
те пиролиза образуются CaCl2, кокс, органический
Альтернативной технологией переработки му-
конденсат (для использования в качестве топлива) и
ниципальных отходов пластика (МОП) (особенно в
соответственно тяжелые металлы.
случае отходов поливинилхлоридного кабеля) явля-
Запуск серии пилотных установок (1994-1998) BP
ется процесс NKT (рис. 4) [20, 21], преимуществом
polymer cracking process [20] (рис. 3) позволил осно-
которого является отсутствие в продуктах диоксинов,
вать завод в Шотландии мощностью 25 000 т в год.
хлорорганических соединений, металлов и пласти-
В нагретый кипящий слой реактора (500°С) в отсут-
фикаторов. Процесс начинается с предварительной
ствие воздуха подаются измельченные до 1-20 мм
обработки, заключающейся в отделении легких пла-
Рис. 3. Схема процесса BP polymer cracking process [20].*
* Разрешение на публикацию получено 10.07.2020, © 2016 John Wiley and Sons.
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1223
стиков (полпропилена, полиэтилена и т. д.) и других
Дехлорирование проводится путем нейтрализации
загрязнителей (дерево, песок, железо, сталь, латунь,
ионообменного катализатора [26, 27].
медь и др.). Муниципальные отходы пластика затем
Процесс газификации пластиковых отходов
поступают в реактор при низком давлении (2-3 бар) и
Texaco — самая распространенная на данный мо-
умеренной температуре (375°С). В процессе перера-
мент технология среди газификационных методов.
ботки выделяется небольшой объем углекислого газа,
Первые пилотные установки (10 т/день) были ис-
образующегося в результате реакции между известью
пытаны в США [28]. При термическом разжижении
и хлористым водородом.
муниципальных отходов пластика, содержащих до
В результате двустадийного пиролиза отходов по-
10% поливинилхлорида, деполимеризуются в син-
ливинилхлорида с наполнителем и сорбентом CaCO3
тетическое тяжелое масло и некоторые конденси-
в процессе NKT-Watech при повышенных температу-
руемые и неконденсируемые газовые фракции [29].
рах полимерные цепи разрушаются, образуя большое
Газификация осуществляется кислородом и паром
количество полукокса, а полученный в ходе реак-
при температуре 1200-1500°С. После ряда процессов
ции хлорид кальция обрабатывают для дальнейшего
очистки (удаление HCl и HF) получают чистый и су-
использования [23]. Проведение каталитического
хой синтез-газ, состоящий преимущественно из СО
крекинга отходов, содержащих поливинилхлорид,
и Н2 и незначительного количества CH4, CO2, H2O и
не представляется возможным за счет быстрой дез-
некоторых инертных газов [20]. Отходы подаются в
активации катализатора образующимися в процессе
реактор (печь) вместе с лигнитом (в форме брикетов)
углеродистыми отложениями, содержащими Cl либо
и отработанным маслом. Жидкие углеводороды под-
N [24].
вергаются дальнейшей переработке под давлением
Технология процесса каталитического пиролиза
масла. Газ используется в основном для производства
при атмосферном давлении (Katalytische Drucklose
метанола и электроэнергии.
Verölung) [25], разработанная немецкой компани-
Еще одним промышленным способом переработки
ей Alphakat GmbH, позволяет получать дизельное
хлорсодержащих отходов пластика является процесс
топливо, керосин и нефть путем каталитического
Veba Combi Cracking Process (Veba Oel AG), осно-
преобразования биомассы и смешанных отходов при
ванный на гидрокрекинге, т. е. на обработке отходов
атмосферном давлении при полном удалении атомов
водородом (1992) [20, 21, 30]. По технологии Veba
кислорода, азота и хлора из субстратов (250-320°С).
Oel AG путем сжижения угля получают нафту и га-
Рис. 4. Схема процесса NKT [20, 21].*
* Разрешение на публикацию получено 10.07.2020, © 2016 John Wiley and Sons.
1224
Захарян Е. М. и др.
зойль. Конфигурация установки процесса Veba Combi
отходов пластика, совместный пиролиз отходов по-
Cracking Process в переработке муниципальных отхо-
ливинилхлорида и биомассы);
дов пластика, содержащих менее 4% поливинилхло-
— одностадийный и двустадийный пиролиз.
рида (62 мас% хлора), включает две секции — депо-
В первом случае происходит одновременно процесс
лимеризации и гидрокрекинга. В первой секции при
дехлорирования отходов поливинилхлорида и кре-
температуре от 350 до 400°С протекает дехлориро-
кинг продуктов разложения, во втором случае уда-
вание поливинилхлорида и разложение полимерных
ление хлорсодержащих соединений проводят либо
отходов. Основная часть хлора (80%), выделенного
в начале процесса (разложение поливинилхлорида с
из поливинилхлорида, представляет собой газ HCl,
добавлением сорбента), либо в конце процесса (до-
промывая который, получают технический хлорово-
бавление сорбента в продукты пиролиза).
дород. Частично конденсированный продукт депо-
Пиролиз чистого поливинилхлорида, не содер-
лимеризации, содержащий 18% хлороводорода [20],
жащего примеси. Термическое разложение поли-
вводится в секцию гидроочистки, где HCl удаляется
винилхлорида представляет собой двухступенчатый
с пластовой водой. Очищенный от хлороводорода
процесс (рис. 5) [31]. Первый этап включает деги-
конденсат и образующиеся газы смешивают с депо-
дрохлорирование полимера, что приводит к образо-
лимеризованным материалом для обработки в сек-
ванию сопряженных двойных связей, разрыв которых
ции гидрокрекинга [30] и гидрируют при 400-450°C
происходит на втором этапе. Основными лабильными
под высоким давлением (≈100 бар) в жидкофазном
участками дегидрохлорирования являются третичные
реакторе с неподвижным слоем. Путем разделения
хлорины. На втором этапе разложение дегидрохло-
после гидроочистки получают синтетическую сырую
рированного продукта продолжается за счет крекин-
нефть и гидрирующий битум — поток гидрирован-
га и пиролиза углеводородов линейной или цикли-
ного остатка, содержащего тяжелые углеводороды,
ческой структуры с низким содержанием углерода.
загрязненные золой, металлами и инертными солями.
Сопряженная полиеновая структура, образующаяся
Смешивая этот битум с углем, можно получать кокс
в процессе выделения HCl и имеющая как цис-, так и
(до 2 мас%). В отходящем газе (E-gas) образуются
транс-положения, подвергается ароматизации/цикли-
легкие крекирующиеся продукты, которые очищают
зации и сшиванию с формированием широкого спек-
от H2S и NH3. Оставшуюся часть хлора (2 мас% Cl
тра углеводородных продуктов.
по весу в поливинилхлориде) в виде хлорированных
Разложение поливинилхлорида на первом этапе
соединений сорбируют CaO с образованием CaCl2.
протекает в интервале 280-400°С с массопотерей до
Во всех этих процессах использование получен-
65% (в пересчете на весь остаток). Температура, при
ных продуктов как сырья для нефтехимии возможно
которой происходит наибольшая потеря массы на
лишь после полного последующего удаления хлор-
первом этапе, составляет 320°С. Вторая стадия раз-
содержащих соединений. Исследование механизмов
ложения поливинилхлорида наблюдается в интервале
процессов пиролиза, крекинга, газификации, меха-
нохимической переработки и развитие возможных
альтернативных подходов к переработке хлорсодер-
жащих отходов стало предметом исследований в по-
следние 15 лет. В следующих разделах эти процессы
будут рассмотрены подробно.
Пиролиз
Пиролиз отходов, содержащих поливинилхлорид,
классифицируется на несколько типов:
— некаталитический и каталитический, в ката-
литическом пиролизе добавление катализатора спо-
собствует ускорению дехлорирования, а добавление
сорбента снижает долю хлора в продуктах;
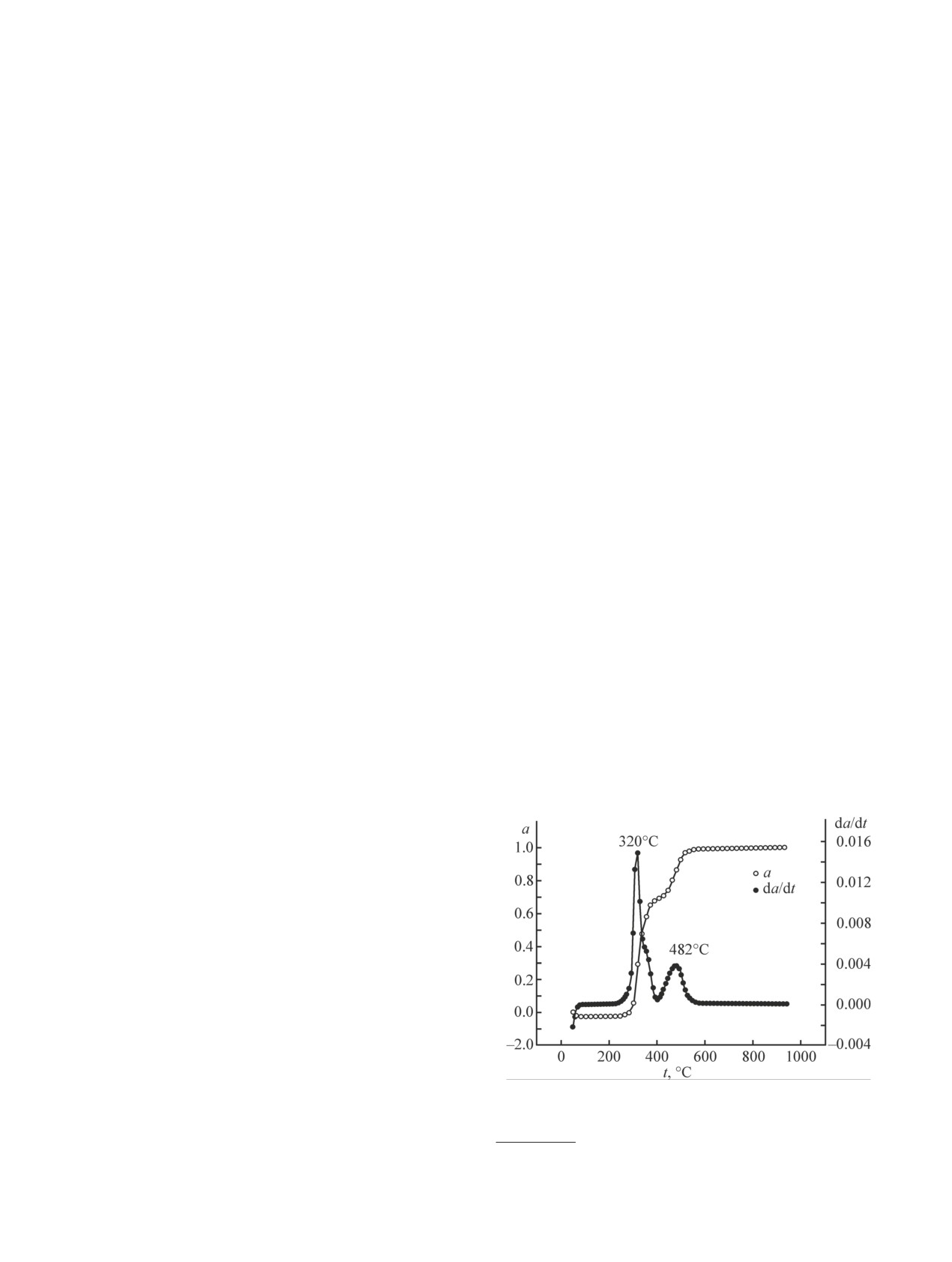
Рис. 5. Термогравиметрическая кривая разложения по-
— пиролиз чистого поливинилхлорида и поливи-
ливинилхлорида [31].*
нилхлорид-содержащих смесей (двухкомпонентных,
многокомпонентных смесей с поливинилхлоридом,
* Разрешение на публикацию получено 10.07.2020,
хлор- и бромсодержащих смесей, муниципальных
© 2008 Elsevier.
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1225
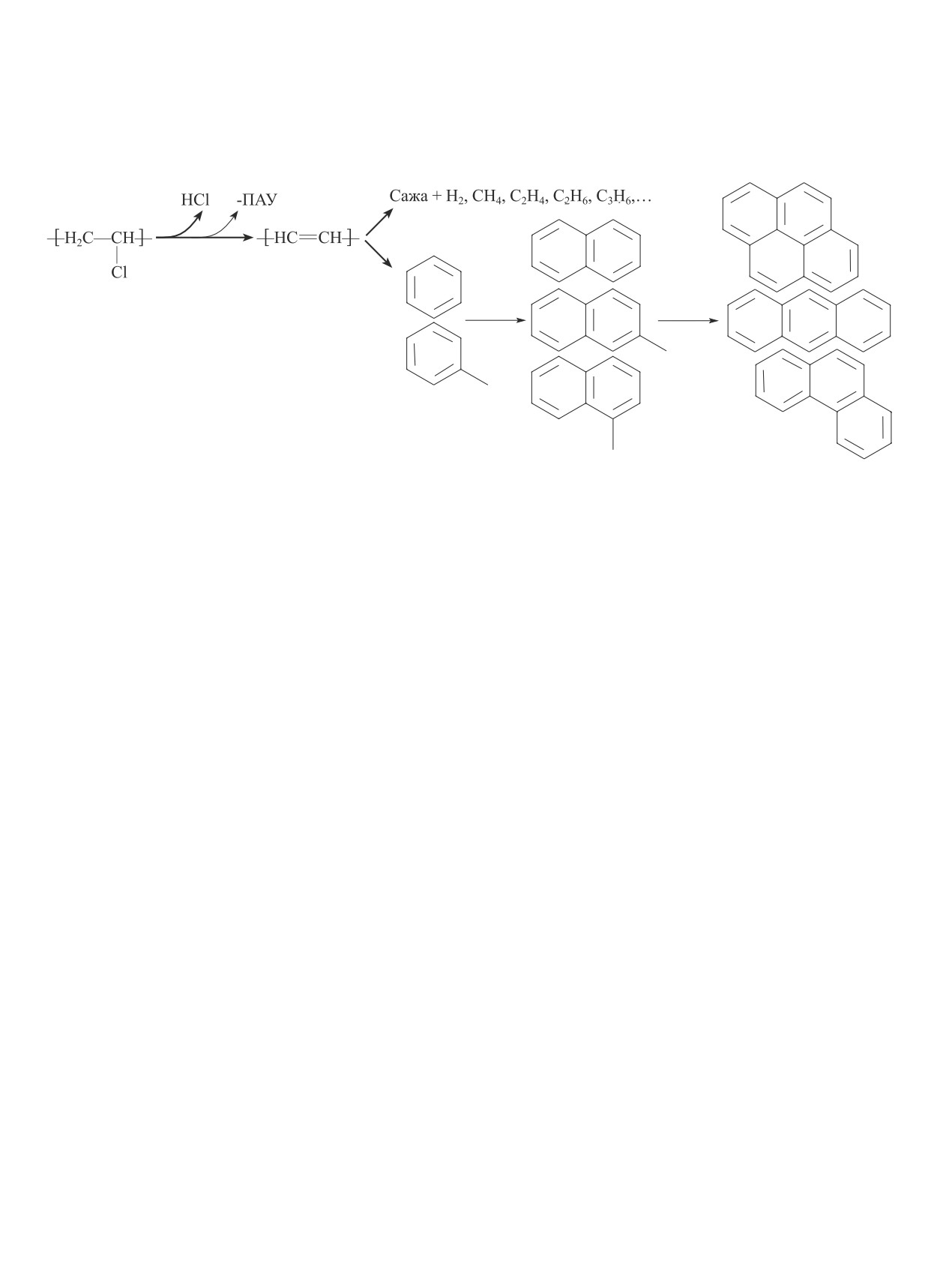
400-560°C с температурой максимального изменения
ливинилхлорида и, как следствие, пиролиза муни-
массы, равной 482°C, и потерей до 35% массы. При
ципальных отходов пластика является образование
этом первая стадия деградации протекает быстрее,
полициклических ароматических углеводородов (схе-
чем вторая. Продукты пиролиза состоят из хлористо-
ма 1), выбросы которых в окружающую среду нега-
го водорода (56%), бензола и его производных (6.3%),
тивно влияют на здоровье людей [34]. Исследование
углеводородных газов (28.6%) и твердого полукокса
влияния температуры на образование полицикличе-
(9.1%) [32], степень дехлорирования составляет 99%
ских ароматических углеводородов с 2-4 кольцами в
(табл. 1).
смоле пиролиза поливинилхлорида показало, что с
Использование реактора с проволочной сеткой
повышением температуры до 900°С доля некоторых
в пиролизе поливинилхлорида позволило свести к
полициклических ароматических углеводородов воз-
минимуму взаимодействие образующихся летучих и
растала в 6-8 раз, причем выход полициклических
пиролизующихся частиц поливинилхлорида, а также
ароматических углеводородов, полученный при мед-
вторичных реакций летучих компонентов [33]. С по-
ленном пиролизе, был значительно ниже по сравне-
вышением температуры пиролиза до 500°С выход
нию с быстрым пиролизом.
полукокса снижался до 16% (рис. 6), доля атомов хло-
С повышением температуры от 500 до 900°С вы-
ра в поливинилхлориде при этом падала с 55 до 1%.
ход HCl снижался с 54.7 до 30.2%, тогда как увеличи-
Исследование механизма пиролиза показало, что
вался объем газообразных углеводородов. Медленный
при температуре ниже 450°C большая часть потери
пиролиз способствовал более высокому выходу HCl и
массы происходит за счет дегидрохлорирования, в то
более низкому выходу газа и смолы в отличие от бы-
время как углеводороды, образующиеся в процессе,
строго пиролиза, в котором неполное дегидрохлори-
составляют значительную массопотерю при повышен-
рование поливинилхлорида приводило к образованию
ных температурах (>450°C). 88% потери массы при
хлорированных ароматических соединений.
450°С обусловлено дегидрохлорированием, в то время
Использование добавок при пиролизе поливи-
как только 12% приходится на выделение углеводо-
нилхлорида во многих исследованиях предпола-
родов. Это говорит о том, что процесс циклизации/
гает либо ускорение процесса дехлорирования по-
ароматизации начинается на ранней стадии, в то время
ливинилхлорида за счет снижения температуры
как образование/выделение ароматических углеводо-
начала массопотерь [35], либо уменьшение доли
родов — на поздней стадии дегидрохлорирования.
хлорсодержащих соединений в продуктах реакции
Помимо образования хлорорганических соеди-
благодаря связыванию выделяющегося HCl сорбен-
нений одним из основных недостатков пиролиза по-
тами [3].
Рис. 6. Выход полукокса и содержание в полукоксе атомов хлора и углерода с повышением
температуры пиролиза [33].*
* Разрешение на публикацию получено 10.07.2020, © 2016 Elsevier.
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1227
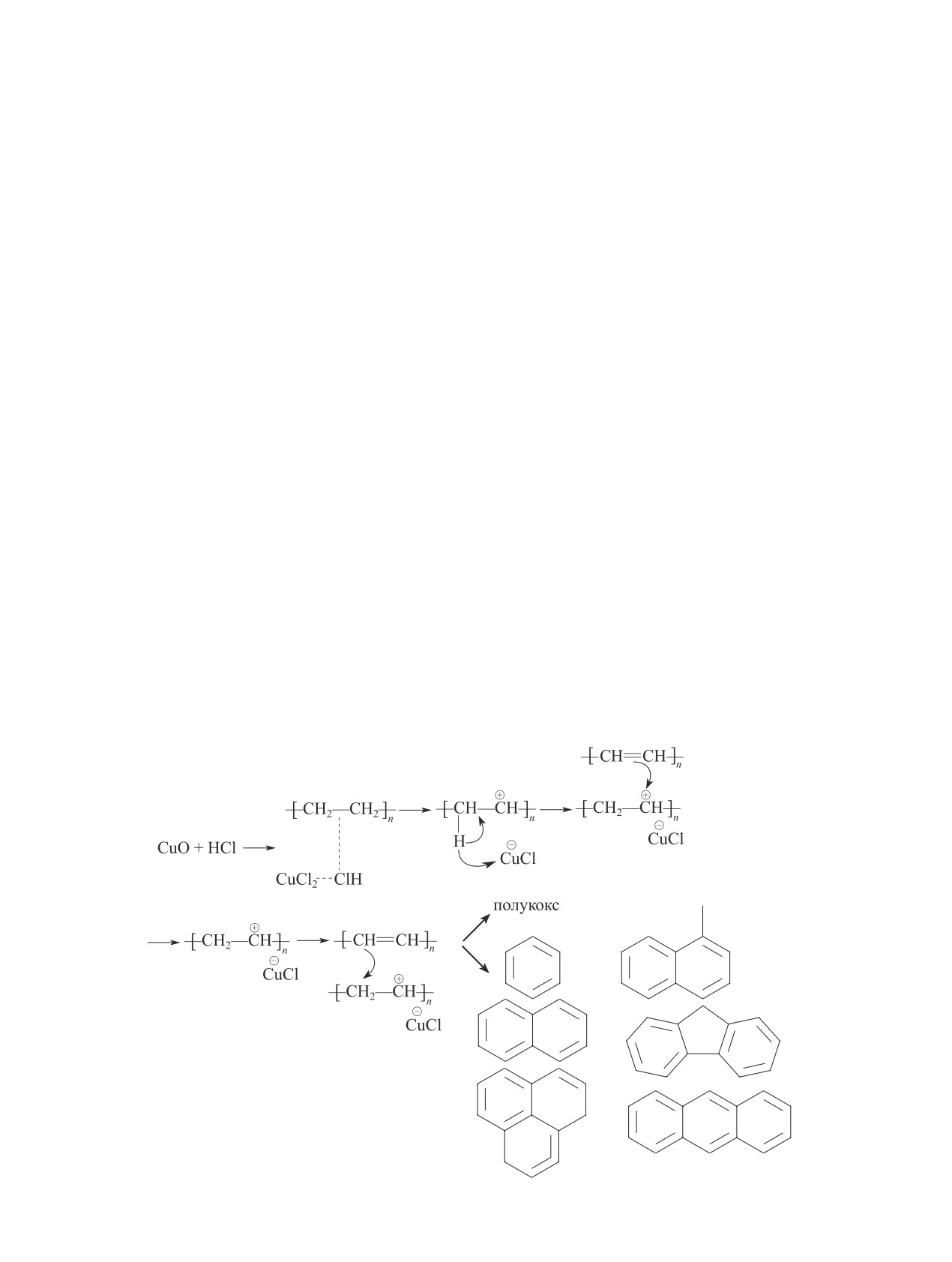
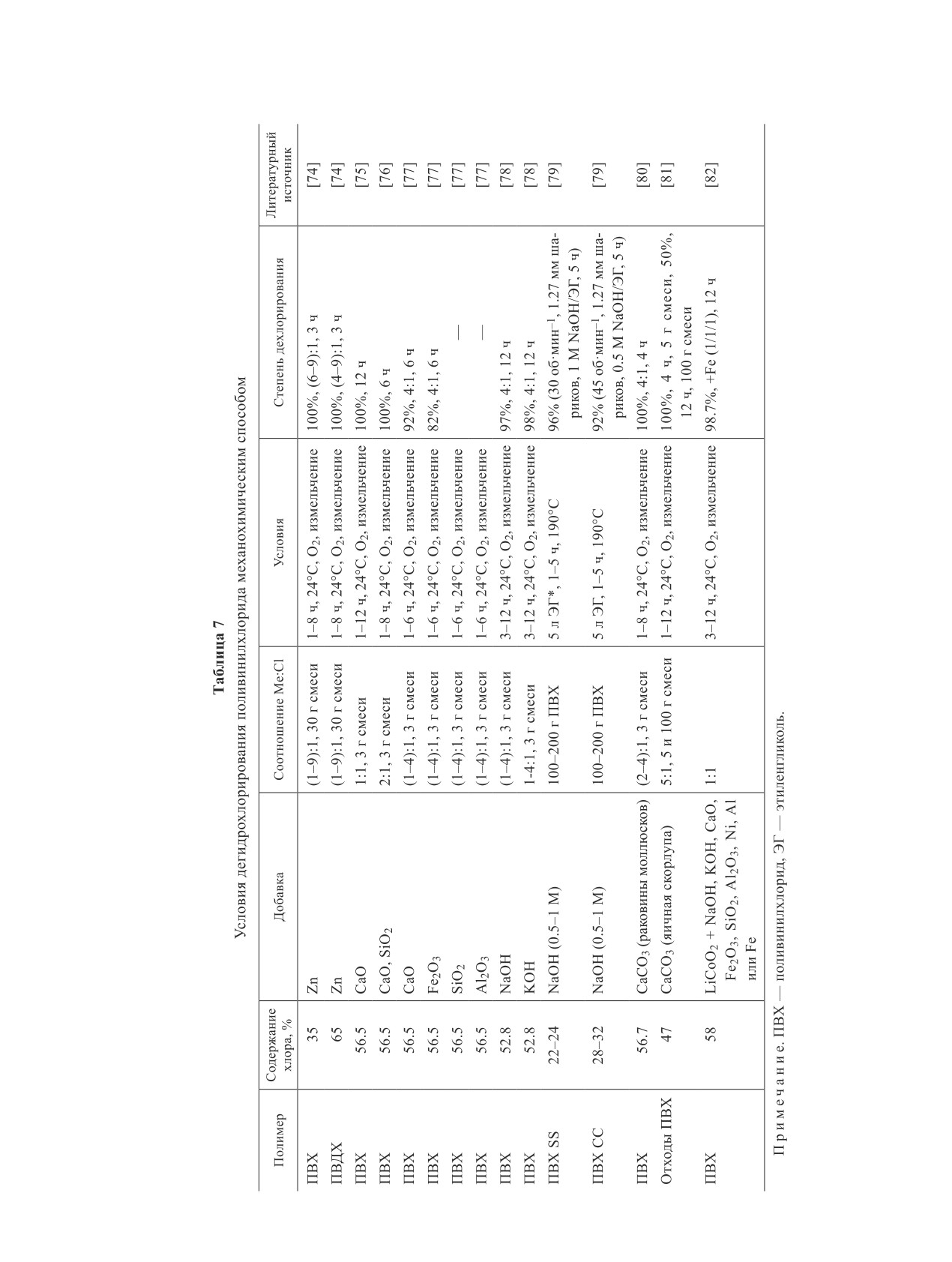
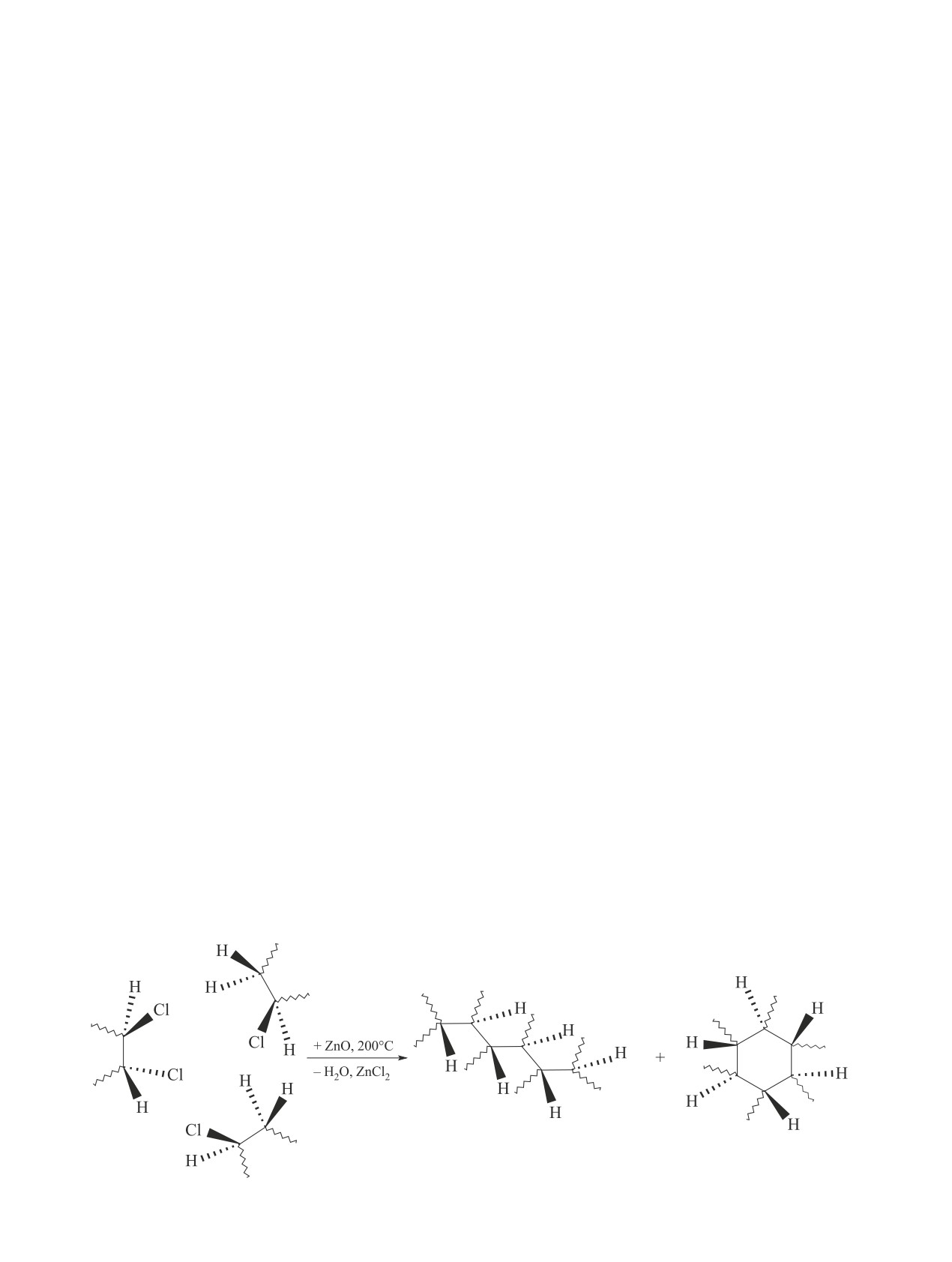
Схема 1
Механизм образования полициклических ароматических углеводородов в пиролизе поливинилхлорида
C1
Двустадийный пиролиз чистого поливинилхлори-
Алюминий не влияет на количество выделивше-
да и отходов, содержащих поливинилхлорид, прово-
гося в процессе разложения поливинилхлорида HCl,
дили в [36]. При некаталитическом пиролизе чистого
поскольку не взаимодействует с ним из-за пассиви-
поливинилхлорида доля жидкого масла составила
рующего оксидного слоя на его поверхности. При
16.9%, отходов поливинилхлорида — 12.1%, а смеси
образовании бензола из поливинилхлорида проис-
поливинилхлорид/нефтяные остатки — 43.8%. Выход
ходит не только удаление трех HCl из сегмента ше-
газообразного HCl в этом ряду падал (табл. 1). При
сти атомов углерода, но и отделение предварительно
добавлении нефтяных остатков к поливинилхлори-
образованного циклогексадиенового фрагмента от
ду в соотношении 4/6 происходило значительное
полимерной цепи. Снижение выхода бензола и толуо-
увеличение доли жидкого масла и снижение доли
ла также связано с ингибирующим действием железа
HCl (20.6%), что обусловлено взаимодействием ас-
и цинка. Алюминий способствует образованию HCl
фальтенов с радикалами хлора, образовавшимися в
и повышает долю алкилароматических соединений.
процессе крекинга поливинилхлорида. Хлорирование
Наряду с бензолом в процессе дехлорирования поли-
асфальтенов протекало очень быстро, о чем свиде-
винилхлорида в присутствии алюминия образуются
тельствовало образование меньшего количества вы-
нафталин и антрацен. Присутствие оксида алюми-
деляемого HCl. Результаты каталитического пиролиза
ния или диоксида титана приводит к повышению
поливинилхлорида над 5% Fe2O3/С незначительно
температуры дехлорирования поливинилхлорида и
отличались от некаталитического: доля газообразного
скорости процесса.
HCl составляла 50.6, жидкого масла — 11.1%, что
Пиролиз поливинилхлорида в присутствии окси-
говорит о неэффективности катализатора в пиролизе
дов металлов, в том числе редкоземельных, проводи-
поливинилхлорида. При использовании железосодер-
ли в [37]. Основными компонентами жидких продук-
жащего катализатора возрастала доля нерастворимых
тов являлись ароматические углеводороды С6-С14, в
органических соединений — до 36.6% по сравнению
том числе бензол и толуол. При добавлении Fe2O3 и
с чистым поливинилхлоридом (28.1%).
ZnO значительно снижалось количество жидких про-
Влияние некоторых металлов (Al, Fe, Zn), оксидов
дуктов, на 30%, по сравнению с количеством масел,
металлов (Al, Ti, Cu, Fe, Са) и карбоксилатов (Zn, Sn)
образованных при пиролизе чистого поливинилхло-
на пиролиз поливинилхлорида было изучено в [35]
рида, а при добавлении Al2O3, наоборот, повышалось,
при температурах 350-550°С. Взаимодействие ме-
при этом росла доля бензола и толуола. Высокий вы-
таллов и оксидов с поливинилхлоридом происходит
ход газообразных СО и CO2 в смеси поливинилхло-
посредством поверхностных контактов без какого-ли-
рид/Fe2O3 обусловлен восстановлением оксида же-
бо перемешивания. Металлы Fe, Zn, оксиды Fe, Cu и
леза до металла в данных условиях. В присутствии
карбоксилат цинка благодаря достаточно большому
Al2O3 доля газообразных продуктов была на 70%
радиусу катиона способствовали снижению темпера-
меньше, чем при пиролизе чистого поливинилхлори-
туры дехлорирования за счет образования хлоридов
да. Наличие PbO и редкоземельных оксидов на выход
металлов.
газов по сравнению с чистым поливинилхлоридом
1228
Захарян Е. М. и др.
не влияло. Образование полукокса увеличивалось
в качестве высокоэффективного подавителя дыма
с добавлением ZnO, тогда как CaO способствовал
приводило к снижению количества образующихся
снижению доли углерода в остатке.
ароматических соединений и к значительному по-
В процессе пиролиза хлор из поливинилхлорида
вышению содержания алифатических соединений
выделяется не только в виде газообразного HCl, кото-
в летучих веществах (700°С, N2). Таким образом,
рый хлорирует оксиды до оксихлоридов и хлоридов
они предотвращали образование полиолефиновых
металлов, но и в виде хлорорганических сооединений,
структур, тем самым снижая токсичность летучих
что было показано ранее [3]. Fe2O3 и CeO2, как кисло-
продуктов пиролиза. Оксиды переходных металлов
ты Льюиса, способствуют процессу галогенирования
(V, Mo, Ti) способствовали межмолекулярной реак-
бензола по Фриделю-Крафтсу с образованием хлор-
ции поперечного сшивания, формируя стабильную
бензола (табл. 1), тогда как ZnO подавляет этот процесс.
структуру мостика физической связи и уменьшая
Редкоземельные оксиды (Lа2O3, Nd2O3, CeO2) де-
образование полициклических ароматических угле-
монстрировали отличную способность фиксировать
водородов. Каталитические свойства оксидов падали
значительное количество исходного хлора из поли-
в ряду V2O5 > MoO3 > TiO2. Катион металла в оксиде
винилхлорида [37]. Так, добавление Lа2O3 способ-
образовывал водородную связь с ионами водорода
ствовало удалению хлора из поливинилхлорида в
в поливинилхлориде (схема 2). Мо6+ в МоО3 инги-
виде LаOCl с эффективностью более 95% при 800°С
бировал циклизацию цепей поливинилхлорида до
и 75% при 400°С. При 800°С PbO связывал до 70%
ароматических и токсичных соединений.
выделяющегося HCl с образованием хлорида свинца,
Оксиды Cu, Zn, Mn способствовали формиро-
а Fe2O3 и CeO2 сорбировали всего 20-30% хлорово-
ванию сшитой структуры за счет взимодействия с
дорода. Хлорирование Al2O3 в данных условиях не
выделяющимся HCl, что препятствовало образова-
наблюдалось благодаря инертности оксида.
нию полициклических ароматических углеводоро-
Как и в предыдущих исследованиях, добавление
дов. Полученные в результате хлориды металлов
оксидов переходных металлов, таких как V, Mo, Ti,
взаимодействовали с атомом хлора полимера с об-
Cu, Zn и Mn, способствовало снижению начальной
разованием электрофильного комплекса (схема 3),
температуры разложения двух стадий пиролиза по-
что способствовало образованию поперечных связей
ливинилхлорида [38]. Использование данных оксидов
между молекулами за счет электрофильного присо-
Схема 2
Механизм воздействия первого типа оксидов переходных металлов
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1229
единения. Эффективность связывания атома хлора
10-30 раз. Образующийся в процессе сжигания смеси
оксидами металлов в хлориды уменьшалась в ряду
поливинилхлорид/Fe и действующий в качестве кис-
CuO > ZnO > MnO2. Использование MnO2 приводило
лоты Льюиса хлорид железа способствуют процес-
к снижению скорости образования HCl, тогда как CuO
су межмолекулярной циклизации полиеновой цепи
способствовал процессу дегидрохлорирования поли-
(внутримолекулярная циклизация не происходит),
винилхлорида на первой стадии пиролиза. Добавка
что приводило к образованию незамещенных арома-
цинка приводила к формированию углеродного слоя,
тических соединений, таких как бензол и некоторые
уменьшая образование полиенов и ароматических
полициклические ароматические углеводороды, и их
летучих соединений, и снижению концентрации дыма
хлорированию.
и токсичности.
За счет каталитического оксихлорирования FeCl3
Применение оксидов всех упомянутых металлов
промежуточной полимерной цепи, образующейся при
(V, Mo, Ti, Cu, Zn и Mn) способствовало увеличению
дегидрохлорировании поливинилхлорида в смеси
количества остаточного углерода в системе и образо-
He/O2, содержание токсичных полихлорированных
ванию карбонизированного слоя.
дибензодиоксинов достигало 8217 тыс. пг в 1 г по-
Одно- и двустадийное сжигание чистого поливи-
ливинилхлорида, в то время как без Fe это значение
нилхлорида и смеси поливинилхлорид/наночастицы
составляло всего 183 пг в 1 г поливинилхлорида.
железа (60/40) при 850°С и в две стадии (375 и 850°С)
Авторы [40, 41] исследовали кинетику пиролиза
проводилось в [39]. Сжигание поливинилхлорида
отходов поливинилхлорида, смешанных с пылью
протекало в два этапа: термическое разложение с
электродуговой печи (ПЭДП), являющейся побочным
выделением HCl и бензола и последующее сжига-
продуктом металлургических процессов, образую-
ние углеродистого остатка. Присутствие наночастиц
щейся в электродуговых печах во время выплавки
железа ускоряло процесс дегидрохлорирования за
стали. Токсичность пыли обусловлена наличием сое-
счет снижения температуры начала потери массы,
динений тяжелых металлов: цинцита (ZnO), франкли-
как и в [35]. Так, в продуктах всех процессов сжига-
нита (ZnFe2O4), магнетита (Fe3O4), гематита (Fe2O3),
ния были обнаружены хлорбензолы и хлорфенолы,
галита (NaCl), сильвита (KCl), гидроксихлорида
наличие наночастиц Fe повышало их количество в
свинца (PbOHCl) и т. д.
Схема 3
Механизм воздействия второго типа оксидов переходных металлов
3
3
3
3
1230
Захарян Е. М. и др.
За счет быстрого взаимодействия выделяющегося
490°С образованием 1.5 мас% остатка. Полипропилен
HCl с оксидами металлов снижалась температура
и полиэтилен деградируют при более высоких тем-
начала массопотерь. Общая потеря массы на первой
пературах — 420-530 и 450-550°С соответственно.
стадии пиролиза смесей поливинилхлорид/ПЭДП с
Разложение акрилонитрил-бутадиен-этиленстироль-
соотношениями 1:1, 1:2 и 1:3 составляла 21.5, 32 и
ного сополимера протекает, как правило, одностадий-
39% соответственно, что ниже, чем у чистого поли-
но при 349-514°C, при этом оставляя всего 1.7 мас%
винилхлорида (45-55%), а увеличение остаточной
твердого остатка [43].
массы, связанной с образованием хлоридов металлов
Максимальные скорости разложения чистого по-
в твердой фазе, — 26, 20 и 16.5% соответственно.
ливинилхлорида в работе [44] наблюдались при 321
Также наблюдалось увеличение выхода бензола за
и 493°С. Добавление полиэтилена, полистирола и
счет циклизации и разложения полиена, образую-
смеси полиэтилен/полистирол не изменяло темпера-
щегося при выделении хлороводорода из поливи-
туры начала дехлорирования, изменялся только тем-
нилхлорида. С помощью масс-спектроскопии было
пературный режим второй стадии, т. е. циклизации/
обнаружено образование метанола и пропина при
ароматизации, сшивки и крекинга. Так, второй этап
температуре выше 350°C. Оксиды железа оставались
разложения смеси полиэтилен/поливинилхлорид в
в остатке пиролиза, в то время как Zn и Pb превра-
соотношении 1:1 протекал с максимальной скоро-
щались в растворимые хлориды металлов, которые в
стью при 507°С, т. е. добавление полиэтилена спо-
дальнейшем можно было извлечь выщелачиванием
собствовало повышению температуры разложения
в воде.
поливинилхлорида. Добавление полистирола и смеси
Использование катализаторов во всех случаях
полиэтилен/полистирол, наоборот, приводило к сни-
ускоряло процесс дехлорирования поливинилхлори-
жению этой температуры до 462 и 456°С.
да, при этом некоторые, такие как Fe2O3 и CeO2 [3], за
Влияние полипропилена, полиэтилена низкой
счет кислотных свойств способствовали образованию
плотности и полистирола на двухкомпонентный пи-
хлорорганических соединений в пиролизном масле, а
ролиз поливинилхлорид-содержащих смесей изучали
также снижали долю пиролизного масла в продуктах
в [45], при этом пиролиз смеси полипропилен/по-
[35]. Основные оксиды (Lа2O3 [3], CaO [33, 35]), а
ливинилхлорид проводили при температуре 380°С,
также амфотерный ZnO действовали в качестве свя-
смеси полиэтилен/поливинилхлорид — при 430°С,
зующего хлороводород сорбента, снижая содержание
смеси полистирол/поливинилхлорид — при 360°С,
хлорсодержащих соединений как в газообразных про-
выбор температуры был обусловлен температурами
дуктах, так и в жидких маслах. Образующиеся хлори-
разложения компонентов смеси с поливинилхлори-
ды металлов в твердом остатке удаляли, как правило,
дом. Добавление полимера к поливинилхлориду во
выщелачиванием. Сжигание частиц поливинилхло-
всех случаях приводило к повышению доли жидких
рида при высоких температурах [39] в присутствии
частиц железа приводило к значительному образова-
нию не только хлорбензолов и хлорфенолов, но и бо-
лее опасных полихлорированных дибензодиоксинов.
Полученные результаты использования металлов и их
оксидов в лабораторных экспериментах пиролиза чи-
стого поливинилхлорида позволят применять их уже
в пиролизе поливинилхлорид-содержащих смесей.
Пиролиз бинарных смесей, содержащих поливи-
нилхлорид. Поливинилхлорид [31] начинает разру-
шаться при 250-260°С, разложение происходит в
два этапа: 250-360°С соответствует полному уда-
лению HCl с образованием 54.2 мас% углеродисто-
го остатка, Т ≥ 410°С — деградации и циклизации
оставшейся полиеновой структуры с образованием
Рис. 7. Термогравиметрические кривые полиэтилена (1),
15 мас% остатка (рис. 7) [42]. Полиэтилентерефталат
полипропилена (2), полистирола (3), поливинилхлорида
разрушается при 400-500°С, оставляя около 15 мас%
(4), полиэтилентерефталата (5) [42].*
твердого остатка, который в свою очередь разлагается
при более высокой температуре (>640°С). Разложение
* Разрешение на публикацию получено 10.07.2020,
полистирола начинается при 300 и заканчивается при
© 2004 Elsevier.
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1231
масел по сравнению с чистым поливинилхлоридом.
(243-378°С), тогда как на втором, за счет разложения
Выход пиролизных масел падал в ряду полипропи-
сополимера — уже 76.3, 56.3 и 40.5% соответствен-
лен/поливинилхлорид (73%) > полиэтилен/поливи-
но (367-533°С). Первые пики потери массы смесей
нилхлорид (69%) > полистирол/поливинилхлорид
в соотношении 75/25, 50/50 и 25/75 зафиксированы
(60%), при этом больший выход твердого остатка
при 304, 311 и 317°C соответственно, в то время как
(27%), который состоит из полукокса и тяжелых угле-
при разложении чистого поливинилхлорида эта тем-
водородов, достигался в случае разложения смеси
пература составляла 322°С. Доля твердого остатка
полистирол/поливинилхлорид. Большая часть хлора
возрастала с повышением содержания поливинилхло-
из поливинилхлорида выделялась в виде газообраз-
рида до 17.6%.
ного HCl (91-96%). За счет взаимодействия выде-
Сравнение пиролиза поливинилиденхлорида с
ляющегося хлороводорода из поливинилхлорида и
поливинилхлоридом, как чистого, так и в смеси с
образующихся мономеров из полистирола, полипро-
полипропиленом, полиэтиленом и полистиролом,
пилена, полиэтилена значительно возрастала доля
проводилось в [47]. Пиролиз чистого поливинили-
хлорорганических соединений (до 3-12%) по срав-
денхлорида сопровождался образованием 68% газов
нению с долей хлорированных соединений, обра-
и 32% твердого остатка в отличие от чистого поливи-
зованных при пиролизе чистого поливинилхлорида
нилхлорида [36] без жидких продуктов за счет боль-
[39]. Содержание хлорорганических соединений в
шего содержания хлора (73.2 мас% Cl) и более низкой
жидких продуктах падало в ряду полипропилен/по-
температуры разложения. Разложение поливинили-
ливинилхлорид > полистирол/поливинилхлорид >
денхлорида начинается уже при 200°C в отличие от
полиэтилен/поливинилхлорид с 12 700 до 2800 ppm
250°C при разложении поливинилхлорида, и проис-
(табл. 2). В пиролизных маслах основную часть соот-
ходит потеря более 50% массы при 300°C против 350
ветственно представляли мономеры полипропилена,
у поливинилхлорида. Пиролиз двухкомпонентных
полистирола и полиэтилена и их производные.
смесей, т. е. добавление к поливинилиденхлориду
Пиролиз смеси полистирол/поливинилхлорид
других полимеров, приводит к образованию 61-74%
[46] при температуре пиролиза полиэтилен/поливи-
пиролизного масла за счет снижения доли газов и
нилхлорид (430°С) в потоке N2 приводил к повыше-
твердого остатка, которого в отличие от чистого по-
нию выхода масел (67.7%), а пиролиз полипропилен/
ливинилиденхлорида было получено не более 5-9%.
поливинилхлорид [46], наоборот, к снижению их
Образование хлорированных углеводородов в
доли (56.7%) по сравнению с пиролизом смесей, ис-
жидких продуктах уменьшалось в ряду полистирол/
следуемым в работе [45]. Эффективность повышения
поливинилиденхлорид > полипропилен/поливини-
температуры заключалась в образовании меньшего
лиденхлорид > полиэтилен/поливинилиденхлорид,
количества хлорорганических соединений в пиролиз-
при этом содержание хлорсодержащих соединений
ных маслах — 81 ppm в продуктах смеси полистирол/
в продуктах было в разы меньше, чем в аналогич-
поливинилхлорид и 365 ppm в продуктах смеси поли-
ных смесях с поливинилхлоридом, хотя доля ато-
пропилен/поливинилхлорид [46].
мов хлора в поливинилиденхлориде выше, чем в
Влияние добавки акрилонитрил-бутадиен-эти-
поливинилхлориде. Этот факт можно объяснить тем,
ленстирольного сополимера на пиролиз поливи-
что большая часть хлора из поливинилиденхлорида
нилхлорида изучалось при различных массовых со-
выделялась при более низких температурах, чем из
отношениях в смеси (1/3, 1/1, 3/1) [43]. Основными
поливинилхлорида, и тем, что происходило разло-
компонентами пиролизного масла акрилонитрил-бу-
жение полиэтилена, полипропилена и полистирола.
тадиен-этиленстирольного сополимера являлись
Наибольшее содержание хлорированных углеводоро-
его мономеры, т. е. стирол, бензол, α-метилстирол
дов в маслах смеси полистирол/поливинилиденхло-
и бензолбутаннитрил. Взаимодействие акрилони-
рид было связано с более высокой реакционной
трил-бутадиен-этиленстирольного сополимера и по-
способностью стирольного мономера с HCl по срав-
ливинилхлорида в смеси приводило к более раннему
нению с другими ненасыщенными углеводородами.
разложению и поливинилхлорида с ускорением вы-
Основными хлорсодержащими продуктами в
деления HCl, и акрилонитрил-бутадиен-этиленсти-
пиролизном масле смесей полиэтилен/поливинили-
рольного сополимера. На первом этапе протекало
денхлорид и полипропилен/поливинилиденхлорид
дехлорирование поливинилхлорида с потерей массы
являлись 2-хлор-2-метилпропан и 2-хлор-2-метил-
смесей акрилонитрил-бутадиен-этиленстирольный
пентан и 2-хлор-этилбензол и 2-хлор-2-фенилпропан
сополимер/поливинилхлорид 15, 29.4 и 41.9% при
в смеси полистирол/поливинилиденхлорид, как и в
соотношении 75/25, 50/50 и 25/75 соответственно
аналогичных смесях поливинилхлорида.
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1233
1234
Захарян Е. М. и др.
Использование сорбентов необходимо для связы-
La-MgO проявлял активность и стабильность в те-
вания выделяемого газообразного хлороводорода,
чение 5 циклов.
что, как правило, приводит к снижению газообраз-
Влияние сорбентов и катализаторов на удале-
ного хлора и хлора в жидких продуктах. При этом
ние хлора в пиролизе смесей полипропилен/поли-
большая часть хлора, образованного при разложении
винилхлорид, полиэтилен низкой плотности/поли-
поливинилхлорида, уходит в твердый остаток в виде
винилхлорид и полистирол/поливинилхлорид при
хлоридов металлов.
температурах, обусловленных температурами разло-
В [48] при пиролизе смеси полипропилен/поли-
жения компонентов смеси с поливинилхлоридом, изу-
винилхлорид в качестве HСl-сорбента использовали
чалось в [50]. При пиролизе смеси полипропилен/по-
MgO и MgO/C. Композитный MgO/С был получен
ливинилхлорид доля газообразного HCl падала c 82.3
путем взаимодействия Mg(OH)2 и сахарозы, исполь-
до 6.1% в ряду γ-Al2O3 > MgO > Al-Mg, где Al-Mg —
зуемой в качестве источника углерода, который в
композитный оксид, полученный осаждением солей
свою очередь способствовал предотвращению агло-
металлов в спиртовом растворе NH3 с последующим
мерации синтезированных наночастиц MgO. За счет
прокаливанием, в то время как доля хлороводорода,
большей площади поверхности и меньшего размера
выделяемого в процессе некаталитическогого пи-
частиц у MgO/С по сравнению с MgO усиливалось
ролиза смеси, составляла 88.2%. Доля хлороргани-
взаимодействие сорбента MgO/С с выделяющимся в
ческих соединений аналогично снижалась до 2.8%,
процессе пиролиза HCl, при этом наличие углерода
тогда как в продуктах некаталитического пиролиза
в композите способствовало разложению хлорор-
их доля составляла 11.7%. Высокая эффективность
ганических соединений, образующихся в данном
композитного катализатора по сравнению с други-
процессе (табл. 2).
ми добавками была связана с кислотно-основными
При некаталитическом пиролизе смеси полипро-
свойствами его компонентов, взаимно усиливающих
пилен/поливинилхлорид доля газообразного HCl со-
друг друга: благодаря основным свойствам MgO про-
ставляла 80, хлорорганических соединений — 20%.
являл значительную дехлорирующую способность,
С добавлением сорбентов доля выделившегося хло-
благодаря кислотным свойствам γ-Al2O3 — крекин-
роводорода и хлорорганических соединений зна-
гующую.
чительно снижалась: до 13.7% над MgO и до 2.1%
При пиролизе смесей полиэтилен низкой плотно-
над MgO/С, где 1.1% — HCl и 1% — хлорирован-
сти/поливинилхлорид и полистирол/поливинилхло-
ные углеводороды, такие как 2-хлор-2-метилпро-
рид наблюдалась аналогичная эффективность ком-
пан, 2-хлор-2-метилбутан, 2-хлор-2-метилпентан и
позитного катализатора: Al-Mg, связывая в 17-19 раз
3-хлор-3-метилпентан. Оставшийся хлор (около 95%)
больше газообразного хлороводорода, снижал долю
выделялся в виде хлорида магния над MgO/С и около
органического хлора в 3-4 раза по сравнению с не-
82% — над MgO.
каталитическим пиролизом. Путем взаимодействия
Добавление La в MgO заметно ускоряло скорость
композита с выделяющимся HCl до 91-93% хлоро-
разложения смеси полипропилен/поливинилхлорид
водорода было преобразовано в хлориды металлов.
и приводило к снижению среднего числа углерод-
В [45] рассматривалось одновременное использо-
ных атомов в жидких продуктах [49] (до 10 над
вание катализатора Al2O3-SiO2 (SA-1) и сорбентов
La-MgO и до 20 над MgO), что можно объяснить
на основе оксидов железа (FeOOH, Fe2O3, Fe3O4) в
значительным повышением числа кислотных цен-
пиролизе смеси полипропилен/поливинилхлорид. Как
тров в катализаторе за счет La2O3 и большей площа-
и в [50], добавка Al2O3-SiO2 способствовала значи-
ди его поверхности. По сравнению с результатами,
тельному ускорению процесса разложения полимеров
полученными при пиролизе полимерной смеси в
и снижению удельного веса жидких продуктов по
присутствии MgO и MgO/С [48], за счет усилен-
сравнению со скоростью термического разложения и
ного взаимодействия сорбента La-MgO [37] с об-
удельным весом образованных в его процессе жидких
разующимся в ходе разложения поливинилхлори-
продуктов, а сорбенты снижали долю хлороргани-
да хлороводородом доля HCl снижалась до 0.54, а
ческих соединений. Лучший результат был достиг-
доля хлорорганических соединений — до 0.11%.
нут при парофазном контакте смеси катализатора и
Поскольку на поверхности катализатора MgO в про-
сорбента — 1100 ppm хлорированных углеводоро-
цессе реакции образовывалась «кора» MgCl2, инги-
дов (C6-C10) в жидкой фазе, тогда как в пиролизном
бирующая дальнейшую способность дегидрохло-
масле, образованном в результате разложения смеси
рирования поливинилхлорида, данный катализатор
полипропилен/поливинилхлорид, органического хло-
не мог далее повторно использоваться, тогда как
ра содержалось 12700 ppm. Сравнение железосодер-
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1235
жащих сорбентов показало, что наиболее эффектив-
взаимодействием оксида кальция с хлором, выделя-
ными оказались FeOOH и Fe3O4.
емым в шнековом реакторе из поливинилхлорида.
Сравнение каталитических и дехлорирующих
Наилучший результат показало применение известко-
свойств катализатора SA-1 и сорбентов γ-Fe2O3 и
вого горячего фильтра на втором этапе — было полу-
RedMud, состоящего из смеси оксидов металлов, из-
чено пиролизное масло, содержание хлорированных
учалось в пиролизе смеси полиэтилен/поливинилхло-
углеводородов в котором составляло всего 9.25 ppm.
рид в [46]. Доля газообразного HCl, выделяемого
Добавление полипропилена, полистирола, поли-
при разложении поливинилхлорида, падала в ряду
этилена и акрилонитрил-бутадиен-этиленстироль-
«без катализатора» > SA-1 > γ-Fe2O3 > RedMud до
ного сополимера к поливинилхлориду приводило к
23.1%. Как и в [45], SA-1 проявлял лишь каталити-
увеличению не только доли жидких продуктов, но и
ческие свойства в разложении поливинилхлорида.
содержания хлорорганических соединений в них за
Лучшая поглотительная способность RedMud была
счет взаимодействия выделяющегося хлороводорода
обусловлена большей адсорбцией HCl на поверхно-
в процессе разложения поливинилхлорида с выделя-
сти сорбента по сравнению с γ-Fe2O3 [51]. Меньшее
ющимися мономерами полиэтилена, полипропилена,
содержание органического хлора в жидком масле
полистирола и акрилонитрил-бутадиен-этиленсти-
некаталитического пиролиза (0.1%) по сравнению
рольного сополимера. Добавка полиэтилена в смеси
с каталитическим (0.2-0.7%) было связано с влия-
полиэтилен/поливинилхлорид способствовала сниже-
нием потока N2, частично подавляющего реакцию
нию скорости разложения поливинилхлорида, тогда
между газообразным HCl и продуктами разложения
как добавка смеси полиэтилен/полипропилен и чисто-
полимеров. Как и в случае смеси полиэтилен/поли-
го полипропилена приводила к значительному уско-
винилхлорид, при пиролизе смесей полипропилен/
рению второй стадии разложения дехлорированного
поливинилхлорид и полистирол/поливинилхлорид
поливинилхлорида [44]. Проведение пиролиза смесей
меньшее содержание хлорированных соединений в
в потоке азота [46], частично подавляющего реакцию
масле наблюдалось при некаталитическом пиролизе,
между газообразным HCl и продуктами разложения
0.19 и 0.05% соответственно, тогда как меньше HCl
полимеров, показало большую эффективность в уда-
выделялось и больше твердого остатка образовыва-
лении хлорорганических соединений по сравнению с
лось с использованием RedMud.
процессом в атмосфере N2 [45]. Среди применяемых
В исследовании [52] изучался двухступенчатый
сорбентов наилучшие результаты показали La-MgO
пиролиз отходов полиэтилена низкой плотности и
[49], действующий и в качестве катализатора за счет
поливинилхлорида (m = 200 г) в присутствии не-
его усиленного взаимодействия с HCl — менее 0.11%
гашеной извести. На первой стадии проводилось
хлорсодержащих соединений в пиролизных маслах,
дехлорирование смеси в шнековом реакторе (400°С),
и RedMud [46] благодаря хорошей поглотительной
на второй — полное разложение полиэтилена низкой
способности (0.2-0.4%). Также менее 1% хлорор-
плотности и полиена поливинилхлорида в реакто-
ганических соединений в жидких продуктах было
ре с псевдоожиженным слоем (700°С). Основными
обнаружено при парофазном контакте в случае одно-
компонентами пиролизных газов являлись метан,
временного использования катализатора и сорбента
этилен, этан, пропилен, бутан и 1,3-бутадиен, общий
[45]. Сорбция атомов хлора СаО на втором этапе
выход ненасыщенных мономеров варьировался от
двухступенчатого пиролиза в полупромышленном
23 до 29% в зависимости от условий. Из реактора с
подходе позволила получить пиролизное масло с
псевдоожиженным слоем были получены пиролизные
минимальным содержанием хлорорганических сое-
масла, обогащенные ароматическими соединениями
динений — 9.25 ppm [52].
до 95%, среди которых содержалось до 51-80% мо-
Пиролиз отходов, содержащих поливинилхлорид.
ноциклических углеводородов, причем с добавлением
Поскольку отходы, как правило, представляют собой
извести выход бензола значительно увеличивался.
смеси, содержашие различные полимерные состав-
При проведении пиролиза без сорбента в пиро-
ляющие (в том числе полипропилен, полиэтилен,
лизном масле шнекового реактора содержалось око-
полистирол, поливинилхлорид, полиэтилентерефта-
ло 2500 ppm хлорорганических соединений, доля
лат и др.), необходимо проведение и исследование
которых снижалась до 500 ppm на второй стадии.
многокомпонентных систем, близких по составу к
При подаче негашеной извести вместе с сырьем со-
муниципальным отходам пластика [6].
держание органического хлора в шнековом масле
Многие авторы изучали пиролиз таких модельных
было ниже (443 ppm), чем в реакторном масле с псев-
смесей, как полипропилен/полистирол/полиэтилен/
доожиженным слоем (578 ppm), что обусловлено
поливинилхлорид в соотношении 3:3:3:1 (3П/ПВХ,
1236
Захарян Е. М. и др.
где 3П — полипропилен/полистирол/полиэтилен)
Изучение дехлорирования смеси пластиков, со-
и полипропилен/полистирол/полиэтилен/поливи-
держащей 40% полиэтилена, 35% полипропилена,
нилхлорид/полиэтилентерефталат в соотношении
18% полистирола, 4% полиэтилентерефталата и 3%
3:3:3:1:1 (3П/ПВХ/ПЭТ), исследуя влияние несколь-
поливинилхлорида, близкой по составу к муници-
ких добавок на дехлорирование поливинилхлорида
пальным отходам пластика, посредством пироли-
[6, 47, 50, 53, 54].
за в потоке азота в полупромышленных масштабах
Исследование некаталитического пиролиза мо-
(m = 100 г) являлось целью работы [53]. Проведение
дельных смесей 3П/ПВХ, 3П/ПВХ/ПЭТ и МОП про-
ступенчатого пиролиза (275-500°С) смеси приводило
водилось в [6]. Доля жидких продуктов (59%), по-
к снижению доли масел до 58.2-61.7% по сравне-
лученных при пиролизе муниципальных отходов
нию с обычным пиролизом (65.2%) в зависимости от
пластика, была выше, чем 3П/ПВХ/ПЭТ (53%), и
температуры первого этапа (275-300°С) и времени
ниже, чем 3П/ПВХ (70%). Относительно высокая
реакции при этой температуре (30-120 мин), при
доля твердых остатков у муниципальных отходов
этом росла доля газов и твердого остатка. При сту-
пластика (16%) по сравнению с модельными смесями
пенчатом пиролизе в маслах ароматических соедине-
(5 и 13%) была обусловлена наличием различных до-
ний образовалось на 15% меньше, чем при обычном.
бавок (пластификаторов и стабилизаторов), входящих
Ступенчатый пиролиз смеси полимеров позволил
в состав смеси полимерных отходов.
снизить содержание хлорированных соединений в
Содержание хлорированных соединений в жидких
маслах до 0.2 и твердом остатке до 0.1-0.2%, при
продуктах пиролиза росло в ряду 3П/ПВХ< 3П/ПВХ/
этом повышая долю газообразного HCl с 2.2 до 2.5%,
ПЭТ<МОП, что было связано с наличием полиэти-
тогда как при обычном пиролизе эти значения состав-
лентерефталата в модели смешанных пластиков и
ляли 0.5 и 0.3% соответственно.
муниципальных отходов пластика, который способ-
Использование катализатора предполагало ускоре-
ствовал повышению доли хлорированных углеводо-
ние процесса дехлорирования и последующего кре-
родов в маслах и, как следствие, резкому снижению
кинга образующихся углеводородов, а сорбентов —
доли неорганического хлора (табл. 3). Большее ко-
большую степень связывания газообразного HCl.
личество хлорсодержащих соединений в твердом
Тем самым снижается содержание хлорсодержащих
остатке муниципальных отходов пластика (53 мг) по
соединений в пиролизных маслах. Твердый остаток,
сравнению с долей хлорированных соединений, обра-
образующийся в процессе пиролиза, содержащий
зованных при пиролизе других смесей, было связано
допустимое количество хлорорганических соедине-
с взаимодействием выделяющегося хлороводорода
ний [18], можно использовать в качестве твердого
из поливинилхлорида с добавками, содержащимися
топлива.
в муниципальных отходах пластика. Методом газовой
Использование композитного Al-Mg [50] в каче-
хроматографии в составе жидких продуктов были
стве катализатора и сорбента в пиролизе 3П/ПВХ, как
обнаружены 2-хлор-2-фенилпропан, 2-хлор-2-метил-
и в пиролизе двухкомпонентных смесей, проводило к
пропан, 2-хлор-2-метилпентан, α-хлорэтилбензол и
значительному снижению доли хлорорганических со-
хлорсодержащие эфиры бензойных кислот. Жидкие
единений в пиролизных маслах (с 8100 до 1900 ppm)
продукты в основном состояли из углеводородов
и газообразного хлороводорода за счет поглощения
C7-С10 (до 45% в МОП, 40% в 3П/ПВХ/ПЭТ и 20%
MgO.
в поливинилхлориде), C13-С15 (до 10%) и C17-С19
Добавление сорбента CaCO3 при пиролизе смеси
(до 15%). Углеводороды C7-С10, имеющие большую
пластиков, содержащей 40% полиэтилена, 35% по-
долю в пиролизных маслах, представляли собой мо-
липропилена, 18% полистирола, 4% полиэтиленте-
номеры входящих в состав смеси полимеров.
рефталата и 3% поливинилхлорида [53], как и Al-Mg
Доля жидких продуктов при пиролизе 3П/ПВДХ
в [50], приводило к снижению доли хлорированных
составляла 58% [47], что было несколько меньше по
соединений в жидкой (25%) и газообразной (40%)
сравнению с долей масел, полученных при пиролизе
фазах за счет поглощения выделяемого из поливи-
3П/ПВХ [6]. Аналогично содержанию хлороргани-
нилхлорида хлороводорода. Образование большего
ческих соединений, образованных в жидких про-
количества соединений C5-C9, таких как стирол, то-
дуктах пиролиза чистого поливинилиденхлорида и
луол и др., в присутствии CaCO3, возможно, связано с
поливинилхлорида и их двухкомпонентных смесей,
каталитическими свойствами CaCO3. Больший объем
хлорсодержащих соединений в пиролизных мас-
газов в продуктах по сравнению с пиролизом без
лах 3П/ПВДХ содержалось меньше, чем в маслах
CaCO3 был обусловлен, вероятно, более глубоким
3П/ПВХ, — 0.3%, или 245 ppm.
крекингом, протекающим за счет взаимодействия
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1237
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1239
выделяющегося HCl с сорбентом CaCO3. В составе
щих из 35% полиэтилена низкой плотности, 32% по-
полученных твердых веществ пиролиза преобладал
лиэтилена высокой плотности, 24% полипропилена,
полукокс с высокой теплотой сгорания, который мог
4% поливинилхлорида, 3% димера этилен-пропилена
бы стать альтернативой ископаемому топливу, а также
и 2% полистирола, исследовали в [1]. В процессе
CaCO3 и CaCl2. Доля хлорорганических соединений
пиролиза углеводородные макромолекулы попадают
в пиролизных жидкостях при ступенчатом пиролизе
в поры катализатора, где происходит дополнительное
над CaCO3 не превышала 0.2%, в газах — 1.7, в твер-
расщепление связи С-С. Носитель SAPO-11 в отли-
дых остатках — ≤7.5%.
чие от ZSM-5 имеет немного больший средний диа-
Каталитический пиролиз смеси полимерных отхо-
метр пор, за счет чего более крупные молекулы, не
дов, описанных в [53], доля атомов хлора в которых
соответствующие размеру этих пор, не подвергались
составляла 1.1%, проводили в присутствии ZSM-5 и
дополнительному расщеплению. При достижении
RedMud в [54]. Как и следовало ожидать, при боль-
активных центров молекулами с длинной углеродной
шей температуре (500°C) за счет протекания более
цепью происходила циклизация и полициклизация с
глубокого крекинга снижалась доля жидких масел и
образованием кокса, который в свою очередь дезак-
росло содержание газов.
тивировал катализатор, за счет чего на катализаторах
Вследствие высокой пористости и кислотности
на основе SAPO-11 было образовано больше твердых
цеолита ZSM-5 его добавка способствовала процессу
продуктов (в том числе кокса) по сравнению с ZSM-5.
разложения полимерных компонентов, приводя к уве-
Добавление катализаторов к реакционной смеси
личению доли жидких продуктов по сравнению с не-
приводило к значительной изомеризации газообраз-
каталитическим процессом. Наличие большего числа
ных продуктов. Газы, полученные над Ni/ZSM-5,
кислотных центров Бренстеда в структуре цеолита
содержали в своем составе до 51.2-56.1% развет-
способствовало реакции ароматизации и ускорению
вленных углеводородов, а над Ni/SAPO-11/Ca(OH)2/
протекания коксообразующих реакций, приводящих
RedMud — 47.7-58.6%. Снижение доли разветвлен-
к быстрой дезактивации катализатора уже после пер-
ных углеводородов во втором случае было связано с
вого цикла. В отличие от цеолита RedMud оказал
добавлением Ca(OH)2 в каталитическую смесь.
незначительное влияние на распределение продуктов
Пиролизные масла представляли собой смеси
пиролиза.
углеводородов C5-С30: н-олефин и парафин, развет-
Доля хлорсодержащих соединений в пиролизном
вленные и ароматические углеводороды. При ис-
масле при термической обработке при 440°С состави-
пользовании катализаторов в пиролизных маслах
ла 0.2, при 500°С — 0.5%. С использованием цеолита
доля ароматических и ненасыщенных углеводородов
эта доля повышалась до 1.2 и 1.3%, при использова-
значительно повышалась за счет циклизации углево-
нии RedMud — до 0.5 и 1.1%, что, возможно, связано
дородных молекул в порах и на поверхности катали-
с высокой крекингующей способностью катализато-
затора вблизи активных центров.
ров с последующим образованием алкильных ради-
В газообразных продуктах некаталитического пи-
калов, которые в свою очередь взаимодействовали с
ролиза содержалось 102 202 ppm хлорорганических
HCl, выделяющимся при разложении поливинилхло-
соединений, в масле пиролиза — 4364, в остатке —
рида в смеси пластика.
1950.
Отсутствие хлороводорода в газообразных про-
За счет образования большего количества водоро-
дуктах обусловлено его взаимодействием с актив-
да в газообразных продуктах над Ni/ZSM-5, чем над
ными центрами катализаторов (ZSM-5 и RedMud).
Ni/SAPO-11, который легко связывался с радикалами
Большая доля хлорированных соединений в твердом
хлора в НСl (до 70 000 ppm), снижалась концентра-
остатке над RedMud (3.7-4.2%) по сравнению с со-
ция органических соединений хлора в пиролизном
держанием хлорорганических соединений в полу-
масле (до 500 ppm). С добавлением смеси сорбентов
коксе, полученном в процессе некаталитического
Ca(OH)2 и RedMud содержание хлорированных сое-
пиролиза (менее 0.1%) или пиролиза над цеолитом
динений в пиролизном масле значительно снизилось
(0.1%), была обусловлена взаимодействием оксидов
в обоих случаях: до 284 ppm над Ni/ZSM-5/Ca(OH)2/
металлов, входящих в состав катализатора, с выде-
RedMud и до 228 над Ni/SAPO-11/Ca(OH)2/RedMud.
ляющимся HCl с образованием соответствующих
Использование катализаторов вдвое уменьшило вы-
хлоридов.
ход газообразного хлороводорода.
Влияние каталитических смесей Ni/ZSM-5,
На примере пиролиза модельных смесей, содер-
RedMud, Ca(OH)2 и Ni/SAPO-11 на состав продуктов
жащих различные полимеры, и муниципальных
пиролиза муниципальных отходов пластика, состоя-
отходов пластика авторы [6] показали, что присут-
1240
Захарян Е. М. и др.
ствие в модельных смесях полиэтилентерефталата,
в жидких продуктах хлорорганических соединений
пластификаторов и стабилизаторов, имеющихся в
было обнаружено всего 228 ppm.
муниципальных отходах пластика, способствовало
Пиролиз бромсодержащих отходов в смеси с поли-
повышению доли хлорированных углеводородов в
винилхлоридом. Поскольку некоторые виды муници-
маслах. Ступенчатое повышение температуры пиро-
пальных отходов пластика содержат до 4% бромиро-
лиза в полупромышленном подходе в потоке азота
ванного акрилонитрил-бутадиен-этиленстирольного
смеси [53], близкой по составу к муниципальным
сополимера (AБС-Br) [6, 55], входящего в состав
отходам пластика, по сравнению с обычным пироли-
многих электронных и сенсорных устройств, актуаль-
зом приводило к снижению доли хлорорганических
ным вопросом в процессе переработки таких отходов
соединений на 21% за счет повышения содержания
является взаимное влияние хлор- и бромсодержа-
газообразного хлороводорода. В каталитическом пи-
щих соединений на совокупный пиролиз отходов.
ролизе [53, 54] среди добавок более эффективным
Авторы [42] исследовали влияние добавок по-
оказался сорбент CaCO3 по сравнению с RedMud, а
ливинилхлорида и (или) полиэтилентерефталата на
добавление цеолита ZSM-5, способствующего про-
некаталитический пиролиз смеси 3П/AБС-Br, где
цессу разложения с последующим повышением доли
АБС-Br содержит бромированный антипирен [56]
жидких масел, приводило к большему образованию
и оксид сурьмы. В отличие от чистого акрилони-
хлорированных соединений. При этом, как и в не-
трил-бутадиен-этиленстирольного сополимера раз-
каталитическом пиролизе, ступенчатый процесс в
ложение бромированного акрилонитрил-бутадиен--
присутствии CaCO3 улучшал качество пиролизных
этиленстирольного сополимера протекает в два этапа:
масел: 0.2% хлорорганических соединений по срав-
320-425°С соответствует выделению бромированного
нению с 0.6 при обычном пиролизе. Одновременное
антипирена и 470-520°С — разложению сополимера
использование различных катализаторов и сорбентов
на мономеры с образованием около 10 мас% твердого
в пиролизе муниципальных отходов пластика [1] по-
остатка, соединений, полученных путем внутренней
казало большую эффективность и активность цеолита
циклизации акрилонитрильных звеньев в сополиме-
Ni/SAPO-11 в совокупности с Ca(OH)2 и RedMud —
ре. Основными неорганическими газами, выделяю-
доля газообразного хлороводорода была снижена в
щимися в процессе разложения полимеров, являются
2 раза за счет сорбции в отличие от некаталитиче-
NH3, HCN, HCl и HBr.
ского пиролиза муниципальных отходов пластика, а
Структура олигомера бромированной эпоксидной смолы с концевыми трибромфенольными группами
(диглицидиловый эфир 2,6,2,6-тетрабромбисфенола А)
Пиролиз 3П/AБС-Br приводил к образованию
как деградация смеси 3П/AБС-Br протекала около
11 мас% газообразного продукта, 13 мас% твердого
4 ч, т. е. присутствие поливинилхлорида и (или) по-
остатка и 73 мас% масел. Добавка поливинилхлори-
лиэтилентерефталата значительно ускоряло процесс
да и (или) полиэтилентерефталата способствовала
разложения за счет снижения температур, при кото-
снижению доли масел (до 52% в случае + поливи-
рых происходила максимальная потеря полимерной
нилхлорид + полиэтилентерефталат) и повышению
массы.
доли газообразных продуктов (до 22% в случае + по-
При термической деградации полиолефины дают
ливинилхлорид + полиэтилентерефталат), при этом
широкий спектр линейных насыщенных и ненасы-
в присутствии поливинилхлорида в полимерной
щенных углеводородов, а также небольшие коли-
смеси увеличивалось образование парафиновых
чества ароматических соединений из полиэтилена,
угеводородов и уменьшалось образование твердо-
разветвленных и ароматических углеводородов из
го остатка. Среднее число атомов углерода в мас-
полипропилена и в основном стирол и другие про-
лах варьировалось от 9.4 до 9.8. Разложение смеси
изводные бензола из полистирола. Присутствие по-
3П/AБС-Br/ПВХ/ПЭТ длилось всего 2 ч, в то время
ливинилхлорида и полиэтилентерефталата в смеси
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1241
3П/AБС-Br способствовало снижению количества тя-
ла обусловлена структурой катализатора, который
желых соединений C13-C17, образованных в процессе
при каталитическом разложении гидратировался до
разложения полиэтилена и полипропилена, путем
Fe2O3·nH2O, Fe2O3 и, наконец, до Fe3O4. Fe2O3, дей-
преобразования их в легкие C5-C8.
ствующий в качестве катализатора дехлорирования и
Добавление по отдельности поливинилхлори-
сорбента хлора при разложении поливинилхлорида,
да или полиэтилентерефталата в смесь 3П/AБС-Br
превращался в гидраты FeCl2·2H2O и FeCl2·4H2O,
практически не влияло на количество азотсодержа-
которые в свою очередь способствовали образованию
щих соединений, образованных путем разложения и
хлорсодержащих соединений из углеводородов, по-
взаимодействия акрилонитрила из бромированного
лученных термическим разложением полиолефинов
акрилонитрил-бутадиен-этиленстирольного сополи-
в смеси.
мера с другими компонентами полимеров (табл. 4), в
Влияние бромированного полистирола (ПС-Br)
то время как присутствие обеих добавок приводило
на пиролиз смеси 3П/ПВХ и 3П/ПВХ/ПЭТ в присут-
к значительному снижению этой доли до 355 ppm.
ствии Ca/C-композита исследовали в [59]. Как и в
Присутствие полимеров поливинилхлорида или
[6, 42], добавление полиэтилентерефталата в смесь
полиэтилентерефталата в 3П/AБС-Br приводило к
пластиков 3П/ПВХ/ПС-Br повышало не только коли-
росту доли бромсодержащих соединений в 2-2.5 раза
чество хлорорганических соединений в пиролизных
по сравнению с пиролизом смеси 3П/AБС-Br не толь-
маслах, но и долю газообразных продуктов и твердых
ко за счет изменения соотношения нитрилов, но за
углеродных остатков и снижало долю жидкости: до
счет взаимодействия продуктов разложения поливи-
60-66% по сравнению с термическим разложением
нилхлорида, полиэтилентерефталата и бромирован-
3П/ПВХ/ПС-Br (до 71% масел).
ного антипирена в акрилонитрил-бутадиен-этилен-
Основными хлорсодержащими продуктами явля-
стирольном сополимере, вызывающего образование
лись разветвленные алканы (С4, С6, С8), образован-
Br-соединений в пиролизных маслах [56]. Добавление
ные при взаимодействии выделившегося при пироли-
полиэтилентерефталата к 3П/AБС-Br/ПВХ приводило
зе поливинилхлорида HCl с продуктами разложения
к увеличению концентрации хлорорганических соди-
полипропилена. Третичные атомы углерода продук-
нений в масле за счет образования тяжелых углеводо-
тов разложения полипропилена благодаря лабиль-
родов C15-C16 и С18-С21 [56].
ности водорода, находящегося у такого типа атомов
Каталитический пиролиз смеси 3П/АБС-Br/ПВХ
углерода, являются более реакционноспособными
проводили в режиме парофазного контакта, сравни-
по отношению к атомам Cl, чем вторичные атомы
вая катализаторы на основе железа (FeOOH и Fe/C) и
углерода н-алкенов и н-алкадиенов, являющихся
кальция (CaCO3 и Ca/C) [57]. Некаталитический пи-
основными ненасыщенными продуктами пиролиза
ролиз смеси приводил к образованию 59 мас% жид-
полиэтилена. HCl также реагировал со стирольным
ких продуктов [42], среднее число атомов углерода в
мономером и димером с образованием значительного
которых составляло 9.6. Использование катализато-
количества 1-хлорэтилбензола и хлорированных ди-
ров приводило к увеличению доли жидкого продукта
фенилбутана и пентана. Бромоводород, образованный
до 63-67 мас% и его плотности за счет образования
в результате термического пиролиза, реагировал в
конденсированных соединений, при этом основную
основном с разветвленными алкенами и стиролом.
долю в маслах составляли мономеры полимеров,
В присутствии полиэтилентерефталата увеличил-
входящих в состав смеси, и их производные.
ся выход хлорированных разветвленных алканов.
Железосодержащие катализаторы [58] в про-
Образование бромированных алкенилбензолов было
цессе дебромирования бромированного акрило-
обусловлено взаимодействием продуктов разложения
нитрил-бутадиен-этиленстирольного сополимера
полистирола и полипропилена с HBr, а винилбромида
оказались более эффективными в удалении ато-
и этилбромида — реакцией бромирования этилено-
мов брома (до 90%), в то время как кальциевые —
вых сегментов полиэтилентерефталата.
в удалении атомов хлора (93-98%), при этом оба
Композитный катализатор Сa/C, как и в [57], пока-
типа катализаторов содержание азотсодержащих
зал 100%-ную эффективность дехлорирования и де-
соединений в продуктах снижали незначитель-
бромирования смеси 3П/ПВХ/ПС-Br при ее пиролизе:
но. Так, степень дебромирования падала в ряду
0 ppm Br- и Cl-органических соединений в отличие от
FeOOH > Fe/C > Ca/C > CaCO3, а степень дехлори-
1120 ppm хлорированных и 7330 ppm бромированных
рования — в ряду Ca/C > CaCO3 > Fe/C > FeOOH.
соединений при термическом пиролизе.
Меньшая степень дехлорирования пиролизного
Добавление полиэтилентерефталата в полимерную
масла FeOOH (30%) по сравнению с Fe/C (80%) бы-
смесь значительно снижало степень дехлорирования.
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1243
Лишь двухкратное увеличение массы катализатора
в [60]. Максимальная скорость потери массы при
Ca/C в пиролизе 3П/ПВХ/ПЭТ/ПС-Br по сравнению
пиролизе чистой сосновой древесины наблюдается
с пиролизом 3П/ПВХ/ПС-Br позволило удалить 94%
при 350°С, при этом основная массопотеря происхо-
Br (ост. 300 ppm) и более 99% Cl (ост. 20 ppm).
дит в интервале температур 250-380°С, что можно
Добавление бромированных акрилонитрил-бута-
объяснить реакциями дегидратации, образованием
диен-этиленстирольного сополимера и полистирола
свободных радикалов, оксигенированных соединений
в смесь 3П/ПВХ значительно повышало количество
и углеродистых остатков. Разложение смеси био-
хлорорганических соединений за счет взаимодей-
сырья и поливинилхлорида протекает в две стадии:
ствия выделяющегося HCl с бромированным анти-
первая (200-400°С) связана с дегидрохлорированием
пиреном и продуктами разложения остальных поли-
поливинилхлорида и разложением гемицеллюлозы
меров [42, 59]. Как и в предыдущем исследовании
и целлюлозы, вторая (400-500°С) — с разложением
[6], наличие полиэтилентерефталата также повыша-
дехлорированного поливинилхлорида и лигнина. За
ло долю хлорорганических соединений в маслах на
счет взаимодействия древесины и поливинилхлорида
300 ppm в случае смеси с бромированным акрилони-
в смеси значительно снижалась температура, соответ-
трил-бутадиен-этиленстирольным сополимером [42]
ствующая максимальной потере массы (на 47-51°).
и на 1700 ppm — с бромированным полистиролом
Пиролиз целлюлозы, основного компонента
[59]. Наиболее эффективным в дехлорировании сме-
биомассы, состоит из двух конкурирующих реак-
си, содержащей бромированный акрилонитрил-бута-
ций: 1) обезвоживание и обугливание, 2) транс-
диен-этиленстирольный сополимер и поливинилхло-
гликозилирование и образование левоглюкозана.
рид, оказался композитный Ca/C, тогда как хорошую
Выделяющийся HCl из поливинилхлорида при низ-
бром-сорбционнную способность проявил FeOOH
котемпературном режиме (230-300°C) способствует
[42]. Добавление большего количества катализатора
обезвоживанию целлюлозы и образованию альдегида
Ca/C в реакционную смесь 3П/ПВХ/ПС-Br позволило
из целлюлозы, что снижало скорость деполимериза-
полностью удалить и хлорированные, и бромирован-
ции и выход пиролизных масел. Таким образом, при
ные соединения, образующиеся в процессе разложе-
добавлении древесины к поливинилхлориду выход
ния компонентов полимерной смеси [59].
полукокса увеличивался на 15.5-27.9% с повышением
Совместный пиролиз отходов поливинилхлорида
доли полимера в смеси, а выход масел аналогично
и биомассы. Совместная, так называемая «зеленая»
снижался на 7.2-14.4% (табл. 5).
переработка биологических и пластиковых отходов,
По сравнению с содержанием атомов углерода и
в последнее время является одним из актуальных
водорода в угле, образованном при пиролизе сосно-
направлений переработки отходов [60-69]. Подобный
вой древесины, при добавлении поливинилхлорида
метод переработки поливинилхлорида и биомассы
и повышении его содержания доля атомов углерода
позволяет увеличить долю жидких продуктов, повы-
увеличилась, а доля атомов водорода соответственно
сить качество пиролизных масел и твердого остатка
незначительно уменьшалась. Низкое атомное отно-
путем связывания и удаления хлорированных соеди-
шение H/C (0.38) означало, что полукокс состоит
нений компонентами биосырья [60-68]. Основным
преимущественно из фиксированных углеродных
продуктом совместного пиролиза является полукокс
ароматических колец. Аналогично изменялась доля
с достаточно высокой теплотворной способностью,
атомов С и Н в пиролизном масле смеси биосырья и
благодаря которой его можно использовать в каче-
полимера, тем самым снижалось отношение Н/С (до
стве твердого топлива наравне с бурым углем и би-
0.83). С добавлением полимера в смесь с древесиной
тумом [65]. Некоторые авторы получали в процессе
значительно повышалось содержание ароматических
совместного пиролиза биосырья и поливинилхлори-
соединений, в основном с 2-3 кольцами, и снижалась
да c различными добавками биоуголь, обладающий
доля кислородсодержащих соединений в пиролизных
относительно высокой сорбционной способностью,
маслах, что улучшало свойства пиролизных масел для
позволяющей удалять, например, толуол [66] и ртуть
использования их в качестве топлив.
[67, 68] из сточных вод.
Аналогичная ситуация происходила и при пиро-
Процесс пиролиза необходимо проводить в инерт-
лизе смеси биомассы (сосновые опилки и бумага) и
ной атмосфере, поскольку в присутствии кислорода
поливинилхлорида (10 мас%) [61]. Сосновые опил-
возможно протекание побочных процессов с образо-
ки состояли в основном из 45~50 мас% целлюлозы,
ванием токсичных диоксинов, дибензофуранов и т. д.
27~39 мас% гемицеллюлозы и 21~30 мас% лигнина,
[39]. Исследование пиролиза смеси биомассы (со-
в бумаге, как правило, преобладала целлюлоза (более
сновая древесина) и поливинилхлорида проводили
70 мас%).
1244
Захарян Е. М. и др.
Как и в исследовании [60], добавление 10 мас%
биосырья (табл. 5). Основными компонентами масел
поливинилхлорида к биомассе способствовало сни-
скорлупы ореха и косточек персика являются аро-
жению температуры, соответствующей максималь-
матические соединения и фенол и его соединения,
ной потере массы, на 30°С и ускорению процесса
образующиеся в результате разложения природного
дегидрохлорирования поливинилхлорида независимо
полимера лигнина. Образование более тяжелых аро-
от природы биосырья и атмосферы процесса [61].
матических соединений, таких как полициклические
Процесс разложения биомассы ускорялся при мень-
ароматические углеводороды, в совместном пиролизе
ших температурах в присутствии полимера, что было
поливинилхлорида и биомассы связано с выделением
обусловлено возможным каталитическим влиянием
HCl, сопровождающим внутреннюю циклизацию и
паров HCl, выделяющихся из поливинилхлорида при
ароматизацию.
250-350°С. Хлороводород способствовал процессам
Так же как и в работе [60], при добавлении поли-
дегидратации биомассы с образованием альдегида,
винилхлорида к биосырью изменялось содержание
декарбонилирования и декарбоксилирования в ка-
атомов углерода, кислорода и водорода в пиролизном
честве кислоты Льюиса, приводящим к увеличению
масле и твердом остатке [62], при этом значительно
количества твердых углеродистых остатков.
повышалась теплотворная способность и масел, и
Увеличение доли CO2 оказывало едва заметное
твердого остатка.
влияние на процесс разложения биомассы при тем-
Изучение совместного пиролиза органических
пературе ниже 773°С, но ускоряло процесс при по-
отходов (соевый белок) и отходов поливинилхло-
вышении температуры за счет протекания газифика-
рида проводилось в [63]. Небольшие потери массы
ции древесного угля, основного компонента твердого
при разложении соевого белка наблюдаются уже при
остатка, и углерода:
200°C, что свидетельствует о выделении воды, кото-
рое продолжается до 350°C. При более высоких тем-
CmHnO + CO2 → CO + H2O,
пературах начинается разложение самой полимерной
C + CO2 → 2CO + 173.5 кДж·моль-1.
структуры через разрыв связи, дегидратацию, обра-
зование свободных радикалов, кислородсодержащих
Совместный пиролиз отходов биомассы (скорлупа
соединений и в дальнейшем углеродистых остатков
грецкого ореха и косточка персика) и поливинилхло-
(около 20 мас%) вплоть до 530°C. При пиролизе по-
рида был исследован в [62]. Термическое разложение
ливинилхлорида (530°C) масса остатков составляет
скорлупы ореха и косточки персика, содержавших в
4% от первоначального веса.
своем составе 26 и 36.9% лигнина, в основном состо-
Смешивание биосырья с отходами поливинилхло-
яло из трех стадий потери массы: потеря связанной
рида способствовало понижению температур, при
влаги (22-175°С), активный пиролиз (180-480°C)
которых начинается потеря массы и происходит ее
и пассивный пиролиз из-за вторичного разложения
максимальная потеря, а также ускорению процесса
(>700°С). По окончании активного пиролиза био-
разложения благодаря выделяющемуся из поливи-
масса скорлупы ореха теряла 61.4% от своего перво-
нилхлорида HCl. Аналогично результатам исследо-
начального веса, в то время как биомасса косточек
ваний [60-62], образующийся в процессе разложения
персика — 59.8%. Добавка биосырья в пиролизе по-
поливинилхлорида хлороводород действует в каче-
лимеров незначительно снижала температуру мак-
стве кислотного катализатора [63].
симальной массопотери (до 270°С в случае поливи-
Повышение температуры пиролиза с 400 до 600°С
нилхлорида).
приводило сначала к повышению выхода смолы в
При пиролизе биосырья наибольший выход био-
случае чистого биосырья и смеси биосырье/поливи-
масла в обоих случаях достигался при 500°С, даль-
нилхлорид (4:1 и 1:4), затем к снижению содержания
нейшее повышение температуры процесса приводило
смолы. В случае смеси биосырье/поливинилхлорид
к снижению выхода биомасла и кокса и росту доли га-
(1:1) и отходов поливинилхлорида доля образую-
зов, что обусловлено глубоким крекингом при высо-
щейся смолы падала. Выход кокса во всех случаях
ких температурах. Образование большего количества
с повышением температуры снижался, что может
кокса при пиролизе косточек персика было связано
быть объяснено каталитическим действием HCl, ко-
с большим количеством лигнина в составе данного
торый к тому же подавлял деполимеризацию и сни-
сырья по сравнению со скорлупой ореха.
жал скорость дегидратации и обугливания. Смола,
Добавление биосырья к поливинилхлориду при-
полученная при пиролизе соевого белка, содержа-
водило к снижению доли биомасла за счет образова-
ла углеводороды с 0-2 бензольными кольцами, в
ния воды и кокса по сравнению с пиролизом чистого
то время как в пиролизной смоле, образованной из
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1245
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1247
поливинилхлорида, были обнаружены углеводоро-
водорослей, это значение составляло 0.81, поскольку
ды с 0-3 бензольными кольцами [60]. При пиролизе
HCl ускорял дегидратацию водорослей, уменьшая
смесей биосырья и отходов поливинилхлорида при
содержание водорода.
всех массовых соотношениях биосырья и отходов
Распределение атомов Cl в биомасле, биоугле и
поливинилхлорида с повышением температуры уве-
неконденсируемом газе, образованных в процессе пи-
личивалась доля соединений, содержащих 2-3 коль-
ролиза водорослей, составляло 5.1, 8.5 и 86.4%, тогда
ца, и появлялись полициклические ароматические
как по мере добавления поливинилхлорида в смесь
углеводороды с 4 бензольными кольцами, т. е. взаимо-
эти значения изменялись до 7.6, 77.1 и 15.3% в случае
действие соевого белка и поливинилхлорида во время
продуктов смеси биосырья и полимера (25 мас% по-
совместного пиролиза значительно способствовало
ливинилхлорида), т. е. большая часть хлорированных
образованию более тяжелых компонентов и пода-
соединений из смеси водоросли/поливинилхлорид
влению образования азотсодержащих соединений,
была обнаружена в биоугле и биомасле благодаря
помимо индола.
взаимодействию субстратов.
Таким образом, добавление биосырья к отходам,
Добавление различных активаторов в процессе
содержащим поливинилхлорид, способствовало пол-
совместного пиролиза биосырья и поливинилхло-
ному удалению хлорированных соединений из пиро-
рида способствовало образованию биоугля, который
лизных масел и твердого остатка, что подтверждает
можно использовать в качестве сорбента, обладаю-
100%-ную эффективность совместного пиролиза по-
щего достаточно высокой площадью поверхности.
лимерных отходов с биосырьем.
Так, например, добавка KОН, являющегося наиболее
Синергическое воздействие на свойства биомасла
широко применяемым активатором, приводит к об-
и биоугля при совместном пиролизе макроводорослей
разованию более термически стабильного биоугля,
Enteromorpha clathrate в смеси с различным массо-
так как его максимальная пористость достигается
вым содержанием поливинилхлорида (5-25 мас%)
при 700-900°C [66]. Во время карбонизации в присут-
исследовалось авторами [64]. Как и в [60], разло-
ствии KOH образованный in situ K2CO3 влиял на мор-
жение смеси протекало в два этапа: дегидрохлори-
фологию и размер самосшитого SiO2, был получен
рование поливинилхлорида и разложение белков и
биоуголь с открытой пенообразной пористой струк-
углеводов водорослей на первой стадии и разложе-
турой, содержащей микро- и мезопоры. Добавление
ние дехлорированного поливинилхлорида на второй.
KОН при пиролизе смесей лигнина и рисовой шелухи
С повышением доли поливинилхлорида в смеси пики
с поливинилхлоридом способствовало увеличению
максимальной потери массы, в отличие от [60], сме-
доли биоугля почти в 2 раза, до 52-55%.
щались в более высокий температурный диапазон
Пиролиз бинарных смесей в присутствии KОН
благодаря каталитическим свойствам выделяющегося
приводил к формированию продукта с большей пло-
из поливинилхлорида HCl, взаимодействующего с
щадью поверхности, например, в случае лигнина в
продуктами деградации водорослей.
15 раз выше по сравнению с биоуглем без активации,
Биомасло, полученное из водорослей, состоит из
а в случае рисовой шелухи — в 4 раза [66], что связа-
кислород- (спирты, кетоны, фенолы и органические
но со структурными особенностями углеродных кар-
кислоты) и азотсодержащих соединений (амины, ами-
касов продуктов. Исследование сорбционных свойств
ды, нитрилы и пиридины), 55 и 20% соответственно,
по отношению к толуолу показало, что большую
образованных в ходе разложения углеводов, белков
сорбционную емкость имел продукт пиролиза смеси
и липидов, входящих в состав водорослей. По мере
лигнин/ПВХ/KОН — 263.4 мг·г-1.
добавления поливинилхлорида выходы биомасла
Перемолотые в планетарной мельнице отходы
и биоугля снижались, в то время как доля некон-
биомассы (бумага и дерево) и поливинилхлорида
денсированных газов пропорционально возрастала.
были подвергнуты совместному пиролизу при 600-
Повышение доли поливинилхлорида в смеси приво-
800°С в потоке N2 [67]. Хлороводород, выделяемый
дило к меньшему образованию окисленных (до 15%)
из поливинилхлорида, в процессе совместного пи-
и азотированных (до 4.6%) соединений в маслах по
ролиза частично сорбировался в пиролизном полу-
сравнению с биомаслом из водорослей за счет уве-
коксе с образованием функциональных C-Cl-групп.
личения содержания ароматических (до 25%) и али-
Добавление большего количества поливинилхлори-
фатических (27.2%) углеводородов. Взаимодействие
да к биосырью (бумага либо дерево) приводило к
водорослей и поливинилхлорида в процессе пиролиза
образованию твердого остатка с меньшей удельной
приводило к снижению отношения Н/С в биоугле до
площадью поверхности, поскольку расплавленный
0.6, в то время как в биоугле, полученном из макро-
поливинилхлорид прилипал к поверхности бумаги
1248
Захарян Е. М. и др.
и дерева, что блокировало развитие пористой струк-
к образованию токсичных хлорированных диоксинов
туры.
и дибензофуранов, процесс пиролиза необходимо
С повышением содержания поливинилхлорида
проводить в инертной среде.
увеличивалась доля атомов хлора в полукоксе, наи-
более оптимальными условиями процесса пиролиза
Дехлорирование хлорсодержащих
оказались 700°С и соотношение биосубcтрат/поли-
пиролизных масел
винилхлорид = 3:1, при этом большее количество
атомов хлора наблюдалось в биоугле, полученном при
Поскольку большинство пиролизных масел, полу-
пиролизе смеси дерево/поливинилхлорид.
ченных в процессе термического и каталитического
Исследование синтезированного хлорированно-
разложения пластиковых отходов, содержат значи-
го биоугля в качестве сорбента элементарной ртути
тельное количество хлорированных соединений, их
показало его большую эффективность в удалении
необходимо удалять с целью дальнейшего исполь-
ртути по сравнению с необработанным полукоксом
зования либо в качестве топлива, либо в качестве
(в 2.5-5 раз выше), эффективность достигала 90%
нефтехимического сырья.
при 140°С. Улавливание ртути в случае хлорирован-
Каталитическое дехлорирование пиролизных ма-
ного биоугля происходило посредством химической
сел, полученных путем термической переработки
адсорбции в отличие от простой физической адсорб-
(410°С) муниципальных отходов пластика, состоя-
ции на поверхности полукокса без хлора.
щих из полиэтилена, полипропилена, полистирола,
Добавление Fe(NO3)3 к смеси биосырья и поливи-
поливинилхлорида, полиэтилентерефталата, прово-
нилхлорида в одностадийном пиролизе [67] привело
дили над γ-Fe2O3, Fe3O4/C, ZnO, MgO и RedMud [70]
к образованию магнитного Cl-биоугля с большей
(табл. 6).
удельной поверхностью [68], который оказался эф-
Наибольшую эффективность и активность пока-
фективнее хлорированного биоугля, полученного в
зал катализатор γ-Fe2O3 (95%, 30 ppm Cl), наименее
[67], в удалении ртути в более широком температур-
активным оказался MgO (78%, 132 ppm Cl), что, воз-
ном диапазоне (25-220°C). Механизм удаления Hg0
можно, связано с кислотно-основными свойствами
на Fe/Cl-полукоксе заключался в ее хемосорбции
оксидов. Оксид железа проявлял стабильность до
посредством связывания ртути с активными сайтами
5 ч реакции с неизменной максимальной степенью
Fe3O4, C-Cl и C=O.
дехлорирования, в то время как эффективность де-
Совместный пиролиз отходов биосырья и отходов
хлорирования над MgO и ZnO при 5 ч составила 20
поливинилхлорида позволяет получить не только
и 30% соответственно за счет образующейся соле-
альтернативное топливо в виде полукокса, но и пи-
вой «коры» (MgCl2 [49] и ZnCl2) на поверхностях
ролизные масла [60-65], по качеству превосходя-
катализаторов, дезактивирующей поры с кислот-
щие масла пиролиза пластиковых отходов. Также
но-основными центрами. Даже при использовании
возможно получение сорбента, например, толуола
γ-Fe2O3 в течение 16 ч содержание хлорорганиче-
[66] и элементной ртути [67, 68] из сточных вод.
ских соединений в пиролизных маслах не превышало
Добавление биосырья к поливинилхлориду при пи-
30 ppm.
ролизе способствовало снижению температур начала
Пиролизные масла, полученные путем разложения
и максимума разложения поливинилхлорида, а также
смешанных пластмасс, состоящих из полиэтилена
ускорению процесса разложения биосырья благода-
(33%), полипропилена (33%), полистирола (33%) и
ря выделяющемуся из поливинилхлорида HCl, дей-
поливинилхлорида (1%), подвергали дехлорированию
ствующему в качестве кислотного катализатора, при
в присутствии катализаторов на основе оксида желе-
этом происходило незначительное снижение доли
за, ненанесенных (α-Fe2O3, γ-Fe2O3) и нанесенных на
пиролизных масел и повышение доли кокса по срав-
углерод (Fe3O4/С) [71].
нению с отходами поливинилхлорида. Образование
Механизм дехлорирования поливинилхлорида
более тяжелых ароматических соединений, таких
над Fe3O4 был предложен авторами [72]. Железо-
как полициклические ароматические углеводороды, в
содержащие катализаторы в ходе процесса дехлори-
совместном пиролизе поливинилхлорида и биомассы
рования дезактивировались за счет адсорбции на их
было связано с выделением HCl, сопровождающим
поверхности газообразного хлороводорода, образу-
внутреннюю циклизацию и ароматизацию. Поскольку
ющегося во время реакции. Непрерывная адсорбция
разложение биомассы, содержащей достаточное ко-
HCl на оксиде железа приводила к превращению его
личество атомов кислорода, и поливинилхлорида в
в FeCl2. Используя газ-носитель, такой как He, можно
кислороде и воздушной атмосфере может привести
непрерывно удалять обратимо адсорбированный HCl,
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1249
1250
Захарян Е. М. и др.
тем самым продлевая срок службы катализатора,
Наиболее эффективным поглотителем хлориро-
исключая его дезактивацию. Конверсия масла над
ванных соединений в пиролизных маслах, получен-
оксидными катализаторами составляла 95-99%, при
ных из муниципальных отходов пластика, оказался
этом наибольшую активность (99%) и стабильность
γ-Fe2O3, снижающий изначальное количество хлор-
проявлял Fe3O4/С, доля хлорированных соединений
органических соединений до 30 ppm [70], тогда как
в отработанном масле не превышала 50-70 ppm даже
среди всех сорбентов на основе железа большую
спустя 25 ч непрерывной работы катализатора.
активность и стабильность (до 25 ч непрерывной ра-
Авторы [73] перерабатывали хлорсодержащие тя-
боты) проявил композитный Fe3O4/C [71], поглощая
желые пиролизные масла 1 и 2, полученные в [54]
в процессе переработки более 1800 ppm Cl. В срав-
(табл. 6), содержащие в своем составе посредством
нении с термообработкой пиролизных масел, полу-
термического и каталитического крекинга в основном
ченных различным путем, использование сорбента
стирол, толуол и этилбензол.
RedМud приводило к остаточному содержанию хлор-
Степень крекинга при термообработке масел 1 и 2
органических соединений в отработанных маслах
составила 87 и 67.5%, в то время как при каталитиче-
менее 0.1% [73].
ском процессе конверсия выросла до 92.3 и 86.5%. С
ростом степени крекинга снизилась доля легкой и тя-
Механохимическое дехлорирование
желой фракций, а доля газообразных продуктов повы-
силась до 46.8 и 20.4% соответственно по сравнению
Механохимическое дехлорирование хлорсодержа-
с долей газов, полученных при термообработке масла
щих полимеров, как правило, проводят в планетар-
1 (15.8%) и масла 2 (8.7%). Основными компонентами
ной шаровой мельнице с использованием стальных
легкой фракции во всех случаях являлись алифатиче-
шариков различной массы, размера и количества при
ские углеводороды C5-С10 (78-92%) и ароматические
комнатной температуре [74-82] и наполнителя, кото-
углеводороды C11-С16. Доля хлорсодержащих соеди-
рый необходим для связывания хлористого водорода.
нений при термообработке масел 1 и 2 снизилась до
Обычно в качестве наполнителя используют металлы
0.2%, тогда как при использовании катализатора это
[74], оксиды металлов [75-77], основания [78] и соли
значение было менее 0.1%. Хлорированные развет-
[80-82] (табл. 7).
вленные алифатические и ароматические соединения
В процессе механической переработки полимеров
(C6-С11), входящие в состав пиролизных масел, в
или их смесей с наполнителем возникают большие
процессе крекинга снова разлагались с выделением
внутренние напряжения, приводящие к разрыву цепи
газообразного HCl и, как следствие, превращались в
макромолекулы, т. е. к механохимической деструк-
дехлорированные конденсируемые легкие фракции.
ции. Энергия связи С-С ничтожно мала по сравнению
Тяжелые фракции, представляющие собой тем-
с энергией, затрачиваемой при самых мягких услови-
ные вязкие продукты, также в основном состояли из
ях переработки полимеров. Благодаря тому, что энер-
C5-С10 (до 65.2% в пиролизном масле 1 и до 55.1%
гия, необходимая для перемещения макромолекул,
в пиролизном масле 2): росла доля C11-С16 (до 28.8
превышает энергию химической связи, механические
и 30.3% соответственно) и появлялись углеводороды
воздействия приводят к расщеплению отдельных
>C16. Содержание хлорорганических соединений
цепных молекул, оказавшихся в зоне случайной кон-
не превышало 0.1 и 0.2% при термическом прогоне
центрации механических напряжений.
пиролизных масел 1 и 2, а в случае каталитического
В результате разрыва химической связи образу-
крекинга оно увеличивалось до 4.5 и 5.6% соответ-
ются активные фрагменты — свободные радикалы
ственно, что связано с взаимодействием основного
R* и (или) ионы R+/-, участвующие в дальнейшем
компонента RedMud Fe2O3 с выделяющимся в про-
в различных химических процессах (изомеризация,
цессе крекинга HCl с образованием FeCl3.
реакция передачи цепи и обрыв цепи). Подробный
Большая часть хлора, выделяющегося в виде HCl,
механизм подобного дехлорирования, в процессе ко-
находилась в газовой фракции после термообработки
торого происходит не только отщепление HCl (деги-
пиролизных масел (80.6.% в пиролизном масле 1 и
дрохлорирование) и Cl (дехлорирование), но и сшив-
79.7% в пиролизном масле 2). При использовании
ка, и окисление [74], приведен на схеме 4 на примере
RedMud процентное содержание исходного хлора,
поливинилиденхлорида.
удерживаемого в твердой фракции, повышалось до
Влияние природы хлорсодержащего полимера,
43.3 в масле 1 и 84% в масле 2, а в газовой фазе со-
размера и массы стальных шариков исследовали в
ответственно снижалось до 51 в масле 1 и до 8.7% в
[74] в присутствии Zn. Независимо от природы по-
масле 2.
лимера степень дехлорирования росла с увеличением
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1251
Схема 4
Механизм механохимического дехлорирования поливинилиденхлорида с Zn
продолжительности реакции (от 1 до 8 ч) и молярно-
Алмазоподобный углерод, образованный путем
го соотношения Zn и Cl в смеси поливинилхлорид/
сшивки цепей (2) или карбиновых фрагментов (1в),
поливинилиденхлорид (от 1:1 до 9:1). Так, 100%-ная
являлся основным продуктом дегидрохлорирова-
степень дехлорирования поливинилиденхлорида до-
ния поливинилхлорида и поливинилиденхлорида.
стигалась за 5 ч при Zn/Cl = 4:1 и уже за 1.5 ч при
Образование циклических соединений по реак-
Zn/Cl = 9:1.
ции Дильса-Альдера (1б) и жирных кислот прохо-
Дехлорирование поливинилиденхлорида протека-
дило через реакцию окисления. Путем дегидро-
ло значительно быстрее по сравнению с дехлориро-
хлорирования, сшивки карбинового фрагмента в
ванием поливинилхлорида, что связано с различием
полиацетилен и его последующего окисления воз-
в структуре полимеров, поскольку связь двух атомов
можно образование пероксидного соединения. За
хлора с одним атомом углерода делает поливинили-
счет взаимодействия Zn и HCl были получены ок-
денхлорид менее стабильным при разложении, что
сихлорид цинка(II) (Zn2OCl2·2H2O) и симонколлеит
значительно облегчает удаление HCl из полимерной
Zn5(OH)8Cl2·H2O.
структуры. По истечении 2 ч реакции при всех со-
Дехлорирование поливинилхлорида путем из-
отношениях степень дехлорирования поливинили-
мельчения с СаО (CaO/Cl = 1:1) [75] сопровождалось
денхлорида превышала 80%, а поливинилхлорида —
образованием водорастворимого хлорида CaОНCl,
только при соотношении 9:1.
который удаляли с помощью Na3PO4:
[CH2CHCl]n + CaO = CaOHCl + [CH=CH]m (n, m — степень полимеризации, n > m),
10CaОHCl(ж) + 6 Na3PO4(ж) = Ca10(PO4)6(OH)2(тв.) + 10NaCl(ж) + 8NaOH(ж).
Полученный в ходе процесса (12 ч) и фильтрации вых количеств атомов хлора, что делало возможным
твердый углеродистый остаток не содержал и следо- его использование в дальнейшем в качестве топлива,
1252
Захарян Е. М. и др.
а образованный гидроксиапатит, обладающий способ-
числа (42) удаление атомов хлора снижалось до 88%
ностью сорбировать катионы тяжелых металлов, — в
за тот же период.
качестве сорбента в очистке сточных вод.
Влияние оксидов (CaO, Fe2O3, SiO2, Al2O3) на
Повышение соотношения Ca/Cl до 2:1 и добавле-
дехлорирование поливинилхлорида на воздухе ис-
ние SiO2 для усиления измельчения поливинилхло-
следовали в [77] (1-6 ч). Дехлорирование в присут-
рида в [76] значительно снижало время реакции по
ствии данных оксидов протекало по двум путям: с
сравнению с [75]. При этом немалое влияние оказали
образованием хлоридов CaOHCl [75] и FeCl2·2H2O
размер планетарной мельницы и, как следствие, мас-
при использовании CaO и Fe2O3 и с выделением га-
са и количество используемых стальных шариков.
зообразного HCl в результате разложения поливи-
Так, в маленькой планетарной мельнице использо-
нилхлорида в присутствии SiO2 и Al2O3 согласно
вание большего допустимого количества шариков
данным рентгенограмм. SiO2 и Al2O3 при этом играли
(7 шт.) приводило к 100%-ной степени дехлорирова-
важную роль в качестве шлифовальных добавок, из-
ния уже спустя 6 ч реакции. В большой планетарной
мельчая частицы поливинилхлорида.
мельнице с добавлением мелких шариков диаметром
В отличие от СаО [75], связывающего один атом
4.8 нм (1560 шт) максимальная степень дехлорирова-
хлора в структурном звене поливинилхлорида,
ния составляла 90% (8 ч), а с увеличением диаметра
атом железа из Fe2O3 взаимодействует с двумя ато-
шариков (15.6 нм) и соответственно уменьшением их
мами Cl:
4 -CH2CHCl- + Fe2O3 → 3 -CH=CH- + -(CHCl-CHCl)- + FeCl2·2H2O + FeO.
За счет этого степень дехлорирования с Fe2O3
рирования повышалась с увеличением времени и
(40%) значительно превышала степень дехлориро-
количества добавки. При соотношении Cl:K/Na = 1:2
вания при использовании в процессе переработки
продукт реакции системы поливинилхлорид/KOH (4 ч)
сорбента СаО (18%) при молярном соотношении
представлял собой липкую пасту оранжевого цвета, а
Ме/Cl = 1/1 (6 ч). Таким образом, степень дехлори-
системы поливинилхлорид/NaOH — желтую пудру.
рования падала в ряду Fe2O3 > Al2O3 > SiO2 > CaO.
Отходы поливинилхлорида, использованные в по-
Степень дехлорирования повышалась не только с
лупромышленной установке [79], представляли собой
увеличением времени измельчения, но также с уве-
уплотнительные полосы (1) из дверей рефрижератора
личением количества оксидного порошка, т. е. моляр-
и электрический кабель (2) из рециркуляции. Для
ного соотношения Ме/Cl: 92% с Fe2O3 и 82% с CaO
лучшего измельчения отходов поливинилхлорида
(Ме/Cl = 4/1, 6 ч).
их изначально обрабатывали раствором NaOH для
Использование щелочных добавок (KOH и NaOH)
дехлорирования поверхности. Таким образом проте-
в качестве наполнителя изучали в [78]. Пики хлори-
кало замещение SN2 с образованием функциональных
дов металлов на ИК-спектрах появлялись уже спустя
групп -ОН и элиминирование E2 со связями С=С. Без
3 ч.
шарового фрезерования молекулам NaOH сложно
В обеих системах (поливинилхлорид/NaOH и по-
было проникать в толстые частицы поливинилхло-
ливинилхлорид/KOH) средний размер частиц смеси
рида вследствие образования двойных связей на их
быстро уменьшался на начальной стадии измель-
поверхности в результате элиминирования E2, поэ-
чения, но затем за счет агломерации мелких частиц
тому полностью дехлорированные частицы не могли
при длительном помоле постепенно увеличивался.
быть получены. Использование более высокой кон-
Молекулярная масса частично дехлорированного
центрации NaOH (более 1 M) приводило к большему
поливинилхлорида в смеси поливинилхлорид/KОН
увеличению вязкости жидкости, что отрицательно
была больше, чем в смеси поливинилхлорид/NaOH,
сказывалось на измельчении шариками и ухудшало
поскольку KОН преимущественно реагировал с
окисление этиленгликолем по кислороду.
атомами Cl в поливинилхлориде, тогда как NaOH
Увеличение скорости вращения до 30 об·мин-1,
разлагался. Скорость дехлорирования полимера, из-
добавление стальных шариков повышало степень
мельченного с KОН, была выше, чем с NaOH, за счет
дехлорирования отходов 1 до 96% в 1 М NaOH/эти-
небольшого различия электронных свойств калия и
ленгликоль. Максимальная степень дехлорирования
натрия. Положительный заряд K больше, чем Na, за
(92%) отходов 2 достигалась при 45 об·мин-1 в 0.5 М
счет большего радиуса и большего числа электронных
NaOH/этиленгликоль. Дехлорированные остатки обо-
слоев, т. е. K+ быстрее прореагирует с Cl-, чем Na+.
их видов отходов поливинилхлорида (менее 100 мкм)
Как и в предыдущих исследованиях, степень дехло-
содержали менее 1 мас% хлора.
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1253
Использование биологических отходов, таких как
[80], приводящее к уменьшению частиц отходов и
раковины моллюсков и яичная скорлупа, состоящих
разрыву связей в них, способствовало их взаимодей-
из карбоната кальция, в дехлорировании поливи-
ствию с образованием хлорида кальция уже после 2 ч
нилхлорида исследовалось в [80, 81]. Измельчение
помола, согласно ИК-спектрам, и полиена с кратными
отходов поливинилхлорида и раковин моллюсков
связями.
[CH2CHCl]n + CaCO3 = [CH=CH]m + CaCl2 + CO2 + H2O (n, m — степень полимеризации).
Более 95% хлора из поливинилхлорида было уда-
хлорид-иона в хлорид кальция, в то время как кон-
лено в течение 2 ч реакции (Cl:Ca = 1:4, частота вра-
версия Li снижалась до 18%, что было обусловле-
щения 700 об·мин-1). По сравнению с измельченной
но сложностью связывания Li и Со из-за слоистой
смесью поливинилхлорида с чистым CaCO3 значи-
структуры LiCoO2. Добавление оксидов Fe2O3, SiO2
тельного различия в степени дехлорирования не на-
и Al2O3 также способствовало повышению степени
блюдалось, что предполагало использование отходов
дехлорирования поливинилхлорида до 87% (Al2O3):
раковин моллюсков в качестве хорошего сорбента вы-
она росла в ряду Fe2O3 < SiO2 < Al2O3, как и конвер-
деляющегося из поливинилхлорида хлороводорода.
сия Li — до 68% при добавлении Al2O3, что было
Применение результатов лабораторного подхода
связано с лучшим измельчением и, как следствие,
переработки отходов поливинилхлорида и яичной
трением в присутствии оксида алюминия.
скорлупы в полупромышленном процессе проводи-
При дехлорировании поливинилхлорида в при-
лось в [81], различия между подходами заключались
сутствии нульвалентных металлов (Ni, Al, Fe) атом
в массе реакционной смеси и объеме планетарной
хлора связывался с атомом металла (Ni, Al или Fe) с
мельницы. Использование большего соотношения
образованием хлорида MClx, который в свою очередь
Ca:Cl по сравнению с предыдущими исследования-
взаимодействовал с Li и Co с образованием LiCoO2.
ми [76, 77, 80] было обусловлено дехлорированием
За счет меньшей активности Co по сравнению с
промышленных отходов поливинилхлорида, содер-
Li происходило образование LiCl, а не CoCl2. Так,
жащих различные добавки и меньшее количество ато-
степень дехлорирования поливинилхлорида в ряду
мов хлора в отличие от чистого поливинилхлорида.
Ni < Al < Fe росла от 70.3 до 92.5%, а конверсия ли-
Кинетический анализ показал, что процесс дехлори-
тия — от 78.5 до 98.7%.
рования протекал в 7 раз быстрее при более высоком
Наилучшие результаты были получены при до-
соотношении Ca:Cl (5:1) в отличие от Ca:Cl (2.3:1).
бавлении Fe, при этом в результате реструктури-
Скорость полупромышленного процесса составля-
зации образовался магнитный материал CoFe4O6.
ла 1.23·10-5 с-1, что примерно в 5 раз медленнее,
Показано, что оптимальное соотношение LiCoO2/
чем скорость лабораторных экспериментов. Таким
ПВХ/Fe составляет 1/2/1, длительность реакции —
образом, полное дехлорирование в лабораторном
12 ч. Конверсия Li, Cl и Co в данных условиях со-
эксперименте достигалось спустя 4 ч, тогда как при
ставляла 100, 96.4 и 8.1% соответственно.
полупромышленном (100 г смеси) удалось удалить не
Механохимическая переработка поливинилхлори-
более 55% за 12 ч.
да подразделяется на два типа:
Совместная механохимическая переработка отра-
— в присутствии наполнителя-сорбента, такого
ботанных литий-ионных аккумуляторов, содержащих
как металлы, основные/амфотерные оксиды, щелочи,
катодные материалы (C/LiCoO2), и поливинилхлори-
соли, связывающего выделяющийся HCl в процессе
да с различными добавками и последующим выще-
разрыва связей при помоле поливинилхлорида в свя-
лачиванием водой исследовалась в [82]. Содержание
зи с уменьшением его молекулярной массы;
Co и Li в катодном материале составляло 51.8 и
— в присутствии наполнителя, использующегося
6.5 мас%. При измельчении LiCoO2 и поливинилхло-
в качестве шлифующих агентов, например, SiO2 и
рида без добавок конверсия Li, Co и Cl составляла
Al2O3 [77].
27.5, 1.4 и 13% соответственно.
100%-ной эффективности дехлорирования по-
При добавлении щелочных соединений степень
ливинилхлорида многие авторы добивались путем
дехлорирования поливинилхлорида превышала 60%
повышения молярного отношения активного металла
и росла в ряду NaOH < KOH < CaO (массовое отно-
к хлору в пересчете на группу -СН2-СНСl- в поливи-
шение LiCoO2/ПВХ/гидроксид = 1/1/1, 12 ч). В слу-
нилхлориде [74] либо при увеличении длительности
чае CaO степень дехлорирования поливинилхлорида
процесса до 12 ч [75]. При максимальном времени
достигала 90% за счет связывания иона кальция и
реакции (12 ч) в одинаковых условиях большую ак-
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1255
тивность проявил сорбент CaO [76] по сравнению
мерно при 250°C и протекает в интервале 250-350°C
с щелочами NaOH и KОН [78]. За счет добавления
[83]. При добавлении оксида кальция потеря массы
шлифовального агента SiO2 при помоле смеси CaO/
наблюдалась в том же температурном диапазоне с
поливинилхлорид снижалось время процесса без
той лишь разницей, что потеря массы была меньше
потери эффективности [76].
за счет образования нелетучего CaCl2 вместо HCl.
Проведение дехлорирования отходов поливи-
Использование ZnO в качестве сорбента HCl сни-
нилхлорида (100-200 г) путем первичного дехлори-
жает температуру начала потери массы до 200°C.
рования растворами щелочей в этиленгликоле [79] с
Основная реакция в присутствии ZnO представляет
последующим помолом с NaOH позволило получать
собой поперечное сшивание одинарной связи C-C
дехлорированные остатки поливинилхлорида (менее
в полимерной цепи или среди полимерных цепей с
100 мкм), содержание атомов хлора в которых состав-
последующим превращением в алифатический (CH)n
ляло менее 1 мас%.
полимер либо ароматические соединения в резуль-
Полученные результаты с использованием лабора-
тате молекулярной циклизации либо разрыва цепи
торных сорбентов и чистого поливинилхлорида позво-
(схема 5).
лили масштабировать процесс [74] и провести дехло-
На основании результатов исследований, про-
рирование отходов поливинилхлорида в присутствии
веденных методами просвечивающей электронной
биологических [80, 81] и технических отходов [82].
микроскопии и ИК-спектроскопии, авторы предпо-
Одим из недостатков данного способа переработ-
ложили, что твердофазная реакция протекала при
ки отходов поливинилхлорида является необходи-
200°C через образование жидкой фазы хлорида цин-
мость промывания полученного остатка от образо-
ка, который действовал в качестве промотора реак-
ванных в процессе хлоридов металлов с дальнейшей
ции. Вторая стадия — изомеризация алифатического
очисткой сточных вод. Главные преимущества меха-
(CH)n полиена в ароматические соединения бензоль-
нохимического дехлорирования поливинилхлорида
ного типа (схема 6). Поскольку сшивание происходит
заключаются в проведении помола при комнатной
при более низкой температуре (200°C), чем возможно
температуре в воздушной среде, что значительно
протекание реакции изомеризации, ароматические
снижает потребности в электроэнергии, исключает
продукты не образуются.
применение инертных газов-носителей и коррозию
Большая часть выделяющегося хлороводорода
металлического оборудования по сравнению с пиро-
(до 73%) при разложении поливинилхлорида реа-
лизом и образование дехлорированных остатков, не
гировала с ZnO (5 ч) с выделением воды и образо-
содержащих атомов хлора.
ванием растворимых солей цинка [Zn2OCl2·2H2O,
Zn5(OH)8Cl2·H2O] и небольшим количеством HCl
(~0.4%) (табл. 8). Как и при механохимическом
Низкотемпературное каталитическое
дехлорировании [74-82], хлорорганических соеди-
дехлорирование
нений обнаружено не было.
Как правило, потеря массы чистого поливинилхло-
Проведение дегидрохлорирования полимеров
рида в токе азота при нагревании начинается при-
в присутствии ZnO при более низкой температуре
Схема 5
Процесс дехлорирования поливинилхлорида над ZnO (200°C)
1256
Захарян Е. М. и др.
Схема 6
Процесс полимеризации алифатического (CH)n полиена
(150°С) [84] было обусловлено наличием в смеси с
щади контакта ZnO с ПВХ/ПВДХ за счет диффузии
поливинилхлоридом полимера поливинилиденхло-
образуемого в кислом растворе ZnCl2 в матрицу со-
рида, температура разложения которого составляет
полимера.
120°С, а выделение НСl начиналось уже при 190°С.
Влияние микроволнового излучения (800 Вт)
Кроме того, выбор низкой температуры процесса
на смесь отходов ПВХ/ПВДХ/ХПЭ, где ХПЭ —
определяется использованием в процессе дехлори-
хлорированный полиэтилен, было изучено в [18].
рования хлорсодержащих полимеров растворителя
Варьирование температуры в интервале 220-300°С
тетрагидрофурана [85]. Механизм протекания де-
проведения дехлорирования смеси хлорированных
гидрохлорирования данного сополимера был ана-
отходов показало, что оптимальной температурой,
логичен механизму, описанному в [83], процесс
при которой достигалась наибольшая степень дехло-
термообработки продуктов реакции приводил к об-
рирования (60%) с образованием большего количе-
разованию твердых микропористых углеродистых
ства газообразного хлороводорода, является 280°С.
соединений с удельной площадью поверхности 500-
Добавление графита и карбида кремния (SiC) по-
529 м2·г-1.
вышало степень дехлорирования и количество га-
При проведении реакции в тетрагидрофуране зна-
зообразного HCl на 20-25%. Исследование влияния
чительно увеличивалась степень дехлорирования
скорости нагрева (4-15 град·мин-1) показало, что
(92%, 30 мин) при данной температуре (150°С) по
соотношение степени дехлорирования и количества
сравнению с твердофазным дехлорированием смеси
газа HCl максимально при нагреве 9 град·мин-1: при
(22%, 30 мин). Эффективность дехлорирования в
4 град·мин-1 степень дехлорирования максимальна,
растворителе была обусловлена увеличением пло-
доля газообразного хлороводорода не превышала
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1257
Таблица 8
Условия дехлорирования поливинилхлорида в присутствии наполнителей
Соотношение
Литера-
Содержание
Степень
Полимер/сополимер
Добавка
субстрат/
Условия
турный
хлора, %
дехлорирования
добавка
источник
ПВХ
35
ZnO
1:(0.75-0.3)
190-300°С, 30 мин-5 ч,
73%, 200°С, 5 ч,
[83]
N2
ZnO/мономер = 3/1
Сополимер ПВХ (35%)-
67.45
ZnO
1:1.6
150-170°С, N2, 30 мин
22%
[84]
ПВДХ (65%)
Сополимер ПВХ (35%)-
67.45
ZnO
1:1.6
ТГФ, 150-170°С, N2, 30
92%
[84]
ПВДХ (65%)
мин
ПВХ (70%), ПВДХ (20%)
42.3 в смеси
—
—
220-300°С, 800 Вт
65%, 75% газа HCl
[18]
и ХПЭ (10%)
ПВХ (70%), ПВДХ (20%)
42.3 в смеси
SiC
1:2
280°С, 800 Вт
84%, 83% газа HCl
[18]
и ХПЭ (10%)
ПВХ (70%), ПВДХ (20%)
42.3 в смеси
Графит
1:2
280°С, 800 Вт
81%, 82% газа HCl
[18]
и ХПЭ (10%)
П р и мечан и е. ПВХ — поливинилхлорид, ПВДХ — поливинилиденхлорид, ХПЭ — хлорированный полиэтилен,
ТГФ — тетрагидрофуран.
50%, тогда как при максимальном нагреве снижа-
Сополимеризация/термоокисление
лись оба показателя за счет меньшей длительности
процесса. Таким образом, содержание атомов Cl в
Термоокислительное разложение поливинилхло-
полученном твердом восстановленном топливе со-
рида в диоктилфталате при 200°С исследовали в [86]
ставляло всего 0.328%, а по теплотворной способ-
(О2, 1-6 ч). Добавление данного пластификатора спо-
ности 20.6 МДж·кг-1 данный продукт можно было
собствовало значительному ускорению разложения
сопоставить с бурым и битумным углем.
поливинилхлорида с выделением свободного HCl по
Как и механохимическая переработка поливи-
сравнению с чистым поливинилхлоридом уже при
нилхлорида, низкотемпературное дехлорирование
200°С. Усиленное дехлорирование сопровождалось
не приводит к образованию жидких хлорсодержащих
быстрым расщеплением цепи без какого-либо замет-
органических соединений, что является его основным
ного сшивания. Продукты разложения (30 мин-3 ч)
достоинством. Процесс такого типа дехлорирования
представляли собой твердую субстанцию от белого
протекает благодаря образованию жидкого промото-
до желтого цвета. При большем времени реакции
ра, например, ZnCl2 [83, 84] с образованием воды и
(4-6 ч) твердый продукт превращался в масла корич-
растворимых в ней хлоридов цинка. Проведение ре-
невого цвета, что свидетельствовало о протекании
акции с сорбентом в жидкой среде при использовании
окислительного расщепления полиенов, приводящего
тетрагидрофурана значительно повышало качество
к снижению молекулярной массы фрагментов. Разрыв
дехлорированного продукта, степень дехлорирования
цепи происходил в основном в центре цепи сопря-
составляла 92% [84].
женного полиена.
В последнее время актуальным направлением
При более высоких временах разложения были об-
исследования дехлорирования хлорсодержащих от-
разованы полиены с более низкими молекулярными
ходов является изучение влияния микроволнового
массами. Уже через 3 ч окислительной деградации
излучения на разложение полимеров. Применение
молекулярные массы большинства деградированных
микроволнового излучения в присутствии адсор-
цепей составляли менее 1000 г·моль-1. Наличие в
бента в дехлорировании смеси ПВХ/ПВДХ/ХПЭ
ИК-спектрах карбонильных (1725 см-1) и гидрок-
позволяло удалять до 84% атомов хлора из смеси
сильных (3460 см-1) полос доказывало образование
хлорированных полимеров [18], полученный полу-
частично окисленного поливинилхлорида.
кокс имел схожую теплотворную способность с бу-
Полученные результаты свидетельствуют о том,
рым углем и битумом с минимальным содержанием
что наличие фталатных пластификаторов будет значи-
хлора (0.328%).
тельно ускорять процесс разложения поливинилхло-
1258
Захарян Е. М. и др.
рида, что будет сказываться благоприятным образом
свойствами выделяющегося HCl из поливинилхлори-
на степени дехлорирования при пиролизе гибких по-
да в дегидратации и разложении целлюлозы.
ливинилхлорида и муниципальных отходов пластика,
— При механохимической переработке чистого
содержащих такой тип полимеров.
поливинилхлорида с использованием различных не-
органических сорбентов, таких как металлы, оксиды
металлов, гидроксиды и соли, актуально применение
Заключение
в качестве наполнителя биологических (раковина
В обзоре обобщены результаты работ по механо-
устрицы, яичная скорлупа) и технических отходов
химической и термической обработке поливинилхло-
(литий-ионные батарейки) в дехлорировании отходов
рида, включая низкотемпературное дехлорирование
поливинилхлорида, что обеспечивает возможность
и пиролиз как чистого поливинилхлорида, так и в
проведения совместной переработки отходов разных
смеси с другими полимерами и биосырьем. Анализ
типов.
литературной информации позволяет сделать следу-
ющие выводы.
Финансирование работы
— При низкотемпературной переработке меха-
Работа выполнена в рамках государственно-
низм разложения поливинилхлорида заключается в
го задания Института нефтехимического синтеза
выделении хлороводорода и образовании полиена,
им. А. В. Топчиева РАН.
при пиролизе — в разложении полимера с последу-
ющим крекингом образующихся соединений.
Конфликт интересов
— Применение металлооксидных катализаторов в
качестве сорбентов выделяющегося HCl в каталити-
А. Л. Максимов является главным редактором
ческом разложении и дехлорировании позволяет зна-
Журнала прикладной химии. У остальных соавторов
чительно снизить долю газообразного хлора и хлора
конфликт интересов, требующий раскрытия в данной
в жидких продуктах. Хлорфиксирующая способность
статье, отсутствует.
зависит от основности оксида, а каталитическая эф-
фективность — от его кислотной функции.
Информация об авторах
— При пиролизе двухкомпонентной смеси поли-
Захарян Елена Михайловна, к.х.н., м.н.с.
винилхлорида с другими полимерами добавление
ИНХС РАН,
полистирола, смеси полистирола/полиэтилена, акри-
лонитрил-бутадиен-этиленстирольного сополимера,
Петрухина Наталья Николаевна, к.т.н., с.н.с.
полиэтилентерефталата способствует разложению
ИНХС РАН,
поливинилхлорида при более низких температурах,
тогда как наличие полиэтилена, наоборот, приводит
Максимов Антон Львович, д.х.н., проф., чл.-корр.
к повышению температуры разложения. Добавление
РАН, директор ИНХС РАН, проф. химического фа-
всех полимеров к поливинилхлориду в бинарной сме-
культета МГУ им. М. В. Ломоносова,
си увеличивает выход жидких продуктов и значитель-
но снижает содержание в них атомов хлора. Таким
образом, совместная переработка поливинилхлорида
Список литературы
и других полимеров должна осуществляться только
при контроле состава сырьевых смесей.
[1] Fekhar B., Gombor L., Miskolczi N. Pyrolysis of
chlorine contaminated municipal plastic waste: In-situ
— Добавление полиэтилентерефталата к мно-
upgrading of pyrolysis oils by Ni/ZSM-5, Ni/SAPO-11,
гокомпонентным смесям, содержащим поливи-
red mud and Ca(OH)2 containing catalysts // J. Energy
нилхлорид, снижает содержание атомов хлора в га-
Institute. 2019. V. 92. N 5. P. 1270-1283. https://
зообразных и жидких продуктах, тогда как при его
добавлении к смесям, содержащих хлорированные и
[2] Ragaert K., Delva L., Van Geem K. Mechanical and
бромированные отходы, доля хлора, наоборот, повы-
chemical recycling of solid plastic waste // Waste
шается, и снижается доля брома.
Manage. (Oxford). 2017. V. 69. P. 24-58. https://
— Чрезвычайно перспективным можно считать
процесс совместного пиролиза поливинилхлорида с
[3] Huggett C., Levin B. C. Toxicity of the pyrolysis
биомассой, при котором значительно снижается тем-
and combustion products of poly(vinyl chlorides):
пература разложения биомассы и ускоряется процесс
Aliterature assessment // Fire and Materials. 1987. V. 11.
дегидрохлорирования, что связано с каталитическими
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1259
[4]
Qi Y., He J., Li Y., Yu X., Xiu F.-R., Deng Y., Gao X.
fractions during co-pyrolysis // Waste Manage. 2015.
A novel treatment method of PVC-medical waste by
V. 38. P. 194-200.
near-critical methanol: Dechlorination and additives
recovery // Waste Manage. 2018. V. 80. P. 1-9.
[17]
Park K.-B., Oh S.-J., Begum G., Kim J.-S. Production
of clean oil with low levels of chlorine and olefins in a
[5]
Yu J., Sun L., Ma Ch., Qiao Y., Yao H. Thermal
conditions two-stage pyrolysis of a waste low-density
degradation pf PVC: A review // Waste Manage. 2016.
polyethylene and polyvinyl chloride // Energy. 2018.
V. 48. P. 300-314.
V. 157. P. 402-411.
[6]
Bhaskar Th., Uddin Md. A., Murai K., Kaneko J.,
[18]
Liu Zh., Wang H.-Q., Zhang X.-d., Liu J.-W., Zhou Y.-Y.
Hamano K., Kusaba T., Muto A., Sakata Yu.
Dechlorination of organochloride waste mixture by
Comparison of thermal degradation products from
microwave irradiation before forming solid recovered
real municipal waste plastic and model mixed plastics
fuel // Waste Manage. 2017. V. 62. P. 118-124.
// J. Anal. Appl. Pyrolysis. 2003. V. 70. P. 579-587.
[19]
Tukker A., Groot H. D. Simons L., Wiegersma S.
[7]
Ignatyev I. A., Thielemans D. W., Beke B. V. Recycling
Chemical recycling of plastics waste (PVC and other
of polymers: A review // ChemSusChem. 2014.
resins), TNO Report for the European Commision,
V. 7. P. 1579-1593.
STB-99-55 Final. P. 15-17.
[20]
Tukker A., de Groot H., Simons L., Wiegersma S.
[8]
Hubo S., Leite L., Martins C., Ragaert K. Evaluation
Chemical recycling of plastic waste: PVC and other
of post-industrial and post-consumer polyolefin-based
resins // Eur. J. Commun. 1999. DG III. Final Report.
polymer waste streams for injection moulding // 6th
STB-99-55 Final Delft. the Netherlands. P. 11-15.
Polymer and Mould Innovations Int. Conf. Guimaraes,
[21]
Francis R. Recycling of Polymers. Wiley-VCH, Verlag
Portugal, 2014. P. 201-206.
GmbH and Co. KGaA, 2016. P. 83-90.
[9]
Al-Salem S., Lettiery P., Baeyens J. Recycling and
[22]
Brophy J. H., Hardmann S., Wilson D. C. Polymer
recovery routes of plastic solid waste (PSW): A review
cracking for feedstock recycling of mixed plastic
// Waste Manage. 2009. V. 29. P. 2625-2643.
wastes // Chemical aspects of plastics recycling /
Eds W. Hoyle, D. R. Karsa. The Royal Society of
[10]
Arvanitoyannis I. S., Bosnea L. A. Recycling of
Chemistry Information Services, Cambridge, UK,
polymeric materials used for food packaging: Сurrent
1997. P. 35-46.
status and perspectives // Food Review Int. 2001.
[23]
Scheirs J. Polymer Recycling: Science, Technology
V. 17. N 3. P. 291-346.
and Applications. 1998. John Wiley and Sons Ltd,
Chichester, UK, P. 241-258.
[11]
Kikuchi R., Kukacka J., Raschman R. Grouping of
[24]
Miskolczi N., Angyal A., Bartha L., Valkai I. Fuels
mixed waste plastics according to chlorine content //
by pyrolysis of waste plastics from agricultural and
Sep. Purif. Technol. 2008. V. 61. N 1. P. 75-81. https://
packaging sectors in a pilot scale reactor // Fuel
Process. Technol. 2009. V. 90. N 7-8. P. 1032-1040.
[12]
Wang C. Q., Wang H., Fu J. C. G., Liu Y. N.
Flotation
separation of waste plastics for recycling: a review //
[25]
Bahram S. Ph. D. Thesis. KTH School of Industrial
Waste Manage. 2015. V. 41. P. 28-38.
Engineering and Management, Division of Heat and
Power Technology. Stockholm. 69 p.
[13]
Censori M., la Marca F., Carvalho M. T. Separation of
[26]
Scheirs J., Kaminsky W. Feedstock recycling and
plastics: The importance of kinetics knowledge in the
pyrolysis of waste plastics: Сonverting waste plastics
evaluation of froth flotation // Waste Manage. 2016.
into diesel and other fuels. John Willey & Sons Ltd,
V. 54. P. 39-43.
Chichester, 2006. P. 193-207.
[27]
Scheirs J. Polymer recycling: Science, technology and
[14]
Ravve A. Principles of polymer chemistry. Kluwer
applications. John Wiley and Sons Ltd, Chichester,
Academic. Plenum Publishers, 2000.
UK, 1998. P. 241-258.
[15]
Lu P., Huang Q., Bourtsalas A. C., Themelis N. J.,
[28]
Weissman R. Recycling of mixed plastic waste by the
Chi Y., Yan J. Review on fate of chlorine during
Texaco gasification process // Chemical Aspects of
thermal processing of solid wastes // J. Environ. Sci.
plastics recycling / Eds W. Hoyle, D. R. Karsa The
2019. V. 78. P. 13-28.
Royal Society of Chemistry Information Services,
Cambridge, UK, 1997. P. 199-213.
[16]
Zhou H., Long Y., Li Q., Zhang Y. Thermogravimetric
[29]
EPA 540/R-94/514a. 1995. Texaco gasification
characteristics of typical municipal solid waste
process. Site Technology Capsule. United States,
1260
Захарян Е. М. и др.
Environmental Protection, Agency. Office of Research
[41]
Al-Harahsheh M., Al-Nu′airat J., Al-Otoom A.,
and Development Cincinnati, OH 45268.
Al-Hammouri I., Al-Jabali H., Al-Zoubi M., Abu
[30]
Niemann K., Wenzel F., The Veba-Combi-Cracking-
Al′asal Sh. Treatments of electric arc furnace dust and
Technology: An update // Fuel Process. Technol. 1993.
halogenated plastic wastes: A review // J. Environ.
V. 35. P. 1-20.
Chem. Eng. 2019. V. 7. N 1. ID 102856.
[31]
Zhu H. M., Jiang X. G., Yan J. H., Chi Y., Cen K. F.
[42]
Brebu M., Bhaskar Th., Murai K., Muto A., Sakata Y.,
TG-FTIR analysis of PVC thermal degradation and
Uddin Md. A. The effect of PVC and/or PET on
HCl removal // J. Anal. Appl. Pyrolysis. 2008. V. 82.
thermal degradation of polymer mixtures containing
brominated ABS // Fuel. 2004. V. 83. N 14-15.
[32]
Scott D. S.,
Czernik S.R., Piskorz J.,
P. 2021-2028.
Radlein D. St. A. G
. Fast pyrolysis of plastic wastes //
Energy Fuels. 1990. V. 4. P. 407-411.
[43]
Liu G., Liao Y., Ma X. Thermal behavior of vehicle
[33]
Zhou J., Gui B., Qiao Y., Zhang J., Wang W., Yao H.,
plastic blends contained acrylonitrile-butadiene-
Yu Y., Xu M. Understanding the pyrolysis mechanism
styrene (ABS) in pyrolysis using TG-FTIR // Waste
of polyvinylchloride (PVC) by characterizing the chars
Manage. (Oxford). 2017. V. 61. P. 315-326. https://
produced in a wire-mesh reactor // Fuel. 2016. V. 166.
[44]
Wu J., Chen T., Luo X., Han D., Wang Zh., Wu J. TG/
[34]
Zhou H., Wu Ch., Onwudili J. A., Meng A., Zhang Y.,
FTIR analysis on co-pyrolysis behavior of PE, PVC
Williams P. T. Influence of process conditions on
and PS // Waste Manage. 2014. V. 34. N 3. P. 676-682.
the formation of 2-4 ring polycyclic aromatic
hydrocarbons from the pyrolysis of polyvinyl chloride
[45]
Uddin Md.A., Sakata Yu., Shiraga Y., Muto A.,
// Fuel Process. Technol. 2016. V. 144. P. 299-304.
Murata K. Dechlorination of chlorine compounds
in Poly(vinyl chloride) mixed plastics derived oil by
[35]
Blazso M., Jakab E. Effect of metals, metal oxides
solid sorbents, // Ind. Eng. Chem. Res. 1999. V. 38.
and carboxylates on the thermal decomposition
processes of poly(vinyl chloride) // J. Anal. Appl.
[46]
Yanik J., Uddin Md. A., Ikeuchi K., Sakata Y. The
Pyrolysis. 1999. V. 49. N 1-2. P. 125-143. https://
catalytic effect of RedMud on the degradation of
poly(vinylchloride) containing polymer mixture into fuel
[36]
Ali M. F., Siddiqui M. N. Thermal and catalytic
oil // Polym. Degrad. Stab. 2001. V. 73. N 2. P. 335-346.
decomposition behavior of PVC mixed plastic
waste with petroleum residue // J. Anal. Appl.
[47]
Bhaskar Th., Tanabe M., Muto A., Sakata Y., Liu
Pyrolysis. 2005. V. 74. N 1-2. P. 282-289. https://
Ch.-F., Chen M.-D., Chao Ch. C. Analysis of
chlorine distribution in the pyrolysis products of
[37]
Masuda Y., Uda T., Terakado O., Hirasawa M.
poly(vinylidene chloride) mixed with polyethylene,
Pyrolysis study of poly(vinyl chloride)-metal oxide
polypropylene or polystyrene // Polym. Degrad. Stab.
mixtures: Quantitative product analysis and the
chlorine fixing ability of metal oxides // J. Anal.
Appl. Pyrolysis. 2006. V. 77. N 2. P. 159-168. https://
[48]
Zhou Q., Yang J.-W., Wang Y.-Zh., Wu Y.-H.,
Wang D.-Zh. Preparation of nano-MgO/Carbon
[38]
Ji M., Chen L., Que J., Zheng L. L., Chen Z., Wu Zh.
composites from sucrose-assisted synthesis for highly
Effects of transition metal oxides on pyrolysis
efficient dehydrochlorination process // Mater. Lett.
properties of PVC // Process Saf. Environ. Prot. 2020.
2008. V. 62. N 12-13. P. 1887-1889.
V. 140. P. 211-220.
[49]
Zhou Q., Lan W., Du A., Wang Yu., Yang J., Wu Y.,
[39]
Font R., Galvez A., Molto J., Fullana A., Aracil I.
Yang K., Wang X. Lanthania promoted MgO:
Formation of polychlorinated compounds in the
Simulnateous highly efficient catalytic degradation
combustion of PVC with iron nanoparticles //
and dehydrochlorination of polypropylene/polyvinyl
Chemosphere. 2010. V. 78. N 2. P. 152-159. https://
chloride // Appl. Catal. B: Environmental. 2008. V. 80.
N 1-2. P. 141-146.
[40]
Al-Harahsheh M., Al-Otoom A., Al-Makhadam L.,
Hamilton I. E., Kingman S., Al-Asheh S., Hararah M.
[50]
Zhou Q., Tang Ch., Wang Y.-Zh., Zheng L. Catalytic
Pyrolysis of poly(vinyl chloride) and electric arc
degradation and dechlorination of PVC-containing
furnace dust mixture // J. Hazard. Mater. 2015. V. 299.
mixed plastics via Al-Mg composite oxide catalysts //
P. 425-436.
Fuel. 2004. V. 83. N 13. P. 1727-1732.
Направления вторичной химической переработки поливинилхлорида (обзор). Часть 1
1261
[51]
Karayildirim T., Yanik J., Yuksel M., Saglam M.,
[61]
He Y., Ma X. Comparative investigation on non-
Vasile C., Bockhorn H. The effect of some fillers on
isothermal kinetics for thermo-degradation of
PVC degradation // J. Anal. Appl. Pyrolysis. 2006.
lignocellulosic substrate and its chlorinated derivative
V. 75. N 2. P. 112-119.
in atmospheres with CO2 participations // Bioresour.
Technol. 2015. V. 189. P. 71-80.
[52]
Park K.-B., Oh S.-J., Begum G., Kim J.-S. Production
of clean oil with low levels of chlorine and olefins in a
[62]
Ozsin G., Pütün A. E. A comparative study on co-
conditions two-stage pyrolysis of a waste low-density
pyrolysis of lignocellulosic biomass with polyethylene
polyethylene and polyvinyl chloride // Energy. 2018.
terephthalate, polystyrene, and polyvinyl chloride:
V. 157. P. 402-411.
Synergistic effects and product characteristics // J.
Clean. Prod. 2018. V. 205. P. 1127-1138.
[53]
Lopez A., de Marco I., Caballero B. M.,
Laresgoiti M. F., Adrados A. Dechlorination of fuels
[63]
Tang Y., Huang Q., Sun, K., Chi Y., Yan J
. Co-pyrolysis
in pyrolysis of PVC containing plastic wastes // Fuel
characteristics and kinetic analysis of organic food waste
Process. Technol. 2011. V. 92. N 2. P. 253-260. https://
[54]
Lopez A., de Marco I., Caballero B. M.,
[64]
Cao B., Sun Y., Wang Sh., Yuan J., Esakkimuthu S.,
Laresgoiti M. F., Adrados A., Aranzabal A. Catalytic
Uzoejinwa B.B., Yuan Ch., El-Fatan Abomohra A.,
pyrolysis of plastic wastes with two different types of
Qian L., Liu L., Li B., He Zh., Wang Q. Synergistic
catalysts: ZSM-5 zeolite and RedMud // Appl. Catal.
effects of co-pyrolysis of macroalgae and polyvinyl
B: Environmental. 2011. V. 104. N 3-4. P. 211-219.
chloride on bio-oil/bio-char properties and transferring
regularity of chlorine // Fuel. 2019. V. 246. P. 319-
[55]
Aquado J., Serrano D. In., Clarc J. H
. RSC clean
technology monographs, on feedstock recycling
[65]
Zevenhoven R., Alexlsen E. P., Hupa M. Pyrolysis of
of waste plastic // Cambridge: Royal Society of
waste-derived fuel mixtures containing PVC // Fuel.
Chemistry. 1999. P. 13-27.
2002. V. 81. N 4. P. 507-510.
[56]
Czegeny Zs., Jakab E., Blazso M., Bhaskar T.,
Sakato Y. Thermal decomposition of polymer mixtures
[66]
Zhang N., Shen Y. One-step pyrolysis of lignin and
of PVC, PET and ABS containing brominated flame
polyvinyl chloride for synthesis of porous carbon
retardant: formation of chlorinated and brominated
and its application for toluene sorption // Bioresour.
organic compounds // J. Anal. Appl. Pyrolysis. 2012.
Technol. 2019. V. 284. P. 325-332.
V. 96. P. 69-77.
[67]
Xu Y., Zeng X., Luo G., Zhang B., Xu P., Xu M.,
[57]
Brebu M., Bhaskar Th., Murai K., Muto A., Sakata Y.,
Yao H. Chlorine-char composite synthesized by co-
Uddin Md. A. Removal of nitrogen, bromine and
pyrolysis of biomass wastes and polyvinyl chloride
chlorine from PP/PE/PS/PVC/ABS-Br pyrolysis liquid
for elemental mercury removal // Fuel. 2016. V. 183.
products using Fe- and Ca-based catalysts // Polym.
Degrad. Stab. 2005. V. 87. N 2. P. 225-230. https://
[68]
Xu Y., Luo G., He Sh., Deng F., Pang Q., Xu Y., Yao H.
Efficient removal of elemental mercury by magnetic
[58]
Brebu M., Uddin M.A., Muto A., Sakata Y., Vasile C.
chlorinated biochars derived from co-pyrolysis of
Catalytic degradation of acrylonitrile-butadiene-
Fe(NO3)3-laden wood and polyvinyl chloride waste //
styrene into fuel oil. 2. Changes in the structure and
Fuel. 2019. V. 239. P. 982-990.
catalytic activity of iron oxides // Energy Fuel. 2001.
[69]
Sipra A.T., Gao N., Sarwar H. Municipal solid waste
[59]
Bhaskar Th., Kaneko J., Muto A., Sakata Yu., Jakab E.
(MSW) pyrolysis for bio-fuel production: A review
Pyrolysis studies of PP/PE/PS/PVC/HIPS-Br plastics
of effects of MSW components and catalysts // Fuel
mixed with PET and dehalogenation (Br, Cl) of the
Process. Technol. 2018. V. 175. P. 131-147. https://
liquid products // J. Anal. Appl. Pyrolysis. 2004. V. 72.
N 1. P. 27-33.
[70]
Lingaiah N., Uddin Md.A., Muto A., Imai T.,
Sakata Y. Removal chlorine compounds by catalytic
[60]
Lu P., Huang Q., (Thanos) Bourtsalas A. C., Chi Y.,
dehydrochlorination for the refinement of municipal waste
Yan J. Synergistic effects on chair and oil produced
plastic derived oil // Fuel. 2001. V. 80. N 13. P. 1901-1905.
by the co-pyrolysis of pine wood, polyethylene and
polyvinyl chloride // Fuel. 2018. V. 230. P. 359-367.
[71]
Lingaiah N., Azhar Uddin Md., Muto A., Sakata Yu.,
Imai T., Murata K. Catalytic dechlorination of
1262
Захарян Е. М. и др.
chloroorganic compounds from PVC-containing
chloride wastes in NaOH/ethylene glycol using an up-
mixed plastic-derived oil // Appl. Catal. A: General.
scale ball mill reactor and validation by discrete element
2001. V. 207. N 1-2. P. 79-84.
method simulations // Waste Manage. 2019. V. 99. P. 31-
[72]
Ahmed O. H., Altarawneh M., Al-Harahsheh M.,
[80]
Tongamp W., Kano J., Zhang Q., Saito F. Simultaneous
Jiang Zh.-T., Dlugogorski B. Z. Catalytic de-
treatment of PVC and oyster-shell wastes by
chlorination of products from PVC degradation by
mechanochemical means // Waste Manage. 2008.
magnetite (Fe3O4) // Appl. Surf. Sci. 2019. V. 480.
V. 28. N 3. P. 484-488.
P. 792-801.
[81]
Baláž M., Bujňáková Z., Achimovičová M.,
[73]
Lopez-Urionabarrenechea A., de Marco I.,
Tešinský M., Baláž P. Simultaneous valorization of
Caballero B. M., Laresgoiti M. F., Adrados A.
polyvinyl chloride and eggshell wastes by a semi-
Upgrading of chlorinated oils coming from pyrolysis
industrial mechanochemical approach // Environ. Res.
of plastic waste // Fuel Process. Technol. 2015. V. 137.
2019. V. 170. P. 332-336.
P. 229-239.
[82]
Wang M.-M., Zhang C.-C., Zhang F.-Sh. Recycling
[74]
Xiao X., Zeng Z., Xiao S. Behavior and products
of spent lithium-ion battery with polyvinyl chloride
of mechano-chemical dechlorination of polyvinyl-
by mechanochemical process // Waste Manage. 2017.
chloride and poly(vinylidene chloride) // J. Hazard.
V. 67. P. 232-239.
Mater. 2008. V. 151. N 1. P. 118-124.
[83]
Kosuda T., Okada T., Nozaka Sh., Matsuzawa Y.,
[75]
Kano J., Zhang Q., Saito F., Baron M., Nzihou A.
Shimizu T., Hamanaka S., Mishima Sh.
Synthesis of hydroxyapatite with the mechanochemical
Characteristics and mechanism of low temperature
treatment products of PVC and CaO // Process Saf.
dehydrochlorination of poly(vinyl chloride) in the
Environ. Prot. 2006. V. 84. N 4. P. 309-312. https://
presence of zinc(II) oxide // Polym. Degrad. Stab.
[76]
Mio H., Saeki Sh., Kano J., Saito F. Estimation of
mechanochemical dechlorination rate of poly(vinyl
[84]
Okada T., Sutoh S., Sejima K., Tomohara H.,
chloride) // Environ. Sci. Technol. 2002. V. 36. N 6.
Mishima Sh. A useful method for thorough
dehydrochlorimation of poly(vinylidene chloride-co-
[77]
Inoue T., Miyazaki M., Kamitani M., Kano J., Saito F.
vinyl chloride) using zinc(II) oxide // Polym. Degrad.
Mechanochemical dechlorination of polyvinyl
Stab. 2020. V. 171. N 4. P. 109040.
chloride by co-grinding with various metal oxides //
[85]
Hay J. N. Study of the thermal dehydrochlorination
Adv. Powder Technol. 2004. V. 15. N 2. P. 215-225.
of poly(vinylidene chloride) and poly(vinyl chloride)
by ESR spectroscopy // J. Polym. Sci. A. 1970. V. 8.
[78]
Inoue T., Miyazaki M., Kamitani M., Kano J., Saito F.
P. 1201-1212.
Dechlorination of polyvinyl chloride by its grinding
[86]
Szarka G., Domjan A., Szakacs T., Ivan B. Oil from
with KOH and NaOH // Adv. Powder Technol. 2005.
poly(vinyl chloride): Unprecedented degradative
V. 16. N 1. P. 27-34.
chain scission under mild thermooxidative
condition // Polym. Degrad. Stab. 2012. V. 97. N 9.
[79]
Lu J., Borrjigin S., Kumagai Sh., Kameda T., Saito Yu.,
Yoshioka T. Practical dechlorination of polyvinyl