Журнал прикладной химии. 2021. Т. 94. Вып. 1
НЕОРГАНИЧЕСКИЙ СИНТЕЗ И ТЕХНОЛОГИЯ НЕОРГАНИЧЕСКИХ ПРОИЗВОДСТВ
УДК 546.05, 54.057, 546.221.1, 546.34
СИНТЕЗ СУЛЬФИДА ЛИТИЯ КАРБОТЕРМИЧЕСКИМ ВОССТАНОВЛЕНИЕМ
СУЛЬФАТА ЛИТИЯ НЕФТЯНЫМ КОКСОМ
© Е. В. Карасева, Л. В. Шеина, В. С. Колосницын
Уфимский институт химии Уфимского федерального исследовательского центра РАН,
450054, г. Уфа, пр. Октября, д. 69
E-mail: karaseva@anrb.ru
Поступила в Pедакцию 4 ноября 2019 г.
После доработки 3 августа 2020 г.
Принята к публикации 20 августа 2020 г.
Изучено влияние условий карботермического восстановления сульфата лития нефтяным коксом на
состав образующихся продуктов и степень конверсии сульфата лития. Установлено, что оптималь-
ными условиями карботермического восстановления сульфата лития нефтяным коксом являются
температура 750°С и время 1-2 ч. Степень конверсии сульфата лития определяется способом при-
готовления реакционной смеси и составляет 80-90 мол%.
Ключевые слова: сульфид лития; нефтяной кокс; карботермическое восстановление; катодные ма-
териалы; сульфидно-литиевые аккумуляторы
DOI: 10.31857/S0044461821010011
Сульфид лития является перспективным электрод-
фидно-литиевого аккумулятора — композит суль-
ным материалом для энергоемких электрохимических
фид лития-углерод [5-11]. Применение этого метода
накопителей энергии — сульфидно-литиевых аккуму-
позволяет исключить при изготовлении электродов
ляторов [1, 2]. Преимуществом сульфидно-литиевых
технологические операции, связанные с использова-
аккумуляторов является высокая удельная энергия
нием гигроскопичного и легко окисляющегося инди-
(теоретическая удельная энергия системы углерод-
видуального Li2S.
сульфид лития 1400 Вт·ч·кг-1), высокая безопасность
В качестве восстановителей предложено исполь-
из-за отсутствия металлического литиевого электрода
зование самых разнообразных углеродных матери-
и низкая стоимость вследствие использования де-
алов — графитов, углеродных саж, углеродных на-
шевых электродных материалов. Источником ионов
новолокон и нанотрубок, графенов [5-8, 12, 13] и
лития является сульфид лития.
некоторых полимеров [11, 14]. Однако для снижения
Наиболее простым и дешевым методом получения
стоимости катодных материалов на основе Li2S в ка-
Li2S является карботермическое восстановление не-
честве восстановителя целесообразно использовать
дорогого сульфата лития [3, 4]:
дешевые углеродные материалы, например такие, как
нефтяной кокс.
Li2SO4 + 4C
Li2S + 4CO.
Цель работы — изучение влияния условий (тем-
Преимуществом этого метода является легкость
пературы и времени) карботермического восстанов-
масштабируемости и возможность in situ получать
ления сульфата лития нефтяным коксом на состав об-
активный материал положительного электрода суль-
разующихся продуктов — композитов Li2S-углерод.
5
6
Карасева Е. В. и др.
Экспериментальная часть
проводили при температурах 650, 750 и 850°С в те-
чение 1-10 ч.
В работе использовали сульфат лития моногидрат
Термогравиметрические исследования (ТГА) вы-
Li2SO4·H2O (ТУ 6-09-5299-86) и нефтяной кокс элек-
полняли с использованием стандартных методик [15]
тродный (ТУ 38.1011320-90).
на модернизированном дериватографе фирмы МОМ
Для карботермического восстановления сульфата
(Венгрия). Термограммы снимали в воздушной ат-
лития мольное соотношение Li2SO4:углерод должно
мосфере в закрытых корундовых тиглях, нагревая
быть не менее 1:4. С учетом того что нефтяной кокс
образцы до 1000°С со скоростью 5 град·мин-1.
содержит летучие органические вещества и после
Содержание Li2S в продуктах синтеза устанав-
полного восстановления сульфата лития полученный
ливали методом прямого кислотно-основного ти-
композит должен содержать углерод для обеспечения
трования с помощью автоматического титрато-
его электропроводности, мы использовали мольное
ра Titroline® 5000 (Sl Analytics) и универсального
соотношение Li2SO4:С = 1:6.4.
электрода марки HANNA HI 1333 B, аналогично [16].
Реакционную смесь Li2SO4·H2O и углерода гото-
В качестве титранта использовали фиксанальные
вили измельчением исходных компонентов в плане-
растворы HNO3 (х.ч., ГОСТ 4461-77 «Азотная кис-
тарной мельнице. После измельчения реакционную
лота»).
смесь подвергали термообработке в закрытых ке-
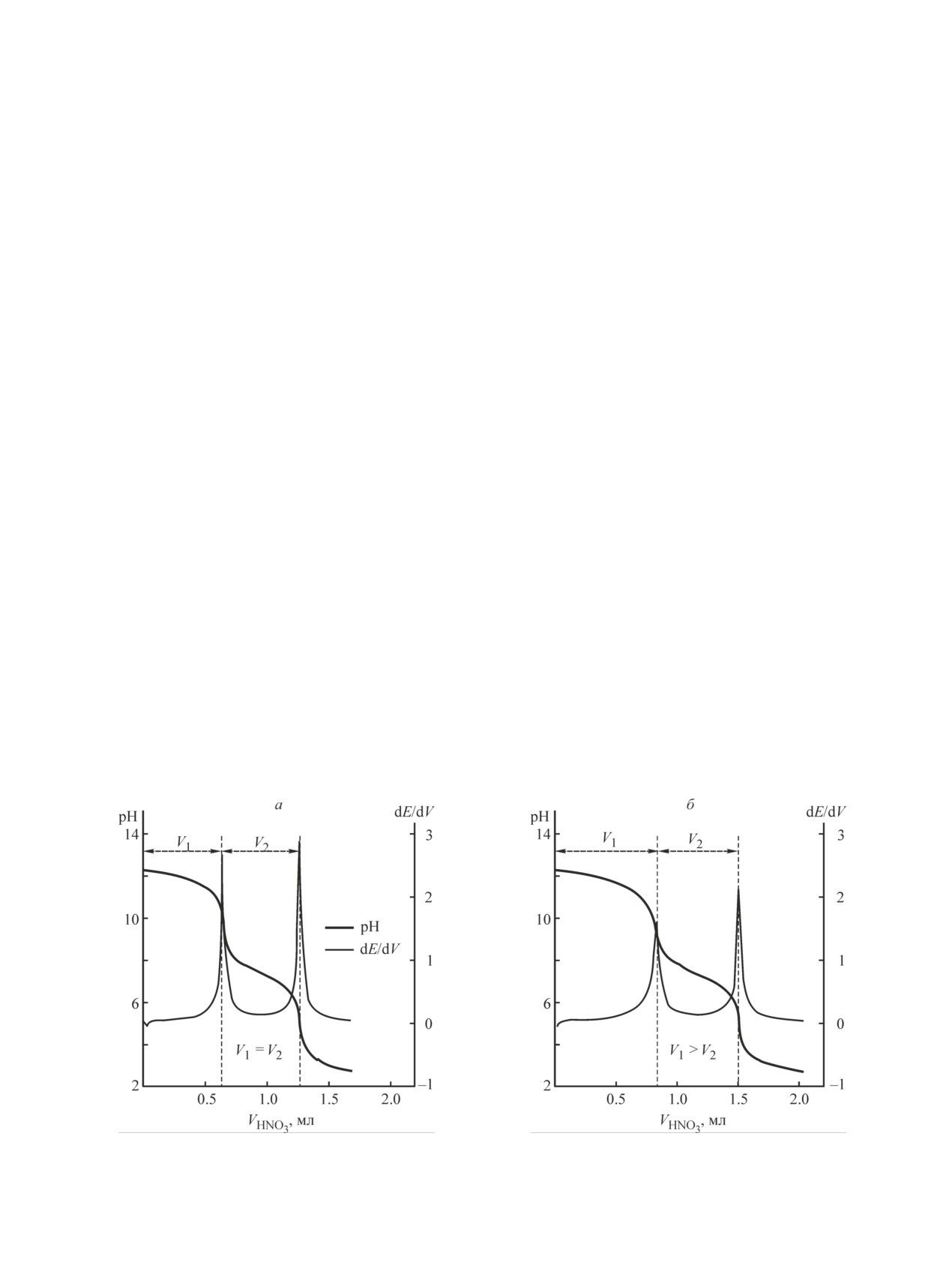
Кривая кислотно-основного титрования сульфида
рамических тиглях в муфельной печи в атмосфе-
лития имеет две ступени (рис. 1, а), соответствующие
ре воздуха. Нагрев муфельной печи проводили со
нейтрализации LiOH и LiHS, образующихся в резуль-
скоростью 10 град·мин-1. По истечении заданного
тате гидролиза Li2S. Содержание Li2S рассчитывали
времени синтеза тигель с полученным продуктом
по уравнению (1).
извлекали из горячей муфельной печи и переносили
При титровании синтезированных продуктов кар-
в перчаточный бокс, заполненный сухим воздухом.
ботермического восстановления сульфата лития было
Полученные продукты гомогенизировали растира-
обнаружено, что объем титранта, расходуемый на
нием в агатовой ступке и хранили в стеклянных гер-
первой ступени титрования, больше, чем объем ти-
метичных сосудах.
транта, расходуемый на второй ступени (рис. 1, б).
Время термолиза реакционной смеси отсчитывали
Этот факт свидетельствует о том, что в продуктах
от времени достижения заданной температуры и до
синтеза помимо Li2S присутствует литийсодержащая
извлечения смеси из муфельной печи. Для установле-
примесь, растворимая в воде, например Li2O, LiOH
ния оптимальных условий синтеза Li2S (температуры
или Li2CO3. Поскольку диапазон значений рН площа-
и времени) карботермическое восстановление Li2SO4
док на кривых титрования определяется кислотно-ос-
Рис. 1. Типичные кривые прямого кислотно-основного титрирования индивидуального Li2S (а)
и композита Li2S-нефтяной кокс (850°С, 6 ч) (б).
Синтез сульфида лития карботермическим восстановлением сульфата лития нефтяным коксом
7
новными свойствами титруемых соединений, допол-
титрования, расчет содержания Li2S в продуктах син-
нительно в аналогичных условиях было проведено
теза осуществляли по уравнению (2), а содержание
титрование Li2CO3 (ТУ 95.1951-89) и установлено,
Li2O — по уравнению (3).
что значения рН площадок на кривых титрования
На основании результатов кислотно-основного
лежат в диапазоне 11-7, что ниже по сравнению со
титрования рассчитывали состав продуктов синтеза.
значениями рН площадок на кривых титрования Li2O
Массовое содержание Li2S, Li2O и непрореагировав-
и Li2S (12.5-7.5). Полученные результаты позволили
шего Li2SO4 рассчитывали по уравнениям (4)-(6), а
нам предположить, что литийсодержащей примесью
массу углерода в продуктах синтеза — по разнице
в продуктах синтеза, вероятнее всего, является Li2O.
общей массы продуктов синтеза и суммы масс Li2S,
Поэтому в случае различия объема титранта, затра-
Li2O и Li2SO4. Степень конверсии сульфата лития
чиваемого на первой и второй ступенях на кривых
(мол%) рассчитывали по уравнению (7):
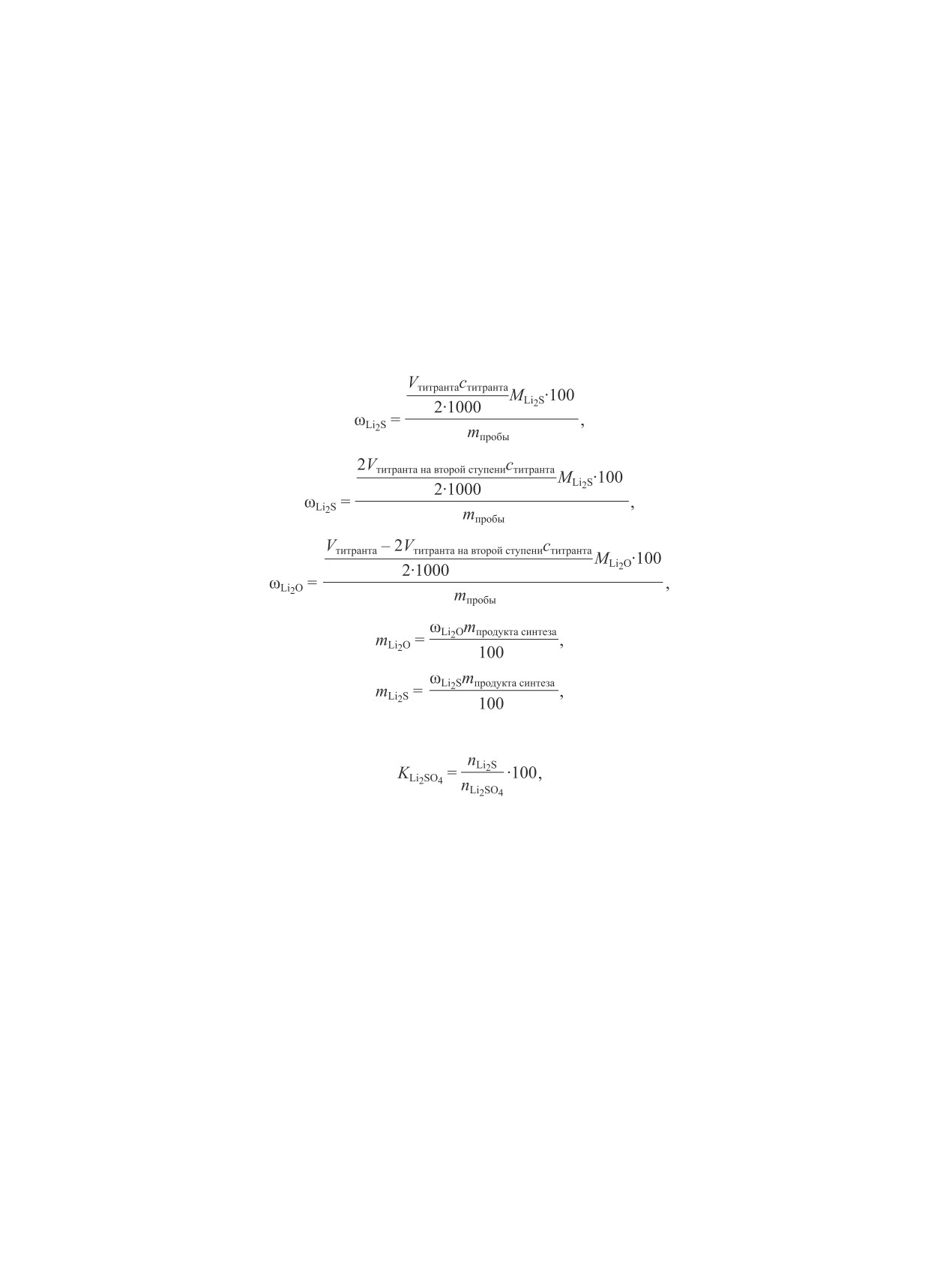
(1)
(2)
(3)
(4)
(5)
mLi2SO4 = MLi2SO4(nLi2SO4 - nLi2S - nLi2O),
(6)
(7)
где ωLi2S и ωLi2O — содержание Li2S и Li2O в про-
440°С, потеря массы при нагреве до 1000°С составила
дуктах синтеза (мас%); MLi2S, МLi2O и МLi2SO4 —
80 мас% (рис. 2, а). На кривой потери массы сульфата
молярные массы Li2S, Li2O и Li2SO4 (г·моль-1);
лития моногидрата наблюдается одна ступень при
mпробы — масса пробы образца, взятого для титрова-
132°С, соответствующая удалению одной молекулы
ния (г); ститранта — концентрация титранта (г-экв·л-1);
воды (14 мас%) (рис. 2, б). При температуре выше
Vтитранта — объем титранта, пошедший на титрование
300°С на кривой TГ сульфида лития наблюдается
пробы (мл); Vтитранта на второй ступени — объем титранта
увеличение массы образца до 160 мас% (рис. 2, в),
на второй ступени кривой титрования (мл); nLi2S, nLi2O
что свидетельствует о частичном окислении Li2S до
и nLi2SO4 — количество молей Li2S, Li2O и Li2SO4
Li2SO4 [3].
(моль); mLi2S, mLi2O и mLi2SO4 — масса Li2S, Li2O и
Первая ступень потери массы реакционной смеси
Li2SO4 в продуктах синтеза (г); mпродукта синтеза —
(рис. 2, г) при 130°С соответствует удалению кристал-
масса продукта синтеза (г); KLi2SO4 — степень кон-
логидратной воды из сульфата лития. Вторая ступень
версии сульфата лития (мол%).
потери массы начинается при температуре 440°С, что
соответствует температуре начала термодеструкции
углерода. Изменение массы реакционной смеси пре-
Обсуждение результатов
кращается при 700°С. Потеря массы реакционной
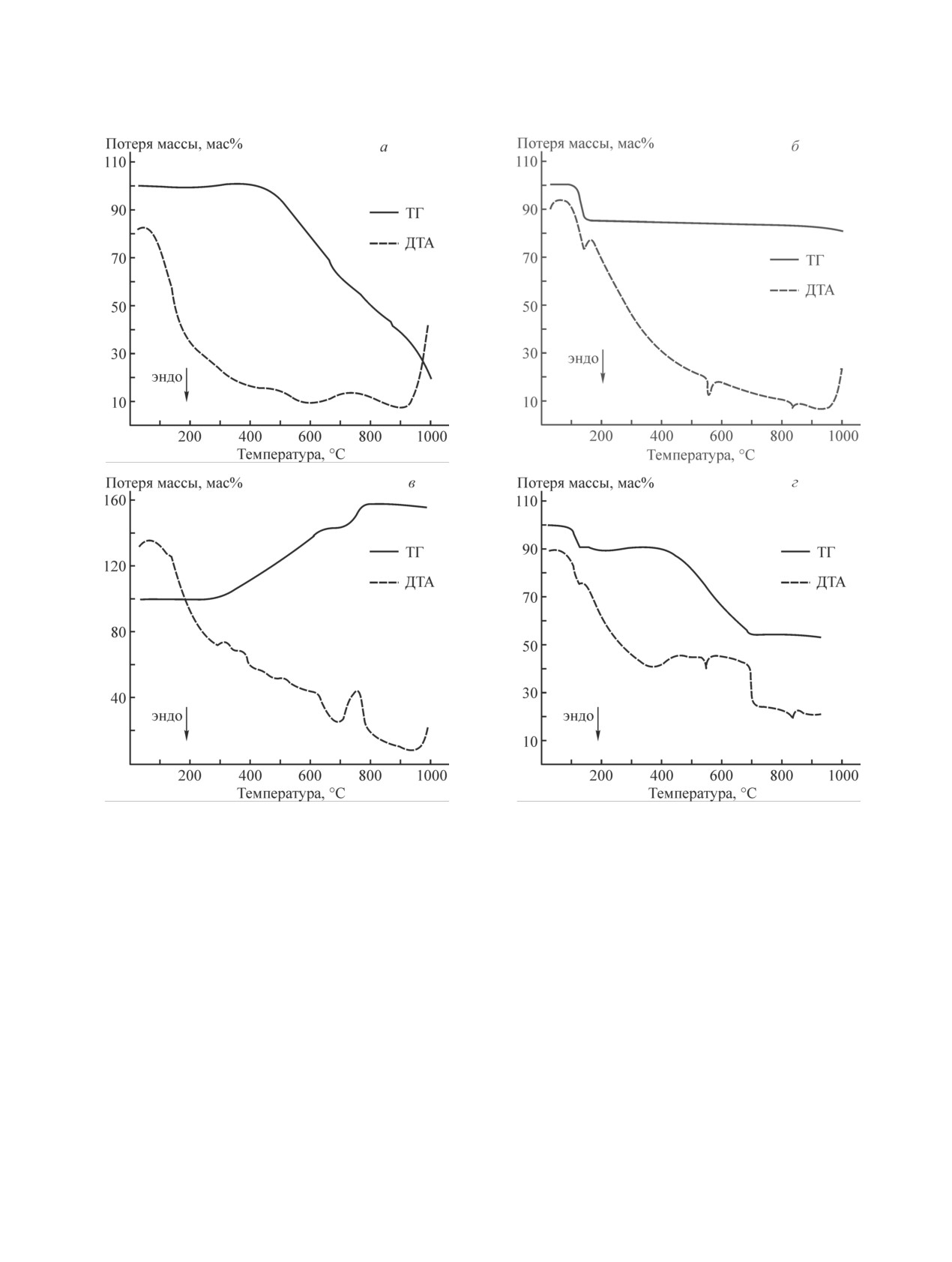
Термогравиметрические исследования показали,
смеси в интервале 440-700°С сопровождается двумя
что термодеструкция нефтяного кокса начинается при экзотермическими эффектами, интенсивность ко-
8
Карасева Е. В. и др.
Рис. 2. Кривые потери массы и тепловых эффектов нефтяного кокса (а), сульфата лития моногидрата (б), сульфида
лития (в) и реакционной смеси Li2SO4·H2O:нефтяной кокс (62.5:37.5 мас%) (г).
Условия анализа: тигель закрытый корундовый, скорость нагрева 5 град·мин-1.
торых выше, чем при термодеструкции нефтяного
Из кривых потери массы реакционных смесей в
кокса. Общая потеря массы реакционной смеси при
процессе термолиза при различных температурах
нагревании до 1000°С составила 46.8 мас%.
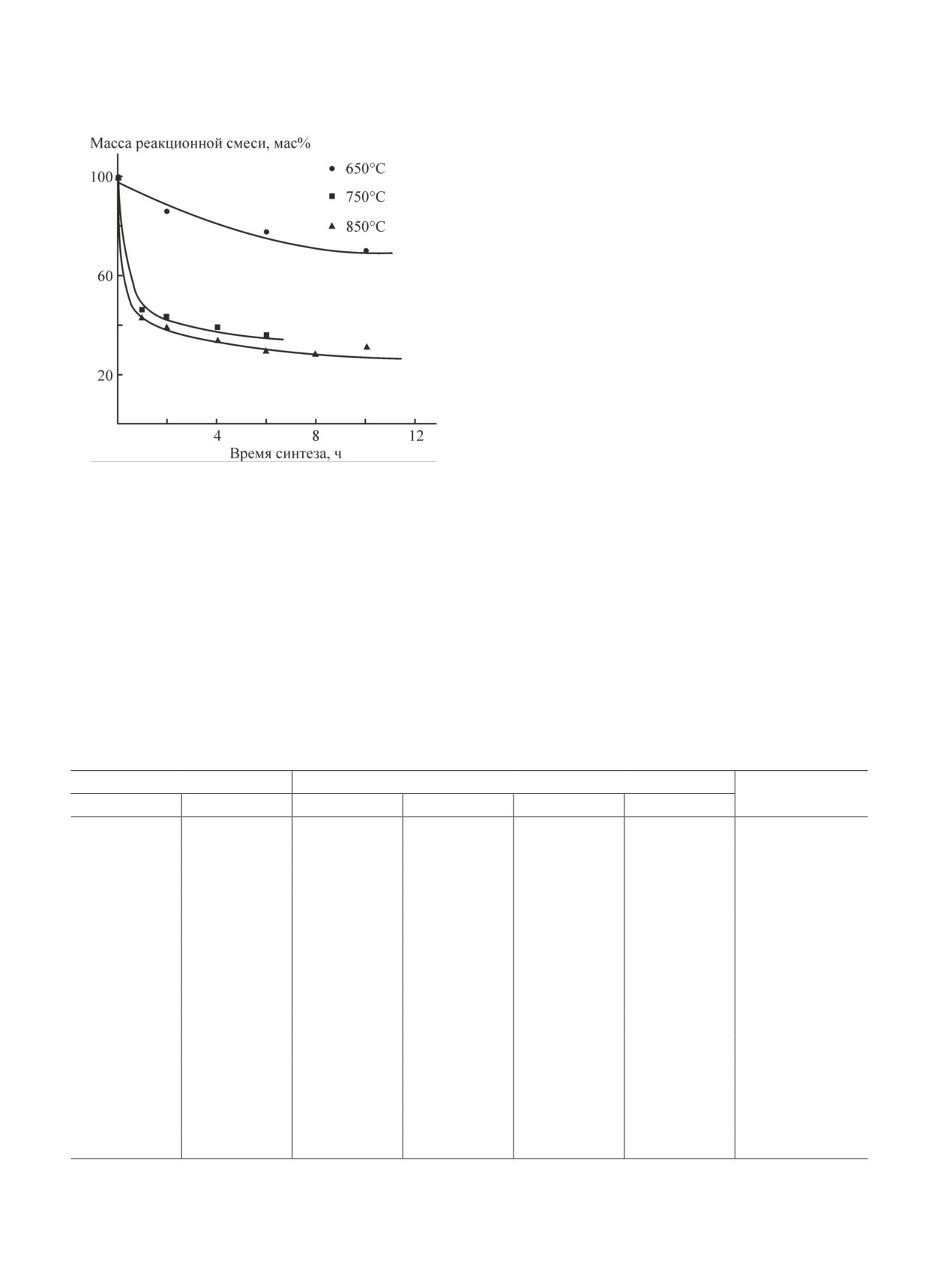
(рис. 3) следует, что увеличение температуры термо-
Если в условиях ТГА реакция восстановления
лиза приводит к более быстрому уменьшению массы
сульфата лития углеродом не протекает, то поте-
реакционной смеси. При температуре 650°С скорость
ря массы реакционной смеси должна составить
и глубина термолиза реакционной смеси существенно
39.4 мас%. Реальная потеря массы реакционной
ниже, чем при температурах 750 и 850°С.
смеси на 7.4 мас% больше, что может свидетель-
При температурах 750 и 850°С интенсивное
ствовать о частичном протекании реакции карботер-
уменьшение массы реакционной смеси происходит в
мического восстановления Li2SO4 в условиях TГA.
первые 1-2 ч. Затем уменьшение массы реакционной
Подтверждением протекания реакции карботерми-
смеси стабилизируется и практически прекращает-
ческого восстановления сульфата лития нефтяным
ся. Из анализа состава твердых продуктов синтеза
коксом является и присутствие интенсивных экзотер-
(см. таблицу) следует, что при 650°C реакция карбо-
мических эффектов на кривой ДТА.
термического восстановления Li2SO4 не протекает.
Синтез сульфида лития карботермическим восстановлением сульфата лития нефтяным коксом
9
Li2S в продуктах синтеза объясняется не повышением
конверсии сульфата лития, а снижением содержания
углерода. Повышение температуры синтеза от 750 до
850°С приводит к небольшому, на 2-3 мол%, повы-
шению степени конверсии.
Результаты проведенного исследования показа-
ли, что карботермическое восстановление сульфата
лития начинается при температурах выше 650°С.
При 750 и 850°С степень конверсии сульфата лития
при восстановлении нефтяным коксом составляет
80 ± 2 мол%.
Исходя из уравнения карботермического восста-
новления сульфата лития и мольного соотношения
исходных реагентов, состав продуктов синтеза при
условии 100%-ной конверсии сульфата лития должен
быть 61.3 мас% Li2S и 38.7 мас% углерода. Однако
содержание Li2S и углерода в продуктах синтеза ни-
Рис. 3. Влияние температуры и времени термолиза на же теоретического значения. Это свидетельствует о
изменение массы реакционной смеси.
том, что в условиях синтеза углерод расходуется не
Состав реакционной смеси (мас%): Li2SO4·H2
O — 62.5, только в реакции восстановления сульфата лития,
нефтяной кокс — 37.5.
но и в реакциях его термодеструкции и окисления
кислородом воздуха.
Содержание сульфида лития в продуктах синтеза не
Следует отметить, что в продуктах синтеза, полу-
превышает 0.05 мас%. При 750°С в течение первых
ченных при 750 и 850°С, всегда присутствует Li2O,
2 ч термолиза конверсия сульфата лития составила
содержание которого составляет от 2 до 3.5 мас% и
в среднем 80 мол%. Увеличение времени термолиза
не зависит от длительности и температуры термолиза.
не приводит к существенному повышению степени
Присутствие Li2О в продуктах синтеза предположи-
конверсии сульфата лития, но увеличивает его содер-
тельно обусловлено разложением карбоната лития,
жание в продуктах синтеза. Увеличение содержания
образовавшегося при повышенной температуре в
Состав продуктов синтеза Li2S карботермическим восстановлением Li2SO4 нефтяным коксом
Условия синтеза
Состав продукта синтеза, мас%
KLi2SO4, мол%
Т, °С
время, ч
Li2S
Li2SO4
Li2O
C
650
2
0.05
62.5
0
37.5
0.2
6
0.05
69.1
0
30.9
0.2
10
0.05
77.1
0
22.9
0.2
750
1
39.0
14.4
2.3
44.3
80.3
2
41.1
16.6
2.5
39.9
79.3
4
46.3
12.8
3.4
28.4
81.4
6
50.8
18.1
2.6
17.6
81.4
850
1
42.3
14.9
1.8
41.1
82.5
2
47.6
12.0
2.3
38.2
84.8
4
53.7
19.4
2.4
24.5
82.1
4
54.8
6.7
0.8
37.7
93.2*
6
59.6
24.9
3.5
12.2
79.1
8
66.3
21.7
2.6
9.4
83.5
10
55.9
32.5
1.7
9.9
77.6
* Синтез из реакционной смеси, полученной «растворным методом».
10
Карасева Е. В. и др.
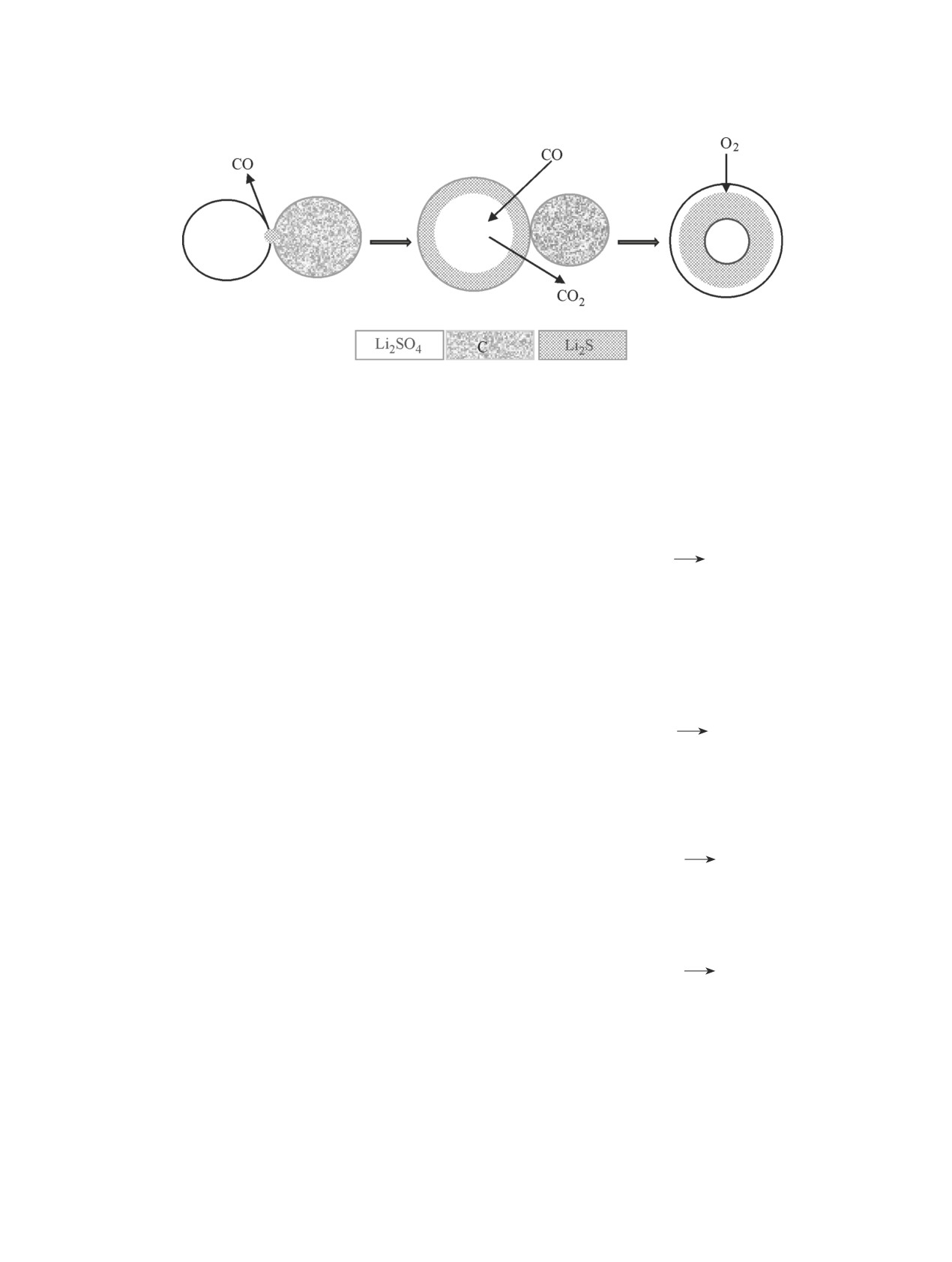
Рис. 4. Схема карботермического восстановления сульфата лития.
присутствии СО2 [17, 18]. Это предположение согла-
нескольких одновременно протекающих реакций и
суется с выводами других авторов, которые методом
может быть представлен схемой (рис. 4).
рентгеноструктурного анализа качественно обнару-
Первоначально в результате прямого взаимодей-
живали примеси Li2O и Li2СО3 в продуктах карбо-
ствия между твердыми частицами сульфата лития
термического восстановления сульфата лития [7, 8]
и углерода образуются сульфид лития и монооксид
и в композитах Li2S-углерод, полученных методом
углерода:
плазменного спекания [17, 18].
Li2SO4 + 4С
Li2S + 4CO.
Присутствие примесей сульфата лития в составе
продуктов синтеза (см. таблицу) может быть объ-
Затем роль восстанавливающего агента выполня-
яснено двумя причинами — неполным восстанов-
ет монооксид углерода. Это согласуется с выводами
лением Li2SО4 вследствие блокировки частицами
Kohl с соавт. [6], термодинамические расчеты кото-
Li2S, образовавшимися в процессе синтеза, и окис-
рых показали, что карботермическое восстановление
лением поверхностного слоя Li2S кислородом возду-
Li2SО4 при температуре выше 725°C, наиболее веро-
ха. Факторами, определяющими степень конверсии
ятно, протекает с образованием Li2S и CO:
сульфата лития, вероятно, являются размер частиц
исходных сульфата лития и углерода и их реакцион-
½Li2SO4 + 2CО
½Li2S + 2CO2.
ная доступность. Эффективным методом уменьшения
размера реагирующих частиц и увеличения площади
Образующийся диоксид углерода в свою очередь
контакта является смешивание исходных реагентов
реагирует с твердым углеродом с генерацией CO,
так называемым «растворным способом» [8, 19].
который возвращается в реакцию восстановления
С целью проверки данной гипотезы мы провели
сульфата лития, замыкая восстановительный цикл:
синтез композита Li2S-углерод термолизом смеси
C + СО2
2CO.
сульфата лития с нефтяным коксом, полученной «рас-
творным» методом. В водный раствор Li2SO4·H2O
В условиях проведения синтеза (выше 300°С) воз-
(сLi2SO4 = 24%) порционно вводили пасту углерода с
можно частичное окисление сульфида лития кисло-
этанолом (этанол применяли для улучшения смачи-
родом воздуха:
ваемости нефтяного кокса водным раствором суль-
фата лития), перемешивая суспензию на магнитной
Li2S + 2O2
Li2SO4.
мешалке в течение 5-6 ч. Затем растворитель удаляли
испарением при 80-100°С и образовавшуюся твердую
Таким образом, карботермическое восстановле-
фазу подвергали термолизу при 850°С в течение 4 ч.
ние сульфата лития осуществляется как углеродом,
Было установлено, что конверсия сульфата лития при
входящим в состав исходных реакционных смесей,
использовании реакционной смеси, полученной «рас-
так и монооксидом углерода, образующимся при
творным» методом, увеличилась с 82 до 93 мол%, а
взаимодействии сульфата лития и углерода, что со-
содержание углерода в составе продуктов синтеза бы-
гласуется с предположениями других авторов [7, 8].
ло близко к теоретическому значению (см. таблицу).
Аналогичные реакции протекают при карботерми-
Процесс карботермического восстановления
ческом восстановлении оксидов других металлов,
сульфата лития в воздушной атмосфере состоит из
например железа, марганца, титана и ванадия [20-23].
Синтез сульфида лития карботермическим восстановлением сульфата лития нефтяным коксом
11
Выводы
[4]
Pat. US 2011/0200882 Al (publ. 2011). Lithium
containing transition metal sulfide compounds.
Карботермическое восстановление сульфата ли-
[5]
Yang Z., Guo J., Das S. K., Yu Y., Zhou Z.,
тия нефтяным коксом является эффективным спо-
Abruna H. D., Archer L. A. In situ synthesis of lithium
собом получения композитов сульфид лития-угле-
sulfide-carbon composites as cathode materials for
род. Оптимальными условиями карботермического
rechargeable lithium batteries // J. Mater. Chem. A.
восстановления сульфата лития нефтяным коксом
2013. V. 1. N 4. P. 1433-1440.
являются: температура 750°С и продолжительность
процесса 1-2 ч, конверсия сульфата лития в данных
[6]
Kohl M., Brückner J., Bauer I., Althues H., Kaskel S.
условиях составляет 80 ± 2 мол%. Повышение темпе-
Synthesis of highly electrochemically active Li2S
nanoparticles for lithium-sulfur batteries // J. Mater.
ратуры синтеза выше 750°С и длительности синтеза
Chem. A. 2015. V. 3. P. 16307-16312.
более 3-4 ч не увеличивает степень конверсии суль-
фата лития, но приводит к существенному снижению
[7]
Liu J., Nara H., Yokoshima T., Momma T., Osaka T.
содержания углерода в продуктах синтеза за счет его
Micro-scale Li2S-C composite preparation from
термодеструкции.
Li2SO4 for cathode of lithium ion battery //
Изменением условий смешивания исходных реа-
Electrochim. Acta. 2015. V. 183. P. 70-77.
гентов удается повысить конверсию сульфата лития
с 80 ± 2 до 93 ± 2 мол%.
[8]
Li Z., Zhang S., Zhang C., Ueno K., Yasuda T.,
Tatara R., Dokko K., Watanabe M. One-pot pyrolysis
of lithium sulfate and graphene nanoplatelet
Финансирование работы
aggregates: In situ formed Li2S/graphene composite
for lithium-sulfur batteries // Nanoscale. 2015. V. 7.
Работа выполнена по теме № АААА-А17-
117011910031-7 (AAAA-A20-120012090022-1) госу-
[9]
Wang D. H., Xie D., Yang T., Zhong Y., Wang X. L.,
дарственного задания.
Xia X. H., Gu C. D., Tu J. P. Conversion from Li2SO4
to Li2S@C on carbon paper matrix: A novel integrated
cathode for lithium-sulfur batteries // J. Power Sources.
Конфликт интересов
2016. V. 331. P. 475-480.
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
[10]
Wang D. H., Xia X. H., Xie D., Niu X. Q., Ge X.,
Gu C. D., Wang X. L., Tu J. P. Rational in-situ
construction of three-dimensional reduced graphene
oxide supported Li2S/C composite as enhanced
Информация об авторах
cathode for rechargeable lithium-sulfur batteries // J.
Карасева Елена Владимировна, к.х.н., доцент,
Power Sources. 2015. V. 299. P. 293-300.
Шеина Людмила Владимировна, к.х.н.,
[11]
Ye F., Noh H., Lee J., Lee H., Kim H.-T. Li2S/carbon
nanocomposite strips from a low-temperature
conversion of Li2SO4 as high-performance lithium-
Колосницын Владимир Сергеевич, д.х.н., проф.,
sulfur cathodes // J. Mater. Chem. A. 2018. V. 6. N 15.
[12]
Peng Y., Zhang Y., Wen Z., Wang Y., Chen Z.,
Hwang B.-J., Zhao J. Constructing fast electron
Список литературы
and ion conductive framework for Li2S as advanced
[1] Su D., Zhou D., Wang C., Wang G. Lithium-sulfur
lithium sulfur battery // Chem. Eng. J. 2018. V. 346.
batteries: Toward high performance lithium-sulfur
batteries based on Li2S cathodes and beyond: Status,
[13]
Chen Y., Lu S., Zhou J., Qin W., Wu X. Synergistically
challenges, and perspectives // Adv. Funct. Mater. 2018.
assembled Li2S/FWNTs@reduced graphene oxide
V. 28. N 38. ID 1800154.
nanobundle forest for free-standing high-performance
Li2S cathodes // Adv. Funct. Mater. 2017. V. 27.
[2] Pat. US 8,361,652 B2 (publ. 2013). Lithium sulphide
battery and method of producing the same.
[14]
Zhang J., Shi Y., Ding Y., Peng L., Zhang W., Yu G.
[3] Лидин Р. А., Молочко В. А., Андреева Л. Л. Хими-
A Conductive molecular framework derived Li2S/N, P
ческие свойства неорганических веществ. М.:
codoped carbon cathode for advanced lithium-sulfur
Химия, 2000. С. 16.
batteries // Adv. Energy Mater. 2017. V. 7. ID 1602876.
12
Карасева Е. В. и др.
[20]
Kato Y. Hydrogen utilization for carbon recycling iron
making system // ISIJ Int. 2012. V. 52. N 8. P. 1433-
[15]
Альмяшев В. И., Гусаров В. В. Термические ме-
1438.
тоды анализа. СПб: СПбГЭТУ (ЛЭТИ), 1999.
C. 17-22.
[21]
Turkuova K., Slizovskiy D., Tangstad M. CO reactivity
[16]
Колосницын В. С., Кузьмина Е. В., Шеина Л. В.,
and porosity of manganese materials // ISIJ Int. 2014.
Карасева Е. В., Яковлева А. А. Определение со-
V. 54. N 6. P. 1204-1208.
держания сульфидной серы в растворах поли-
сульфидов лития в апротонных растворителях
[22]
Блохина И. А., Иванов В. В., Кирик С. Д., Никола-
методом кислотно-основного титрования // Изв.
ева Н. С. Карботермический синтез микронных
вузов. Химия и хим. технология. 2012. Т. 55. № 3.
порошков TiB2 // Неорган. материалы. 2016. Т. 52.
С. 22-26.
№ 6. С. 601-608.
[17]
Takeuchi T., Kageyama H., Nakanishi K., Tabuchi M.,
Sakaebe H., Ohta T., Senoh H., Sakai T., Tatsumi K.
[Blokhina I. A., Ivanov V. V., Kirik S. D., Nikolaeva N. S.
All-solid-state lithium secondary battery with Li2S-C
Carbothermal synthesis of TiB2 powders of micron
composite positive electrode prepared by spark-
size // Inorg. Mater. 2016. V. 52. N 6. P. 550-557.
plasma-sintering process // J. Electrochem. Soc. 2010.
V. 157. N 11. P. A1196-A1201.
[23]
Крутский Ю. Л., Максимовский Е. А., Крут-
ская Т. М., Попов М. В., Нецкина О. В., Никули-
[18]
Takeuchi T., Sakaebe H., Kageyama H., Senoh H.,
на А. А., Черкасова Н. Ю., Квашина Т. С. Синтез
Sakai T., Tatsumi K. Preparation of electrochemically
высокодисперсного диборида ванадия с исполь-
active lithium sulfide-carbon composites using spark-
зованием нановолокнистого углерода // ЖПХ.
plasma-sintering process // J. Power Sources. 2010.
2017. Т. 90. № 9. С. 1121-1127 [Krutskii Yu. L.,
V. 195. N 9. P. 2928-2934.
Maksimovskii E. A., Krutskaya T. M., Popov M. V.,
Netskina O. V., Nikulina A. A., Cherkasova N. Yu.,
[19]
Shunxin J., Xiuping C., Fan P., Zhao Z., Chen F.,
Kvashina T. S. Synthesis of highly dispersed vanadium
Zhong M. A simple solution-based method to prepare
diboride with the use of nanofibrous carbon // Russ. J.
honeycomb-like Li2S/graphene composite for lithium-
Appl. Chem. 2017. V. 90. N 9. P. 1379-1385.
sulfur batteries // Int. J. Electrochem. Sci. 2018. V. 13.
N 4. P. 3407-3419.