Журнал прикладной химии. 2021. Т. 94. Вып. 12
ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ И МАТЕРИАЛЫ НА ИХ ОСНОВЕ
УДК 541.64+691.175.743+541.183
НОВЫЙ СУЛЬФОКАТИОНИТ НА ОСНОВЕ ПОЛИВИНИЛХЛОРИДА
И ОЦЕНКА ВОЗМОЖНОСТИ ЕГО ПРИМЕНЕНИЯ ДЛЯ УМЯГЧЕНИЯ ВОДЫ
© М. Г. Мухамедиев1, Д. Ж. Бекчанов1, М. М. Жураев1,2, П. Лиеберзейт3, Д. А. Гафурова1
1 Национальный университет Узбекистана им. Мирзо Улугбека,
100174, Республика Узбекистан, г. Ташкент, ул. Университетская, д. 4
2 Чирчикский государственный педагогический институт Ташкентской области,
111700, Республика Узбекистан, Ташкентская обл., г. Чирчик, ул. Амира Темура, д. 104
Поступила в Редакцию 10 февраля 2021 г.
После доработки 2 декабря 2021 г.
Принята к публикации 2 декабря 2021 г.
Взаимодействием гранулированного поливинилхлорида с серой получен серосодержащий полимер, окис-
ление которого азотной кислотой привело к образованию сульфокатионита. Наличие сульфогруппы
в ионите доказано методом ИК-спектроскопии, а катионообменных свойств — определением его
статической обменной емкости. Методом сканирующей электронной микроскопии изучена морфо-
логия полученного катионита. Определено, что ионит термически устойчив при 423 K, устойчивость
по отношению к действию сильных окислителей, таких как хлорная и азотная кислоты, сильных
оснований составляет 80-95%. В статических условиях изучена кинетика и рассчитаны константы
равновесия сорбции ионов Са2+ и Мg2+ синтезированным катионитом из водных растворов. Уста-
новлено, что после проведения 5 циклов сорбции-десорбции емкость синтезированного катионита по
ионам Ca2+ и Mg2+ осталась неизменной. Показано, что синтезированный сульфокатионит можно
использовать для уменьшения жесткости воды.
Ключевые слова: поливинилхлорид; сера; окисление; сульфокатионит; сорбция; ионы металлов;
умягчение воды
DOI: 10.31857/S004446182112001X
Для умягчения воды используются несколько ви-
концентрированной серной кислотой в гетерофазных
дов ионитов (KУ-2, DOWEX-HCR-S/S, Lewatit-C249,
условиях [1].
Purolite-C100E), получаемых сульфированием сер-
Сорбенты, используемые в различных отраслях
ной кислотой сополимера стирола и дивинилбензо-
промышленности, должны отвечать ряду требова-
ла и содержащих сильнокислотные сульфогруппы.
ний, включая высокую сорбционную способность по
Недостатком метода их получения является много-
отношению к различным ионам, нерастворимость в
стадийность: сначала синтезируют гранулированный
воде, устойчивость к биодеградации, химическую и
полимер суспензионной сополимеризацией стирола с
термическую стабильность, возможность повторно-
дивинилбензолом, затем этот сополимер сульфируют
го использования, а процесс их получения должен
1362
Новый сульфокатионит на основе поливинилхлорида и оценка возможности его применения для умягчения воды
1363
соответствовать экологическим требованиям. Одним
ки, приведенные в следующих стандартах: ГОСТ
из способов получения ионообменных материалов
10898.1-84 «Иониты. Метод определения влаги»;
являются полимераналогичные превращения в цепях
ГОСТ10898.4-84 «Иониты. Методы определения
промышленных многотоннажных полимеров, выпу-
удельного объема»; ГОСТ 20255.1-89 «Иониты.
скаемых в виде волокон или гранул [2], например,
Методы определения статической обменной емко-
модификация поливинилхлорида полиэтиленполи-
сти»; ГОСТ 20255.2-89 «Иониты. Методы определе-
амином [3] с дальнейшим получением полиамфолита
ния динамической обменной емкости»; ГОСТ 16188-
на его основе [4]. Эти ионообменные материалы об-
70 «Метод определения прочности при истирании».
ладали способностью сорбировать цветные металлы
ИК-спектры порошков образцов (порошок по-
из водных растворов [5].
лучали растиранием образцов в ступе с пестиком
Цель работы — получение сульфокатионита пу-
из прочного минерала) регистрировали с помощью
тем химической модификации гранульного поливи-
ИК-Фурье-спектрометра IRTracer-100 (Shimadzu) в
нилхлорида серой и изучение возможности его при-
комплекте с приставкой однократного нарушенного
менения для уменьшения жесткости природных вод.
полного внутреннего отражения c призмой алмаз/
ZnSe MIRacle 10, предназначенной для анализа твер-
дых, жидких, пастообразных, гелеобразных и трудно-
Экспериментальная часть
обрабатываемых веществ в диапазоне сканирования
Сульфокатионит получали путем модификации
4600-600 см-1.
гранульного поливинилхлорида серой с дальнейшим
Морфологию поверхностей материалов изучали
окислением продукта осернения азотной кислотой.
с использованием метода сканирующей электронной
Взаимодействие серы с гранульным поливинилхло-
микроскопии на приборе EVO MA-10 (Carl Zeiss),
ридом проводили по модифицированной методике
оборудованном микроаналитической системой для
[6]. 10 г гранульного поливинилхлорида, очищенного
энергодисперсионного рентгеновского (EDX) микро-
по методике [3], помещали в автоклав из нержаве-
анализа (Oxford Instruments).
ющей стали и смешивали с 7 г порошкообразной
Термогравиметрический и дифференциально-тер-
серы. Автоклав плотно закрывали и нагревали при
мический анализ катионита проводили на термогра-
температуре 423 K в течение 5 ч. После охлаждения
виметрическом анализаторе TG 209 F1. Химическая
продукт помещали в колбу, снабженную обратным
стабильность была изучена в отношении сильных
холодильником, обрабатывали 150 мл 10 М HNO3 при
кислот, обладающих окислительными свойствами,
температуре 363 K в течение 4 ч, промывали водой и
таких как HNO3 и HClO4, и в отношении сильного
сушили до постоянной массы. Статическая обменная
основания — NaOH при высоких температурах. Для
емкость (СОЕ) по NaОН полученного образца соста-
выявления химической стойкости исследуемые иони-
вила 3.5 мг-экв·г-1, прочность сорбента — 95-98%.
ты оставляли в агрессивных реагентах (1 и 5% HNO3
Используемые реагенты для синтеза катионита
и HClO4, 5% NaOH) на 10-48 ч, после чего иониты
на основе поливинилхлоридного пластиката и в про-
отфильтровывали, промывали до нейтральной реак-
цессе сорбции металлов на катионите: сера моло-
ции и высушивали до постоянной массы. Химическая
тая (ч., ООО Sur Energy), HNO3 (конц., х.ч.), HClO4
стабильность ионитов оценивалась по изменению
(конц., х.ч.), NaOH (гранулы, х.ч.), CaCl2 обезвожен-
значения СОЕ. Изменение массы при воздействии
ный (х.ч.); MgCl2·6H2O (ч.), этилендиаминтетраук-
сильных кислот и оснований определяли гравиметри-
сусная кислота (ч.), NaCl (ч.) (все вышеуказанные
ческим методом. Для этого навеску сухого образца
реактивы производства ООО «АО РЕАХИМ»), пла-
ионита массой 1.0 г помещали в коническую колбу с
стикат поливинилхлорид марки И40-13А, рец. 8/2
плотно притертой пробкой и заливали 100 мл иссле-
в виде сферических гранул размером 2-3 мм (АО
дуемого раствора и выдерживали при необходимой
«Джакопо Индастриз групп»); этилацетат (ч., АО
температуре и времени. Сорбент отфильтровывали,
«Навоиазот») — очищали перегонкой, температура
высушивали и определяли остаточную массу.
кипения 350 K, nD20 1.3720. Катионит КУ-2-8 (ООО
Сорбцию ионов металлов из водных растворов на
«СМОЛЫ»).
сульфокатионит изучали при исходной концентрации
Подготовку синтезированного сульфокатио-
Ca2+ и Mg2+ 0.025, 0.05, 0.075, 0.1 моль·л-1 при тем-
нита вели по методике ГОСТ 10896-78 «Иониты.
пературах 293, 303 и 313 K. Для этой цели навески по
Подготовка к испытанию». Физико-химические
0.2 г сухого ионита со статической обменной емко-
характеристики синтезированного ионита и ка-
стью 3.5 мг-экв∙г-1 помещали в конические колбы ем-
тионита КУ-2-8 определяли, используя методи-
костью 250 мл и заливали 100 мл раствора изучаемой
1364
Мухамедиев М. Г. и др.
соли определенной концентрации, сорбцию проводи-
ли в течение 24 ч при постоянном перемешивании на
магнитной мешалке со скоростью 80 об·мин-1. Для
поддержания постоянной температуры колбу с ме-
шалкой помещали в воздушный термостат. Кинетику
сорбции изучали аналогичным образом, реакцию
вели в нескольких колбах с различной концентраци-
ей соли и при различных температурах. Из реакци-
онных колб за определенный промежуток времени
отбирали пробу и определяли концентрацию ионов
металлов. Концентрацию Са2+ и Мg2+ до и после
адсорбции определяли методом комплексонометрии
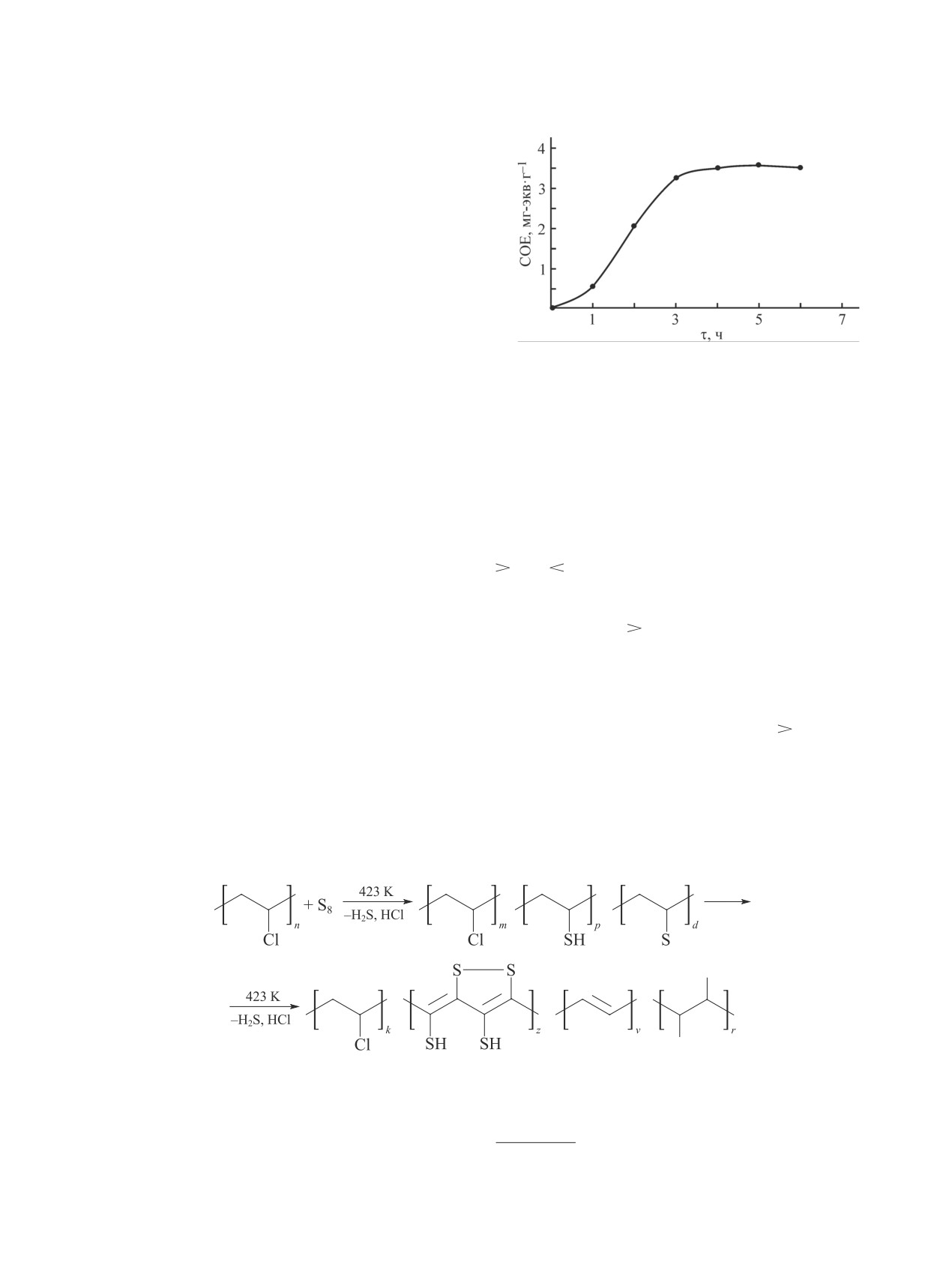
Рис. 1. Зависимость статической обменной емкости
сульфокатионита на основе поливинилхлорида от
с использованием этилендиаминтетрауксусной кис-
продолжительности реакции осернения полимера
лоты. Для определения динамической обменной ем-
(Т = 423 K).
кости полученный гранулированный сульфокатионит
с СОЕ 3.50 мг-экв·г-1 в натриевой форме помещали
в колонку и пропускали растворы, содержащие раз-
образованию новых ионогенных групп в модифици-
личные концентрации Са2+ и Мg2+, до тех пор, пока
рованном полимере (рис. 1).
не наблюдался проскок ионов в растворе при выходе
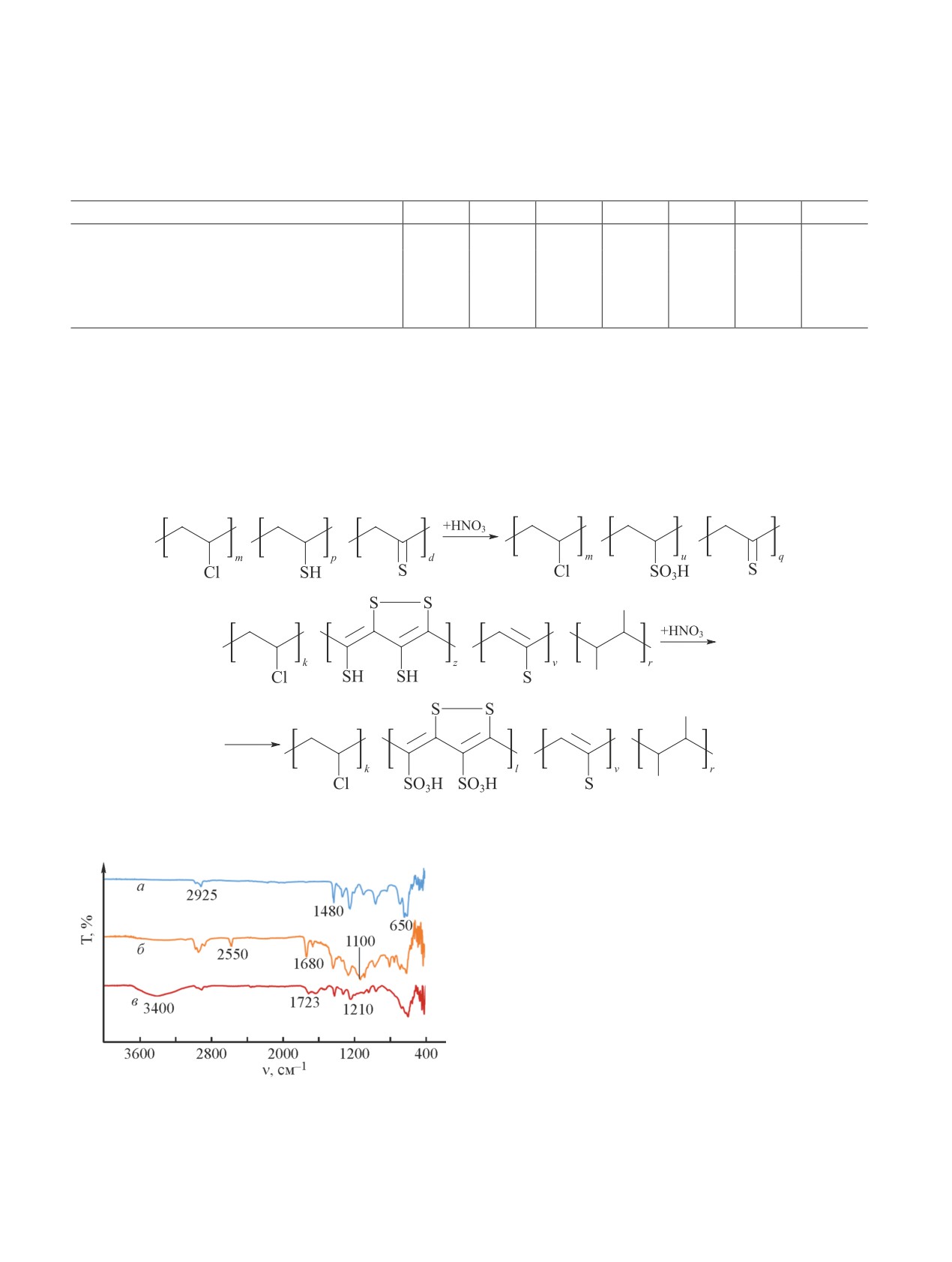
В ИК-спектре полимера, модифицированного се-
из колонки. Десорбцию проводили 10%-ным водным
рой (рис. 2, б), в области 1630-1680 см-1 присутст-
раствором NaCl.
вуют полосы поглощения валентных колебаний
C C связи [7]. Появление этих полос связано
с дегидрохлорированием винилхлоридной цепи.
Обсуждение результатов
Полоса поглощения в области 1100 см-1 принадлежит
Повышение температуры реакционной среды до
тионовой группе C S, а при 2550 см-1 наблюда-
423 K при осернении поливинилхлорида приводит
ется полоса поглощения, соответствующая валент-
к возрастанию СОЕ катионита, однако при темпе-
ным колебаниям —S—H сульфидной группы. В ИК-
ратурах выше 423 K происходит снижение сорбци-
спектрах всех изучаемых образцов (рис. 2) в области
онной способности. При температуре 453 K также
693 и 635 см-1 наблюдается полоса поглощения ва-
наблюдается уменьшение массы модифицируемого
лентных колебаний остаточных групп С—Cl и при
серой полимера (табл. 1), причиной чего может яв-
1250, 1480-1440 и 1425 см-1 полосы поглощения, со-
ляться деструкция макромолекул поливинилхлорида.
ответствующие деформационным колебаниям групп
Максимальная статическая обменная емкость
С—С, С—Н и СН2 полимерной цепи* [7]. На основе
ионита, полученного осернением поливинилхлори-
анализа ИК-спектров схему реакции взаимодействия
да, достигается за 5 ч (Т = 423 K), дальнейшее уве-
поливинилхлорида и серы можно представить в сле-
личение продолжительности процесса не приводит к
дующем виде:
В процессе реакции некоторые атомы хлора заме-
Для формирования сульфогрупп в структуре по-
щаются атомами серы, к образовавшимся в результате
лимера была проведена реакция окисления осер-
реакции дегидрохлорирования двойным связям при-
соединяется сульфид водорода, и в структуре поли-
* Купцов А. Х., Жижин Г. Н. Фурье-КР и Фурье-ИК
мера появляются гидросульфидные группы.
спектры полимеров. М.: Техносфера, 2013. С. 31-35.
Новый сульфокатионит на основе поливинилхлорида и оценка возможности его применения для умягчения воды
1365
Таблица 1
Характеристики сульфокатионита, полученного взаимодействием поливинилхлорида с серой при различных
температурах*
Температура, K
393
403
413
423
433
443
453
Статическая обменная емкость, мг-экв∙г-1
1.8
2.3
3.2
3.5
3.3
3.1
2.9
Масса поливинилхлорида до реакции, г
2
2
2
2
2
2
2
Масса продукта после реакции, г
2.12
2.18
2.22
2.26
2.11
2.01
1.95
Прирост массы, %
5.75
8.70
10.82
12.86
5.30
0.35
-2.75
* Мольное соотношение поливинилхлорид:S = 1:1.5, продолжительность реакции 5 ч.
ненного полимера раствором HNO3. Максимальная
—SО3H-группы, в области 1220-1080 см-1 — ва-
СОЕ достигалась в 10 М растворе HNO3 за 4 ч при
лентные колебания связи S О, полосы поглощения
температурах выше 363 K (табл. 2).
—ОН-групп в области 3400 см-1. Реакцию окисления
В ИК-спектре синтезированного сульфокатионита
азотной кислотой серы в составе модифицированного
(рис. 2, в) в области 1723 и 1210 см-1 наблюдаются
поливинилхлорида можно представить следующей
интенсивные полосы поглощения одновалентной
схемой:
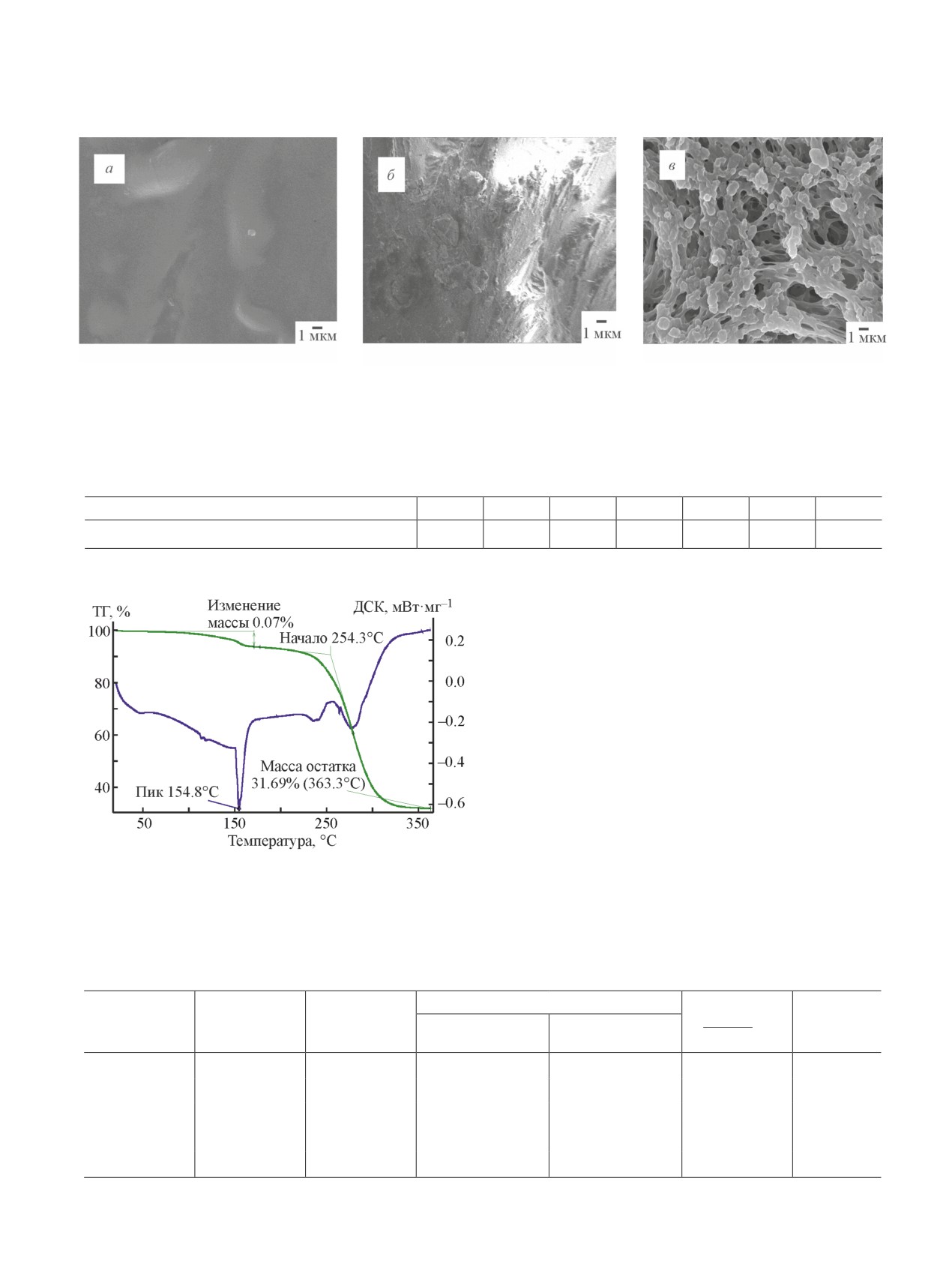
Поверхность исходного поливинилхлорида яв-
ляется однородной и не имеет пор (рис. 3, а), после
удаления пластификаторов путем экстракции и мо-
дификации поливинилхлорида серой фиксируются
(рис. 3, б) элементы надмолекулярной структуры
полимера (сера присутствует в форме кристаллов ок-
таэдрической формы). Изображение сульфокатионита
на основе поливинилхлорида (рис. 3, в) иллюстрирует
участки поверхности сорбента, имеющие пористую
структуру, облегчающую адсорбцию ионов металлов
на поверхности сорбента.
При нагревании масса образца изменяется в 2 эта-
па (рис. 4): при 403-433 K регистрируется потеря
массы 6.07%, при нагревании выше 527 K происходит
Рис. 2. ИК-спектры поливинилхлорида и продуктов его
разложение образца, приводящее к потере до 32%
модификации.
массы от первоначальной. На кривых дифференци-
а — поливинилхлорид; б — поливинилхлорид, модифи-
альной сканирующей калориметрии регистрируется
цированный серой; в — сульфокатионит на основе поли-
винилхлорида.
эндотермический пик при Tмах = 427.8 K с поглоще-
1366
Мухамедиев М. Г. и др.
Рис. 3. Изображения, полученные методом сканирующей электронной микроскопии, образцов поливинилхлорида
(а), поливинилхлорида, модифицированного серой (б), сульфокатионита на основе поливинилхлорида (в).
Таблица 2
Влияние температуры на статическую обменную емкость образовавшегося сульфокатионита при окислении
поливинилхлорида, модифицированного серой*
Температура, K
323
333
343
353
363
373
383
Статическая обменная емкость, мг-экв·г-1
1.2
1.4
2.9
3.3
3.5
3.5
3.5
* Время реакции 4 ч, окислитель HNO3(конц.).
нием энергии 28.13 Дж·г-1 и при Tмах = 554 K — по-
терей энергии 130 Дж·г-1. Полученные результаты
показывают, что термостабильность сульфокатионита
на основе поливинилхлорида соответствует анало-
гичным характеристикам промышленного катионита
КУ-2 [8].
Устойчивость сульфокатионита на основе поли-
винилхлорида к сильным основаниям и кислотам
позволяет его использовать в агрессивных средах
(табл. 3). Физико-химические параметры сульфока-
тионита, полученного на основе поливинилхлорида
(табл. 4), практически близки к аналогичным показа-
телям катионита КУ-2-8, используемого в промыш-
Рис. 4. Дериватограмма сульфокатионита на основе
ленности, и соответствуют ГОСТ 20298-74 «Смолы
поливинилхлорида (ТГ — термогравиметрия, ДСК —
ионообменные».
дифференциальная сканирующая калориметрия).
Таблица 3
Устойчивость сульфокатионита, полученного на основе полвинилхлорида, к различным агрессивным средам
-1
Статическая обменная емкость, мг·экв·г
Температура
Время
СОЕпосл
Изменение
Среда
после обработки
, %
Т, K
контакта, ч
исходная СОЕисх
массы, %
СОЕпосл
СОЕисх
1% HNO3
298
48
3.43
3.12
91.1
1.0
5% HNO3
298
48
3.43
3.01
87.6
4.5
1% HClO4
298
48
3.43
2.45
71.4
13.6
5% HClO4
298
48
3.43
2.28
66.5
14.5
5% NaOH
373
10
3.43
2.85
83.0
11.5
Новый сульфокатионит на основе поливинилхлорида и оценка возможности его применения для умягчения воды
1367
Таблица 4
Характеристики сульфокатионита на основе поливинилхлорида и катионита КУ-2-8
Катионит на основе поливинилхлорида
Катионит КУ-2-8
Показатель
H+-форма
Na+-форма
H+-форма
Na+-форма
Внешний вид и цвет
Продолговатые светло-коричневые
Сферические светло-красно-желтые
гранулы
гранулы
Размер гранул, мм
0.3-1.9
0.3-1.3
Удельный объем влажного катионита,
2.4
2.4
2.8
2.8
см3·г-1, не более
Статическая обменная ем-
NaOH
3.5
Отсутствует
4.3
Отсутствует
кость по 0.1 Н растворам,
CaCl2
1.9
2.2
2.8
2.9
ммоль-экв·г-1
MgCl2
1.9
2.1
2.2
2.4
Общая динамическая
NaOH
1400
Отсутствует
1600
Отсутствует
обменная емкость,
CaCl2
Не определялась
1170
Не определялась
1350
г-экв·(м3)-1
MgCl2
Не определялась
1250
Не определялась
1310
Влажность, %
28-32
48-58
Механическая прочность, %
99
99
Рис. 5. Кинетика сорбции ионов Мg2+ (а) и Са2+ (б) сульфокатионитом на основе поливинилхлорида при темпера-
туре 313 K.
Рис. 6. Изотермы сорбции ионов Са2+ (а) и Мg2+ (б) из водных растворов сульфокатионитом на основе поливи-
нилхлорида при различных температурах (время контакта 24 ч).
1368
Мухамедиев М. Г. и др.
Таблица 5
Параметры уравнений Ленгмюра и Фрейндлиха, описывающие изотермы сорбции ионов Са2+ и Mg2+
сульфокатионитом на основе поливинилхлорида
Константы уравнения
Константы уравнения Ленгмюра
Коэффициент
1/n
Коэффициент
Фрейндлиха qe = KFc
Ион
корреляции
корреляции
максимальная адсорбция
константа равновесии
R2
n
KF, мг·г-1
R2
qмax, мг·г-1
адсорбции KL, л·мг-1
Ca2+
55.5
0.00085
0.997
5.68
11.72
0.982
Mg2+
38.5
0.00074
0.972
2.44
1.18
0.968
Таблица 6
Термодинамические характеристики процесса сорбции ионов Са2+ и Mg2+ сульфокатионитом на основе
поливинилхлорида
ΔG°, кДж·моль-1
Ион
ΔH°, кДж·моль-1
ΔS°, Дж·моль-1∙K-1
293 K
303 K
313 K
Ca2+
8.44
52.72
-6.99
-7.52
-8.05
Mg2+
3.01
37.84
-8.06
-8.44
-8.82
Равновесие при сорбции ионов Мg2+ и Са2+ по-
Выводы
лученным сульфокатионитом достигается в течение
Синтезированный на основе поливинилхлорида
12 ч, дальнейшее увеличение времени контакта ка-
сульфокатионит соответствует требованиям, предъ-
тионита с растворами солей к возрастанию сорбции
являемым к ионитам, используемым для уменьшения
практически не приводит (рис. 5). Изотермы сорбции
жесткости воды.* Изотермы сорбции синтезирован-
ионов Са2+ и Мg2+ катионитом свидетельствуют о его
ным сульфокатионитом ионов Ca2+ и Mg2+ описыва-
высокой сорбционной способности по отношению к
ются уравнением Ленгмюра, статическая обменная
ионам этих металлов (рис. 6).
емкость синтезированного ионообменного материала
Значения констант равновесия адсорбции рас-
по ионам Ca2+ выше, чем у катионита Purolite C100E.
считаны из изотерм сорбции с использованием мо-
Динамическая сорбционная емкость сульфокатионита
дифицированных для ионного обмена уравнений
на основе поливинилхлорида по ионам Ca2+ и Mg2+
Фрейндлиха и Ленгмюра [9]. Коэффициенты корреля-
после нескольких циклов сорбции-десорбции оста-
ции R2 при расчетах по уравнению Ленгмюра выше,
ется практически неизменной, что свидетельствует
чем по уравнению Фрейдлиха (табл. 5), следователь-
о возможности его многократного применения для
но, процесс изучаемой адсорбции ионов металлов
уменьшения жесткости природной воды.
лучше описывается уравнением Ленгмюра.
Эндотермический характер процесса и возраста-
ние энтропии, наблюдаемые в данной работе (табл. 6),
Финансирование работы
также отмечены при изучении сорбции ионов Са2+
Работа выполнена в рамках проекта
ионитом Purolite C100E (ΔH = 22.733 кДж·моль-1 и
ПЗ-20170925290+ПЗ-2017092965+GP-20170927395
ΔS = 9.545·10-3 кДж·моль·K-1) [10].
«Получение ионитов на основе местного сырья и
С целью выяснения возможности использова-
их использование для сорбции цветных и редких
ния полученного сульфокатионита в промышлен-
металлов из отходов производства», финансируе-
ных условиях проведено исследование сорбции-
мого Министерством инновационного развития
десорбции ионов Ca2+ и Mg2+ в динамических
Республики Узбекистан.
условиях. Установлено, что динамическая обменная
емкость сульфокатионита после регенерации рас-
твором NaCl в первых пяти циклах практически не
изменялась.
* ГОСТ 20298-74. Смолы ионообменные.
Новый сульфокатионит на основе поливинилхлорида и оценка возможности его применения для умягчения воды
1369
Конфликт интересов
в промышленной водоподготовке // ЖПХ. 2019.
Т. 92. № 11. С. 1401-1407.
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в этой статье.
[Mukhamediev M. G., Bekchanov D. Zh . New anion
exchanger based on polyvinyl chloride and its
Информация о вкладе авторов
application in industrial water treatment // Russ. J.
Appl. Chem. 2019. V. 92. N 11. Р. 1499-1505.
М. Г. Мухамедиев предложил метод получения
сульфокатионита на основе поливинилхлорида и ус-
[4]
Bekchanov D., Mukhamediev M., Kutlimuratov
ловия его получения, проводил расчеты термодинами-
N., Xushvaqtov S., Juraev M. Synthesis of a new
ческих параметров процесса сорбции; Д. Ж. Бекчанов
granulated polyampholyte and its sorption properties
осуществлял синтез осерненного поливинилхлорида,
// IJTech. 2020. V. 11. N 4. P. 794-803.
изучал кинетику и термодинамику процесса сорбции
ионов металлов; Д. А. Гафурова проводила окисле-
[5]
Himoyat I., Shodlik K., Mukhtarjan M., Davronbek B.,
Sherimmat Y., Bakhtiyor Y. Sorption of Zn (II) and
ние осерненного поливинилхлорида и определяла
Cr (III) ions into ion exchangers obtained on the basis
статическую обменную емкость полученного суль-
of local raw materials // Int. J. Pharm. Res. 2020.
фокатионита; М. М. Жураев проводил эксперименты
V. 12. N 3. Р. 1728-1738.
по наработке образцов и изучению их динамической
обменной емкости, влажности, прочности катионита;
[6]
Шаглаева Н. С., Баландин В. В., Султангареев Р. Г.,
Петер Лиеберзейт проводил исследование получен-
Прозорова Г. Ф., Вакульская Т. И., Хутсишвили С. С.
ных образцов методами сканирующей электронной
Сульфуризация поливинилхлорида // ЖПХ.
микроскопии и ИК-спектроскопии.
2013. Т. 86. № 4. C. 655-658 [Shaglaeva N. S.,
Bayandin V. V., Sultangareev R. G., Prozorova G. F.,
Vakul’skaya T. I., Khutsishvili S. S. Sulfurization of
Информация об авторах
polyvinylchloride // Russ. J. Appl. Chem. 2013. V. 86.
Мухамедиев Мухтаржан Ганиевич, д.х.н., проф.,
N 4. P. 611-614.
[7]
Lazar L., Bandrabur B.,. Tataru-Fărmuş R.-E,
Бекчанов Давронбек Жумазарович, д.х.н., доцент,
Drobotă M., Bulgariu L., Gutt G. FTIR analysis of
ion exchange resins with application in permanent
Жураев Мурод Махмаражаб угли,
hard water softening // EEMJ. 2014. V. 13. N 9.
P. 2145-2152.
Петер Лиеберзейт, проф.,
[8]
Emelʹyanov A. S., Rodin A. V., Belova E. V.,
Гафурова Дилфуза Анваровна, д.х.н., доцент,
Vidanov V. L. Thermal stability of KU-2*8 sulfocation
exchanger in contact with nitric acid under isochoric
conditions // Prot. Met. Phys. Chem. Surf. 2019. V. 55.
N 12. P. 1044-1049.
Список литературы
[1] Zagorodni A. A. Ion exchange materials: properties and
[9]
Li C., Yu Y., Li Q., Zhong H., Wang S. Kinetics
applications. Amsterdam; London: Elsevier Sci., 2007.
and equilibrium studies of phosphate removal
P. 21-22.
from aqueous solution by calcium silicate hydrate
synthesized from electrolytic manganese residue //
[2] Bekchanov D., Mukhamediev M., Lieberzeit P.,
Ads. Sci. & Tech. 2019. V. 37. N 7-8. P. 547-565.
Babojonova G., Botirov S. Polyvinylсhloride-based
anion exchanger for efficient removal of chromium (VI)
[10]
Bundrabur B., Tataru-Farmus R.-E., Lazar L., Gutt G.
from aqueous solutions // Polym. Adv. Technol. 2021.
Application of a strong acid resin as ion exchanger
V. 32. N 10. Р. 3995-4004.
material for water softening — eqvilibrium and
thermodynamic analysis // SCSCC6. 2012. V. 13. N 4.
[3] Мухамедиев М. Г., Бекчанов Д. Ж. Новый анионит
на основе поливинилхлорида и его применение