174
Кузнецова С. А. и др.
Журнал прикладной химии. 2021. Т. 94. Вып. 2
УДК 541.45.459
СИНТЕЗ И ФОТОКАТАЛИТИЧЕСКИЕ СВОЙСТВА ОКСИДА ОЛОВА(II)
© С. А. Кузнецова1, Л. Н. Мишенина1, А. Г. Мальчик2
1 Национальный исследовательский Томский государственный университет,
534050, г. Томск, пр. Ленина, д. 36
2 Юргинский технологический институт Томского политехнического университета,
652055, Сибирский федеральный округ, Кемеровская обл., г. Юрга, ул. Ленинградская, д. 26
Поступила в Редакцию 20 сентября 2019 г.
После доработки 14 декабря 2020 г.
Принята к публикации 28 декабря 2020 г.
Изучено влияние природы осадителя гидроксоформы олова(II) на состав, структуру и морфологию
поверхности образцов на основе оксида олова(II), полученных методом осаждения в одинаковых
условиях с различными осадителями: NaOH, смесь NaOH с гексаметилентетрамином, раствор NH3.
Методом рентгенофазового анализа с уточнением структуры методом Ритвельда установлено,
что структура SnO чувствительна к составу осадителя. Добавка гексаметилентетрамина к NaOH
приводит к получению SnO с искаженной тетрагональной решеткой за счет уменьшения расстояния
между атомами Sn-Sn. Показано, что температура формирования SnO определяет форму частиц,
пористость, размер агломератов и ширину запрещенной зоны оксида. Выявлена возможность и ус-
ловия получения образцов SnO, проявляющих фотокаталитическую активность в модельной реакции
разложения метилового оранжевого. Установлено, что фотокаталитическую активность проявляют
образцы SnO без примесей SnO2 с удельной площадью поверхности 5.4, 5.9, 6.8 м2·г-1 и объемом пор
0.026, 0.034 и 0.025 см3·г-1 соответственно.
Ключевые слова: оксид олова(II); получение оксида олова(II); структура; морфология поверхности;
фотокаталитическая активность
DOI: 10.31857/S0044461821020055
Фотокаталитический метод является достаточно
того, скорость фотодеструкции органических загряз-
эффективным методом очистки воды от органических
нителей в присутствии данного оксида достаточно
загрязнителей [1]. В качестве фотокатализаторов в
высока [8]. Оксид олова(II), обладающий фотока-
основном предлагается использовать материалы на
талитическими свойствами, чаще всего получают
основе оксида цинка и оксида титана(IV). Ширина за-
методом осаждения: из растворов солей олова(II)
прещенной зоны, характеризующая область значений
катионы Sn2+ осаждают в виде гидроксида олова(II)
энергии с нулевой плотностью электронных состоя-
или оксогидроксида олова(II), которые впоследствии
ний вышеуказанных оксидов, находится в диапазоне
разлагаются до оксида. В качестве осадителей приме-
3-3.5 эВ [2, 3]. В последние годы ведутся исследо-
няют растворы аммиака, гидроксида натрия [9] или
вания по разработке фотокатализаторов с шириной
гидроксида калия [10]. Однако во всех этих работах
запрещенной зоны, не превышающей 3 эВ [4, 5], что
не уделяется внимание изучению влияния строения
позволило бы использовать их фотокаталитическую
и размера частиц SnO на пористость полученных
активность в видимой области спектра. Некоторые
образцов и их фотокаталитическую активность. Для
исследовательские группы указывают на то, что ок-
того чтобы оценить это влияние, необходимо прово-
сиды титана(IV) и цинка могут быть заменены на
дить исследования по получению оксида в одинако-
оксид олова(II), который имеет ширину запрещенной
вых условиях [состав исходного соединения олова(II),
зоны 2.5-3.6 эВ [6, 7] и поэтому может поглотить
концентрация, рН, температура, способ термической
больше видимого излучения солнечного света. Кроме
обработки].
Синтез и фотокаталитические свойства оксида олова(II)
175
Цель работы — установление влияния состава
с CuKα-излучением в интервале 2°-90° (2θ), c ша-
осадителя гидроксоформы олова(II) на состав, струк-
гом 0.02° и скоростью съемки 2 град·мин-1. Анализ
туру, морфологию поверхности и фотокаталитиче-
фазового состава образцов проводили с использо-
ские свойства образцов на основе оксида олова(II),
ванием базы данных PCPDFWIN, а также програм-
полученных методом осаждения из раствора хлорида
мы полнопрофильного анализа POWDER CELL 2.4.
олова(II).
Количественный анализ состава образцов (чтобы
исключить образование SnO2) выполняли с использо-
ванием RIR-метода. Размеры областей когерентного
Экспериментальная часть
рассеяния были определены по уравнению Шеррера.
Образцы оксида олова(II) были приготовлены из
Ошибка расчета областей когерентного рассеяния
растворов SnCl2 в присутствии различных осадите-
составляла ±5%. Уточнение структуры оксидов оло-
лей: NaOH (ч.д.а., ООО «ПраймКемикалсГрупп»),
ва(II) проведено методом Ритвельда с использовани-
25 мас%-ного раствора NH3 (ч.д.а., ЗАО «База
ем программы порошковой дифракции ReX [11-13],
№ 1 Химикаты») и смеси гексаметилентетрамина
модель кристаллической структуры строили с ис-
(С6Н12N4) (ос.ч., ООО «ПраймКемикалсГрупп») с
пользованием программы Веста [14]. Морфологию
NaOH. Раствор SnCl2 получали путем растворения 4 г
поверхности порошка SnO исследовали с помощью
Sn (ч.д.а., НПК «Специальная металлургия») в 75 мл
сканирующего растрового электронного микроскопа
концентрированного раствора HCl (ос.ч., ЗАО «База
Hitachi TM-3000 при ускоряющем напряжении 15 кВ
№ 1 Химикаты») (рН 2). В растворы SnCl2 добавля-
(электронная пушка: 5∙102 Па, камера для образца
ли вышеуказанные осадители до рН 11, в результа-
30-50 Па). Оценку параметров пористой структуры и
те наблюдалось образование суспензий. В случае
площади удельной поверхности образцов проводили
применения смеси гексаметилентетрамина с NaOH
с помощью автоматического газоадсорбционного
порядок внесения осадителей в кислый раствор
анализатора TriStar II. Измерение площади удель-
SnCl2 был следующим: для нейтрализации соляной
ной поверхности осуществляли методом Брунауэра-
кислоты в раствор вносили твердый NaOH до рН 7,
Эммета-Теллера (БЭТ). Усредненные объем и размер
добавляли гексаметилентетрамин и выдерживали в
пор были определены по модели BJH (Barett-Joyner-
течение 30 мин, после вносили твердый NaOH до
Halenda) из данных изотерм адсорбции и десорбции
рН 11. Полученные суспензии выдерживали в тече-
при относительном давлении p/p0 = 0.99. Точность
ние 30 мин при комнатной температуре или при тем-
метода составляла 5-10% при значениях относитель-
пературе 80°С до образования осадков черного или
ного давления 0.05-0.35.
черно-серого цвета. После чего осадки фильтровали,
Электронные спектры диффузного отражения
многократно промывали дистиллированной водой и
(ЭСДО) образцов регистрировали на спектрофото-
сушили в сушильном шкафу при температуре 90°С.
метре UV-2501 PC (Shimadzu) с приставкой диффуз-
Образцы SnO, полученные при комнатной температу-
ного отражения ISP-250 A относительно BaSO4 в
ре в присутствии осадителей NaOH, NaOH + гексаме-
диапазоне длин волн 190-900 нм (11 000-54 000 см-1).
тилентетрамин, а также раствора NH3, обозначены 1,
Конечные спектры ЭСДО представляли в координа-
2 и 3 соответственно. Образцы SnO, полученные при
тах функция Кубелки-Мунка-волновое число и опре-
температуре 80°С в присутствии тех же осадителей,
деляли ширину запрещенной зоны. Исследование фо-
обозначены как 1.t, 2.t и 3.t.
токаталитической активности полученных образцов
Для установления фазового состава продукта вза-
проводили на модельной реакции фотодеградации
имодействия Sn2+ c гексаметилентетрамином допол-
красителя метилового оранжевого по методике [15].
нительно был поставлен эксперимент, в котором в
После установления адсорбционно-десорбционного
кислый раствор SnCl2, так же как и при получении
равновесия смесь органического красителя с образ-
образцов 2 и 2.t, вносили твердый NaOH до рН 7
цом облучали I2-эксилампой (модель I2_BD_P, про-
(для нейтрализации соляной кислоты), затем добав-
изводитель ИСЭ СО РАН).
ляли гексаметилентетрамин и выдерживали в течение
Измерение оптической плотности образцов про-
2 сут (образец 0). Через 30 мин наблюдали слабую
водили каждые 10 мин в течение 1 ч, отбирая и
опалесценцию раствора и только через 2 сут получа-
центрифугируя аликвоты. Концентрацию метило-
ли суспензию белого цвета.
вого оранжевого определяли на спектрофотометре
Рентгенофазовый анализ высушенной суспен-
ПЭ-5400 УФ по интенсивности максимума поглоще-
зии этого образца и полученных порошков оксида
ния при λ = 461 нм. Для подтверждения того, что в
выполняли на дифрактометре Rigaku Miniflex 600
растворе метилового оранжевого без образцов SnO
176
Кузнецова С. А. и др.
не происходит фотолиз и деколоризация красителя,
ния Sn(II) при длительном выдерживании раствора.
был поставлен холостой опыт, в котором раствор ме-
Поэтому для полного осаждения Sn2+ в раствор с
тилового оранжевого выдерживали в тех же условиях
гексаметилентетрамином через 30 мин его выдер-
в отсутствие оксида.
живания, где уже присутствует Sn6O4(ОН)4, но нет
гидратированного SnO2, вносили дополнительно еще
NaOH до достижения рН 11. Процесс образования
Обсуждение результатов
SnO в присутствии NaOH + гексаметилентетрамин
В случае применения в качестве осадителя раство-
(образцы 2 и 2.t) может быть описан следующими
ра аммиака образование осадка черного цвета [оксид
реакциями:
олова(II)] наблюдалось только после выдерживания
С6Н12N4 + 6Н2О
6СН2О + 4NH3,
суспензии при температуре 80°С. При использовании
12NH3 + 8Н2О + 6SnCl2 = Sn6O4(ОН)4 + 12NH4Cl,
NaOH и NaOH + гексаметилентерамин в полученных
суспензиях при комнатной температуре практически
Sn6O4(ОН)4 = 6SnO + 2Н2О,
сразу наблюдалось образование осадка черного цвета.
NaOH + SnCl2 = Sn(OH)2 + 2NaCl,
Согласно литературным данным [9, 15], образование
Sn(OH)2 = SnO + Н2О.
SnO в присутствии таких осадителей, как NaOH (об-
разцы 1 и 1.t) и раствор аммиака (образцы 3 и 3.t),
Согласно результатам рентгенофазового анализа
происходит по следующим реакциям:
образцов 1, 1.t, 2 и 2.t и уточнения их структуры ме-
NaOH + SnCl2 = Sn(OH)2 + 2NaCl,
тодом Ритвельда (программа ReX Powder diffraction),
Sn(OH)2 = SnO + Н2О;
все вышеуказанные образцы представляют собой
однофазный оксид олова(II) тетрагональной сингонии
12NH3 + 8Н2О + 6SnCl2 = Sn6O4(ОН)4 + 12NH4Cl,
(пр. гр. P 4/n mm) (рис. 2).
Sn6O4(ОН)4 = 6SnO + 2Н2О.
Параметры кристаллических решеток образцов,
Состав твердой фазы суспензии, полученной из
полученных без нагревания, характеризуются близ-
раствора соли Sn2+ c гексаметилентетрамином (обра-
кими значениями (табл. 1).
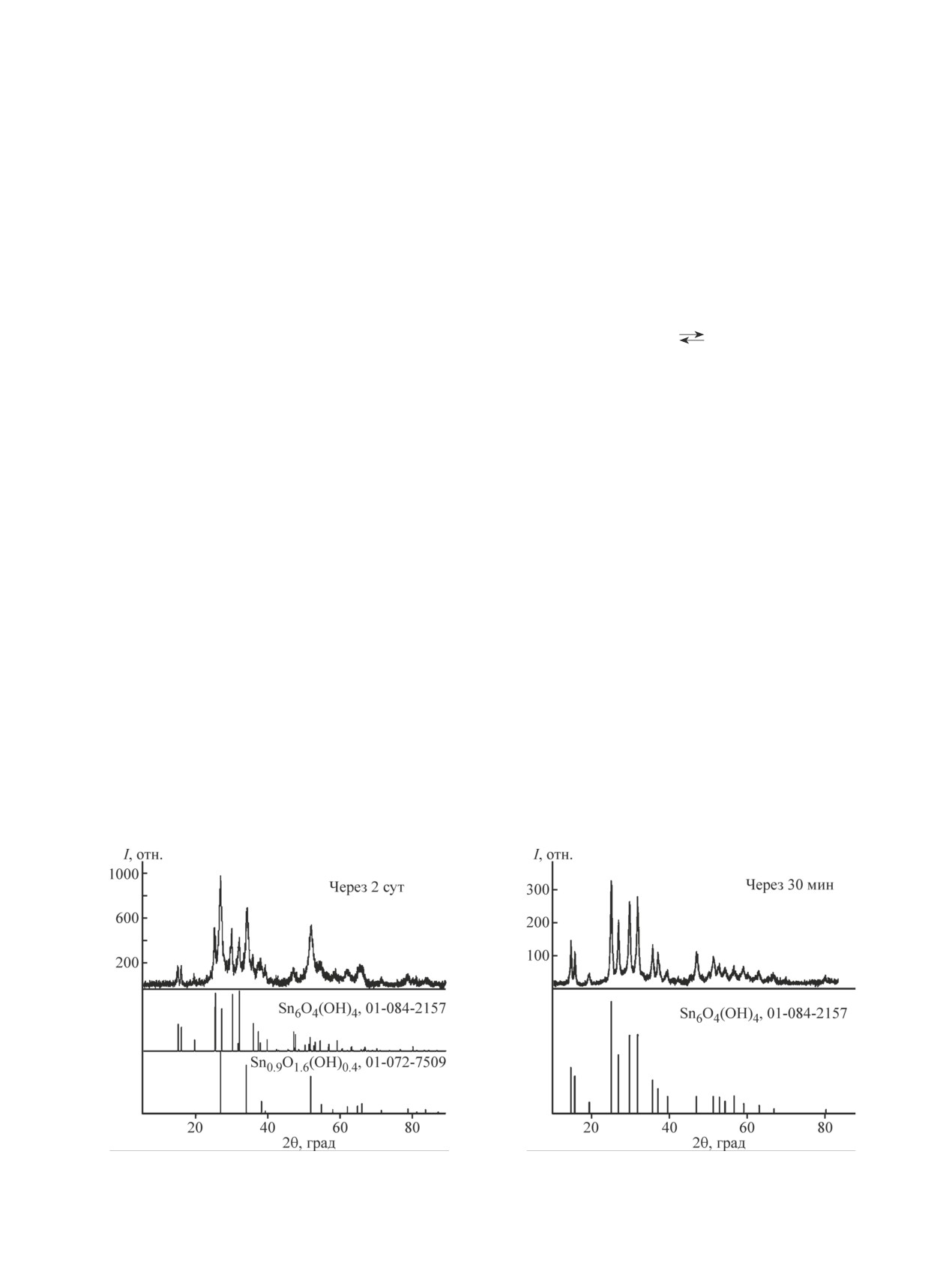
зец 0), представляет собой смесь Sn6O4(ОН)4 тетра-
Структура оксида олова(II) содержит квадрат-
гональной структуры и Sn0.9O1.6(ОН)0.4·(0.9SnO2 ×
но-бипирамидальные фрагменты [SnO4], образующие
× 0.2H2O) структуры рутила (рис. 1) в количествен-
слои, параллельные плоскости (002) (рис. 3).
ном соотношении 48 и 52 мас% соответственно.
В образцах 1 и 1.t расстояние Sn-Sn составляет
100%-ную фазу Sn6O4(ОН)4 можно получить только
3.69 Å, что согласуется с литературными данными
в незначительном количестве после выдерживания
3.70 Å и свидетельствует об образовании кристалла с
раствора в течение 30 мин (рис. 1).
хорошо сформированной структурой. Интенсивность
Таким образом, применение гексаметилентетра-
дифракционных максимумов при этом также соответ-
мина для получения SnO невозможно из-за окисле-
ствует данным базы PDF2 (00-006-0395). Образцы 2
Рис. 1. Рентгенограммы твердой фазы суспензии, полученной из раствора соли Sn2+ c гексаметилентетрамином.
Синтез и фотокаталитические свойства оксида олова(II)
177
Рис. 2. Рентгенограммы образцов SnO, полученных в присутствии разных осадителей и при разных температурах.
Образец: 1 — NaOH, tкомн; 2 — NaOH + гексаметилентетрамин, tкомн; 1.t — NaOH, 80°С; 2.t — NaOH + гексаметилен-
тетрамин, 80°С.
Таблица 1
Параметры кристаллических решеток образцов SnO, полученных в различных условиях
Область когерентного рассеяния, Å
а
с
Образец (условия получения — осадитель, температура)
hkl (101)
hkl (002)
Å
1 (NaOH, tкомн)
275
283
3.789
4.828
2 (NaOH с гексаметилентетрамином, tкомн)
357
390
3.792
4.826
1.t (NaOH, 80°С)
285
241
3.783
4.820
2.t (NaOH с гексаметилентетрамином, 80°С)
366
278
3.794
4.817
178
Кузнецова С. А. и др.
ОКР по направлению плоскости (101), изменяется
от 1.09 до 0.75 для образцов 2 и 2.t и для образцов
1 и 1.t от 1.02 до 0.84. Такое же изменение интен-
сивности дифракционных максимумов для оксида
олова(II) наблюдается в работе [16]. Исследуемые
образцы SnO имеют разную форму и размеры частиц
(рис. 4).
Агломераты образца 1 представляют собой спек-
шиеся, слоистые частицы разной формы и размеров.
В образце 2 в отличие от образца 1 присутствуют
квадратные пластинки размером 40 × 40 мкм и тол-
щиной до 100 нм. Такое различие в форме агломера-
тов можно связать с различным составом прекурсора
Рис. 3. Структура SnO.
получения оксида олова(II). В случае образца 1 это
Sn(OH)2, образца 2 — смесь Sn(OH)2 и Sn6O4(OH)4.
и 2.t формируются в результате наслаивания слоев,
Морфология образцов SnO, полученных с этими же
параллельных главной оси 4-го порядка, перпенди-
осадителями, но при температуре 80°С, отличается
кулярно плоскости спаянности, при этом расстоя-
от образцов 1 и 2 тем, что агломераты формируются
ние Sn-Sn уменьшается до 3.54 Å. В результате об-
более схожие по форме и близкие по размеру. Все
разуется искаженная структура, что проявляется в
образцы характеризуются низкими значениями удель-
изменении интенсивности дифракционных макси-
ной площади поверхности и средним размером пор
мумов на дифрактограммах для плоскостей (001) и
до 24.2 нм (табл. 2).
(002). Коэффициент анизотропии, рассчитанный как
Изотермы адсорбции-десорбции азота для этих
отношение ОКР по направлению плоскости (002) к образцов (рис. 5) близки к типу II по классификации,
Рис. 4. Микрофотографии образцов SnO, полученных в присутствии разных осадителей и при разных температурах.
Образец: 1 — NaOH, tкомн; 2 — NaOH + гексаметилентетрамин, tкомн; 1.t — NaOH, 80°С; 2.t — NaOH + гексаметиленте-
трамин, 80°С.
Синтез и фотокаталитические свойства оксида олова(II)
179
Таблица 2
Усредненные характеристики размеров внутренних полостей (каналов, пор) образцов SnO
Суммарный объем пор,
Средний размер пор,
Образец (условия получения — осадитель, температура)
Sуд, м2·г-1
см3·г-1
нм
1 (NaOH, tкомн)
5.9
0.034
24.2
2 (NaOH с гексаметилентетрамином, tкомн)
6.8
0.025
14.9
1.t (NaOH, 80°С)
2.9
0.016
22.0
2.t (NaOH с гексаметилентетрамином, 80°С)
5.4
0.026
19.5
предложенной в работе [17]. Петли сорбционного
В образцах, полученных без нагревания, присут-
гистерезиса приближаются к точкам относительно-
ствуют как микропоры, так и мезо- и макропоры.
го давления: образец 1 — р/р0 = 0.7, образец 1.t —
Повышение температуры синтеза приводит к тому,
р/р0 = 0.5, образец 2 — р/р0 = 0.5, образец 2.t —
что в частицах SnO остаются мезопоры, их объем
р/р0 = 0.6, что свидетельствует о преобладании ми-
уменьшается в случае применения осадителя NaOH
кропор разного размера [18].
и увеличивается, если применять смесь NaOH c гек-
Рис. 5. Изотермы (77 K) адсорбции-десорбции азота и распределение пор по размерам образцов SnO, полученных
в присутствии разных осадителей и при разных температурах.
Образец: 1 — NaOH, tкомн; 2 — NaOH + гексаметилентетрамин, tкомн; 1.t — NaOH, 80°С; 2.t — NaOH + гексаметиленте-
трамин, 80°С.
180
Кузнецова С. А. и др.
Рис. 6. Спектры диффузионного отражения образцов SnO, полученных в присутствии разных осадителей и при
разных температурах.
1 — NaOH, tкомн и NaOH + гексаметилентетрамин, tкомн; 2 — NaOH + гексаметилентетрамин, 80°С; 3 — NaOH, 80°С.
саметилентетрамином. Микропоры всех образцов
(рис. 7, а). Результаты качественного (рис. 7, б) и
имеют максимальный объем (рис. 5).
количественного рентгенофазового анализа свиде-
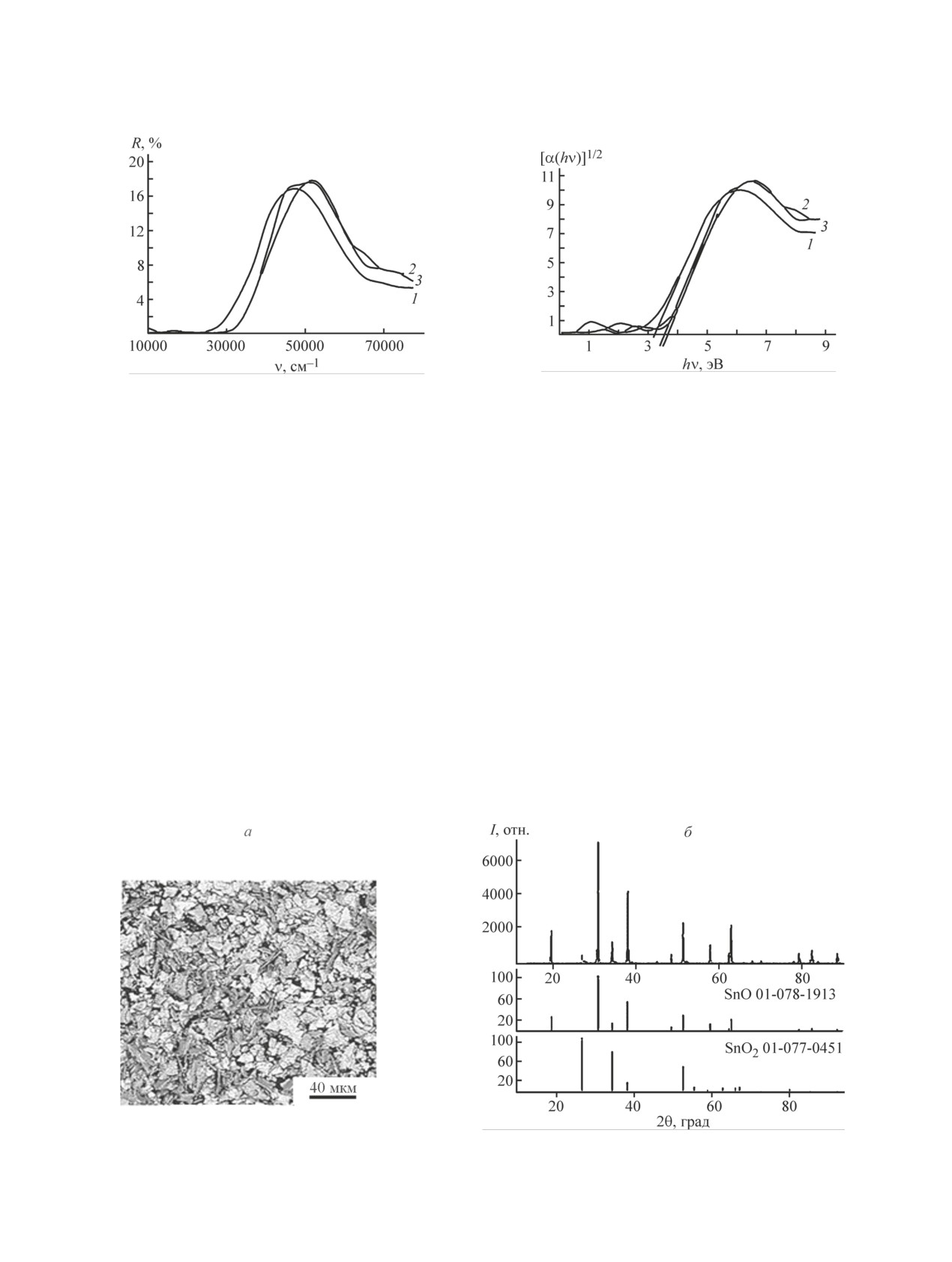
По спектрам диффузного отражения для иссле-
тельствуют о том, что данный образец представляет
дуемых образцов были рассчитаны значения оп-
собой смесь SnO и SnO2: SnO — 94.9 мас% и SnO2 —
тической ширины запрещенной зоны (рис. 6).
5.1 мас%.
Экспериментальные данные согласуются с лите-
Возможность образования примеси SnO2 объяс-
ратурными (2.5-3.6 эВ) [6, 7] и характеризуются
нена нами ранее в работе [19]. Основные характе-
близкими значениями для всех образцов: образец
ристики образца 3.t представлены в табл. 3. Данный
1 — ΔЕ = 3.2 эВ, образец 2 — ΔЕ = 3.2 эВ, образец
образец характеризуется площадью удельной поверх-
1.t — ΔЕ = 3.6 эВ, образец 2.t — ΔЕ = 3.5 эВ.
ности 20.9 м2·г-1, средним объемом пор 0.048 см3·г-1,
При использовании в качестве осадителя 25%-но-
средним размером пор 9.4 нм и шириной запрещен-
го раствора NH3 образование порошка на основе SnO
ной зоны 3.2 эВ.
происходит только при повышении температуры син-
Несмотря на бóльшую площадь удельной поверх-
теза до 80°С. Полученный в этих условиях образец
ности, размер и объем пор по сравнению с образцами
3.t представляет собой сросшиеся пластины слоистой
1.t, 2.t, образец 3.t не проявляет фотокаталитическую
структуры с различными сколами на поверхности
активность в модельной реакции разложения метило-
Рис. 7. Микрофотография (а) и рентгенограмма (б) образца 3.t, полученного при температуре 80°С с осадителем
NH3.
Синтез и фотокаталитические свойства оксида олова(II)
181
Таблица 3
Параметры кристаллических решеток SnO и SnO2
Область когерентного рассеяния, Å
а
с
Фаза
hkl (101)
hkl (002)
Å
SnO
490.5
539.1
3.791
4.808
SnO2
—
—
4.759
3.238
Рис. 8. Фотокаталитическая деградация под воздействием УФ-излучения (λ = 342 нм) водных растворов метилового
оранжевого и метилового оранжевого в присутствии образцов SnO, полученных в присутствии разных осадителей
и при разных температурах.
Образец: 1 — NaOH, tкомн; 2 — NaOH + гексаметилентетрамин, tкомн; 1.t — NaOH, 80°С; 2.t — NaOH + гексамети-
лентетрамин, 80°С.
Таблица 4
Характеристики сорбции и фотодеструкции метилового оранжевого в присутствии образцов SnO
Образец
Степень превращения
kν фотодеградации,
Сорбция, мас%
(условия получения — осадитель, температура)
(λ = 342 нм), мас%
мин-1
1 (NaOH, tкомн)
69.1
87.6
0.044
1.t (NaOH, 80°С)
45.2
92.2
0.045
2 (NaOH с гексаметилентетрамином, tкомн)
1.5
3.3
—
2.t (NaOH с гексаметилентетрамином, 80°С)
47.6
92.7
0.048
вого оранжевого (рис. 8, а). Органический краситель
центров Льюиса на поверхности оксида олова(II)
в отсутствие оксида под воздействием УФ-лампы с
[20], на которых и происходит сорбция органического
λ = 342 нм не изменяет своей концентрации.
красителя. Фотодеградация метилового оранжевого
Образец 2, представляющий собой 100%-ную фазу
соответствует первому порядку реакции (рис. 8, б).
SnO, также не фотоактивен. Он же характеризуется
Константы скорости фотодеструкции метилового
самой низкой площадью удельной поверхности и
оранжевого в присутствии образцов, проявляющих
самым малым объемом пор. После часовой темновой
фотокаталитические свойства, сравнимы и не зависят
выдержки метилового оранжевого с этим образцом
от количества сорбируемого красителя.
сорбция органического красителя составляет не более
1.5 мас% (табл. 4).
Выводы
Остальные образцы 1.t, 2.t, 1 сорбируют метило-
вый оранжевый от 45.2 до 69.1 мас%. Достаточно
Состав осадителя и температурная обработ-
высокие значения темновой сорбции на этих образ-
ка гидроксоформ олова(II) оказывают влияние на
цах объясняются большим количеством кислотных
тип и размер пор образцов SnO, характеризующих-
182
Кузнецова С. А. и др.
ся площадью удельной поверхности 2.9-6.8 м2·г-1.
Список литературы
Кристаллический SnO c хорошо сформированной
[1]
Ajiboye Т. О., Oyewo О. А., Damian C.,
структурой и большим объемом пор получается
Onwudiwe D. C. Simultaneous removal of organics
методом осаждения в присутствии NaOH. Добавка
and heavy metals from industrial wastewater: A review
гексаметилентетрамина к NaOH приводит к форми-
// Chemosphere. 2021. V. 262. P. 128379.
рованию кристаллического SnO с искаженной решет-
кой и самым низким значением удельной площади
[2]
Chang X. T., Li Z. L., Zhai X. X., Sun S. B., Gu D. X.,
поверхности. Повышение температуры синтеза об-
Dong L. H., Yin Y. S., Zhu Y. Q. Efficient synthesis
разцов SnO до 80°С позволяет повысить однород-
of sunlight-driven ZnO-based heterogeneous
photocatalysts // Mater. & Design. 2016. V. 98.
ность пор по размерам и их объем, что сказывается
P. 324-332.
на их сорбции и фотокаталитической активности.
Показано, что применение в качестве осадителя рас-
[3]
Wang K., Liu B., Li J., Liu X., Zhou Y., Zhang X.,
твора аммиака приводит к получению SnO c при-
Bi X., Jiang X. In-situ synthesis of TiO2 nanostructures
месью SnO2.
on Ti foil for enhanced and stable photocatalytic
Форма и размер агломерата исследуемых образ-
performance // J. Mater. Sci. Techn. 2019. V. 35. N 4.
цов не оказывают влияния на фотокаталитические
свойства SnO. Фотокаталитические свойства SnO
[4]
Пячин С. А., Карпович Н. Ф., Зайцев А. В., Бур
определяются прежде всего объемом пор. В реакции
ков А. А., Каминский О. И., Ермаков М. А. Гидротер-
деградации метилового оранжевого в УФ-области
мальный синтез и фотокаталитическая активность
(342 нм) участвуют образцы SnO, характеризую-
анатаза, допированного оксидом вольфрама //
щиеся объемом пор более 0.016 нм. Максимальная
Фундаментал. исслед. 2017. № 10-2. С. 261-266.
степень превращения метилового оранжевого (92-
[5]
Moongraksathum B., Chen Yu-W. CeO2-TiO2
mixed oxide thin films with enhanced photocatalytic
93 мас%) наблюдается на образцах SnO, имеющих
degradation of organic pollutants // J. Sol-Gel Sci.
в своей структуре микро- и мезопоры со средним
Technol. 2017. V. 82. Р. 772-782.
объемом 0.025-0.026 см3·г-1. Константа скорости
фоторазложения органического красителя составля-
[6]
Ogo Y., Hiramatsu H., Nomura K., Yanagi H.,
ет 0.045-0.048 мин-1. Следует отметить, что данные
Kamiya T., Hirano M., Hosono H. p-channel thin-film
образцы SnO не уступают фотокатализаторам такого
transistor using p-type oxide semiconductor, SnO //
же состава, полученным более сложным методом [8].
Appl. Phys. Lett. 2008. V. 93. P. 032113.
Образцы SnO с примесью SnO2 фотокаталитические
свойства не проявляют.
[7]
Iqbal M. Z., Wang F., Rafi Ud., Javed Q., Rafique M. Y.,
Li Y., Li P. Preparation, characterization and optical
properties of tin monoxide micro-nano structure via
Финансирование работы
hydrothermal synthesis // Mater. Lett. 2012. V. 68.
P. 409-412.
Работа выполнена в рамках государственного за-
дания Министерства науки и высшего образования
[8]
Cui Y., Wang F., Zubair Iqbal M., Wang Z., Li Y., Tu J.
Российской Федерации, проект № 0721-2020-0037.
Synthesis of novel 3D SnO flower-like hierarchical
architectures self-assembled by nano-leaves and
its photocatalysis // Mater. Res. Bull. 2015. V. 70.
Конфликт интересов
P. 784-788.
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
[9]
Pires F. I., Wang F., Feng T., Zhao H., Rafique M. Y.,
Kafi ud Din, Farooq M. H., Quarat u lain Javed,
Khan D. F. Microwave-assisted hydrothermal
Информация об авторах
synthesis of nanocristalline SnO powders // Mater.
Lett. 2008. V. 62. P. 239-242.
Кузнецова Светлана Анатольевна, к.х.н., доцент,
[10]
Zubair Iqbal M., Wang F., Quarat u lain Javed, Yasir
Мишенина Людмила Николаевна, к.х.н., доцент,
Rafique M., Qiu H., Ghulam Nabi. Synthesis of novel
nano-flowers assembled with nano-petals array of
Мальчик Александра Геннадьевна, к.х.н., доцент,
stannous oxide /// Mater. Lett. 2012. V. 75. P. 236-239.
Синтез и фотокаталитические свойства оксида олова(II)
183
[11]
Bortolotti M., Lonardelli I. ReX. Cell: A user-friendly
[17]
Карнаухов А. П. Адсорбция. Текстура дисперсных
program for powder diffraction indexing // J. Appl.
и пористых материалов. Новосибирск: Наука, 1999.
Cryst. 2013. V. 46. P. 259-261.
C. 77.
[18]
Емельченко Г. А., Масалов В. М., Жохов А. А.,
[12]
Boultif A., Louër D. Powder pattern indexing with
Ходос И. И. Микро- и мезопористые углеродные
the dichotomy method // J. Appl. Cryst. 2004. V. 37.
наноструктуры с решеткой инвертированного опа-
P. 724-731.
ла // Физика твердого тела. 2013. T. 55. Вып. 5.
С. 1021-1026 [Emelʹchenko G. A., Masalov V. M.,
[13]
Visser J. W. A fully automatic program for finding the
Zhokhov A. A., Khodos I. I. Microporous and
unit cell from powder data // J. Appl. Cryst. 1969. V. 2.
mesoporous carbon nanostructures with the inverse
opal lattice // Phys. Solid State. 2013. V. 55. N 5.
[14]
Momma K., Izumi F. VESTA 3 for three-dimensional
P. 1105-1110.
visualization of crystal, volumetric and morphology
data // J. Appl. Cryst. 2011. V. 44. P. 1272-1276.
[19]
Кузнецова С. А., Лисица К. В., Мальчик А. Г.,
Козик В. В. Растворимость кислорода в суспен-
[15]
Кузнецова С. А., Пичугина А. А., Козик В. В.
зии оксогидроксида олова (II), предшественника
Гидротермально-микроволновый способ полу-
синтеза оксидов олова (II), (IV) // Вестн. МГТУ
чения SnO из аммиачной суспензии Sn6O4(OH)4
им. Н. Э. Баумана. Сер. Естеств. науки. 2018. № 5.
// Неорган. материалы. 2015. Т. 51. № 5. С. 490-
С. 112-124.
495 [Kuznetsova S. A., Pichugina A. A., Kozik V. V.
Microwave assisted hydrothermal process for the
[20]
Скворцова Л. Н., Чухломина Л. Н., Минакова Т. С.,
preparation of SnO from an ammoniacal Sn6O4(OH)4
Шерстобоева М. В. Исследование кислотно-основ-
suspension // Inorg. Mater. 2015. V. 51. N 5. Р. 436-
ных и сорбционных свойств поверхности металло-
керамических композитов // ЖПХ. 2017. Т. 90. № 8.
[16]
Wang Sheng-Ch., Chiang Ray-K., Hu Pin-J.
С. 1014-1019 [Skvortsova L. N., Chukhlomina L. N.,
Morphological and phase control of tin oxide
Minakova T. S., Sherstoboeva M. V. Investigation of
single-crystals synthesized by dissolution and
acid-base and sorption properties of surface of metal-
recrystallization of bulk SnO powders // J. Ceram.
ceramic composites // Russ. J. Appl. Chem. 2017.
Soc. 2011. V. 31. P. 2447-2451.
V. 90. N 8. Р. 1246-1251.