Производные гидразида неопентановой кислоты как реагенты для флотационного извлечения цветных металлов
461
Журнал прикладной химии. 2021. Т. 94. Вып. 4
УДК 543.632.9; 547.386
ПРОИЗВОДНЫЕ ГИДРАЗИДА НЕОПЕНТАНОВОЙ КИСЛОТЫ
КАК РЕАГЕНТЫ ДЛЯ ФЛОТАЦИОННОГО ИЗВЛЕЧЕНИЯ
ЦВЕТНЫХ МЕТАЛЛОВ
© Л. Г. Чеканова1, Ю. Б. Ельчищева2, А. В. Харитонова1, П. Т. Павлов2,
С. А. Заболотных1, Г. В. Чернова1
1 Институт технической химии УрО РАН (филиал ПФИЦ УрО РАН),
614013, г. Пермь, ул. Академика Королева, д. 3
2 Пермский государственный национальный исследовательский университет,
614990, г. Пермь, ул. Букирева, д. 15
Е-mail: larchek.07@mail.ru
Поступила в Редакцию 8 октября 2020 г.
После доработки 23 декабря 2020 г.
Принята к публикации 8 февраля 2021 г.
Изучены пять производных гидразида неопентановой кислоты и охарактеризованы их физико-хими-
ческие свойства (растворимость, протолитические равновесия, гидролитическая устойчивость),
определяющие возможность применения реагентов во флотационных процессах концентрирования
цветных металлов. Установлен состав комплексных соединений реагентов с Cu(II), Ni(II) и Co(II) в
растворах, рассчитаны их конcтанты нестойкоcти, а также произведения растворимости препа-
ративно выделенных и идентифицированных комплексов. Показана принципиальная возможность
использования реагентов в качестве собирателей на примере флотации сульфидных медно-никелевых
и медных руд.
Ключевые слова: производные гидразидов; неопентановая кислота; цветные металлы; флотация
DOI: 10.31857/S0044461821040058
К перспективным реагентам для процессов кон-
Варьирование углеводородных радикалов в
центрирования и разделения цветных металлов мож-
структуре гидразидов позволяет регулировать рас-
но отнести гидразиды и их производные, которые
творимость реагентов в различных растворителях,
являются типичными хелатообразующими лиганда-
гидролитическую стабильность, области значений
ми благодаря наличию в их структуре гидразидной
рН образования комплексов. Введение радикалов
группы [—C(O)NHN(R)2] [1, 2]. Ее модификация
высших (С15-С19) α-разветвленных третичных карбо-
позволяет изменять свойства соединений (киcлот-
новых кислот значительно улучшает экстракционные
но-основные, дентатность и др.), что создает возмож-
характеристики реагентов [8]. Следует ожидать, что
ность их применения для различных практических
введение низкомолекулярных разветвленных ради-
задач [3, 4]. Например, гидразиды и 1,2-диацилгидра-
калов может придать производным гидразидов ряд
зины н-алифатических карбоновых кислот предложе-
свойств, необходимых для использования их во фло-
ны для флотационного обогащения калийных руд и
тационных процессах: повысить растворимость и
сульфидных руд цветных металлов [3, 5, 6]; другие
гидролитическую устойчивость в водных растворах.
классы производных гидразина — β-N-оксиэтилги-
Цель работы — исследование производных гидра-
дразиды и ацилсульфонилгидразины — как эффек-
зида неопентановой кислоты для оценки возможно-
тивные собиратели для ионной флотации тяжелых
сти их применения в качестве потенциальных флота-
металлов [7].
ционных реагентов.
462
Чеканова Л. Г. и др.
Экспериментальная часть
λ(IV) = 235 нм, λ(V) = 237 нм). Показатель преломления
определяли на рефрактометре RE40D (Mettler Toledo).
Объектами исследования выбраны гидразид нео-
Для определения констант ионизации и устойчи-
пентановой кислоты (I) и его производные: диацил-
вости реагентов к гидролизу использовали спектро-
гидразины (II, III) и ацилсульфонилгидразины (IV, V)
фотометрический метод.**** Условия определения
общей формулы
констант ионизации: l = 1 cм; c(I) = 2.0·10-4 моль·л-1,
λ = 197 нм (рKа), 220 нм (Kа1); c(II) = 4.0·10-5 моль·л-1,
(CH3)3C—C—NH—NHR,
λ = 240 нм; c(III) = 4.0·10-5 моль·л-1, λ = 280 нм;
O
c(IV) = 4.0·10-5 моль·л-1, λ = 217 нм; c(V) =
= 8.0·10-5 моль·л-1, λ = 208 нм. Условия опреде-
где R = H (I) — гидразид неопентановой кислоты;
ления гидролитической устойчивости: l = 1 cм;
R = C(O)(СН3)3 (II) — 1,2-динеопентаноилгидразин;
c(I) = 2.0·10-3 моль·л-1, λ = 215 нм (KOH), 208 нм
R = C(O)C6H4CH3 (III) — 1-неопентаноил-2-бензо-
(HCl); c(II) = 6.5·10-5 моль·л-1, λ = 245 нм; c(III) =
илгидразин; R = SO2C6H4CH3 (IV) — 1-неопента-
= 6.0·10-5 моль·л-1, λ = 230 нм; c(IV) = 6.0·10-5 моль·л-1,
ноил-2-(п-толуолсульфонил)гидразин; R = SO2CH3
λ = 233 нм; c(V) = 8.0·10-5 моль·л-1, λ = 236 нм. Выбор
(V) — 1-неопентаноил-2-метансульфонилгидразин.
длины волны, при которой изучали гидролитиче-
Соединение (I) получали гидразинолизом этило-
скую устойчивость соединений, был обоснован от-
вого эфира неопентановой кислоты; (II), (III) - вза-
сутствием при этой длине волны поглощения либо
имодействием в пиридине эквимолярных количеств
минимальным поглощением возможных продуктов
гидразида неопентановой кислоты и хлорангидридов
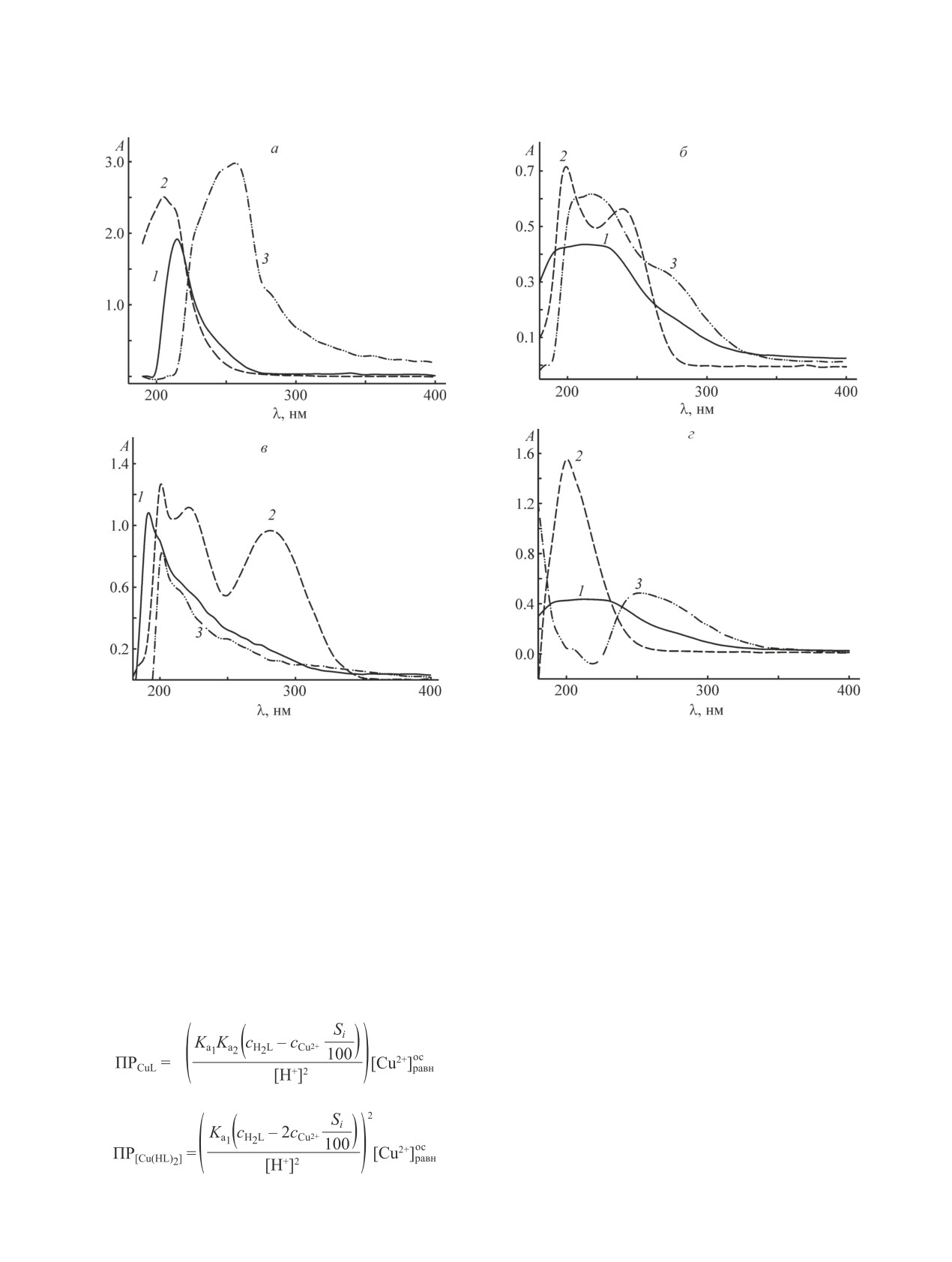
гидролиза [рис. 1, пример для (II)].
соответствующих кислот;* (IV) и (V) — реакцией
Измерения значений рН растворов проводили на
неопентаноилхлорида с тозил- и мезилгидразином
рН-метре АНИОН 4100 (НПП «Инфраспак-Аналит»)
соответственно [9]. Индивидуальность и чистота ре-
с комбинированным электродом ЭСК10603/7.
агентов подтверждена данными ИК- и ЯМР 1Н спек-
Процессы комплексообразования реагентов с ио-
троскопии, хроматомасс-спектрометрии и элемент-
нами цветных металлов исследовали спектрофотоме-
ного анализа. ИК-спектры в диапазоне 400-4000 см-1
трическим методом [10]. Для создания необходимых
регистрировали на Фурье-спектрометре Vertex 80V
значений рН рабочих растворов и для предотвраще-
(Bruker) (суспензия в вазелиновом масле; число ска-
нирований 64, разрешающая способность 2 см-1);
спектры ЯМР1H — на спектрометре Bruker Avance
Neo [400 МГц; в CDCl3, внутренний стандарт —
гексаметилдисилазан (0.055 м. д.)], УФ-спектры —
на спектрофотометре СФ-2000 (ОКБ-Спектр);
масс-спектры — на хроматографе Agilent Technologies
6890N/5975B (колонка HP-5ms, 30 м × 0.25 мм,
0.25 мкм, газ-носитель — гелий, электронная иони-
зация, 70 эВ; диапазон сканирования 35-435 а. е. м.).
Элементный анализ проводили на анализаторе Vario
EL cube CHNS (Elementar).
Растворимость реагентов в этиловом спирте изу-
чали рефрактометрическим,** в воде — гравиметри-
ческим, в 0.1 моль·л-1 растворе KОН — спектрофо-
тометрическим методом*** (условия определения:
l = 1 cм; λ(I) = 215 нм, λ(II) = 245 нм, λ(III) = 230 нм,
Рис. 1. Спектры поглощения растворов 1,2-динео-
* Общая органическая химия. Т. 3. Азотсодержащие
соединения / Под ред. Д. Бартона и У. Д. Оллиса. Пер. с
пентаноилгидразина (1), неопентановой кислоты
англ. М.: Химия, 1983. С. 268-275.
(2), гидразин-гидрата (3), гидразида неопентановой
** Пилипенко А., Пятницкий И. Аналитическая химия.
кислоты (4) в 0.1 моль·л-1 растворе KОН; cреагентов =
Кн. 2. М.: Химия, 1990. С. 798.
= 4·10-5 моль·л-1.
*** Бернштейн И. Я., Каминский Ю. Л. Спектрофото-
метрический анализ в органической химии. Л.: Химия,
1975. C. 18-19; 144-161.
**** Там же.
Производные гидразида неопентановой кислоты как реагенты для флотационного извлечения цветных металлов
463
ния выпадения труднорастворимых гидроксоком-
за депонированы в Кембриджском банке структурных
плексов металлов (в случае применения щелочей)
данных (CCDC 2036694).
в качестве регулятора рН использовали растворы
Флотоактивность реагента (I) изучали при
аммиака.
обогащении сульфидной медно-никелевой руды
Содержание металлов в растворе определяли на
Печенгского промышленного района (Мурманская
атомно-эмиссионном спектрометре с индуктивно
обл.) с содержанием (мас%): Ni — 0.548, Cu — 0.184,
связанной плазмой ICAP 6500 DUO (Thermo Fisher
Co — 0.025. Пробу руды массой 240 г, характеризую-
Scientific). Изучение состава комплексов методом
щуюся размером частиц 3 мм, смешивали с Na2CO3
насыщения выполняли экстракционно-фотометри-
(взятым из расчета 3 кг·т-1) и измельчали в шаровой
ческим (органическая фаза — толуол) и кондуктоме-
мельнице до заданного размера частиц: (-0.063) мм
трическим способами [кондуктометр SEVEN MULTI
не менее 80%. Флотацию проводили в лабораторной
S70-K (Mettler Toledo)] [11].
флотомашине 237ФЛ (НПК «Механобр-Техника») по
Константы устойчивости комплексов по методу
коллективной схеме, включающей основную (10 мин)
Бабко определяли по следующей методике: в мерные
и контрольную (15 мин) флотации. При выполнении
колбы емкостью 25.0 мл приливали 10.0 мл амми-
флотационных опытов c реагентами (IV) и (V) с суль-
ачного буферного раствора для создания рН 10-11,
фидной медной рудой Томинского месторождения
водные растворы солей металлов и реагентов в соот-
(Челябинская обл.) с содержанием Cu 0.32 мас% на-
ношениях [M(II)]:[реагент] = 1:1 или 1:2, объем до-
веска руды составляла 175.0 г [фракция с размером
водили до метки дистиллированной водой. Растворы
частиц (-0.071) мм не менее 85%], время основной и
перемешивали и измеряли оптическую плотность
контрольной флотации — 2 мин. Собиратели вводили
при длинах волн, соответствующих максимальному
в пульпу в виде 1%-ных водных растворов или рас-
поглощению комплекса (ℓ = 1 см). Затем растворы
творов в 0.1 моль·л-1 KОН. Полученные после прове-
комплексов последовательно разбавляли в 2 и 5 раз,
дения экспериментов продукты сушили, взвешивали
измеряя оптическую плотность после каждого раз-
и истирали. Разложение проб для проведения анализа
бавления. Условную константу устойчивости ком-
проводили их растворением в смеси HCl:HNO3 (3:1)
плексов (βMRn) рассчитывали по формуле
с использованием микроволнового нагрева в системе
MARS 6 (CEM Corporation). Содержание цветных ме-
таллов в растворе определяли на атомно-абсорбцион-
ном спектрометре iСЕ 3500 (Thermo Fisher Scientific).
По данным химического анализа продуктов флотации
,
осуществляли расчет технологических показателей
обогащения руды, которые сравнивали с показате-
лями обогащения, полученными в экспериментах с
где q — разбавление; Δ — отклонение от основного
использованием в качестве собирателя бутилового
закона светопоглошения:
, А и Аq — опти-
ксантогената калия (АО «Волжский Оргсинтез») (ба-
зовый опыт).
ческие плотности исходного и разбавленного рас-
В работе использовали реактивы: гидразин-гид-
творов; cМ — концентрация ионов металлов после
рат (содержание гидразина 64.16%, АО «Вектон»),
разбавления раствора; n — количество координи-
неопентановую кислоту (99%, Acros Organics BVBA),
рованных лигандов, найденных методом молярных
метансульфохлорид (99.5%, Acros Organics BVBA),
отношений.
п-толуолсульфохлорид (99%, Acros Organics BVBA),
Константы нестойкости комплексов рассчитывали
этанол (95%, ООО «Константа — Фарм М»), толу-
по формуле
ол (х.ч., 99.6%, АО «Экос-1»), бутиловый ксанто-
K = 1/βMRn.
генат калия (96%, АО «Волжский Оргсинтез»), бу-
тиловый ксантогенат калия (58.5%, ООО «НАКС
Монокристаллический образец комплекса Cu(II)
Технолоджи-Ск»), дибутилдитиофосфат натрия (бу-
с реагентом (IV) получали из Cu(CH3COO)2·H2O.
тиловый аэрофлот) (ТУ 2452-00151848149-00З, АО
Рентгеноструктурные исследования проводили на мо-
«Квадрат Плюс»), HCl (х.ч., 35%, АО «Башкирская
нокристальном дифрактометре Xcalibur Ruby с ССD-
содовая компания»), HNO3 (х.ч., 65%, ООО «РМ
детектором (Agilent Technologies) по стандартной
Инжиниринг»), NH3 (водный) (ч.д.а., 25%, ООО
методике [MoKα-излучение, 295(2) K, ω-сканирование
«Сигма Тек»), Na2CO3 (х.ч., 99.8%, АО «Вектон»),
c шагом 1°]. Результаты рентгеноструктурного анали-
CuSO4·5Н2О (ч., 98.5%, ООО «Уралхимлаб»).
464
Чеканова Л. Г. и др.
Обсуждение результатов
диссоциации (Kа) сопряженной кислоты (H2L+), кис-
лотность — константой диссоциации (Kа1) нейтраль-
Соединения (I)-(V) — белые кристаллические
ных молекул (HL) (2) [3, с. 23, 94]. Определенные
вещества. В литературе описаны свойства соединения
спектрофотометрическим методом значения констант
(I), представляющего интерес в качестве исходно-
диссоциации реагентов приведены в табл. 1.
го и промежуточного продуктов в синтезе биологи-
чески активных веществ [12]. Соединения (II)-(V)
Kа1
Kа2
охарактеризованы спектральными методами и кон-
H2L
HL-
L2-,
(1)
стантами ионизации, рассчитанными с использова-
Kа
Kа1
нием программного обеспечения Advanced Chemistry
H2L+
HL
L-.
(2)
Development (ACD/Labs) Software V11.02.
Установлено, что все реагенты хорошо раство-
Гидролитическая устойчивость является важной
римы в этаноле и водных щелочных растворах, со-
характеристикой промышленного реагента, посколь-
единение (I) — также в водных растворах кислот.
ку определяет не только его расход, но и вторичную
По сравнению с гомологами нормального строения
токсичность, обусловленную продуктами гидроли-
растворимость (I)-(III) в водных растворах кислот
за. Устойчивость исследуемых соединений изуча-
и щелочей значительно выше (табл. 1). Например,
ли в щелочных средах, так как, исходя из значений
растворимость производных пентановой кислоты:
констант диссоциации, можно предположить, что
гидразида в 0.1 моль·л-1 HCl — 144.5 г·л-1 (найдено
процессы комплексообразования с ионами метал-
экстраполяцией данных) [3, с. 22]; 1,2-диацилгидра-
лов будут преимущественно протекать в щелочных
зина в 0.1 моль·л-1 KОН — 14.0 г·л-1 [3, c. 93]. Для
растворах [для (I) — также и в кислых средах]. По
соединений (IV), (V) растворимость в исследуемых
уменьшению концентраций реагентов в 0.1 моль·л-1
растворителях сопоставима с растворимостью гомо-
растворе KОН, определенных спектрофотометри-
логов нормального строения.
ческим методом, рассчитали степень гидролиза при
Реагенты (II)-(V) (H2L) — двухосновные кис-
различной продолжительности термостатирования
лоты (1). Процесс диссоциации соединений (IV),
(табл. 2). Установлено, что все реагенты устойчивы
(V) по I cтупени связан с отрывом протона NHSO2-
к щелочному гидролизу при температуре 22°С; сое-
фрагмента за счет большего акцепторного действия
динение (I) менее подвергается гидролизу в кислых
сульфонильной группы по сравнению с карбонильной
средах, чем в щелочных (табл. 2).
[13]. Реагент (I) (HL) — амфотерное соединение,
При подборе реагентов-собирателей для флотации
основность которого характеризуется константой
металлсодержащих полезных ископаемых руковод-
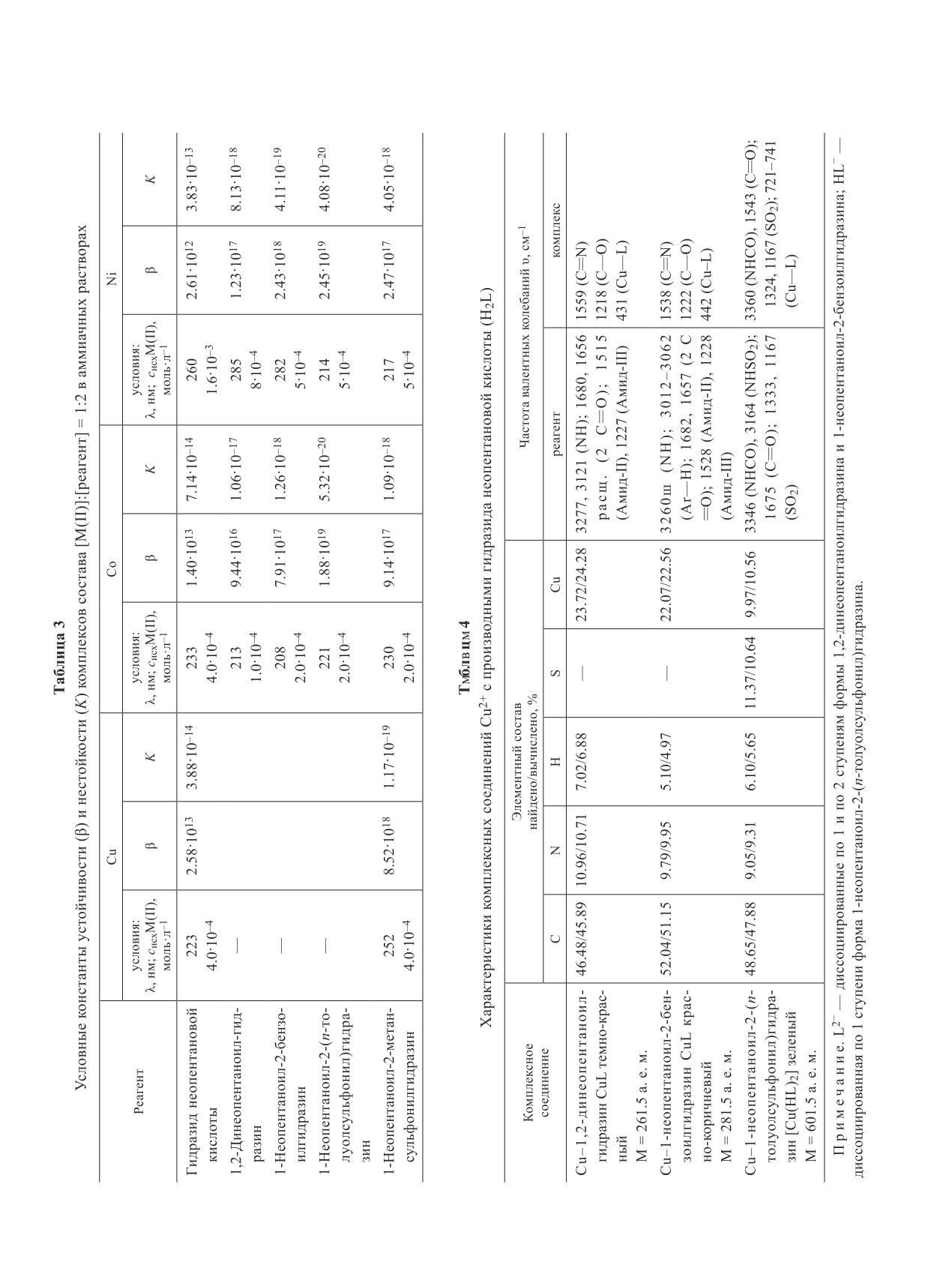
Таблица 1
Физико-химические характеристики производных гидразида неопентановой кислоты
Значения констант
Растворимость, г·л-1, при 20°С
диссоциации
n = 5, Р = 0.95
Реагент
Tпл, °С
0.1 моль·л-1
0.1 моль·л-1
вода
этанол
рKа1
рKа2
KOH
НСl
Гидразид неопентановой кис-
55-57
291
152.7
234
267.5
14.13 ± 0.11
—
лоты
1,2-Динеопентаноилгидразин
233-235
8.7
162.4
21.3
—
11.33 ± 0.02
12.83 ± 0.25
1-Неопентаноил-2-бензоил-
188-190
2.0
104.9
16.3
—
10.25 ± 0.12
11.75 ± 0.15
гидразин
1-Неопентаноил-2-(п-толуол-
155-157
0.6
58.9
11.9
—
8.31 ± 0.05
13.34 ± 0.10
сульфонил)гидразин
1-Неопентаноил-2- метансуль-
185-188
—
17.9
16.0
3.8
8.78 ± 0.03
12.97 ± 0.25
фонилгидразин
Примечание. рKа гидразида неопентановой кислоты 3.23 ± 0.11.
Производные гидразида неопентановой кислоты как реагенты для флотационного извлечения цветных металлов
465
Таблица 2
Степень гидролиза производных гидразида неопентановой кислоты в 0.1 моль·л-1 KOH при T = 22 ± 1°С
Степень гидролиза, %, при продолжительности реакции, мин
Реагент
30
60
120
180
Гидразид неопентановой кислоты:
0.1 моль·л-1 KОН
1.9
2.2
4.1
5.4
0.1 моль·л-1 НСl
—
1.4
2.5
3.0
1,2-Динеопентаноилгидразин
5.0
7.4
8.4
8.8
1-Неопентаноил-2-бензоилгидразин
—
—
—
2.5
1-Неопентаноил-2-(п-толуолсульфонил)гидразин
1.8
2.3
4.1
5.2
1-Неопентаноил-2-метансульфонилгидразин
2.8
4.1
6.5
7.1
ствуются характеристиками сродства органических
воспроизводимые результаты для cостава (1:1) дан-
соединений к определенным металлам и проводят
ным методом не удалось. Низкие значения констант
аналогию между взаимодействием реагентов с ка-
подтверждают образование в растворах устойчивых
тионами в растворе и соединениями этих металлов
комплексных соединений, а сопоставление констант
на поверхности минералов [11]. Поэтому с целью
нестойкости с аналогичными константами аммиач-
оценки возможности протекания реакций комплексо-
ных комплексов металлов*** свидетельствует
образования с цветными металлами, находящимися в
о приоритетности протекания реакций комплексо-
поверхностном слое минералов, были изучены соот-
образования цветных металлов с исследуемыми ре-
ветствующие процессы в растворах.
агентами.
Спектры поглощения смесей аммиачных комплек-
Комплексообразование реагентов (II)-(IV) с Cu(II)
сов металлов и исследуемых реагентов не являются
изучали методом осаждения (как это было сделано
суперпозицией спектров компонентов: в спектрах
для неразветвленных гомологов [3, с. 105-113]), по-
смесей наблюдаются сдвиги максимумов поглоще-
скольку образующиеся комплексные соединения ма-
ния и изменения их интенсивности по сравнению с
лорастворимы в воде. Для соединений (II), (III) были
исходными соединениями (рис. 2).
препаративно выделены комплексы состава СuL, для
Для подтверждения природы образующихся ком-
(IV) — [Сu(HL)2] (табл. 4).
плексов проводили их экстракцию в толуол, достигая
при этом от 90 до 95% извлечения. Количественный
переход ионов металлов в органическую фазу возмо-
жен только в составе их комплексных соединений с
реагентами, так как аммиачные комплексы металлов
не экстрагируются в толуол (что было доказано до-
полнительными исследованиями).
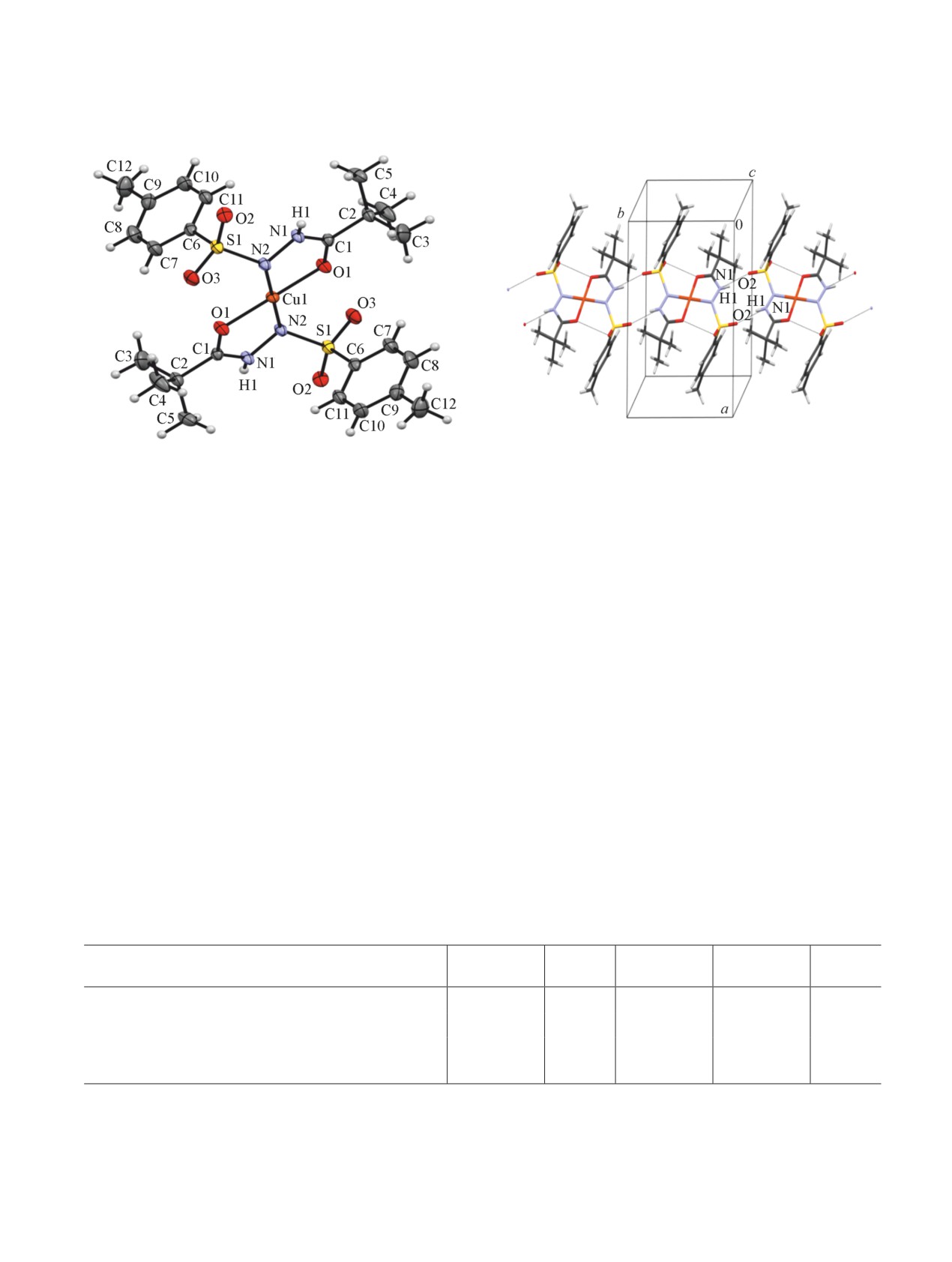
Структура комплекса Cu(II) с соединением (IV)
Состав образующихся комплексных соединений
была также подтверждена рентгеноструктурным ис-
устанавливали методом молярных отношений*
следованием выращенного монокристалла (рис. 3, а).
с последующей обработкой данных методом сдви-
Образование пятичленных хелатных металлоци-
га равновесия** и кондуктометрическим титро-
ванием [3, с. 104-105]. Было показано, что в рас-
клов с двумя лигандами происходит за счет кова-
творах при рН 10.0-11.0 все исследуемые реагенты
лентного связывания Cu(II) с азотом сульфамидной
образуют комплексы с мольными соотношениями
группы и координации по кислороду карбонильной
[M(II)]:[реагент] = 1:1 и 1:2 (табл. 3). Расчеты кон-
группы. За счет межмолекулярных водородных свя-
стант устойчивости комплексных соединений выпол-
зей N1—H1∙∙∙O2 молекулы связаны в бесконечные
цепи, вытянутые вдоль оси 0b (рис. 3, б).
нены только для комплексов (1:2), так как получить
Расчет произведения растворимости (ПР) (табл. 5)
комплексов выполнен аналогично методике, опи-
* Булатов М. И., Калинкин И. П. Практическое руко-
водство по фотометрическим методам анализа. Л.: Химия,
1986. С. 244, 245, 267.
*** Лурье Ю. Ю. Справочник по аналитической химии
** Там же.
М.: Химия, 1979. С. 328, 329.
466
Чеканова Л. Г. и др.
Рис. 2. Спектры поглощения растворов реагентов и предполагаемых комплексных соединений в аммиачных рас-
творах.
а: 1 — Сo(II), с = 1.0·10-3 моль·л-1; 2 — гидразид неопентановой кислоты, с = 2.0·10-3 моль·л-1; 3 — смесь гидразида
неопентаной кислоты и Сo(II); pHравн 11.0.
б: 1 — Cu(II), с =1.0·10-3 моль·л-1; 2 — 1,2-динеопентаноилгидразин, с = 2.0·10-3 моль·л-1; 3 — смесь 1,2-динеопента-
ноилгидразина и Сu(II); pHравн 10.5.
в: 1 — Ni(II), с = 8.0·10-4 моль·л-1; 2 — 1-неопентаноил-2-бензоилгидразин, с = 1.6·10-3 моль·л-1; 3 — смесь 1-неопен-
таноил-2-бензоилгидразина и Ni(II); pHравн 11.2.
г: 1 — Cu(II), с = 1.0∙10-3 моль·л-1; 2 — 1-неопентаноил-2-метансульфонилгидразин, с = 1.0∙10-3 моль·л-1; 3 — смесь
1-неопентаноил-2-метансульфонилгидразина и Cu(II); pHравн 10.0.
санной в работе [3, с. 114-119], но без учета ионных
где Kа1 и Kа2 — константы диссоциации лигандов Н2L
состояний металлов над осадком по формулам (3)
по I и II ступеням; сCu2+ и сН2L — концентрации Сu2+
[для комплексов реагентов (II), (III)] и (4) [для (IV)]:
и добавленного лиганда соответственно (моль·л-1);
Si — степень осаждения Сu2+ (%); [H+] — равновес-
ная концентрация Н+ (моль·л-1); [Cu2+]рсвно — равно-
весная концентрация Сu2+ над осадком, определенная
,
(3)
экспериментально (моль·л-1).
Найденные значения ПР подтверждают, что ком-
плексные соединения — труднорастворимые осадки
(табл. 5), что может быть основанием для рекомен-
,
(4)
дации использования реагентов (II)-(IV) для ионной
флотации Cu(II).
Производные гидразида неопентановой кислоты как реагенты для флотационного извлечения цветных металлов
467
468
Чеканова Л. Г. и др.
a
б
Рис. 3. Молекулярная (а) и кристаллическая структура (б) комплекса Cu2+ c 1-неопентаноил-2(п-толуолсульфо-
нил)-гидразином по данным рентгеноструктурного анализа.
Гидразид неопентановой кислоты (табл. 6) в про-
чение никеля в коллективный концентрат повышается
цессе флотации сульфидной медно-никелевой руды
на 2.48%, кобальта — на 3.43%. При этом потери
в условиях базового опыта проявляет себя как менее
меди с хвостами соответствуют потерям в базовом
сильный собиратель по сравнению с используемым
опыте, никеля и кобальта — снижаются; качество
на обогатительных фабриках бутиловым ксантогена-
концентрата сопоставимо (Cu, Co) или несколько
том калия. Сочетание гидразида с ксантогенатом не-
выше (Ni), чем в базовом опыте.
значительно увеличивает извлечение Cu и Со, однако
На примере сульфидной медной руды показано,
качество пенных продуктов при этом ухудшается.
что применение в качестве собирателей реагентов
Лучшие результаты достигнуты со смесью гидразида
(IV) и (V) позволило увеличить степень извлечения
неопентановой кислоты и бутилового ксантогената
меди на 8.85 и 3.18% и повысить содержание ме-
калия, синтезированного по инновационной техноло-
талла в концентрате на 0.76 и 1.58% соответственно
гии NAX TECHNOLOGY с содержанием основного
(табл. 7) при равных расходах по сравнению с базо-
вещества 58.5%. При расходе бутилового аэрофлота
вым опытом.
натрия вдвое меньшем, чем в базовом опыте, извле-
Таблица 5
Характеристики растворимости комплексных соединений Cu2+ с производными гидразида неопентановой
кислоты (Н2L)
[Cu2+]освн,
[L2-], [HL-],
Комплексное соединение
[H+]
Si, %
-lgПР
моль·л-1
моль·л-1
Cu-1,2-динеопентаноилгидразин CuL
3.31·10-10
99.98
2.00·10-7
6.29·10-9
14.90
Cu-1-неопентаноил-2-бензоилгидразин CuL
3.16·10-10
99.95
5.00·10-7
1.00·10-6
12.30
Cu-1-неопентаноил-2-(п-толуолсульфонил)гидразин
1.00·10-8
99.90
1.00·10-6
1.48·10-6
17.66
[Сu(HL)2]
П р и мечан и е. ПР — произведение растворимости комплексных соединений; L2- — диссоциированные по 1 и по
2 ступеням формы 1,2-динеопентаноилгидразина и 1-неопентаноил-2-бензоилгидразина; HL- — диссоциированная по
1 ступени форма 1-неопентаноил-2-(п-толуолсульфонил)гидразина; Si — степень осаждения Сu2+; [H+] — равновесная
с
концентрация Н+; [Cu2+]о
— равновесная концентрация Cu2+ над осадком; [L2-], [HL-] — равновесные концентрации
ионов L2- и HL- соответственно.
Производные гидразида неопентановой кислоты как реагенты для флотационного извлечения цветных металлов
469
470
Чеканова Л. Г. и др.
Таблица 7
Результаты флотации медной руды с собирателями бутилксанотогенатом калия,
1-неопентаноил-2-(п-толуолсульфонил)гидразином и 1-неопентаноил-2-метансульфонилгидразином
Cu
Условия флотации
Продукт флотации
Выход, %
среднее содержание, %
степень извлечения, %
БКК базовый опыт
Основная
9.91
2.280
70.10
Контрольная
5.33
0.827
13.66
∑(осн. + контр.)
15.23
1.77
83.76
Камерный продукт
84.77
0.062
16.24
Итого
100
0.32
100
1-Неопентаноил-2-(п-толуол-
Основная
7.84
3.75
87.24
сульфонил)гидразин
Контрольная
4.50
0.40
5.37
∑ (осн.+контр.)
12.34
2.53
92.61
Камерный продукт
87.66
0.028
7.39
Итого
100
0.34
100
1-Неопентаноил-2-метан-
Основная
5.64
4.60
76.67
сульфонилгидразин
Контрольная
3.14
1.11
10.26
∑ (осн.+контр.)
8.78
3.35
86.94
Камерный продукт
91.22
0.049
13.06
Итого
100
0.34
100
Примечание. БКК — бутиловый ксантогенат калия; Af — бутиловый аэрофлот натрия; ∑(осн. + контр.) — суммар-
ное значение показателей основной и контрольной флотации. Расход реагентов, г·т-1: основная флотация — БКК — 25.2,
Af — 10.8; контрольная флотация — БКК — 11.2 Af — 10.8.
Выводы
составе реагента 1-неопентаноил-2-(п-толуолсульфо-
нил)гидразина повышает его активность в отношении
Полученные результаты позволяют сделать вывод
сульфидов меди.
о возможности применения производных гидразида
неопентановой кислоты в качестве собирателей для
флотации цветных металлов. Введение короткого
Финансирование работы
разветвленного радикала в структуру гидразидов
Работа выполнена при финансовой поддержке
увеличивает растворимость соединений в воде и во-
Российского научного фонда (грант 20-69-46066) с
дных растворах кислот и щелочей по сравнению с
использованием оборудования ЦКП «Исследования
неразветвленными гомологами, а также придает им
материалов и вещества» ПФИЦ УрО РАН.
умеренную гидролитическую устойчивость. Низкие
значения констант нестойкости свидетельствуют об
Конфликт интересов
образовании в растворах прочных комплексных сое-
динений реагентов с Cu(II), Ni(II) и Co(II), благодаря
Авторы заявляют об отсутствии конфликта инте-
чему следует ожидать формирование прочных соеди-
ресов, требующего раскрытия в данной статье.
нений и при закреплении лигандов на поверхности
минералов металлов и, как следствие, эффективность
Информация о вкладе авторов
ее гидрофобизации, что подтверждается результатами
флотационных опытов (увеличение степени извлече-
Л. Г. Чеканова и Ю. Б. Ельчищева провели иссле-
ния и содержания металлов в концентрате). Лучшие
дование физико-химических и комплексообразующих
флотационные свойства проявляют ацилсульфонилги-
свойств реагентов; П. Т. Павлов и А. В. Харитонова
дразины — 1-неопентаноил-2-(п-толуолсульфонил)-
синтезировали образцы реагентов; С. А. Заболотных
гидразин и 1-неопентаноил-2-метансульфонилги-
и Г. В. Чернова исследовали флотационные свойства
дразин, причем наличие ароматического радикала в
реагентов.
Производные гидразида неопентановой кислоты как реагенты для флотационного извлечения цветных металлов
471
Информация об авторах
флотационного обогащения вкрапленных мед-
но-никелевых руд // Хим. технология. 2014. № 8.
Чеканова Лариса Геннадьевна, к.х.н., доцент,
С. 488-492.
[6] Тетерина Н. Н., Радушев А. В., Адеев С. М.,
Ельчищева Юлия Борисовна, к.х.н., доцент,
Гусев В. Ю. Гидразиды карбоновых кислот как
собиратели при флотации сильвина из калийных
Харитонова Анастасия Владимировна, к.х.н.,
руд // ЖПХ. 1995. Т. 68. № 1. С. 3-8.
[7] Пат. РФ 2422437 (опубл. 2011). Способ извлечения
Павлов Петр Тимофеевич, к.х.н., доцент,
ионов меди(II) из аммиачных сред с использова-
нием бета-n-оксиэтилгидразидов алифатических
карбоновых кислот.
Заболотных Светлана Александровна, к.х.н.,
[8] Radushev A. V., Batueva T. D., Kataev A. V. Versatic
functional tert-carboxylic acids as metal extractive
Чернова Галина Викторовна, к.х.н.,
agents // Separ. Sci. Technol. 2015. V. 50. N 4. P. 512-
[9] Овербергер Ч. Дж., Ансели Ж.-П., Ломбарди-
но Дж. Г. Органические соединения со связями
Список литературы
азот-азот. Л.: Химия, 1970, С. 128.
[1] Коган В. А., Зеленцов В. В., Гэрбэлэу Н. В., Луков В. В.
[10] Пашкина Д. А., Гусев В. Ю., Радушев А. В.
Современные представления о строении координа-
Комплексообразование меди(II) с 2ʹ,2ʹ-диалкил-па-
ционных соединений переходных металлов с орга-
ра-третбутилбензогидразидами // ЖНХ. 2014.
ническими производными гидразина // ЖНХ. 1986.
Т. 59. № 4. С. 552-556.
Т. 31. № 11. С. 2831-2843.
[2] Liu D., Chen Z., Qin S., Huang W., Jiang L., Liang F.
[Pashkina D. A., Gusev V. Yu., Radushev A. V.
Synthesis, characterization, and properties of four metal
Complexation of copper (II) with 2ʹ,2ʹ-dialkyl-para-
complexes with multidentate N-acyl-salicylhydrazide
tert-butylbenzohydrazides // Russ. J. Inorg. Chem.
ligands // J. Inorg. Gen. Chem. 2011. V. 637. N 10.
2014. V. 59. N 4. P. 394-398.
[3] Радушев А. В., Чеканова Л. Г., Гусев В. Ю. Гидразиды
[11] Рябой В. И. О поверхностных реакциях флотореа-
и 1,2-диацилгидразины. Получение, свойства, при-
гентов с минералами на основе их донорно-акцеп-
менение в процессах концентрирования металлов.
торного взаимодействия // Обогащение руд. 2008.
Екатеринбург: УрО РАН, 2010. C. 64-68, 22-23,
№ 6. С. 24-30.
93-94, 104-119.
[12] Li B., Bemish R. J., Bill D. R., Brenek S., Buzon R. A.,
[4] Sharifan M., Wan Yunus W. M. Z., Haron M. J.,
Chiu C. K.-F., Newell L. Preparation of pivaloyl
Rahman M. Z. A. Extraction and separation of
hydrazide in water // Org. Synth. 2005. V. 81. P. 254-
molybdenum (VI) from acidic media by hydrazides of
fatty acids // J. Chem. Technol. Biotechnol. 2008. V. 83.
[13] Черных В. П., Макурина В. И. Реакционная способ-
ность замещенных амидов и гидразидов аромати-
[5] Тимошенко Л. И., Чеканова Л. Г., Маркосян С. М.,
ческих сульфокислот // Реакцион. способность орг.
Байгачева Е. В. Реагенты класса гидразидов для
соединений. 1977. Т. ХІV. № 1 (49). С. 106-115.