Журнал прикладной химии. 2021. Т. 94. Вып. 4
ФИЗИКО-ХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ СИСТЕМ И ПРОЦЕССОВ
УДК 541.12
РЕШЕНИЕ ОБРАТНОЙ ЗАДАЧИ ПО НЕСТАЦИОНАРНЫМ ДАННЫМ
ДЛЯ ХИМИЧЕСКИХ РЕАКЦИЙ С НЕИДЕАЛЬНОЙ КИНЕТИКОЙ
© Н. И. Кольцов
Чувашский государственный университет им. И. Н. Ульянова,
428015, г. Чебоксары, Московский пр., д. 15
E-mail: koltsovni@mail.ru
Поступила в Редакцию 11 декабря 2020 г.
После доработки 20 февраля 2020 г.
Принята к публикации 26 февраля 2021 г.
Разработан метод определения по нестационарным данным констант скоростей стадий химических
реакций, протекающих в изотермическом безградиентном реакторе по неидеальному кинетическому
закону Марселина-Де Донде. Метод позволяет оценивать интервалы изменения значений констант
скоростей стадий с учетом ошибок измерений концентраций реагентов без использования оптимиза-
ционных алгоритмов. Приведен пример, показывающий хорошую точность решения обратной задачи
оценки значений констант скоростей стадий для реакции получения 4-трет-бутилпирокатехина
предлагаемым методом.
Ключевые слова: обратная задача; интервалы констант скоростей стадий; химические реакции;
неидеальная кинетика; нестационарные эксперименты; безградиентный реактор
DOI: 10.31857/S0044461821040137
Обратная задача химической кинетики, связанная
использования оптимизационных алгоритмов для
с оценкой значений констант скоростей элементар-
химических реакций, протекающих по неидеальным
ных стадий сложных реакций, традиционно решается
кинетическим законам Марселина-Де Донде [6-8] в
на основе идеального закона действующих масс с
открытом изотермическом безградиентном реакторе.
применением оптимизационных алгоритмов [1, 2].
Нами разработаны подходы к решению этой задачи
без использования оптимизационных алгоритмов
Методическая часть
[3-5], позволяющие повысить точность оценок зна-
Рассмотрим химическую реакцию, протекающую
чений констант скоростей стадий за счет упрощения
через элементарные стадии вида
(линеаризации) кинетических моделей и учета по-
грешностей измерений экспериментальных данных.
ai1A1 + ai2A2 +…+ ainAn
Представляет интерес исследовать точность решения
(1)
обратной задачи на основе более общих кинетиче-
bi1A1 + bi2A2 +…+ binAn, i = 1, …, s,
ских законов, учитывающих влияние различных не-
идеальных факторов (изменения активностей, взаим-
где i — номер стадии; s — число стадий; Aj — реа-
ное влияние реагентов, неоднородность реакционной
генты; j — номер реагента; n — число реагентов; aij,
среды и др.).
bij — стехиометрические коэффициенты.
Цель исследования — разработать метод решения
Нестационарный режим такой реакции в изотер-
обратной задачи по нестационарным данным без мическом безградиентном реакторе описывается си-
535
536
Кольцов Н. И.
стемой нелинейных обыкновенных дифференциаль-
концентрации реагентов (6) и скорости их изменения
ных уравнений [1, 2]
(производные от концентраций)
Ajʹ(t) = ∑(bij - aij)(ri - r-i) +
Ajkʹ(t) = p∑ajkptp-1, k = 1, 2, …, K*.
(7)
i
p
(2)
+ q0Aj0 - qAj , j = 1, …, n,
Подставим эти значения в (2)-(5) и получим си-
стему из K × N линейных уравнений относительно
где ri(ki, fj), r-i(k-i, fj) — кинетические законы стадий
s ≤ s* ≤ 2s неизвестных констант скоростей стадий:
в прямом и обратном направлениях (1/с); ki, k-i —
константы скоростей стадий (1/с); fj — безразмерные
∑(bik - aik)[ri(ki, k-i, fj) - r-i(ki, k-i, fj)] +
термодинамические функции неидеальности реаген-
(8)
+ q0kAj0k - qAjk = Ajkʹ.
тов; Aj — концентрации N независимых реагентов
(мол. доли); t — время (с); Aj0 — начальные условия;
Эта система разрешима тогда, когда число ее урав-
q0, q — начальная и текущая скорости потока в реак-
нений не превышает числа неизвестных
торе (1/с).
Рассмотрим неидеальный кинетический закон
L ≡ K × N ≤ s*.
(9)
Марселина-Де Донде [6-8]:
Рассмотрим различные варианты реализации ус-
ri = ri0exp(∑aijμj), r-i = r-i0exp(∑bijμj), i = 1, …, s,
(3)
ловия (9). Если L = s*, то константы скоростей всех
стадий определяются точно и однозначно
где ri0, r-i0 — кинетические множители (1/c); μj —
безразмерные потенциалы Фейнберга [21]:
ki = Δi/Δ, k-i = Δ-i/Δ, i = 1, …, s,
(10)
μj = μj0 + lnAj + fj(Aj), j = 1, …, n.
(4)
где Δ ≠ 0 и Δi, Δ-i — главный и вспомогательные опре-
делители системы (8), удовлетворяющие условиям
Для идеальной кинетики функция fj = 0 и выраже-
физичности ΔiΔ > 0, ΔiΔ ≥ 0.
ния (3), (4) совпадают с законом действующих масс
Если L < s*, то значения s* - L констант опреде-
ri = ki∏Ajaij, r-i = k-i∏Ajbij. Для неидеальной кинетики
ляются неоднозначно, только с точностью до произ-
эта функция может быть определена в виде, анало-
вольной постоянной.
гичном [23, 24], c учетом неоднородности реакци-
Для полноты учета всех исходных данных разде-
онной среды fj = Ajγj, где γj — параметры, характери-
лим их на типовые качественно различные участки:
зующие влияние среды на концентрации реагентов.
быстрой, средней и медленной релаксации. При этом
Например, при γj = 1 этой функции соответствует
из условия (9) следует, что для разрешимости обрат-
кинетический закон
ной задачи достаточно K ≤ s*/N участков (опорных
точек). Если K = 1 (достаточно одного участка), то
ri = ki∏Ajaijexp(Ajaij), r-i = k-i∏Ajbii0exp(Ajbij).
(5)
для учета остальных участков систему (8) следует ре-
шать для всех трех участков отдельно (независимо).
Обозначим экспериментальные значения концен-
Среднее арифметическое полученных решений дает
траций реагентов в моменты времени tk через Ajk,
приближенные, но однозначные значения констант
k = 1, …, K* + 1. Соединим для каждого реагента со-
скоростей стадий:
ответствующие этим значениям точки гладкой кривой
(сплайном) из K* полиномиальных фрагментов:
ki = ∑ki,k/K, k = 1, …, K,
(11)
k
Ajk(t) = ∑ajkptp, k = 1, 2, …, K*,
(6)
где ki,k = [Ajkʹ - (q0kAj0k - qAjk)]/Σ(bik - aik)ri(fj).
p
Если для выполнения условия (9) необходимо два
где ajkp — коэффициенты k-того фрагмента сплайна
участка (K = 2), то систему (8) можно решать один раз
степени p ≥ 3 для j-того реагента [5].
по формуле (10) или для всех различных комбинаций
Выберем 3 ≤ K ≤ K* участков (наборов смежных
пар участков отдельно по формуле (11). Если для
фрагментов) сплайн-кривой с различной типовой ди-
выполнения условия (9) необходимо три участка, то
намикой (быстрая, средняя и медленная релаксация)
систему (8) достаточно решить один раз по формуле
и по одной опорной точке в середине (примерно)
(10), так как в этом случае учитываются релаксаци-
каждого участка. Рассчитаем в этих опорных точках
онные характеристики всех участков.
Решение обратной задачи по нестационарным данным для химических реакций с неидеальной кинетикой
537
Соотношения (10), (11) позволяют определить
Запишем для схемы (12) с учетом (13) уравнения
точечные значения констант скоростей стадий при от-
(2) для закрытого изотермического безградиентного
сутствии ошибок измерений (шума). Для учета влия-
реактора:
ния шума рассчитаем интервальные оценки значений
Aʹ = -r1 + r-1, Bʹ = -r1 + r-1 - 2r2 + 2r-2,
(14)
констант [min k±i, max k±i] по формулам (2)-(11), за-
давая различные уровни шума и соответствующие за-
Сʹ = r1 - r-1, Dʹ = r1 - r-1 + 2r2 - 2r-2,
(15)
шумленные значения концентраций реагентов Ajk* =
Eʹ = r2 - r-2,
= Ajk[1 + Rjksgn(Rjk - 0.5)S/100], где Rjk ∈ (0,1) — слу-
чайные числа, S — уровень шума (%). Погрешность
где A, B, C, D, E — концентрации реагентов A, B, C,
решений обратной задачи оценим по относительным
D, E; r1 = k1ABexp(A)exp(B), r-1 = k-1CDexp(C)exp(D),
среднеквадратичным отклонениям концентраций
r2 = k2B2exp(B)exp(B), r-2 = k-2D2Eexp(D)exp(D)×
RAj = 100∑[(Ajk - Ajk*)2/Ajk2]0.5/K, где Ajk* — расчет-
×exp(E).
ные значения концентраций реагента j в моменты
Для системы (14), (15) выполняются три неза-
времени tk, найденные численным интегрированием
висимых закона сохранения: A + С = A0 + C0 = 1,
уравнений (2)-(5) с учетом шума при расчетных зна-
B + D = 1, B + C + 2E = 1, т. е. в механизме (12) уча-
чениях констант скоростей стадий (10), (11).
ствуют только два независимых реагента. Выразим
Применим описанный метод для расчета интерва-
из этих законов сохранения, например, C, D и B через
лов изменения значений констант скоростей стадий
A и E (C = 1 - A, D = 1 - A + + 2E, B = A - 2E), под-
реакции получения 4-трет-бутилпирокатехина с
ставим найденные выражения в (14), (15) и получим
учетом неидеальности реакционной среды.
эквивалентную систему уравнений
Экспериментальная часть
Aʹ = -k1ABexp(A)exp(B) + k-1CDexp(C)exp(D),
(16)
Реакция получения 4-трет-бутилпирокатехина
Eʹ = k2B2exp(B)exp(B) -
окислением 4-трет-бутилфенола пероксидом водо-
(17)
- k-2D2Eexp(D)exp(D)exp(E).
рода в присутствии титаносиликатных катализаторов
экспериментально изучалась в закрытом изотермиче-
Применим соотношения (6)-(11) для оценки зна-
ском реакторе [9] в предположении ее протекания по
чений констант скоростей стадий реакции получения
механизму [10]
4-трет-бутилпирокатехина, описываемой системой
(16), (17). В работе [10] для оценки значений кон-
1) A + B C + D, 2) 2B
2D + E,
(12)
стант скоростей стадий использовались усредненные
экспериментальные данные (4 точки), измеренные в
где A — 4-трет-бутилфенол (C10H14O), B — пер-
трех опытах. Расширим эти данные (увеличим число
оксид водорода (H2O2), C — 4-трет-бутилпирокате-
точек) с помощью модельного опыта, решая прямую
хин (C10H14O2), D — H2O, E — O2.
задачу при значениях констант скоростей стадий [10].
В работе [10] для этого механизма в рамках иде-
Пересчитаем их в 1/c: k1* = 0.233 × 0.12 = 0.0280,
ального закона действующих масс на основе неста-
k2* = 0.535 × 0.12 = 0.0642 при начальных концентра-
ционарных значений концентраций реагентов с помо-
циях [A]0 = 0.12, [E]0 = 0 [моль·л-1], что соответствует
щью оптимизационных алгоритмов были рассчитаны
начальным условиям A0 = 1, E0 = 0. Проинтегрируем
константы скоростей стадий при 50°С: k1,опт = 0.233,
систему (16), (17) при этих начальных условиях с
k2,опт = 0.535 л·моль-1·с-1 с ошибкой RA < 10.4%.
шагом Δt = 0.1 на интервале [0, 10], вычислим концен-
трации реагентов в 11 узловых точках и примем их за
Обсуждение результатов
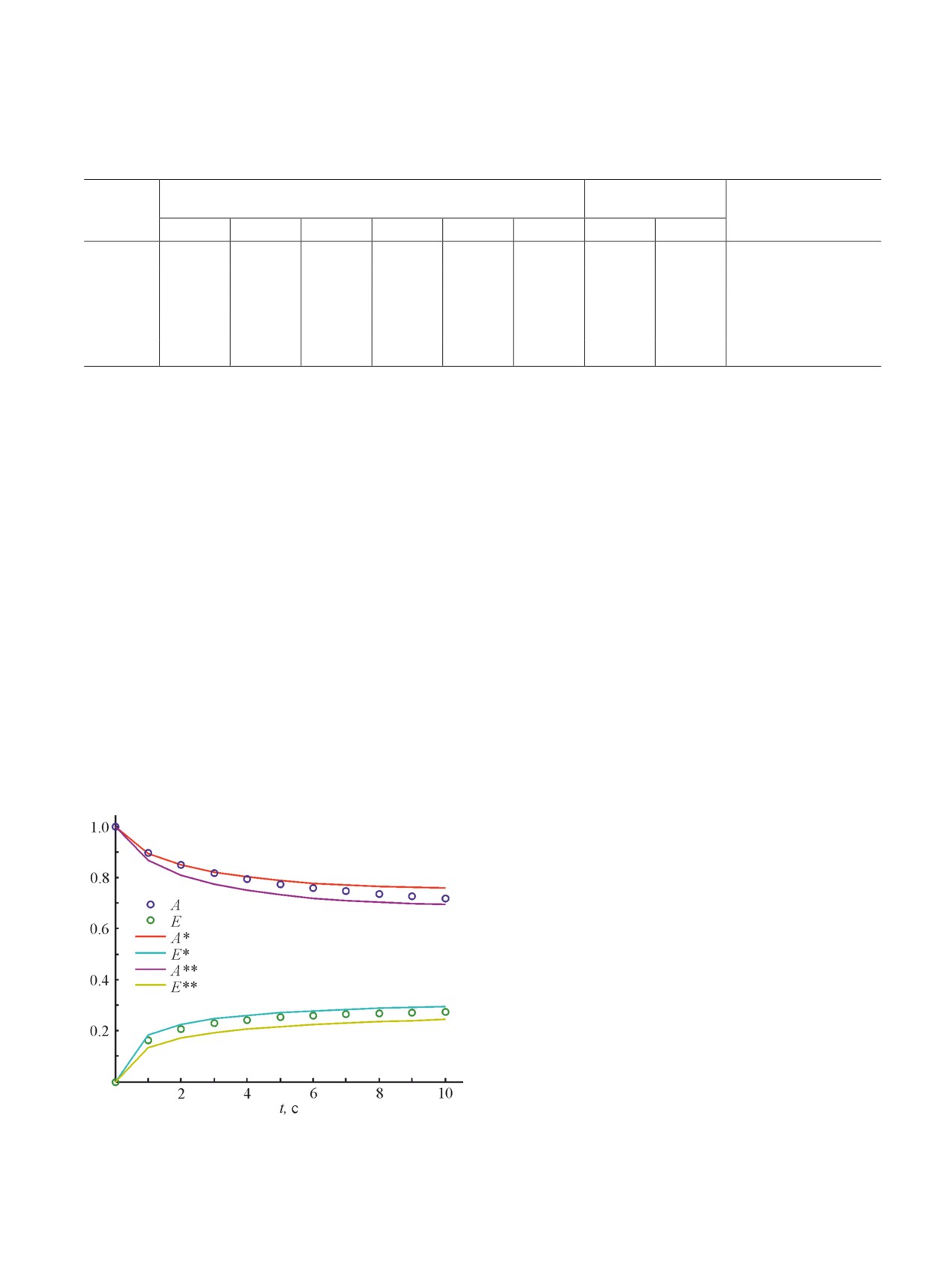
исходные данные (см. рисунок). Соединим эти точки
Решим для реакции получения 4-трет-бутилпиро-
кривыми и разобьем их на участки быстрой {1-3},
катехина обратную задачу с использованием неиде-
средней {4-9} и медленной {10-11} релаксации, со-
ального кинетического закона (3)-(5) с потенциалами
ответствующие интервалам времени [0, 2] и [3, 8] и
реагентов, соответствующими неоднородной реакци-
[9, 10]. Так как число независимых реагентов N = 2
онной среде, аналогичными [6-8]:
и число неизвестных констант s* = 2, то для выпол-
нения условия (9) K × N ≤ s* достаточно K ≤ s*/N = 1
μA = μA0 + lnA + A, μB = μB0 + lnB + B,
(13)
участка (любой одной опорной точки). В этом случае,
μC = μC0 + lnC + C4, μD = μD0 + lnD + D,
как отмечалось выше, для учета остальных участков
μE = μE0 + lnE + E.
систему (8) следует решать для всех трех участков
538
Кольцов Н. И.
Константы скоростей стадий реакции получения 4-трет-бутилпирокатехина окислением 4-трет-бутилфенола
пероксидом водорода в присутствии титаносиликатных катализаторов в зависимости от уровня шума
Средние значения
Константы скоростей стадий, 1/с
Среднеквадратичное
Шум S, %
констант, 1/с
отклонение RA, %
k1,1
k2,1
k1,2
k2,2
k1,3
k2,3
k1,средн
k2,средн
0
0.0306
0.0765
0.0218
0.0708
0.0205
0.0437
0.0243
0.0637
3.2768
5
0.0370
0.0993
0.0268
0.1057
0.0205
0.0437
0.0281
0.0829
2.2984
10
0.0451
0.1220
0.0335
0.1416
0.0205
0.0437
0.0330
0.1025
1.3716
15
0.0553
0.1515
0.0426
0.1961
0.0205
0.0437
0.0395
0.1304
0.8210
20
0.0685
0.1901
0.0554
0.2833
0.0205
0.0437
0.0481
0.1724
1.1989
отдельно (независимо). Выберем три опорные точки
Решая эти уравнения независимо по формуле (11),
в серединах этих участков, рассчитаем в этих точках
найдем три пары значений констант скоростей стадий
по формулам (6), (7) концентрации реагентов A1, E1,
k1,1 = -A1ʹ/[A1(A1 - 2E1)exp(A1)exp(A1 - 2E1)],
A2, E2, A3, E3 и скорости их изменения A1ʹ, E1ʹ, A2ʹ, E2ʹ,
(21)
A3ʹ, E3ʹ. Подставим полученные значения в уравнения
k2,1 = E1ʹ/[(A1 - 2E1)2exp(A1 - 2E1)2],
(16), (17) и получим три системы из двух уравнений
k1,2 = -A2ʹ/[A2(A2 - 2E2)exp(A2)exp(A2 - 2E2)],
относительно двух неизвестных:
(22)
k2,2 = E2ʹ/[(A2 - 2E2)2exp(A2 - 2E2)2],
-k1A1(A1 - 2E1)exp(A1)exp(A1 - 2E1) =
k1,3 = -A3ʹ/[A3(A3 - 2E3)exp(A3)exp(A3 - 2E3)],
(18)
= A1ʹ, k2(A1 - 2E1)2exp(A1 - 2E1)2 = E1ʹ,
(23)
k2,3 = E3ʹ/[(A3 - 2E3)2exp(A3 - 2E3)2].
-k1A2(A2 - 2E2)exp(A2)exp(A2 - 2E2) =
(19)
В таблице приведены результаты численного рас-
= A2ʹ, k2(A2 - 2E2)2exp(A2 - 2E2)2 = E2ʹ,
чета констант скоростей стадий и их средние значе-
-k1A3(A3 - 2E3)exp(A3)exp(A3 - 2E3) =
ния при разном уровне шума.
(20)
Для функций неидеальности (13) при уровне шума
= A3ʹ, k2(A3 - 2E3)2exp(A3 - 2E3)2 = E3ʹ.
S ≤ 20% решениями обратной задачи с погрешностью
RA < 3.3% являются интервалы значений констант
скоростей стадий k1 ∈ [0.0243, 0.0481], k2 ∈ [0.0637,
0.1724], которые включают значения констант
k1* = 0.0280, k2* = 0.0642, рассчитанные в [10] с помо-
щью оптимизационных методов. Экспериментальные
значения (точки) и расчетные зависимости нестаци-
онарных концентраций реагентов A и Е при разном
уровне шума S приведены на рисунке.
Приведенные на рисунке зависимости показывают
близость экспериментальных и расчетных значений
концентраций реагентов, что подтверждает достаточ-
но высокую точность решения обратной задачи по
предлагаемому в данной статье методу.
Выводы
Разработан метод решения обратной задачи хи-
мической кинетики для реакций, протекающих в от-
крытом изотермическом безградиентном реакторе
по неидеальным отличным от закона действующих
Экспериментальные (точки) и расчетные зависимости
концентраций реагентов A и Е от времени при уровнях
масс кинетическим законам. Метод позволяет по не-
шума S = 0% (А*, Е*) и S = 20% (А**, Е**).
стационарным экспериментальным данным с учетом
Решение обратной задачи по нестационарным данным для химических реакций с неидеальной кинетикой
539
ошибок измерений оценивать интервалы изменения
Chem. Reactors (CHEMREACTOR-22). London,
значений констант скоростей стадий без использова-
Sept. 19-23, 2016. P. 377-378.
ния оптимизационных алгоритмов. Результативность
[5] Кольцов Н. И. Метод определения констант скоро-
стей стадий химических реакций в закрытом без-
метода показана на примере реакции получения
градиентном реакторе // ЖПХ. 2020. Т. 93. № 10.
4-трет-бутилпирокатехина, протекающей по неиде-
С. 1474-1481.
альному кинетическому закону Марселина-Де Донде.
[Kolʹtsov N. I. Method for determining the rate
Благодарности
constants of chemical reaction stages in an enclosed
gradientless reactor // Russ. J. Appl. Chem. 2020.
Автор выражает благодарность за участие в об-
V. 93. N 10. P. 1544-1552.
суждении работы В. Х. Федотову.
[6] Bykov V. I., Gorban A. N., Yablonskii G. S. Description
Конфликт интересов
of nonisothermal reactions in terms of Marcelin-de-
Автор заявляет об отсутствии конфликта интере-
Donder kinetics and its generalizations // React. Kinet.
Catal. Lett. 1982. V. 20. N 3-4. P. 261-265.
сов, требующего раскрытия в данной статье.
[7] Горбань А. Н., Быков В. И., Яблонский Г. С.
Информация об авторах
Описание неизотермических реакций в рамках
Кольцов Николай Иванович, д.х.н., проф., ORCID:
уравнений неидеальной химической кинетики //
Кинетика и катализ. 1983. Т. 24. № 5. С. 1239-1248.
[8] Gorban A. N., Kolokoltsov V. N. Generalized mass
action law and thermodynamics of nonlinear markov
Список литературы
processes // Math. Model. Natural Phenom. 2015.
[1] Исмагилова А. С., Спивак С. И. Обратные задачи хи-
V. 10. N 5. P. 16-46.
мической кинетики. Saarbrucken: Lap Lambert Acad.
Publ., 2013. P. 91-110.
[9] Talipova R. R., Kharrasov R. U., Agliullin M. R.,
[2] Ягола A. Г., Янфей В., Степанова И. Э., Титарен-
Badikova A. D., Kutepov B. I. Selective oxidation
ко В. Н. Обратные задачи и методы их решения. М.:
of 4-tertbutylphenol by hydrogen peroxide in the
Бином. Лаборатория знаний, 2014. С. 113-141.
presence of titanosilicates // Appl. Petrochem. Res.
[3] Федотов В. Х., Кольцов Н. И., Гайдай Н. А., Ага-
2016. N 6. P. 419.
фонов Ю. А., Ботавина М. А., Лапидус А. Л.
Исследование адсорбции диоксида углерода на
[10] Спивак С. И., Кантор О. Г., Морозкин Н. Д.
хромоксидном катализаторе по линейному време-
Контроль качества моделей химической кинети-
ни релаксации // ЖПХ. 2016. Т. 89. № 5. С. 582-
ки при решении задачи оптимизации процесса
591 [Fedotov V. Kh., Kolʹtsov N. I., Gaidai N. A.,
получения 4-трет-бутилпирокатехина // Теорет.
Agafonov Yu. A., Botavina M. A., Lapidus A. L. Study
основы хим. технологии. 2020. Т. 54. № 3. С. 383-
of carbon dioxide adsorption on chromium oxide and
gallium oxide catalysts on the basis of linear relaxation
[Spivak S. I., Kantor O. G., Morozkin N. D. Quality
times // Russ. J. Appl. Chem. 2016. V. 89. N 5. P. 719-
control of chemical kinetics models for optimizing the
process of obtaining 4-tert-butylpyrocatechol // Theor.
[4] Fedotov V. Kh., Kolʹtsov N. I. The inverse problem
Found. Chem. Eng. 2020. V. 54. N 3. P. 513-521.
solution for catalytic reactions // XXII Intern. Сonf.