Особенности поведения сорбентов на основе фосфатов кальция и магния в воде и растворах электролитов
603
Журнал прикладной химии. 2021. Т. 94. Вып. 5
УДК 541.83+544.58
ОСОБЕННОСТИ ПОВЕДЕНИЯ СОРБЕНТОВ
НА ОСНОВЕ ФОСФАТОВ КАЛЬЦИЯ И МАГНИЯ В ВОДЕ
И РАСТВОРАХ ЭЛЕКТРОЛИТОВ
© И. Л. Шашкова, Н. В. Китикова, А. И. Иванец*
Институт общей и неорганической химии НАН Беларуси,
220072, Республика Беларусь, г. Минск, ул. Сурганова, д. 9, корп. 1
* E-mail: ivanets@igic.bas-net.by; andreiivanets@yandex.ru
Поступила в Редакцию 14 декабря 2020 г.
После доработки 26 февраля 2021 г.
Принята к публикации 22 марта 2021 г.
Изучена гидролитическая стабильность фосфатов кальция и магния в водных растворах в широком
интервале рН и в присутствии электролитов NaCl и CaCl2: гидрофосфат кальция и трикальцийфос-
фат устойчивы при рН 4.5-10.0, а гидроксиапатит — при pH 3.0-12.0. Увеличение отношения объема
раствора к массе фосфатов от 250 до 500 мл/г приводит к росту степени гидролиза в 1.4-1.9 раза.
В присутствии 0.01 М NaCl и 0.001 М CaCl2 все образцы проявляют высокую гидролитическую устой-
чивость, а увеличение концентрации до 1.0 М NaCl и 0.01 М CaCl2 приводит к протеканию процессов
депротонизации гидрофосфат-ионов и превращению фосфатов магния в фосфаты кальция.
Ключевые слова: фосфаты кальция и магния; сорбенты; гидролиз; гидролитическая устойчивость;
фазовые превращения
DOI: 10.31857/S004446182105008X
Благодаря простоте, эффективности и низкой стои-
химического состава фосфата, морфологии частиц,
мости сорбция является широко применяемой техно-
состояния поверхности [8, 9].
логией удаления тяжелых металлов и радионуклидов
Гидролитическая устойчивость сорбентов на ос-
[1]. Важное место среди используемых сорбентов
нове фосфатов кальция и магния практически не
занимает группа фосфатных сорбентов, в том числе
исследовалась. Ранее показана взаимосвязь раство-
фосфаты кальция и магния, характеризующиеся ис-
римости различных фосфатов кальция и магния с
ключительно высокой емкостью и селективностью
сорбционными свойствами по отношению к ионам
в процессах поглощения ионов тяжелых металлов и
Pb2+, Cr3+ и Fe3+ [10], а также возможность фазовых
радионуклидов [2-4]. Преимуществом данных сор-
превращений при наличии фоновых электролитов в
бентов является экологическая безопасность, а также
растворе [11].
возможность получения из природных минералов и
Цель работы - исследование физико-химических
возобновляемых ресурсов [5, 6].
закономерностей поведения индивидуальных фосфа-
Гидролитические свойства фосфатов кальция и
тов кальция и магния и продуктов фосфатирования
магния необходимо учитывать при иммобилизации
природного доломита в водных растворах различного
радионуклидов в фосфатные матрицы для безопас-
состава.
ного захоронения [7]. Поведение гидроксиапатита в
растворе описывается различными моделями, учи-
Экспериментальная часть
тывающими параллельное протекание процессов
растворения твердой фазы, комплексообразования в
В качестве объектов исследования использова-
растворе и на поверхности твердой фазы, протекания
ны дигидрат гидрофосфата кальция CaHPO4·2H2O,
фазовых трансформаций. Направление этих реакций
трикальцийфосфат Ca3(PO4)2, гидроксиапатит
может существенно изменяться в зависимости от
Ca10(PO4)6(OH)2, гексагидрат магнийаммоний
604
Шашкова И. Л. и др.
фосфата MgNH4PO4·6H2O, а также гидрофосфа-
hP = mP/MP·100%,
(1)
ты Ca-Mg состава Ca0.7Mg0.3HPO4∙2H2O (ФД-1) и
hCat = mСat/MCat·100%,
(2)
средние фосфаты Ca-Mg с примесью гексагидрата
магнийаммоний фосфата MgNH4PO4·6H2O состава
где mP/MP — отношение количества фосфат-ионов,
Ca2.65Mg3(NH4)1.3(PO4)4(CO3)0.3·6H2O (ФД-2).
перешедших в раствор (ммоль·г-1), к содержанию
Индивидуальные фосфаты синтезировали по
фосфат-ионов в сорбенте (ммоль·г-1); mСat/MCat —
классическим методикам,* сорбенты ФД-1 и ФД-2 —
отношение количества катионов Ca2+, Mg2+ или
фосфатированием термообработанного доломита
(Ca2+ + Mg2+), перешедших в раствор (ммоль·г-1),
[12]. CaCl2 (х.ч.) (ООО «АО Реахим»), (NH4)2HPO4
к их содержанию в сорбенте (ммоль·г-1).
(х.ч.) (ООО «АО Реахим»), водный раствор амми-
Концентрацию ионов PO43- определяли фотоко-
ака (25 мас%, х.ч.) (ООО «АО Реахим»), H3PO4
лориметрическим методом определения фосфор-
(65 мас%, х.ч.) (ООО «АО Реахим»), HNO3 (65 мас%,
но-молибденового комплекса (максимум светопо-
х.ч.) (ООО «АО Реахим»), NaCl (х.ч.) (ООО «АО
глощения при длине волны 690 нм), образующегося
Реахим») использовали для синтеза вышеуказанных
при взаимодействии фосфат-ионов в кислой среде
фосфатов и для приготовления растворов электроли-
с молибдатом аммония. Концентрацию ионов Ca2+
тов. Регулирование рН рабочих растворов проводили
и Mg2+ определяли комплексонометрическим ти-
добавлением растворов 0.1 М HNO3 и стандарт-титра
трованием при pH 10.0 в присутствии индикатора
0.1 М NaOH (ЗАО «Уралхиминвест»).
эриохрома черного Т.
Гидролитическую стабильность указанных фос-
фатов изучали:
— при отношении объема дистиллированной воды
Обсуждение результатов
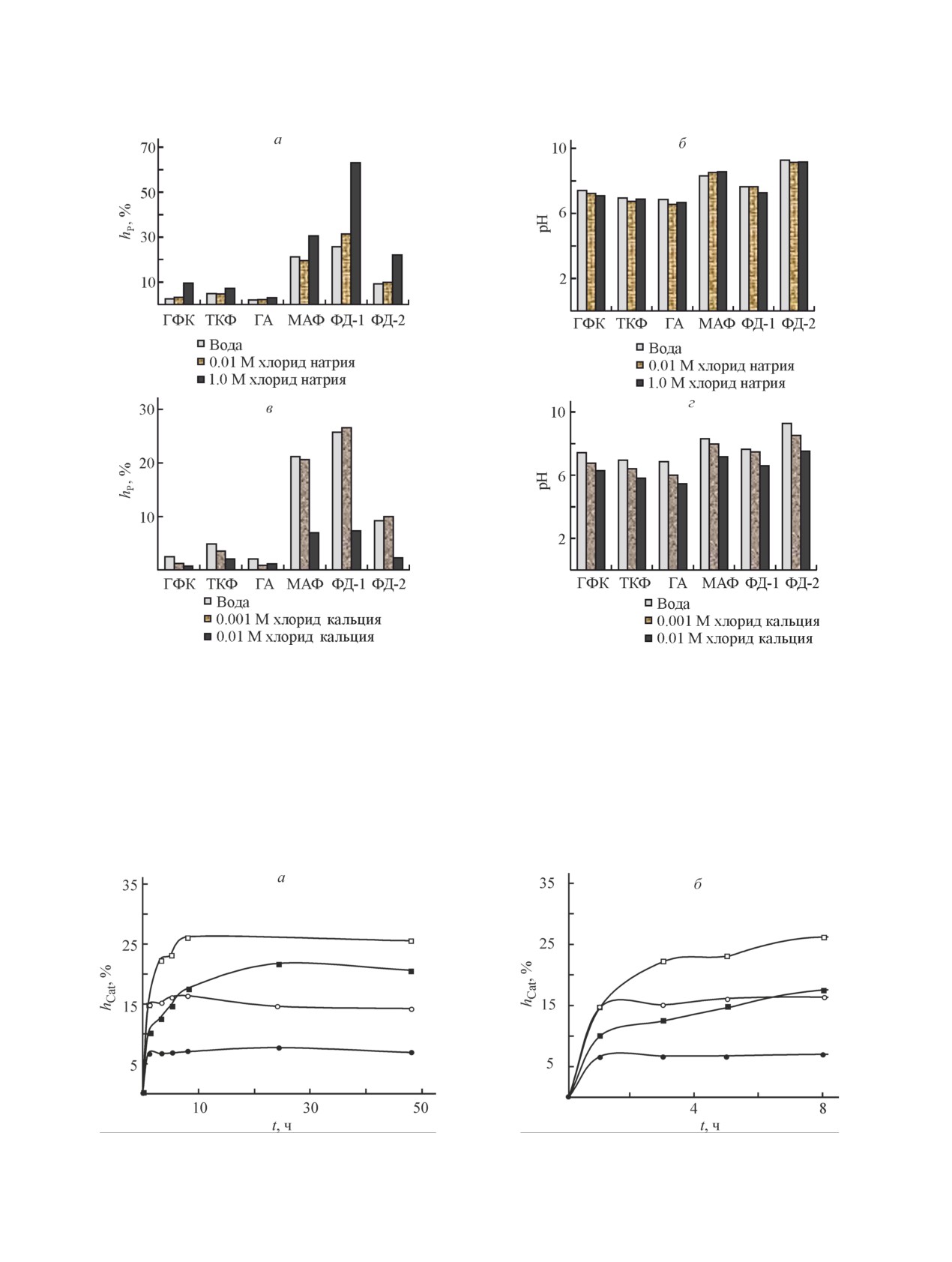
(pH 5.8) к массе навески V/m 250 и 500 мл/г и продол-
По гидролитической устойчивости в водных
жительности контакта 48 ч;
растворах гидроксиапатит, трикальцийфосфат и ги-
— при pH растворов в интервале 3.0-12.0
дрофосфат кальция значительно превосходят маг-
(V/m = 500 мл/г, продолжительность контакта 48 ч);
нийаммоний фосфат и смешанные фосфаты ФД-1 и
— в присутствии электролитов 0.01 и 1.0 M NaCl,
ФД-2 (рис. 1). Так, степень гидролиза магнийаммоний
0.001 и 0.01 M CaCl2, приготовленных из соответству-
фосфата при V/m 500 мл/г достигает hCat = 19.2% и
ющих реактивов при V/m = 500 мл/г и pH 6.0;
hP = 21.2%, а для образца ФД-1 — 22.1% и 25.7%
— при варьируемой продолжительности контакта
соответственно. В этих условиях hCat фосфатов каль-
(1.0, 3.0, 5.0, 8.0, 24.0 и 48.0 ч) сорбентов ФД-1 и ФД-2
ция изменяется в интервале 0.8-2.1%, hP = 2.0-4.9%.
с растворами, при pH 3.0 и 10.0 и V/m = 500 мл/г.
Высокая степень гидролиза ФД-1 обусловлена при-
Навеску фосфатов заливали дистиллированной
сутствием в его составе гидрофосфата магния [про-
водой либо раствором электролита, выдерживали при
изведение растворимости (ПР) 7.6·10-5], поскольку
комнатной температуре при периодическом переме-
гидрофосфат кальция (ПР 2.7·10-7) менее растворим.
шивании. По истечении заданного времени раствор
Гидролиз образца ФД-2 обусловлен присутствием
фильтровали на бумажном фильтре «синяя лента».
среднего фосфата магния и магнийаммоний фосфа-
Осадок сушили на воздухе сначала при комнатной
та, характеризующихся большей растворимостью
температуре, затем при 65°С до постоянной массы.
по сравнению со средним фосфатом кальция. По
Рентгенофазовый анализ проводили на установке
гидролитической устойчивости изученные образцы
ДРОН-3 (CuKα-излучение). Фазовую идентификацию
располагаются в следующий ряд:
исследуемых образцов проводили с использованием
базы рентгенографических порошковых стандартов
Ca10(PO4)6(OH)2 > CaHPO4 ≈
JCPDS PDF2.
Гидролитическую стабильность оценивали по из-
≈ Ca3(PO4)2 > ФД-2 > MgNH4PO4 > ФД-1.
(3)
менению pH растворов в процессе их взаимодействия
с фосфатами, содержанию в растворе ионов PO43-,
При взаимодействии сорбентов с водой при pH 5.8
Ca2+, Mg2+ и суммарной концентрации ионов Ca2+ и
во всех случаях концентрация перешедших в рас-
Mg2+. Степень гидролиза по фосфат-ионам (hP) и по
твор фосфат-ионов превосходит концентрацию ка-
катионам (hCat) рассчитывали по формулам:
тионов. При этом соотношение (Ca2+ + Mg2+)/РO43-
в исходных фосфатах выше, чем в растворе, после
48.0 ч выдерживания соответствующих образцов.
* Щегров Л. Н. Фосфаты двухвалентных металлов.
Киев: Наук. думка, 1987. 216 с.
Аналогичное поведение отмечено для образцов
Особенности поведения сорбентов на основе фосфатов кальция и магния в воде и растворах электролитов
605
Рис. 1. Концентрации катионов и фосфат-ионов в растворе (а, б), степени гидролиза (в, г), молярное соотношение
катионов и фосфат-ионов в растворе (д), рН (е) для образцов фосфатов.
ГФК — CaHPO4·2H2O, ТКФ — Ca3(PO4)2, ГА — Ca10(PO4)6(OH)2, МАФ — MgNH4PO4·6H2O, ФД-1 —
Ca0.7Mg0.3HPO4∙2H2O, ФД-2 — Ca2.65Mg3(NH4)1.3(PO4)4(CO3)0.3·6H2O.
Ca-дефицитного гидроксиапатита с различным мо-
вании механизма сорбции ионов металлов данными
лярным соотношением Ca2+/PO43- [13]. Установлено,
фосфатами.
что с уменьшением содержания кальция в исходной
Процесс гидролиза изученных фосфатов со-
твердой фазе растворимость гидроксиапатита в воде
провождается увеличением pH раствора (pH > 5.8)
увеличивалась, а соотношение Ca2+/PO43- уменьша-
(рис. 1, е), что обусловлено процессами протониза-
лось. Такой нестехиометрический переход ионов в
ции-депротонизации и комплексообразования на по-
раствор, так называемое инконгруэнтное растворе-
верхности твердой фазы (4)-(7) и в растворе (8)-(10):
ние, характерен для гидроксиапатита [14]. Таким
OPO3H2
OPO3H- + H+,
(4)
образом, при гидролизе изучаемых фосфатов кальция
и магния параллельно протекают процессы раство-
CaOH + HOH
CaOH2+ + OH-,
(5)
рения, комплексообразования в поверхностном слое
CaOH2+ + H2PO4-
CaOPO3H- + H+ + H2O, (6)
и в растворе, а также осаждения более устойчивых
новых фаз. Это необходимо учитывать при исследо-
OPO32- + Ca2+ + HOH
OPO3HCa+ + OH-, (7)
606
Шашкова И. Л. и др.
PO43- +HOH HPO42- + OH-,
(8)
гидрофосфата кальция, ФД-1 и магнийаммоний фос-
фата практически не влияет на pH раствора, а для
HPO42- +HOH H2PO4- + OH-,
(9)
остальных образцов приводит к незначительному
Ca2+ + PO43- + HOH CaHPO4 + OH-.
(10)
уменьшению рН.
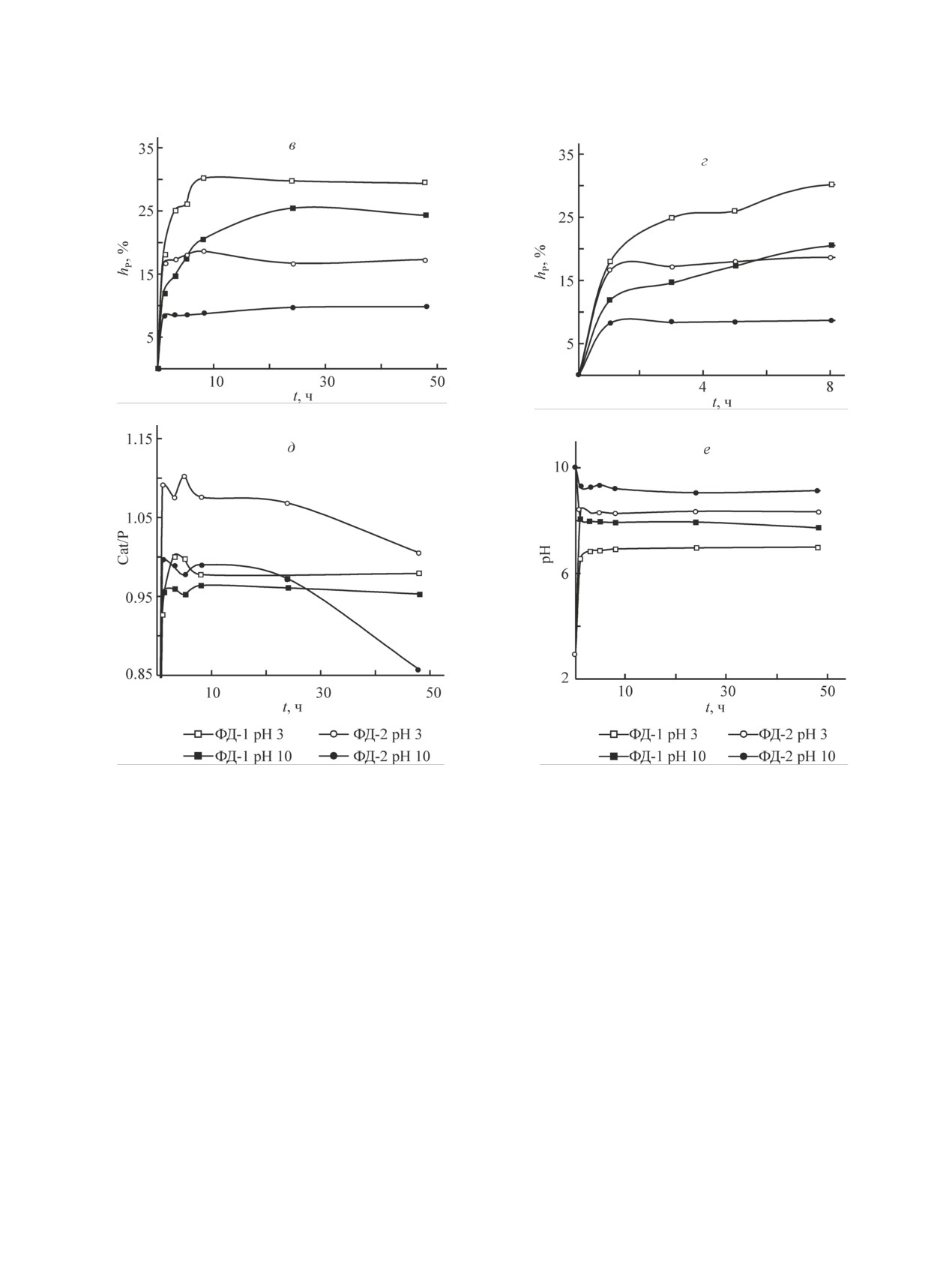
С увеличением рН исходного раствора (рН0) от
Более существенное изменение концентраций ка-
3.0 до 4.5 степень гидролиза всех изученных фосфа-
тионов и фосфора в растворе и степени гидролиза
тов уменьшается (рис. 2, в, г). По мере увеличения
наблюдается при изменении V/m для магнийаммо-
рН0 от 4.5 до 10.0 для Mg-содержащих сорбентов
ний фосфата и сорбентов на основе фосфатирован-
(магнийаммоний фосфат, ФД-1, ФД-2) наблюдается
ного доломита, в то время как для гидролитически
плато на кривых изменения концентраций катионов
более устойчивых фосфатов кальция влияние V/m
и анионов и соответствующих степеней гидролиза.
незначительно (рис. 1, д). Увеличение концентрации
В области рН 10.0-12.0 для данных фосфатов проис-
Рис. 2. Концентрации катионов и фосфат-ионов в растворе (а, б) и соответствующие степени гидролиза (в, г),
молярное соотношение перешедших в раствор катионов и фосфат-ионов (д) и рН (е) при различных рН исходных
растворов для образцов фосфатов.
ГФК — CaHPO4·2H2O, ТКФ — Ca3(PO4)2, ГА — Ca10(PO4)6(OH)2, МАФ — MgNH4PO4·6H2O, ФД-1 —
Ca0.7Mg0.3HPO4∙2H2O, ФД-2 — Ca2.65Mg3(NH4)1.3(PO4)4(CO3)0.3·6H2O.
Особенности поведения сорбентов на основе фосфатов кальция и магния в воде и растворах электролитов
607
ходит резкое снижение перехода катионов в раствор
для фосфатов кальция и магния имеют три выражен-
при значительном увеличении концентрации фос-
ных участка: 3.0-4.5, 4.5-10.0, 10.0-12.0. Так, для
фат-ионов в растворе. Концентрация катионов Ca2+
фосфатов кальция и ФД-1 в интервале рН0 3.0-7.0 и
и фосфат-ионов в водных растворах при выдержи-
для образцов магнийаммоний фосфата и ФД-2 в ин-
вании гидрофосфата кальция, трикальцийфосфата
тервале рН0 3.0-9.0 значение равновесного рН выше
и гидроксиапатита в интервале рН0 4.5-12.0 прак-
рН0. В области рН0 9.0-12.0 равновесные значения
тически не изменяется и остается близкой к нулю
pH практически равны рН0 для всех изученных фос-
(рис. 2, а-г).
фатов (рис. 2, е).
Зависимости изменения молярного соотношения
Зависимость равновесных pH от рН0 характеризу-
Cat/PO43- от рН0 имеют сложный характер (рис. 2, д).
ет состояние поверхности сорбентов. Участок посто-
Можно выделить общие тенденции для всех фосфа-
янных равновесных значений pH в интервале рН0 4.5-
тов — максимальные значения Cat/PO43- в растворе с
10.0 соответствует рН точки нулевого заряда — pHтнз
рН0 3.0, плато для большинства образцов в интервале
[9], что важно учитывать при сорбции катионов
рН0 4.5-10.0 и снижение Cat/PO43- до нуля при рН0
металлов из растворов. По мере увеличения pHтнз
12.0. Зависимости изменения равновесного pH от рН0
исследуемые сорбенты образуют следующий ряд:
ФД-2 < MgNH4PO4 < ФД-1≤ CaHPO4 < Ca3(PO4)2 ≤ Ca10(PO4)6(OH)2.
(11)
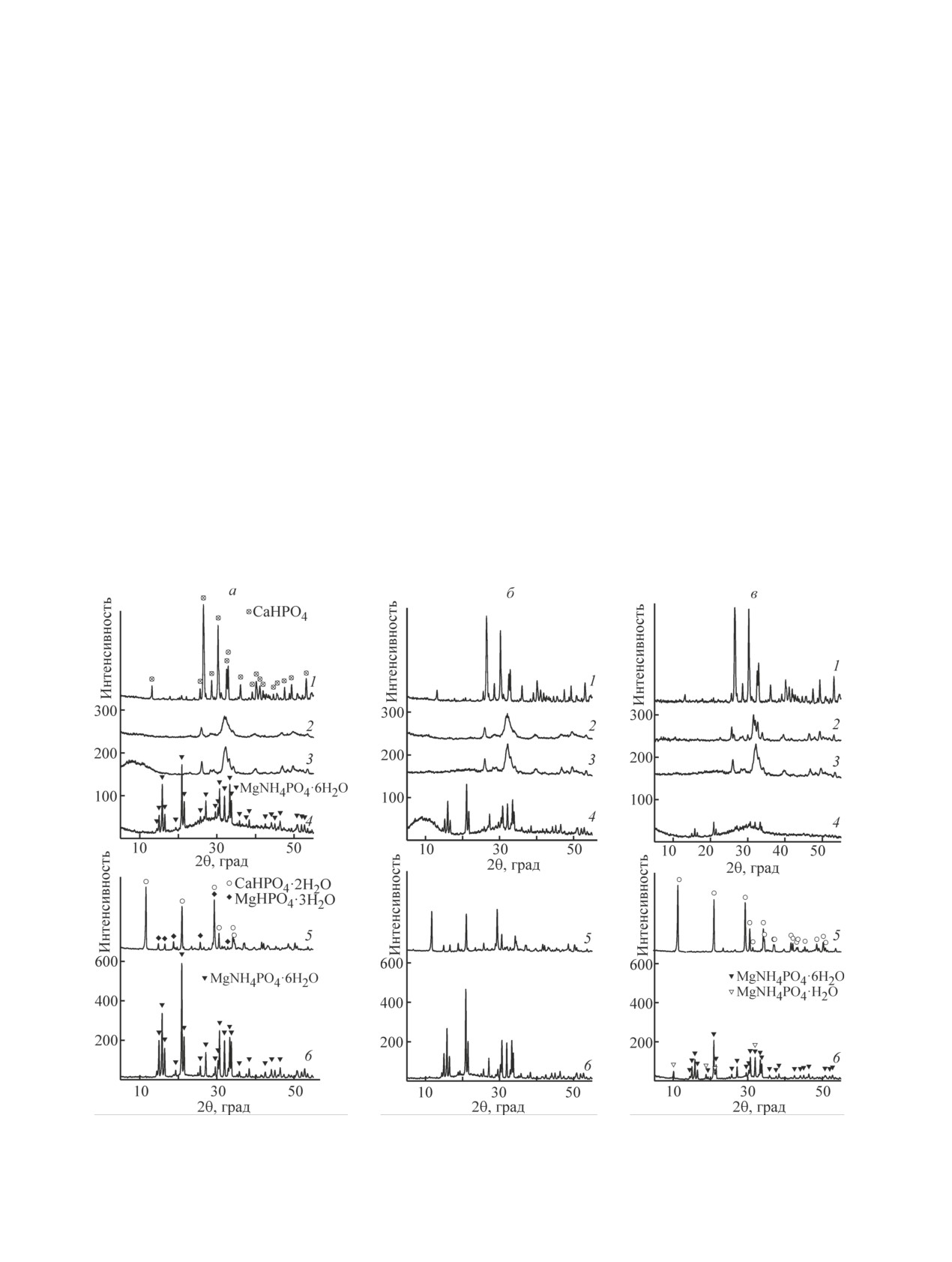
При контакте фосфатов кальция и магния с во-
основных дифракционных максимумов фосфатных
дой при рН0 3.0-4.5 их фазовый состав не меняется
образцов при рН 10.0. Существенное снижение кон-
(рис. 3, а). Наблюдается уменьшение интенсивности
центрации катионов в растворе для магнийаммоний
Рис. 3. Рентгенограммы CaHPO4·2H2O (1), Ca3(PO4)2 (2), Ca10(PO4)6(OH)2 (3), ФД-2 [Ca2.65Mg3(NH4)1.3(PO4)4(CO3)0.3×
×6H2O] (4), ФД-1 (Ca0.7Mg0.3HPO4∙2H2O) (5) и MgNH4PO4·6H2O (6) после выдерживания в дистиллированной воде
при рН 3.0 (а), 10.0 (б) и в 0.01 М CaCl2 (в).
608
Шашкова И. Л. и др.
фосфата может быть обусловлено образованием осад-
Увеличение концентрации фосфора и молярного
ка Mg(OH)2 по схеме
соотношения Ca2+/PO43- в растворе при рН 12.0 по
сравнению с исходным гидрофосфатом кальция об-
MgNH4PO4 + 2OH- → Mg(OH)2 + NH4+ + PO43-. (12) условлено образованием трикальцийфосфата (13) и
гидроксиапатита (14) (рис. 3, б):
3CaHPO4 + OH- → Ca3(PO4)2 + PO43- + 2H+ + Н2О,
(13)
10CaHPO4 + 2OH- → Ca10(PO4)6(ОН)2 + 4PO43- + 10H+.
(14)
Трикальцийфосфат в сильнощелочной среде
центрации ионов Ca2+ и увеличением концентрации
(рН0 12.0) превращается в термодинамически более
фосфат-ионов в растворе, а также данными рентгено-
стабильную фазу — Ca-дефицитный гидроксиапатит
фазового анализа (рис. 3, б). В результате гидролиза
состава Ca10-х(PO4)6-х(НРО4)х(ОH)2-х, где х = 0.64
ФД-2 при рН0 10.0 образуется слабоокристаллизован-
[схема (15)], что подтверждается уменьшением кон-
ная фаза Mg3(PO4)2·22H2O по схеме (16):
10Ca3(PO4)2 + 6OH- → 3Ca10(PO4)6(ОH)2 + 2PO43-,
(15)
3MgNH4PO4 + 3OH- → Mg3(PO4)2 + 3NH4ОН + PO43-.
(16)
В присутствии 0.01 М NaCl степень гидролиза
обратная зависимость из-за особенностей гидролиза,
гидрофосфата кальция, трикальцийфосфата и гидрок-
поскольку в отличие от фосфатов кальция гидролизу
сиапатита составляет менее 5%, что близко к значе-
подвергаются как анионы, так и катионы (рис. 4, а, б).
ниям степени гидролиза в дистиллированной воде
Степень гидролиза фосфатов кальция и магния в рас-
(рис. 4, а). При увеличении концентрации NaCl до
творах CaCl2 снижается по сравнению с гидролизом
1.0 моль·л-1 степень гидролиза всех фосфатов возрас-
в дистиллированной воде (рис. 4, в), что сопровожда-
тает в 1.5-2 раза, за исключением гидроксиапатита,
ется уменьшением pH раствора (рис. 4, г). Это обу-
степень гидролиза которого в присутствии катионов
словлено уменьшением растворимости фосфатов в
натрия в интервале концентраций 0.01-1.0 моль·л-1
растворе CaCl2, превращением гидрофосфата кальция
не изменяется. Гидролиз фосфатов кальция в раство-
в трикальцийфосфат (18), трикальцийфосфата и Са-
рах NaCl сопровождается небольшим уменьшением
дефицитного гидроксиапатита — в гидроксиапатит
pH растворов (рис. 4, б), что можно описать схемой
стехиометрического состава [(19), (20)]:
(17). Для Mg-содержащих сорбентов наблюдается
OPO3H2 + Na+ → OPO3Na- + 2H+,
(17)
2CaHPO4 + Ca2+ → Ca3(PO4)2 + 2H+,
(18)
3Ca3(PO4)2 + Са2+ + 2Н2О → Ca10(PO4)6(OH)2 + 2Н+,
(19)
Ca10-х(PO4)6-х(НРО4)х(ОH)2-х + хСа2+ + хН2О → Ca10(PO4)6(OH)2 + 2хН+.
(20)
Состав гидрофосфата кальция и гидроксиапатита
уменьшение интенсивности пиков магниаммоний
после выдерживания в растворе CaCl2 не изменяет-
фосфата наблюдается для данного фосфата и соот-
ся, а трикальцийфосфат частично превращается в
ветствующей примесной фазы в образце ФД-2, для
гидроксиапатит. ФД-1 после контакта с раствором
которого также проявляется широкий рефлекс, ха-
CaCl2 представлен только фазой CaHPO4·2H2O, при-
рактерный для трикальцийфосфата, при 2θ около 30°
чем с более интенсивными рефлексами гидрофосфата
(рис. 3, в) (22):
кальция, чем у исходного образца (21). Существенное
MgHPO4 + Ca2+ → CaHPO4 + Mg2+,
(21)
2MgNH4PO4 + 3Са2+ → Са3(PO4)2 + 2NH4+ + 2Mg2+ + 3H2O.
(22)
Кинетику гидролиза изучали для образцов ФД-1 и наибольшее практическое значение (рис. 5). Гидролиз
ФД-2, полученных из природного сырья и имеющих данных фосфатов протекает с высокой скоростью,
Особенности поведения сорбентов на основе фосфатов кальция и магния в воде и растворах электролитов
609
Рис. 4. Степени гидролиза по фосфат-ионам (а, в) и рН растворов (б, г) в присутствии электролитов NaCl (а, б) и
CaCl2 (в, г) для образцов фосфатов.
ГФК — CaHPO4·2H2O, ТКФ — Ca3(PO4)2, ГА — Ca10(PO4)6(OH)2, МАФ — MgNH4PO4·6H2O, ФД-1 —
Ca0.7Mg0.3HPO4∙2H2O, ФД-2 — Ca2.65Mg3(NH4)1.3(PO4)4(CO3)0.3·6H2O.
гидролитическое равновесие устанавливается в тече-
химических процессов на протяжении всего времени
ние 8 и 1 ч для образцов ФД-1 и ФД-2 соответственно
контакта ФД-1 и ФД-2 с водными растворами при ка-
(рис. 5, а, б). Изменение молярных соотношений
жущемся достижении гидролитического равновесия
Cat/PO43- (рис. 5, в) свидетельствует о протекании
(рис. 5, а -г).
Рис. 5. Степени гидролиза по катионам (Ca2+ + Mg2+) (а, б), фосфат-ионам (в, г), молярное соотношение Cat/PO43- в
растворе (д) и рН (е) для образцов ФД-1 (Ca0.7Mg0.3HPO4∙2H2O) и ФД-2 [Ca2.65Mg3(NH4)1.3(PO4)4(CO3)0.3·6H2O).
610
Шашкова И. Л. и др.
Рис. 5. Продолжение.
Выводы
претерпевают химических превращений в растворах
NaCl. В присутствии CaCl2 состав гидрофосфата
Изученные фосфаты кальция и магния характери-
кальция и гидроксиапатита не изменяется, трикаль-
зуются высокой гидролитической устойчивостью в
цийфосфат частично превращается в гидроксиапа-
области рН 4.5-10.0 и по гидролитической устойчиво-
тит, а Mg-содержащие фазы в образцах магнийаммо-
сти располагаются в ряд Ca10(PO4)6(OH)2 > CaHPO4 ≈
ний фосфата, ФД-1 (Ca0.7Mg0.3HPO4∙2H2O) и ФД-2
≈ Ca3(PO4)2 > ФД-2 [Ca2.65Mg3(NH4)1.3(PO4)4(CO3)0.3×
[Ca2.65Mg3(NH4)1.3(PO4)4(CO3)0.3·6H2O] — в фосфаты
×6H2O] > MgNH4PO4 > ФД-1 (Ca0.7Mg0.3HPO4∙2H2O).
кальция. Полученные результаты о поведении фос-
В сильнощелочной среде при рН 12.0 гидрофосфат
фатных сорбентов в водных растворах могут быть
кальция превращается в трикальцийфосфат и гидрок-
учтены при выборе оптимальных условий их при-
сиапатит, а трикальцийфосфат — в Ca-дефицитный
менения в процессах очистки водных сред от ионов
гидроксиапатит. При гидролизе данных фосфатов
тяжелых металлов и радионуклидов.
происходит нестехиометрическое выделение в рас-
твор катионов и фосфатного аниона (инконгруэнтное
Конфликт интересов
растворение) вследствие протекания процессов пере-
осаждения и комплексообразования на поверхности
Авторы заявляют об отсутствии конфликта инте-
сорбентов. Изученные фосфаты кальция и магния не ресов, требующего раскрытия в данной статье.
Особенности поведения сорбентов на основе фосфатов кальция и магния в воде и растворах электролитов
611
Информация об авторах
[8] Bengtsson Å., Shchukarev A., Persson P., Sjöberg S.
A solubility and surface complexation study of a
Шашкова Ирина Лукинична, к.х.н.,
non-stoichiometric hydroxyapatite // Geochim.
Cosmochim. Acta. 2009. V. 73. N 2. P. 257-267.
Китикова Наталья Владиленовна, к.х.н.,
[9] Kwon K.-Y., Wang E., Chung A., Chang N., Lee S.-W.
Иванец Андрей Иванович, д.х.н., доцент,
Effect of salinity on hydroxyapatite dissolution studied
by atomic force microscopy // J. Phys. Chem. C. 2009.
V. 113. N 9. P. 3369-3372.
Список литературы
[10] Shashkova I. L., Ratʹko A. I., Kitikova N. V. Removal of
[1] Carolin C. F., Kumar P. S., Saravanan A., Joshiba G. J.,
heavy metal ions from aqueous solutions by alkaline-
Naushad Mu. Efficient techniques for the removal of
earth metal phosphates // Colloid Surf. A. 1999.
toxic heavy metals from aquatic environment: A review
V. 160. N 3. P. 207-215.
// J. Environ. Chem. Eng. 2017. V. 5. N 3. P. 2782-2799.
[11] Иванец А. И., Китикова Н. В., Шашкова И. Л.,
[2] Singh N. B., Nagpal G., Agrawal S., Rachna. Water
Кульбицкая Л. В. Стабильность кальциевых и
purification by using adsorbents: A review // Environ.
магниевых фосфатных сорбентов в растворах
хлорида кальция и комплексообразующих реа-
org/10.1016/j.eti.2018.05.006
гентов // ЖПХ. 2015. Т. 88. № 2. С. 227-233
[3] Nzihou A., Sharrock P. Role of phosphate in the
[Ivanets A. I., Kitikova N. V., Shashkova I. L.,
remediation and reuse of heavy metal polluted wastes
Kulʹbitskaya L. V. Stability of calcium and magnesium
and sites // Waste Biomass Valor. 2010. V. 1. P. 163-
phosphate sorbents in solution of calcium chloride
and complexing agents // Russ. J. Appl. Chem. 2015.
[4] Ibrahim M., Labaki M., Giraudon J.-M., Lamonier J.-F.
V. 88. N 2. P. 232-238.
Hydroxyapatite, a multifunctional material for air, water
and soil pollution control: A review // J. Hazard. Mater.
[12] Ivanets A. I., Kitikova N. V., Shashkova I. L.,
2019. V. 383. ID 121139.
Oleksiienko O. V., Levchuk I., Sillanpää M. Using
of phosphatized dolomite for treatment of real mine
[5] Imam D. M., Moussa S. I., Attallah M. F. Sorption
water from metal ions // J. Water Proc. Eng. 2016.
behavior of some radionuclides using prepared
V. 9. P. 246-253.
adsorbent of hydroxyapatite from biomass waste
material // J. Radioanal. Nucl. Chem. 2019. V. 319.
[13] Mavropoulos E., Rossi A. M., da Rocha N. C. C.,
P. 997-1012.
Soares G. A., Moreira J. C., Moure G. T. Dissolution
of calcium-deficient hydroxyapatite synthesized at
[6] Smičiklas I., Onjia A., Raičevic S., Janackovic D.,
different conditions // Mater. Charact. 2003. V. 50.
Mitrić M. Factors influencing the removal of divalent
N 2-3. P. 203-207.
cations by hydroxyapatite // J. Hazard. Mater. 2008.
V. 152. P. 876-884.
[14] Dorozhkin S. V. Dissolution mechanism of calcium
apatites in acids: A review of literature // World
[7] Vinokurov S. E., Kulikova S. A., Myasoedov B. F.
Methodol. 2012. V. 2. N 1. P. 1-17.
Hydrolytic and thermal stability of magnesium
potassium phosphate compound for immobilization
of high level waste // J. Radioanal. Nucl. Chem. 2018.
V. 318. N 3. P. 2401-2405.