Журнал прикладной химии. 2021. Т. 94. Вып. 6
ФИЗИКО-ХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ СИСТЕМ И ПРОЦЕССОВ
УДК 669.4
ТЕРМОДИНАМИЧЕСКОЕ ОПИСАНИЕ ЖИДКИХ СПЛАВОВ
СИСТЕМЫ ЛИТИЙ-СВИНЕЦ
© А. Г. Морачевский, Е. Г. Фирсова
Санкт-Петербургский политехнический университет Петра Великого,
195251, г. Санкт-Петербург, ул. Политехническая, д. 29
E-mail: morachevski@mail.ru
Поступила в Редакцию 30 марта 2021 г.
После доработки 12 апреля 2021 г.
Принята к публикации 19 мая 2021 г.
Сплавы лития со свинцом представляют основной интерес в жидком состоянии, они служат объ-
ектом многочисленных исследований и описаний структурной упорядоченности в жидкой фазе, пер-
спективны для использования в жидкометаллических системах преобразования энергии, в ядерной
энергетике. В данной работе суммированы и анализируются результаты исследований термодина-
мических свойств жидких сплавов системы Li-Pb, выполненных различными методами за период с
1973 по 2018 г. Обработка всей совокупности экспериментальных данных позволила рекомендовать
значения термодинамических функций интервала составов, представляющих интерес для технологи-
ческих целей (0 ≤ xLi ≤ 0.50, с «шагом» 0.05). Результаты расчетов представлены в табличной форме
и описаны с помощью полиномов.
Ключевые слова: система литий-свинец; фазовая диаграмма; жидкие сплавы; термодинамические
свойства
DOI: 10.31857/S0044461821060013
В последние десять лет возобновился интерес к
разработке жидкометаллических батарей для стаци-
онарных накопителей энергии [1, 2]. В качестве анод-
ного материала в них предполагается использовать
литий, материал катода — сплавы на основе свинца.
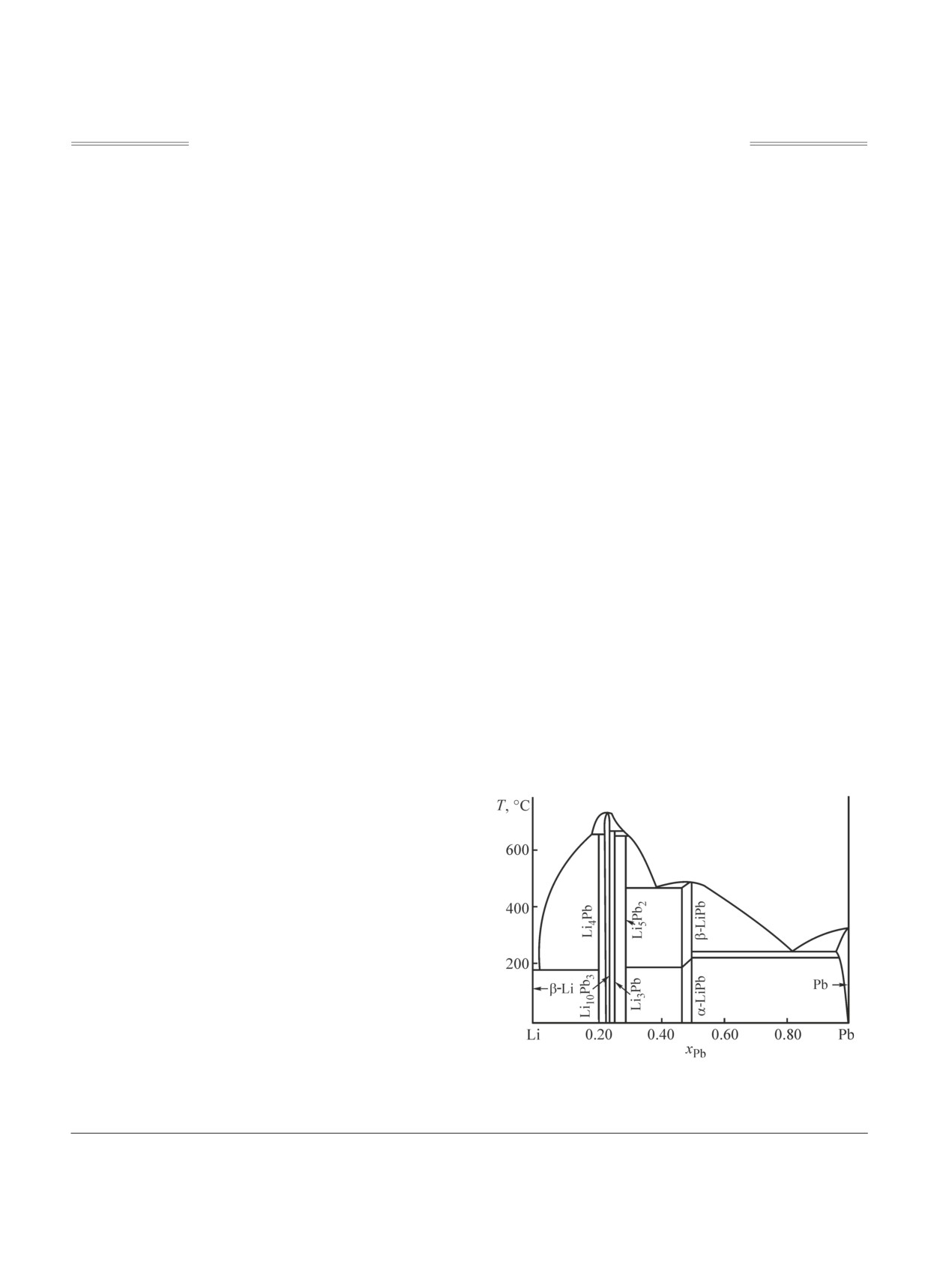
Литий и свинец образуют между собой ряд соеди-
нений, составы которых неоднократно уточнялись.
По данным [3], в системе образуются два соедине-
ния, плавящихся конгруэнтно: LiРb (т. пл. 755 K),
Li10Рb3 (т. пл. 1001 K). Три соединения: Li5Рb2,
Li3Рb и Li4Рb — плавятся с разложением. В богатой
свинцом области составов имеется относительно
легкоплавкая эвтектика (хLi = 0.157, 508 K) [3, 4].
Соединения Li10Рb3 и β-LiРb имеют области гомо-
генности (рис. 1).
В работе [5] при оптимизации термодинамических Рис. 1. Фазовая диаграмма системы литий-свинец (по
свойств системы Li-Рb методом СALРНAD, исходя
данным работы [3]).
683
684
Морачевский А. Г., Фирсова Е. Г.
из первых принципов, авторы после детального ана-
единением Li3Bi. Это исключает возможность полу-
лиза всех имеющихся в литературе структурных и
чать непосредственно в ходе эксперимента величину
кристаллографических исследований твердых фаз
dЕ/dT, измерения выполнены при четырех фиксиро-
приняли существование в системе Li-Рb несколь-
ванных температурах: 770, 812, 869 и 932 K. Значения
ко других по составу соединений: Li4Рb (Li22Рb5),
парциальной молярной энтропии смешения (∆SLi)
Li7Рb2, Li3Рb, Li5Рb2, LiРb. Авторы [5] учитывали
рассчитывались путем обработки методом наимень-
также имеющиеся в литературе сведения о структуре
ших квадратов данных лишь для четырех температур.
жидких фаз [6, 7].
В работе [19] результаты исследования представлены
Термодинамические свойства жидких сплавов си-
только в виде графиков, что не позволяет их исполь-
стемы Li-Рb изучались неоднократно различными ме-
зовать при оценке усредненных значений ЭДС.
тодами, первое исследование выполнено в 1973 г. [8],
В табл. 2 сопоставлены значения ЭДС цепи при
последнее из известных нам опубликовано в 2018 г. [9].
923 K, рассчитанные на основании эксперименталь-
Особенности применения различных методов иссле-
ных работ [8, 15, 16] и принятые с помощью различ-
дования термодинамических свойств жидких сплавов
ных приемов усреднения величины ЭДС для последу-
рассмотрены в целом ряде работ [10-13]. Специально
ющих расчетов термодинамических свойств жидких
термодинамическим свойствам жидких сплавов лития
сплавов системы Li-Рb.
посвящен обзор [14]. Основные исследования жидких
В соответствии с известными классификациями
сплавов лития со свинцом суммированы в табл. 1.
жидких сплавов Зауэрвальда, Дутчака, Васеды [12]
Для использования экспериментальных данных
сплавы лития со свинцом относятся к системам с вы-
при термодинамических расчетах технологического
раженным взаимодействием компонентов в жидком
характера выбрана температура 923 K (650°С), интер-
состоянии. Это подтверждается также результатами
вал составов 0.05 ≤ хLi ≤ 0.50 с «шагом» 0.05.
структурных исследований [6, 7]. Из числа термоди-
При изучении термодинамических свойств жид-
намических функций наиболее структурночувстви-
ких сплавов лития наиболее полное описание систе-
тельной является парциальная молярная энтропия
мы получено методом измерения электродвижущих
смешения. Ее отрицательные значения приводят к
сил (ЭДС) концентрационных цепей с расплавленным
отрицательным величинам интегральной энтропии
электролитом:
смешения в области образования наиболее проч-
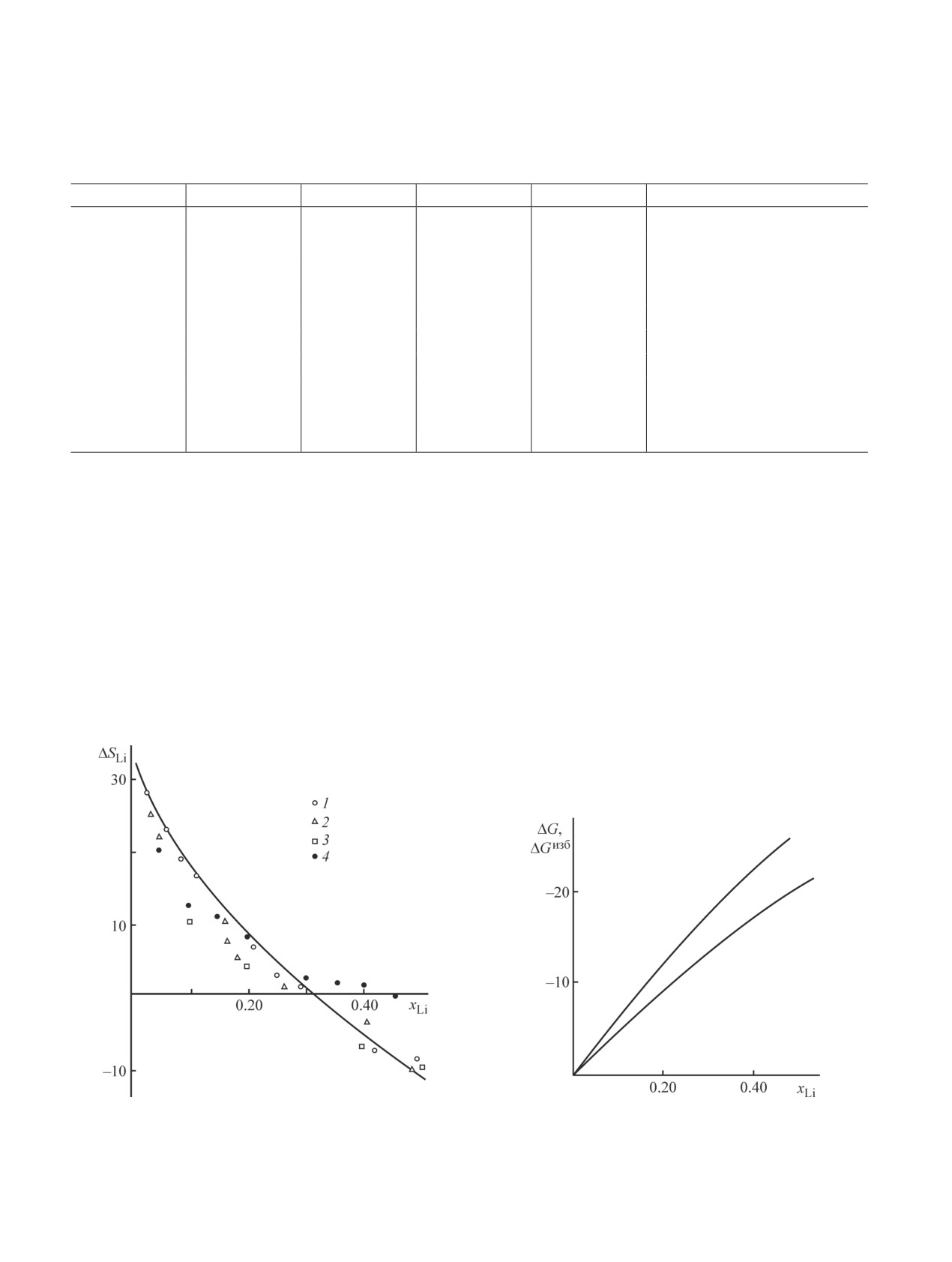
ных интерметаллических соединений. Как видно
│Расплавленный электролит│
из рис. 2, результаты определения ∆SLi в работе [20]
(-)Li
Li, Pb(+)
(1)
│LiF-LiCl, LiCl-KCl
│
этим условиям не удовлетворяют. Кроме того, полу-
ченные величины ЭДС имеют заметное систематиче-
Все выполненные методом ЭДС работы (табл. 1)
ское отклонение от данных других авторов (табл. 2).
охватывают необходимый интервал составов, но име-
При оценке средних значений ЭДС результаты работы
ют свои особенности. В работе [8] значения ЭДС
[20] во внимание не принимались. Среднее абсолют-
при 923 K приходится получать методом экстрапо-
ное отклонение данных работы [8] от принятых зна-
ляции. В работе [16] в качестве электрода сравнения
чений ЭДС составило 1.30%, работы [15] — 1.28%,
использовался не литий, а висмут, насыщенный со-
работы [16] — 0.47%.
Таблица 1
Сводка исследований термодинамических свойств жидких сплавов системы литий-свинец
Литературный
Метод
Область составов хLi
Температура, K
Год
источник
ЭДС
0.030-0.593
783-833
1973
[8]
ЭДС
0.038-0.908
783-1103
1976
[15]
ЭДС
0.0019-0.9492
770-932
1978
[16]
Калориметрия
0.0114-0.9689
1000
1979
[17]
Давление пара
0.050-0.950
700-900
1979
[18]
ЭДС
0.0-0.740
780-900
1981
[19]
ЭДС
0.025-0.965
775-975
2001
[20]
Калориметрия
0.0-1.0
817, 923, 1021, 1023
2018
[9]
Термодинамическое описание жидких сплавов системы литий-свинец
685
Таблица 2
Величины ЭДС цепи (1) по данным различных исследований при температуре 923 K (В)
хLi
[8]
[15]
[16]
[20]
Принятое значение *
0.05
0.730
0.720
0.724
0.761
0.724
0.10
0.670
0.652
0.655
0.679
0.659
0.15
0.624
0.604
0.615
0.629
0.614
0.20
0.595
0.568
0.582
0.598
0.582
0.25
0.556
0.539
0.548
0.567
0.548
0.30
0.520
0.514
0.520
0.537
0.519
0.35
0.485
0.488
0.490
0.508
0.488
0.40
0.452
0.460
0.458
0.479
0.459
0.45
0.420
0.436
0.426
0.450
0.427
0.50
0.396
0.410
0.398
0.418
0.401
* По данным работ [8, 15, 16].
Анализ экспериментальных данных работы [19],
мы Li-Рb при 923 K в соответствии с указанными в
в которой исследование термодинамических свойств
табл. 2 усредненными значениями ЭДС. Графически
жидких сплавов системы Li-Рb проводилось мето-
зависимость ∆Gизб и ∆G от состава сплава при 923 K
дом ЭДС при температурах 800 и 900 K, ставит под
представлена на рис. 3.
сомнение возможность столь глубокого локального
Зависимость ∆Gизб = f(хLi) может быть описана
минимума на кривой ∆SLi = f(хLi). Следует с большой
с помощью уравнения Редлиха-Кистера различной
осторожностью подходить к оценке парциальной
степени с использованием безразмерной Q-функции
молярной энтропии компонента на границе области
(Q = ∆Gизб/RT) [12].
гетерогенности и внутри ее.
Q = x(1 - x)[b + c(2x - 1) + d(2x - 1)2],
(2)
В табл. 3 приведены парциальные и интегральные
молярные характеристики жидких сплавов систе- Q = x(1 - x)[b + c(2x - 1) + d(2x - 1)2 + e(2x - 1)3], (3)
Q = x(1 - x)[b + c(2x - 1) + d(2x - 1)2 +
+ e(2x - 1)3 + f(2x - 1)4].
(4)
Рис. 2. Зависимость парциальной молярной энтропии
Рис. 3. Зависимость интегральных молярных энергии
лития (∆SLi, Дж·моль-1·K-1) от состава сплава при 923 K
Гиббса и избыточной энергии Гиббса от состава сплава
по данным различных исследований: 1 — [8], 2 — [15],
Li-Рb при 923 K, рассчитанных из усредненных значе-
3 — [16], 4 — [20].
ний ЭДС: 1 — ∆G, 2 — ∆Gизб (кДж·моль-1).
686
Морачевский А. Г., Фирсова Е. Г.
Таблица 3
Термодинамические свойства жидких сплавов системы Li-Рb при 923 K (все величины в кДж·моль-1)
хLi
-∆GLi
-∆GизбLi
-∆G
-∆Gизб
0.05
69.91
46.94
3.89
2.43
0.10
63.59
45.90
7.25
4.75
0.15
59.29
44.73
10.24
7.01
0.20
56.12
43.78
13.01
9.17
0.25
52.84
42.21
15.62
11.28
0.30
50.07
40.82
17.98
13.29
0.35
47.06
39.01
20.14
15.17
0.40
44.27
37.23
22.08
16.91
0.45
41.23
35.11
23.79
18.51
0.50
38.73
33.41
25.20
19.88
Таблица 4
Параметры уравнений (2)-(4) для системы литий-свинец при 923 K
Параметры уравнения
Уравнение
b
c
d
e
f
(2)
-10.336812
-6.230273
-2.423839
—
—
(3)
-10.349447
-6.541102
-3.543058
-0.986443
—
(4)
-10.357933
-7.011765
-6.639899
-7.296577
-3.940938
В данном случае х = хLi. Параметры уравнений
lnγLi = f(хLi), ∆GизбLi = f(хLi), lnγLi = f(1 - хLi)2. При об-
(2)-(4) приведены в табл. 4.
работке экспериментальных данных с применением
Коэффициент корреляции (R2) высокий: 0.999760
полиномов Редлиха-Кистера необходимость в экс-
(2), 0.999984 (3) и 0.999993 (4). Экспериментальные
траполяции кривых отпадает. Величина lnγ∞Li может
и расчетные значения безразмерного параметра Q
быть рассчитана с помощью следующих уравнений:
сопоставлены в табл. 5.
lnγ∞Li = b - c + d,
(5)
Важной в технологическом отношении и для об-
щей характеристики отклонений от идеального пове-
lnγ∞Li = b - c + d - e,
(6)
дения является величина предельного коэффициента
lnγ∞Li = b - c + d - e + f.
(7)
активности лития в жидком свинце [21]. Эта величи-
на на основании экспериментальных данных может
Расчет lnγ∞Li приводит к близким результатам:
быть получена экстраполяцией до хLi = 0 кривых
-6.5304 (5), -6.3650 (6), -6.6304 (7). Среднее значение
Таблица 5
Сопоставление экспериментального (Qэкс) и расчетных значений параметра Q по уравнениям (2)-(4) в системе
литий-свинец при 923 K
Q по уравнению
хLi
Qэкс
(2)
(3)
(4)
0.10
-0.6190
-0.6214
-0.6191
-0.6189
0.20
-1.1950
-1.1970
-1.1980
-1.1961
0.30
-1.7319
-1.7288
-1.7297
-1.7323
0.40
-2.2036
-2.2051
-2.2020
-2.2006
0.50
-2.5906
-2.5842
-2.5873
-2.5895
Термодинамическое описание жидких сплавов системы литий-свинец
687
lnγ∞Li = -6.5086, γ∞Li = 0.00149. Некоторый разброс
значений lnγ∞Li, по нашим наблюдениям, связан с
тем, что в системах с сильным взаимодействием ком-
понентов в области сильноразбавленных растворов
(0 < х < 0.05) величина Q практически линейно за-
висит от состава, описание этой области с помощью
полиномиальных зависимостей затруднительно.
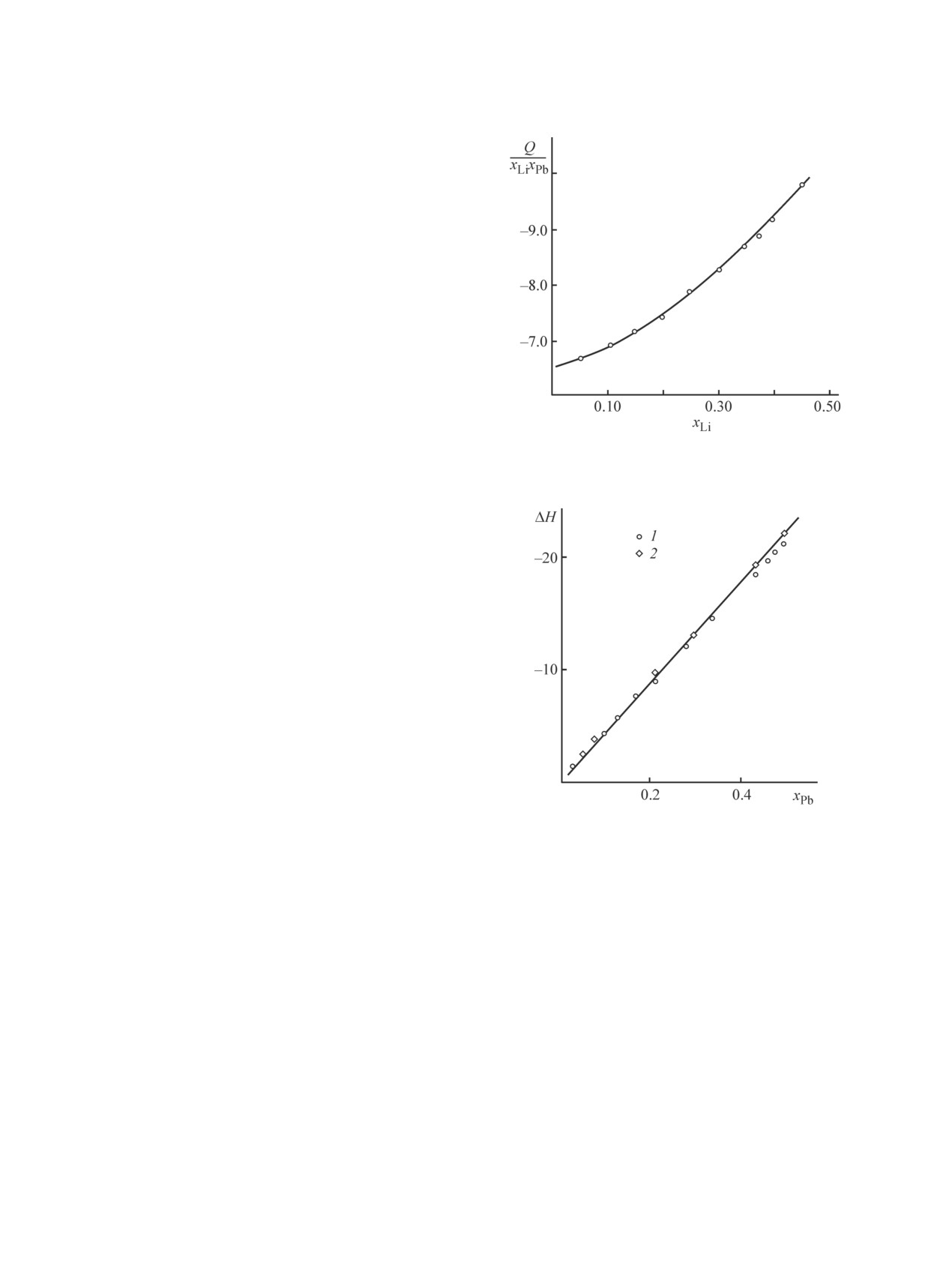
Экстраполяция функции вида (Q/хLiхPb) = f(хLi) до
хLi = 0 представлена на рис. 4. При хLi = 0 величина
lnγ∞Li оказывается paвной -6.48, γ∞Li = 0.00153, что
хорошо согласуется с указанным выше средним зна-
чением lnγ∞Li.
Вычисленные из первых принципов значения ак-
тивности лития в жидких сплавах со свинцом [5]
вполне согласуются с данными экспериментальных
исследований [8, 15, 16, 20] в интервале температур
Рис. 4. Зависимость безразмерной функции Q/хLixPb от
750-850 K.
состава сплава при 923 K.
Рассмотрим имеющиеся сведения об энтальпии
смешения жидких сплавов системы литий-свинец.
Подробное калориметрическое исследование при
1000 K представлено в работе [17]. Экстремум кри-
вой ∆H = f(хLi) лежит при хPb = 0.22. Полученные
значения ∆H хорошо согласуются с данными работы
[8] (рис. 5) и других исследований, выполненных
методом ЭДС [15, 16]. На основании формы кривой
d∆H/dхPb = f(хPb) авторы [17] делают вывод об образо-
вании в жидкой фазе ассоциатов Li7Pb2. Имеющиеся
в литературе сведения о теплоемкости жидких спла-
вов системы Li-Pb и об энтальпиях плавления соеди-
нений Li7Pb2 и LiPb рассмотрены в работе [12].
В работе [9] термодинамические свойства жидких
сплавов системы Li-Pb изучались калориметриче-
ским методом во всем интервале составов при тем-
пературах 817, 923, 1021, 1023 K. На основании полу-
ченных значений энтальпии смешения при различных
Рис. 5. Зависимость энтальпии смешения
(∆Н,
кДж·моль-1) от состава сплава Li-Рb по калориметри-
температурах рассчитаны парциальные молярные
ческим данным (1000 K, [17]) и рассчитанной из изме-
избыточные энергия Гиббса и энтропия смешения
рений ЭДС (800 K, [8]): 1 — [17], 2 — [8].
при 1073 K. Вычисленные из калориметрических
измерений значения парциальной молярной избы-
точной энергии Гиббса и коэффициента активности
[12, 22-24]. Упомянем только некоторые исследова-
лития близки к усредненным из измерений ЭДС при
ния более позднего времени.
923 K (табл. 6).
Большое внимание в ряде работ уделяется изуче-
Расхождения между значениями ∆GизбLi, рассчи-
нию разнообразных свойств эвтектической смеси в
танными из измерений ЭДС и из калориметрических
богатой свинцом области составов в жидком состоя-
данных [9], не носят систематического характера
нии [25-28]. С использованием модели молекулярной
и лежат в пределах от 0.9 до 2.4%. Коэффициент
динамики в работах [26, 27] оцениваются некоторые
активности лития при бесконечном разбавлении, вы-
термодинамические характеристики чистых компо-
численный из калориметрических данных [21], равен:
нентов и сплавов лития со свинцом. Особый интерес
lnγ∞Li = -6.334, γ∞Li = 0.00178 (923 K).
в этом отношении представляет обзор [28] (43 ссылки
Структурные особенности жидких сплавов систе-
на работы разных лет), в котором суммируются сведе-
мы Li-Pb, физико-химические и другие свойства их
ния об исследованиях свойств эвтектического сплава
подтверждающие, подробно рассмотрены в работах
в системе Li-Рb (15.7-17.0 ат% Li): плотность, удель-
688
Морачевский А. Г., Фирсова Е. Г.
Таблица 6
Сопоставление принятых величин на основании измерений ЭДС и рассчитанных из калориметрических
измерений [9] (923 K)
-∆GизбLi, кДж·моль-1
-lnγLi
хLi
ЭДС
[9]
ЭДС
[9]
0.10
45.90
46.83
5.981
6.102
0.20
43.78
44.68
5.705
5.822
0.30
40.82
41.83
5.319
5.451
0.40
37.23
37.90
4.851
4.939
0.50
33.41
33.10
4.354
4.313
ная теплоемкость, теплопроводимость, динамическая
личины ∆GLi вполне удовлетворительно согласуются
вязкость, объемный коэффициент термического рас-
с результатами работы [8].
ширения, поверхностное натяжение, электрическое
сопротивление, давление пара.
Выводы
В заключительной части сообщения укажем ра-
Математическая обработка всей совокупности
боты, в которых исследовался процесс сплавообра-
опубликованных работ, содержащих исследования
зования при выделении лития на жидком свинцовом
термодинамических свойств жидких сплавов лития
катоде [29, 30]. Потенциал выделения лития из рас-
со свинцом, позволила рекомендовать набор термо-
плавленного электролита LiCl-KCl эвтектического
динамических характеристик системы при 923 K в
состава при плотности тока 0.1А·см-2 и температуре
интервале составов 0.05 ≤ хLi ≤ 0.50 с «шагом» 0.05.
673 K равен 0.64 В относительно литиевого электрода
Рекомендуемые величины описаны с применением
сравнения. Предельная плотность тока значительно
полинома Редлиха-Кистера различных степеней.
зависит от условий эксперимента, она может дости-
гать 4 А·см-2 [29].
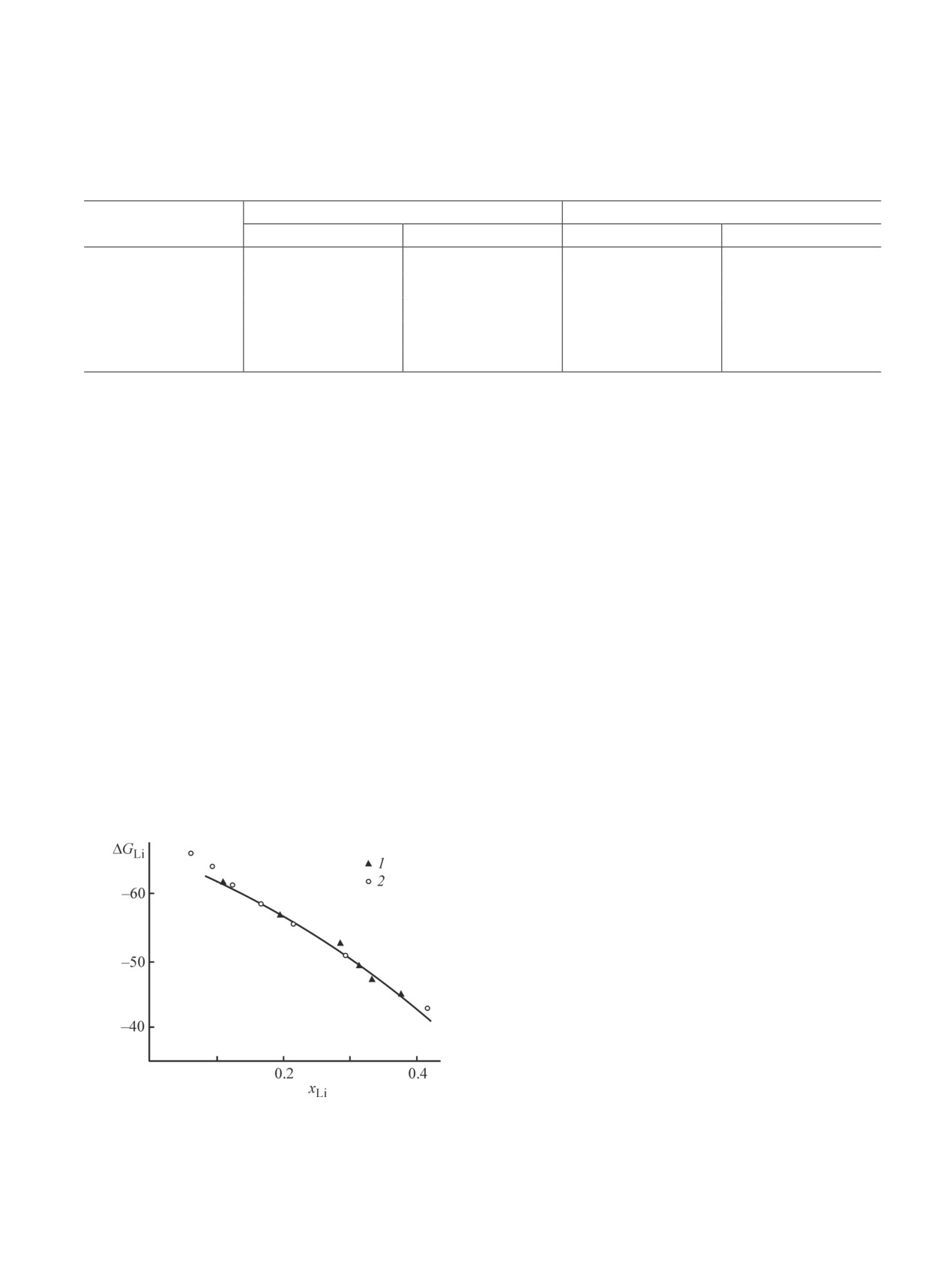
Авалиани с соавторами [30] на основании измере-
Конфликт интересов
ния потенциалов выделения лития из расплавленного
электролита LiCl-KCl при 773 K на жидких катодах-
А. Г. Морачевский заявляет, что он является
сплавах Li-Рb (0.107 ≤ хLi ≤ 0.375) рассчитаны тер-
членом редколлегии Журнала прикладной химии.
модинамические характеристики исходных сплавов
Авторы заявляют об отсутствии конфликта интере-
(∆GLi, αLi , γLi). Как видно из рис. 6, полученные ве-
сов, требующего раскрытия в данной статье.
Информация об авторах
Морачевский Андрей Георгиевич, д.т.н., проф.,
Фирсова Елена Германовна, к.т.н., доцент,
Список литературы
[1] Kim H., Boysen D. A., Newhouse J. M., Spatocco B. L.,
Chung B., Burke P. J., Bradwell D. J., Jiang K.,
Tomaszowska A. A., Wang K., Wei W., Ortiz L. A.,
Barrida S. A., Poizeau S. M., Sadoway D. R. Liquid
metal batteries: Fast, present, and future // Chem. Rev.
Рис. 6. Парциальная молярная энергия Гиббса лития
2013. V. 138. P. 2075-2093.
(∆GLi, 773 K, кДж·моль-1) по данным поляризацион-
ных измерений [31] и рассчитанная из измерений ЭДС
[2] Wang K., Jiang K., Chung B., Ouchi T., Burke P. J.,
(800 K, [8]): 1 — [30], 2 — [8].
Boysen D. A., Bradwell D. J., Kim H., Muecke U.,
Термодинамическое описание жидких сплавов системы литий-свинец
689
Sadoway D. R. Lithium-antimony-lead liquid metal
[18] Neubert A. Thermodynamic study of solid and liquid
battery for grid-level energy storage // Nature. 2014.
lithium-lead alloys using Knudsen-effusion mass
V. 514. N 7522. P. 348-350.
spectrometry // J. Chem. Thermodyn. 1979. V. 11.
N 10. P. 971-977.
[3] Okamoto H. Li-Pb (Lithium-Lead) // J. Phase
[19] Becker W., Schwitzgebel G., Ruppersberg H.
Equlibria. 1993. V. 14. N 6. P. 770.
Thermodynamic investigations of liquid Li-Pb and Li-
[4] Hubberstey P., Sample T., Barker M. G. Is Pb-17Li
Ag-alloys — a comparative study // Z. Metallkunde.
really the eutectic alloy? A determination of the lead-
1981. Bd 7. N 3. S. 186-190.
rich section of the Pb-Li phase diagram (0.0 ≤ хLi ≤
[20] Gasior W., Moser Z. Thermodynamic study of liquid
≤ 0.221) // J. Nucl. Mater. 1992. V. 191-194. P. 283-287.
lithium-lead alloys using the EMF method // J. Nucl.
[5] Zhou C., Guo C., Li C., Du Z. Thermodynamic
Mater. 2001. V. 294. P. 77-83.
optimization of the Pb-Li system aided by first-
principles calculations // J. Nucl. Mater. 2016. V. 477.
[21] Морачевский А. Г. Термодинамические свойства
P. 95-101.
разбавленных растворов различных элементов в
жидком свинце // ЖПХ. 2014. Т. 87. № 12. С. 1697-
[6] Ruppersberg H., Egger H. Short-range order in liquid
1718 [Morachevskii A. G. Thermodynamic properties
Li-Pb alloys // J. Chem. Phys. 1975. V. 63. P. 4095-
of dilute solutions of various elements in liquid lead //
4103.
Russ. J. Appl. Chem. 2014. V. 87. N 12. P. 1783-1803.
[7] Ruppersberg H., Schirmacher W. Ordering potential
in liquid Li4Pb and Li7Ag calculated from neutron
[22] Белащенко Д. К. Структура жидких и аморфных
diffraction data // J. Phys. F: Met. Phys. 1984. V. 14.
металлов. М.: Металлургия, 1985. 192 с.
P. 2787-2795.
[23] Морачевский А. Г., Козин Л. Ф. Термодинамика
[8] Демидов А. И., Морачевский А. Г., Герасимен-
ассоциированных расплавов // Термодинамика и
ко Л. Н. Термодинамические свойства жидких
материаловедение полупроводников / Под ред.
сплавов системы литий-свинец // Электрохимия.
В. М. Глазова. М.: Металлургия, 1992. С. 53-74.
1973. Т. 9. С. 848-851.
[24] Saboungi M.-L., Geerstma W., Price D. L. Ordering
[9] Terliсka S., Debski A., Gasior W. Thermodynamic
in liquid alloys // Ann. Rev. Phys. Chem. 1990. V. 41.
properties of Li-Pb system // J. Mol. Liq. 2018.
P. 207-244.
V. 249. P. 66-72.
[25] Mas de les Vall E. Lead-lithium eutectic material
database for nuclear fusion technology // J. Nucl.
[10] Komarek K. L. Experimental techniques in high
Mater. 2008. V. 376. P. 353-357.
temperature thermodynamics // Pure Appl. Chem.
1992. V. 64. N 1. P. 93-102.
[26] Fraile A., Cuesta-Lopez S., Perlado J. M. Molecular
[11] Морачевский А. Г., Воронин Г. Ф., Гейдерих В. A.,
dinamics simulations of lead and lithium in liquid
Куценок И. Б. Электрохимические методы иссле-
phase // Trans. Fusion Sci. Technol. 2012. V. 61.
дования в термодинамике металлических систем.
January. P. 77-82.
М.: ИКЦ «Академкнига», 2003. 334 с.
[12] Морачевский А. Г., Фирсова Е. Г. Термодинамика
[27] Gan X., Xiao S., Deng H., Wang B., Sun X., Li X.,
жидких металлов и сплавов. СПб: Лань, 2016. 240 с.
Hu W. Thermodynamic properties of Li, Pb, Li17Pb83
[13] Sommer F. Modern methods in high temperature
with molecular dynamics simulations // Fusion Eng.
calorimetry // J. Thermal Analysis. 1988. V. 33. N 1.
Design. 2014. V. 89. P. 2946-2952.
P. 15-28.
[14] Морачевский А. Г., Демидов А. И. Термодинами-
[28] Martelli D., Venturini A., Utili M. Literature review of
ческие свойства жидких сплавов лития // ЖФХ.
lead-lithium thermophysical properties // Fusion Eng.
1983. Т. 57. № 9. C. 2113-2128.
Design. 2019. V. 138. P. 183-195.
[15] Яценко С. П., Салтыкова Е. А. Термодинамические
свойства жидких сплавов системы литий-свинец //
[29] Темногорова H. B., Демидов А. И., Морачевский А. Г.
ЖФХ. 1976. Т. 50. № 8. C. 2129-2130.
Исследование процесса выделения лития на жид-
[16] Saboungi M.-L., Marr J., Blander M. Thermodynamic
ких металлических катодах // Изв. вузов. Цв. ме-
properties of quasi-ionic alloy from electromotive
таллургия. 1979. № 3. С. 89-96.
force measurements: The Li-Pb system // J. Chem.
[30] Авалиани А. Ш., Кипиани Г. Н., Миндин В. Ю.,
Phys. 1978. V. 68. N 4. P. 1375-1384.
Шулая Л. Н. Определение термодинамических
[17] Predel B., Oehme G. Kalorimetrische Untersuchung
свойств жидких сплавов лития из поляризацион-
flussiger Lithium-Blei-Legierungen // Z. Metallkunde.
ных измерений // ЖПХ. 1988. Т. 61. № 2. С. 401-
1979. Bd 70. N 7. S. 450-453.
402.