Новый подход к синтезу диэтил-2,3-диизобутилсукцината...
699
Журнал прикладной химии. 2021. Т. 94. Вып. 6
УДК 547.461.4 + 544.478
НОВЫЙ ПОДХОД К СИНТЕЗУ ДИЭТИЛ-2,3-ДИИЗОБУТИЛСУКЦИНАТА —
КОМПОНЕНТА ТИТАН-МАГНИЕВЫХ КАТАЛИЗАТОРОВ ПОЛИМЕРИЗАЦИИ
ПРОПИЛЕНА
© И. В. Нечепуренко1, И. Я. Майнагашев 1, А. А. Барабанов2, С. А. Сергеев2,
Г. Д. Букатов2, В. А. Захаров2, М. А. Мацько2, К. П. Волчо1, Н. Ф. Салахутдинов1
1 Новосибирский институт органической химии им. Н. Н. Ворожцова СО РАН,
630090, г. Новосибирск, пр. Академика Лаврентьева, д. 9
2 Федеральный исследовательский центр «Институт катализа им. Г. К. Борескова СО РАН»,
630090, г. Новосибирск, пр. Академика Лаврентьева, д. 5
E-mail: niv@nioch.nsc.ru
Поступила в Редакцию 24 ноября 2020 г.
После доработки 20 мая 2021 г.
Принята к публикации 25 мая 2021 г.
Разработан способ синтеза 2,3-диалкил-замещенных сукцинатов конденсацией диэфира янтарной
кислоты с двумя молекулами изомасляного альдегида с последующими этерификацией и гидрирова-
нием суммы диенов. С использованием этого способа синтезирован диэтил-2,3-диизобутилсукцинат
с хорошим выходом и степенью чистоты 75-99%. Показано, что при использовании полученного
диэтил-2,3-диизобутилсукцината в качестве стереорегулирующего компонента титан-магниевых
катализаторов может быть синтезирован полипропилен с широким молекулярно-массовым распре-
делением. При этом оптимальные характеристики, позволяющие получать полипропилен с высоким
выходом и индексом изотактичности, имеют катализаторы, приготовленные с использованием
диэтил-2,3-диизобутилсукцината с чистотой >95%.
Ключевые слова: титан-магниевые катализаторы; диэтил-2,3-диизобутилсукцинат; реакция Штоб-
бе; электронодонорные стереорегулирующие соединения; полимеризация пропилена
DOI: 10.31857/S0044461821060037
В настоящее время практически весь стереорегу-
сокую степень стереорегулярности (индекс изотак-
лярный изотактический полипропилен производится
тичности более 95%) и широкое молекулярно-мас-
с использованием высокоэффективных титан-магни-
совое распределение (величина полидисперсности
евых катализаторов. Одним из важнейших компо-
Mw/Mn = 5-9) [2]. Сукцинаты были одними из пер-
нентов этих катализаторов, определяющих свойства
вых соединений, позволивших получать полимеры
полимера, являются электронодонорные соединения
с широким молекулярно-массовым распределени-
различного состава. Эти соединения обеспечивают
ем, поэтому катализаторы, содержащие сукцинаты,
высокую стереоспецифичность катализатора, а также
некоторые авторы выделяют в отдельное, шестое
определяют молекулярно-массовое распределение, и,
поколение титан-магниевых катализаторов для по-
как следствие, область применения получаемого на
лимеризации пропилена [1, 4]. В широком ряду
этом катализаторе полимера [1].
2,3-диалкил-замещенных сукцинатов в качестве
Одним из таких классов электронодонорных соеди-
внутреннего донора наиболее часто используется
нений являются 2,3-диалкил-замещенные эфиры ян-
диэтил-2,3-диизопропилсукцинат [4-6], но в патент-
тарной кислоты (сукцинаты) [2, 3]. Титан-магниевые
ной литературе встречается и упоминание о диэ-
катализаторы, содержащие эти соединения, позволяют
тил-2,3-диизобутилсукцинате как эффективном вну-
получать необходимые для промышленности марки
треннем доноре для производства полипропилена с
полипропилена (например, трубные), имеющие вы-
широким молекулярно-массовым распределением [3].
700
Нечепуренко И. В. и др.
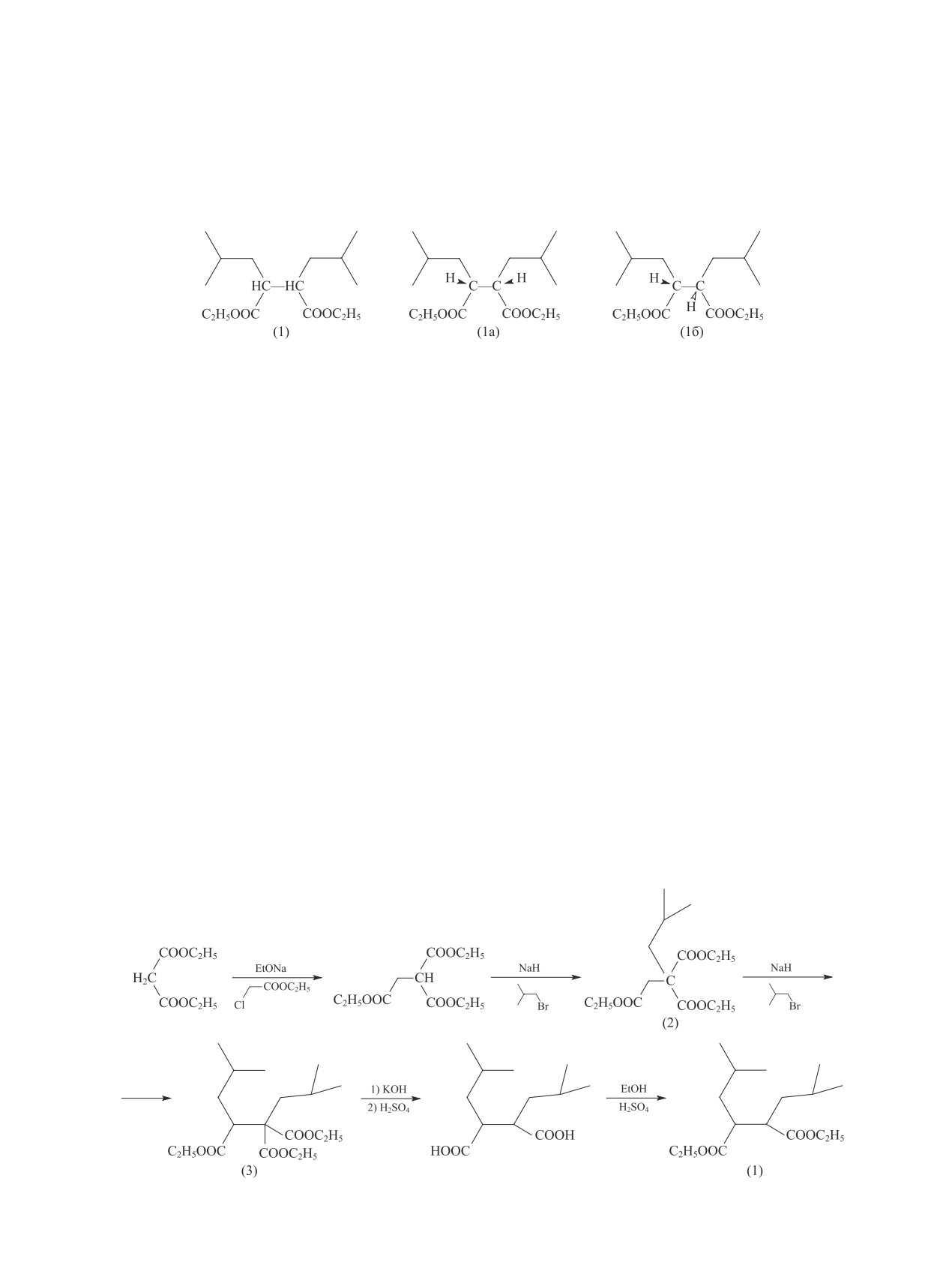
Диэтил-2,3-диизобутилсукцинат (1) обладает дву-
оптически неактивного сорбента будут определены
мя стереоцентрами и способен существовать в виде
только две формы соединения (1): анти- (или эри-
четырех изомеров, но при анализе, например, методом
тро-), условно отображаемая формулой (1а), и син-
газожидкостной хроматографии с использованием
(или трео-), условно отображаемая формулой (1б).
В настоящее время в литературе не описано об-
гостадийный синтез соединения (1) из простых и
щего способа синтеза 2,3-диалкил-замещенных сук-
доступных реагентов, включающий алкилирование
цинатов. Имеются сведения о возможности введения
малонового эфира галогенацетатом с последующими
метильного, этильного или бензильного замести-
двумя последовательными алкилированиями гало-
телей действием на диэтилсукцинат диизопропил-
геналкилами, гидролизом, декарбоксилированием и
амидом лития (два эквивалента) и соответствующим
этерификацией (схема 1), предложенный в работе [3].
алкилгалогенидом [7]. Соединение (1) может быть
Однако, руководствуясь схемой, предложенной
получено с выходом 37% взаимодействием димети-
в патенте [3], мы смогли воспроизвести только две
лового эфира фумаровой кислоты с изобутильным
первые стадии процесса и синтезировать изобутил-
радикалом, генерируемым при анодном окислении
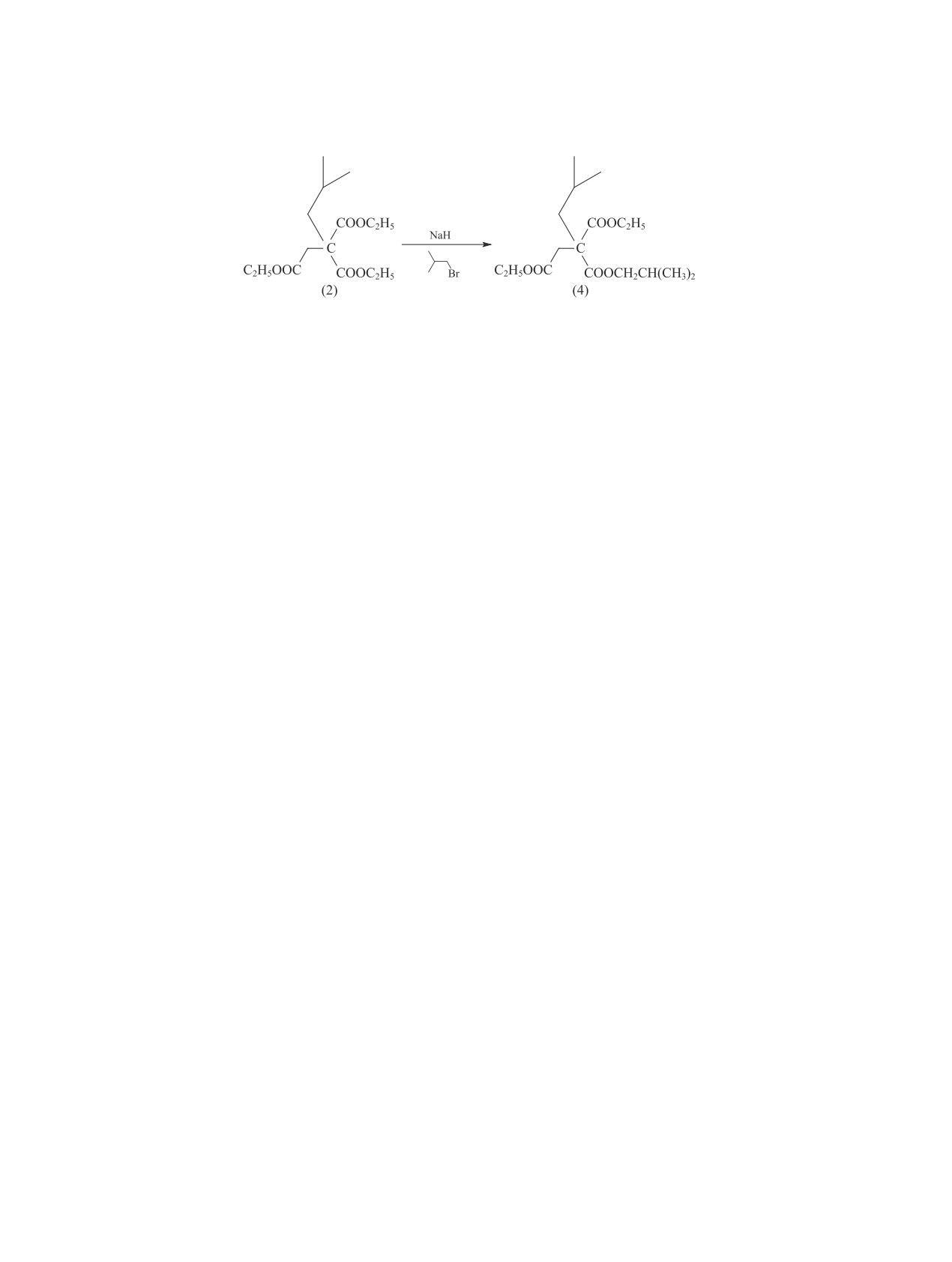
триэфир (2), тогда как третья стадия, проводимая по
натриевой соли изовалериановой кислоты [8], или
методике [3], вместо ожидаемого диизобутилпроизво-
реакцией этилового эфира изокапроновой кислоты с
дного (3) приводит к образованию смеси исходного
диизопропиламидом лития при -78°С с последующей
изобутилтриэфира (2) и его изобутилового эфира (4)
димеризацией под действием TiCl4 с выходом 84%
(cхема 2) в близком соотношении, что, очевидно,
[9]. Эти способы синтеза соединения (1) обладают
связано с пониженной С—Н кислотностью реакци-
значительными недостатками, которые заключаются
онного центра в изобутилтриэфире (2). Независимое
в использовании дорогостоящих реагентов (бутилли-
описание успешного применения этой последователь-
тий, диизопропиламид лития), или глубокого охлаж-
ности для синтеза соединения (1) в литературе также
дения и инертной атмосферы, или сложного обору-
отсутствует. Следовательно, данная последователь-
дования, необходимого для проведения электролиза,
ность реакций или не позволяет получить заявленный
и, как правило, приводят к получению соединения
продукт (1), или отличается низкой воспроизводимо-
(1) с невысоким выходом. Более перспективным, с
стью, что делает ее неприменимой для практического
технологической точки зрения, представляется мно-
использования.
Схема 1
Новый подход к синтезу диэтил-2,3-диизобутилсукцината...
701
Схема 2
Цель исследования — разработка способа синтеза
спектрометре Bruker AV-400. В качестве внутрен-
диэтил-2,3-диизобутилсукцината (1), позволяющего
него стандарта использовали сигналы растворителя
получать продукт с высокой чистотой и не требую-
(δН 7.24 и δС 76.90 м. д.).
щего использования сложного химического оборудо-
Синтез 1-изобутил-1,2-диэтил-4-метилпен-
вания и высокоопасных реактивов. Еще одной целью
тан-1,1,2-трикарбоксилата (4). Суспензию 64 мг
работы было определение степени чистоты соедине-
(1.61 ммоль) NaH в масле (60%) промывали 2 раза
ния (1), необходимой и достаточной для приготовле-
гексаном по 5 мл, декантировали, остатки растворите-
ния высокоактивного титан-магниевого катализатора
ля отгоняли на роторном испарителе. Добавляли 1 мл
для получения стереорегулярного полипропилена.
ДМФА, колбу заполняли аргоном. При комнатной
температуре и перемешивании прибавляли по каплям
324 мг (1.07 ммоль) триэтил-1-изобутилэтан-1,1,2-
Экспериментальная часть
трикарбоксилата (2), синтезированного по методике
Для синтезов использовали без дополнительной
[3], перемешивали 30 мин при комнатной температу-
очистки продажные реактивы компании Alfa Aesar —
ре. Прибавляли по каплям 220 мг (1.61 ммоль) изо-
изобутилбромид, 98%; L-лейцин, 99%; диэтилсук-
бутилбромида. Перемешивали реакционную смесь
цинат, 98%; изобутираль, 98%; диметилформамид
при Т = 85°С в течение 8 ч. Реакционную смесь ох-
(ДМФА), 99%; компании Acros — бромистый этил,
лаждали, разбавляли 5 мл воды и экстрагировали
99%; гидрид натрия, 60%-ную эмульсию в мине-
трижды по 5 мл хлористого метилена. Объединенную
ральном масле; циклогексилметилдиметоксисилан,
органическую фазу промывали 2 мл насыщенного
98%; Березниковского титаномагниевого комбината
раствора NaCl, сушили MgSO4. Осушитель отфиль-
Ависма — TiCl4 (ос.ч.); ООО «Томскнефтехим» —
тровывали, растворитель отгоняли на ротационном
триэтилалюминий, 0.3 М раствор в гептане; АО
испарителе. Вместо ожидаемого триэтил-1,2-бисизо-
«Экос-1» — гептан (ос.ч.). Растворители (ООО
бутилэтан-1,1,2-трикарбоксилата (3) получили 177 мг
«Компания Химсервис») ацетонитрил (х.ч.), гек-
смеси исходного соединения (2) и его изобутилового
сан (х.ч.), метил-трет-бутиловый эфир, МТБЭ
эфира (4) в соотношении 48:52 по данным ЯМР 1Н.
(х.ч.), этилацетат (х.ч.), хлористый метилен (х.ч.)
Синтез этил-2-бром-4-метилпентаноата (7).
перед использованием перегоняли. Этанол, 96%
При перемешивании и охлаждении в бане с водой
(ООО «Компания Химсервис») абсолютировали
и льдом к раствору 32.6 г (0.249 моль) L-лейцина и
кипячением над CaO и последующей перегонкой.
104 г (1.01 моль) NaBr в 44 мл 2.5 М водной H2SO4
Использовали неорганические соединения класси-
в течение 1 ч прибавляли по каплям 2 М водный
фикации х.ч. АО «Башкирская содовая компания»
раствор 155.1 г (2.22 моль) NaNO2. Баню убрали, ре-
(NaCl, NaOH, NaHCO3, СаО, HCl) и ООО «Компания
акционную смесь перемешивали при комнатной тем-
Химсервис» (NaBr, NaNO2, MgSO4, H2SO4, Mg). Газы
пературе в течение 6 ч. Экстрагировали трижды по
аргон (х.ч., АО «Сибтехгаз»), пропилен (полиме-
200 мл этилацетата, объединенные вытяжки промы-
ризационной чистоты, группа компаний «Титан»)
вали трижды по 200 мл 50%-ного водного раствора
использовали без дополнительной осушки и очистки.
NaCl, сушили MgSO4. Осушитель отфильтровывали,
Хроматомасс-спектрометрический (ХМС) анализ
растворитель отгоняли на ротационном испарителе,
проводили на газовом хроматографе Agilent 7890 A
получили 41.0 г масла (2-бром-изокапроновая кисло-
с квадрупольным масс-спектрометром Agilent 5975C
та). Полученное масло растворяли в 300 мл этанола,
в качестве детектора, кварцевая колонка HP-5MS
добавляли 7.5 мл H2SO4 и кипятили с обратным хо-
30 000 × 0.25 мм. Спектры ЯМР 1H и 13С 5-10%-ных
лодильником в течение 6 ч. Спирт частично отгоняли,
растворов соединений в CDCl3 регистрировали на
прибавляли 600 мл эфира, промывали трижды по
702
Нечепуренко И. В. и др.
200 мл насыщенного раствора NaCl, сушили MgSO4.
(2Н, м, Н-3), 3.08 (1Н, дд, 12.0, 2.3, Н-5), 4.06-4.25
Осушитель отфильтровывали, растворитель отгоняли
(6Н, м, 3ОСН2).
на ротационном испарителе, получили 40.76 г масла.
Синтез моно- и дизамещенных янтарных кислот
После перегонки в вакууме (2 мм рт. ст.) получили
(10) и (8). К раствору 5.22 г соединения 3 в 100 мл аб-
31.36 г масла с Ткип = 64-67°С. Выход — 56%. По
солютного спирта добавляли 8 г KОН, кипятили с об-
данным ХМС, содержание основного вещества —
ратным холодильником в течение 16 ч. Растворитель
86%. Спектры ЯМР 1Н и 13С соединения (7) соответ-
отгоняли на ротационном испарителе, добавляли
ствовали литературным данным [10].
25 мл воды, нейтрализовали конц. Н2SO4 и допол-
Синтез триэтил-4-метилпентан-1,1,2-трикар-
нительно добавляли 1 мл конц. Н2SO4. Реакционную
боксилата (9). Растворяли 1.16 г (0.05 моль) натрия в
смесь кипятили с обратным холодильником 15 ч.
70 мл абсолютного этанола и к полученному теплому
Охлажденную реакционную смесь экстрагировали
раствору прибавляли по каплям последовательно 8.1 г
трижды по 25 мл этилацетата, объединенные экс-
(0.05 моль) малонового эфира и 11.26 г (0.05 моль)
тракты промывали трижды по 10 мл насыщенного
соединения (7). При кипячении реакционной смеси с
раствора NaCl, сушили MgSO4. Осушитель отфиль-
обратным холодильником и перемешивании в течение
тровывали, растворитель отгоняли на ротационном
12 ч выпадает осадок. Реакционную смесь охлаждали
испарителе, получили 3.0 г смеси соединений (10) и
до комнатной температуры, добавляли 70 мл насы-
(8) в виде масла, которое использовали без очистки
щенного раствора NaHCO3, экстрагировали триж-
на следующей стадии.
ды по 70 мл этилацетата, объединенные вытяжки
Синтез монозамещенного сукцината (11). К рас-
промывали трижды по 30 мл насыщенного раствора
твору 3.0 г смеси соединений (10) и (8) в 30 мл аб-
NaCl, сушили MgSO4. Осушитель отфильтровывали,
солютного спирта добавляли 0.5 мл H2SO4 и кипя-
растворитель отгоняли на ротационном испарителе,
тили с обратным холодильником в течение 15 ч.
получили 16.32 г масла. После перегонки в вакууме
Реакционную смесь охлаждали, приливали 150 мл
(2 мм рт. ст.) получили 9.46 г соединения (9) с Ткип =
этилацетата, промывали трижды по 20 мл насыщен-
= 104-122°С. Выход — 62%. По данным ХМС, содер-
ного раствора NaCl, сушили MgSO4. Осушитель от-
жание основного вещества 92%. ЯМР 1Н (400 МГц,
фильтровывали, растворитель отгоняли на ротаци-
CDCl3, δ, м. д., J, Гц): 0.86 (3Н, д, 8.2, СН3-5), 0.91
онном испарителе, получили 3.24 г масла. После
(3Н, д, 8.5, СН3-5), 1.19-1.29 (9Н, м, 3ОСН2СН3),
перегонки в вакууме (2 мм рт. ст.) получили 1.96 г
1.52-1.63 (3Н, м, Н-3, Н-4), 3.11 (1Н, тд, 10.2, 4.1,
соединения (11) (Ткип = 122-129°С), содержание сое-
Н-2), 3.66 (1Н, д, 10.2, Н-1), 4.07-4.26 (6Н, м, 3ОСН2).
динения (1) не более 5%.
Синтез триэтил-2,7-диметилоктан-4,4,5-три-
Синтез соединений (15а-в) в ДМФА. К 0.18 моль
карбоксилата (3). К раствору 3.68 г (12.7 ммоль) со-
NaH добавляли 35 мл ДМФА, охлаждали до 0°С,
единения (9) в 50 мл ацетонитрила прибавляли 4.66 г
прибавляли раствор 30 мл (0.18 моль) диэтилсукци-
(34.0 ммоль) изобутилбромида, 0.36 г (15.2 ммоль)
ната и 18.5 мл (0.198 моль) изомасляного альдегида в
NaH, 84 мг (3.6 мол%) CuI, 74 мг (2.4 мол%) I2.
40 мл ДМФА. Перемешивали реакционную смесь при
Реакционную смесь кипятили с обратным холо-
60°С в течение 3 ч. Прибавляли 16 мл (0.207 моль)
дильником и перемешиванием 10 дней по 8 ч, в на-
бромистого этила, перемешивали реакционную смесь
чале каждых следующих суток реакции добавля-
при 60°С в течение 2 ч. Реакционную смесь охла-
ли по 1.74 г (12.7 ммоль) изобутилбромида и 0.30 г
ждали, разбавляли 450 мл воды и экстрагировали
(12.7 ммоль) NaН. Окончание реакции определяли
метил-трет-бутиловым эфиром. Объединенную ор-
по исчезновению соединения (9) (ХМС). К реакци-
ганическую фазу промывали насыщенным раствором
онной смеси добавляли 50 мл насыщенного раствора
NaCl, сушили MgSO4. Осушитель отфильтровывали,
NaCl, подкисляли концентрированной HCl до pH 2,
растворитель отгоняли на ротационном испарите-
экстрагировали трижды по 50 мл этилацетата, суши-
ле. Получили 36.19 г смеси соединений (15а-в) в
ли MgSO4. Осушитель отфильтровывали, раствори-
соотношении 54:28:17 по данным ХМС, выход —
тель отгоняли на ротационном испарителе, получили
88%.
5.22 г соединения (3) в виде масла. Полученное ве-
Характеристичные сигналы спектра ЯМР 1Н сме-
щество использовалось без очистки на следующей
си соединений (15а-в), ЯМР 1Н (400 МГц, CDCl3,
стадии. Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м. д., J,
δ, м. д., J, Гц): соединение (15а) — 2.39 дд (1Н, Н-3,
Гц): 0.78-0.96 (12Н, м, СН3-1, СН3-2, СН3-7, СН3-8),
16.4, 6.0), 2.79 дд (1Н, Н-3, 16.4, 9.0), 3.65 ддд (1Н,
1.18-1.29 (9Н, м, 3ОСН2СН3), 1.37-1.49, 1.51-1.63
Н-2, 9.5, 9.0, 6.0), 5.01 дм (1Н, Н-1ʹ, 9.5); соединение
(2Н, м, Н-6), 1.68-1.83 (2Н, м, Н-2, Н-7), 1.85-1.95
(15б) (E-изомер) — 3.31 с (2Н, Н-3), 6.73 дм (1Н, Н-2ʹ,
Новый подход к синтезу диэтил-2,3-диизобутилсукцината...
703
10.2); соединение (15в) (Z-изомер) — 3.20 с (2Н, Н-3),
перемешивали реакционную смесь при 60°С в тече-
5.79 дм (1Н, Н-2ʹ, 9.8).
ние 2 ч. Реакционную смесь охлаждали, разбавляли
Синтез соединения (1) с чистотой 96%.
водой и экстрагировали МТБЭ. Объединенную орга-
А) К 0.159 моль NaH добавляли 30 мл ДМФА, охлаж-
ническую фазу промывали насыщенным раствором
дали до 0°С, прибавляли раствор 36.19 г (0.159 моль)
NaCl, сушили MgSO4. Осушитель отфильтровывали,
соединения (15а-в) (смесь изомеров) и 19.1 мл
растворитель отгоняли на ротационном испарите-
(0.206 моль) изомасляного альдегида в 40 мл ДМФА.
ле. Получили 27.97 г смеси соединений (16а-е), вы-
Перемешивали реакционную смесь при 60°С в те-
ход — 83%. После перегонки в вакууме (5 мм рт. ст.)
чение 3 ч. Прибавляли 14.5 мл (0.190 моль) броми-
получили 17.98 г вещества (16) с Ткип = 128-158°С,
стого этила, перемешивали реакционную смесь при
выход — 53%. По данным ХМС, соотношение соеди-
60°С в течение 2 ч. Реакционную смесь охлаждали,
нений (16а-е) в смеси составило 33:29:8:6:2:3.
разбавляли 450 мл воды и экстрагировали МТБЭ.
Б) В стальной автоклав емкостью 0.5 л помещали
Объединенную органическую фазу промывали насы-
раствор 17.98 г (0.064 моль) соединения (16) в 100 мл
щенным раствором NaCl, сушили MgSO4. Осушитель
этилового спирта (96%) и суспензию никеля Ренея,
отфильтровывали, растворитель отгоняли на рота-
приготовленную из 3.00 г сплава Ренея, в 20 мл эти-
ционном испарителе. Получили 41.79 г смеси со-
лового спирта (96%). Гидрирование проводили при
единений (16а-е) в соотношении 45:29:10:7:5:3 по
давлении водорода 100 атм, Т = 180°С и времени
данным ХМС, выход — 94%. После перегонки в ва-
реакции 24 ч. Растворитель отгоняли на ротационном
кууме (5 мм рт. ст.) получили 26.75 г соединения (16)
испарителе, получили 17.22 г масла, которое пере-
с Ткип = 126-158 °С, выход — 60%.
гоняли в вакууме, отбирали фракцию с Ткип = 123-
Б) В стальной автоклав емкостью 0.5 л помещали
133°С (3 мм рт. ст.), получили 7.31 г соединения (1)
раствор 26.75 г (0.095 моль) соединения (16) в 70 мл
с чистотой 93%. Полученную фракцию перегоняли в
этилового спирта (96%) и суспензию никеля Ренея,
вакууме повторно, отбирали фракцию с Ткип = 122-
приготовленную из 4.50 г сплава Ренея, в 20 мл эти-
128°С (3 мм рт. ст.), получили 5.64 г соединения (1) с
лового спирта (96%). Гидрирование проводили при
чистотой >99% по ХМС, выход — 31%.
давлении водорода 100 атм, Т = 180°С и времени
Синтез соединения (1) с чистотой 75% («в од-
реакции 24 ч. Растворитель отгоняли на ротационном
ном сосуде»). А) Процесс проводили «в одном сосу-
испарителе, получили 23.86 г масла. Вещество пере-
де» аналогично предыдущему синтезу, но смешива-
гоняли в вакууме, отбирали фракцию с Ткип = 121-
ли реагенты при комнатной температуре. Из 42 мл
148°С (3 мм рт. ст.), получили 19.97 г соединения (1)
(0.25 моль) диэтилсукцината получили 30.39 г смеси
с чистотой 93%. Полученную фракцию перегоняли в
соединений (16а-е), выход — 43%. По данным ХМС,
вакууме повторно, отбирали фракцию с Ткип = 100-
соотношение соединений (16а-е) в смеси составило
116°С (1 мм рт. ст.), получили 16.70 г соединения (1)
16.7:15:6.8:6.5:4:1.
с чистотой 96% по ХМС, выход — 61%.
Б) В стальной автоклав емкостью 0.5 л помещали
Спектр ЯМР 1Н (400 МГц, CDCl3, δ, м. д., J, Гц):
раствор 29.39 г (0.104 моль) соединений (16а-е) в
0.84, 0.87 д (6Н + 6Н, 4СН3, 6.1), 0.99-1.10 м (2H,
60 мл этилового спирта (96%) и суспензию никеля
H-1ʹ), 1.22, 1.24 т (3Н + 3Н, 2ОСН2СН3, 7.0), 1.37-
Ренея, приготовленную из 5.00 г сплава Ренея [11]
1.69 м (4Н, 2Н-1ʹ, 2H-2ʹ), 2.60-2.71 м (2Н, Н-2, Н-3),
в 20 мл этилового спирта (96%). Гидрирование про-
4.06-4.20 м (4Н, 2ОСН2).
водили при давлении водорода 100 атм, Т = 180°С
Синтез соединения (1) с чистотой 99% («в од-
и времени реакции 20 ч. Отгоняли растворитель,
ном сосуде»). А) К 0.12 моль NaH добавляли 20 мл
получили 23.98 г масла, которое перегоняли в ва-
ДМФА, охлаждали до 0°С и прибавляли рас-
кууме, отбирали фракцию с Ткип = 120-140°С (3 мм
твор 20 мл (0.12 моль) диэтилсукцината и 12.2 мл
рт. ст.), получили 13.35 г соединения (1) с чистотой
(0.132 моль) изомасляного альдегида в 25 мл ДМФА.
60%. Полученную фракцию перегоняли в вакууме
Перемешивали реакционную смесь при 60°С в тече-
повторно, отбирали фракцию с Ткип = 100-120°С
ние 3 ч. Прибавляли 10.4 мл (0.138 моль) бромистого
(1 мм рт. ст.), получили 6.62 г соединения (1) с чисто-
этила, перемешивали реакционную смесь при 60°С
той 75% по ХМС, выход — 22%.
в течение 2 ч. Добавляли 0.138 моль NaH в 25 мл
Приготовление катализаторов и проведение поли-
ДМФА. Прибавляли раствор 12.8 мл (0.138 моль) изо-
меризации пропилена. Приготовление катализаторов
масляного альдегида в 13 мл ДМФА. Перемешивали
проводили согласно Примеру 1 патента [12] путем
реакционную смесь при 60°С в течение 3 ч.
трехкратной обработки магнийсодержащего носителя
Прибавляли 10.4 мл (0.138 моль) бромистого этила,
приблизительного состава nMgCl2 × mMg(OC2H5)2
704
Нечепуренко И. В. и др.
избытком TiCl4 в присутствии соединения (1) с чи-
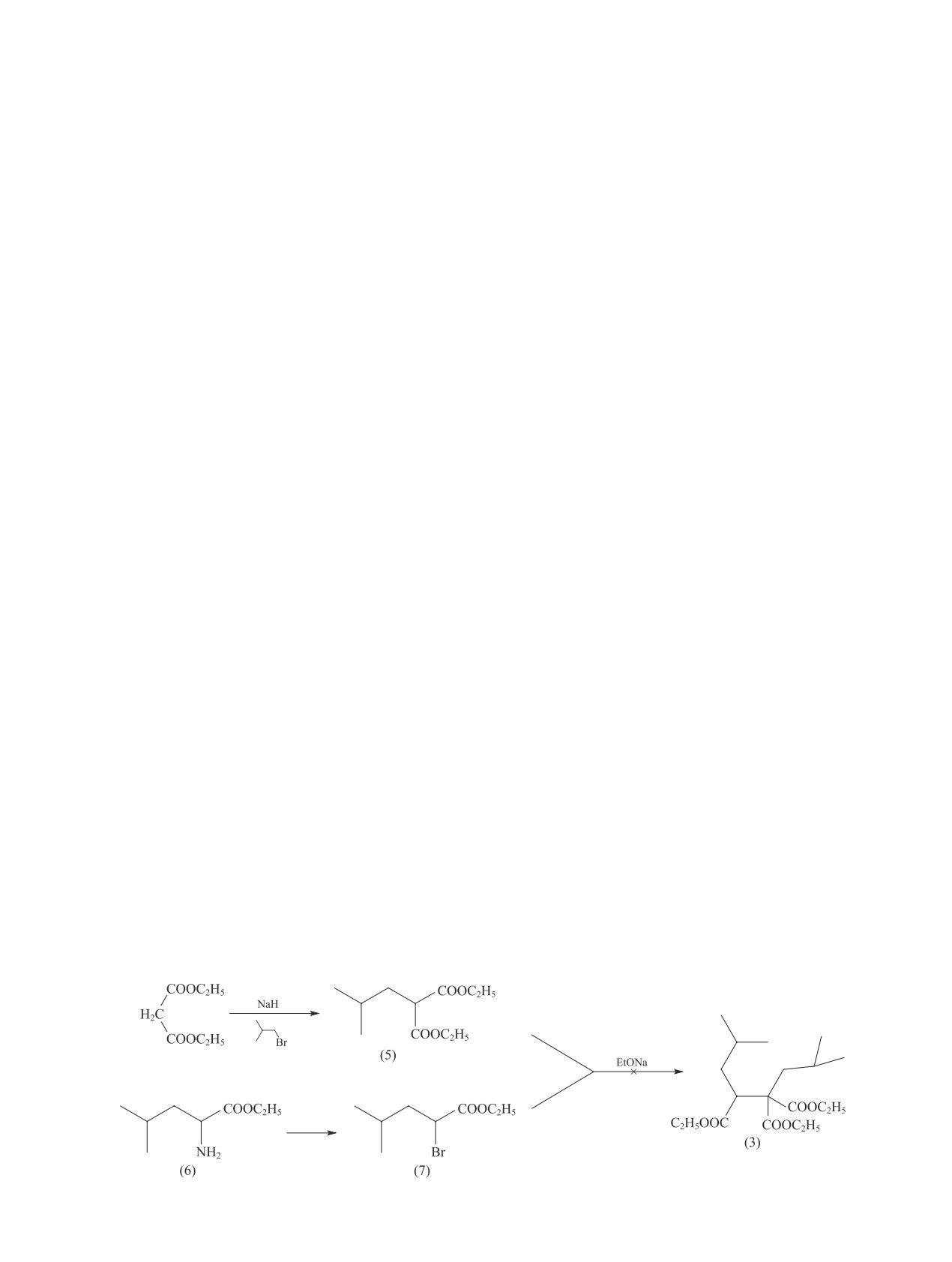
обходимый для получения соединения (1), мы попы-
стотой 75-99% при мольных отношениях Ti/Mg = 30
тались его синтезировать другими способами, ранее
и соединение (1)/Mg = 0.15. После промывки полу-
не описанными в литературе. По первому варианту
ченного твердого катализатора гептаном получали
(схема 3) были получены изобутилмалонат (5) и эти-
суспензию катализатора в гептане с содержанием
ловый эфир 2-бром-изокапроновой кислоты (7) [из
титана в катализаторе 2-3 мас% и содержанием сое-
лейцина (6)]. Однако оказалось, что реакция между
динения (1) 11-14 мас%.
ними в условиях, аналогичных условиям работы [13],
Полимеризацию пропилена проводили в стальном
не протекает.
автоклаве емкостью 1 л в среде 300 мл гептана при
По другому варианту, взаимодействием соедине-
температуре 70°С, постоянном давлении пропилена
ния (7) с малоновым эфиром оказалось возможным
0.6 МПа, в присутствии 2 об% водорода в газовой
получить триэфир (9) [изомер соединения (2)] и затем
фазе реактора, 4 мл раствора триэтилалюминия в
проалкилировать его изобутилбромидом с образо-
гептане (0.3 М) и дополнительного стереорегулиру-
ванием диизобутил-замещенного триэфира (3) (cхе-
ющего электронодонорного агента — циклогексил-
ма 4). Полученный диизобутил-замещенный триэфир
метилдиметоксисилана (ЦГМДМС) при мольном
(3) гидролизовали (KОН/этиловый спирт) с последу-
отношении Al/ЦГМДМС = 20. Время полимеризации
ющим декарбоксилированием неустойчивой 1,1-ди-
— 1 ч. По окончании полимеризации содержимое
карбоновой кислоты (H2SO4, нагревание), что должно
реактора выгружали, полученный порошок полимера
приводить к образованию дизамещенных янтарных
сушили в вакуумном шкафу до постоянной массы.
кислот (8а,б). После этерифицирования смеси кислот
Затем определяли удельную активность катализа-
этанолом в кислой среде в качестве основного продук-
тора (выход полимера, кг·г-1кат·ч-1), относительное
та получили диэтил-2-изобутилсукцинат (11), а содер-
количество ксилол-растворимой фракции (XS) со-
жание соединения (1) составило не более 5%. Таким
гласно ASTM D-5492 и рассчитывали индекс изотак-
образом, в данных условиях происходит не только
тичности (ИИ), ИИ =100 - XS. Полидисперсность
декарбоксилирование, но и потеря изобутильного за-
полипропилена (ширину молекулярно-массового
местителя, что не позволяет использовать предложен-
распределения полипропилена, равную отношению
ную схему для эффективного синтеза соединения (1).
средневесовой молекулярной массы Mw к средне-
Таким образом, мы показали, что последова-
численной молекулярной массе Mn) определяли при
тельность реакций, предложенная в патенте [3], не
температуре 160°C методом высокотемпературной
позволяет получить соединение (1) или отличается
гельпроникающей хроматографии. Более детальное
низкой воспроизводимостью. После этого нами был
описание методик приготовления катализаторов и
предложен другой, оригинальный, подход к синтезу
проведения полимеризации приведено в патенте [12]
диэтил-2,3-диизобутилсукцината (1).
(Пример 1).
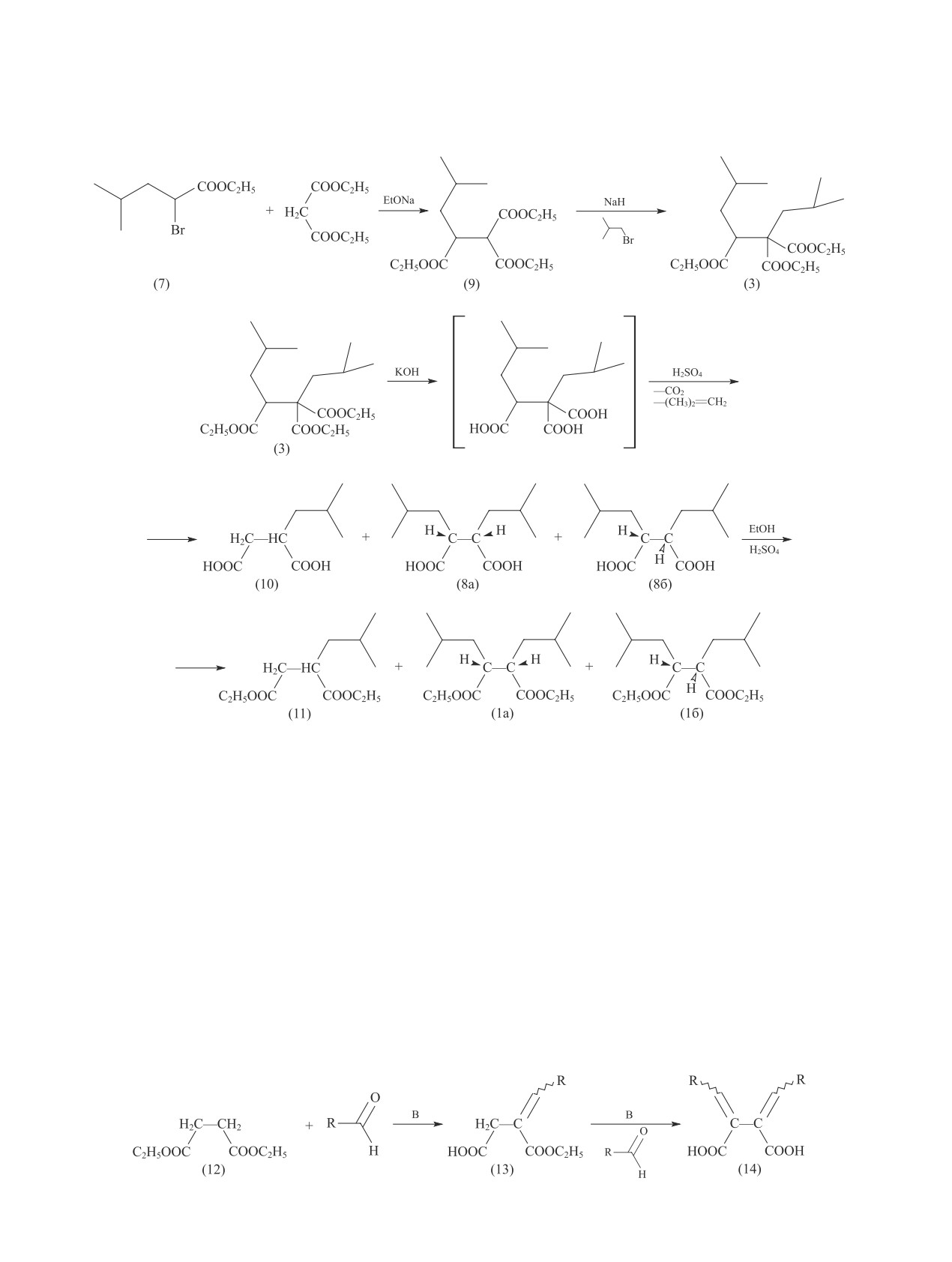
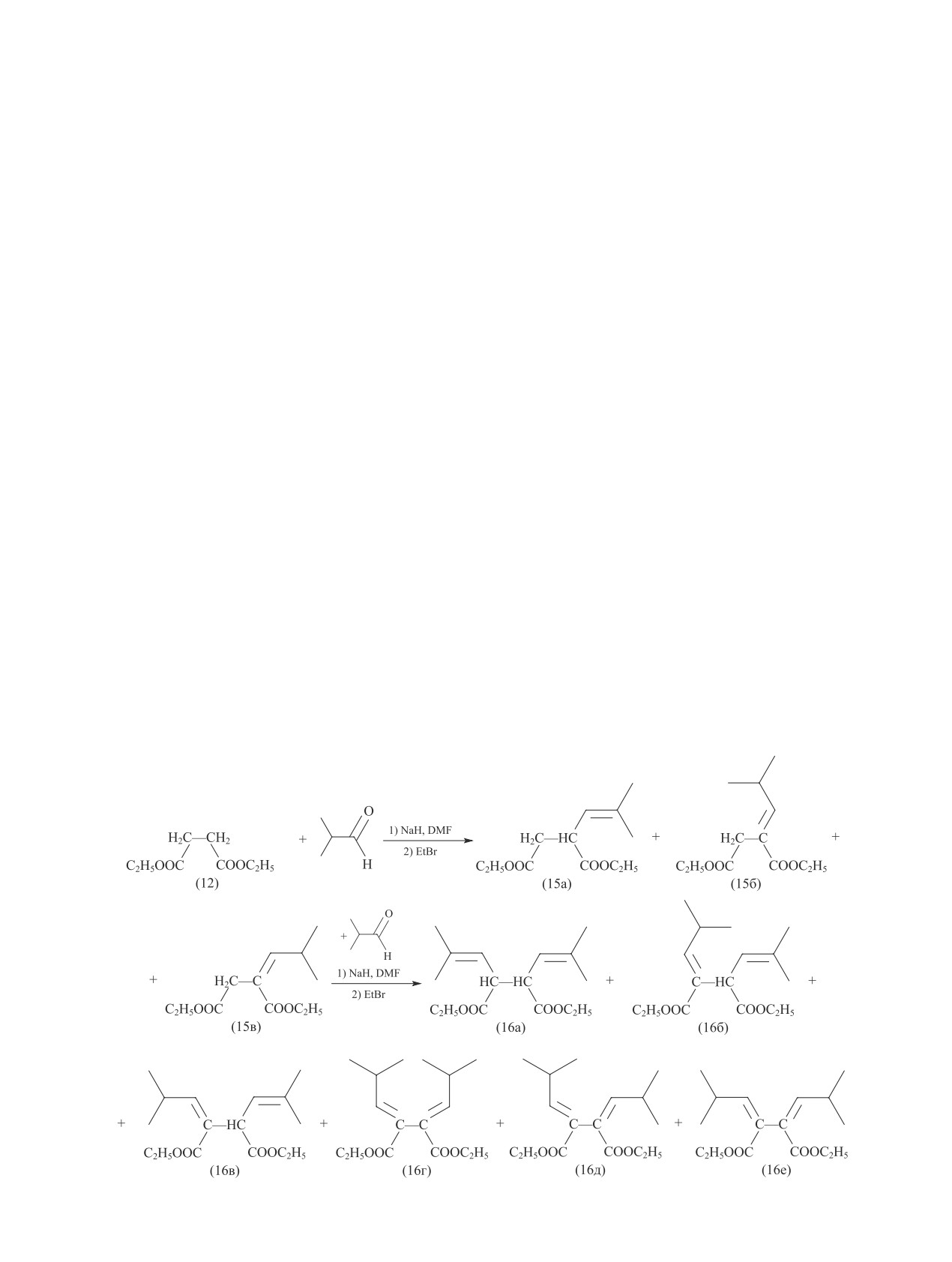
Известно, что конденсация по Штоббе диэтилсук-
цината (12) с альдегидами (или кетонами) приводит к
образованию моноэфиров (13), процесс может быть
Обсуждение результатов
проведен двукратно с получением бисэтилиденовых
Синтез диэтил-2,3-диизобутилсукцината. Так
производных янтарной кислоты (14) (cхема 5) [14].
как нами было обнаружено, что путем, указанным в
Однако для изобутилового альдегида такая двойная
патенте [3], не удается синтезировать триэфир (3), не-
конденсация не описана в литературе. Для получения
Схема 3
Новый подход к синтезу диэтил-2,3-диизобутилсукцината...
705
Схема 4
соединения (1) продукт типа (14) необходимо переве-
лиденовым производным сукцината под действием
сти в сложный диэфир и затем гидрировать сопряжен-
трет-бутилата калия в ДМФА и алкилирование по-
ные двойные связи, что также может представлять
лученного моноэфира, приводит к бисэтилиденовому
непростую задачу ввиду того, что каждая из связей
диэфиру соединения (14) [16].
является трехзамещенной. Конденсацию изобутило-
Для получения соединения (16) были исполь-
вого альдегида с диэтилсукцинатом можно проводить
зованы модифицированные условия патента [17]
в присутствии трет-бутилата калия в трет-бутано-
(трет-бутилат калия, ДМФА, 20°С). Мы заменили
ле, получая смесь моноэтилиденовых моноэфиров
основание (трет-бутилат калия) на более удобный
(13) [15]. Также известно, что последовательный про-
в работе NaH, уменьшили температуру смешения
цесс «в одном сосуде», включающий конденсацию
реагентов до 0°С и провели процесс двойной конден-
ацетона с диэтилсукцинатом под действием трет-бу-
сации постадийно с обработкой после каждой стадии,
тилата калия в ДМФА, алкилирование монозамещен-
что позволило добиться получения продукта (16) с
ного моноэфира, конденсацию ацетона с моноэти-
более высокой чистотой.
Схема 5
706
Нечепуренко И. В. и др.
При проведении конденсации путем смешения
единений (16а-е) в условиях работы [19] [катали-
компонентов (изомасляного альдегида с диэтилсук-
затор — Pd/С (10%), Р = 2.7 атм, Т = 20°С, t = 6 ч].
цинатом) при температуре 0°С и дальнейшем нагре-
Успешным оказалось использование в качестве ка-
вании при 60°С, после обработки этилбромидом была
тализатора гидрирования никеля Ренея в довольно
выделена смесь монозамещенных сукцинатов (15а-в)
жестких условиях (Р = 100 атм, Т = 180°С, t = 24 ч).
в соотношении 54:28:17 по данным ХМС с общим вы-
В результате был получен целевой диэтил-2,3-дии-
ходом 88% (cхема 6). Следует отметить, что в случае
зобутилсукцинат (1) в виде пары диастереомерных
проведения реакции в ДФМА преобладающим явля-
соединений (1а,б), содержащий в качестве примеси
ется изомер (15а), тогда как при использовании в ка-
диэтил-2-изобутилсукцинат (11) (схема 7). По данным
честве растворителя трет-бутанола преобладающим
ХМС, соотношение соединений (1а):(1б):(11) соста-
был Е-изомер (15б) (82%), а содержание соединения
вило 41:36:9. После двукратной вакуумной перегонки
(15а) составляло лишь 11% [15]. После второй стадии
получили соединение (1) с выходом 61% и чистотой
конденсации была выделена смесь дизамещенных
96%, не содержащее примесей монозамещенного
сукцинатов (16а-е), выход составил 62% после пе-
сукцината (11). Общий выход на три стадии составил
регонки в вакууме. По данным ХМС, основными
32%.
компонентами смеси являются соединения (16а) и
Была изучена возможность проведения конден-
(16б), их соотношение составляет 45:29. Содержание
сации диэтилсукцината с изобутиралем «в одном
соединений (15а-в) не превышает 5%, что является
сосуде» без выделения промежуточных продуктов
критически важным, поскольку отделение от примеси
(15а-в). Аналогично ранее описанному подходу, про-
продукта монозамещения на последующих стадиях
водили смешивание компонентов конденсации при
оказалось затруднительным.
температуре 0°С и дальнейшем нагревании при 60°С,
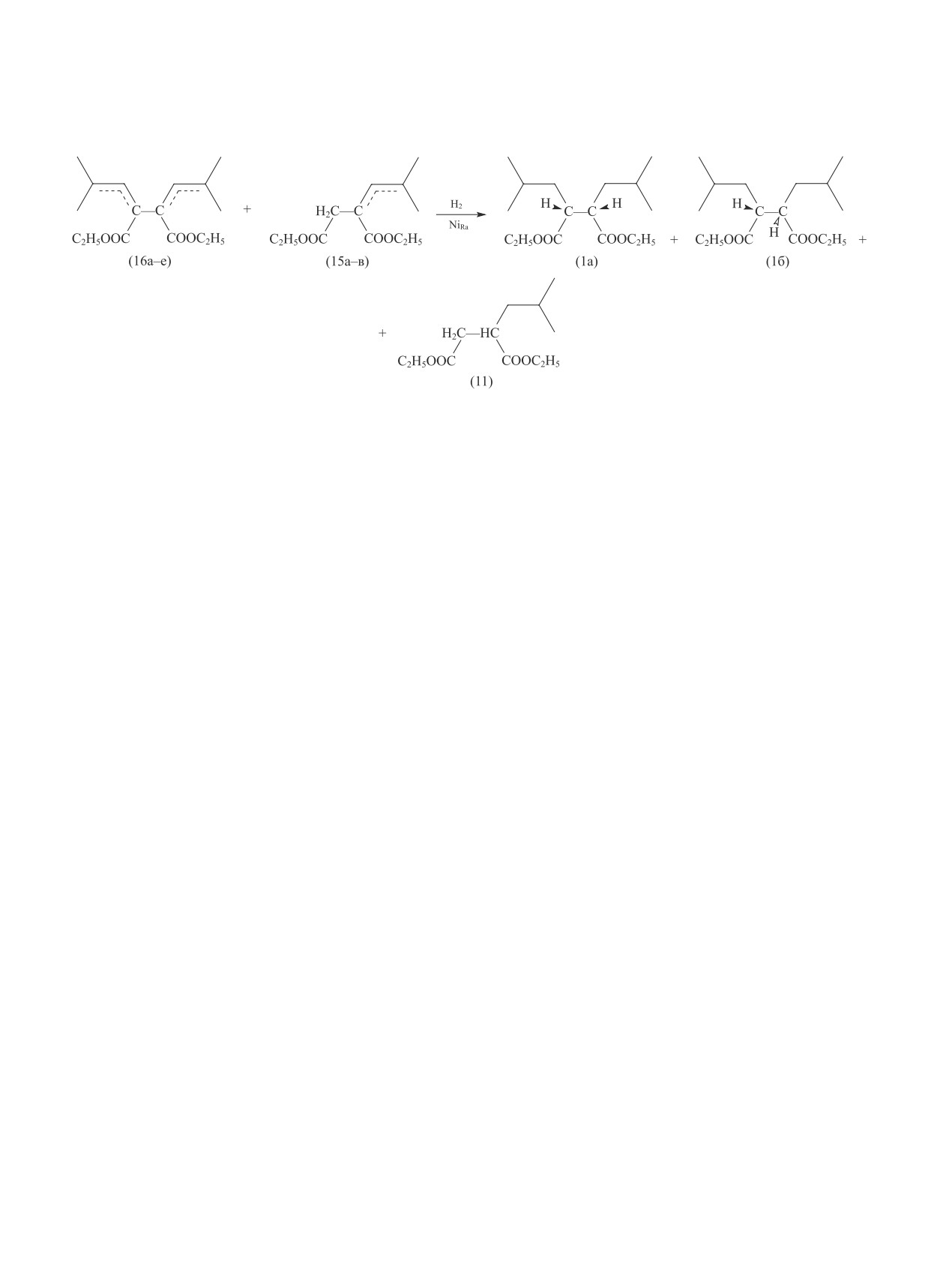
Гидрирование диенов типа (16), содержащих
затем алкилировали этилбромидом. После этого ре-
сложноэфирные функциональные группы, в лите-
акционную массу охлаждали до температуры 0°С,
ратуре не описано. Гидрирование итаконатов типа
прибавляли 1.15 эквивалента NaH и 1.15 эквивалента
(15б,в) чаще всего проводили в гомогенных усло-
изобутилового альдегида, далее нагревали при тем-
виях, на катализаторах, содержащих комплексные
пературе 60°С. Получающийся в ходе реакции in situ
соединения Rh [15, 18], либо на катализаторе Pd на
моноэфир 2,3-бисизобутилиденсукцината взаимодей-
угле [19]. Нам не удалось прогидрировать смесь со-
ствием с 1.15 эквивалента этилбромида превращали
Схема 6
Новый подход к синтезу диэтил-2,3-диизобутилсукцината...
707
Схема 7
в диэфиры (16а-е). После экстракционной обработки
1Н соединения (1) наблюдается удвоенный набор
диэфиры (16а-е) перегоняли в вакууме, получили
сигналов протонов, говорящий о присутствии двух
смесь соединений (16а-е) с выходом 53%. По дан-
форм соединения — (1а) и (1б). Так, наблюдаются
ным ХМС, соотношение соединений (16а-е) в смеси
сигналы, характерные для метильных групп в изобу-
составляло 33:29:8:6:2:3. После гидрирования смеси
тильных заместителях (дублеты при 0.84 и 0.87 м. д.),
соединений (16а-е) в условиях, аналогичных опи-
сигналы неэквивалентных этильных фрагментов в
санным ранее (никель Ренея, Р = 100 атм, Т = 180°С,
сложноэфирных группах СООС2Н5 (триплеты при
t = 24 ч), и двухкратной вакуумной перегонки полу-
1.22 и 1.24 м. д. и квартеты в области 4.06-4.20 м. д.).
чили диэтил-2,3-диизобутилсукцинат (1) с чистотой
Теоретически при наличии двух форм соединения
по ХМС >99% (выход — 31%). Мы также провели
(1а) и (1б) наиболее сильное различие могло наблю-
аналогичный процесс «в одном сосуде», отличаю-
даться для сигналов протонов Н-2 и Н-3 этих форм.
щийся тем, что смешение компонентов на первой
Однако в данном случае сигнал этих протонов вы-
и второй стадиях конденсации проводили при тем-
глядит в виде неразрешенного мультиплета в области
пературе 20°С, дальнейшая процедура выполнена
2.60-2.71 м. д., что не позволяет провести отнесение
без изменений. При этом была получена смесь сое-
форм соединения (1). Спектр ЯМР 1Н соединения (1)
динений (16а-е) с выходом 43%. По данным ХМС,
соответствует спектру, опубликованному в литературе
соотношение соединений (16а-е) в смеси составило
[3].
16.7:15:6.8:6.5:4:1. Гидрирование этого продукта при-
Катализаторы полимеризации пропилена.
вело к получению соединения (1) с чистотой по ХМС
Полученное соединение (1) чистотой 75, 96 и 99%
75% (выход — 22%).
было использовано для приготовления титан-маг-
Таким образом, при проведении конденсации «в
ниевых катализаторов ТМК-1, ТМК-2 и ТМК-3 по
одном сосуде» возможно получение продукта (1) с
методике [12]. Эти катализаторы были испытаны в
разной степенью чистоты в зависимости от усло-
полимеризации пропилена. Результаты испытаний и
вий проведения реакции. Для получения целевого
свойства полученного полипропилена приведены в
продукта с чистотой не хуже, чем при постадийном
таблице. Для сравнения в таблице также приведены
процессе, необходимо строгое соблюдение темпера-
литературные данные по полимеризации пропиле-
турных условий (смешивание при 0°С). Проведение
на в близких условиях, на катализаторах ТМК-4 и
постадийного процесса позволило получить продукт
ТМК-5, содержащих диэтил-2,3-диизопропилсук-
(1) с большим выходом (61% против 31 и 22%). Что
цинат в качестве стереорегулирующего соединения
касается различий в чистоте продуктов (96% при
[4, 5].
постадийном проведении и 99% при проведении ре-
Все полученные катализаторы характеризуются
акции «в одном сосуде» при температуре смешения
высокой активностью (выходом полипропилена),
0°С), то скорее всего оно обусловлено отбором раз-
позволяют получать полипропилен с высоким со-
ного количества фракций продукта при вакуумной
держанием изотактической фракции (>95 мас%) и
перегонке.
широким молекулярно-массовым распределени-
Согласно данным ХМС, диэтил-2,3-диизобу-
ем: величина полидисперсности Mw/Mn составляет
тилсукцинат (1) состоит из двух форм (1а) и (1б)
5.3-5.5. Активность катализаторов ТМК-1, ТМК-2 и
(анти- и син-) в соотношении 1:1. В спектре ЯМР
ТМК-3, полученных в настоящей работе, при сопо-
708
Нечепуренко И. В. и др.
Результаты испытаний катализаторов, приготовленных с использованием диэтил-2,3-диизобутилсукцината (1),
в экспериментах по полимеризации пропилена
Образец
Чистота
Выход полипропилена,
Индекс изотактичности
Полидисперсность
катализатора
соединения (1), %
кг·г-1кат·ч-1
полипропилена, мас%
полипропилена Mw/Mn
ТМК-1
75
9.0
95.6
5.5
ТМК-2
96
10.3
97.2
5.3
ТМК-3
>99
9.4
97.1
5.5
ТМК-4*
—
6.3
94.4
9.3
ТМК-5**
—
3.6
98.9
4.1
* Данные работы [4].
** Данные работы [5].
ставимой стереоспецифичности превосходит актив-
приготовить катализаторы с высокой активностью
ность катализаторов ТМК-4 и ТМК-5, приведенную в
и стереоспецифичностью и обеспечивает получение
литературе (см. таблицу). Отметим, что применение
полипропилена с широким молекулярно-массовым
катализатора ТМК-1, приготовленного с использова-
распределением.
нием соединения (1) чистотой 75%, приводит к обра-
зованию полипропилена с более низкой стереорегу-
Благодарности
лярностью: индекс изотактичности составляет 95.6%.
Катализаторы ТМК-2 и ТМК-3, приготовленные с
Авторы выражают благодарность Химическому
образцами диэтил-2,3-диизобутилсукцината, имею-
исследовательскому центру коллективного пользо-
щими чистоту >95%, позволяют получать полипро-
вания СО РАН за проведение спектральных и анали-
пилен с более высокой изотактичностью (величины
тических измерений.
индекса изотактичности >97%). Эти катализаторы об-
ладают высокой активностью, высокой стереоспеци-
фичностью и позволяют получать полипропилен с
Конфликт интересов
широким молекулярно-массовым распределением
Авторы заявляют об отсутствии конфликта инте-
(Mw/Mn = 5.3-5.5, см. таблицу).
ресов, требующего раскрытия в данной статье.
Выводы
Информация о вкладе авторов
Разработан способ синтеза диэтил-2,3-диизобу-
тилсукцината (1) с использованием недорогих ком-
И. В. Нечепуренко разрабатывал и выполнял
мерчески доступных реагентов и растворителей, а
схемы синтеза органических соединений, интер-
также обычного химического оборудования. Этот
претировал хроматограммы ХМС, ЯМР-спектры,
способ включает синтез бисэтилиденовых произво-
писал рукопись; И. Я. Майнагашев синтезировал
дных янтарной кислоты двукратной последователь-
органические соединения; А. А. Барабанов синте-
ной конденсацией диэтилсукцината с изобутиловым
зировал, исследовал и испытывал образцы катализа-
альдегидом и алкилированием промежуточно обра-
торов, писал рукопись; С. А. Сергеев синтезировал
зующихся полуэфиров. Последующее гидрирование
катализаторы; Г. Д. Букатов разрабатывал и опти-
бисэтилиденовых производных на никеле Ренея в
мизировал методику приготовления катализаторов;
жестких условиях приводит к целевому диэтил-2,3-
В. А. Захаров ставил задачи по приготовлению ката-
диизобутилсукцинату (1) в виде смеси син- и ан-
лизаторов; М. А. Мацько ставил задачи по приготов-
ти-стереоизомеров. С использованием этого подхода
лению катализаторов и проведению полимеризации,
был синтезирован продукт (1) со степенью чистоты
писал рукопись; К. П. Волчо ставил задачи и разра-
75-99% и выходом 31-61%.
батывал схемы синтеза органических соединений,
Показано, что введение полученного диэтил-2,3-
писал рукопись; Н. Ф. Салахутдинов ставил задачи
диизобутилсукцината (1) в состав титан-магниевых
и разрабатывал схемы синтеза органических соеди-
катализаторов полимеризации пропилена позволяет
нений.
Новый подход к синтезу диэтил-2,3-диизобутилсукцината...
709
Информация об авторах
[5] Hamedani N. G., Arabi H., Poorsank F. Towards the
design of a mixture of diether and succinate as an
Нечепуренко Иван Васильевич, к.х.н., н.с. НИОХ
internal donor in a MgCl2-supported Ziegler-Natta
СО РАН,
catalyst // New J. Chem. 2020. V. 44. P. 15758-15768.
Майнагашев Илья Яковлевич, вед. инж. НИОХ СО
[6] Салахов И. И., Букатов Г. Д., Батыршин А. З.,
Мацько М. А., Барабанов А. А., Тавторкин А. Н.,
Барабанов Артем Александрович, к.х.н., с.н.с. ИК
Темникова Е. В., Сахабутдинов А. Г. Синтез по-
СО РАН,
липропилена в жидком мономере в присутствии
титан-магниевого катализатора: эффект различ-
ных внутренних доноров // ЖПХ. 2019. Т. 92. № 6.
РИНЦ ID: 132133, ResearcherID: H-8141-2012,
C. 767-780.
Scopus ID: 8368275300
Сергеев Сергей Андреевич, к.х.н., вед. инж. ИК СО
[Salakhov I. I., Bukatov G. D., Batyrshin A. Z.,
Matsko M. A., Barabanov A. A., Tavtorkin A. N.,
РИНЦ ID: 11062, ResearcherID: C-8465-2014,
Temnikova E. V., Sakhabutdinov A. G. Synthesis of
Scopus ID: 35461658300, 57207787408
polypropylene in the liquid monomer in the presence
Букатов Геннадий Дмитриевич, к.х.н., с.н.с. ИК
of a titanium-magnesium catalyst: Effect of various
СО РАН,
internal donors // Russ. J. Appl. Chem. 2019. V. 92.
N 6. P. 796-808.
РИНЦ ID: 56915, ResearcherID: C-8472-2014 ,
Scopus ID: 6603562252
[7] Long N. R., Rathke W. Isolation and reactions of
Захаров Владимир Александрович, д.х.н., проф.,
the lithium di-enolate of diethyl succinate // Synth.
гл.н.с. ИК СО РАН,
Commun. 1981. V. 11. N 9. P. 687-696.
[8] Champagne Ph. J., Renaud R. N. Electrochemical
РИНЦ ID: 45134, ResearcherID: F-3795-2012 ,
oxidation of carboxylic acid anions in the presence
Scopus ID: 35494058700, 57204529621, 57215694449
of some mono- and di-substituted olefins // Canad. J.
Мацько Михаил Александрович, к.х.н., зав. лаб.
Chem. 1980. V. 58. N 11. P. 1101-1105.
ИК СО РАН,
[9] Pat. CN 103145553 (publ. 2013). Synthesis and
РИНЦ ID: 107994, ResearcherID: C-8462-2014 ,
application of 2,3-hydrocarbyl substituted diester
Scopus ID: 6603632493 , 57200564890 , 57217249984
succinate.
Волчо Константин Петрович, д.х.н., проф. РАН,
[10] Tan D. Q., Younai A., Pattawong O., Fettinger J. C.,
гл.н.с. НИОХ СО РАН,
Cheong P. H.-Y., Shaw J. T. Stereoselective synthesis
of γ-lactams from imines and cyanosuccinic
Салахутдинов Нариман Фаридович, чл.-корр.
anhydrides // Org. Lett. 2013. V. 15. N 19. P. 5126-
РАН, д.х.н., зав. отделом НИОХ СО РАН,
5129. Supl. Inform. S. 5.
[11] Репинская И. Б., Шварцберг М. С. Избранные ме-
Scopus ID: 7003619588
тоды синтеза органических соединений. Ново-
сибирск: Изд-во Новосиб. ун-та, 2000. C. 80.
Список литературы
[12] Пат. RU 2152404 (опубл. 2000). Способ получения
[1] Taniike T., Terano M. The use of donors to increase the
катализатора, применяемого для полимеризации
isotacticity of polypropylene // Adv. Polym. Sci. 2013.
олефинов.
V. 257. P. 81-98.
[13] Zelinsky N. Ueber die producte der einwirkung
von cyankalium auf a-brompropionsaureester
[2] Pat. WO 2000/063261 (publ. 2000). Components and
(einfache und bequeme darstellungsweise der beiden
catalysts for the polymerization of olefins.
symmetrischen dimethylbernsteinsauren) // Ber. Dtsch
[3] Pat. WO 2013/029767 (publ. 2013). Process for
Chem. Ges. 1888. Bd 21. S. 3160-3172.
preparing di-substitued succinates.
[14] Stobe H. Die Fulgide // Justus Liebigs Ann. Chem.
[4] Vittoria A., Meppelder A., Friederichs N., Busico V.,
Cipullo R. Demystifying Ziegler-Natta catalysts: The
tusLiebigsAnnalenDerChemieVolume380
origin of stereoselectivity // ACS Catal. 2017. V. 7. N 7.
[15] Burk M. J., Bienewald F., Harris M., Zanotti-Gerosa A.
P. 4509-4518.
Practical access to 2-alkylsuccinates through
asymmetric catalytic hydrogenation of stobbe-derived
710
Нечепуренко И. В. и др.
itaconates // Angew. Chem., Int. Ed. 1998. V. 37.
«JDayPhos» series and its use in rhodium(I)-catalyzed
hydrogenation // Adv. Synth. Catal. 2018. V. 360.
(SICI)1521-3773(19980803)37:13/14<1931::AID-
ANIE1931>3.0.CO;2-3
[19] Ballini R., Bosica G., Fiorini D., Righi P. Nitroalkanes
[16] Pat. US 2003/181743 (publ. 2003). Process for
and dimethyl maleate as source of 3-alkyl succinic
preparing alkylidene substituted succinic acid esters.
anhydrides and (E)-3-alkylidene succinic anhydrides
[17] Pat. WO 02/098837 (publ. 2002). Process for preparing
// Synthesis. 2002. N 5. P. 681-685.
alkylidene substituted succinic acid esters.
[18] Poklukar G., Stephan M., Mohar B. Modular
1,1ʹ-ferrocenediyl-cored P-stereogenic diphosphines: