Журнал прикладной химии. 2021. Т. 94. Вып. 6
ПРИКЛАДНАЯ ЭЛЕКТРОХИМИЯ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
УДК 544.653
СИНТЕЗ И ИССЛЕДОВАНИЕ ЭЛЕКТРОХИМИЧЕСКИХ СВОЙСТВ
ГЕКСАЦИАНОФЕРРАТА МАРГАНЦА КАК КАТОДНОГО МАТЕРИАЛА
ДЛЯ Na-ИОННЫХ АККУМУЛЯТОРОВ
© М. А. Каменский, Е. В. Шкреба, Е. Г. Толстопятова, В. В. Кондратьев*
Санкт-Петербургский государственный университет,
199034, г. Санкт-Петербург, Университетская наб., д. 7/9
* E-mail: vkondratiev@mail.ru
Поступила в Редакцию 9 октября 2020 г.
После доработки 20 мая 2021 г.
Принята к публикации 2 июня 2021 г.
Гидротермальным методом синтезирован гексацианоферрат марганца и установлена его кубическая
структура. Порошок гексацианоферрата марганца исследован в составе катодного материала для
натрий-ионных аккумуляторов c электронопроводящей добавкой углеродной сажи и связующим по-
лимером поливинилиденфторидом. Методом циклической вольтамперометрии и зарядно-разрядных
кривых проведено исследование электрохимических свойств электродов на основе гексацианоферрата
марганца в пропиленкарбонатном растворе перхлората натрия. Получены величины удельной емко-
сти катодного материала и их зависимости от плотности тока. Изучена стабильность емкостных
характеристик материала при длительном зарядно-разрядном циклировании.
Ключевые слова: гексацианоферрат марганца; натрий-ионные аккумуляторы; удельная емкость
DOI: 10.31857/S0044461821060153
Разработки новых материалов для эффективного
Работа электродных материалов для металл-
накопления и хранения энергии относятся к чис-
ионных аккумуляторов, таких как натрий-, калий-,
лу приоритетных задач современной электрохимии.
магний-интеркалируемые материалы, основана на
В настоящее время наиболее эффективными автоном-
аналогичном принципе обратимого внедрения ионов
ными источниками тока являются литий-ионные ак-
металлов в гостевые материалы. В частности, боль-
кумуляторы, обладающие достаточно высокой плот-
шое внимание уделяется разработкам натрий-ионных
ностью энергии и мощностью, что нашло широкое
материалов, и среди них в качестве перспективной
применение для портативной и мобильной электро-
матрицы интеркалирования для создания катодов
ники, аккумуляторных электроинструментов, быто-
натрий-ионных аккумуляторов широко используют
вой техники и многих других приложений. С учетом
гексацианоферраты переходных металлов [3-8].
ограниченности литиевых ресурсов и быстрого по-
Семейство материалов на основе полиядер-
требления природных запасов лития для производ-
ных гексацианоферратов переходных метал-
ства литий-ионных аккумуляторов в последние годы
лов может быть представлено общей формулой
уделяется большое внимание разработкам альтерна-
KxMy[Mʹ(CN)6]z∙nH2O (K — катион щелочного или
тивных материалов для других металл-ионных акку-
щелочноземельного металла; M, Mʹ — внешне- и
муляторов (постлитий-ионных аккумуляторов) [1, 2].
внутрисферные ионы переходных металлов). Среди
811
812
Каменский М. А. и др.
последних систем наиболее известна и изучена
материалов для натрий-ионных аккумуляторов и де-
Берлинская лазурь [гексацианоферрат(II) железа(III)]
тальными исследованиями кинетики твердофазных
[3, 5-7, 9], в структуре молекулы которой ионы же-
процессов инжекции ионов в кристаллические струк-
леза, координированные с углеродом или азотом ци-
туры полученных соединений. Эти вопросы являются
анидных групп (так называемые внутрисферные или
общими в химии твердотельных функциональных
внешнесферные ионы железа), могут быть заменены
материалов и важными для понимания механизма
на ионы другого переходного металла.
электродных процессов для развития металл-ион-
Кристаллическая структура Берлинской лазури,
ных электрохимических систем для новых аккуму-
как и многих других ее аналогов — полиядерных
ляторов.
цианидов переходных металлов, представляет со-
Цель работы — синтез гексацианоферрата мар-
бой трехмерную полимерную сетку, содержащую
ганца с кубической структурой с последующим из-
чередующиеся ядра железа(II) и железа(III), локали-
учением его в составе электродного материала для
зованные в узлах гранецентрированной кубической
натрий-ионных аккумуляторов, исследование связи
кристаллической решетки и связанные мостиковыми
между структурно-химическими характеристиками
СN-лигандами [3, 5]. Для этого класса соединений
полученного соединения и его электрохимическими
характерна сложная переменная стехиометрия, что
свойствами.
обусловлено наличием вакансий мест [Fе(CN)6]4- в
кристаллической структуре, зависящих от условий
Экспериментальная часть
синтеза.
Эти соединения имеют в своей кристаллической
В работе использовались коммерчески доступ-
структуре широкие каналы, так что катионы натрия,
ные реагенты и материалы: перхлорат натрия (≥98%,
калия и некоторые другие могут легко передвигаться
кат. номер 410241), Na4Fe(CN)6∙10H2O (≥98%, кат.
внутри кристаллической структуры. Энергия взаи-
номер 13425), безводный пропиленкарбонат (99.7%,
модействия катионов металлов, являющихся более
кат. номер 310328), N-метилпирролидон (99%, кат.
слабыми кислотами по Льюису, с анионными фраг-
номер 443778) и натрий металлический (99.9%, кат.
ментами решетки уменьшается в ряду Li+ > Na+ > K+,
номер 483745) (Sigma-Aldrich), поливинилиденфто-
так что ионы натрия более мобильны в структурах
рид (≥99.5%, EQ-Lib-PVDF, MTI Corp.), углеродная
гексацианоферратов металлов, чем ионы лития [10].
сажа «Super P» (EQ-Lib-SuperP, MTI Corp.), MnSO4
Если оба иона переходного металла M и Мʹ могут
(х.ч.), цитрат натрия Na3C6H5O7 (х.ч.), NaCl (х.ч.)
в рабочем диапазоне потенциалов подвергаться одно-
(ООО «НеваРеактив»). Растворы для синтеза гекса-
электронному редокс-переходу (2+/3+), в результате
цианоферрата марганца готовили с использованием
при варьировании х в составе KxMy[Mʹ(CN)6]z∙nH2O
деионизированной воды с сопротивлением не более
от 0 до 2 может достигаться теоретическая емкость
18 MОм, полученной на установке очистки Millipore
материала до 155 мА·ч·г-1. В частности, к таким
Direct-Q UV (Millipore).
соединениям относятся гексацианоферраты марган-
Для синтеза гексацианоферрата марганца (да-
ца, в которых оба из составляющих решетку ионов
лее — MnHCF) гидротермальным методом 6 ммоль
переходных металлов (марганца и железа) могут
MnSO4 растворяли в 100 мл воды и добавляли по
участвовать в одноэлектронных редокс-переходах.
каплям к раствору 3 моль Na4[Fe(CN)6], 12 ммоль
Многочисленные примеры различных гексациано-
цитрата натрия и 0.24 моль NaCl в 100 мл воды.
ферратов металлов, исследованных в качестве мате-
Синтез шел около 3 ч при интенсивном перемеши-
риалов металл-ионных аккумуляторов, приводятся
вании магнитной мешалкой в атмосфере аргона при
в обзорах [3-5]. Среди ранее изученных в качестве
85°С. После окончания добавления раствора получен-
материалов катодов соединений доминирующее по-
ную смесь перемешивали в тех же условиях еще 3 ч.
ложение занимают материалы на основе собствен-
Полученный белый осадок отделяли фильтрованием
но Берлинской лазури, а также гексацианоферраты
и сушили 12 ч в вакууме при 120°С для удаления
меди, цинка, никеля и кобальта, в то время как ис-
кристаллизационной воды цеолитного типа.
следованиям материалов на основе гексацианофер-
Морфологию полученных осадков исследовали на
рата марганца уделялось заметно меньше внимания
сканирующем электронном микроскопе SUPRA 40VP
[4, 8].
(Carl Zeiss) при ускоряющем напряжении 20 кВ.
Таким образом, актуальность проводимого ис-
Рентгеновские исследования проводили на авто-
следования определяется необходимостью поиска
матическом порошковом дифрактометре D2 Phaser
новых способов синтеза наноструктурированных
(Bruker), излучение рентгеновской трубки — CuKα1+2
Синтез и исследование электрохимических свойств гексацианоферрата марганца...
813
(длины волн CuKα1 — 1.54059 Å и CuKα2 — 1.54443 Å)
Обсуждение результатов
в диапазоне 2θ 10°-70°. Идентификация фаз прово-
Путем гидротермального синтеза был получен по-
дилась с использованием программного комплекса
рошок гексацианоферрата марганца (MnHCF), состав
PDXL2 (Rigaku) с использованием базы порошко-
которого, согласно [11], соответствует соединению
вых дифракционных данных Powder Diffraction File
Na2MnFe(CN)6∙nН2О.
(PDF-2, ICDD, 2016).
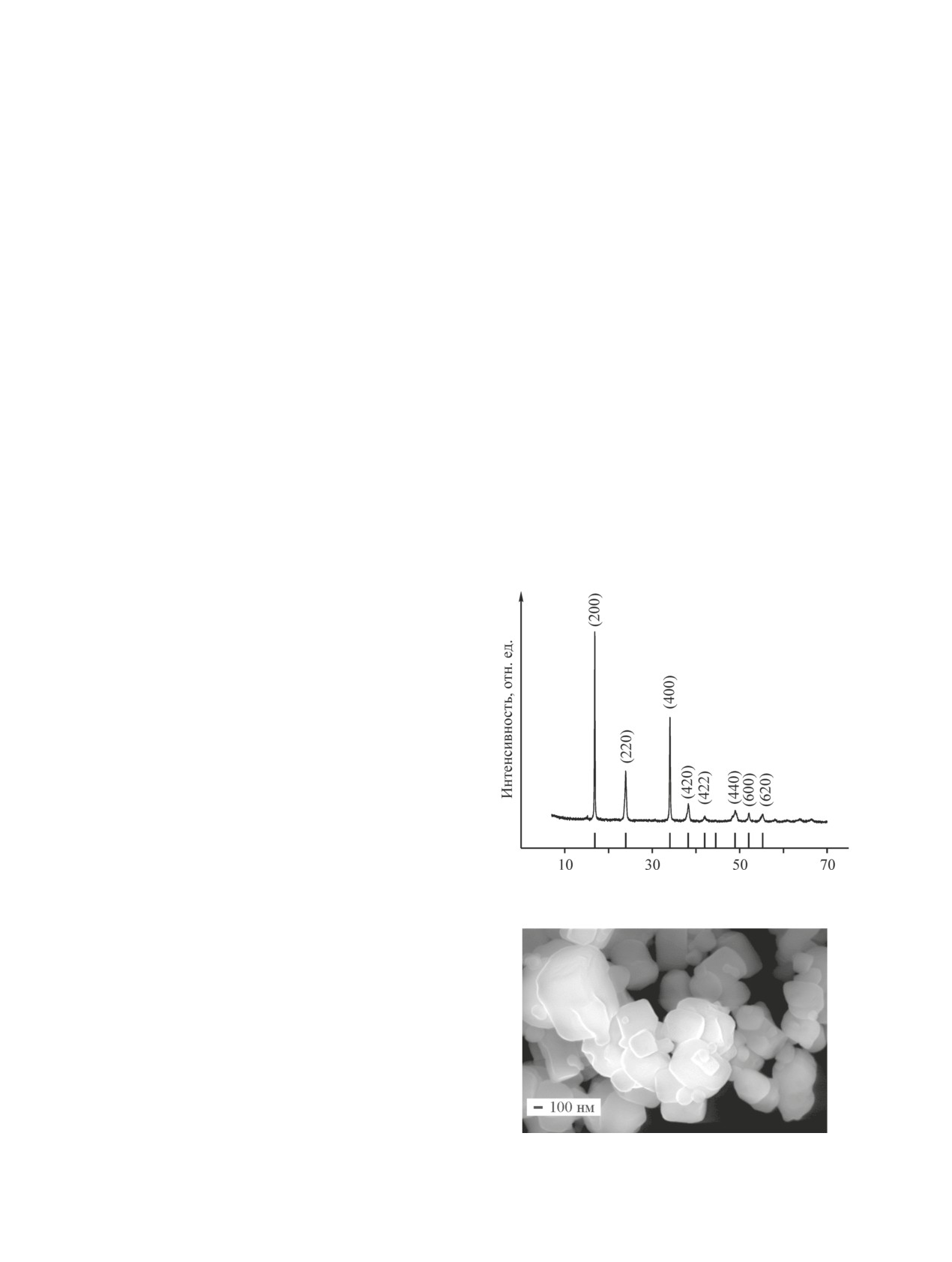
По данным рентгеновской дифракции (рис. 1),
Термографические исследования проводили с ис-
полученный порошок MnHCF обладает кубической
пользованием прибора TG 209 F1 Libra (Netzsch) при
структурой с пространственной группой Fm3m.
скорости нагрева 2 град·мин-1 в токе N2 в диапазоне
Наиболее интенсивные дифракционные пики при
температур от комнатной до 350°C.
величинах 2θ, равных 16.86°, 23.93°, 34.04°, 38.24°,
Электроды были изготовлены по стандартной тех-
42.01°, 44.52°, 48.94° и 52.07°, отнесены к кристал-
нологии. Для приготовления активной массы смесь
лическим плоскостям (200), (220), (400), (420), (422),
активного вещества, проводящей добавки (углерод-
(440), (600) и (620) кубической решетки, что согласу-
ной сажи) и связующего тщательно перетирали в
ется с данными [12]. Заметного количества примес-
агатовой ступке. В качестве связующего использова-
ных фаз не детектируется.
ли поливинилиденфторид (PVDF), растворенный в
Порошок MnHCF состоит из частиц правильной
N-метилпирролидоне. Массовое соотношение ком-
формы размером 150-300 нм, размер крупных частиц
понентов MnHCF:углеродная сажа:PVDF составляло
достигает 1000 нм (рис. 2).
70:20:10 мас%. Приготовленную активную массу
Термографический анализ воздушно-сухого по-
наносили аппликатором с фиксированным зазором
рошка синтезированного гексацианоферрата мар-
на токопроводящую основу (Al-фольгу), проводи-
ганца показал (рис. 3), что с ростом температуры
ли первоначальную сушку электродов в сушильном
шкафу в вакууме при температуре 80°С (6 ч), затем
прессование под механическим ролл-прессом и окон-
чательную сушку в вакууме при 60°С перед помеще-
нием электродов в ячейку. Масса активного вещества
на электродах составляла 3-5 мг·см-2.
Электрохимические свойства электродов иссле-
довали в герметичных трехэлектродных ячейках
в электролите 1 М NaClO4 в пропиленкарбонате с
графитовым противоэлектродом большой площади.
В качестве электрода сравнения использовали хло-
рид-серебряный электрод, соединенный с основным
раствором солевым мостиком с ключом, заполнен-
ным раствором 1 М NaClO4 в пропиленкарбонате.
Значения потенциалов были пересчитаны и приведе-
ны относительно Na/Na+-электрода. Ячейки собирали
и тестировали в заполненном аргоном сухом боксе
Рис. 1. Рентгенограмма порошка MnHCF.
(Unilab) при комнатной температуре.
Циклические вольтамперограммы были получены
с использованием потенциостата Autolab PGSTAT 30
(Eco-Chemie) в интервале потенциалов 2.7-3.9 В при
скорости развертки 2 мВ·с-1. Исследование методом
гальваностатического заряда-разряда проводилось на
автоматической гальваностатической рабочей стан-
ции (Neware) в интервале потенциалов 2.8-4.0 В.
Токи разряда варьировались от 50 до 1050 мА·г-1,
что примерно соответствовало токам в единицах те-
оретической емкости от 0.5С до 9С. Полученные
величины емкости (Q) нормировались на массу ак-
тивного электродного материала (гексацианоферрата
Рис. 2. Электронная микрофотография порошка куби-
марганца).
ческого MnHCF.
814
Каменский М. А. и др.
На циклических вольтамперограммах электродов
MnHCF/PVDF (рис. 4) наблюдались две пары катод-
ных и анодных пиков, которые относятся к после-
довательно протекающим процессам электрохими-
ческой интеркаляции натрия при перезарядке ионов
марганца и железа в структуре гексацианоферрата
марганца. Первая пара редокс-пиков при формаль-
ном потенциале около 3.15 В отнесена к изменению
степени окисления внутрисферных ионов железа
[Fe(CN)6]3-/4-, а вторая пара пиков при более положи-
тельных потенциалах относится к изменению степени
окисления ионов марганца Mn3+/2+ [4, 8].
Первая пара редокс-пиков Fe3+/Fe2+ при потен-
циалах около 3.15 В более четко выражена и доста-
точно симметрична, в то время как редокс-пики для
перехода Mn3+/Mn2+ менее выражены и наблюдается
Рис. 3. Зависимость потери массы порошка MnHCF от
разность значений потенциалов катодного и анодного
температуры при скорости нагрева 2 град·мин-1.
пиков около 200 мВ. Эти результаты свидетельствуют
о более быстрой кинетике редокс-перехода Fe3+/Fe2+,
наблюдается падение массы в интервале температур
сопровождаемого процессом интеркаляции ионов
90-110°C, связанное с потерей кристаллизационной
натрия, чем для редокс-перехода Mn3+/Mn2+. Разная
воды, а наибольшее падение массы наблюдается в
площадь под пиками токов для первого и второго
области температур 110-160°C, связанное с потерей
редокс-переходов при выбранной скорости развертки
кристаллизационной воды цеолитного типа. В целом
потенциала свидетельствует о неполном использо-
потеря массы составляет ~11.5%, что соответствует
вании редокс-емкости в области перезарядки ионов
потере около двух молекул воды на одну молекулу
марганца в структуре гексацианоферрата марганца,
вещества. Полученный результат согласуется с дан-
которое может быть обусловлено как медленной ки-
ными о потере воды из гексацианоферрата марганца,
нетикой редокс-процесса Mn3+/Mn2+, так и большим
полученного близким способом синтеза [8].
внутренним омическим сопротивлением электрода.
На основе полученного порошка MnHCF готовили
активную массу для получения намазных электродов.
Для этого использовали традиционное связующее
поливинилиденфторид, обеспечивающее хорошие
механические свойства электрода MnHCF/PVDF.
Рис. 5. Кривые гальваностатического заряда-разряда
Рис. 4. Циклические вольтамперограммы электрода
электродов MnHCF/PVDF в 0.5 M NaClO4 в пропилен-
MnHCF/PVDF в 0.5 M NaClO4 в пропиленкарбонате,
карбонате, значения токов заряда-разряда указаны в
ν = 2 мВ∙с-1.
легенде.
Синтез и исследование электрохимических свойств гексацианоферрата марганца...
815
Исследование электродов MnHCF/PVDF методом
что составляет около 6% от начальной емкости.
гальваностатических зарядно-разрядных кривых про-
Полученные результаты показали, что изученный
водили при различных токах заряда-разряда (рис. 5).
состав электродного материала имеет достаточно
На всех разрядных кривых при наиболее низких то-
высокую стабильность емкости при длительном за-
ках разряда присутствуют два плато: при потенци-
рядно-разрядном циклировании.
але около 3.65 В (отн. Na/Na+) и потенциале около
3.25 В (отн. Na/Na+). Это соответствует двустадийно-
Выводы
му процессу перезарядки ионов железа и марганца,
Уст ановлены условия гидротерма льно-
сопровождающемуся интеркаляцией ионов натрия в
го синтеза гексацианоферрата марганца соста-
структуру гексацианоферрата марганца.
ва Na2MnFe(CN)6∙nН2О с кубической структурой.
При токе разряда 50 мА·г-1 значение удельной
Полученные величины удельной емкости материала
емкости электрода MnHCF/PVDF в пересчете на ак-
и их высокая стабильность позволяют рассматривать
тивный материал составляет 85 мА·ч·г-1, что меньше
электродный материал на основе гексацианофер-
величин емкости, найденных для гексацианоферра-
рата марганца как перспективный для дальнейшей
тов марганца с моноклинной структурой в близких
разработки и применения в составе натрий-ионных
по составу электродных материалах в работах [13,
аккумуляторов.
14]. Это связано как с используемыми нами более
высокими плотностями тока, так и с неполным про-
теканием электродного процесса в области второго
Благодарности
редокс-перехода Mn3+/Mn2+ для исследуемой кубиче-
Исследования методом сканирующей элек-
ской структуры гексацианоферрата марганца.
тронной микроскопии проведены с использовани-
С ростом токов заряда-разряда происходит сокра-
ем оборудования РЦ «Нанотехнологии» Научного
щение участков плато потенциала, что говорит о со-
парка СПбГУ. Исследования методом порошковой
кращении величины удельной емкости электродного
рентгеновской дифракции проведены с использова-
материала. Наблюдаемое уменьшение удельной емко-
нием оборудования РЦ «Рентгенодифракционные
сти материала связано с кинетическими причинами,
методы исследования» Научного парка СПбГУ.
неполным зарядом и соответственно разрядом при
Термографические исследования выполнены в РЦ
повышенных плотностях тока. Основное сокращение
«Термогравиметрические и калориметрические ме-
емкости связано с редокс-процессом перезарядки ио-
тоды исследования» Научного парка СПбГУ.
нов марганца, для которого наблюдается практически
полное исчезновение плато разряда. Такой ход зави-
симостей связан с затрудненным восстановлением
Финансирование работы
ионов Mn3+ при больших скоростях заряда-разряда
Работа выполнена при финансовой поддержке
вследствие проявления эффекта Яна-Телллера [15].
Санкт-Петербургского государственного универси-
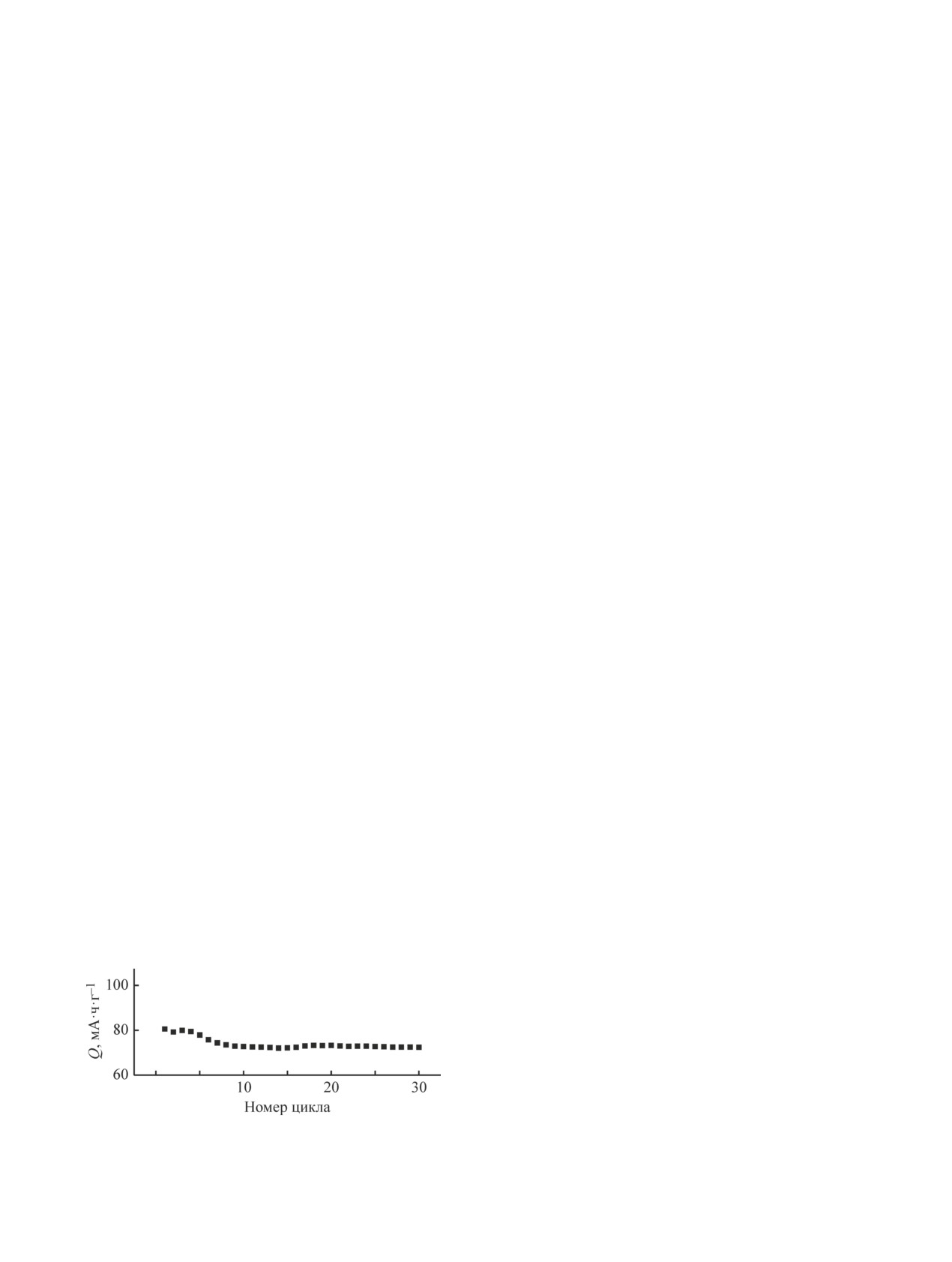
Емкость электрода при плотности тока 90 мА·г-1
тета (грант № 26455158).
немного снижается в течение первых последователь-
ных зарядно-разрядных циклов, а затем практически
не изменяется с ростом числа циклов заряда-разряда
Конфликт интересов
(рис. 6). После 30 циклов заряда-разряда удельная
Авторы заявляют об отсутствии конфликта инте-
емкость электродов снизилась с 80 до 75 мА·ч·г-1,
ресов, требующего раскрытия в данной статье.
Информация об авторах
Каменский Михаил Александрович,
Шкреба Екатерина Владимировна,
Толстопятова Елена Геннадьевна, к.х.н., доцент,
Рис. 6. Зависимость удельной емкости электро-
Кондратьев Вениамин Владимирович, д.х.н.,
да MnHCF/PVDF от числа циклов заряда-разряда,
I = 90 мА·г-1.
816
Каменский М. А. и др.
Список литературы
[9] Тананаев И. В., Сейфер Г. Б., Харитонов Ю. Я.,
Кузнецов В. Г., Корольков А. П. // Химия ферроци-
[1] Tarascon J.-M., Armand M. Issues and challenges
анидов. М.: Наука, 1971. С. 78-80.
facing rechargeable lithium batteries // Nature. 2001.
[10]
Bie X., Kubota K., Hosaka T., Chihara K., Komaba S.
A novel K-ion battery: Hexacyanoferrate(II)/graphite
[2] Deng J., Luo W. B., Chou S. L., Liu H. K., Dou S. X.
cell // J. Mater. Chem. A. 2017. V. 5. P. 4325-4330.
Sodium-ion batteries: From academic research to
practical commercialization // Adv. Energy Mater. 2018.
[11]
Shen Z., Guo S., Liu C., Sun Y., Chen Z., Tu J., Liu S.,
V. 8. ID 1701428.
Cheng J., Xie J., Cao G., Zhao X. Na-rich Prussian
white cathodes for long-life sodium-ion batteries // ACS
[3] Eftekhari A., Kim D.-W. Sodium-ion batteries: New
Sustainable Chem. Eng. 2018. V. 6. P. 16121-16129.
opportunities beyond energy storage by lithium // J.
Power Sources. 2018. V. 395. P. 336-348.
[12]
Zhang X., He P., Zhang X., Li C., Liu H., Wang S.,
Dong F. Manganese hexacyanoferrate/multi-walled
[4] Yabuuchi N., Kubota K., Dahbi M., Komaba S. Research
carbon nanotubes nanocomposite: Facile synthesis,
development on sodium-ion batteries // Chem. Rev.
characterization and application to high performance
2014. V. 114. P. 11636-11682.
supercapacitors // Electrochim. Acta. 2018. V. 276.
P. 92-101.
[5] Lu Y., Wang L., Cheng J., Goodenough J. B. Prussian
blue: A new framework of electrode materials for
[13]
Moritomo Y., Urase S., Shibata T. Enhanced battery
sodium batteries // Chem. Commun. 2012. V. 48.
performance in manganese hexacyanoferrate by partial
substitution // Electrochim. Acta. 2016. V. 210. P. 963-
[6] Fernández-Ropero A. J., Piernas-Muñoz M. J.,
Castillo-Martínez E., Rojo T., Casas-Cabanas M.
[14]
Sottmann J., Bernal F. L. M., Yusenko K. V.,
Electrochemical characterization of NaFe2(CN)6
Herrmann M., Emerich H., Wragg D. S.,
Prussian blue as positive electrode for aqueous sodium-
Margadonna S. In operando synchrotron XRD/
ion batteries // Electrochim. Acta. 2016. V. 210. P. 352-
XAS investigation of sodium insertion into
the Prussian blue analogue cathode material
[7] Chen J., Wei L., Mahmood A., Pei Z., Zhou Z., Chen X.,
Na1.32Mn[Fe(CN)6]0.83·zH2O // Electrochim. Acta.
Chen Y. Prussian blue, its analogues and their derived
2016. V. 200. P. 305-313.
materials for electrochemical energy storage and
conversion // Energy Storage Mater. 2020. V. 25.
[15]
Moritomo Y., Wakaume K., Takachi M., Zhu X. H.,
Kamioka H. Li+ intercalation of manganese
[8] Song J., Wang L., Lu Y., Liu J., Guo B., Xiao P., Lee J. J.,
hexacyanoferrate as investigated by in situ valence-
Yang X.-Q., Henkelman G., Goodenough J. B. Removal
differential absorption spectroscopy // J. Phys. Soc.
of interstitial H2O in hexacyanometallates for a superior
Jpn. 2013. V. 82. ID 094710.
cathode of a sodium-ion battery // J. Am. Chem. Soc.
2015. V. 137. P. 2658-2664.