Журнал прикладной химии. 2021. Т. 94. Вып. 8
ПРИКЛАДНАЯ ЭЛЕКТРОХИМИЯ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
УДК 622.276+547.333+620.197.3
ЗАМЕЩЕННЫЕ ПРОПАРГИЛАМИНЫ —
ИНГИБИТОРЫ КИСЛОТНОЙ КОРРОЗИИ СТАЛЕЙ ДЛЯ НЕФТЕДОБЫЧИ
© М. И. Шатирова1, Я. Г. Авдеев2,*, У. Ш. Джафарова3
1 Институт полимерных материалов НАН Азербайджана,
AZ5004, Азербайджанская Республика, г. Сумгаит, ул. С. Вургуна, д. 124
2 Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, г. Москва, Ленинский пр., д. 31, к. 4
3 Институт химии присадок им. А. М. Кулиева НАН Азербайджана,
AZ1029, Азербайджанская Республика, г. Баку, Нариманов, Зия Буниятова, квартал 2062
* E-mail: avdeevavdeev@mail.ru
Поступила в Редакцию 14 декабря 2020 г.
После доработки 12 августа 2021 г.
Принята к публикации 23 августа 2021 г.
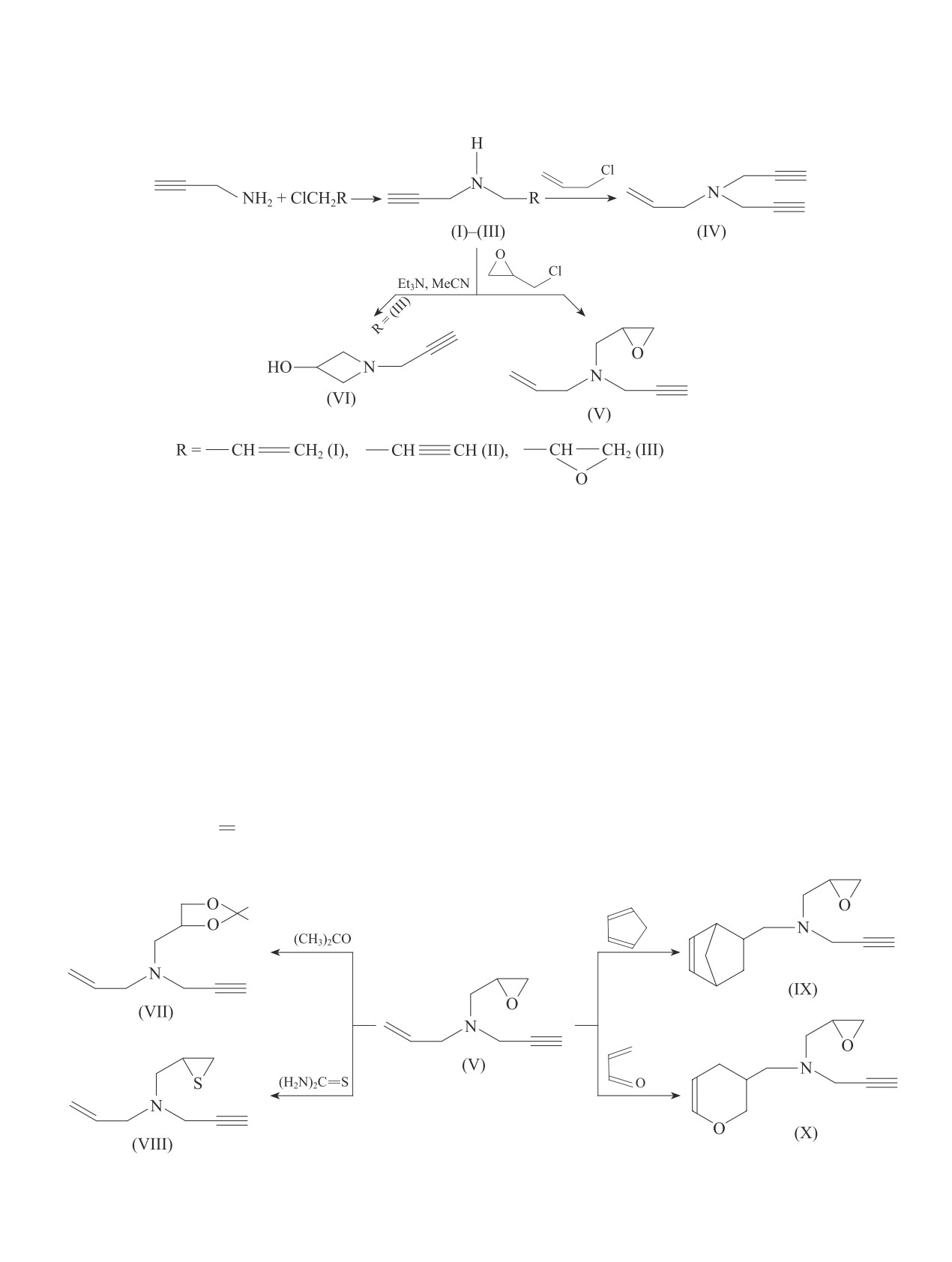
На основе пропаргиламина синтезированы вторичные и третичные амины ацетиленового ряда раз-
личного строения (14 соединений). Установлена возможность существенного торможения этими
веществами коррозии низкоуглеродистой стали в горячих растворах соляной кислоты. Защитный
эффект ацетиленовых аминов усиливается с увеличением их содержания в агрессивной среде и при
повышении ее температуры. Максимальный эффект защиты обеспечивают третичные амины,
содержащие в качестве заместителя 2,3-эпоксипропил или 2,3-эпитиопропил. Наличие в структуре
этих ацетиленовых соединений химически активных эпокси- и эпитиогрупп способствует стимули-
рованию процесса их полимеризации на поверхности стали посредством раскрытия тройных связей
С С, приводящего к быстрому формированию на ней защитной пленки полимера.
Ключевые слова: коррозия; ингибиторы коррозии; низкоуглеродистая сталь; пропаргиламин
DOI: 10.31857/S0044461821080107
Солянокислотная обработка является эффектив-
коррозии, рекомендуемые для защиты стальных кон-
ным методом воздействия на призабойную зону не-
струкций при проведении такой технологической
фтеносных и газоносных пластов с целью прироста
операции, обсуждаются в работе [4]. Они в своей
добычи углеводородного сырья [1-3]. Проведение
основе представлены соединениями класса аминов,
этой технологической операции часто невозможно
четвертичных аммониевых солей, азометинов, N- и
без использования ингибиторов кислотной корро-
S-содержащих гетероциклов, меркаптанов и тиолов.
зии, сводящих к минимуму агрессивное действие
Подавляющее большинство этих соединений не в
соляной кислоты на стальные части подземного обо-
полной мере соответствуют жестким требованиям со-
рудования скважин и применяемой для этого спец-
временного производства, поскольку верхний предел
техники [4]. Наиболее важные группы ингибиторов
температурного диапазона их эксплуатации ограни-
1040
Замещенные пропаргиламины — ингибиторы кислотной коррозии сталей для нефтедобычи
1041
чивается 60°С [4], при более высоких температурах
х.ч.), гидроксид калия (АО «ЭКОС-1», х.ч.), гептаги-
они становятся неэффективны в защите металла [5].
драт сульфата магния (АО «ЛенРеактив», х.ч.), карбо-
Это не позволяет использовать их для защиты сталь-
нат калия (ООО «АО Реахим», х.ч.), соляную кислоту
ных конструкций при солянокислотной обработке
(АО «ЭКОС-1», х.ч.). В качестве растворителей были
нефтяных и газовых месторождений с повышенной
использованы ацетонитрил (ООО ТД «Химмед», кат.
температурой в забое, когда растворы кислоты мо-
№ КА-ВО501109, х.ч.), ацетон (АО «ЭКОС-1», х.ч.),
гут нагреваться до температуры существенно выше
метиловый спирт (АО «ВЕКТОН», х.ч.), этиловый
100°С [1-3]. Этого недостатка во многом лишены
спирт (АО «ВЕКТОН», х.ч.), диэтиловый эфир (Acros
ингибиторы кислотной коррозии, относящиеся к
Organics, кат. № 176830010, 99+%), изопропиловый
группам ацетиленовых соединений [5, 6]. В основе
спирт (ООО ТД «Химмед», кат. №: 211138, х.ч.), то-
их действия лежит уникальная способность фор-
луол (АО «ЭКОС-1», х.ч.), бензол (Alfa Aesar, кат.
мировать на поверхности корродирующего металла
№ L 14012, 99%), очищенные перегонкой.
слой органического полимера, который эффективно
N-Аллилпропаргиламин (I). В реакционную колбу
обеспечивает защиту металла в горячих кислотах.
помещали 8 г (0.2 моль) гидроксида натрия, 8 мл во-
Подавляющее большинство ингибиторов кислот-
ды, 11.0 г (0.2 моль) пропаргиламина и при энергич-
ной коррозии в тех же условиях десорбируются с
ном перемешивании прикапывали 3.8 г (0.05 моль)
поверхности корродирующего металла, что делает
аллилхлорида в течение 20 мин. Через 2 ч органиче-
невозможным обеспечить его необходимую защиту.
ский слой отделили, перегонкой получили соедине-
Несмотря на большое число работ [7-11], посвящен-
ние (I) с Ткип = 125-126°С (740 мм рт. ст.), nD20 1.4485,
ных изучению ингибирующего действия произво-
d420 0.8350, выход 79%.
дных ацетилена, сведений об исследовании аминов
Аналогичным способом получены N,N-дипропар-
ацетиленового ряда в литературе за последние пять
гиламин (II) и N-пропаргил(2,3-эпоксипропил)-
лет нами не встречено.
амин(III).
Цель работы — синтез и изучение свойств вто-
N,N-Дипропаргиламин (II), Ткип = 175-176°С,
ричных и третичных аминов пропаргилового ряда с
1.4710, 0.8960, выход 76%.
различными заместителями.
N-Пропаргил(2,3-эпоксипропил)амин (III),
Ткип = 74-75(10)°С, 1.4651, 0.9232, выход 70%.
N-Аллил-N,N-дипропаргиламин (IV). В колбу с об-
Экспериментальная часть
ратным холодильником помещали 7.6 г (0.1 моль)
Синтез исследуемых соединений. ИК-спектры
аллилхлорида, при перемешивании приливали 3.7 г
синтезированных соединений регистрировали на
(0.04 моль) соединения (II) в течение 20 мин при
ИК-Фурье-спектрофотометре ALPHA FTIR (фир-
температуре 30°С. Смесь охлаждали до 5-7°С и обра-
ма Bruker) на кристалле ZnSe в диапазоне волно-
батывали 9.6 г KОН в 8 мл воды. Органический слой
вых чисел 600-4000 см-1. Спектры ЯМР 1Н запи-
экстрагировали эфиром и сушили над безводным
саны на спектрометре Bruker FТ-300 (300.13 МГц).
МgSO4. Затем отогнали эфир, добавили ингибитор
Химические сдвиги определены относительно тетра-
«эджрайт» (альдоль-α-нафтиламина) и разогнали в
метилсилана (δ = 0.00 м. д.), в качестве растворителя
вакууме. Получили соединение (IV) с Ткип = 92-93°С
использован СDСl3.
(15 мм рт. ст.), 1.4798, 0.900, выход 78%.
В работе использовали пропаргиламин (Sigma-
N-Аллил-N-(2,3-эпоксипропил)пропаргиламин (V).
Aldrich, кат. № ALP5090-0, 98%), аллилхлорид
а) К 3.8 г (0.04 моль) соединения (I) с 1-2 каплями
[Biochem (Франция), кат. № 401310500, 99%], про-
воды по каплями подавали 3.7 г (0.04 моль) эпихлор-
паргилхлорид (ООО «Кемикал Лайн», 99%), эпихлор-
гидрина. После 1-2 ч перемешивания прибавляли
гидрин (Acros Organics, кат. № 11778-0010, 99%), три-
20 мл этилового спирта и по каплям подавали спир-
этиламин (ООО «Компонент-Реактив», х.ч.), эфират
товой раствор KОН в количестве 2.1 г. После филь-
трифторида бора (Alfa Aesar, кат. № 41796, 46.5%),
трования и отгонки спирта выделили соединение (V)
циклопентадиен (Sigma-Aldrich, кат. № 45433-8,
с Ткип = 92-94°С (9 мм рт. ст.), 1.4718, 0.9513, выход
96%), акролеин (Fluka, кат. № 01680, 97%), гидро-
43%.
хинон (ООО «ВитаРеактив», ч.), нитрил акриловой
б) К раствору 5.2 г (0.055 моль) соединения (I)
кислоты (Sigma-Aldrich, кат. № 32013-7, 99+%), тио-
в 30 мл изопропилового спирта в атмосфере азота
мочевину (ООО «АО Реахим», х.ч.), мочевину (ООО
по каплям добавляли 5.1 г (0.055 моль) эпихлорги-
«АО Реахим», х.ч.), альдоль-α-нафтиламина (ООО
дрина и помещали на ледяную баню (0°С). Затем
«АО Реахим», ч.), гидроксид натрия (АО «ЭКОС-1»,
эту смесь перемешивали при комнатной темпера-
1042
Шатирова М. И. и др.
туре в течение 24 ч и концентрировали при пони-
и выделяли 4.7 г (71 %) соединения (VIII) с Ткип = 77-
женном давлении. Остаток очищали при помощи
78°C (2 мм рт. ст.), 1.5990, 0.9812. ИК-спектр, ν, см-1:
колоночной хроматографии. Использовали стеклян-
2170, 3300 (С СН), 1645, 3085 (—НС СН2), 700
ную колонку (длина — 300 мм, диаметр — 10 мм),
(С—S). Спектр ЯМР 1Н, δ, м. д.: 2.16-2.50 м (2H,
наполнитель — силикагель КСКГ для хроматографии
СН2S), 2.49 т (1Н, С СН, 4J = 2.4 Гц), 2.78-3.10 м
(фракция 0.125-0.2 мм), SORBIS GROUP, элюент —
(1Н, СНS), 3.27 д (2H, 4J = 2.4 Гц, NCH2), 3.31-3.48 м
бензол:диэтиловый эфир = 3:1. Получили 6.8 г (88%)
(2Н, NCH2), 5.00-5.30 м (2Н, СН2 С), 5.45-5.90 м
соединения (V).
(1Н, СН).
N-(3-Азетидинолил)пропаргиламин (VI). К 5.6 г
Найдено (%): C 64.51, H 7.65, N 8.47, S 19.02.
(0.05 моль) раствора N-пропаргил(2,3-эпоксипропил)-
C9H13NS. Вычислено (%): C 64.67, H 7.78, N 8.38, S 19.16.
амина (III) в 10 мл сухого ацетонитрила при 0°С мед-
N-Метиленнорборненил-N-(2,3-эпоксипропил)про-
ленно добавляли 15.3 г (0.15 моль) триэтиламина на
паргиламин (IX). Смесь 3.8 г (0.025 моль) соединения
протяжении 10-20 мин. Реакционную массу пере-
(V) и 1.6 г (0.025 моль) циклопентадиена нагревали
мешивали при 0-5°С еще 30 мин, далее нагревали
в присутствии 0.05 г гидрохинона в запаянной ам-
массу при кипячении 1-2 ч. После охлаждения рас-
пуле в течение 8-10 ч при 175-180°C. По окончании
творитель удаляли в вакууме и выделяли соединение
реакции реакционную массу подвергали вакуумной
(VI) с Тпл = 47-48°С. ИК-спектр, ν, см-1: 3335 (О—Н),
разгонке. При этом отгонялись непрореагировавшие
1180 (С—N), 2176, 3295 ( СН). Спектр ЯМР 1Н,
исходные компоненты, а целевой продукт подвер-
δ, м. д.: 2.38 д (4Н, NСН2, 3J = 10.2 Гц), 2.45 т (1Н,
гали повторной разгонке и отделяли аддукт (IX) с
С СН, 4J = 2.2 Гц), 3.40 д (2H, NCH2, 4J = 2.2 Гц),
Ткип = 121-122°С (2 мм рт. ст.), 1.5147, 1.0296, выход
3.64 м (1Н, СНО), 3.80 с (1Н, ОН).
73%. ИК-спектр, ν, см-1: 2175, 3295 (С СН), 1658
Найдено (%): C 64.71, H 8.25, N 12.50.
(НС СН), 3045, 1255, 940 (эпокси цикл). Спектр
C6H9NO. Вычислено (%): C 64.86, H 8.11, N 12.61.
ЯМР 1Н, δ, м. д.: 0.53-0.74 м (1Н, СН6эндо), 1.17-
N-Аллил-N-(метилен-1,3-диоксоланил)пропар-
1.52 м (2Н, СН27син, анти в мостике), 1.68-1.95 м (1Н,
гиламин (VII). К смеси 8.1 г ацетона, содержащего
СН6ʹэкзо), 2.15-2.30 м (1Н, СН5 в цикле), 2.43 т (1Н,
0.1 мл эфирата трехфтористого бора, добавляли 1.4 г
С СН, 4J = 2.4 Гц), 2.48-2.96 м (8Н, СН1,4 в голове
(0.01 моль) эпоксида (V). При этом наблюдалось не-
мостика, CH2О и ОСН2 в цикле), 3.37 д (2H, NCH2,
большое повышение температуры. После суточного
4J = 2.4 Гц), 3.43-3.75 м (4H, 2NCH2).
стояния реакционную смесь тщательно обрабатывали
Найдено (%): C 77.30, H 8.65, N 6.60.
насыщенным водным раствором K2CO3, отделяли
C14H19NO. Вычислено (%): C 77.42, H 8.76, N 6.45.
органический слой, сушили над MgSO4 и разгонкой
N-Метилендигидропиранил-N-(2,3-эпоксипропил)-
в вакууме выделяли 9 г (64%) соединения (VII) с
пропаргиламин (X). Смесь 7.5 г (0.05 моль) соедине-
Ткип = 116-117°С (1 мм рт. ст.), 1.4767, 0.990. ИК-
ния (V), 2.8 г (0.05 моль) акролеина, 10 мл толуола
спектр, ν, см-1: 1640, 3035, 3080 (—НС СН2), 950
в присутствии 0.05 г гидрохинона нагревали в запа-
(диоксолан. цикл), 2130, 3275 (С СН). Спектр ЯМР
янной ампуле при 175-180°С в течение 8 ч. После
1Н, δ, м. д.: 1.33 с (3Н, СН3), 1.42 с (3Н, СН3), 2.47 т
обработки и двукратной разгонки выделяли соеди-
(1Н, С СН, 4J = 2.4 Гц), 2.89 д.д (2Н, СН2О), 3.10-
нение (X) с Ткип = 125-126°С (1 мм рт. ст.), 1.4834,
3.20 м (2H, NCH2), 3.26 д (2H, NCH2, 4J = 2.4 Гц),
1.0668, выход 66%. ИК-спектр, ν, см-1: 2180, 3285
3.35-3.46 м (2Н, NСН2), 4.10-4.30 м (1Н, ОСН),
(С СН), 1660 (НС СН), 3060, 1258, 910 (эпок-
4.80-5.50 м (2Н, СН2 С), 5.60-6.20 м (1Н, СН).
си цикл). Спектр ЯМР 1Н, δ, м. д.: 2.43 т (1Н,
Найдено (%): C 70.10, H 9.15, N 6.58.
С СН, 4J = 2.2 Гц), 2.50-2.80 м (6Н, СН2СН2 и СН2О
C12H19NO2. Вычислено (%): C 68.90, H 9.09, 6.70.
в цикле), 2.90-3.15 м (2Н, 2СНО), 3.26-3.65 м (6H,
N-Аллил-N-(2,3-эпитиопропил)пропаргиламин
3NCH2), 5.90-6.10 м (2Н, СН СН).
(VIII). В колбу емкостью 250 мл загружали 3.3 г
Найдено (%): C 69.61, H 8.15, N 15.33.
(0.024 моль) соединения (V), 6.5 г (0.086 моль) тио-
C12H17NO2. Вычислено (%): C 69.57, H 8.21, N 15.46.
мочевины и 50 мл абсолютного метилового спирта.
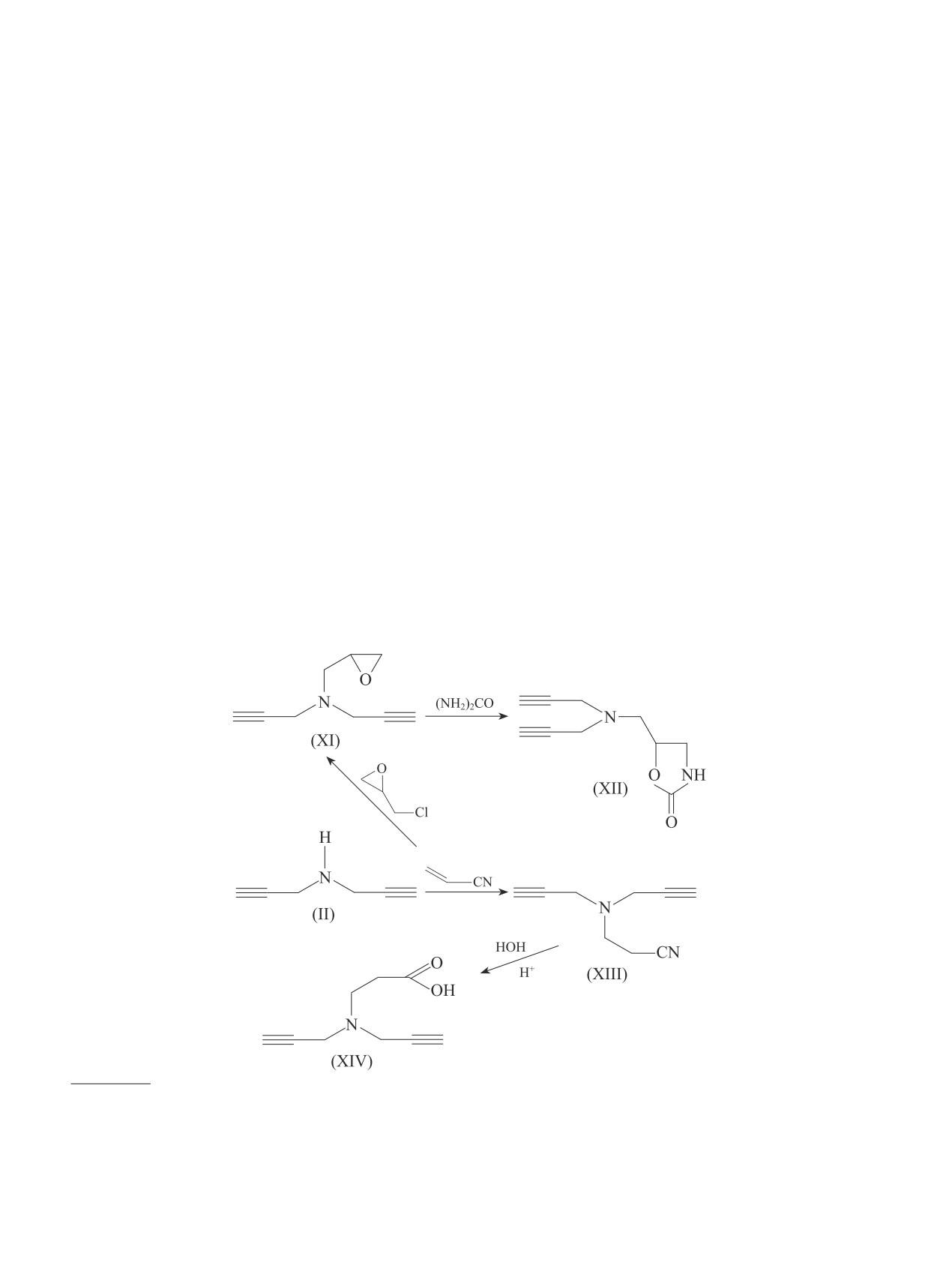
N-(2,3-Эпоксипропил)-N,N-дипропаргиламин (XI).
Содержимое колбы перемешивали при температуре
Аналогично методу получения (IV) из 4.6 г соедине-
60-65°C в течение 24 ч, затем обрабатывали водой,
ния (II) и 4.6 г эпихлоргидрина получено вещество
экстрагировали эфиром и сушили над MgSO4. После
(XI) с Ткип = 111-112ºС (4 мм рт. ст.), 1.4935, 1.0289.
отгонки растворителя остаток перегоняли в вакууме
ИК-спектр, ν, см-1: 2185, 3280 (С СН), 3065, 1260,
Замещенные пропаргиламины — ингибиторы кислотной коррозии сталей для нефтедобычи
1043
916 (эпокси цикл), 1190 (C—N). Спектр ЯМР 1Н,
остатка вакуумной перегонкой выделено вещества
δ, м. д.: 2.30 т (2Н, 2С СН, 4J = 2.4 Гц), 2.40-2.61
(XIV) с Ткип = 139-140°С (1 мм рт. ст.), 1.4879, 1.2885,
(2Н, СН2О), 2.85-3.04 м (1Н, СНО), 3.10-3.28 м (4H,
87%. ИК-спектр, ν, см-1: 2175, 3290 ( СН), 1760
2NCH2), 3.34 д (2H, NCH2).
(С О), 3510, 2815 (О—Н). Спектр ЯМР 1Н, δ, м. д.:
Найдено (%): C 72.30, H 7.25, N 9.52.
2.39 т (2Н, 2С СН, 4J = 2.4 Гц), 3.30 д (4H, 2NCH2,
C9H11NO. Вычислено (%): C 72.48, H 7.38, N 9.40.
4J = 2.4 Гц), 3.41 т (2Н, NCH2, 3J = 11.8 Гц), 3.50 т
N,N-Дипропаргил-2-оксазолидон (XII). К раство-
(2Н, NCH2, 3J = 11.8 Гц), 10.14 с (1Н, СООН).
ру 6 г (0.1 моль) мочевины в 20 мл спирта добав-
Найдено (%): C 65.30, H 6.51, N 8.54.
ляли 15 г (0.1 моль) соединения (XI). Смесь нагре-
C9H11NO2. Вычислено (%): C 65.45, H 6.67, N 8.48.
вали 22 ч при 85-90°C, затем перегонкой удаляли
Коррозионные исследования. Скорость коррозии
спирт, остаток перегоняли в вакууме и обрабаты-
стали 08кп (состав, мас%: 0.05-0.11 С, до 0.03 Si,
вали эфиром. Выпавший осадок отфильтровыва-
0.25-0.5 Mn, до 0.25 Ni, до 0.04 S, до 0.035 P, до
ли, промывали эфиром и высушивали. Выход 56%,
0.1 Cr, до 0.25 Cu, до 0.08 As, остальное Fe) в 5 М НСl
Тпл = 75-76°С. ИК-спектр, ν, см-1: 3410 (N—Н), 1750
при температуре Т = 20-60°С определяли по потере
(С О), 932 (С—О—С), 1190 (С—N). 3280, 2175
массы образцов размером 30 × 20 × 1.0 мм. Перед
( СН). Спектр ЯМР 1Н, δ, м. д.: 2.39 т (2Н,
опытом образцы зачищали шлифовальной машиной,
2С СН, 4J = 2.5 Гц), 2.75-3.00 м (3Н, СНО,
обезжиривали ацетоном и оставляли в эксикаторе
СН2N), 3.10-3.26 м (4H, 2NCH2), 3.34 д (2H, NCH2,
на 24 ч. Содержание исследованных ингибиторов в
4J = 2.5 Гц), 6.92 с (1Н, NН).
растворе составляет 0.25-1.0 г·л-1.
Найдено (%): C 62.41, H 6.13, N 14.69.
Эффективность ингибиторов оценивали по ве-
C10H12N2O2. Вычислено (%): C 62.50, H 6.25, N 14.58.
личинам коэффициента торможения γ = k0/kин, где
N-(Цианоэтил)-N,N-дипропаргиламин (XIII).
k0 и kин — скорость коррозии в фоновом растворе и
К 4.4 г (0.085 моль) соединения (II) при перемеши-
в растворе с изучаемой добавкой. При обсуждении
вании добавляли 6.7 г (0.1 моль) свежеперегнанного
причин различия в защитном действии синтезиро-
нитрила акриловой кислоты. При этом наблюдалось
ванных соединений разной структуры использовалась
повышение температуры реакционной смеси. После
величина гидрофобности молекул, характеризуемая
приливания расчетного количества нитрила содержи-
логарифмом коэффициента (D) их распределения в
мое колбы нагревали 6 ч при температуре 80-90°С,
системе октанол/вода при рН 0, который рассчитыва-
затем подвергали фракционированию. Полученный
ли с помощью программы ACD/ChemSketch.
продукт имел Ткип = 120-121°С (3 мм рт. ст.), 1.4681,
1.1299. ИК-спектр, ν, см-1: 2250 (С N), 2160, 3300
( СН). Спектр ЯМР 1Н, δ, м. д.: 2.34 т (2Н, 2С СН,
4J = 2.4 Гц), 2.40 т (CH2СN, 3J = 12.2 Гц), 3.25-3.40 м
Обсуждение результатов
(4H, 2NCH2), 3.53 т (2H, NCH2, 3J = 12.2 Гц).
Найдено (%): C 73.81, H 6.78, N 19.05.
Показано, что пропаргиламин вступает в реак-
C9H10N2. Вычислено (%): C 73.97, H 6.85, N 19.18.
ции присоединения с аллил-, пропаргилхлорида-
N,N-Дипропаргиламинопропионовая кислота
ми и эпихлоргидрином, образуя соответствующие
(XIV). В реакционную колбу, снабженную механи-
функциональнозамещенные пропаргиламины (I)-
ческой мешалкой и обратным холодильником, по-
(III) с выходом 70-80%. Синтезированный N,N-
мещали 8.3 г (0.05 моль) свежеперегнанного сое-
дипропаргилаллиламин (II) реагирует также с ал-
динения (XIII). Затем к содержимому колбы при
лилхлоридом, а N-аллилпропаргиламин (I) — с
интенсивном перемешивании порциями приливали
эпихлоргидрином благодаря активной N—H-связи
6.0 мл концентрированной соляной кислоты. При
с образованием в одной стадии соответствен-
этом наблюдалось разогревание реакционной смеси
но N-аллил-N,N-дипропаргилаллиламина (IV) и
и образование соли. На следующий день реакцион-
N-аллил-N-(2,3-эпоксипропил)пропаргиламина (V).
ную массу перемешивали при температуре 50-60°С
Показано, что синтезированный N-пропаргил(2,3-
в течение 6-8 ч, затем обработали водой и добавили
эпоксипропил)амин (III) вступает в реакцию с три-
25 мл серного эфира. Отделили водный слой от ор-
этиламином в среде сухого ацетонитрила хемоселек-
ганического, и последний сушили над прокаленным
тивно, образуя N-(3-азетидинолил)пропаргиламин
сульфатом магния. После отгонки растворителя из
(VI) с выходом 64.5% по схеме
1044
Шатирова М. И. и др.
Строение синтезированных непредельных ами-
Реакция непредельного эпоксиамина (V) с нукле-
нов (I)-(VI) подтверждено данными ИК- и ПМР-
офильными реагентами позволяет синтезировать раз-
спектров. В ИК-спектрах соединений (I)-(III) не об-
личные функциональные производные непредельных
наружены две резонансные узкие полосы в области
аминов. При этом взаимодействие соединения (V) с
3500-3300 см-1, свойственные NH2, но при этом об-
ацетоном в присутствии эфирата трехфтористого бора
наружена одна полоса в области 3450-3300, характер-
приводит к образованию 1,3-диоксолана (VII) с выхо-
ная для NH-группы, что доказывает протекание реак-
дом 64.8%. Реакция с тиомочевиной протекает в сре-
ции по N—H-связи. В ИК-спектрах соединений (I),
де метанола при 60-65°С с заменой атома кислорода
(II) идентифицированы полосы поглощения в области
оксиранового кольца атомом серы. При этом образу-
3445-3320, 3335-3267, 2115-2190 и 1630-1645 см-1,
ется непредельный серосодержаший продукт (VIII)
характерные соответственно для вторичной N—H-,
с выходом 71%. Конденсации непредельного эпок-
C CH- и НС СН2-связей. В ПМР-спектрах сое-
сиамина (V) с циклопентадиеном (при 180-195°С) и
динений (I)-(III) зафиксированы сигналы со следу-
акролеином (при 175-180°С) протекают по двойной
ющими химическими сдвигами протонов (δ, м. д.):
связи с образованием производных норборнена и
1.73 с (NH), 3.28 т (2H, NCH2), 4.84-5.17 (СН2 СН),
дигидропирана с эпоксидной группой и терминаль-
5.64-6.00 м (—СН
), 2.25 т (1Н, С СН).
ной ацетиленовой связью (IX), (X) с выходом 73.6 и
65.5% соответственно.
Замещенные пропаргиламины — ингибиторы кислотной коррозии сталей для нефтедобычи
1045
Строение синтезированных непредельных ами-
что наблюдается нами для полученного соединения.
нов (VII)-(X) подтверждено данными ИК- и ПМР-
Для экзо-положения заместителя КССВ должна быть
спектров. В ИК-спектрах синтезированных соеди-
больше по абсолютной величине: J5,6 = 6.0-7.0 Гц.
нений (VII)-(X) имеются полосы в области 3300 и
Дополнительным подтверждением правильности сте-
2125-2145 см-1, характерные для терминальной аце-
реохимических выводов является величина вициналь-
тиленовой связи. Полосы, свойственные эпоксидному
ной КССВ (J5,6′ = 9.0-9.6 Гц) в аддуктах.
кольцу, обнаружены при 3065, 1248 и 915 см-1. В ИК-
Синтезированный амин (II) вступает в реакцию с
спектрах синтезированных соединений (VII), (VIII)
эпихлоргидрином благодаря активной N—H-связи,
имеются полосы, характерные для аллильного фраг-
при этом образуется N-(2,3-эпоксипропил)-N,N-
мента, но при этом полосы, свойственные эпоксидно-
дипропаргиламин (XI). В дальнейшем соединение
му циклу, не обнаружены. В ИК-спектрах соединений
(XI) при нагревании с карбамидом в этиловом спирте
(IX), (X) отсутствуют полосы поглощения, характер-
подвергается внутримолекулярной гетероциклизации
ные для аллильного фрагмента. Идентифицированы
за счет раскрытия оксиранового кольца с последую-
полосы, свойственные терминальной ацетиленовой
щем его замыканием, что приводит к образованию
связи и эпоксидному циклу (3065, 1248 и 915 см-1).
оксазолидинона (XII). Для получения непредельных
В ходе синтеза соединения (IX) можно предполо-
кислот диацетиленового ряда нами была применена
жить образование смеси экзо/эндо-изомеров. В на-
реакция присоединения N,N-дипропаргилаллиламина
шем случае реакция протекает с образованием про-
(II) с акрилонитрилом. Реакция протекает в присут-
дукта с эндо-конфигурацей. Такой вывод основан на
ствии гидроксида калия в течение 5 ч, приводя к об-
том, что у сигнала С6Нэндо, находящегося в сильном
разованию соответствующего нитрила (XIII) с выхо-
поле, имеются две константы спин-спинового взаимо-
дом 75.5%. Установлено, что в среде соляной кислоты
действия (КССВ): геминальная (J6,6′ = 11.3 Гц) и ви-
синтезированный нитрил (XIII) превращается в не-
цинальная (J5,6 = 4.3 Гц). Согласно справочным дан-
предельную кислоту диацетиленового ряда (XIV):
ным,* в случае эндо-положения заместителя вторая
КССВ будет находится в диапазоне J5,6 = 2.5-5.0 Гц,
* Гордон А., Форд Р. Спутник химика. Физико-
химические свойства, методики, библиография / Пер.
В ИК-спектрах третичных аминов (XI)-(XIV)
с англ. Е. Л. Розенберга и С. И. Коппель. М.: Мир,
наряду с присутствием полос при 2245 (С—N)
1976. С. 297-305 [Gordon A. J., Ford R. A. The Chemistʹs
(XIII), 3410, 1140 и 1720 (С О) (XII), 1760 (С О) и
Companion: A Handbook of Practical Data, Techniques and
References. New York: John Wiley and Sons, 1972].
2675 см-1 (СООН) (XIV) обнаружены также полосы
1046
Шатирова М. И. и др.
поглощения в области 2120-2190, 3295-3300 см-1
Изучение влияния синтезированных производных
(С Н) и при 3060, 1243 и 945 см-1, относящиеся к
пропаргиламина на коррозию низкоуглеродистой ста-
С—Н-связям метиновой и метиленовой групп эпок-
ли в растворе HCl позволило выявить шесть наиболее
сидного кольца (XI).
перспективных ингибиторов коррозии, свойства кото-
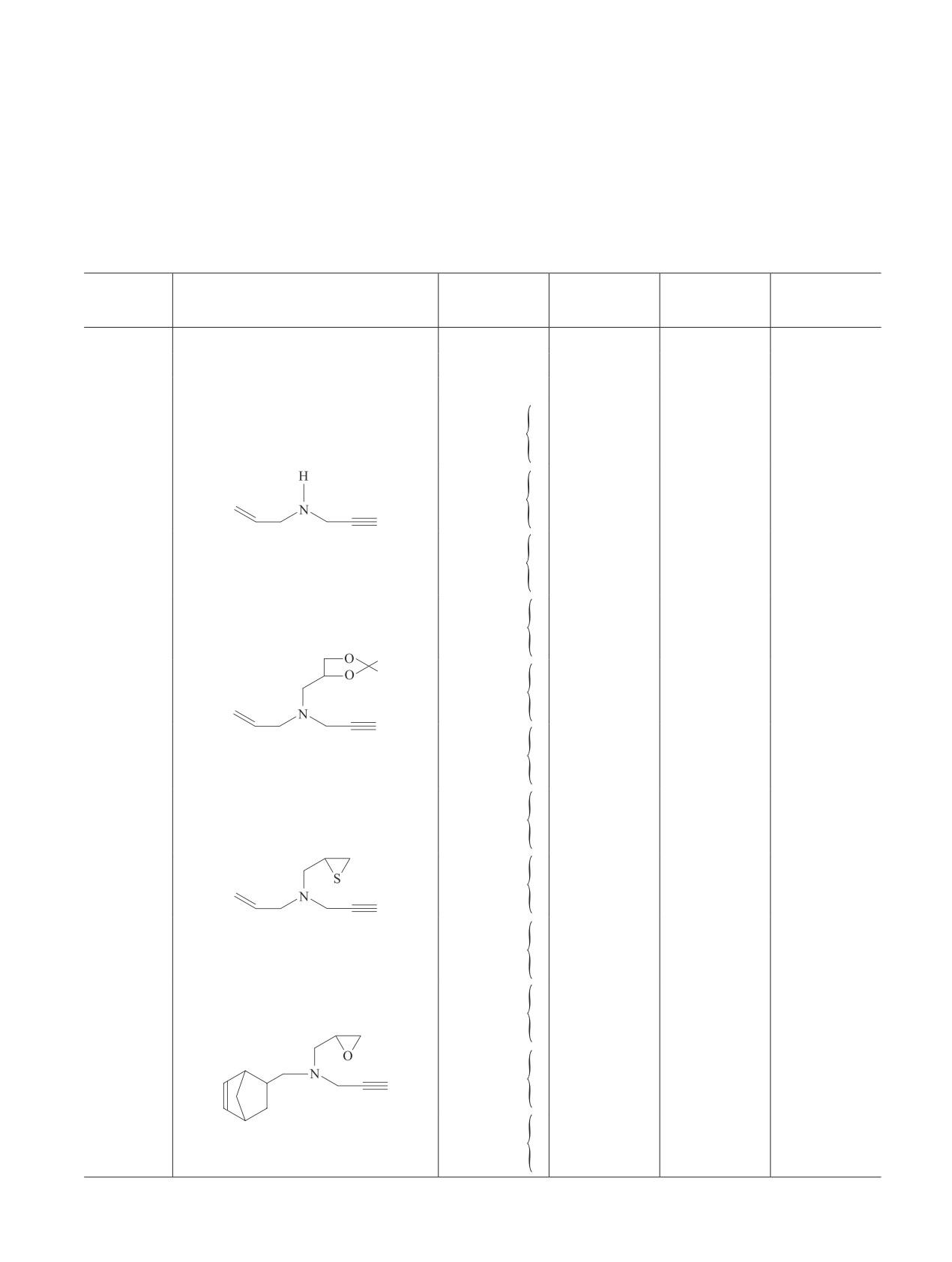
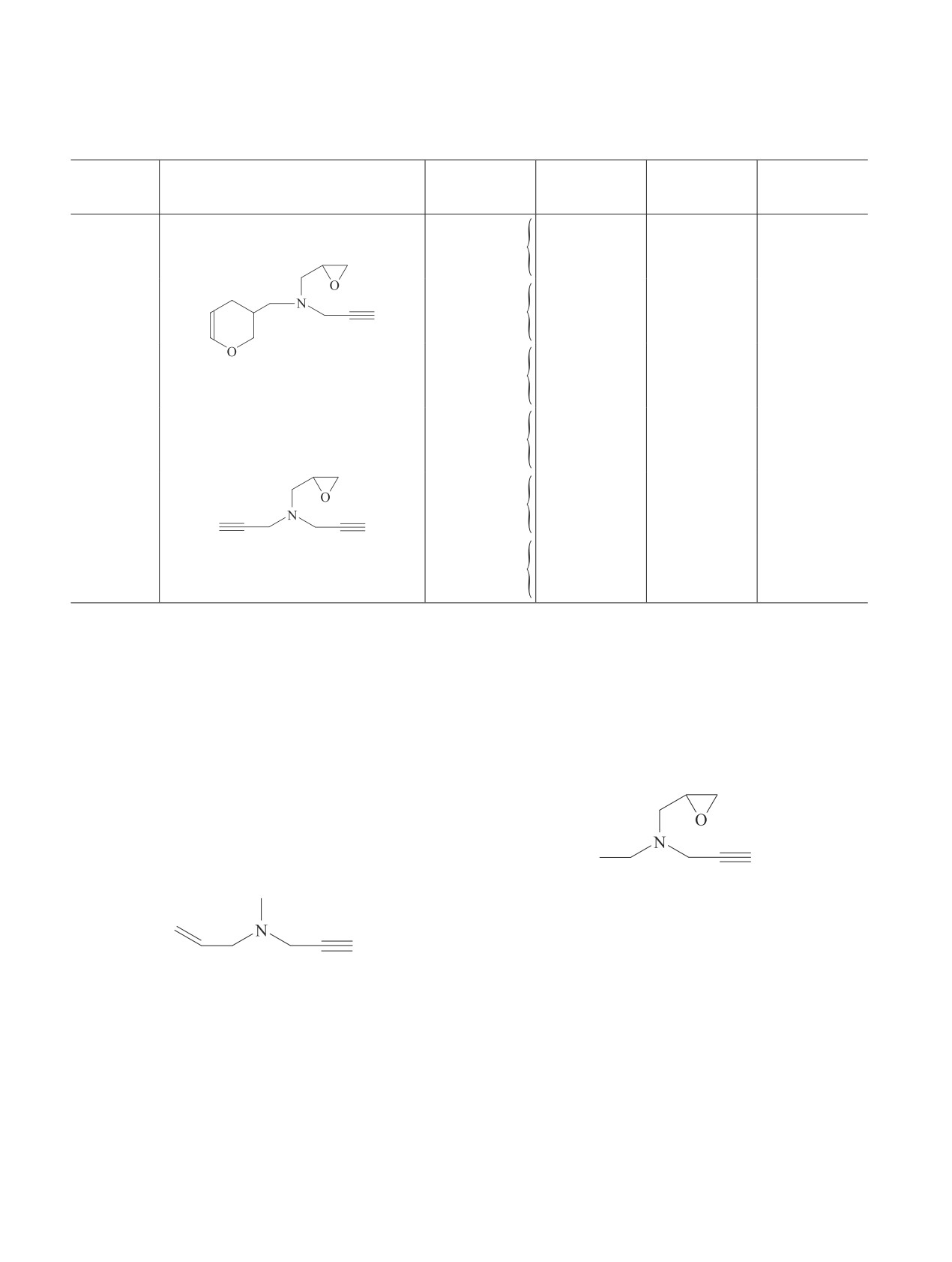
Скорости коррозии стали 08кп в 5 М НСl, содержащей добавки замещенных пропаргиламинов
Концентрация
Скорость
Коэффициент
Температура,
Соединение
Формула ингибитора
ингибитора,
коррозии,
торможения
°C
г·л-1
г·м-2·ч-1
коррозии
20
0
8.3
—
—
—
40
0
59
—
60
0
280
—
0.25
2.0
4.2
20
0.5
1.7
4.9
1.0
1.6
5.2
0.25
13.7
4.3
(I)
40
0.5
8.2
7.2
1.0
5.0
12
0.25
15.7
18
60
0.5
10.2
27
1.0
5.0
56
0.25
2.9
2.9
20
0.5
2.25
3.7
1.0
1.7
4.9
0.25
12.8
4.8
(VII)
40
0.5
10.1
5.8
1.0
8.2
7.2
0.25
28.0
10
60
0.5
22.4
13
1.0
11.5
24
0.25
1.9
4.4
20
0.5
1.6
5.2
1.0
1.5
5.5
0.25
8.4
7.0
(VIII)
40
0.5
6.1
9.7
1.0
3.2
18
0.25
11.4
25
60
0.5
9.0
31
1.0
3.0
93
0.25
3.4
2.4
20
0.5
2.1
4.0
1.0
1.2
6.9
0.25
8.0
7.4
(IX)
40
0.5
7.3
8.1
1.0
3.9
15
0.25
39.5
7.1
60
0.5
6.1
46
1.0
3.1
90
Замещенные пропаргиламины — ингибиторы кислотной коррозии сталей для нефтедобычи
1047
Таблица (продолжение)
Концентрация
Скорость
Коэффициент
Температура,
Соединение
Формула ингибитора
ингибитора,
коррозии,
торможения
°C
г·л-1
г·м-2·ч-1
коррозии
0.25
4.6
1.8
20
0.5
3.1
2.7
1.0
2.0
4.2
0.25
11.2
5.3
(X)
40
0.5
7.1
8.3
1.0
4.2
14
0.25
21.4
13
60
0.5
18.0
16
1.0
9.3
30
0.25
2.1
4.0
20
0.5
1.0
8.3
1.0
0.4
21
0.25
5.4
11
(XI)
40
0.5
4.1
14
1.0
2.0
30
0.25
6.4
44
60
0.5
2.4
120
1.0
2.1
130
рых рассмотрены ниже (см. таблицу). Коррозия стали
всего, повышает его гидрофобность (lgD = -0.62),
08кп в растворе 5 М HCl ускоряется с ростом темпе-
существенно снижая растворимость в кислоте. Как
ратуры. Повышение температуры на 40°C увеличива-
результат, это соединение уступает в защитных свой-
ет скорость коррозии стали в 34 раза. В растворе HCl
ствах даже соединению (I) (lgD = -1.57), замедляя
в выбранном диапазоне температур все исследуемые
коррозию при Т = 60°C только в 24 раза.
добавки замедляют коррозию стали. Как правило,
Другая группа ингибиторов со сходным структур-
эти соединения плохо тормозят разрушение металла
ным фрагментом
в растворах при Т = 20°C. Защитный эффект ингиби-
торов усиливается с увеличением их содержания в
коррозионной среде и при повышении температуры.
Среди исследованных ацетиленовых ингибиторов
можно выделить вещества, содержащие фрагмент
представлена соединениями (IX), (X) и (XI). Их за-
щитные свойства снижаются по мере уменьшения
ненасыщенности заместителя в ряду (XI) > (IX) > (X),
что также хорошо известно для непредельных соеди-
Это соединения (I), (VII) и (VIII). Наиболее про-
нений [5, 6]. Если для соединения (XI) максимально
стое соединение (I) существенно тормозит коррозию
наблюдаемое замедление коррозии составило 130 раз,
стали, замедляя ее при Т = 60°C в 56 раз. Введение
то в тех же условиях для соединений (IX) и (X) на-
в такую структуру фрагмента, содержащего атом S
блюдаемые скорости коррозии стали в 1.5 и 4.4 раза
[соединение (VIII)], повышает защитное действие
выше, чем у соединения (XI).
ингибитора, тормозя в тех же условиях коррозию в
Интересно, что среди исследованных соединений
93 раза. Этот эффект характерен для ингибиторов
максимально эффективны наиболее простые по струк-
ацетиленового ряда и отмечался в литературе [5, 6].
туре и ненасыщенные вещества (XI) и (VIII), содер-
Введение в структуру молекулы фрагмента мети-
жащие в качестве заместителей крайне реакционные
лен-1,3-диоксолана [соединение (VII)], вероятнее
фрагменты — эпоксипропил и эпитиопропил. Оба эти
1048
Шатирова М. И. и др.
заместителя химически очень активны, что, вероят-
Авдеев Ярослав Геннадиевич, д.х.н., доцент,
нее всего, играет существенную роль в их защитном
действии. В основе защитного действия многих аце-
Джафарова Улдуз Шамсаддин кызы,
тиленовых соединений при коррозии стали в раство-
рах HCl лежит их способность адсорбироваться на
поверхности металла и формировать на ней полимер-
ный защитный слой, блокирующий металл от крайне
Список литературы
агрессивной среды (адсорбционно-полимеризацион-
[1] Глущенко В. Н., Силин М. А. Нефтепромысловая
ный механизм) [5, 6]. Реакционноспособные эпокси- и
химия. Т. 4. Кислотная обработка скважин / Под
эпитиогруппы должны инициировать и существенно
ред. И. Т. Мищенко. М.: Интерконтакт Наука, 2010.
ускорять процесс полимеризации ненасыщенных
С. 9-13.
соединений, способствуя быстрому формированию
[2] Shafiq M. U., Mahmud H. B. Sandstone matrix acidizing
на поверхности стали защитной пленки и обеспе-
knowledge and future development // J. Petrol. Explor.
чивая максимальную защиту от коррозии. Наиболее
Prod. Technol. 2017. V. 7. N 4. P. 1205-1216.
хорошо этот эффект должен проявляться при высоких
[3] Hong L. V., Mahmud H. B. A preliminary screening
температурах. Действительно, в присутствии этих
and characterization of suitable acids for sandstone
соединений коррозия стали при 40 и 60°С в растворе
matrix acidizing technique: A comprehensive review //
кислоты протекает практически с одинаковой ско-
J. Petrol. Explor. Prod. Technol. 2019. V. 9. P. 753-778.
ростью, что может быть только результатом форми-
рования ингибитором на поверхности стали защит-
[4] Finšgar M., Jackson J. Application of corrosion
ной пленки полимера. Таким образом, модификация
inhibitors for steels in acidic media for the oil and gas
N,N-дипропаргил- или N-аллил-N-пропаргиламинов
industry: A review // Corros. Sci. 2014. V. 86. P. 17-41.
химически активными эпокси- и эпитиогруппами
позволяет получить высокоэффективные ингибиторы
[5] Подобаев Н. И., Авдеев Я. Г. Ацетиленовые сое-
коррозии низкоуглеродистой стали в горячей соляной
динения как ингибиторы кислотной коррозии же-
кислоте (Т = 60°С). Полученный результат позволяет
леза. Обзор // Защита металлов. 2004. Т. 40. № 1.
говорить о перспективности применения этих соеди-
С. 11-18 [Podobaev N. I., Avdeev Ya. G. A Review of
нений в качестве ингибиторов солянокислотной кор-
acetylene compounds as inhibitors of acid corrosion of
розии сталей на предприятиях нефте- и газодобычи.
org/10.1023/B:PROM.0000013105.48781.86 ].
[6] Авдеев Я. Г., Кузнецов Ю. И. Физико-химические
Выводы
аспекты ингибирования кислотной коррозии ме-
таллов ненасыщенными органическими соедине-
Синтезированы непредельные амины пропаргило-
ниями // Успехи химии. 2012. Т. 81. № 12. С. 1133-
вого ряда с различными заместителями, изучены их
1145 [Avdeev Ya. G., Kuznetsov Yu. I. Physicochemical
свойства. Полученные соединения (шесть наимено-
aspects of inhibition of acid corrosion of metals by
ваний) обладают высоким защитным действием при
unsaturated organic compounds // Russ. Chem.
коррозии низкоуглеродистой стали в растворах соля-
ной кислоты. Определены коэффициенты торможе-
org/10.1070/RC2012v081n12ABEH004292 ].
ния коррозии стали в присутствии синтезированных
[7] Barker R., Pickles B., Hughes T. L., Barmatov E.,
соединений и установлено, что они увеличиваются
Neville A. Effect of transition rate and propargyl
alcohol concentration on the corrosion of carbon
при повышении содержания ацетиленового соедине-
steel during transitions in fluid composition from
ния в коррозионной среде и ее температуры.
inhibited hydrochloric acid to sodium chloride brine //
Electrochim. Acta. 2020. V. 338. ID 135877.
Конфликт интересов
[8] Barmatov E., La Terra F., Hughes T. Mechanism of
Авторы заявляют об отсутствии конфликта инте-
degradation of propargyl alcohol by acid-catalysed
ресов, требующего раскрытия в данной статье.
hydrolysis and corrosion inhibition efficiency of propargyl
alcohol intermediates for carbon steel in hydrochloric
acid // Mater. Chem. Phys. 2021. V. 272. ID 125048.
Информация об авторах
Шатирова Махруза Исмаил кызы, к.х.н.,
[9] Barmatov E., Hughes T. Effect of corrosion products
and turbulent flow on inhibition efficiency of propargyl
Замещенные пропаргиламины — ингибиторы кислотной коррозии сталей для нефтедобычи
1049
alcohol on AISI 1018 mild carbon steel in 4 M
acidic solutions used in oil well acidizing // J. Mol.
hydrochloric acid // Corros. Sci. 2017. V. 123. P. 170-
Liq. 2018. V. 256. P. 548-557.
[10] N a s c i m e n t o R . C . ,
Furtado L. B.,
[11] Mainier F. B., Farneze H. N., Serrao L. F., Tannus de
Guimaraes M. J. O. C., Seidl P. R., Rocha J. C.,
Oliveira B., Nani B. F. Performance of Stainless Steel
Ponciano J. A. C., Cruz M. T. M. Synergistic effect of
AISI 317L in hydrochloric acid with the addition of
propargyl alcohol, octadecylamine, and 1,3-dibutyl
propargyl alcohol // Int. J. Electrochem. Sci. 2018.
thiourea for API P110 alloys in acetic and formic
V. 13. P. 3372-3381.