1468
Зоткин М. А. и др.
Журнал прикладной химии. 2022. Т. 95. Вып. 11-12
УДК 541.64
СИНТЕЗ И ИССЛЕДОВАНИЕ СОРБЦИОННЫХ СВОЙСТВ
АДДИТИВНОГО ПОЛИНОРБОРНЕНА
С ДИМЕТИЛАНТРАЦЕНОВЫМ ЗАМЕСТИТЕЛЕМ
© М. А. Зоткин1, Д. А. Алентьев1,*, Н. Н. Гаврилова2, М. В. Бермешев1
1 Институт нефтехимического синтеза им. А. В. Топчиева РАН,
119991, ГСП-1, г. Москва, Ленинский пр., д. 29
2 Российский химико-технологический университет им. Д. И. Менделеева,
125047, г. Москва, Миусская пл., д. 9
* E-mail: d.alentiev@ips.ac.ru
Поступила в Редакцию 1 декабря 2022 г.
После доработки 25 декабря 2022 г.
Принята к публикации 25 декабря 2022 г.
Синтезирован норборнен, содержащий заместитель с 9,10-дигидроантраценовым фрагментом и дву-
мя метильными группами. Определены условия его аддитивной полимеризации, при которых высоко-
молекулярный продукт (Mw более 5·105) образуется с высоким выходом (более 70%). Синтезированный
полимер охарактеризован методом спектроскопии ядерного магнитного резонанса, рентгенофазо-
вого анализа, термогравиметрического анализа. Методом низкотемпературной сорбции-десорбции
азота исследованы сорбционные свойства синтезированного полимера, в том числе их изменение во
времени. Полимер характеризуется удельной поверхностью до 550 м2·г-1, наличием микро- и мезопор
и подвержен физическому старению.
Ключевые слова: полинорборнены; аддитивная полимеризация; микропористые материалы
DOI: 10.31857/S0044461822110111; EDN: GRQAVA
Разработка микро- и мезопористых полимерных
вимо с удельной поверхностью таких полимеров,
материалов с большой удельной поверхностью яв-
как политриметилсилилпропин, а также полимеров
ляется актуальной прикладной задачей современной
с внутренней микропористостью (жесткоцепные не-
химии полимеров. Такие материалы требуются для
линейные полимеры с фрагментами спиробисиндана
решения широкого круга технологических задач:
в основной цепи). Увеличение объема заместителя в
хранения и транспортировки газов [1], создания под-
этих полимерах приводит к росту удельной поверхно-
ложек для гетерогенных катализаторов [2], стаци-
сти. Наиболее высокие значения удельной поверхно-
онарных фаз для хроматографических колонок [3],
сти наблюдались в случае полимеров, содержащих в
мембранных материалов для газоразделения, паро-
боковой цепи жесткие и объемные олигоциклические
разделения и первапорации [4].
структуры: фрагменты 9,10-дигидроантрацена и его
Полинорборнены — класс полимеров, перспектив-
пентациклического производного [6].
ных для решения обозначенных задач, что обусловле-
Учитывая, что аддитивная полимеризация при-
но, во-первых, широкими возможностями для синтеза
водит к образованию полимеров с более жесткой
полимеров с различной структурой основных и боко-
основной цепью и соответственно большей удельной
вых цепей, а во-вторых, сорбционными свойствами
поверхностью, чем метатезисная полимеризация [5],
ряда замещенных полинорборненов [5]. В работе
можно заключить, что синтез полинорборненов с
[6] обнаружено, что полинорборнены, содержащие
фрагментами 9,10-дигидроантрацена в заместителях
в боковой цепи карбоциклические заместители, яв-
по аддитивной схеме является наиболее перспектив-
ляются микропористыми материалами и обладают
ным направлением дизайна микропористых поли-
удельной поверхностью до 740 м2·г-1, что сопоста-
меров на основе норборненов с карбоциклическими
Синтез и исследование сорбционных свойств аддитивного полинорборнена с диметилантраценовым заместителем
1469
заместителями. Введение метильных групп в боковые
ным протонам CDCl3 (7.24 м. д.), в спектрах ЯМР
заместители является одним из способов модифика-
13С — по центральному пику CDCl3 (77.00 м. д.).
ции полимерных структур, позволяющих тонко ре-
Хроматомасс-спектрометрический анализ прово-
гулировать их свойства, такие как свободный объем,
дили на газохроматомасс-спектрометре MAT 95 XL
транспортные характеристики, температура стеклова-
(Finnigan) с хроматографом HP 6890+ (Agilent).
ния [7, 8]. Поэтому интересной задачей стал синтез
Условия регистрации масс-спектров и некоторые ха-
полинорборненов с заместителями, содержащими
рактеристики масс-спектрометра: электронная ио-
фрагменты 9,10-дигидроантрацена, в которых атомы
низация (энергия ионизации 70 эВ), диапазон масс
водорода частично замещены на метильные группы,
20-800 а. е. м., разрешение 1000, температура источ-
и исследование их сорбционных свойств.
ника 200°С, скорость сканирования 1 с/декада масс.
Цель работы - синтез норборнена, содержащего
Условия анализа проб с использованием газожид-
заместитель с фрагментом 9,10-дигидроантрацена
костного хроматографа и некоторые характеристики
и двумя метильными группами, исследование его
хроматографа: капиллярная колонка 30 м × 0.25 мм
аддитивной полимеризации и изучение сорбционных
с фазой DB-5 (полидиметилсилоксан, содержащий
свойств полученного полимера.
5% фенильных групп); газ-носитель — He (чистота
99.995%, ООО «НИИ КМ»); деление потока 1:30;
скорость подъема температуры 5 град·мин-1 от 30
Экспериментальная часть
до 120°С, 10 град·мин-1 от 120 до 270°С, далее вы-
Na2Cr2O7 (ч.д.а., ООО «Мосреактив»), гидрохи-
держка при 270°С в течение 10 мин. Молекулярную
нон (ч., ООО «АО РЕАХИМ»), H2SO4 (х.ч., ООО
массу оценивали методом гельпроникающей хрома-
«АО РЕАХИМ»), KOH (ч.д.а., ООО «Русский
тографии на хроматографе Agilent 1260 Infinity II с
Химик»), изопрен (99%, Merck, кат. номер I19551),
тройным детектированием (светорассеяние, рефрак-
этанол (ос.ч., ООО ТД «Химмед»), Al порошко-
тометрия, вискозиметрия). Колонки: PLgel MiniMIX
образный ПА-1 (98%, ООО «Русский Химик»),
(фаза MIXED-B, 250 × 4.6 мм, 10 мкм, Agilent) (3 шт.
HgCl2 (ос.ч., ООО ТД «Химмед»), четыреххлори-
последовательно). Растворитель — тетрагидрофуран
стый углерод (ч.д.а., ООО ТД «Химмед»), цикло-
[чистота ВЭЖХ (>99.9%), Merck, кат. номер 270385],
гексанол (ос.ч., ООО «Мосреактив»), ацетон (ч.д.а.,
объем пробы 50 мкл, концентрация полимера в про-
ООО ТД «Химмед»), дихлорметан (х.ч., ООО «АО
бе 1 мг·мл-1. Калибровку проводили по полисти-
РЕАХИМ»), 2,5-норборнадиен (98%, Merck, кат. но-
рольным стандартам [M = (1·103)-(1·106), Merck,
мер 8.20918), ацетат палладия(II) (>95%, Merck, кат.
кат. номера 81402-81416]. Расчет молекулярно-мас-
номер 8.18056), тетракис[3,5-бис(трифторметил)фе-
совых характеристик проводили по калибровочной
нил]борат натрия (NaBArF, >95%, Merck, кат. номер
зависимости, которая была линейной в диапазоне
692360), трициклогексилфосфин (PCy3, >95%, Merck,
(1·103)-(1·106). Термогравиметрический анализ вы-
кат. номер 261971) использовали без дополнительной
полнен на синхронном термоанализаторе TGA/DSC 1
очистки. Толуол (ос.ч., ООО ТД «Химмед») кипятили
(Mettler Toledo) в атмосфере аргона и на воздухе при
над Na (ч.д.а., ООО «Мосреактив») 3 ч и перегоня-
скорости нагрева 10 град·мин-1 в интервале темпера-
ли в атмосфере аргона (99.998%, ООО «Аргон»).
тур 30-1000°C. Рентгенофазовый анализ выполнен с
Хлороформ (х.ч., ООО ТД «Химмед») кипятили над
использованием детектора ASX (Bruker) и излучения
CaH2 (96%, кат. номер UN 1404) 3 ч и перегоняли в
CuKα (длина волны λ = 1.54 Å). Расстояния между
атмосфере аргона. Метанол (х.ч., ООО ТД «Химмед»)
структурными фрагментами рассчитывали по урав-
кипятили над Mg (х.ч., ООО «Мосреактив») в течение
нению Вульфа-Брэгга. Для операций в инертной
3 ч и перегоняли в атмосфере аргона. 1,4-Бензохинон
атмосфере использовали перчаточный бокс LABstar
синтезировали по стандартной методике путем окис-
(MBraun).
ления гидрохинона дихроматом натрия с серной кис-
Исследования адсорбции-десорбции азота
лотой [9].
проводили при 77 K на анализаторе Gemini VIIt
Спектры ядерного магнитного резонанса (ЯМР)
(Micromeritics Instruments Corporation). Образцы пе-
регистрировали на ЯМР-спектрометре Bruker
ред исследованиями дегазировали при температу-
AvanceTM DRX400 при 400.1 МГц для спектров 1H
ре 100°С и давлении 25-50 мТорр в течение 10 ч.
и 100.6 МГц для спектров 13C с использованием дей-
Удельную поверхность рассчитывали по уравнению
терохлороформа (CDCl3, 99.9%, стабилизирован-
Брунауэра-Эмметта-Теллера, используя для расче-
ный Ag, ООО «Сольвекс») в качестве растворителя.
тов следующие диапазоны относительных давлений:
Сигналы в спектрах ЯМР 1Н относили по остаточ-
0.02-0.18 (при исследовании образца, выдержан-
1470
Зоткин М. А. и др.
ного 3 недели после осаждения) и 0.02-0.22 (при
(0.1 мм рт. ст.). Неочищенный продукт представлял
исследовании образца, выдержанного 12 недель по-
собой вязкую жидкость. Для дальнейшей очистки
сле осаждения). Распределение мезопор и микропор
использовали метод препаративной колоночной хро-
по размерам оценивали с использованием методов
матографии. Для этого раствор продукта в дихлор-
Барретта-Джойнера-Халенды и Хорвата-Кавазое со-
метане нанесли на силикагель (диаметр частиц
ответственно. t-Метод де Бура использовали для рас-
63-200 мкм, Merck, кат. номер 1.07734), после чего
чета внешней поверхности, поверхности микропор и
перенесли на колонку с силикагелем. В качестве элю-
объема микропор. Также объем микропор определяли
ента использовали циклогексан. Ход разделения кон-
методом Дубинина-Радушкевича.
тролировали с использованием тонкослойной хрома-
Синтез 2,6-/2,7-диметилантрахинона. В стеклян-
тографии [пластины TLC Silica gel 60 с алюминиевой
ный вкладыш автоклава поместили 24 г 1,4-бензо-
подложкой (Merck, кат. номер 1.05553)]. Фракцию с
хинона (0.22 моль), 55 г изопрена (1.3 моль), 100 мг
Rf = 0.3 упаривали в вакууме (30, затем 0.1 мм рт. ст.).
гидрохинона и 50 мл этанола. Смесь выдерживали в
В результате получен продукт в виде вязкой масляни-
герметично закрытом автоклаве при 130°C в течение
стой жидкости. Выход: 6.2 г (63%).
7 ч. После охлаждения до комнатной температуры
1H ЯМР (δ, м. д., CDCl3): 7.10-7.01 м. (4H, Ar—H),
полученную смесь перенесли в плоскодонную колбу
6.90-6.81 м. (2H, Ar—H), 6.12 с. (2H, —CH CH—),
емкостью 2 л с магнитной мешалкой, содержащую
4.04 м. (2H), 2.45 уш.с. (2H), 2.29-2.27 с. (6H, CH3),
1.6 л раствора KOH в этаноле (5 мас%). Смесь пере-
2.01 уш.с. (2H), 0.72-0.70 д. (1H), -0.06-(-0.08) д. (1H).
мешивали при 50°C на воздухе в течение 3 ч. Осадок
13C ЯМР (δ, м. д., CDCl3): 145.69, 143.04-142.29,
отфильтровывали на стеклянном крупнопористом
139.72, 138.27, 135.09-134.44, 128.70-127.89, 125.98-
фильтре, промывали водой и этанолом, затем очища-
125.13, 123.86, 122.61, 49.00, 47.95-47.10, 44.15,
ли методом препаративной колоночной хроматогра-
40.24, 20.87, 17.85.
фии, используя горячий толуол в качестве элюента,
Масс-спектр, m/z: 298 [NBAntMe2 (С23H22+) — мо-
после чего толуол упаривали в вакууме (30 мм рт. ст.).
лекулярный ион, относительная интенсивность 30%],
Полученную твердую стеклообразную массу рас-
206 [AntMe2 (С16H14+), относительная интенсивность
творили в горячем этаноле и отфильтровали через
100%].
слой силикагеля (диаметр частиц 63-200 мкм, Merck,
Аддитивная полимеризация NBAntMe2. Процедура
кат. номер 1.07734). Фильтрат упаривали в вакууме
описана на примере полимеризации NBAntMe2
(30 мм рт. ст.) до постоянной массы. В результате по-
при мольном соотношении NBAntMe2/Pd(OAc)2/
лучено порошкообразное вещество желто-оранжевого
NaBArF (тетракис[3,5-бис(трифторметил)фенил]бо-
цвета. Выход: 27 г (50%).
рат натрия)/PCy3 (трициклогексилфосфин), равном
1H ЯМР (δ, м. д., CDCl3): 8.20-8.18 д. (2H, Ar—H),
1000/1/5/2 и концентрации мономера в реакционной
8.09 с. (2H, Ar—H), 7.59-7.57 д. (2H, Ar—H), 2.53 с.
смеси, равной 1.1 М. Другие эксперименты прово-
(6H, CH3).
дили аналогично, варьируя мольное соотношение
Синтез 2,6-/2,7-диметилантрацена (AntMe2).
участников реакции. Полимеризацию осуществляли
Синтез осуществляли путем восстановления
в атмосфере аргона с использованием перчаточного
2,6-/2,7-диметилантрахинона циклогексилатом алю-
бокса. В виалу объемом 8 мл, снабженную магнитной
миния в циклогексаноле углерода по методике [10].
мешалкой, помещали 2.5 г раствора NBAntMe2 в то-
Выход продукта в виде бело-желтого тонкодисперс-
луоле (43 мас%), содержащего 1.1 г (3.7 ммоль) мо-
ного порошка составил 45%.
номера, и добавляли 1.0 мл абсолютного хлороформа.
1H ЯМР (δ, м. д., CDCl3): 8.25 с. (2H, Ar—H),
Каталитическую смесь готовили непосредственно
7.86 д. (2H, Ar—H), 7.71 с. (2H, Ar—H), 7.26 д. (2H,
перед использованием. Для этого в виалу помеща-
Ar—H), 2.52 с. (6H, CH3).
ли 2.0 мг (9.0 мкмоль) Pd(OAc)2, 40 мг (45 мкмоль)
Синтез 9,10-(5ʹ,6ʹ-норборнен-2-ил)-2,6-/2,7-диме-
NaBArF и 5.0 мг (18 мкмоль) PCy3, после чего раство-
тилантрацена (NBAntMe2). В стеклянный вкладыш
ряли в 1.0 мл абсолютного хлороформа. Для полного
автоклава поместили 6.8 г 2,6-/2,7-диметилантрацена
растворения NaBArF в смесь добавляли несколько
(33 ммоль), 18 г (200 ммоль) норборнадиена-2,5 и
капель абсолютного метанола. Полимеризацию ини-
100 мг гидрохинона. Смесь выдерживали в закры-
циировали путем добавления 0.41 мл (3.7 мкмоль Pd)
том автоклаве при 200°C в течение 32 ч. После ох-
раствора каталитической смеси в виалу с мономером
лаждения до комнатной температуры полученную
при перемешивании. Перемешивание продолжали в
смесь перенесли в колбу с магнитной мешалкой,
течение 4 ч при температуре 45°C. Полимер выделяли
отогнали оставшийся норборнадиен-2,5 в вакууме
путем осаждения реакционной смеси в метанол, трех-
Синтез и исследование сорбционных свойств аддитивного полинорборнена с диметилантраценовым заместителем
1471
кратного промывания метанолом и сушки в вакууме.
на, что, по-видимому, обусловлено большим объемом
Затем полимер дважды переосаждали из раствора
заместителя, образующегося из антрацена.
толуола в метанол и сушили в вакууме при 60°C до
Диметилантрацен, исходное соединение для син-
постоянной массы. Выход: 0.80 г (73%). Mw = 1.1·106,
теза мономера, был синтезирован в две стадии из
Mw/Mn = 3.6.
бензохинона (I). Первая стадия — реакция Дильса-
ЯМР 1H (δ, м. д., CDCl3): 8.32-5.91 м. (6H, Ar—H),
Альдера между бензохиноном и изопреном, при-
5.62-(-0.45) м. (16H).
водящая к образованию промежуточного продукта,
ЯМР 13C (δ, м. д., CDCl3): 143.0-140.5, 136.5-
диметилтрицикло[8.4.0.03,8]тетрадекадиен-5,12-ди-
133.5, 128.1-121.0, 62.1-37.2, 22.7-19.8.
она-2,9 в виде смеси двух изомеров, различающих-
ся взаимным расположением метильных групп, и
последующая окислительная ароматизация полу-
Обсуждение результатов
ченного промежуточного продукта с образованием
Для синтеза мономера, норборнена с 9,10-диги-
диметилантрахинона также в виде смеси двух изоме-
дроантраценовым фрагментом и двумя метильными
ров с метильными группами в положениях 2,6 и 2,7.
группами (NBAntMe2), был применен подход, разра-
По данным ЯМР-спектроскопии (Дополнительные
ботанный ранее для синтеза аналогичных мономеров:
материалы, рис. 1), молярное соотношение изоме-
норборнена с незамещенным 9,10-дигидроантрацено-
ров составляло 1/1. Вторая стадия — восстановле-
вым фрагментом и норборнена с пентациклическим
ние 2,6-/2,7-диметилантрахинона с образованием
фрагментом [11]. Подход основан на реакции Дильса-
2,6-/2,7-диметилантрацена в виде двух изомеров с
Альдера между норборнадиеном-2,5, выступающим
молярным соотношением 1/1 (Дополнительные ма-
в роли диенофила, и производным антрацена, вы-
териалы, рис. 2). Синтезированный диметилантрацен
ступающего в роли диена. В этой реакции присое-
был вовлечен в реакцию Дильса-Альдера с норбор-
динение антрацена происходит по положениям 9 и
надиеном-2,5, в результате чего был получен целе-
10, что переводит молекулу от 14-электронной аро-
вой мономер в виде смеси двух изомеров в моляр-
матической системы к двум 6-электронным. Важной
ном соотношении 1/1 (Дополнительные материалы,
особенностью этой реакции является образование
рис. 3, 4), различающихся взаимным расположением
исключительно экзо-изомера замещенного норборне-
метильных групп (I).
(I)
1472
Зоткин М. А. и др.
NBAntMe2 проявил высокую активность в адди-
катализатор составляет 1000/1, а температура реак-
тивной полимеризации в присутствии трехкомпо-
ции — 45°C. При этих условиях образуются поли-
нентной каталитической системы на основе ацетата
меры с достаточно высокой молекулярной массой.
палладия, борорганического сокатализатора (NaBArF)
Проведение полимеризации при комнатной темпе-
и трициклогексилфосфина (II). Эта каталитическая
ратуре приводило к образованию полимера с низкой
система обеспечивала образование растворимого по-
молекулярной массой даже при большом времени
лимера, характеризующегося высокой молекулярной
реакции. Увеличение соотношения мономер/катализа-
массой, с выходом более 60% (табл. 1). Путем варьи-
тор не приводило к увеличению молекулярной массы
рования условий полимеризации было установлено,
образующихся полимеров.
что оптимальное молярное соотношение мономер/
Строение синтезированного полимера подтверж-
дитивных полинорборненов [12]. Максимум первого
дено методом спектроскопии ядерного магнитного
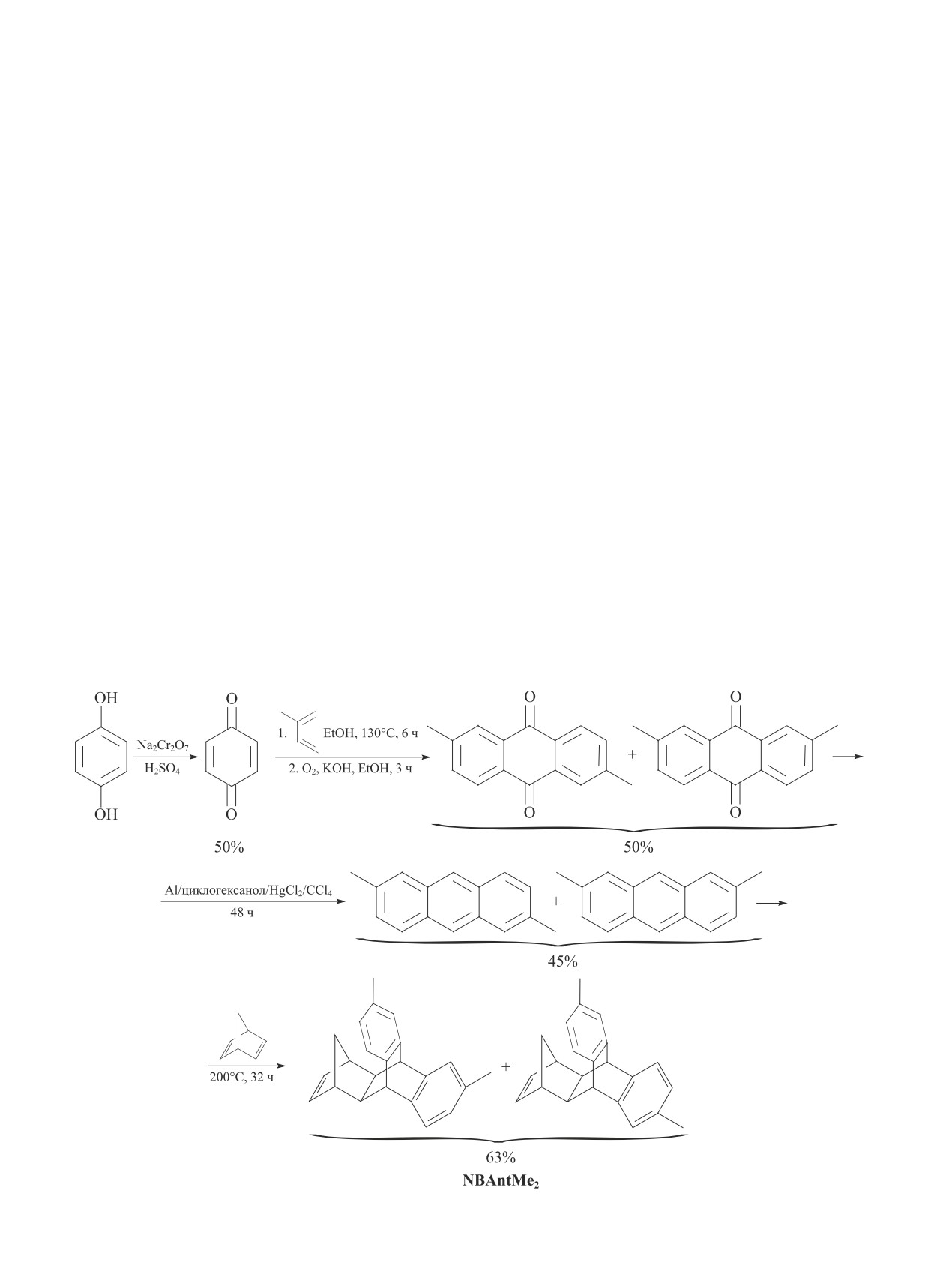
пика расположен при 5.3°, что соответствует рассто-
резонанса (ЯМР) на ядрах 1H и 13C. В спектрах при-
янию 16.6 Å, предположительно, между сегментами.
сутствуют сигналы, характерные для ароматических
Максимум второго пика расположен при 14.8°, что
фрагментов (6-8 м. д. для спектров 1H и 120-150 м. д.
соответствует расстоянию 6.0 Å, предположительно,
для спектров 13C), и отсутствуют сигналы, характер-
между структурными фрагментами, расположенными
ные для двойных связей (Дополнительные материа-
в пределах одного сегмента.
лы, рис. 5, 6).
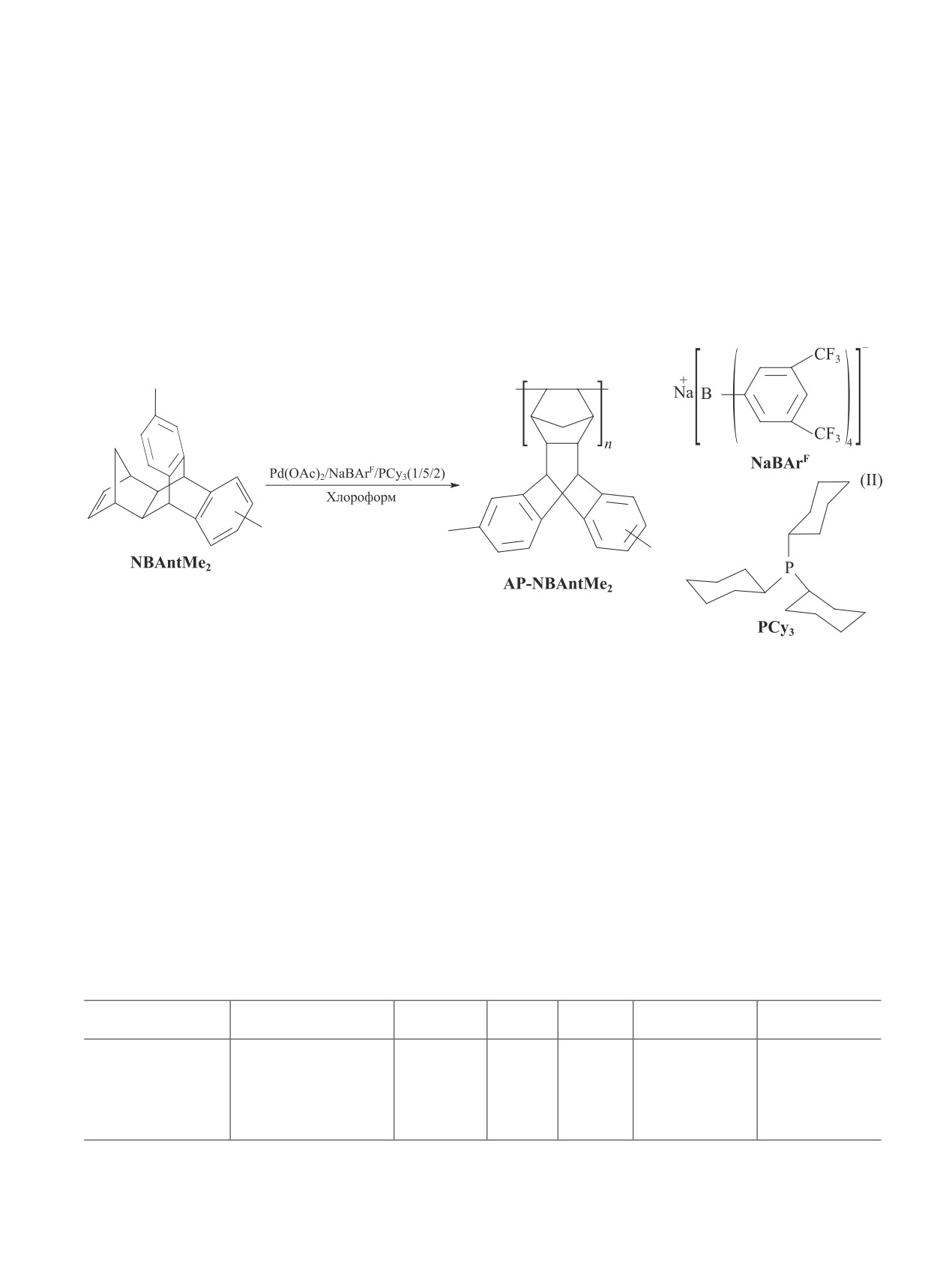
По данным термогравиметрического анализа, тем-
По данным рентгенофазового анализа, синтези-
пература разложения синтезированного полинор-
рованный полимер является рентгеноаморфным. Его
борнена (температура, соответствующая потере 5%
дифрактограмма представлена двумя широкими пика-
массы) при нагревании как в атмосфере аргона, так
ми при 5°-7° и 10°-20° (рис. 1), характерными для ад-
и на воздухе составляла 310 °C (рис. 2). В атмосфере
Таблица 1
Условия аддитивной полимеризации 9,10-(5ʹ,6ʹ-норборнен-2-ил)-2,6/2,7-диметилантрацена (NBAntMe2)
и характеристики полимеров
Молярное отношение
Концентрация мономера
Температура,
Mw·10-3
Mw/Mn
Время, ч
Выход, %
мономер/Pd
в реакционной смеси, M
°C
продукта реакции
продукта реакции
1000
1.0
45
1.5
65
510
2.7
1000
1.0
25
22
65
260
2.1
2000
1.1
45
3
89
360
1.8
3000
1.1
45
3
73
380
1.9
П р и м еч а н и е. Условия полимеризации: растворитель — хлороформ, каталитическая система Pd(OAc)2/тетра-
кис[3,5-бис(трифторметил)фенил]борат натрия/трициклогексилфосфин в молярном соотношении 1/5/2.
Синтез и исследование сорбционных свойств аддитивного полинорборнена с диметилантраценовым заместителем
1473
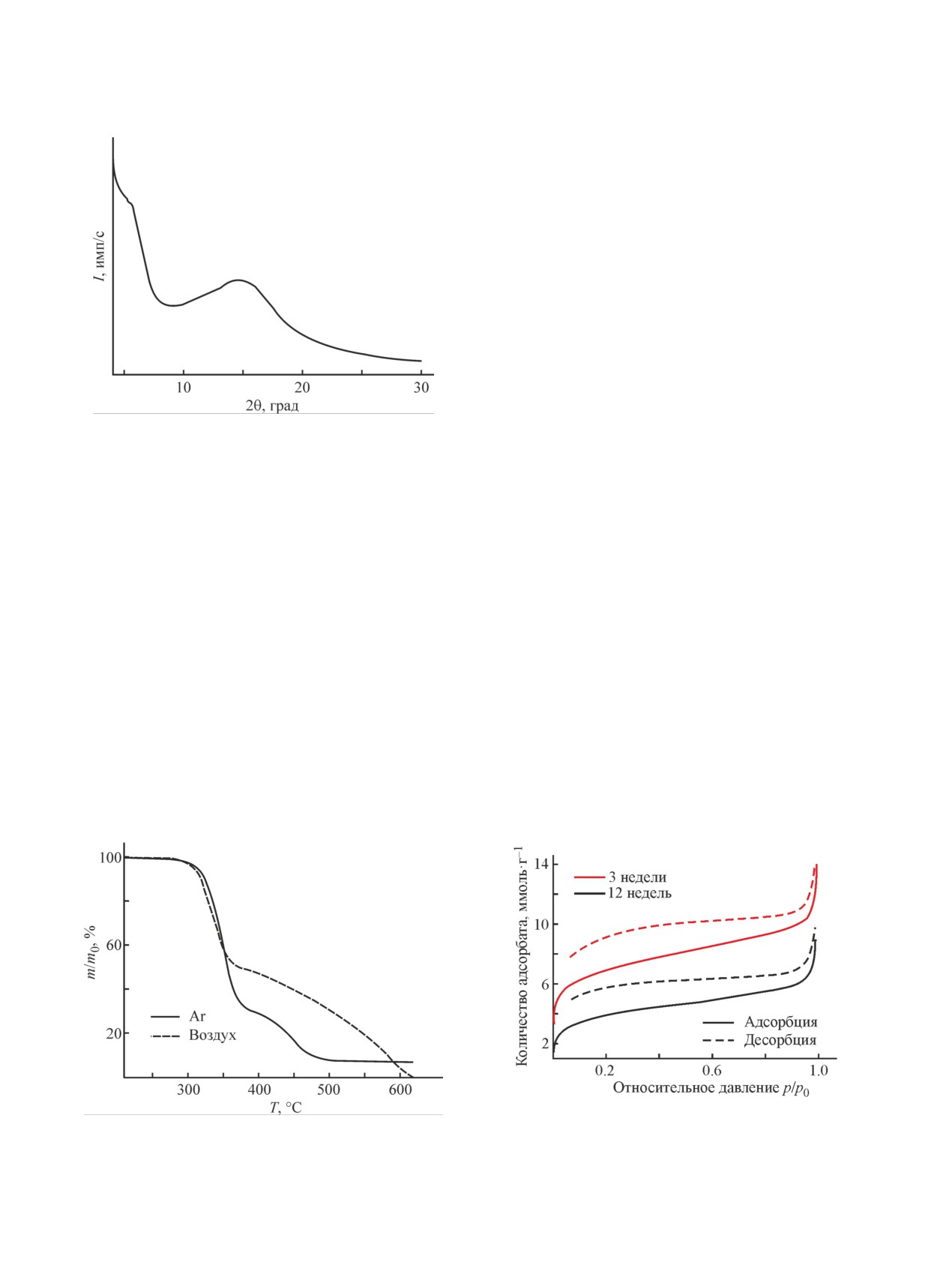
Форма петель гистерезиса относится типу H3, что
соответствует щелевой форме мезопор. На начальных
участках изотермы (при р/р0 менее 0.1) наблюдаются
резкие скачки величины адсорбции, что свидетель-
ствует о наличии развитых микропор в образцах. Из
распределений мезо- и микропор по размерам (рис. 4)
следует, что в исследованных образцах преобладают
мезопоры диаметром менее 10 нм и микропоры диа-
метром менее 1.2 нм.
Основные характеристики пористой структуры
(удельная поверхность, удельный объем микро- и
мезопор и т. д.) были рассчитаны из изотерм адсорб-
ции-десорбции с использованием различных мето-
дов (табл. 2). Образец AP-NBAntMe2, выдержанный
3 недели после осаждения полимера, характери-
Рис. 1. Дифрактограмма аддитивного поли(9,10-
зуется удельной поверхностью 550 м2·г-1, что со-
(5ʹ,6ʹ-норборнен-2-ил)-2,6/2,7-диметилантрацена)
поставимо с удельной поверхностью аддитивных
(AP-NBAntMe2).
полинорборненов с триметилсилильными группа-
ми [13] и термически-перегруппированных поли-
аргона полимер разлагается без остатка, тогда как при
меров [14]. Суммарный удельный объем пор этого
нагревании полимера на воздухе образуется твердый
образца составляет 0.48 см3·г-1. В зависимости от
остаток, составляющий 5-6% от исходной массы об-
методов расчета объем микропор варьируется от
разца полимера, что свидетельствует об окислении
0.10 до 0.22 см3·г-1, а объем мезопор — от 0.14 до
полимера на воздухе при нагревании.
0.26 см3·г-1. Это означает, что вклад микро- и мезо-
Структурные параметры образцов AP-NBAntMe2
пор в пористую структуру этого образца полимера
определяли методом низкотемпературной адсорб-
сопоставим. Таким образом, аддитивный полинор-
ции-десорбции азота. Были исследованы два образ-
борнен с диметилантраценовым заместителем может
ца полимера, различающиеся длительностью вы-
использоваться как в технологических областях, где
держивания после его осаждения и высушивания:
требуются микропористые материалы, таких как,
3 и 12 недель. Форма изотерм адсорбции-десорб-
например, хранение и транспортировка газов, так и
ции азота (рис. 3) позволяет их отнести к типу IV по
в областях, где требуются мезопористые материалы,
классификации Брунауэра, который характеризуется
таких как гетерогенный катализ.
протеканием полимолекулярной адсорбции с после-
Образец AP-NBAntMe2, выдержанный 12 недель
дующей капиллярной конденсацией в мезопорах.
после осаждения полимера, характеризуется в 1.5-
Рис. 3. Изотермы адсорбции-десорбции азота адди-
Рис. 2. Кривые термогравиметрического анализа адди-
тивного поли(9,10-(5ʹ,6ʹ-норборнен-2-ил)-2,6/2,7-диме-
тивного поли(9,10-(5ʹ,6ʹ-норборнен-2-ил)-2,6/2,7-диме-
тилантрацена) (AP-NBAntMe2), полученные через 3 и
тилантрацена) (AP-NBAntMe2).
12 недель после осаждения и высушивания полимера.
1474
Зоткин М. А. и др.
Рис. 4. Распределения мезопор (а) и микропор (б) по размерам, рассчитанные методами Баррета-Джойнера-Халенды
и Хорвата-Кавазое соответственно, в образцах полимера аддитивного поли(9,10-(5ʹ,6ʹ-норборнен-2-ил)-2,6/2,7-ди-
метилантрацена) (AP-NBAntMe2), выдержанных 3 и 12 недель после осаждения и высушивания.
Таблица 2
Сорбционные характеристики аддитивного поли(9,10-(5ʹ,6ʹ-норборнен-2-ил)-2,6/2,7-диметилантрацена)
Удельный объем
Удельная
Удельный
мезопор по методу
Длительность
поверхность
Данные по t-методу де Бура
Суммарный
объем микропор
Барретта-Джойнера-
выдерживания
по уравнению
удельный
по методу
Халенды, см3·г-1
после
Брунауэра-
объем пор,
Дубинина-
осаждения,
Эмметта-
удельная
удельная
удельный
см3·г-1
Радушкевича,
недели
Теллера,
внешняя
поверхность
объем
см3·г-1
адсорбция
десорбция
м2·г-1
поверхность,
микропор,
микропор,
м2·г-1
м2·г-1
см3·г-1
3
0.48
550
320
230
0.10
0.22
0.26
0.14
12
0.30
305
210
95
0.04
0.13
0.13
0.14
П р и м е ч а н и е. Суммарный объем пор определен при максимальном значении относительного давления
(p/p0 = 0.995).
2 раза меньшей удельной поверхностью и объемом
Выводы
пор по сравнению с образцом, исследованным через
3 недели после осаждения. Это можно объяснить
Норборнен, содержащий 9,10-дигидроантраце-
старением полимера, обусловленным релаксацией
новый заместитель с двумя метильными группами,
свободного объема. Интересно отметить, что старе-
способен полимеризоваться по аддитивной схеме,
ние более существенно влияет на микропоры, чем
при этом с высоким выходом образуется рентгено-
на мезопоры: согласно t-методу де Бура удельная
аморфный, стеклообразный и термически стабильный
поверхность и удельный объем микропор снижают-
высокомолекулярный продукт. Наличие в боковой це-
ся в течение 9 недель в 2.5 раза, тогда как удельный
пи объемного и жесткого заместителя препятствует
объем мезопор, рассчитанный из изотермы десорбции
плотной упаковке полимерных цепей и приводит к
методом Барретта-Джойнера-Халенды, практически
формированию микро- и мезопор в структуре, за счет
не меняется. На кривой распределения мезопор по
чего полимер характеризуется большой удельной
размерам (рис. 4, а) также по мере старения полимера
поверхностью (SБЭТ = 550 м2·г-1), сопоставимой с
наблюдается более существенное снижение количе-
удельной поверхностью кремнийзамещенных адди-
ства мезопор меньшего размера по сравнению с более
тивных полинорборненов и термически-перегруп-
крупными мезопорами, в результате чего на кривой
пированных полимеров. Исследованный полимер
появляется максимум при 4 нм. По-видимому, это
подвергается физическому старению, что отражается
связано с увеличением скорости релаксации пор при
на его сорбционных свойствах: удельная поверхность
уменьшении их размера.
полимера снижается в 1.5-2.5 раза в течение 9 недель.
Синтез и исследование сорбционных свойств аддитивного полинорборнена с диметилантраценовым заместителем
1475
Таким образом, введение в боковую цепь адди-
[6]
Zotkin M. A., Alentiev D. A., Shorunov S. V., Sokolov
тивного полинорборнена диметилантраценовых
S. E., Gavrilova N. N., Bermeshev M. V. Microporous
фрагментов является эффективным подходом к по-
polynorbornenes bearing carbocyclic substituents:
Structure-property study // Polymer. 2023. V. 269.
лучению микропористых полимеров с развитой вну-
P. 125732.
тренней поверхностью и высокими температурами
стеклования.
[7]
Tanaka K., Okano M., Toshino H., Kita H.,
Okamoto K.-I. Effect of methyl substituents on
Финансирование работы
permeability and permselectivity of gases in
polyimides prepared from methyl-substituted
Работа выполнена в рамках гранта Российского
phenylenediamines // J. Polym. Sci. Part B: Polym.
научного фонда № 22-79-10054.
Phys. 1992. V. 30. P. 907-914.
[8]
Tian M., Rochat S., Fawcett H., Burrows A. D.,
Конфликт интересов
Bowen C. R., Mays T. J. Chemical modification of
Авторы заявляют об отсутствии конфликта инте-
the polymer of intrinsic microporosity PIM-1 for
ресов, требующего раскрытия в данной статье.
enhanced hydrogen storage // Adsorption. 2020. V. 26.
P. 1083-1091.
Информация об авторах
[9]
Vliet E. B. Quinone // Org. Synth. 1922. V. 2. P. 85.
Зоткин Максим Александрович
[10]
Yang W. J., Kim D. Y., Jeong M.-Y., Kim H. M.,
Jeon S.-J., Rae B. 2,6-Bis(styryl)anthracene
Алентьев Дмитрий Александрович, к.х.н.
derivatives with large two-photon cross-sections //
Chem. Commun. 2003. P. 2618-2619.
Гаврилова Наталья Николаевна д.х.н., доцент
[11]
Cui J., Yang J.-X., Pan L., Li Y.-S. Synthesis
Бермешев Максим Владимирович, д.х.н., доцент
of novel cyclic olefin polymer with high glass
transition temperature via ring-opening metathesis
polymerization // Macromol. Chem. Phys. 2016.
V. 217. P. 2708-2716.
Список литературы
[1] Morris R. E., Wheatley P. S. Gas storage in nanoporous
[12]
Wilks B., Rezac M. Impact of average free-volume
materials // Angew. Chem. Int. Ed. 2008. V. 47. P. 4966-
element size on transport in stereoisomers of
polynorbornene. II. Impact of temperature on
[2] Zhang Y., Riduan S. N. Functional porous organic
solubility // J. Polym. Sci. Part B: Polym. Phys. 2003.
polymers for heterogeneous catalysis // Chem. Soc.
V. 41. P. 1939-1946.
Rev. 2012. V. 41. P. 2083-2094.
[13]
Чапала П. П., Бермешев М. В., Гаврилова Н. Н.
[3] Wu Y., Zhang N., Luo K., Liu Y., Bai Z., Tang S. Recent
Микропористая структура высокопроницаемых
advances of innovative and high-efficiency stationary
аддитивных кремнийсодержащих политрицикло-
phases for chromatographic separations // Trends Anal.
ноненов // Высокомолекуляр. соединения. Сер. А.
Chem. 2022. V. 153. P. 116647.
2017. Т. 59. С. 95-100.
[4] Lee W. H., Seong J. G., Hu X., Lee Y. M. Recent progress
[Chapala P. P., Bermeshev M. V., Gavrilova N. N.
in microporous polymers from thermally rearranged
Microporous structure of highly permeable additive
polymers and polymers of intrinsic microporosity for
silicon-containing polytricyclononenes // Polym. Sci.
membrane gas separation: Pushing performance limits
Ser. A. 2017. V. 59. P. 143-148.
and revisiting trade-off lines // J. Polym. Sci. 2020.
V. 58. P. 2450-2466.
[14]
Park H. B., Jung C. H., Lee Y. M., Hill A. J., Pas S. J.,
Mudie S. T., Van Wagner E., Freeman B. D.,
[5] Alentiev D. A., Bermeshev M. V. Design and synthesis
Cookson D. J. Polymers with cavities tuned for fast
of porous organic polymeric materials from norbornene
selective transport of small molecules and ions //
derivatives // Polym. Rev. 2022. V. 62. P. 400-437.
Science. 2007. V. 318. P. 254-258.