Журнал прикладной химии. 2022. Т. 95. Вып. 2
ПРИКЛАДНАЯ ЭЛЕКТРОХИМИЯ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
УДК 547.781:620.197.3
ОДНОСТАДИЙНЫЙ СИНТЕЗ ИНГИБИТОРА КОРРОЗИИ СТАЛИ
1-(2-НЕОНОНИЛАМИДОЭТИЛ)-2-НЕОНОНИЛ-2-ИМИДАЗОЛИНА
© С. О. Бондарева, Ю. И. Муринов
Уфимский институт химии Уфимского федерального исследовательского центра РАН,
450054, г. Уфа, пр. Октября, д. 69
Поступила в Редакцию 28 декабря 2021 г.
После доработки 14 февраля 2022 г.
Принята к публикации 22 февраля 2022 г.
В одну стадию из диэтилентриамина и неодекановой кислоты с выходом 55-60% синтезирован
1-(2-неонониламидоэтил)-2-неононил-2-имидазолин, его строение подтверждено данными газо-
жидкостной хроматографии, масс-спектрометрии, УФ-, ИК- и ЯМР 13C спектроскопии. Методом
УФ-спектроскопии показана устойчивость синтезированного имидазолина к кислотному гидролизу и
изучена кинетика его щелочного гидролиза в 50%-ном водном изопропиловом спирте при температуре
25-75°С, рН 12.5. Гравиметрическим методом изучено ингибирующее действие 1-(2-неонониламидо-
этил)-2-неононил-2-имидазолина на коррозию низкоуглеродистой стали Ст3 в 2.0 М серной кислоте,
1.0 и 4.8 М соляной кислоте, степень защиты составляет 90-94%.
Ключевые слова: неодекановая кислота; 1-(2-неонониламидоэтил)-2-неононил-2-имидазолин; щелочной
гидролиз; ингибитор кислотной коррозии
DOI: 10.31857/S0044461822020037, EDN: DDUEWF
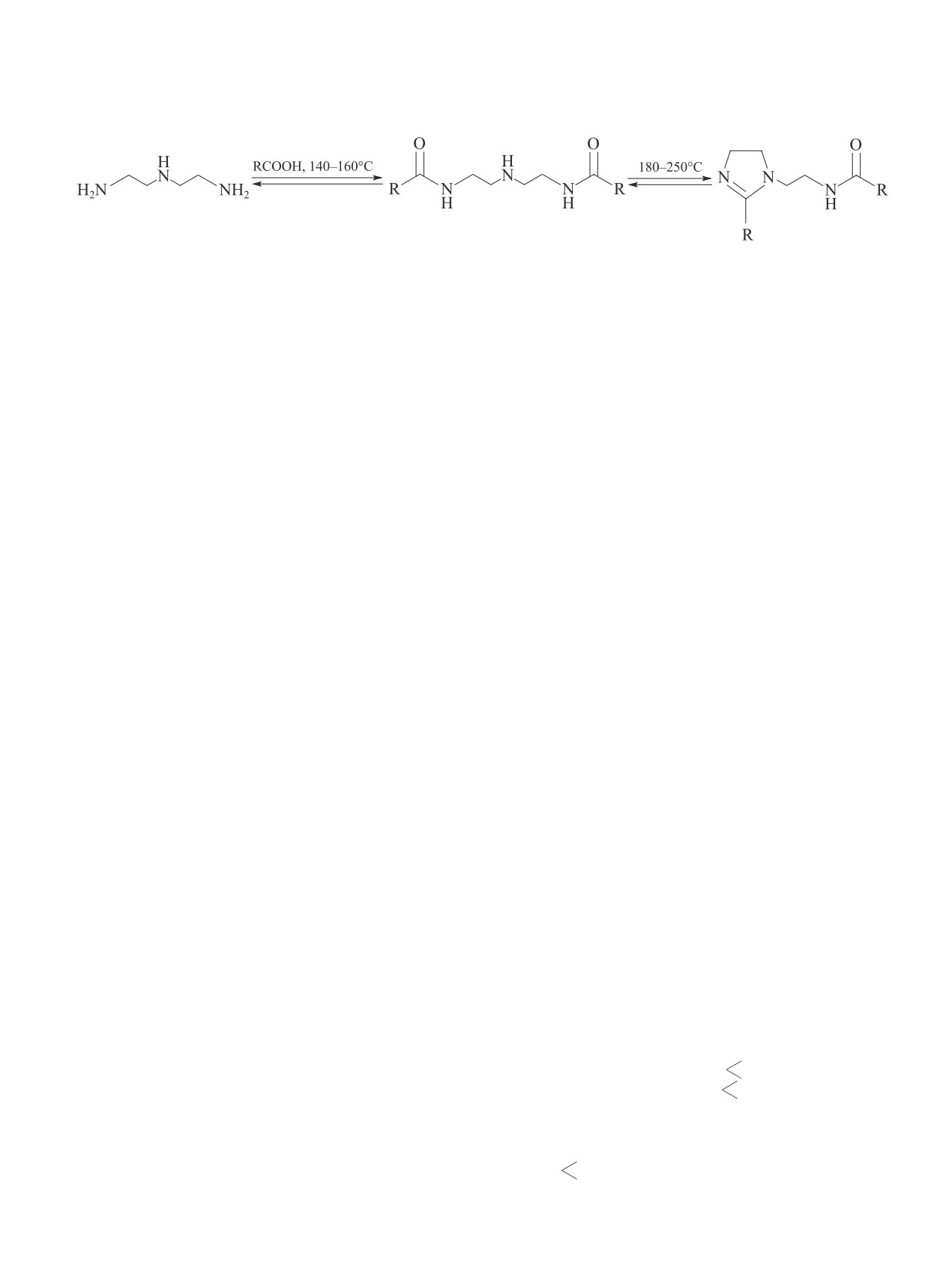
1,2-Дизамещенные имидазолины применяют для
водят в Европе, США и Китае. Неодекановая кислота
получения катионоактивных и амфолитных поверх-
представляет собой смесь 10-15 изомерных α,α′-,
ностно-активных веществ [1], а также в качестве ин-
α,α′,β- и α,α′,δ,δ′-разветвленных карбоновых кислот
гибиторов коррозии в процессах добычи, транспорта
общей формулы R1R2R3CCOOH. Можно ожидать,
и переработки нефти [2-4]. В кислых растворах ими-
что 1,2-дизамещенные имидазолины на основе не-
дазолины относительно устойчивы, но в водно-основ-
одекановой кислоты будут значительно устойчивее
ных средах легко гидролизуются [5-7]. Изменение
к гидролизу, чем имидазолины на основе жирных
характеристик ингибитора при хранении вследствие
неразветвленных карбоновых кислот, обычно при-
щелочного гидролиза является существенным недо-
меняемые в качестве ингибиторов коррозии [11, 12].
статком ингибиторов имидазолинового класса [8, 9].
Несмотря на большое число препаративных мето-
Ранее [10] мы показали, что введение разветвленного
дов синтеза 1,2-дизамещенных имидазолинов [1, 13],
заместителя в α-положение к реакционному центру
в промышленности для производства этих соедине-
затрудняет присоединение гидроксид-иона и, как
ний используется метод термической конденсации
следствие, замедляет скорость щелочного гидролиза
жирных карбоновых кислот или их эфиров с амино-
имидазолинов. В настоящее время наиболее доступ-
содержащими компонентами [14-16]. Реакцию про-
ной для синтеза имидазолинов с α,αʹ-разветвленными
водят в две стадии, циклизацию моно- или диамида
алкильными заместителями является неодекановая
в соответствующий имидазолин часто осуществляют
кислота, которую в промышленных объемах произ-
при пониженном давлении:
231
232
Бондарева С. О., Муринов Ю. И.
Очевидно, что по сравнению с линейными кисло-
с капиллярной колонкой SE-30, 30 м × 0.25 мм ×
тами пространственно-затрудненная неодекановая
× 0.25 мкм при 200-320°С. Величину рН контролиро-
кислота будет вступать в реакцию конденсации с
вали с помощью рН-метра ОР-211/1 (Radelkis) с ком-
диэтилентриамином в более жестких условиях. Так,
бинированным стеклянным электродом ЭСК 10601/7.
ацилирование диэтилентриамина неодекановой кис-
1-(2-Неонониламидоэтил)-2-неононил-2-
лотой с заметной скоростью протекает в интервале
имидазолин синтезировали в атмосфере азота (ос.ч.
температур 200-240°С с умеренным выходом целе-
первый сорт, АО «Линде Уралтехгаз») методом тер-
вого N,N′-(иминодиэтан-2,1-диил)ди(неодеканамид)а,
мической конденсации предварительно перегнан-
но введение избытка неодекановой кислоты позволи-
ного при 59-60°С (2 мм рт. ст.) диэтилентриамина с
ло снизить температуру реакции до 180-210°С [17].
неодекановой кислотой. Синтез осуществляли при
Цель работы — синтез 1, 2-дизамещенного ими-
мольных соотношениях диэтилентриамин:неодека-
дазолина методом термической конденсации диэти-
новая кислота 1:2 и 1:3, температуру варьировали в
лентриамина с неодекановой кислотой в условиях
интервале 210-260°С, масса исходной реакционной
избытка неодекановой кислоты, оценка его гидро-
смеси во всех экспериментах составляла 6 ± 0.2 г.
литической устойчивости в водно-основных и кис-
Реакционную смесь перемешивали при 80-100°С
лых растворах, изучение его защитного действия
в течение 0.5 ч, затем в течение 1 ч нагревали до
по отношению к низкоуглеродистой стали в кислых
255 ± 5°С и выдерживали в течение 3-3.5 ч с от-
растворах.
водом паров воды, выделяющейся в процессе ре-
акции. Ход реакции контролировали с помощью
УФ-спектроскопии и газожидкостной хроматографии.
Экспериментальная часть
После охлаждения очищали от примесей: 1.5 г про-
Исходные реагенты и растворители. В работе ис-
дукта растворяли в 10 мл толуола и промывали 10 мл
пользовали диэтилентриамин (техн., ОАО «Каустик»);
5 М раствора соляной кислоты — имидазолин перехо-
неодекановую кислоту (техн., ExxonMobil Chemical);
дил в солевую форму и выделялся на границе раздела
толуол (ч.д.а.), хлороформ (ч.д.а.), изопропиловый
фаз в виде жидкого масла темно-вишневого цвета.
спирт (х.ч.), серную кислоту (х.ч.) и соляную кис-
Удалив органическую и водную фазы, растворяли
лоту (х.ч.) (все — ЗАО «Экос-1»); гидроксид натрия
целевой продукт в 5-10 мл хлороформа, последова-
(х.ч.) и хлорид натрия (х.ч.) (ООО «ХлоренХима»);
тельно промывали 10 мл 0.1 М раствора гидроксида
н-деканол (ООО «АО РЕАХИМ», ч.), очищенный
натрия и 5 мл насыщенного раствора хлорида натрия.
перегонкой при 102-104°С (10 мм рт. ст.).
После удаления хлороформа получали 0.90 г 1-(2-не-
Приборы и оборудование. Спектры ЯМР регистри-
онониламидоэтил)-2-неононил-2-имидазолина (60%),
ровали на спектрометре Bruker Avance III (Bruker),
вязкой жидкости желтого цвета, представляющей
рабочие частоты 500.13 (1H) и 125.47 МГц (13C),
собой высококипящую смесь изомеров. Содержание
растворитель — CDCl3, внутренний стандарт — те-
1-(2-неонониламидоэтил)-2-неононил-2-имидазо-
траметилсилан. ИК-спектр записан на ИК-Фурье-
лина в синтезированном реагенте, по данным ГЖХ
спектрометре TENSOR 27 (Bruker) в пленке в
и УФ-спектроскопии, составляло не менее 95%.
области 4000-700 см-1, УФ-спектры — на спектро-
УФ-спектр (i-PrOH), λmax, нм (lgε): 233 (3.80). ИК-
фотометре Specord M40 (Carl Zeiss Jena) в области
спектр (пленка), ν, см-1: 3346 ср (NH), 1634 с (C O),
49 000-32 000 см-1. Масс-спектр зарегистрирован на
1582 с (C N), 1538 с [δ(NH)], 1001 ср (C—N кольца).
жидкостном квадрупольном хроматомасс-спектроме-
Спектр ЯМР 1H (CDCl3), δ, м. д.: 0.75-1.68 м (38 Н,
тре LCMS-2010EV (Shimadzu) в условиях химической
С9Н19), 3.27 уш.с (2H, CH2—N кольца), 3.32 уш.с
ионизации при атмосферном давлении (ХИАД) в
(4H, CH2—NHCO, CH2—N
), 3.56 уш.с (2H,
режиме регистрации положительных и отрицатель-
CH2—N C), 6.15, 6.21 уш.с (1H, NHCO). Спектр
ных ионов. Чистоту синтезированных соединений
ЯМР 13C (CDCl3), δC, м. д.: 8.79, 22.52, 25.30
контролировали методом газожидкостной хромато-
(С9Н19); 38.22, 38.32 (CH2—NHCO); 48.01-48.16
графии на газовом хроматографе GC-2014 (Shimadzu)
(CH2—N
); 41.79, 41.96, 45.71, 45.77 (Cчетв); 50.72,
Одностадийный синтез ингибитора коррозии стали 1-(2-неонониламидоэтил)-2-неононил-2-имидазолина
233
50.91 (CH2—N C); 51.42 (CH2—N кольца), 170.75,
Эффективность добавок оценивали коэффициен-
171.88 (C N), 177.47, 178.22 (C O). Масс-спектр
том торможения (γ) и степенью защиты (Z), которые
(ХИАД), m/z, %: 394.4 [M + H]+ (100), 392.4 [M - H]-
вычисляли по формулам
(100). C24H47N3O. Мвыч 393.3719.
γ =
,
(3)
Гидролиз имидазолина. Щелочной гидролиз прово-
дили в термостатируемом реакторе, оснащенном об-
ратным холодильником, по методике [10] в 50%-ном
Z =
·100%,
(4)
водном изопропиловом спирте в интервале темпера-
тур 25-75°С, рН 12.5 ± 0.1. Из температурной зависи-
где ν0 и νt — соответственно скорости коррозии об-
мости lgkэф = f(1/T) по тангенсу угла наклона прямой
разца при травлении без ингибитора и с ингибитором.
(tgα) рассчитывали значение энергии активации (Ea)
Данные, приведенные в работе, получены усред-
по формуле
нением результатов трех измерений.
Ea = R(-tgα),
(1)
Обсуждение результатов
где R = 8.31 Дж·моль-1∙K-1 — универсальная газовая
При использовании в качестве ацилирующего
постоянная.
агента неодекановой кислоты, представляющей со-
Для оценки устойчивости синтезированного ими-
бой смесь изомеров, различающихся по реакционной
дазолина к кислотному гидролизу в термостатиру-
способности, разделение реакции на стадии синтеза
емый реактор (80.0 ± 0.1°С) помещали 5 мл 0.05 М
диамида и циклизации его в имидазолин (см. схе-
раствора имидазолина в н-деканоле, добавляли 5 мл
му) проблематично и весьма условно: фактически
40%-ной серной кислоты и перемешивали на магнит-
при постепенном повышении температуры синтез
ной мешалке в течение 8 ч. Содержание имидазолина
имидазолина проходит в одну стадию. Был проведен
в растворах определяли методом УФ-спектроскопии
ряд экспериментов, в которых варьировали мольное
по интенсивной π→π*-полосе поглощения в области
соотношение исходных диэтилетриамина и неоде-
232-234 нм, отвечающей переходу связи С N в ге-
кановой кислоты, температуру и время проведения
тероцикле.
реакции (табл. 1). Образование 1-(2-неонониламидо-
Определение защитного действия. Скорость кор-
этил)-2-неононил-2-имидазолина с заметной скоро-
розии углеродистой стали Ст3 определяли гравиме-
стью протекало при температуре 250-260°С, но часть
трическим методом в колбах и термостатируемых
наименее реакционноспособных изомеров неодекано-
ячейках объемом 50 мл, используя стальные пла-
вой кислоты и в этих условиях не вступала в реакцию.
стинки прямоугольной формы размером 14.0 × 30.7 ×
Дальнейшее увеличение времени синтеза приводило
× 0.9 мм, в которых для крепления были высверлены
к осмолению продуктов. Стехиометрическое соотно-
отверстия диаметром 3.5 мм. Пластинки обезжири-
шение реагентов достигалось лишь при увеличении
вали изопропанолом, промывали дистиллирован-
доли реакционноспособных изомеров неодекановой
ной водой, высушивали фильтровальной бумагой и
кислоты, в нашем случае при мольном соотношении
взвешивали. Противокоррозионные свойства синте-
диэтилентриамина и неодекановой кислоты, равном
зированного имидазолина оценивали в 1.0 и 4.8 М
1:3. При данном соотношении исходных реагентов
растворах соляной кислоты при температурах 25 ±
реакция протекала быстрее (по сравнению с мольным
± 0.5 и 40 ± 0.1°С соответственно и в 2.0 М раство-
соотношением диэтилентриамина и неодекановой
рах серной кислоты при температурах 25 ± 0.5 и
кислоты, равным 1:2), время синтеза сократилось
50 ± 0.1°С. Концентрация имидазолина составляла
на 2 ч, а выход 1-(2-неонониламидоэтил)-2-неоно-
0.025-0.8 г·л-1 (0.058-1.865 ммоль·л-1). После ис-
нил-2-имидазолина вырос до 85-90% (в пересчете
пытаний пластинки промывали дистиллированной
на исходный диэтилентриамин). Однако из-за избыт-
водой, высушивали и повторно взвешивали.
ка неодекановой кислоты фактическое содержание
Скорость коррозии (ν) рассчитывали по формуле
1-(2-неонониламидоэтил)-2-неононил-2-имидазолина
в реакционной смеси составило 55-60%.
ν =
,
(2)
В водно-основных растворах расходование ими-
где m1 и m2 — соответственно масса образца до и
дазолинов описывается уравнением псевдопервого
после испытаний (г); S — площадь образца (м2); τ —
порядка [5, 18]. С уменьшением рН равновесие в
время испытаний (ч).
растворе смещается в сторону образования прото-
234
Бондарева С. О., Муринов Ю. И.
Таблица 1
Содержание 1-(2-неонониламидоэтил)-2-неононил-2-имидазолина в реакционной смеси
в зависимости от мольного соотношения исходных реагентов, температуры и времени проведения реакции
Содержание имидазолина, %, при мольном соотношении
Температура, °С
Время, ч
[диэтилетриамин]:[неодекановая кислота]
1:2
1:3
210-220
2
0
8-10
230-240
2
13 ± 5
25 ± 5
250-260
2
45 ± 5
50 ± 5
250-260
3
54 ± 5
57* ± 5
250-260
4
57 ± 5
—
250-260
5
65 ± 5
—
* 90% в пересчете на исходный диэтилентриамин.
нированной формы имидазолина. При значениях
имидазолинами (III) и (IV) с линейными алкильны-
водной фазы рН 5-6 1,2-дизамещенные имиидазоли-
ми заместителями в положении 2 имидазолинового
ны полностью переходят в протонированную форму,
кольца устойчивость 1-(2-неонониламидоэтил)-2-
и скорость их гидролиза резко замедляется. Но и в
неононил-2-имидазолина к гидролизу в водно-ос-
этом случае имидазолины на основе неразветвленных
новных растворах увеличилась весьма существенно.
жирных карбоновых кислот недостаточно устойчивы.
Для имидазолинов с разветвленными алкильными
Так, при Т = 70°С период полураспада 1,2-дизаме-
заместителями (I) и (II) были получены близкие по
щенного имидазолина на основе таллового масла в
значению энергии активации.
растворах, моделирующих углекислую коррозионную
Как правило, при травлении в стационарных ван-
среду (3 мас% NaCl, 1 атм СО2), составил 25.1 ч для
нах для удаления окалины используют 15-20%-ные
рН исходного раствора 4.1 и 7.4 ч для рН исходного
растворы соляной кислоты, из-за ее высокой лету-
раствора 6.0 [6].
чести температура травления обычно не превышает
Сравнение эффективных констант скорости ще-
30-40°С, или 8-18%-ные растворы серной кисло-
лочного гидролиза 1-(2-неонониламидоэтил)-2-нео-
ты при температуре 20-70°С [19, 20]. Исследования
нонил-2-имидазолина (I), 1-(2-этилпентиламидо-
показали, что 1-(2-неонониламидоэтил)-2-неоно-
этил)-2-(1-этилпентил)-2-имидазолина (II),
нил-2-имидазолин устойчив к кислотному гидро-
1-(2-аминоэтил)-2-гептил-2-имидазолина (III) и
лизу и не деградирует даже в достаточно жестких
1-оксиэтил-2-нонил-2-имидазолина (IV) показало,
условиях (40% H2SO4, 80°С, 8 ч).
что скорость гидролиза синтезированного нами ими-
Имидазолины являются ингибиторами хемосорб-
дазолина (I) уменьшилась в 20-30 раз даже по срав-
ционного действия. В настоящее время механизм их
нению с имидазолином (II), имеющим α-разветвлен-
защитного действия уточняется, но принято считать,
ный алкильный заместитель во втором положении
что молекулы имидазолина адсорбируются на по-
имидазолинового кольца (табл. 2). По сравнению с
верхности металла за счет sp3- и sp2-гибридизован-
Таблица 2
Эффективные константы и энергии активации гидролиза 1,2-дизамещенных имидазолинов
в водно-изопропанольной среде, рН 12.5 ± 0.1
Константа kэф·106, с-1
Энергия активации Ea,
Имидазолин
25°С
35°С
50°С
60°С
75°С
кДж·моль-1
(I)*
0.20 ± 0.03
0.50 ± 0.05
1.0 ± 0.1
2.0 ± 0.2
6.0 ± 0.5
56.2
(II) [10]
6.7 ± 0.2
72 ± 1
150 ± 15
54.6
(III) [10]
200 ± 23
44.6
(IV) [18]
310
39.2
* Данная работа.
Одностадийный синтез ингибитора коррозии стали 1-(2-неонониламидоэтил)-2-неононил-2-имидазолина
235
ных атомов азота плоского имидазолинового кольца,
защиты. Как и при комнатной температуре, линейной
образуя самособирающийся монослой [2, 12, 21], на
зависимости коэффициентов торможения от концен-
гидрофобной части которого происходит адсорбция
трации имидазолина не наблюдается.
последующего рыхлого мицеллярного слоя молекул
В растворах 2 М серной кислоты степень защиты
имидазолина. Наличие близкорасположенной амид-
увеличивается с ростом концентрации имидазолина
ной группы в положении 1 имидазолинового кольца
(табл. 4): зависимости коэффициентов торможения
положительно сказывается на ингибирующей спо-
от концентрации ингибитора и при 25, и при 50°С
собности, так как p-орбиталь С О-связи амидной
линеаризуются в координатах lgγ-lgс. Следует отме-
группы может взаимодействовать с вакантной d-ор-
тить, что при малых концентрациях (0.025-0.05 г·л-1)
биталью металла, образуя на его поверхности более
1-(2-неонониламидоэтил)-2-неононил-2-имидазолин
прочную защитную пленку [22]. Устойчивые слои
не только показал низкие значения коэффициентов
формируются, если длина гидрофобной алкильной
торможения коррозии, но и привел к изъязвлению
цепи в молекуле имидазолина превышает 7-8 атомов
краев стальных пластинок. Высокий защитный эф-
углерода [23]. В растворах кислот sp3-гибридизо-
фект достигался при концентрации имидазолина
ванные атомы азота имидазолинового кольца прото-
свыше 0.10 г·л-1. По сравнению с солянокислыми
нированы, и гидрофобные алкильные заместители
растворами увеличение температуры привело к более
экранируют положительно заряженные атомы азота
существенному снижению ингибиторной эффектив-
и снижают кулоновское отталкивание соседних заря-
ности имидазолина — заметный защитный эффект
дов, способствуя образованию более плотной упаков-
наблюдался только при концентрациях имидазолина
ки монослоя [12]. На основании данного механизма
0.50 г·л-1 и выше.
можно предполагать, что имидазолин, в молекуле
В целом 1-(2-неонониламидоэтил)-2-неоно-
которого присутствует пендантная амидная группа
нил-2-имидазолин показал лучшее защитное действие
и два гидрофобных α,αʹ-разветвленных алкильных
в растворах соляной кислоты, поскольку при травле-
заместителя с 9 атомами углерода, обладает хорошим
нии в серной кислоте из-за неравномерного растворе-
защитным действием при коррозии стали.
ния металла и его перетравливания получается менее
В растворе 1 М соляной кислоты 1-(2-неононил-
качественная поверхность, чем в соляной кислоте.
амидоэтил)-2-неононил-2-имидазолин эффективно
На поверхности защищаемого металла может осе-
ингибирует коррозию стали при достаточно низких
дать труднорастворимый моногидрат FeSO4·H2O,
концентрациях (табл. 3), и в интервале концентра-
препятствуя образованию равномерной защит-
ций 0.025-0.3 г·л-1 его защитный эффект почти не
ной пленки ингибитора и увеличивая его расход.
зависит от концентрации. Мы также оценили возмож-
Эффективность ингибиторов в том числе опре-
ность применения 1-(2-неонониламидоэтил)-2-неоно-
деляется их скоростью адсорбции на поверхности
нил-2-имидазолина в качестве ингибитора коррозии
защищаемого металла. В растворах 4.8 М соляной
при травлении стали соляной кислотой (4.8 М HCl,
или 2.0 М серной кислоты степень защиты не менее
40°С). В этих условиях защитное действие имидазо-
90% достигается через 3-4 ч и сохраняется как ми-
лина снижается, но при увеличении концентрации
нимум в течение 2 сут (табл. 5). Очевидно, что при
до 0.15-0.20 г·л-1 он обеспечивает 90%-ную степень
кратковременных процессах травления (1-5 мин) для
Таблица 3
Результаты исследования защитной способности 1-(2-неонониламидоэтил)-2-неононил-2-имидазолина
в растворах соляной кислоты
Условия проведения
Концентрация ингибитора,
Коэффициент торможения
Степень защиты Z, %
коррозионных испытаний
г·л-1
коррозии γ
1.0 М HCl, T = 25 ± 0.5°С, 72 ч
0.025
14.50
93.10
0.05
15.26
93.45
0.10
15.26
93.45
0.20
19.33
94.83
0.30
18.13
94.48
4.8 М HCl, T = 40 ± 0.1°С, 1 ч
0.08
3.95
74.69
0.16
13.62
92.65
0.32
10.86
90.79
236
Бондарева С. О., Муринов Ю. И.
Таблица 4
Результаты исследования защитной способности 1-(2-неонониламидоэтил)-2-неононил-2-имидазолина
в растворах 2.0 М серной кислоты
Условия проведения коррозионных испыта-
Концентрация ингибитора,
Коэффициент торможения
Степень защиты Z, %
ний
г·л-1
коррозии γ
T = 25 ± 0.5°С, 48 ч
0.025
1.22
17.94
0.05
1.75
42.92
0.10
12.57
92.05
0.20
51.69
96.07
T = 50 ± 0.1°С, 1 ч
0.08
1.98
49.59
0.16
3.30
69.67
0.40
8.30
87.95
0.80
9.63
89.61
существенной защиты стали потребуются высокие
тывали не только 1-(2-неонониламидоэтил)-2-неоно-
концентрации 1-(2-неонониламидоэтил)-2-неоно-
нил-2-имидазолин, но и продукт его синтеза (мольное
нил-2-имидазолина. По этой причине его применение
соотношение диэтилентриамин:неодекановая кис-
в качестве ингибитора кислотной коррозии целесо-
лота = 1:3, Т = 250-260°С, 3.5 ч), представляющий
образно при более длительной экспозиции.
собой смесь 1-(2-неонониламидоэтил)-2-неоно-
Поскольку выделение целевого имидазолина из
нил-2-имидазолина (59%), побочного 1-(2-аминоэ-
реакционной массы экономически невыгодно, в ка-
тил)-2-неононил-имидазолина (1%), предшествен-
честве потенциального ингибитора коррозии испы-
ника N,N′-(иминодиэтан-2,1-диил)ди(неононанамид)
Таблица 5
Изменение защитной способности 1-(2-неонониламидоэтил)-2-неононил-2-имидазолина
в зависимости от времени экспозиции пластинки в растворах 4.8 М соляной или 2.0 М серной кислоты
Концентрация ингибитора 0.1 г·л-1, температура 25 ± 0.1°С
Степень защиты Z, %,
Степень защиты Z, %,
Время, ч
Время, ч
4.8 М HCl
2.0 М H2SO4
2
87.90
3
90.70
4
91.75
6.5
92.70
8
93.10
16
93.50
24
95.40
24
94.45
48
93.0
48
92.05
Таблица 6
Результаты исследования защитной способности образца неочищенного имидазолинового продукта
Условия проведения коррозионных испытаний
Концентрация ингибитора, г·л-1
Степень защиты Z, %
1.0 М HCl, T = 25 ± 0.5°С, 72 ч
0.01
89.30
0.03
93.80
0.06
93.40
0.12
93.50
0.24
92.20
4.8 М HCl, T = 40 ± 0.1°С, 1 ч
0.32
91.85
2.0 М H2SO4, T = 25 ± 0.5°С, 48 ч
0.20
92.45
0.30
94.80
2.0 М H2SO4, T = 50 ± 0.1°С, 1 ч
0.80
88.20
Одностадийный синтез ингибитора коррозии стали 1-(2-неонониламидоэтил)-2-неононил-2-имидазолина
237
а (4%) и непрореагировавшей неодекановой кислоты
дазолиновый продукт является практически готовым
(36%). В настоящее время хорошо известны эффек-
ингибитором коррозии.
тивные ингибирующие композиции на основе не-
токсичных солей синтетических карбоновых кислот
Благодарности
[24], ведется поиск дешевых ингибиторов на основе
Работа выполнена с использованием оборудования
высших ненасыщенных кислот растительных масел
Центра коллективного пользования «Химия» УфИХ
[25, 26]. Однако подобные ингибиторы применяют
УФИЦ РАН.
для защиты стали в сероводородных и углекислотных
средах и ингибирования атмосферной коррозии (рН
Финансирование работы
3-7). В условиях нашего эксперимента неодекано-
вая кислота находится в неионизированной форме,
Работа выполнена по теме госзадания «Комплексо-
поэтому маловероятно, что ее присутствие усилит
образование моно- и полидентатных сера-азоторгани-
ингибирующее действие синтезированного имида-
ческих соединений с ионами металлов и фармако-
золина. Из приведенных в табл. 6 результатов гра-
нами».
виметрических испытаний следует, что в пересчете
на содержание 1-(2-неонониламидоэтил)-2-неоно-
Конфликт интересов
нил-2-имидазолина неочищенный имидазолиновый
продукт обладает аналогичным защитным действием,
Авторы заявляют об отсутствии конфликта инте-
при концентрации ингибитора 0.2 г·л-1 и выше на-
ресов, требующего раскрытия в данной статье.
блюдалась заметная опалесценция ингибированных
растворов. Как и ожидалось, высокое содержание
Информация об авторах
неодекановой кислоты в образце неочищенного ими-
Бондарева Светлана Олеговна, к.х.н.,
дазолинового продукта не повлияло на его защитную
способность.
Муринов Юрий Ильич, д.х.н., проф.,
Выводы
Предложен простой одностадийный способ син-
Список литературы
теза 1-(2-неонониламидоэтил)-2-неононил-2-ими-
дазолина из доступных промышленных реагентов:
[1] Tyagi R., Tyagi V. K., Pandey S. K. Imidazoline and its
derivatives: An overview // J. Oleo Sci. 2007. V. 56.
диэтилентриамина и неодекановой кислоты.
Введение разветвленного неононильного за-
[2] Jevremovicʹ I., Singer M., Nešicʹ S., Miškovicʹ-
местителя в α-положение к реакционному цен-
Stankovicʹ V. Inhibition properties of self-assembled
тру существенно замедлило скорость гидролиза
corrosion inhibitor talloil diethylenetriamine
1-(2-неонониламидоэтил)-2-неононил-2-имидазо-
imidazoline for mild steel corrosion in chloride solution
лина в щелочной среде (рН 12.5): эффективные
saturated with carbon dioxide // Corros. Sci. 2013.
константы гидролиза при 25 и 75°С равны (0.20 ±
V. 77. P. 265-272.
± 0.03)·10-6 и (6.0 ± 0.5)·10-6 с-1 соответственно.
1-(2-Неонониламидоэтил)-2-неононил-2-имидазолин
[3] Фролов В. И. Противокоррозионная активность ин-
устойчив к кислотному гидролизу, не деградируя в
гибитора «олазол» // Тр. Рос. гос. ун-та нефти и газа
достаточно жестких условиях (40% H2SO4, 80°С, 8 ч).
им. И. М. Губкина. 2009. № 2. С. 165-175.
Синтезированный имидазолин показал хорошее
[4] Abbasov V. M., Mammadova T. A., Veliyev K. R.
Kasamanli K. H. Hydroxy- and aminoethyl imidazolines
ингибирующее действие по отношению к низкоугле-
of cottonseed oil fatty acids as additives for diesel
родистой стали Ст3 в 2 М серной кислоте и 1-5 М
fuels // Open J. Synth. Theory Appl. 2015. V. 4. N 2.
соляной кислоте. При комнатной температуре сте-
P. 33-39.
пень защиты не менее 90% достигается через 3-4 ч
и сохраняется в течение 2 сут. С ростом температуры
[5] Watt M. M. Imidazoline hydrolysis in alkaline and
90%-ную степень защиты в растворах соляной кис-
acidic media — A review // JAOCS. 1990. V. 67. N 12.
лоты обеспечивает концентрация имидазолина свыше
0.10 г·л-1, в растворах серной кислоты заметный
[6] Shamsa A., Barmatov E., Hughes T. L., Hua Y.,
защитный эффект наблюдается при концентрациях
Neville A., Barker R. Hydrolysis of imidazoline based
имидазолина 0.50 г·л-1 и выше. Неочищенный ими-
corrosion inhibitor and effects on inhibition
238
Бондарева С. О., Муринов Ю. И.
performance of X65 steel in CO2 saturated brine // J.
Nugumanov T. R., Nazarov I. S., Murinov Yu. I.
Pet. Sci. Eng. 2021. V. 208. Part B. P. 109235.
Synthesis of an extractant based on neodecanoic acid
for rare earth metal preconcentration and separation //
[7]
Wu Y., Herrington Ph. R. Thermal reactions of fatty
Russ. J. Appl. Chem. 2019. V. 92. N 11. Р. 1531-1536.
acids with diethylene triamine // J. Am. Oil Chem.
Soc. 1997. V. 74. N 1. P. 61-64.
[18]
Коломиец Б. С., Герман В. К., Сучков В. В. Кинетика
и механизм щелочного гидролиза 1-оксиэтил-2-ал-
[8]
Martin J. A., Valone F. W. The existence of imidazoline
кил-2-имидазолинов в водной среде // ЖПХ. 1978.
corrosion inhibitors // Corrosion. 1985. V. 41. N 5.
Т. 51. № 5. С. 1141-1145.
[19]
Иванов Е. С. Ингибиторы коррозии в кислых сре-
[9]
Алцыбеева А. И., Буpлов В. В., Кузинова Т. М.,
дах. М.: Металлургия, 1986. С. 98-101.
Палатик Г. Ф., Pешетников С. М. Особенности
[20]
Verma C., Quraishi M. A., Ebenso E. E. Corrosive
поведения амидоимидазолиновых ингибитоpов
electrolytes // Int. J. Corros. Scale Inhib. 2020. V. 9.
коppозии в водно-углеводоpодных сpедах // Кор-
N 4. Р. 1261-1276.
розия: материалы, защита. 2006. № 1. С. 25-31.
[10]
Бондарева С. О., Лисицкий В. В., Яковцева Н. И.,
[21]
Jovancicevic V., Ramachandran S., Prince P.
Муринов Ю. И. Гидролиз 1,2-дизамещенных имида-
Inhibition of carbon dioxide corrosion of mild steel
золинов в водной среде // Изв. АН. Сер. хим. 2004.
by imidazolines and their precursors // Corrosion.
№ 4. С. 767-771 [Bondareva S. O., Lisitskii V. V.,
1999. V. 55. N 5. P. 449-455.
Yakovtseva N. I., Murinov Yu. I. Hydrolysis of
1,2-disubstituted imidazolines in aqueous media //
[22]
Rodríguez-Valdez L. M., Villamisar W., Casales M.,
Russ. Chem. Bull. 2004. V. 53. N 4. P. 803-807. https://
González-Rodriguez J. G., Martínez-Villafañe А.,
Martinez L., Glossman-Mitnik D. Computational
[11]
Muktiarti N., Ditama I., Soegijonoa B. Characterization
simulations of the molecular structure and corrosion
of imidazoline derivates synthesized from soybean oil
properties of amidoethyl, aminoethyl and hydroxyethyl
fatty acids as corrosion inhibitors on mild steel // AIP
imidazolines inhibitors // Corros. Sci. 2006. V. 48.
Conf. Proc. 2020. V. 2242. N 1. P. 020023-1-020023-6.
N 12. P. 4053-4064.
[12]
Yoo S. H., Kim Y. W., Chung K., Baik S. Y., Kim J. S.
[23]
Gouron A., Le Mapihan K., Camperos S., Al Farra A.,
Synthesis and corrosion inhibition behavior of
Lair V., Ringuedé A., Cassir M., Diawara B. New
imidazoline derivatives based on vegetable oil //
insights in self-assembled monolayer of imidazolines
Corros. Sci. 2012. V. 59. P. 42-54.
on iron oxide investigated by DFT // Appl. Surf. Sci.
2018. V. 456. P. 437-444.
[13]
Tripathy D., Mishra A. Convenient synthesis,
characterization and surface active properties of novel
[24]
Кузнецов Ю. И., Андреева Н. П., Агафонкина М. О.
cationic gemini surfactants with carbonate linkage
О совместной адсорбции на пассивном железе из
based on C12-C18 sat./unsat. fatty acids // J. Appl.
водных растворов 1,2,3-бензотриазола и фенил-
Res. Technol. 2017. V. 15. N 2. Р. 93-101.
ундеканоата натрия // Электрохимия. 2010. Т. 46.
№ 5. С. 593-598 [Kuznetsov Y. I., Andreeva N. P.,
[14]
Пат. RU 2641148 C2 (опубл. 2018). Ингибитор кор-
Agafonkina M. O. On co-adsorption on passive
розии для защиты оборудования для добычи сырой
iron from aqueous 1,2,3-benzotriazole and sodium
нефти, трубопроводов и резервуаров для сырой
phenylundecanoate // Russ. J. Electrochem. 2010.
нефти, а также способ его получения.
V. 46. N 5. Р. 560-564.
[15]
Pat. CN 102964306A (publ. 2012). Preparation method
of imidazoline corrosion inhibitor.
[25]
Swathi P. N., Rasheeda K., Samshuddin S., Alva V. D.
[16]
Wang S. F., Furuno T., Cheng Z. Synthesis of
Fatty acids and its derivatives as corrosion inhibitors
1-hydroxyethyl-2-alkyl-2-imidazoline and its
for mild steel // J. Asian Sci. Res. 2017. V. 7. N 8.
derivative sulfonate amphoteric surfactant from tall
Р. 301-308.
oil fatty acid // J. Wood Sci. 2003. V. 49. Р. 371-376.
[26]
Rehioui M., About S., Benzidia B., Hammouch H.,
[17]
Бондарева С. О., Нугуманов Т. Р., Назаров И. С.,
Erramli H., Daoud N. A., Badrane N., Hajjaji N.
Муринов Ю. И. Синтез экстрагента на основе
Corrosion inhibiting effect of a green formulation
неодекановой кислоты для концентрирования и
based on Opuntia Dillenii seed oil for iron in acid rain
разделения редкоземельных металлов // ЖПХ.
solution // Heliyon. 2021. V. 7. N 4. e06674.
2019. Т. 92. № 11. С. 1435-1440 [Bondareva S. O.,