Журнал прикладной химии. 2022. Т. 95. Вып. 2
ОРГАНИЧЕСКИЙ СИНТЕЗ И ТЕХНОЛОГИЯ ОРГАНИЧЕСКИХ ПРОИЗВОДСТВ
УДК 547.867.3:547.566
СИНТЕЗ И АНТИМИКРОБНАЯ АКТИВНОСТЬ
3-ЗАМЕЩЕННЫХ 8-ПРОПЕНИЛБЕНЗО[e][1,3]OКСАЗИНОВ
© Г. М. Мехтиева
Бакинский государственный университет,
Азербайджан, AZ-1148, г. Баку, ул. З. Халилова, д. 23
Поступила в Редакцию 1 сентября 2021 г.
После доработки 14 февраля 2022 г.
Принята к публикации 13 марта 2022 г.
Тройной конденсацией 2-пропенилфенола, формальдегида и первичных аминов (анилина, пропиламина,
гексиламина и бензиламина) по Манниху получен ряд производных 1,3-бензоксазина. Структуры синте-
зированных соединений подтверждены данными элементного анализа, ИК-, а также ЯМР-спектро-
скопии. Антимикробная активность исследована в растворах полученных соединений с концентра-
цией 5, 15 и 35 мг·л-1 по отношению к микроорганизмам Staphylococcus aureus, Staphylococcus aureus,
Escherichia coli, Candida albicans, Shigella flexneri, Salmonella enterica и Aspergillus niger. Выявлено,
что наилучшими антимикробными свойствами обладает бензоксазин, содержащий в структуре
бензильный фрагмент. Для подтверждения антимикробной активности синтезируемых соединений
при более низких концентрациях были проведены испытания методом серийных разведений и выяв-
лена их минимальная подавляющая концентрация (0.035 мг·л-1). Методом электронной микроскопии
исследована ультраструктура клетки Escherichia coli в присутствии соединения с бензильным заме-
стителем.
Ключевые слова: 1,3-бензоксазины; 2-пропенилфенол; амины; реакция Манниха; антимикробная ак-
тивность
DOI: 10.31857/S0044461822020062, EDN: DEFREZ
Скрининговый поиск соединений, обладаю-
Цель работы — синтез 1,3-бензоксазинов на осно-
щих антимикробной активностью, ведется с конца
ве 2-пропенилфенола, формальдегида и первичных
XX столетия. К числу подобных соединений отно-
аминов (анилин, пропиламин, гексиламин и бензил-
сятся 1,3-бензоксазины [1-5], в основе синтеза кото-
амин) и исследование антимикробных свойств син-
рых лежит реакция тройной конденсации фенолов,
тезированных соединений.
бисфенолов и их производных с формальдегидом и
первичными аминами по Манниху [6, 7]. Включая
Экспериментальная часть
в процесс тройной конденсации ранее не использо-
ванные алкенилфенолы, особенно с С С-связью,
1H и 13C ЯMР-спектры синтезированных соеди-
сопряженной с ароматическим кольцом, и функцио-
нений (3a-d) зарегистрированы с помощью ЯМР-
нальнозамещенные амины, можно получить 1,3-бен-
спектрометра AVANCE 300 (Bruker). Растворителем
зоксазины с высокими бактерицидными и фунгицид-
служил CDCl3 (99.8%, кат. номер 151831, Sigma-
ными свойствами.
Aldrich). ИК-спектры соединений (3a-d) зареги-
253
254
Мехтиева Г. М.
Схема синтеза 3-замещенных 8-пропенилбензо[e][1,3]оксазинов
стрированы на ИК-Фурье-спектрофотометре (Bruker
Синтез соединений (3а-d) (общая методика).
Lumos) в области 4000-600 см-1 при комнатной тем-
В трехгорлую колбу, снабженную мешалкой, термо-
пературе. Элементный анализ выполнен на приборе
метром и обратным холодильником, содержащую
Carlo Erba ЕА 1108 (Science Exchange). Показатель
рассчитанное количество формальдегида, охлажден-
преломления (nD20) определяли на рефрактометре
ного до температуры 5-10°С, добавляли по каплям
AbbeMAT 350/500 (Anton Paar), плотность (d) изме-
первичный амин. Реакционную смесь перемешива-
ряли на приборе DMA 4500М (Anton Paar).
ли при температуре 5-10°C в течение 0.5 ч, затем
В работе в качестве исходных реагентов ис-
к образовавшемуся продукту (1a-d) (см. схему) по
пользовали: 2-пропенилфенол (98%, кат. но-
каплям добавляли 2-пропенилфенол и полученную
мер 6380-21-8, Sigma-Aldrich, Ткип = 230-231°С,
смесь перемешивали 1.5 ч при 95-98°C (по реакции
d = 1.044 г·см-3, nD20 1.578), анилин (99%, Karmalab,
Манниха). Реакционную смесь охлаждали, разбавля-
Ткип = 184°С, d = 0.8786 г·см-3), пропиламин (99%,
ли бензолом (15 мл), органический слой промывали
кат. номер 107-10-8, Sigma-Aldrich, Ткип = 48°С,
5%-ным водным раствором KОН (30 мл) и сушили
d = 0.7173 г·см-3, nD20 1.3879), гексиламин (99%,
над Na2SO4. Растворитель и непрореагировавшую ис-
Karmalab, Ткип = 131-132°С, d = 0.765 г·см-3), а также
ходную смесь реагентов удаляли из массы с помощью
KОН (ч.д.а., ЗАО «Вектон»), безводный прокаленный
роторного испарителя. Продукты (3a-c) извлекали
Na2SO4 (ч.д.а., ЗАО «Вектон») и формалин (37%-ный
перегонкой в вакууме; при получении соединения
водный раствор формальдегида) (Karmalab). В реак-
(3d) остаток несколько раз промывали 5%-ным во-
ции и экстракции применяли осушенный и перег-
дным раствором KОН и перекристаллизовывали из
нанный бензол (ч.д.а., ЗАО «Вектон») (в качестве
изобутилового спирта.
растворителя). Для перекристаллизации соединения
(E)-3-Фенил-8-(проп-1-ен-1-ил)-3,4-дигидро-2H-
(3d) использовали изобутиловый спирт (ч.д.а., ЗАО
бензо[e][1,3]оксазин (3a) получен по общей методике
«Вектон»). Для исследования антимикробной ак-
взаимодействием 13.4 г (0.1 моль) 2-пропенилфено-
тивности использовали диметилсульфоксид (99%,
ла (2) со смесью 16.2 мл формалина и 9.3 г (0.1 моль)
Karmalab, Ткип = 189°С, d = 1.1004 г·см-3).
анилина. Выход 78%. Tкип = 169-172°C/3-4 мм рт. ст.,
nD20 1.5350, d = 1.121 г·см-3.
Найдено (%):
C — 81.19, H — 6.79, N — 5.54.
C17H17NO. Вычислено (%):
C — 81.24, H — 6.82, N — 5.57.
1H ЯMР-спектр (CDCl3; δ, м. д.): 2.14 д (3H,
3030, 2910, 2851, 1651, 1594, 1495, 1445, 1372, 1221,
J = 6 Гц, СН—CH3), 4.75 с (2H, N—CH2—Ar), 5.56 с
1157, 936, 749, 690.
(2H, O—CH2—N—), 6.31-6.41 м (1H, CH3—CH
),
(E)-8-(Проп-1-ен-1-ил)-3-пропил-3,4-дигидро-2H-
6.69 д (1H, J = 15 Гц, Ar—CH
), 6.83-7.41 м (8H,
бензо[e][1,3]оксазин (3b) получен по общей методике
аром.). 13C ЯМР-спектр (CDCl3; δ, м. д.): 19.1, 50.8,
взаимодействием 13.4 г (0.1 моль) 2-пропенилфено-
118.2, 121.0, 121.5, 124.5, 125.0, 126.0, 126.6, 127.0,
ла (2), 16.2 мл формалина (0.2 моль) и 5.9 г (0.1 моль)
127.6, 128.4, 129.4, 148.5, 151.5. ИК-спектр (см-1):
пропиламина. Выход (3b) 81%. Tкип = 144-146°C/3-
4 мм рт. ст., nD20 1.5140, d = 1.045 г·см-3.
Найдено (%):
C — 77.32, H — 8.79, N — 6.44.
C14H19NO. Вычислено (%):
C — 77.38, H — 8.81, N — 6.45.
1H ЯМР-спектр (CDCl3; δ, м. д.): 1.01 т (3H,
1.98 д (3H, J = 7 Гц, CH3—CH
), 2.78 т (2H, J = 8 Гц,
J = 7 Гц, CH—CH3), 1.63-1.70 м (2H, —CH2—CH3),
N—CH2—CH2—CH3), 4.05 с (2H, N—CH2—Ar), 4.95 с
Синтез и антимикробная активность 3-замещенных 8-пропенилбензо[e][1,3]oксазинов
255
(2H, O—CH2—N), 6.25-6.35 м (1H, CH3—CH
),
(E)-3-Гексил-8-(проп-1-ен-1-ил)-3,4-дигидро-2H-
6.62 д (1H, J = 12 Гц, CH—Ar), 6.82-7.40 м (3H,
бензо[e][1,3]оксазин (3c) получен по общей методике
аром.). 13C ЯМР-спектр (CDCl3; δ, м. д.): 12.0, 15.0,
конденсацией 13.4 г (0.1 моль) 2-пропенилфенола (2),
18.1, 21.0, 50.0, 53.5, 83.1, 119.2, 120.0, 125.0, 126.0,
16.2 мл формалина и 8.4 г (0.1 моль) гексиламина.
127.0, 127.6, 152.0. ИК-спектр (см-1): 3028, 2959,
Выход (3c) 89%. Tкип=164-166°C/3-4 мм рт. ст.,
2931, 1652, 1591, 1447, 1373, 1218, 1141, 923, 754.
nD20 1.4950, d = 0.909 г·см-3.
Найдено (%):
C — 78.66, H — 9.68, N — 5.38.
C17H25NO. Вычислено (%):
C — 78.72, H — 9.71, N — 5.4.
1H ЯМР-спектр (CDCl3; δ, м. д.): 0.96 т (3H, J = 6 Гц,
(E)-3-Бензил-8-(проп-1-ен-1-ил)-3,4-дигидро-2H-
CH3), 1.28-1.62 (8H, (CH2)4), 1.95 д (3H, J = 6 Гц,
бензо[e][1,3]оксазин (3d) получен по общей методи-
CH3—CH
), 2.79 т (2H, J = 6 Гц, N—CH2—CH2),
ке путем взаимодействия 13.4 г (0.1 моль) 2-пропе-
4.05 с (2H, N—CH2—Ar), 4.95 с (2H, O—CH2—N),
нилфенола (2), 16.2 мл формалина и 10.7 г (0.1 моль)
6.23-6.33 м (1H, CH3—CH
), 6.74 д (2H, J = 15 Гц,
бензиламина, реакцию образования (1d) проводили
CH—Ar), 6.81-7.39 м (3H, аром.). 13C ЯМР-
при 25°С, а реакцию образования (3d) — при 90°C.
спектр (CDCl3; δ, м. д.): 14.0, 19.0, 23.1, 27.0, 28.0,
В качестве растворителя использовали бензол (15 мл).
32.1, 51.0, 52.5, 83.2, 119.6, 120.0, 125.0, 126.0,
Выход 75%. Tпл = 82°C.
126.7, 127.0, 127.8, 152.0. ИК-спектр (см-1): 3025,
2925, 1652, 1590, 1449, 1373, 1223, 1139, 925, 755.
Найдено (%):
C — 81.36, H — 7.18, N — 5.25.
C18H19NO. Вычислено (%):
C — 81.47, H — 7.22, N — 5.28.
1H ЯМР-спектр (CDCl3; δ, м. д.): 2.02 д (3H,
flexneri ATCC®12022, Salmonella enterica
J = 7 Гц, CH3—CH
), 4.02 с (2H, N—CH2—Ar),
ATCC®13076, Aspergillus niger (изолят, полученный
4.03 с (2H, N—CH2—С6Н5), 5.05 с (2H, O—CH2—N),
из воды). Использованные в работе контрольные
6.33-6.40 м (1H, CH3—CH
), 6.79-6.94 м (1H, CH,
штаммы культур получены в Республиканском сани-
3H, аром.), 7.37-7.94 м (5H, aрoм.). 13C ЯМР-спектр
тарно-карантинном центре Министерства здравоохра-
(CDCl3; δ, м. д.): 19.0, 49.5, 56.5, 82.5, 120.0, 121.1,
нения Азербайджанской республики. Равные объемы
125.0, 125.6, 126.0, 127.0, 127.5, 128.0, 128.5, 129.0,
микробной флоры по 1 мл наслаивали на чашки Петри
138.1, 151.8. ИК-спектр (см-1): 3058, 3029, 2917, 1651,
с селективной средой для каждого возбудителя и ис-
1590, 1447, 1367, 1205, 1123, 925, 737, 696.
пользовали стандартный инокулем, соответствующий
Cоединения (3a-c) являются вязкими жидкостями
по плотности 0.5 по стандарту МакФарланда и содер-
оранжевого и желтого цвета с характерным запахом,
жащий примерно 1.5·108 КОЕ/мл. Противогрибковую
не смешиваются с водой, но хорошо смешиваются
активность определяли в жидкой питательной среде
с органическими растворителями (ацетон, бензол,
Sabouraud Dextrose Agar (Himedia). Приоткрытые
CCl4, CHCl3). Соединение (3d) является твердым
чашки подсушивали в боксе при комнатной темпе-
веществом желтого цвета (Tпл = 82°C).
ратуре в течение 15 мин. Затем в лабораторных ус-
Антимикробная активность синтезированных
ловиях готовили диски, пропитанные растворами
соединений (3a-d) исследована диско-диффузным
испытуемых соединений в концентрации 35, 15 и
методом, а также методом серийных разведений* в
5 [для (3d)] мг·л-1 в диметилсульфоксиде, которые
жидкой питательной среде в мясо-пептонном бульо-
стерильным пинцетом накладывали на агаризованные
не при микробной концентрации 1.5·108 КОЕ/мл.
питательные среды. Степень чувствительности ис-
В работе использовали следующие микроорганизмы:
пытуемого микроорганизма определяли по диаметру
Staphylococcus aureus NCTC 6571, Staphylococcus
подавления роста (в мм). Одновременно проводили
aureus ATCC®25923, Escherichia coli ATCC®25922,
холостые опыты без добавления соединений (3a-d).
Candida albicans NSTC-3255/ATCC2091, Shigella
Чашки Петри инкубировали 24 ч (в присутствии
бактерий при 37°C и грибов при 28°C) в термостате
ТС1/80 (ОАО Смоленское СКТБ СПУ). Степень ак-
* Методические указания МУК 4.2.1890-04. Методы
тивности тестируемых соединений определяли по
контроля. Биологические и микробиологические факто-
диаметру зоны подавления роста микроорганизмов.
ры. Определение чувствительности микроорганизмов к
В качестве образцов сравнения использовали амок-
антибактериальным препаратам. М.: Федеральный центр
госсанэпиднадзора Минздрава России, 2004. 91 с.
сициллин капс. 250 мг (Хемофарм А. Д. Вршац) и
256
Мехтиева Г. М.
флюконазол капс. 150 мг (ООО Фармацевтическая
на трансмиссионном электронном микроскопе JEM-
компания «Здоровье») в концентрации 35 мг·л-1.
1400 (JEOL) при ускоряющем напряжении 80-120 кВ.
С целью проведения антимикробных исследова-
ний методом серийных разведений из растворов, со-
Обсуждение результатов
держащих соединения в концентрации 35 мг·л-1, бы-
ли приготовлены растворы с разведением 1:10, 1:100
Cоединения (3а-d) в концентрации 35 мг·л-1 обла-
и 1:1000. Указанные растворы добавляли в пробирки с
дают антимикробной активностью по отношению ко
4 мл стерильного мясо-пептонного бульона (Научно-
всем исследуемым микроорганизмам (см. таблицу).
исследовательский центр фармакотерапии). Спустя
В концентрации 15 мг·л-1 соединения (3а-c) актив-
1 сут в эти пробирки вводили 0.1 мл суспензии суточ-
ны по отношению к бактериям S. aureus, Sh. flexneri,
ной культуры штаммов бактерий и грибов E. coli, S.
S. enterica и E. Coli, однако практически не актив-
flexneri, S. enterica, S. aureus, C. albicans и A. niger и
ны по отношению к грибам C. albicans и A. niger.
проводили инкубацию в течение 24 ч при 28 и 37°C.
Сравнительно высокой антимикробной активностью
С помощью трансмиссионного электронного ми-
против всех используемых в работе микроорганизмов
кроскопа JEM-1400 (JEOL) получены изображения
обладает (3d).
ультраструктуры клетки E. сoli в присутствии (3d)
Выявлена бактерицидная и фунгицидная актив-
(35 мг·л-1), амоксициллина (35 мг·л-1), а также в их
ность растворов 5 мг·л-1 соединения (3d). Это, ве-
отсутствие. Образцы инкубировали в термостате в
роятно, связано с одновременным присутствием в
течение 24 ч при 37°C, затем центрифугировали при
структуре молекулы двух ароматических групп и
4500 об·мин-1 в течение 10 мин. Затем образцы фик-
1,3-бензоксазинового кольца, связанного с метиле-
сировали погружением на 15 мин в смесь 1.8%-ного
новой группой. Наличие бензильного фрагмента,
водного раствора глутарового альдегида (1.8%-ный
по-видимому, влияет на антимикробную активность
водный раствор, кат. номер 111-30-8, Sigma-Aldrich),
соединения (3d) в сравнении с (3а).
2.5%-ного раствора параформальдегида (99%, ч.д.а.,
Выявлено, что антимикробная активность соеди-
ЗАО «Вектон»,) и 0.1%-ного раствора пикриновой
нений (3a-c) и препаратов сравнения (амоксициллин
кислоты (99%, ч.д.а., ЗАО «Вектон») в фосфатном
и флюконазол) практически одинакова, соединение
буферном растворе (pH 7.4) (IbisLab). Затем биоп-
(3d) в сравнении с эталонами обладает сравнитель-
таты помещали на ночь в свежую порцию фикса-
но более высокой бактерицидной и фунгицидной
тора (2.5%-ного раствора глутарового альдегида).
активностью. Антимикробная активность соедине-
Постфиксацию проводили в 1%-ном растворе OsO4
ний (3a-d) максимальна при концентрации 35 мг·л-1;
(98%, ч.д.а., ЗАО «Вектон») и 1.5%-ном растворе
при разведении активность уменьшается в большей
K4[Fe(CN)6] (98%, ч.д.а., ЗАО «Вектон») в 0.1 М фос-
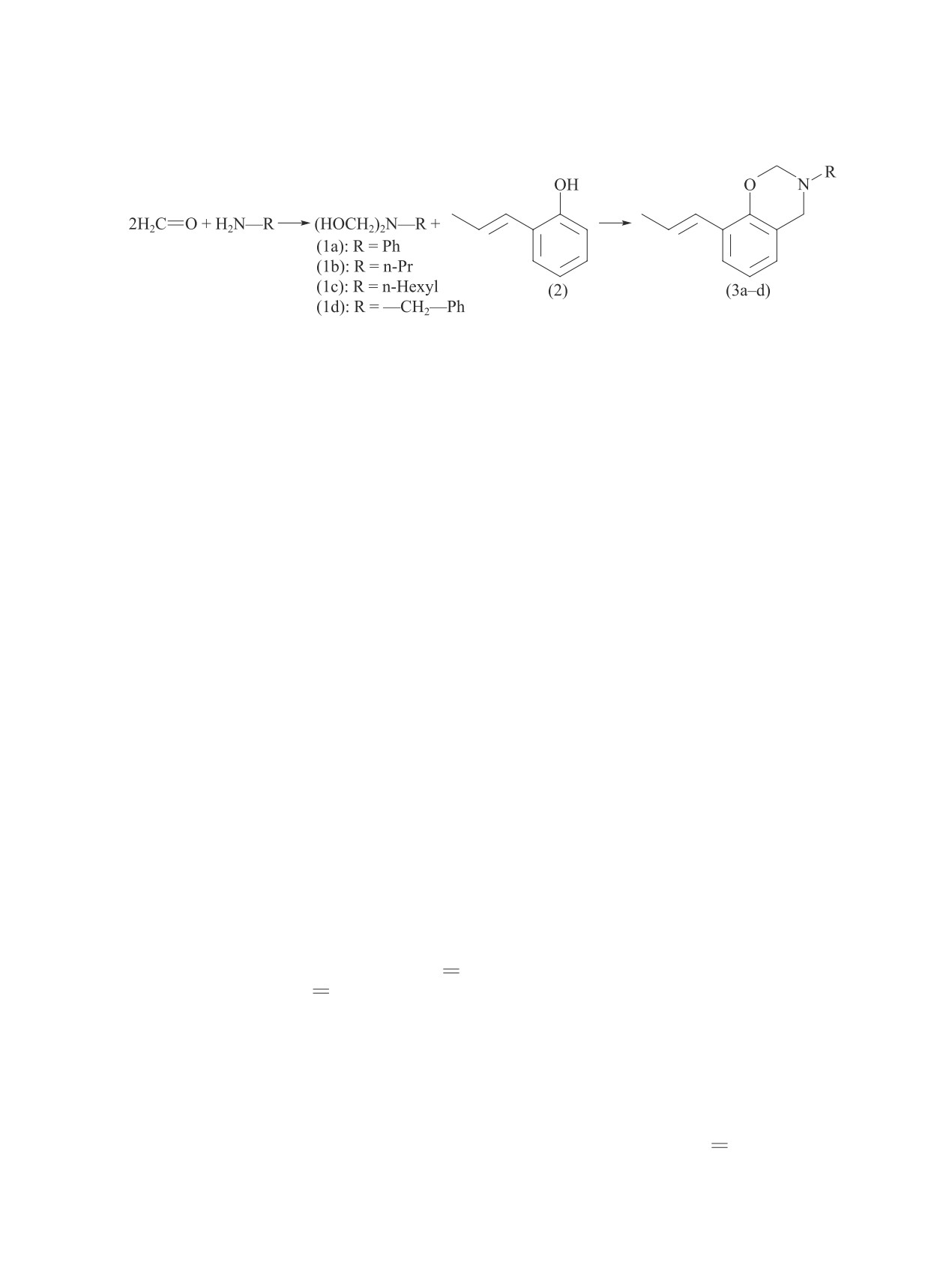
или меньшей степени. Cоединение (3c) показыва-
фатном буферном растворе (pH 7.4) в течение 1.5-2 ч.
ет наиболее высокую активность против S. flexneri
Полученный материал обезвоживали и заливали в
при концентрации 0.035 мг·л-1, однако в указанной
метакрилат Аралдит 502 (25068-38-6 SPI-Chem) и
концентрации не подавляет рост S. enterica (рис. 1).
Эпон-812 (эпоксидная смола-812)( кат. номер 45345,
Соединение (3a) при концентрации 0.035 мг·л-1 также
Sigma-Aldrich) по общепринятой методике.* Полу- и
показывает наивысшую активность против S. flexneri,
ультратонкие срезы, полученные на ультрамикро-
в данном случае диаметр зоны подавления составляет
томе Leica EM UC7, исследовали с помощью све-
2 мм. Однако по отношению к другим бактериям его
тового микроскопа Zeiss (Primo Star). Для повыше-
активность отсутствует (рис. 1).
ния контраста изображения образцов ультратонких
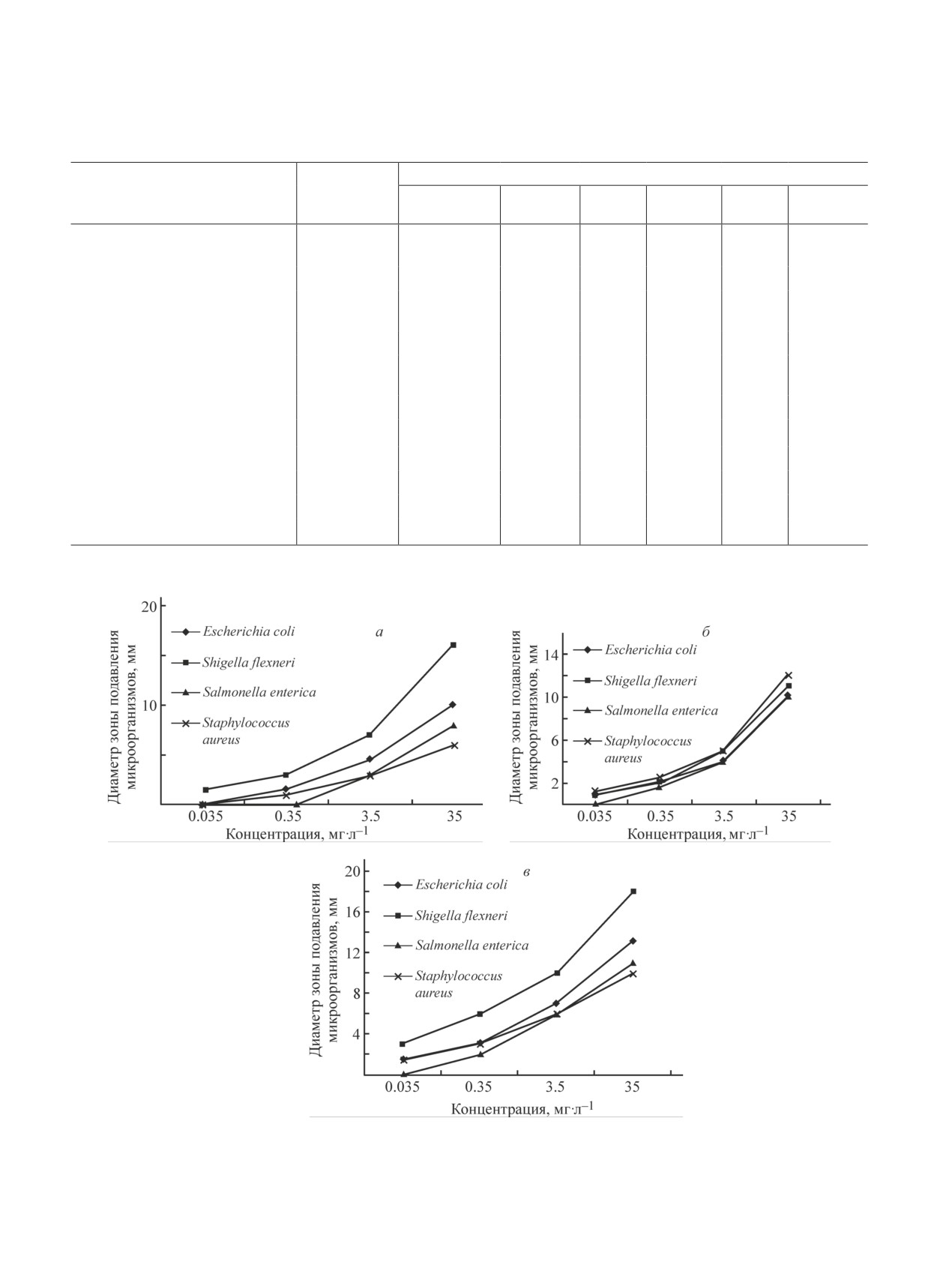
Так как соединение (3d) при концентрации
срезов (50-70 нм) их окрашивали 2%-ным водным
35 мг·л-1 показало эффективность в отношении пода-
раствором уранилацетата (ООО «ГРАНХИМ»), затем
вления роста грибов, его антимикробная активность
0,4%-ным раствором цитрата свинца (ч., Karmalab) по
была исследована не только по отношению к бактери-
Рейнолдсу.** Просмотр и фотографирование окрашен-
ям, но и к грибам. Соединение (3d) при концентраци-
ных и неокрашенных ультратонких срезов проводили
ях 3.5, 0.35 и 0.035 мг·л-1 эффективно по отношению
ко всем исследованным микроорганизмам (рис. 2).
Наибольшая эффективность (3d) наблюдается против
* Kuo J. Electron microscopy: methods and protocols.
C. albicans и E. coli. Минимальная бактерицидная
Totowa: Humana Press. 2007. Р.47.
активность соединения (3a) по отношению ко всем
** Сальникова М. М., Малютина Л. В., Саитов В. Р.,
исследованным бактериям составляет 3.5 мг·л-1,
Голубев А. И. Трансмиссионная электронная микроскопия
в биологии и медицине. Казань, 2016. С. 23-56.
(3b) и (3с) — 0.35 мг·л-1; минимальная бактерицид-
Синтез и антимикробная активность 3-замещенных 8-пропенилбензо[e][1,3]oксазинов
257
Антимикробная активность 8-пропенилбензо[e][1,3]оксазинов
Диаметр зоны уничтожения микроорганизмов, мм
Концентрация,
Cоединение
мг·л-1
Staphylococcus
Escherichia
Shigella
Salmonella
Candida
Aspergillus
aureus
coli
flexneri
enterica
albicans
niger
(E)-3-Фенил-8-(проп-1-ен-1-
15
4
6
10
4
0
0
ил)-3,4-дигидро-2H-бензо[e]-
[1,3]-оксазин (3a)
35
6
10
16
8
2
3
(E)-8-(Проп-1-ен-1-ил)-3-
15
8
6
6
5
0
0
пропил-3,4-дигидро-2H-
бензо[e][1,3]оксазин (3b)
35
12
10
11
10
4
4
(E)-3-Гексил-8-(проп-1-ен-1-
15
6
9
11
8
0
0
ил)-3,4-дигидро-2H-бензо[e]-
[1,3]-оксазин (3c)
35
10
13
18
11
0
2
(E)-3-Бензил-8-(проп-1-ен-1-
5
7
6
5
4
8
6
ил)-3,4-дигидро-2H-бензо[e]-
15
12
13
11
10
14
12
[1,3]-оксазин (3d)
35
21
28
20
22
31
27
Амоксициллин
35
15
10
9
9
—
—
Флюконазол
35
—
—
—
—
29
22
П р и мечан и е. «-» — испытание не проводили.
Рис. 1. Зависимость антибактериальной активности от концентрации (E)-3-фенил-8-(проп-1-ен-1-ил)-3,4-дигидро-
2H-бензо[e][1,3]оксазина (a), (E)-8-(проп-1-ен-1-ил)-3-пропил-3,4-дигидро-2H-бензо[e][1,3]оксазина (б), (E)-3-
гексил-8-(проп-1-ен-1-ил)-3,4-дигидро-2H-бензо[e][1,3]оксазина (в).
258
Мехтиева Г. М.
ная и фунгицидная активности (3d) — 0.035 мг·л-1
(рис. 1, 2).
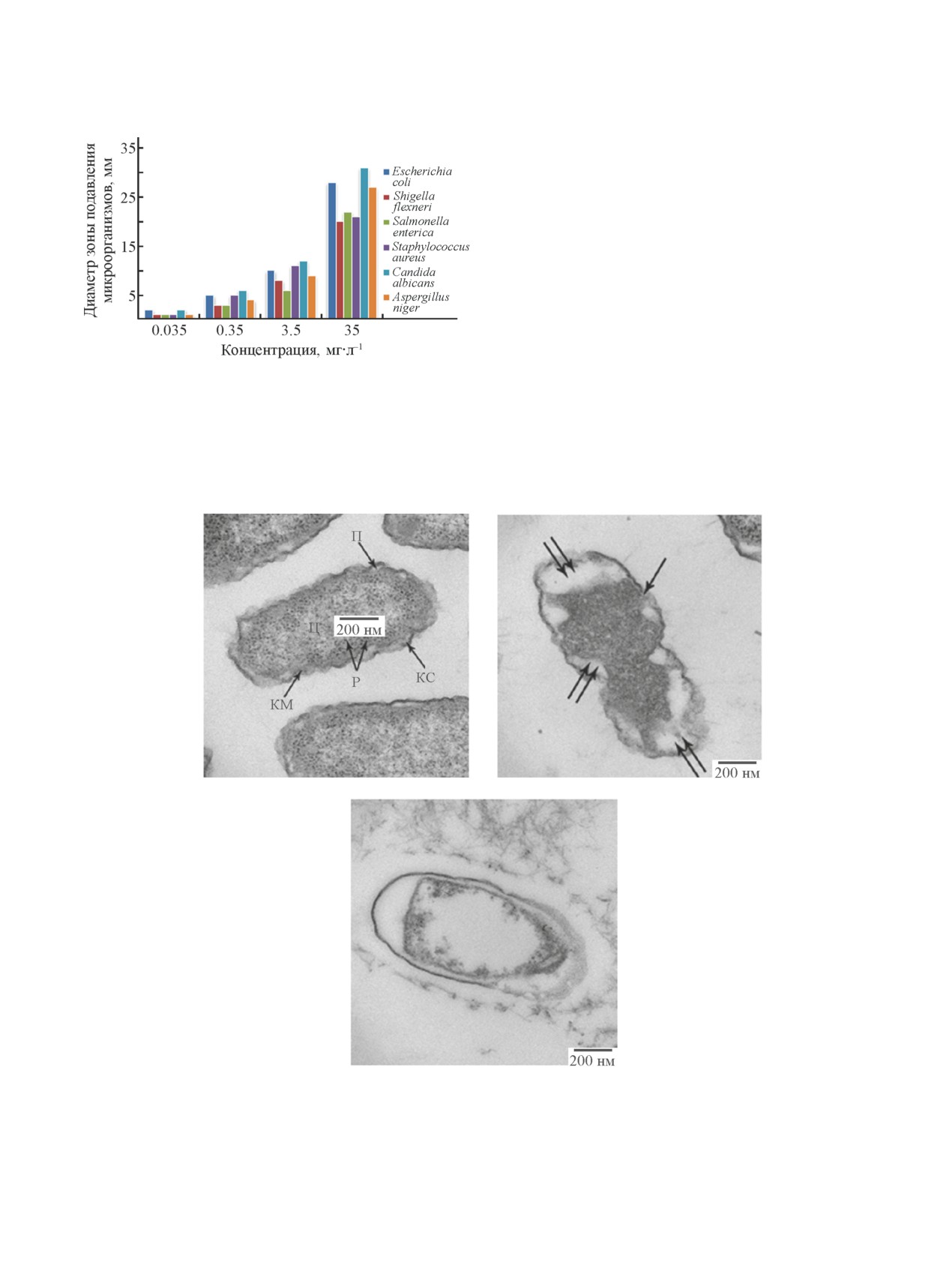
Под действием амоксициллина наблюдается по-
вреждение клеточной стенки и клеточной мембраны
E. сoli (рис. 3, б), рост бактерий прекращается и они
теряют способность размножаться. В присутствии
соединения (3d) происходит патоморфологическое из-
менение ультраструктуры E. сoli (рис. 3, в) — разру-
шаются внутренние и внешние слои оболочки E. coli,
степень повреждения бактерии E. coli много выше,
чем в присутствии амоксициллина. Полученные ре-
зультаты согласуются с результатами более ранних
Рис. 2. Противомикробная активность (E)-3-бензил-8- исследований [8, 9].
(проп-1-ен-1-ил)-3,4-дигидро-2H-бензо[e][1,3]оксазина
Таким образом, наличие в соединении (3d) бензок-
(3d).
сазинового и бензильного фрагментов значительно
повышает его антимикробную активность в сравне-
нии с соединениями (3а-с) и амоксициллином.
a
б
в
Рис. 3. Ультраструктура клетки Escherichia coli в отсутствие (3d) и амоксициллина (а), частично поврежденной
амоксициллином (б) (повреждение клеточной стенки и клеточной мембраны показано двумя стрелками, поврежде-
ние клеточной стенки показано одной стрелкой) и разрушенной (E)-3-бензил-8-(проп-1-ен-1-ил)-3,4-дигидро-2H-
бензо[e][1,3]оксазином (в).
Ц — цитоплазма, KM — клеточная мембрана или плазматическая мембрана, КC — клеточная стенка, Р — рибосома,
П — пептидоглюкан.
Синтез и антимикробная активность 3-замещенных 8-пропенилбензо[e][1,3]oксазинов
259
Выводы
Список литературы
Бензоксазины, синтезированные путем взаи-
[1]
Mansouri S. G., Zali-Boeini H., Zomorodian K.,
модействия 2-пропенилфенола, формальдегида и
Khalvati B., Pargali R. H., Dehshahri A., Rudbari H. A.,
Sahihi M., Chavoshpour Z. Synthesis of novel
первичных аминов, проявляют высокую антими-
naphtho[1,2-e][1,3]oxazines bearing an arylsulfonamide
кробную активность в отношении микроорганиз-
moiety and their anticancer and antifungal activity
мов Staphylococcus aureus, Staphylococcus aureus,
evaluations // Arab. J. Chem. 2020. N 13. P. 1271-1282.
Escherichia coli, Candida albicans, Shigella flexneri,
Salmonella enterica и Aspergillus niger. Наиболее высо-
[2]
Mymoona A., Shaikh H., Syed M. H., Mohammad M. A.,
кой бактерицидной и фунгицидной активностью об-
Akhter N. Synthesis of some new 3,4-dihydro-2H-1,3-
ладает (E)-3-бензил-8-(проп-1-ен-1-ил)-3,4-дигидро-
benzoxazines under microwave irradiation in solvent-
2H-бензо[e][1,3]оксазин, содержащий в структуре как
free conditions and their biological activity // Med.
1,3-бензоксазиновый, так и бензильный фрагменты.
Chem. Res. 2010. N 20. P. 1147-1153.
[3]
Arslan M. Synthesis and characterization of novel
Благодарности
mussel-inspired benzoxazines by thiol-benzoxazine
Автор выражает благодарность и глубокую при-
chemistry // Turk. J. Chem. 2019. N 43. P. 1472-1485.
знательность заведующей отделом микробиологии
Республиканской санитарно-карантинной инспекции
[4]
Periyasamy Th., Asrafalia Sh. P., Muthusamy S.
Министерства здравохранения Ph. D. по биологиче-
New benzoxazines containing polyhedral oligomeric
silsesquioxane from eugenol, guaiacol and vanillin //
ским наукам Г. А. Гулиевой за оказанную помощь
New J. Chem. 2015. N 39. P. 1691-1702.
в исследовании антимикробных свойств синтези-
руемых соединений, а также старшему научному
[5]
Hao Z., Lv S., Song Sh., Li Y., Zhang H. Dynamic
сотруднику лаборатории электронной микроскопии
mechanical and thermal properties of copolymer from
Азербайджанского медицинского университета Ph. D.
o-allylphenol and 4,4-diaminodiphenyl methane-based
по медицине Ф. Г. Рзаеву за помощь в исследовании
benzoxazine and bisphenol-A type novolac epoxy resin
ультраструктуры клетки E. сoli методом электронной
// J. Therm. Anal. Calorim. 2015. N 119. P. 1439-1444.
микроскопии.
[6]
Burke W. J. 3,4-Dihydro-1,3,2H-benzoxazines. Reaction
of p-substituted phenols with N,N-dimethylolamines //
Финансирование работы
JACS. 1949. N 71. P. 609-612.
Работа выполнена при финансовой поддержке
Фонда развития науки при Президенте Азербай-
[7]
Burke W. J., Bishop J. L., Glennie E. L. M., Bauer W. N.
джанской Республики — Грант № EIF/MQM/Elm-
A new aminoalkylation reaction. Condensation of
Tehsil-1-2016-1(26)-71/01/3.
phenols with dihydro-1,3-aroxazines // J. Org. Chem.
1965. N 30. P. 3423-3427.
Конфликт интересов
[8]
Famuyide I. M., Fasina F. O., Eloff J. N., McGaw L. J.
Автор заявляет об отсутствии конфликта интере-
The ultrastructural damage caused by Eugenia
сов, требующего раскрытия в данной статье.
zeyheri and Syzygium legatii acetone leaf extracts on
pathogenic Escherichia coli // BMC Veter. Res. 2020.
N 16. P. 326.
Информация об авторах
[9]
Wang J., Ma M., Yang J., Chen L., Yu P., Wang J.,
Мехтиева Гюнай Мюзакир кызы, к.х.н., научный
Gong D., Deng Sh., WEN X., Zeng Z. In vitro
сотрудник научно-исследовательской лаборатории
antibacterial activity and mechanism of monocaprylin
«Химия алкенилфенолов» химического факультета
against Escherichia and Staphylococcus aureus. // J.
Бакинского государственного университета,
Food Protection. 2018. V. 12. N 81. P.1988-1996.