Журнал прикладной химии. 2022. Т. 95. Вып. 4
РАЗЛИЧНЫЕ ТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ
УДК 502.174
РЕГЕНЕРАЦИЯ АЗОТА И ФОСФОРА ПРИ ПЕРЕРАБОТКЕ ВОДНЫХ ОТХОДОВ
ПРОИЗВОДСТВА ПУТЕМ ОСАЖДЕНИЯ СТРУВИТА С ИСПОЛЬЗОВАНИЕМ
В КАЧЕСТВЕ РЕАГЕНТА АКТИВНОГО ПРОМЕЖУТОЧНОГО ПРОДУКТА
© Ю. В. Кузнецова, В. В. Вольхин, И. А. Пермякова*
Пермский национальный исследовательский политехнический университет,
614990, г. Пермь, Комсомольский пр., д. 29
Поступила в Редакцию 20 апреля 2022 г.
После доработки 9 июня 2022 г.
Принята к публикации 6 июля 2022 г.
Для повышения эффективности извлечения NH4+ и PO43- из водных отходов производства путем
осаждения струвита применен новый подход к осуществлению фазообразования, предусматривающий
проведение нуклеации на основе ионной ассоциации пренуклеационных кластеров до стадии образова-
ния новой поверхности раздела фаз жидкость-твердое тело. Реализацию этого пути фазообразова-
ния удалось осуществить за счет замены традиционных реагентов — солей Mg2+ и PO43-, используе-
мых при осаждении струвита, смесью Mg- и P-содержащих солей в строго ограниченном количестве
воды, что позволило получить промежуточный продукт в рентгеноаморфном состоянии и сохранить
его избыточную энергию по отношению к ионам в исходном растворе. В результате применения
промежуточного продукта для осаждения струвита удалось увеличить степень извлечения NH4+ и
PO43- из водных растворов до уровня 98-99% при молярном соотношении Mg2+:NH4+:PO43- на стадии
осаждения струвита, равном 1.1:1.0:1.0, т. е. близком к стехиометрическому соотношению фазообра-
зующих ионов в составе получаемого продукта, а также заменить при получении струвита соли реак-
тивной квалификации более доступными Mg- и P-содержащими источниками фазообразующих ионов.
Ключевые слова: нуклеация, пренуклеационные кластеры; фазообразование; промежуточная амор-
фная фаза; кристаллогидраты; метастабильность; струвит; фосфаты магния
DOI: 10.31857/S0044461822040156, EDN: DHZIYZ
Регенерация N и P из отходов промышленности
разнообразные методики. Наиболее привлекательной
и сельского хозяйства оказалась в фокусе внимания
признается существующая технология совместно-
в связи с необходимостью реализации концепции
го осаждения Mg2+, NH4+ и PO43- в форме струви-
устойчивого развития общества, основанной на эко-
та (MgNH4PO4·6H2O), продуктом которой является
номике замкнутого цикла. Осуществление рецикла
комплексное NPMg-удобрение пролонгированного
азота и фосфора позволяет не только уменьшить рас-
действия [2, 3]. Технология проста в реализации, вы-
ходование невозобновляемых минеральных ресур-
держивает повышенные нагрузки по перерабатывае-
сов, но и ослабить риск эвтрофикации природных
мым веществам, которые поступают в стоках, харак-
водоемов [1].
теризуется высокой скоростью процесса осаждения
Для решения проблемы регенерации N и P из во-
продукта, позволяет одновременно извлекать NH4+ и
дных отходов производства разрабатываются самые PO43- из стоков [4]. Комплексное NPMg-удобрение
531
532
Кузнецова Ю. В. и др.
пролонгированного действия обладает умеренной
Одновременное извлечение NH4+ и PO43- из сто-
растворимостью и не создает избыток питательных
ков при осаждении струвита также усугубляется раз-
веществ в почве, что существенно сокращает их поте-
личием в поведении NH4+ и PO43- при изменении pH
ри за счет вымывания, например, в ходе поливов, при
растворов. Так, при повышении pH происходят следу-
вегетации сельскохозяйственных культур [5].
ющие превращения ионов: NH4+ → NH3 и H2PO4- →
Несмотря на явные достоинства технологии осаж-
→ HPO42- → PO43- [16, 17]. При этом активность
дения струвита, ее продолжают совершенствовать с
понижается и создаются условия для улетучивания
учетом необходимости переработки водных отходов
NH3 из водной фазы, а αPO43-, наоборот, повышается,
производства, имеющих чрезвычайно разнообразный
что затрудняет проведение оптимизации условий
состав. Потенциальными источниками вторичного
осуществления процесса одновременного извлече-
сырья становятся водные отходы многих производств,
ния NH4+ и PO43- из стоков. Обычно рекомендуется
в том числе водные отходы индустрии удобрений [6-
осаждение струвита проводить при pH 9.0-9.5, что
8]. В типичных стоках содержание NH4+ колеблется
приводит к понижению степени насыщения струви-
от 146 до 311 мг·л-1, а содержание HPO42- варьирует-
та аммонием [16]. Однако для извлечения NH4+ из
ся в пределах 30-500 мг·л-1. Стоки с наиболее высо-
водной среды нет иного соединения, кроме струви-
ким содержанием NH4+ — это водные отходы произ-
та, приемлемого для применения в существующей
водства катализаторов [9, 10], мокрых скрубберов [11]
технологии [18], и поэтому необходимо искать пути
и производства фармацевтической продукции [12].
улучшения результатов насыщения струвита аммони-
Совместное присутствие в стоках NH4+ и PO43- харак-
ем при его осаждении.
терно для предприятий производства полупроводни-
Почти невозможно представить ситуацию, когда
ков [13], сельского хозяйства [14-16]. Таким обра-
Mg2+, NH4+ и PO43- присутствуют в стоке в соотно-
зом, в составе стоков содержание NH4+ и PO43- может
шении, соответствующем составу струвита. Обычно
варьироваться в любых соотношениях. Содержание
в традиционных стоках преобладает NH4+, поэтому
Mg2+ обычно оказывается на низком уровне, или он
Mg2+ и PO43- приходится дополнительно вводить
совсем отсутствует. В составе стоков могут быть
в сток при осаждении струвита. Решая эту задачу,
дополнительные катионные и анионные примеси,
выбирают наиболее доступные сырьевые источники
которые не всегда остаются индифферентными при
Mg и P, но при этом не всегда удается сохранить при-
осаждении струвита. Особо часто рассматривается
емлемые результаты по извлечению NH4+ и PO43-, со-
влияние на осаждение струвита F- и Ca2+ [13, 14].
ответствующие технологии осаждения струвита с ис-
Необходимо оценить, как состав перерабатывае-
пользованием солей реактивной квалификации [14].
мых стоков может отразиться на результатах осаж-
В последнее десятилетие существенно измени-
дения струвита. При осаждении струвита нужно
лись представления о процессе кристаллизации.
ориентироваться на стехиометрическое соотноше-
Установлено образование пренуклеационных кла-
ние входящих в его состав ионов Mg2+:NH4+:PO43-,
стеров [19] и выявлена их роль в осуществлении
равное 1:1:1. Казалось бы, просто ввести недостаю-
низкоэнергетического «неклассического» пути
щие ионы в состав стока, но это обычно не приво-
кристаллизации [20, 21]. Показано, что такой путь
дит к удовлетворительному результату по полноте
кристаллизации приводит к образованию жидкопо-
насыщения струвита NH4+ и PO43-. При образовании
добных аморфных фаз, обладающих избыточной сво-
струвита определяющую роль играет активность ио-
бодной энергией по сравнению с ионами в растворе.
нов: αMg2+, αPO43-, αNH4+. За счeт протекания реакций
Цель работы — повышение эффективности тех-
гидролиза и комплексообразования [16] значения αi
нологии осаждения струвита при извлечении NH4+
оказываются существенно ниже, чем аналитические
и PO43- из разных по составу водных отходов произ-
концентрации, причем в разной степени для каждого
водства за счет перевода процесса кристаллизации
из образующих струвит вида ионов. Поэтому в усло-
образующихся фаз на путь нуклеации пренуклеаци-
виях быстрого протекания реакции осаждения стру-
онных кластеров с использованием в качестве реаген-
вита нередко прибегают к использованию избытка
та для осаждения струвита активного промежуточ-
тех или иных реагентов. Например, при переработке
ного продукта в жидкоподобном рентгеноаморфном
стоков промышленности по производству удобрений
состоянии и разработка научных основ технологии
рекомендованы в качестве оптимальных молярные
осаждения струвита на основе использования актив-
отношения Mg2+:PO43- и PO43-:NH4+ 1.5-1.8 [6]. Но
ного промежуточного продукта в жидкоподобном
такой подход не вполне оправдан с экономической и
рентгеноаморфном состоянии с выявлением усло-
экологической точек зрения.
вий, позволяющих увеличить степень извлечения
Регенерация азота и фосфора при переработке водных отходов производства путем осаждения струвита...
533
NH4+ и PO43- из водных отходов и получить продукт,
жидкоподобного промежуточного продукта измере-
близкий по качеству к струвиту стехиометрического
ния проводили кратковременно и только однократно
состава, без использования избытка реагентов при
для каждой пробы, отобранной на определенной ста-
осаждении струвита и с применением более доступ-
дии получения образца промежуточного продукта.
ных реагентов — источников Mg и P.
Измерения проводили в трех повторностях, сред-
неквадратичное отклонение составляет 0.6 мПа·с.
Анализ состава жидких фаз проводили с исполь-
Экспериментальная часть
зованием спектрофотометра ЮНИКО 1201 (UNICO).
В качестве реагентов для синтеза соединений ис-
Определение остаточной концентрации NH4+ в жид-
пользовали NH4Cl (х.ч., ЗАО «Купавнареактив»),
кой фазе фильтрата проводили в соответствии с ре-
MgCl2·6H2O (ч., ЗАО «Вектон»), антигололедный
комендациями.* Светопоглощение раствора измеряли
реагент Аквайс (бишофит 98.41 мас% MgCl2·6Н2О,
при λ = 425 нм в кюветах с длиной поглощающего
ООО «ВВ-Строй Групп»), MgSO4·12H2O (х.ч., ЗАО
слоя 10 или 50 мм. Определение остаточной концен-
«Реахим»), Na3PO4·12H2O (ч.д.а., ООО «АГАТ-
трации PO43- в жидкой фазе фильтрата проводили в
МЕД»), NaH2PO4·12H2O (ч.д.а., ООО «АГАТ-МЕД»),
соответствии с рекомендациями.** Светопоглощение
Na2HPO4·12H2O (ч.д.а., ООО «АГАТ-МЕД»), ам-
раствора измеряли при λ = 690 нм в кюветах с длиной
миак водный 25% (ч.д.а., ЗАО «Вектон»), NaOH
поглощающего слоя 20 или 50 мм.
(ч.д.а., ПО «УфаХимПроект»), NH4Н2PO4 (ч.д.а.,
Экспериментально определена зависимость ак-
ЗАО «Вектон»), (NH4)2НPO4 (ч.д.а., ЗАО «Вектон»),
тивности образцов промежуточного продукта от мас-
H3PO4 (73%, техническая, марка Б, сорт 1, ООО
сового соотношения безводные соли:вода, 1:n, при
«Альмера Групп»), HCl 35% (х.ч., АО «База №1
варьировании n в интервале 3.4-14.0. Активность
Химреактивов»).
полученных образцов оценивали по результатам ис-
Анализ содержания NH4+ в твердых образцах и
пытания каждого из них при осаждении струвита и
фильтратах проводили с помощью метода капил-
определения при этом степени его насыщения NH4+,
лярного электрофореза с использованием системы
выраженной в процентах от максимального уровня,
Капель-205 (ООО «Люмэкс-маркетинг»). Навески твер-
соответствующего стехиометрическому содержанию
дых образцов предварительно растворяли в 0.1 М HCl.
NH4+ в струвите. Одновременно оценивали выход
Идентификацию фазового состава твердых об-
по массе струвита φ (%). Эксперименты проводили
разцов кристаллогидратов осуществляли с помощью
при 22 ± 0.5°C и молярном соотношении Mg:P в си-
рентгенофазового анализа (РФА), который выпол-
стеме, равном 1.1:1, и исходной концентрации в воде
няли на рентгеновском дифрактометре XRD-7000
[NH4+] = 270 мг·л-1.
(Shimadzu) с программным обеспечением XRD
Для определения зависимости активности проме-
6000/7000 Ver.5.21 и базой данных JCPDSPDFI.
жуточного продукта от молярного соотношения Mg:P
Рентгеновская трубка — Сu, скорость сканирования
в его составе были проведены следующие экспери-
0.5 град·мин-1. Полученные образцы промежуточного
менты: значения отношения Mg:P варьировали от
продукта сразу после приготовления поступали на
1 до 0.51. Все операции выполнены при 22 ± 0.5°С,
рентгенофазовый анализ, чтобы свести к минимуму
массовое соотношение безводные соли:вода в составе
влияние времени выдержки на возможные процессы
промежуточного продукта поддерживали на уровне
в их составе.
1:4. Содержание в водной фазе при осаждении стру-
Исследование кристаллогидратов проводили ме-
вита: NH4+ — 213 мг·л-1, РО43- — от 0 до 256 мг·л-1.
тодом ИК-спектроскопии с использованием Фурье-
В эксперименте по определению влияния соотно-
спектрометра Nicolet 380 (Thermo Scientific), образ-
шения Mg:P в системе на извлечение NH4+ и РО43-
цы таблетировали с KBr. Для навесок использовали
при осаждении струвита с помощью промежуточного
прецизионные весы Excellence Plus XP204S (Mettler
продукта молярное соотношение Mg:P варьировали
Toledo), погрешность 0.2 мг.
Динамическую вязкость получаемых в ходе иссле-
* ПНД Ф 14.1:2:3.1-95. Количественный химический
дования образцов промежуточного продукта измеря-
анализ вод. Методика измерений массовой концентрации
ли с использованием вибровискозиметра серии SV-
ионов аммония в природных и сточных водах фотометри-
ческим методом с реактивом Несслера.
10A (Analog & Digital). Условия измерения вязкости
** ПНД Ф 14.1:2.112-97. Выполнения измерений мас-
выбраны с учетом необходимости минимизировать
совой концентрации фосфат-ионов в пробах природных
влияние вибрационного поля прибора на вязкость
и очищенных сточных вод фотометрическим методом с
исследованного объекта. При исследовании вязкости
восстановлением аскорбиновой кислотой.
534
Кузнецова Ю. В. и др.
в пределах от 1:1 до 1.5:1. Массовое соотношение
как выделяющаяся энергия; ΔGS — энергия обра-
безводные соли:вода в составе использованного об-
зования новой поверхности раздела фаз в системе
разца промежуточного продукта соответствовало 1:n.
жидкость-твердое тело, т. е. энергия, затрачиваемая
Водная среда при осаждении струвита в исходном со-
на образование поверхности зародышей.
стоянии имела состав: [NH4+] = 213 мг·л-1 и [РО43-] =
Для зародышей сферической формы радиуса r
= 256 мг·л-1 при температуре 22 ± 0.5°С.
Для проверки возможности замены солей реак-
ΔG = - RTlnS + 4πr2σ,
(2)
тивной квалификации на более доступные сырьевые
источники Mg2+ и РО43- была проведена серия экспе-
риментов, в которой одни образцы промежуточного
где V — «молекулярный» объем, принятое значение
продукта приготовляли с использованием солей, а дру-
для расчетов энергии зародышеобразования типич-
гие — с применением иных источников Mg и P. Для
ных ионных соединений V = 3∙10-23 см3; S — коэф-
получения более общей зависимости расширены ин-
фициент пересыщения раствора; σ — межфазная
тервалы варьирования ряда факторов: молярного соот-
поверхностная энергия, связанная с зародышеобра-
ношения Mg:P в системе, доли воды в составе проме-
зованием (мДж·м2); r — радиус зародышей сфериче-
жуточного продукта n, исходной концентрации [NH4+]
ской формы (м), T — температура (K), R — универ-
(мг·л-1) в водном растворе при осаждении струвита.
сальная газовая постоянная.
В работе использовали программный продукт
Зависимость, выраженная уравнением (2), имеет
Visual MINTEQ Version 3.1,* который позволяет вы-
максимум, соответствующий энергии образования
числить значение индекса пересыщения раствора SIi
зародыша критического размера, который способен
по отношению к i-фазе, характеризующего движу-
к дальнейшему росту с образованием новой фа-
щую силу в процессе образования соответствующей
зы. Таким образом, согласно классической теории
фазы. С использованием этого программного продук-
кристаллизации зарождение новой фазы в пересы-
та вычислены значения SIi по отношению к фазам
щенном растворе обязательно связано с затратой
MgNH4PO4·6H2O (струвит, St), MgHPO4·3H2O (нью-
энергии.
бериит, Nt) и Mg3(PO4)2·xH2O (фосфат магния, МР) при
Иной подход к пониманию процесса кристал-
низких концентрациях Mg2+, NH4+ и PO43- в водно-со-
лизации основывается на представлении об энер-
левой системе и при исходном значении рН 9.0.
госберегающем пути зарождения образующейся
фазы. Согласно этому подходу процесс нуклеации
происходит на основе пренуклеационных класте-
Обсуждение результатов
ров, которые уже существуют в исходном растворе.
Достижение цели данной работы не удается осу-
Дестабилизация раствора приводит его к самопроиз-
ществить на основе классической теории кристал-
вольному и быстро протекающему спинодальному
лизации. Новые возможности для повышения эф-
распаду на разные фазы жидкость-жидкость, что
фективности технологии осаждения струвита при
происходит, по-видимому, при участии пренуклеаци-
извлечении NH4+ и PO43- из водных отходов произ-
онных кластеров. Эти кластеры сосредоточиваются
водства открываются в связи с развитием представле-
преимущественно в одной из жидких фаз, и при пере-
ний о роли пренуклеационных кластеров в процессе
ходе из исходного раствора в образующуюся жидкую
нуклеации, что приводит к альтернативной модели
фазу они освобождаются от своих гидратных оболо-
фазообразования, согласно которой не требуется за-
чек. На следующей стадии нуклеации в результате
трат энергии на образование межфазной поверхности
аккреции пренуклеационных кластеров происходит
в ходе нуклеации.
формирование более крупных ионно-ассоциирован-
Сущность классической теории зародышеобразо-
ных кластеров и могут образовываться структуры
вания при описании в краткой форме [22] сводится
фрактального типа. Все эти превращения происходят
к представлению о свободной энергии образования
без образования новой поверхности раздела фаз и по-
зародышей:
этому не требуют соответствующей затраты энергии.
Дальнейшее развитие процесса аккреции кластеров
ΔG = ΔGV - ΔGS,
(1)
приводит к образованию жидкоподобного аморфного
промежуточного продукта, сохраняющего избыточ-
где ΔGV — объемная энергия образования связей вну-
ную свободную энергию по отношению к ионам в
три формирующихся зародышей, которая проявляется
исходном растворе. Лишь на последующих стадиях
происходит образование твердых и кристаллических
Регенерация азота и фосфора при переработке водных отходов производства путем осаждения струвита...
535
полиморфов. Согласно [23] обобщенную информа-
счет интенсивного перемешивания и регулирования
цию о превращениях в процессе кристаллизации
температуры, минимально возможное время выпол-
можно представить на примере CaCO3 в форме сле-
нения всех операций, чтобы сохранить активность
дующей модифицированной схемы:
промежуточного продукта вплоть до момента его
использования при осаждении струвита. Оценку
Ca2+(р)/HCO3-(р)/CO32-(р) →
активности полученных образцов промежуточного
→ пренуклеационные кластеры →
продукта проводили на стадии осаждения струвита,
→ крупные ионные кластеры →
руководствуясь достигнутой при этом степенью на-
→ жидкоподобная аморфная фаза →
сыщения струвита ионами NH4+.
→ кристаллический полиморф CaCO3(кр).
Изначально при выборе условий получения проме-
жуточного продукта исходили из необходимости про-
С позиций «неклассической» теории нуклеации
верить — можно ли его получить в активном состоя-
рассматривается также образование фосфата кальция
нии, удовлетворяющем решению задачи повышения
[21].
эффективности извлечения NH4+ и PO43- из водной
Начальные стадии процесса, включая образование
фазы при осаждении струвита. Приготовление про-
ионных кластеров, протекают достаточно быстро.
межуточного продукта проводили при молярном со-
Например, при синтезе краутита [Mn(AsO3OH)∙H2O]
отношении Mg:P, равном 1:0.73. Использовали соли
смешение двух растворов реагентов немедленно при-
Na3PO4·12H2O (3.648 г) и Na2HPO4·12H2O (0.860 г),
водит к формированию густого геля [20], что соответ-
что составляет 0.012 моль PO43-. Для растворения
ствует стадии образования жидкоподобного аморф-
этой смеси солей при 22°C достаточно добавить
ного продукта. Гель характеризуется повышенной
11 мл H2O. При молярном соотношении Mg:P в целом
вязкостью, что может в той или иной мере замедлять
в составе системы, равном 1.1:1, для приготовления
переход систем к стадии зародышеобразования кри-
промежуточного продукта требуется использовать
сталлических фаз, так как в геле устраняется кон-
MgCl2·6H2O в количестве 3.350 г и для его растворе-
векция и замедляется процесс диффузии ионов и
ния — 5 мл воды. Если учесть массу безводных солей
молекул воды [24]. В то же время в среде геля легко
и суммарную массу кристаллизационной воды солей
образуются метастабильные фазы, характеризую-
и дополнительно использованной воды, то массовое
щиеся низким кинетическим барьером для процесса
соотношение безводные соли:вода в промежуточном
зародышеобразования [25].
продукте составило 1:4. Это соотношение можно
В соответствии с целью данной работы предус-
выразить как n = 4.
матривается перевести технологию осаждения стру-
По аналогичной методике приготовлены другие
вита на энергосберегающий путь вплоть до стадии
образцы промежуточного продукта. В составе боль-
формирования твердофазного продукта. Поскольку
шинства из них доля воды характеризуется величиной
традиционные по составу стоки имеют в своем соста-
n = 4, и молярное соотношение Mg:P устанавливается
ве преимущественно NH4+ и в меньшей доле PO43-,
равным 1:0.734.
недостающее для осаждения струвита количество
Образцы 1-3 находятся в аморфном состоянии
PO43- и в полном объеме Mg2+ необходимо вводить
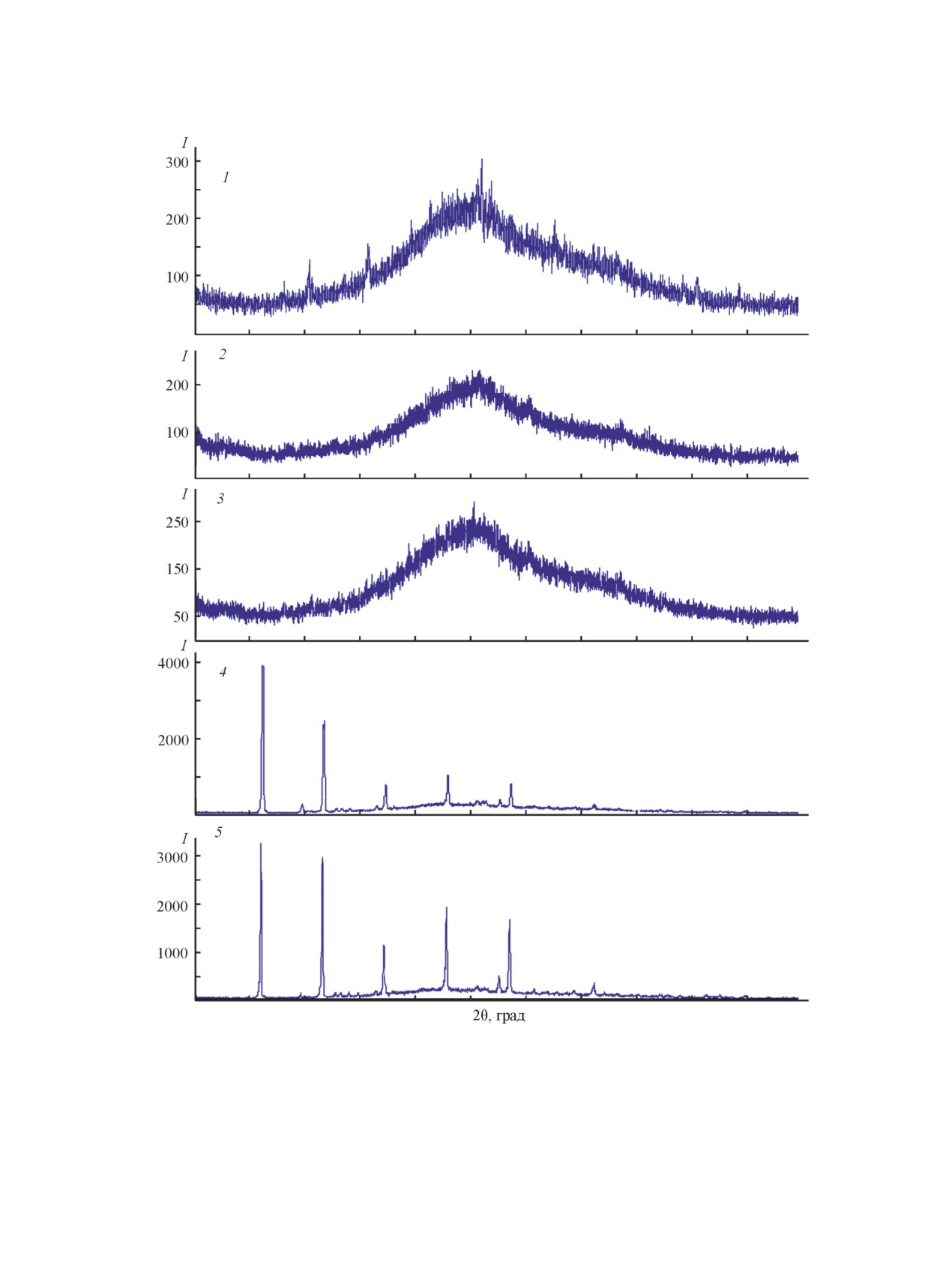
(рис. 1). Образец 1 (n = 4, T = 22 ± 0.5°C) содержит
в сток дополнительно. Мы предложили модифици-
небольшую примесь фазы MgNaPO4∙7H2O, которая
ровать смесь солей Mg2+ и PO43-, предназначенных
относится к соединениям типа струвита [26]. Все три
в качестве реагентов для приготовления струвита,
иона в кристаллической решетке MgNaPO4∙7H2O пол-
предварительно переработав их в жидкоподобную
ностью окружены молекулами воды, что свойственно
форму активного аморфного промежуточного про-
структуре струвита. Но ионы Na+ имеют слишком ма-
дукта, и в таком виде использовать для осаждения
лый размер по сравнению с ионами NH4+, что приво-
струвита в стоке. При разработке принципиальных
дит Na-аналог струвита к неустойчивости. При повы-
основ такого подхода оказалось полезным использо-
шении температуры до 70 ± 1°C (образец 2) аморфное
вать опыт, накопленный при исследовании синтеза
состояние промежуточного продукта сохраняется, но
аморфных фосфата и карбоната кальция в условиях
примесная фаза MgNaPO4∙7H2O исчезает. Выдержка
нуклеации на основе пренуклеационных кластеров
на воздухе в течение 12 ч (образец 3) также пони-
[21, 23]. Выбраны условия приготовления активного
жает интенсивность рефлексов примесной фазы, и
промежуточного продукта: высокие содержания Mg
это может свидетельствовать о том, что в образце
и P в смеси солей, ограниченное количество воды
промежуточного продукта происходят изменения во
в реакционной системе, ускоренное растворение за
времени. Совершенно иным образом протекает син-
536
Кузнецова Ю. В. и др.
Рис. 1. Рентгенограммы образцов промежуточных продуктов.
Условия приготовления образцов, включающие массовые соотношения безводные соли:вода, 1:n, и температуру T.
1 — n = 4, T = 22 ± 0.5°C; 2 — n = 4, T = 70 ± 1°C; 3 — n = 4, T = 22 ± 0.5°C, выдержка в течение 12 ч на воздухе;
4 — n = 14, T = 22 ± 0.5°C; 5 — n = 4, T = 22 ± 0.5°C, выдержка в течение 24 ч в воде.
В составе промежуточного продукта молярное соотношение Mg:P составило 1:0.734.
Регенерация азота и фосфора при переработке водных отходов производства путем осаждения струвита...
537
тез промежуточного продукта при n = 14 (образец 4).
на воздухе; 4 — n = 14, T = 22 ± 0.5°C; 5 — n = 4,
Доля воды в его составе оказывается достаточной для
T = 22 ± 0.5°C, выдержка в течение 24 ч в воде. Для
образования кристаллической фазы Mg3(PO4)2∙22H2O
этих образцов в соответствии с их нумерацией полу-
(каттиит) [27]. Каттиит не относится к соединениям
чены следующие результаты по степени насыщения
типа струвита, но в его структуре катионы и анионы
струвита ионами NH4+: 99.1, 98.4, 90.1, 90.8 и 81.3%.
полностью окружены молекулами воды, большая
Таким образом, подтверждается возможность по-
часть которых взаимодействует с Mg(H2O)62+ и PO43-
лучения промежуточного продукта в активной форме,
с образованием трехмерной сетки водородных связей.
но такой результат находится в существенной зависи-
Следовательно, для образования такой структуры
мости от количества воды в составе промежуточного
необходимо достаточное количество воды.
продукта.
Зависимость устойчивости промежуточного про-
В объеме образующегося аморфного гелеобразно-
дукта от наличия воды, находящейся с ним в кон-
го промежуточного продукта протекают процессы, ко-
такте, подтверждается следующим экспериментом.
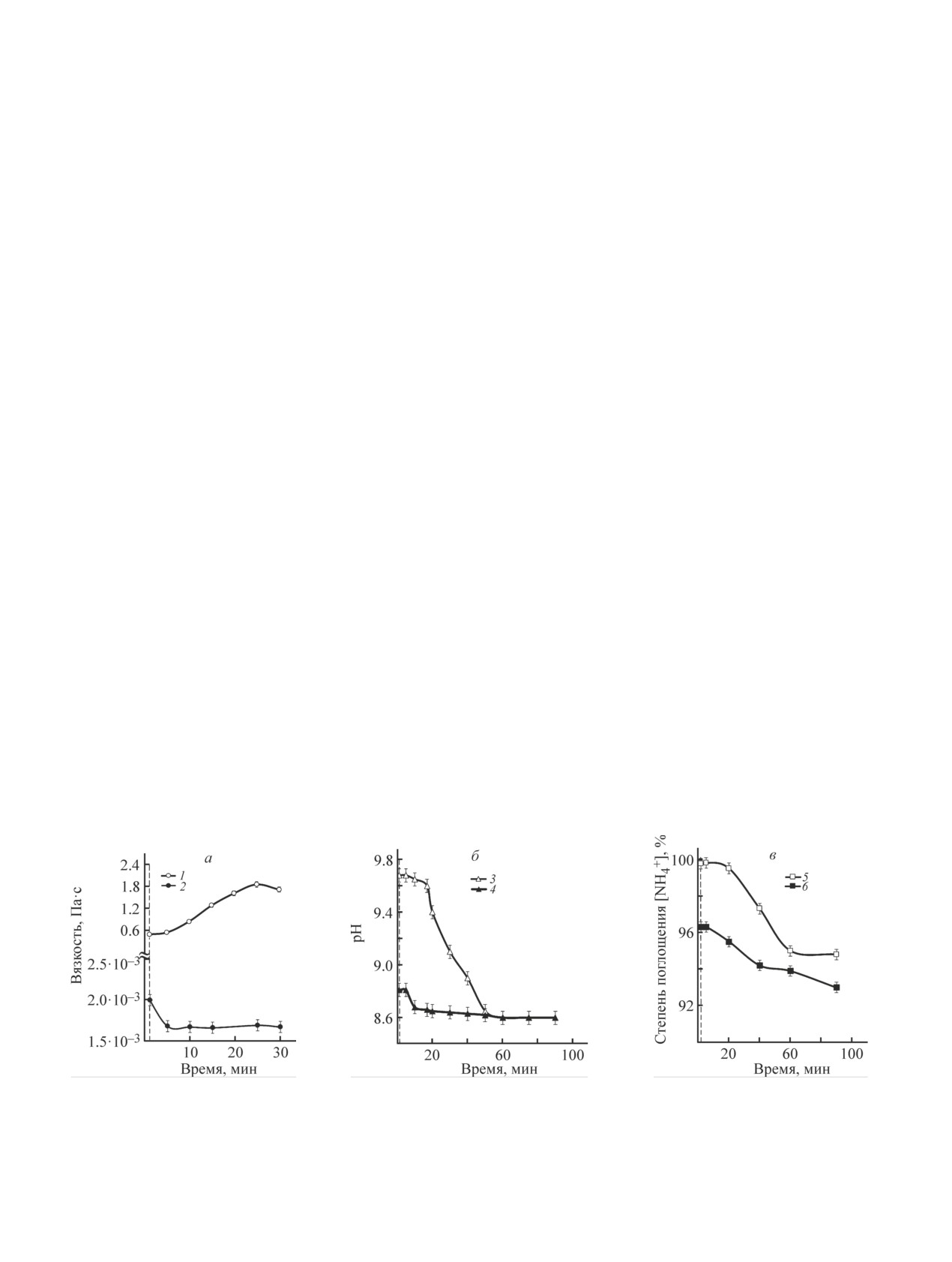
торые влияют на его вязкость. Определены значения
Образец 1 был помещен в водную среду при 22 ± 0.5°C
динамической вязкости μ (Па∙с) образцов промежу-
на 24 ч и за счет фазовой трансформации приобрел
точного продукта в зависимости от продолжительно-
структуру каттиита (образец 5). Такой результат сви-
сти их выдержки на воздухе при 22 ± 0.5°С (рис. 2, а).
детельствует о том, что в присутствии воды в системе
Абсолютные значения и характер изменения вяз-
возникает движущая сила для осуществления фазо-
кости в зависимости от времени после приготовления
образования кристаллогидрата, чему способствует
промежуточного продукта оказались совершенно
также избыток свободной энергии активного про-
различными для образцов, полученных при n = 4 и
межуточного продукта. В свою очередь активность
n = 14. Для образцов первой группы (n = 4) в течение
полученных образцов промежуточного продукта кор-
времени от 2 до 30 мин вязкость возрастает начиная
релирует со степенью насыщения струвита NH4+.
с 0.4 Па∙с, проходит через максимум при 1.9 Па∙с и
Результаты насыщения струвита NH4+ зависят от
далее снижается. Образцы второй группы (n = 14)
условий приготовления образцов промежуточного
показывают некоторое снижение вязкости в началь-
продукта, использованных в процессе осаждения,
ный период времени после приготовления, но затем
что подтверждается экспериментальными данными.
их вязкость остается почти на постоянном уровне
В ходе эксперимента все образцы промежуточного
16∙10-4 Па∙с, что примерно в 2 раза выше вязкости во-
продукта приготовлены с одинаковым в их соста-
ды (8.94∙10-4 Па∙с при 25°С). Такой результат можно
ве молярным соотношением Mg:P, равным 1:0.734.
объяснить образованием суспензии тонкодисперсного
Другие условия приготовления, включая массовую
кристаллического вещества в среде водного раствора.
долю воды n и температуру Т, варьируются для образ-
Судя по характеру влияния вибрационного поля
цов: 1 — n = 4, T = 22 ± 0.5°C; 2 — n = 4, T = 70 ± 1°C;
вискозиметра на значение вязкости промежуточного
3 — n = 4, T = 22 ± 0.5°C, выдержка в течение 12 ч
продукта, полученного при n = 4, он является гелем,
Рис. 2. Зависимость вязкости (а), значений рН (б) и активности (в) образцов промежуточного продукта от времени
с начала приготовления образцов.
Условия приготовления образцов: молярное соотношение Mg:P, равное 1:0.734, температура 22 ± 0.5°С; массовое соот-
ношение безводные соли:вода в составе промежуточного продукта 1:4 (светлые точки) и 1:14 (темные точки).
Вертикальная штриховая линия отмечает окончание по времени стадии смешения солей и воды (около 2 мин).
538
Кузнецова Ю. В. и др.
который имеет супрамолекулярную структуру, т. е.
при n = 4 и при n = 14 в отношении извлечения NH4+
иерархическое строение: более прочную структуру
из водной фазы при осаждении струвита, которые
первого уровня и менее прочную второго уровня, ко-
имеют склонность к снижению при выдержке про-
торая обладает способностью к самовосстановлению
дуктов после приготовления (рис. 2, в). Но у образца
после нарушения [28]. Так, в ходе измерения вязкости
промежуточного продукта, полученного при n = 4,
промежуточного продукта (n = 4) без отключения
активность сохраняется на уровне 99.0-99.9% в те-
прибора получено значение μ = 0.1950 Па∙с. Далее
чение 15 мин после приготовления. Образец проме-
прибор выключили на 5 мин, и при повторном замере
жуточного продукта (n = 14) показал более низкие
вязкость возросла до 0.2720 Па∙с. После перемеши-
значения активности — в интервале 96.2-95.7% в
вания геля в течение 30 с вязкость его понизилась до
период 15 мин после приготовления, которая про-
0.0404 Па∙с, но после отключения прибора на 6 мин
должает снижаться до 93.0%, что не происходит у
вязкость геля вновь возросла в 2 раза.
образца промежуточного продукта при n = 4.
Характер изменения рН образцов промежуточного
На основе обобщения экспериментальных данных
продукта, приготовленных при n = 4 и при n = 14 (рис.
по вязкости и активности полученных образцов и
2, б), неодинаков: в начале замеров у первого образца
их зависимости от времени выдержки после приго-
(n = 4) рН равен 9.7 и остается примерно на этом же
товления можно сформулировать рекомендации по
уровне в течение 15 мин, затем начинает снижаться.
приготовлению активного промежуточного продук-
У второго образца (n = 14) в течение 15 мин рН в
та. Выбор из двух сравниваемых образцов проме-
начале периода немного снижается — от 8.7 до 8.6 и
жуточного продукта, безусловно, остается за тем,
далее остается без изменения. В конце 50-минутного
который приготовлен при n = 4. Вместе с тем долю
периода после приготовления промежуточного про-
воды в составе промежуточного продукта, приготов-
дукта значения рН образцов сходятся в одной точке
ленного при n = 4, целесообразно принять в качестве
(рН 8.6). Этот результат можно интерпретировать как
минимальной рекомендованной для практического
протекание процесса, сопровождающегося высвобо-
использования. Продолжительность операции смеше-
ждением ионов H+ из образцов промежуточного про-
ния солей и добавочной воды составляет 2 мин при
дукта, приготовленных при n = 4, в период времени
интенсивном перемешивании (скорость вращения
от 18 до 50 мин и очень слабое проявление такового
мешалки около 600 об·мин-1). Последующий интер-
для образца, приготовленного при n = 14.
вал времени до применения промежуточного про-
Зависимость значения рН от времени, выявленная
дукта в качестве реагента при осаждении струвита
у промежуточного продукта (n = 4), оказалась анало-
желательно ограничить 10 мин. Перед применением
гичной той, которая установлена для аморфной фазы,
допустима репульпация промежуточного продукта
образующейся в ходе процесса синтеза фосфата каль-
в двукратном по массе количестве воды, что под-
ция [21]. В течение первых 15 мин после смешивания
тверждается опытом приготовления и использования
реагентов при синтезе фосфата кальция рН остается
активного промежуточного продукта.
почти постоянным, и эта стадия интерпретируется
С помощью последующих экспериментов уточне-
как полимерная сборка ионов и сопровождается об-
ны допустимые интервалы ряда параметров, влияю-
разованием ионных ассоциатов общего состава: ≥86%
щих на активность промежуточного продукта.
Ca(HPO4)34-/Ca(HPO4)2(H2PO4)46- и ≥14% CaHPO4/
Результаты эксперимента подтверждают, что до-
CaH2PO4+. Далее идет стадия, занимающая во вре-
пустимый предел содержания воды в промежуточном
мени около 50 мин, в ходе которой продукт ассоци-
продукте соответствует массовому соотношению без-
ации ионов обогащается Ca2+ и приобретает состав
водные соли:вода при n = 8, а пограничным является
Ca2(HPO4)32- и сферическую структуру. Процесс из-
соотношение при n = 9 (рис. 3). Максимальной актив-
менения состава ассоциатов ионов сопровождается
ностью обладает образец, приготовленный при n = 4,
высвобождением ионов H+, что приводит к пони-
с его помощью достигается почти полное извлечение
жению pH. Для системы, включающей ионы Mg2+ и
NH4+ из водной фазы, и этот образец использовался
PO43-, состав ассоциатов ионов может отличаться от
как базовый в ряде других экспериментов.
аморфного фосфата кальция, но по природе и про-
Реализуемые значения молярного соотношения
должительности прохождения двух рассмотренных
Mg:P в составе промежуточного продукта варьиру-
стадий аналогия в процессе ассоциации ионов Mg2+-
ются при переработке наиболее типичных по составу
H+-PO43- и Ca2+-H+-PO43- достаточна очевидна.
водных отходов производства, по крайней мере от 1:1
Важным показателем являются значения активно-
до 1:0.51, что соответствует разному молярному соот-
сти полученных образцов промежуточного продукта
ношению в стоках N:P. Так, если сток содержит толь-
Регенерация азота и фосфора при переработке водных отходов производства путем осаждения струвита...
539
Рис. 4. Зависимость активности промежуточного про-
дукта от молярного соотношения Mg:P в его составе.
Условия эксперимента: температура 22 ± 0.5°С, массо-
Рис. 3. Зависимость активности промежуточного про-
вое соотношение безводные соли:вода 1:4, концентрации
дукта от массового соотношения в его составе безвод-
ионов в водной среде при осаждении струвита: [NH4+] =
ные соли:вода, 1:n.
= 213 мг·л-1 и [РО43-] = 256 мг·л-1.
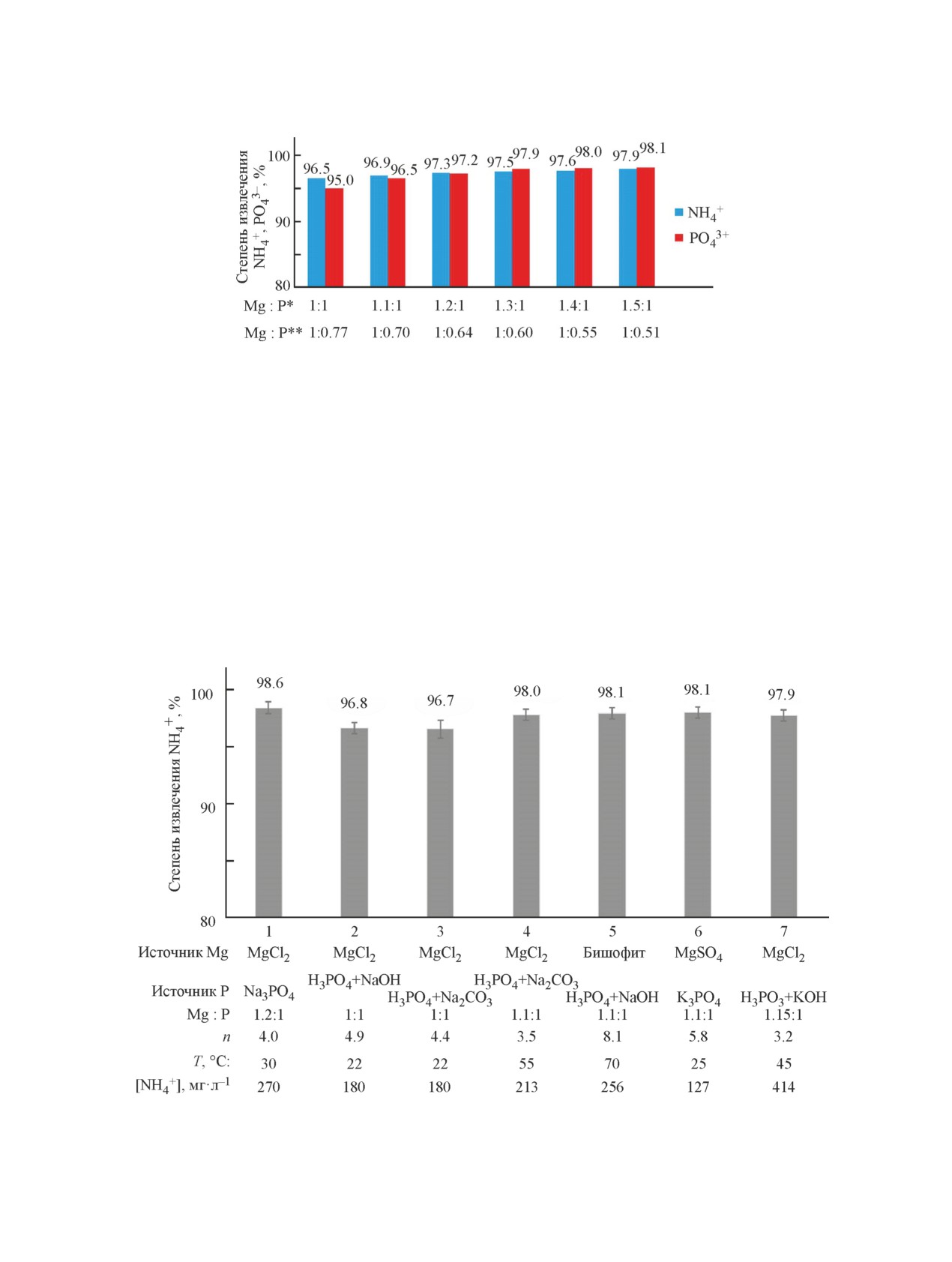
Условия эксперимента: температура 22 ±0.5°C, молярное
Действительно, повышение значений молярного
соотношение Mg:P в системе 1.1:1, концентрации ионов в
водной среде при осаждении струвита: [NH4+] = 270 мг·л-1
соотношения Mg:P в системе, отражающее избыток
и [РО43-] = 256 мг·л-1.
Mg2+ по отношению к РО43- при осаждении стру-
φ - выход по массе струвита (%).
вита, способствует повышению степени извлечения
Mg2+ и РО43- из раствора, причем в большей мере для
РО43-. Так, при Mg:P в системе, равном 1:1, степень
ко NH4+, а РО43- отсутствует, то РО43-, необходимый
извлечения РО43- из раствора составляет лишь 95.0%,
для осаждения струвита, полностью должен быть
эта величина возрастает до 96.5% при Mg:P, равном
представлен в составе промежуточного продукта, при
1.1:1, и до 97.2% при Mg:P, равном 1.2:1. Степень
этом молярное соотношение Mg:P в его составе равно
извлечения NH4+ при изменении Mg:P в этой же по-
1:1, но если фосфат присутствует в стоке и содержа-
следовательности возрастает в ряду 96.5-96.9-97.3%.
ние РО43- достигает 1/2 по отношению к NH4+, что
Таким образом, при одновременном извлечении NH4+
встречается в редких по составу водных отходах, то
и РО43- из стоков с помощью технологии осаждения
при приготовлении промежуточного продукта следу-
струвита с применением промежуточного продукта в
ет ориентироваться на молярное соотношение Mg:P,
качестве реагента можно рекомендовать молярное со-
равное 1:0.51. В приведенном эксперименте образцы
отношение Mg:P в системе устанавливать на уровне
промежуточного продукта приготовлены при варьи-
(1.1-1.2):1. Дальнейшее увеличение избытка исполь-
ровании молярного соотношения Mg:P в интервале
зуемого магния вряд ли оправдано по экономическим
от 1:1 до 1:0.51 (рис. 4).
соображениям.
Несмотря на варьирование молярного соотноше-
Активность промежуточного продукта сохраняет-
ния Mg:P в составе промежуточного продукта в пре-
ся, если температуру при его приготовлении в тече-
делах от 1:1 до 1:0.51, его активность по извлечению
ние 10 мин повысить с 22 до 70°С.
NH4+ при осаждении струвита остается в пределах
Для улучшения экономических показателей тех-
96.9-97.9%, т. е. сохраняется на высоком уровне.
нологии осаждения струвита реагенты реактивной
Можно сделать также вывод, что в промежуточном
квалификации стремятся заменить более доступными
продукте на этой стадии фазообразования не прояв-
сырьевыми источниками P и Mg. В данной работе в
ляется тенденция к соблюдению стехиометрических
качестве источника PO43- испытана H3PO4 техниче-
соотношений между Mg2+ и РО43-, что характерно
ской квалификации, нейтрализованная Na2CO3 или
для образования кристаллических фаз.
NaOH/KOH, и источника Mg2+ — бишофит в форме,
При одновременном извлечении NH4+ и РО43- из
предназначенной для использования в химической
водных отходов производства удобрений с использо-
промышленности. Основным компонентом бишофита
ванием традиционного варианта технологии, осно-
является MgCl2·6H2O (рис. 6).
ванной на осаждении струвита [6], установлено, что
Использование всех включенных в эксперимент
молярное соотношение Mg:P в системе (изменение
сырьевых источников Mg2+- и PO43--содержащего
от 1 до 1.5) значительно влияет на эффективность
сырья при приготовлении промежуточного продукта
извлечения Р по сравнению с относительно меньшим
не привело к снижению результатов по извлечению
влиянием на извлечение NH4+ (рис. 5).
NH4+ из водной фазы при осаждении струвита, значе-
540
Кузнецова Ю. В. и др.
Рис. 5. Зависимость активности промежуточного продукта от молярного соотношения Mg:P в системе и в составе
промежуточного продукта.
Условия эксперимента: температура 22 ± 0.5°С, массовое соотношение безводные соли:вода 1:4, концентрации ионов в
водной среде при осаждении струвита: [NH4+] = = 213 мг·л-1 и [РО43-] = 256 мг·л-1.
Mg:P* — молярное соотношение Mg и P в системе, Mg:P** — молярное соотношение Mg и P в составе промежуточного
продукта.
ния степени извлечения NH4+ не выходят за пределы
ных образцов. В то же время результаты выполнен-
интервала 96.7-99.9%. Вполне приемлемыми явля-
ных экспериментов показали более низкие значения
ются варианты нейтрализации H3PO4 технической
активности полученных образцов (в пределах от 96.7
квалификации Na2CO3 и щелочами (NaOH и KOH) и
до 97.9%) при использовании Mg:P на уровне 1:1, но
замена реактивной соли MgCl2 бишофитом.
активность образцов оказалась выше (в пределах от
Варьирование температуры от 22 до 70 ± 0.5°С
98.0 до 98.6%) при Mg:P, равных 1.1:1 и 1.2:1, что
при приготовлении промежуточного продукта не ока-
подтверждает вышеприведенные рекомендации по
зало существенного влияния на активность получен-
условиям приготовления промежуточного продукта.
Рис. 6. Зависимость активности промежуточного продукта от видов сырьевых источников магния и фосфата, ис-
пользованных при его приготовлении.
Обозначения: массовое соотношение безводные соли:вода 1:n, [NH4+] — концентрация ионов аммония в водной среде
при осаждении струвита, Mg:P — молярное соотношение Mg и P в системе, Т — температура.
Регенерация азота и фосфора при переработке водных отходов производства путем осаждения струвита...
541
трации по Mg2+, NH4+ и PO43-, соответствующие
равновесной растворимости струвита, несмотря на
выдержку осадка в маточнике в течение 10 дней.
Такой результат можно объяснить тем, что движущая
сила процесса кристаллизации понижается по мере
уменьшения концентрации в растворе фазообразую-
щих ионов в ходе формирования фазы струвита, при
этом соответственно снижается пересыщение по от-
ношению к струвиту. Так, при концентрациях ионов
Mg2+, NH4+ и PO43-, равных соответственно 4.4∙10-3,
4.0∙10-3 и 4.0∙10-3 моль·л-1, расчетные значения SIi по
Рис. 7. Зависимость активности промежуточного про-
отношению к основным фазам остаются достаточно
+ в водной фазе.
дукта от исходной концентрации NH4
высокими: SISt = 1.672, SIMP = 2.598 и SINt = 0.212.
Условия эксперимента: молярное соотношение Mg:P в
Последовательно понижая вводимые в программу
системе 1:1, температура 22 ± 0.5°С, исходные значения
для расчета концентрации Mg2+ в моделях водных
рН раствора при осаждении струвита 9.00-9.20, массовое
фаз с целью имитации прохождения фазообразова-
соотношение безводные соли:вода 1:n.
ния, удается найти область низких положительных
значений SISt, например, SISt = 0.2, при котором еще
Одной из задач данной работы является достиже-
сохраняется термодинамическая вероятность обра-
ние высокой степени извлечения NH4+ из водных сред
зования фазы струвита, но движущая сила процесса
путем осаждения струвита при варьировании в широ-
кристаллизации становится весьма низкой. Расчеты
ких пределах исходных концентраций NH4+ в стоках
показывают, что этим условиям соответствуют зна-
без применения при осаждении избытка Mg2+ и (или)
чения концентраций Mg2+, NH4+ и PO43- в жидкой
PO43- в качестве реагентов. Необходимо было под-
фазе, равные 9∙10-4, 1.0∙10-3 и 8∙10-4 моль·л-1, или
твердить возможность решения этой задачи за счет
22, 17 и 79 мг·л-1.
использования активной формы промежуточного про-
Уместно обратить внимание на ожидаемое рас-
дукта в качестве реагента. В эксперименте, посвящен-
хождение расчетных и экспериментальных данных
ном решению этой задачи, величину [NH4+] варьиро-
по содержанию ионов Mg2+, NH4+ и PO43- в жидкой
вали от 180 до 2320 мг·л-1, молярное соотношение
фазе, и это объясняется не только возможностью тор-
Mg:P в системе устанавливали на уровне 1:1, значения
можения процесса из-за очень низкой движущей си-
n для разных образцов промежуточного продукта вы-
лы, например при SISt = 0.20, но и по причине осаж-
бирали в допустимых пределах от 4.4 до 9.0 (рис. 7).
дения струвита — соединения с очень выраженной
Несмотря на изменение исходных значений [NH4+]
метастабильностью, выделение которого из жидкой
в растворах в серии экспериментов более чем на по-
фазы не привет к установлению истинного равно-
рядок, применение промежуточного продукта при
весия между твердой фазой и маточным раствором.
осаждении NH4+ в форме струвита позволило выйти
Вместе с тем ожидается также повышение глубины
на уровень значений степени извлечения NH4+ 96.90-
выделения NH4+ и PO43- из водных фаз при осажде-
98.60%. Лишь при исходной концентрации в растворе
нии струвита с использованием в качестве реагента
[NH4+] = 180 мг·л-1 степень извлечения NH4+ понизи-
активной формы промежуточного продукта. Поэтому
лась до 95.6%. При использовании традиционного ме-
при решении задачи по повышению глубины очистки
тода осаждения струвита степень извлечения NH4+ из
водных сред от NH4+ и PO43- особое внимание уделе-
водной фазы в близких условиях не превышает 65%
но эксперименту.
[12]. Удаление NH4+ из стока при традиционном мето-
При проведении эксперимента предусматрива-
де осаждения струвита удалось увеличить до 99%, но
лось сравнение степени извлечения NH4+ из водной
при молярном соотношении Mg2+:NH4+:PO43- в жид-
среды при осаждении струвита в близких услови-
кой фазе при осаждении струвита, равном 1.8:1.0:1.4,
ях (исходный состав растворов, рН), но с использо-
т. е. при большом избытке Mg2+ и PO43- как реа-
ванием реагентов при осаждении струвита в двух
гентов для осаждения струвита [29]. При молярном
разных вариантах: соли MgCl2 и Na3PO4·12H2O +
соотношении Mg2+:NH4+:PO43-, равном 1.0:1.0:1.0,
+ Na2HPO4·12H2O и такие же соли и в тех же количе-
извлечение NH4+ составило лишь 77.80% [30].
ствах, но переработанные в форму промежуточного
В исследовании [31] показано, что при осажде-
продукта (см. таблицу). Индивидуальные условия:
нии струвита не достигаются остаточные концен-
осаждение струвита при молярном соотношении
542
Кузнецова Ю. В. и др.
Сравнение двух вариантов извлечения NH4+ из водной фазы при осаждении струвита с различием в форме
используемых реагентов: соли (MgCl2 и Na2HPO4) и промежуточный продукт (ПрП), приготовленный
при молярном соотношении Mg:P в системе 1.1:1
Массовое соотношение безводные соли:вода 1:4, температура 22 ± 0.5°С, исходная концентрация ионов аммония
в водной фазе — 270 мг·л-1
Продолжительность
рН водной фазы
Остаточная
Степень извлече-
Выход струвита
осаждения
до/после осаждения
концентрация,
ния NH4+, %
по массе, %
Продолжительность
струвита, мин
струвита
NH4+, мг·л-1
индукционного
при использовании в качестве реагентов
периода,* мин
солей
ПрП
солей
ПрП
солей
ПрП
солей
ПрП
солей
ПрП
90
10
8.10/8.04
8.11/8.01
22.0
81.0
70.0
17.1
79.43
80.00
25
90
7
8.73/8.66
8.72/8.61
60.0
98.1
36.0
1.7
99.70
99.80
3.5
90
7
9.26/9.20
9.28/9.18
63.0
98.7
33.3
1.2
99.43
99.60
Не обнаружено
* Проявляется только при использовании солей.
Mg2+:NH4+:PO43-, равном 1:1:1, исходные рН водной
ции в воде: [NH4+] = 213 мг·л-1, [PO43-] = 256 мг·л-1,
фазы 8.10-8.11, 8.72-8.73 и 9.26-9.28, температура
рН 9.5, температура 22 ± 0.5°С. Молярное соотноше-
22 ± 0.5°С. Особые условия приготовления промежу-
ние Mg:N:P, равное 1.2:1:1, соответствовало исходной
точного продукта: молярное соотношение Mg:P равно
концентрации NH4+ в растворе на каждой стадии.
1:0.73, доля воды в составе соответствует n = 5.4,
Условия приготовления промежуточного продукта
температура 22 ± 0.5°С.
были такими же, как в одностадийном процессе.
При исходных значениях рН растворов 8.72-8.73
Полученные результаты: на первой стадии процесса
и 9.26-9.28 получены наиболее высокие значения
осаждения концентрация NH4+ понизилась с 213 до
степени извлечения NH4+ из водной фазы: 60.0-63.0%
14 мг·л-1, на второй — произошло дальнейшее пони-
в варианте с использованием в качестве реагентов
жение концентрации NH4+ до 0.5 ± 0.2 мг·л-1. Таким
при осаждении струвита солей Mg и P и 98.1-98.7%
образом, эксперимент подтверждает возможность об-
в варианте при осаждении с помощью промежуточ-
разцов активного промежуточного продукта направ-
ного продукта. Однако при рН 8.10-8.11 для обоих
лять процесс формирования метастабильного стру-
вариантов отмечено существенное снижение степе-
вита при осаждении по энергосберегающему пути.
ни излечения NH4+, соответственно до 22.0 (соли) и
81.0% (промежуточный продукт). При значениях рН
Выводы
на уровне 8.26/8.66 и 9.26/9.20 (до/после осаждения
струвита) в варианте с использованием для осажде-
Определены условия приготовления активного
ния традиционных солей остаточные концентрации
промежуточного продукта как реагента при осажде-
NH4+ в водной фазе составляют 33.3-36.0 мг·л-1, что
нии струвита путем смешения Mg- и P-содержащих
выше, чем соответствующее оценочное расчетное
солей и ограниченного количества воды и показано,
значение (17 мг·л-1). При использовании для осажде-
что при соблюдении таких условий удается в ходе
ния струвита промежуточного продукта в аналогич-
фазообразования осуществить процесс нуклеации на
ных условиях по рН остаточная концентрация NH4+
основе ионной ассоциации пренуклеационных класте-
в водной фазе составила 1.2-1.7 мг·л-1, что можно
ров без образования в системе Mg2+-PO43--H2O по-
объяснить его особой активностью как реагента при
верхности раздела фаз жидкость-твердое тело, о чем
осаждении струвита.
свидетельствует формирование продукта нуклеации,
Дополнительно был проведен двухступенчатый
характеризующегося рентгеноаморфным состоянием
эксперимент, в котором провели обычное осаждение
и обладающего свойствами супрамолекулярного геля.
струвита с помощью солей Mg и P (первая ступень)
Показано, что в целом условия получения актив-
и далее ввели в водную фазу промежуточный про-
ного промежуточного продукта включают:
дукт в количестве, эквимолярном по отношению к
— выбор массового отношения безводные соли:
NH4+, оставшемуся в водной фазе (вторая ступень),
:вода в интервале 4-9;
и вновь определили остаточную концентрацию NH4+
— установление молярного соотношения Mg:Р в
в растворе в условиях эксперимента. При осаждении
исходном растворе при осаждении струвита, вклю-
струвита соблюдались условия: исходные концентра-
чая содержание ионов PO43-, уже присутствующих
Регенерация азота и фосфора при переработке водных отходов производства путем осаждения струвита...
543
в растворе помимо представленных в составе проме-
Serralta J., Ferrer J., Seco A. New frontiers from
жуточного продукта, на уровне 1.1:1;
removal to recycling of nitrogen and phosphorus
— выполнение операции смешения солей и во-
from wastewater in the Circular Economy // Biores.
Technol. 2020. ID 122673.
ды в течение около 2 мин при интенсивном пере-
мешивании (скорость вращения мешалки около
[2]
Siciliano A., Limonti C., Curcio G.M., Molinari R.
600 об·мин-1), ограничение периода времени до ис-
Advances in struvite precipitation technologies for
пользования промежуточного продукта при осажде-
nutrients removal and recovery from aqueous waste
нии струвита продолжительностью 10 мин;
and wastewater // Sustainability. 2020. V. 12. N 18.
— проведение репульпации промежуточного про-
дукта в двукратном количестве воды (перемешивание
[3]
Lorick D., Macura B., Ahlström M., Grimvall A.,
в течение 30 с) перед его использованием;
Harder R. Efectiveness of struvite precipitation and
— применение при приготовлении промежуточно-
ammonia stripping for recovery of phosphorus and
го продукта температуры 20 ± 1°С, но возможность
nitrogen from anaerobic digestate: A systematic review
ее повышения вплоть до 70°С с учетом специальных
// Environ. Evid. 2020. V. 9:27.
технологических требований.
[4]
Perera M. K., Englehardt J. D., Dvorak A. C.
Подтверждена возможность замены реактивных
Technologies for recovering nutrients from
солей Mg и Р при получении промежуточного про-
wastewater: A critical review // Environ. Eng. Sci.
дукта соответственно бишофитом (MgCl2·6Н2О) тех-
нической квалификации и продуктами нейтрализации
[5]
Talboys P. J., Heppell J., Roose T., Healey J. R.
Н3РО4, используемой для производства удобрений,
Jones D. L., A Withers P. J. Struvite: A slow-release
Na2CO3 или щелочами NaOH/KOH.
fertiliser for sustainable phosphorus management? //
При использовании активного промежуточного
Plant Soil. 2016. V. 401. P. 109-123.
продукта в качестве реагента для осаждения струвита
удалось повысить степень извлечения NH4+ и PO43-
[6]
Son D. J., Kim W. Y., Jung B. R., Hong K. H. Removal
из водных растворов до уровня 95.6-99.9% для NH4+
of nitrogen and phosphate from fertilizer industry
и 95.0-98.1% для PO43-, не прибегая к применению
wastewater by magnesium ammonium phosphate
избытка реагентов.
formation and electrochemical treatment // Int. J.
Electrochem. Sci. 2019. V. 14. P. 3153-3167.
Финансирование работы
[7]
Phu D. H., Ngoc L. T., Tu L. N. Q., Hieu D. T. M.,
Long N. Q., Le M. V. Simultaneous recovery of phosphorus
Исследование выполнено при финансовой под-
and nitrogen from inorganic fertilizer wastewater
держке Российского фонда фундаментальных иссле-
// J. Appl. Sci. Eng. 2021. V. 25. N 2. P. 673-684.
дований в рамках научного проекта № 20-33-90100.
[8]
Ширинова Д. Б. Очистка слабоминерализованных
сточных вод в производстве фосфорных удобрений
Конфликт интересов
// Евраз. науч. журн. 2016. № 2.
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
[9]
Пат. RU 2716048 C1 (опубл. 05.03.2020). Способ
переработки отходов солевых растворов, содер-
жащих смесь сульфатов и нитратов аммония и
Информация об авторах
натрия.
Кузнецова Юлия Вячеславовна
[10]
Kuznetsova Yu. V., Volkhin V. V., Poylov V. Z.,
Permyakova I. A. Nitrogen and phosphorus recycling
in complex processing of highly concentrated salt
Вольхин Владимир Васильевич, д.х.н.
solutions, by precipitation of ammonium and
phosphate ions in the form of struvite // The XII
Пермякова Ирина Александровна, к.т.н.
Int. conf. on chemistry for young scientists. Saint
Petersburg, 6-10 september 2021. Book of abstracts.
[11]
Huang A. H., Liu J. C. Removal of ammonium as
Список литературы
struvite from wet scrubber wastewater // Water Air and
[1] Robles A., Aguado D., Barat R., Borrás., Bouzas A.,
Soil Poll. 2014. V. 225. N 8. ID 2062.
Giménez J.B., Martí N., Ribes J., Ruano M.V.,
544
Кузнецова Ю. В. и др.
[12]
Li Z., Ren X., Zuo J., Liu Y., Duan E., Yang J., Chen P.,
ловиях возможности образования конкурирующих
Wang Y. Struvite precipitation for ammonia nitrogen
фаз кристаллогидратов фосфатов магния разного
removal in 7-aminocephalosporanic acid wastewater
состава // ЖПХ. 2021. Т. 94. № 10-11. С. 1283-
// Molecules. 2012. V. 17. N 2. P. 2126-2139.
[Kuznetsova Yu. V., Volʹkhin V. V., Permyakova I. A.
[13]
Warmadewanthi, Liu J. C. Recovery of phosphate and
Synthesis of struvite in aqueous-salt systems in which
ammonium as struvite from semiconductor wastewater
competing phases of magnesium phosphate crystal
// Separ. Purific. Tech. 2009. V. 64. N 3. P. 368-373.
hydrates of different compositions can be formed //
Russ. J. Appl. Chem. 2021. V. 94. N 11. P.1469-1482.
[14]
Rahman M. M., Salleh M. A. M., Rashid U., Ahsan A.,
Hossain M. M., Ra C. S. Production of slow release
[23]
Jensen A. C. S., Imberti S., Parker S. F., Schneck E.,
crystal fertilizer from wastewaters through struvite
Politi Y., Fratzl P., Bertinetti L., Habraken W. J. E. M.
crystallization - A review // Arab. J. Chem. 2014. V. 7.
Hydrogen bonding in amorphous calcium carbonate
N 1. P. 139-155.
and molecular reorientation induced by dehydration
// J. Phys. Chem. C. 2018. V. 122. N 6. P. 3591-3598.
[15]
Muhmood A., Lu J., Dong R., Wu S. Formation of
struvite from agricultural wastewaters and its reuse on
[24]
Demichelis R., Raiteri P., Gale J. D., Quigley D.,
farmlands: Status and hindrances to closing the nutrient
Gebauer D. Stable prenucleation mineral clusters are
loop // J Environ. Manage. 2019. V. 230. P. 1-13.
liquid-like ionic polymers // Nature Commun. 2011.
V. 2. P. 590-590.
[16]
Fattah K. P. Assessing struvite formation potential
at wastewater treatment plants // Int. J. Environ. Sci.
[25]
Majzlan J. Processes of metastable-mineral formation
Devel. 2012. V. 3. N 6. P. 548-552.
in oxidation zones and mine waste // Mineralogical
Magazine. 2020. V. 84. N 3. P. 367-375.
[17]
Lin Q., Chen Z., Liu J., Tang B., Ye J., Zhang L.
Optimization of struvite crystallization to recover
[26]
Mathew M., Kingsbury P., Takagi S., Brown W. E.
nutrients from raw swine wastewater // Desalination
A new struvite-type compound, magnesium sodium
and Water Treatment. 2015. V. 56. P. 3106-3112.
phosphate heptahydrate // Acta Crystallogr. Sect. B:
Struct. Sci. Cryst. Eng. Mater. 1982. V. 1. N 38. P. 40-
[18]
Sanghavi R. J., Dobariya R., Bhatti S., Kumar A.
Preparation of high-purity magnesium-ammonium-
[27]
Britvin S. N., Ferraris G., Ivaldi G., Bogdanova A. N.,
phosphate fertilizer using sea bittern and industrial
Chukanov N. V. Cattiite, Mg3(PO4)2·22H2O, a new
waste streams // Environ. Sci. Pollut. Res. Int. 2020.
mineral from Zhelezny Mine (Kovdor Massif, Kola
V. 27. N 7. P. 7720-7728.
Peninsula, Russia) // Neues J. Mineral. Monat. Jg.
2002. V. 4. P. 160-168.
[19]
Gebauer D., Kellermeier M., Gale J. D.,
Bergströmc L., Cölfena H. Pre-nucleation clusters as
[28]
Dawn A. Supramolecular gel as the template for
solute precursors in crystallization // Chem. Soc. Rev.
catalysis, Inorganic superstructure, and pharmaceutical
2014. V. 43. P. 2348-2371.
crystallization // Int. J. Mol. Sci. 2019. V. 20. N 3.
[20]
John C. Mergo III, Seto J. On simulating the formation
[29]
Tonetti A. L., de Camargo C. C., Guimarães J. R.
of structured, crystalline systems via non-classical
Ammonia removal from landfill leachate by struvite
pathways // Front Mater. 2020.
formation: An alarming concentration of phosphorus
in the treated effluent // Water Sci. Technol. 2016.
[21]
Habraken W. J. E. M., Tao J., Brylka L. J., Friedrich H.,
V. 74. N 12. P. 2970-2977.
Bertinetti L., Schenk A. S., Verch A., Dmitrovic V.,
Bomans P. H. H., Frederik P. M., Laven J.,
[30]
Camargo C. C., Guimarães J. R., Tonetti A. L.
Schoot P., Aichmayer B., With G., DeYoreo J. J.,
Treatment of landfill leachate: Removal of ammonia
Sommerdijk N. A. J. M. Ion-association complexes
by struvite formation // Water SA. 2014. V. 40. N 3.
unite classical and non-classical theories for the
biomimetic nucleation of calcium phosphate // Nat.
[31]
Schneider P. A., Wallace J. W., Tickle J. C. Modelling
Commun. 2013. V. 4. ID 1507.
and dynamic simulation of struvite precipitation from
source-separated urine // Water Sci. Technol. 2013.
[22]
Кузнецова Ю. В., Вольхин В. В., Пермякова И. А.
V. 67. N 12. P. 2724-2732.
Синтез струвита в водно-солевых системах в ус-