656
Марочкин Д. В. и др.
Журнал прикладной химии. 2022. Т. 95. Вып. 5
УДК 547.426.46: 547-326
ВЫСОКОКИПЯЩИЕ ПОБОЧНЫЕ ПРОДУКТЫ СИНТЕЗА
ТРИМЕТИЛОЛПРОПАНА И ИХ ПЕРЕРАБОТКА В СЛОЖНЫЕ ЭФИРЫ
© Д. В. Марочкин, О. Г. Карчевская, Т. Е. Крон, Ф. В. Рыжков,
Г. А. Корнеева, Ю. Г. Носков
ООО «Объединенный центр исследований и разработок» (ООО «РН-ЦИР»),
119333, г. Москва, Ленинский пр., д. 55/1, стр. 2
E-mail: MarochkinDV@rdc.rosneft.ru
Поступила в Редакцию 8 апреля 2022 г.
После доработки 14 июля 2022 г.
Принята к публикации 25 июля 2022 г.
По данным ЯМР 1Н спектроскопии основными составляющими кубового остатка после вакуум-
ной перегонки триметилолпропана-сырца, полученного в технологическом процессе конденсации
н-бутираля с формальдегидом по реакции Канниццаро-Тищенко, являются триметилолпропан, ди-
(триметилолпропан), линейные формали и структуры, включающие фрагмент циклического формаля.
Содержание остальных примесей носит минорный характер. Тяжелый кубовый остаток может
быть превращен с высоким выходом в смесь полных сложных эфиров триметилолпропана и ди(три-
метилолпропана) этерификацией с н-пентановой кислотой. Такие эфиры характеризуются низкой
температурой застывания, обладают высокой химической стойкостью, термостабильностью и
хорошими вязкостно-температурными свойствами, а также достаточной совместимостью с различ-
ными пластическими материалами, в связи с чем могут найти применение в качестве смазывающих
материалов, пластификаторов полимеров и других продуктов.
Ключевые слова: триметилолпропан; ди(триметилолпропан); полиолы; сложные эфиры н-пентановой
кислоты и полиолов
DOI: 10.31857/S0044461822050127, EDN: DJLXHN
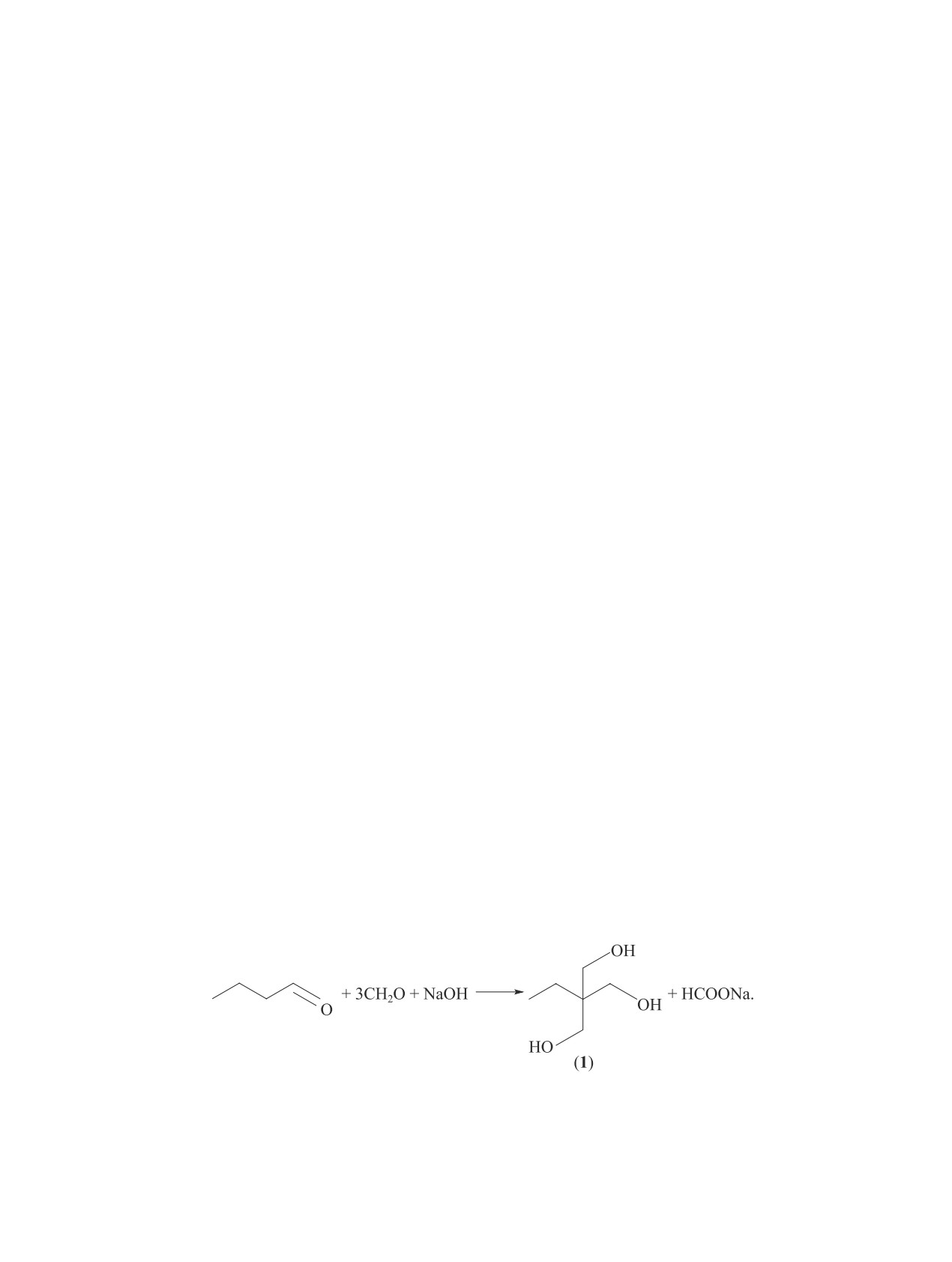
Триметилолпропан (1) является сырьем для про-
метилолпропана [1, 2] является конденсация н-бу-
изводства сложноэфирных смазочных материалов,
тираля с формальдегидом по перекрестной реакции
алкидных и эпоксидных смол, эмалей, полиэфиров
Канниццаро-Тищенко в присутствии гидроксида ще-
и пенополиуретанов, пластификаторов полимеров,
лочного металла, например NaOH, с образованием в
а также клеев для металлов и других продуктов.
качестве сопряженного продукта соответствующего
Наиболее распространенным способом синтеза три-
формиата:
(1)
В ходе синтеза триметилолпропана наряду с целе-
вакуумной перегонки триметилолпропана-сырца.
вым продуктом образуется до 10-13% (в расчете на
Их появление обусловлено взаимодействием в раз-
исходный н-бутираль) высококипящих побочных про-
личных комбинациях целевого триметилолпропана
дуктов, которые составляют основу кубового остатка
с формальдегидом, промежуточными веществами,
Высококипящие побочные продукты синтеза триметилолпропана и их переработка в сложные эфиры
657
легкокипящими побочными продуктами и присут-
повысить суммарный выход триметилолпропана и
ствующими в реакционной среде следами метанола
частично выделить побочный ди(триметилолпропан).
(образуется в результате диспропорционирования
К аналогичному результату приводит трансалкоголиз
формальдегида).
моноциклического формаля триметилолпропана (3)
Опубликован ряд патентов по переработке побоч-
и линейного бисформаля триметилолпропана (4),
ных продуктов синтеза триметилолпропана с целью
обнаруженных среди высококипящих побочных про-
их превращения в триметилолпропан или выделе-
дуктов синтеза триметилолпропана, с избытком одно-
ния ценного полиола ди(триметилолпропана) (2).
атомного или двухатомного спирта при повышенной
Например, предложена обработка кубовых остатков
температуре в присутствии кислотного катализатора.
перегонки триметилолпропана гидрированием в при-
Наряду с триметилолпропаном в этом случае об-
сутствии рутениевого катализатора при температурах
разуются и дополнительные продукты — ацетали
200-280°С [3, 4] и окислением с последующим гидро-
формальдегида [6].
лизом [5]. Такие процедуры позволяют несколько
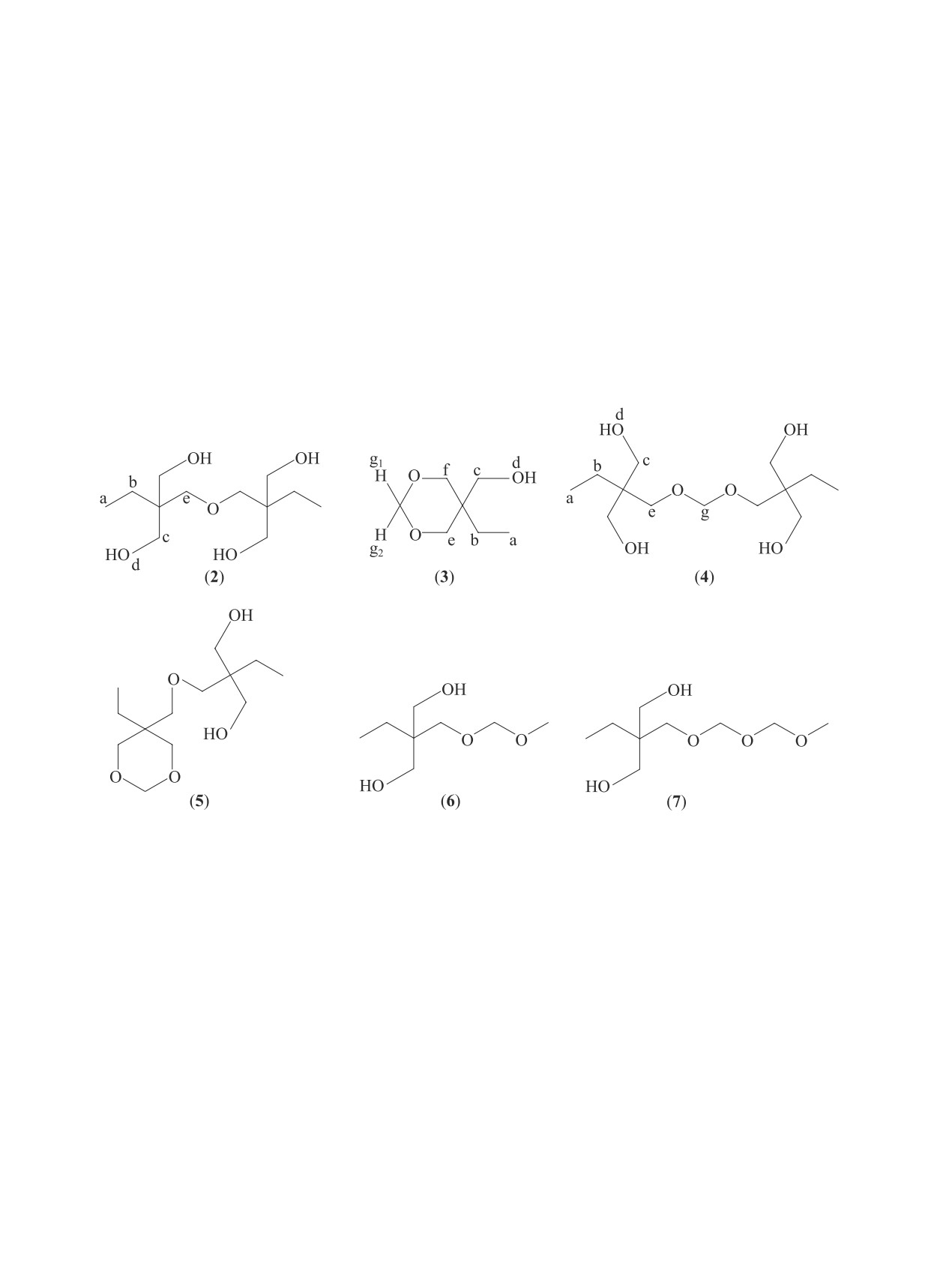
(2) — ди(триметилолпропан), (3) — моноциклический формаль триметилолпропана, (4) — линейный бисформаль
триметилолпропана, (5) — моноциклический формаль ди(триметилолпропана), (6) — монометилформаль триме-
тилолпропана, (7) — метилполиформаль триметилолпропана.
Ранее нами показано [7], что этерификацию тяже-
Цель работы — изучение природы основных вы-
лых побочных продуктов синтеза триметилолпропана
сококипящих компонентов кубового остатка после
можно проводить органическими кислотами без ка-
вакуумной перегонки триметилолпропана-сырца и
кой-либо предварительной обработки с практически
выделения основной части ди(триметилолпропана)
количественным выходом. При этом образующиеся
кристаллизацией и переработка указанных высо-
сложные эфиры триметилолпропана и ди(тримети-
кокипящих компонентов в сложные эфиры триме-
лолпропана) с соответствующими карбоновыми кис-
тилолпропана и ди(триметилолпропана) — ценное
лотами характеризуются низкими температурами за-
сырье для производства синтетических смазочных
стывания, обладают высокой химической стойкостью,
материалов и пластификаторов с привлекательными
термостабильностью и хорошими вязкостно-темпера-
эксплуатационными свойствами. В качестве карбо-
турными свойствами, а также совместимостью с раз-
новой кислоты использовали н-пентановую кислоту,
личными пластическими материалами, в связи с чем
сложные эфиры которой с полиолами входят в состав
они могут находить применение в качестве смазыва-
коммерческих масел [8].
ющих материалов, пластификаторов полимеров и др.
658
Марочкин Д. В. и др.
Экспериментальная часть
ратура 340°С (40 мин). Идентификацию соединений
проводили путем сравнения с хроматограммами ин-
Метил-трет-бутиловый эфир (х.ч., АО
дивидуальных веществ. Состав смесей определяли
«ЛенРеактив»), параформальдегид (96%, Acros
методом внутренней нормализации.
Organics, кат. номер 416780010), пара-толуолсуль-
Синтез триметилолпропана, выделение ди(три-
фокислоту моногидрат (≥98.5%, Sigma-Aldrich,
метилолпропана) и кубового остатка. Синтез триме-
кат. номер 402885) и н-пентановую кислоту (99%,
тилолпропана проводили аналогично [2]. В реактор с
Sigma-Aldrich, кат. номер 800821) использовали без
термостатируемой рубашкой, снабженный обратным
дополнительной очистки. Катионообменную смо-
холодильником и механической мешалкой, загружа-
лу Amberlyst 15 (dry) (Merck, кат. номер 06423), со-
ли 62.5 г параформальдегида, 0.09 г NaOH и 420 мл
держание сульфогрупп >4.7 экв·кг-1 использовали
дистиллированной воды. Смесь перемешивали при
в Н-форме. Для получения дистиллированной воды
температуре 60°С в течение 1 ч до образования одно-
использовали дистиллятор Autostill 4000X (Jencons).
родного прозрачного раствора. Полученный раствор
Анализ и идентификацию компонентов кубового
охлаждали до 45°С, после чего при интенсивном
остатка проводили методами газожидкостной хрома-
перемешивании в реактор одновременно дозирова-
тографии и ЯМР 1Н спектроскопии. Спектры ЯМР 1Н
ли 46.9 г н-бутираля и 71.5 г 40 мас% водного рас-
регистрировали на спектрометре Bruker AVANCE 300.
твора NaOH. Дозирование реагентов вели с такой
Рабочая частота для ядер 1H — 300.17 МГц, раство-
скоростью, чтобы температура реакционной массы
ритель — CD3CN. Расчет спектра ЯМР 1Н линейно-
не поднималась выше 45°С, а значение рН находи-
го бисформаля триметилолпропана (4) выполняли
лось в интервале 9-10.5. После добавления всего
в программном комплексе ACD/Labs. ИК-спектры
количества н-бутираля и раствора щелочи массу в
регистрировали на ИК-Фурье-спектрометре Thermo
реакторе нагревали до 50°С и перемешивали в тече-
Scientific Nicolet iS50, снабжeнном приставкой НПВО
ние 1 ч. Далее массу охлаждали до комнатной тем-
с алмазным элементом, в диапазоне частот 4000-
пературы и нейтрализовали муравьиной кислотой
500 см-1. Температуру застывания синтезирован-
до значения рН 5.5, затем при атмосферном давле-
ных соединений определяли по ГОСТ 20287 (ме-
нии отгоняли 415 г дистиллята формальдегид-вода.
тод Б),* плотность при 20°С — по ASTM D4052,**
Остаток — концентрированный водный раствор про-
кинематическую вязкость при -40, 40 и 100°C — по
дуктов синтеза — загружали в вертикальный труб-
ASTM D445.***
чатый экстрактор и экстрагировали органические
Хроматографический анализ триметилолпропана,
продукты метил-трет-бутиловым эфиром при 90°С
высококипящих побочных продуктов процесса полу-
под давлением 2.7 МПа. После дросселирования вы-
чения триметилолпропана, а также сложных эфиров
ходного потока экстракта до атмосферного давления
триметилолпропана и ди(триметилолпропана) про-
метил-трет-бутиловый эфир отгоняли и возвращали
водили на хроматографе Thermo Finnigan Trace GC с
циркуляционным насосом в экстрактор. Процесс кон-
пламенно-ионизационным детектором и капиллярной
тролировали методом газожидкостной хроматографии
колонкой Zebron ZB-5HT Inferno (30 м × 0.32 мм ×
по наличию триметилолпропана в потоке экстракта.
× 0.25 мкм). Режим работы испарителя: температура
Упаренный экстракт (триметилолпропан-сырец) пе-
350°С, давление газа-носителя (гелий) на входе в
регоняли в вакууме, отделяя легкокипящую «пред-
колонку 130 кПа, поток деления 75 мл·мин-1. Режим
этриольную» фракцию (Ткип = 70-183°С/19 мм рт. ст.)
работы детектора: температура 350°С, расход возду-
и собирая целевую фракцию триметилолпропана с
ха 350 мл·мин-1, водорода — 40 мл·мин-1, гелия —
Ткип = 184-185°С/19 мм рт. ст. Выход 75.7 г (86.8%
30 мл·мин-1. Программирование температуры колон-
в расчете на н-бутираль). Тпл = 57-58°С (58°С [9]),
ки: начальная температура 80°С (3 мин) — нагрев до
содержание основного вещества 99.7 мас% (газо-
340°С со скоростью 6 град·мин-1, постоянная темпе-
жидкостная хроматография). ИК-спектр (ν, см-1):
3210, 2922, 1460, 1377, 1255, 1159, 1060, 1022. Спектр
* ГОСТ 20287. Нефтепродукты. Методы определения
ЯМР 1Н (CD3CN, δ, м. д.): 0.81 т (J = 7.5 Гц, 3Н, СН3),
температур текучести и застывания.
1.27 кв (J = 7.5 Гц, 2H, СH2—СН3), 3.22 (с, 3Н, ОH),
** ASTM D4052. Standard Test Method for Density,
3.45 с (6H, СH2—O).
Relative Density, and API Gravity of Liquids by Digital
Неотогнанный высококипящий остаток вакуум-
Density Meter.
ной перегонки триметилолпропана-сырца последо-
*** ASTM D445. Standard Test Method for Kinematic
вательно перекристаллизовывали сначала из 40 мл
Viscosity of Transparent and Opaque Liquids (and Calculation
of Dynamic Viscosity).
этилацетата, затем из 30 мл ацетона, выпавший белый
Высококипящие побочные продукты синтеза триметилолпропана и их переработка в сложные эфиры
659
кристаллический осадок отфильтровывали. Получили
н-пентановой кислоты, 110 мл толуола и 3.0 г без-
7.6 г ди(триметилолпропана) с чистотой 98.8 мас%.
водной катионообменной смолы Amberlyst 15. Массу
Тпл = 108-109°С (106-115°С [9]). ИК-спектр (ν, см-1):
кипятили в атмосфере аргона при интенсивном пе-
3254, 2960, 2930, 2875, 1254, 1130, 1024. Спектр ЯМР
ремешивании, отделяя реакционную воду в насад-
1Н (CD3CN, δ, м. д.): 0.86 т (J = 7.7 Гц, 6Н, СН3),
ке Дина-Старка. Через 8 ч добавляли 2 г свежего
1.32 кв (J = 7.7 Гц, 4H, СH2—СН3), 2.91 т (J = 5.5 Гц,
катионита Amberlyst 15 и продолжали кипячение
4Н, ОH), 3.35 с (4H, СH2—O—CH2), 3.47 д (J = 5.5 Гц,
еще 12 ч, что обеспечивает количественное проте-
8H, СH2—OH).
кание этерификации. После фильтрования реакци-
Фильтраты (маточные растворы) после выделения
онную смесь подвергали фракционной вакуумной
ди(триметилолпропана) объединяли, упаривали и
перегонке; с первой фракцией дистиллята (15.9 г,
получили 22.4 г вязкого масла, содержащего высо-
Ткип = 50-130°С/0.06 мм рт. ст.) из смеси удаляли
кокипящие побочные продукты синтеза тримети-
остаток непрореагировавшей н-пентановой кислоты,
лолпропана. Далее указанное масло обозначено как
применявшейся в избытке относительно полиолов.
кубовый остаток. Усредненный состав (мас%): триме-
Затем собирали фракцию сложных эфиров — смесь
тилолпропан — 43.7, ди(триметилолпропан) — 20.4,
трипентаноата триметилолпропана (8) и тетрапен-
остальные примеси — 35.9.
таноата ди(триметилолпропана) (9) (Ткип = 180-
Синтез моноциклического формаля триметилол-
230°С/0.06 мм рт. ст.). Получили 45.7 г эфиров, физи-
пропана (5-этил-5-гидроксиметил-1,3-диоксана).
ко-химические свойства которых приведены в таблице.
Синтез проводили аналогично [10]. Целевой продукт
в виде бесцветной маслянистой жидкости выделяли
Обсуждение результатов
вакуумной перегонкой, собирая фракцию с Ткип = 95-
97°С/3 мм рт. ст. (92-94°С/5 мм рт. ст. [10]). Спектр
Согласно литературным данным [11-13] синтез
ЯМР 1Н (CD3CN, δ, м. д.): 0.85 т (J = 7.7 Гц, 3H, СН3),
триметилолпропана сопровождается рядом реакций
1.33 кв (J = 7.7 Гц, 2H, СH2—СН3), 2.75 с (1H, ОН),
с образованием побочных соединений. «Легкие» про-
3.49 д (J = 11.6 Гц, 2H, СН2), 3.61 с (2H, СН2—ОН),
дукты с температурой кипения ниже, чем у тримети-
3.79 д (J = 11.6 Гц, 2H, СН2), 4.67 д (2J = 5.9 Гц, 1H,
лолпропана, в том числе моноциклический формаль
О—СН2—О), 4.85 д (2J = 5.9 Гц, 1H, О—СН2—О).
триметилолпропана, составляют основу «предэтри-
Синтез сложных эфиров из кубового остатка и
ольной» фракции вакуумной перегонки триметилол-
н-пентановой кислоты. В колбу емкостью 250 мл,
пропана-сырца. Другая часть побочных продуктов
снабженную механической мешалкой и насадкой
представлена высококипящими соединениями (2),
Дина-Старка с обратным холодильником, загружа-
(4)-(7), образование которых может быть проиллю-
ли 22.4 г кубового остатка. Затем прибавляли 59.1 г
стрировано следующими уравнениями реакций:
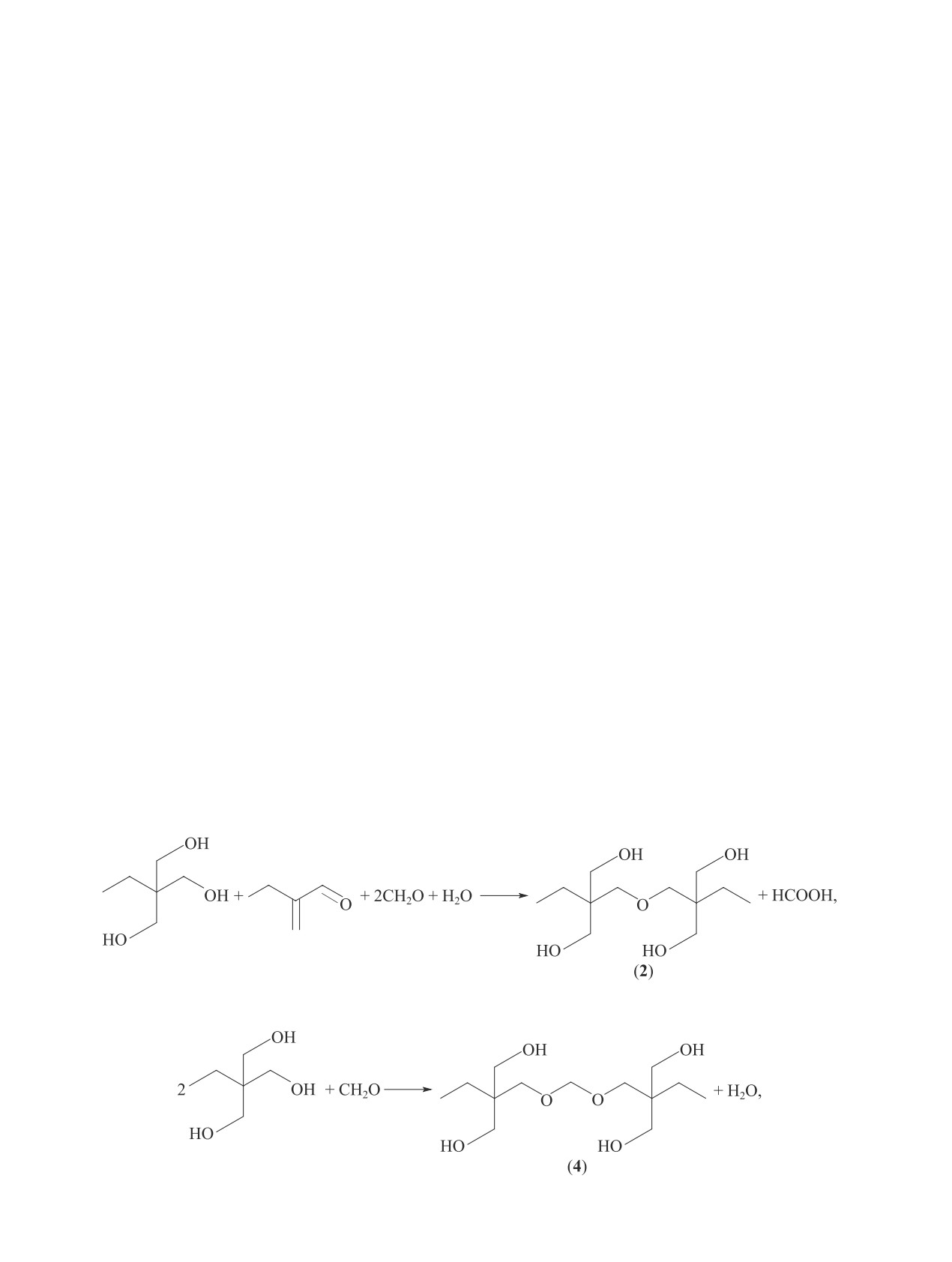
— ди(триметилолпропан) [13]
(2)
- линейный бисформаль триметилолпропана
(3)
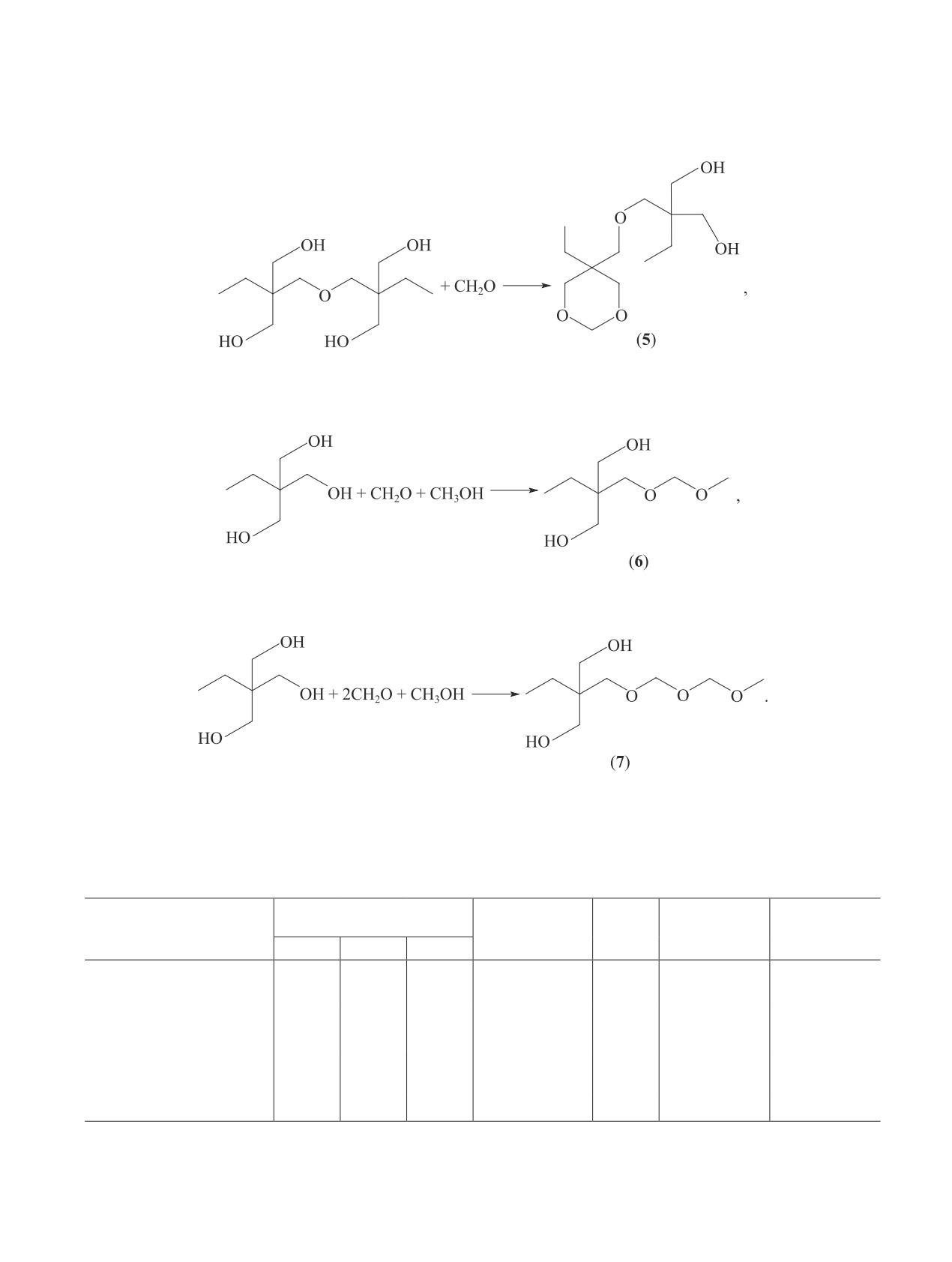
660
Марочкин Д. В. и др.
- моноциклический формаль ди(триметилолпропана)
(4)
- монометилформаль триметилолпропана
(5)
- метилполиформаль триметилолпропана
(6)
Физико-химические свойства сложных эфиров — индивидуальных пентаноатов триметилолпропана,
ди(триметилолпропана) и продукта этерификации кубового остатка, а также коммерческого сложноэфирного
масла Synative® ES 2920
Вязкость кинематическая,
Температура
Плотность
Индекс
Температура
Сложный эфир
мм2·с-1
кипения,
при 20°С,
вязкости
застывания, °С
°С/мм рт. ст.
г·см-3
100°C
40°C
-40°C
Трипентаноат триметилол-
2.553
9.554
699.4*
167-170/0.03
92
ниже -60
1.0010
пропана**
Тетрапентаноат ди(триме-
5.737
32.11
23143
230-235/0.50
121
-56
1.0052
тилолпропана)**
Продукт этерификации ку-
3.269
13.41
2737
189-230/0.06
112
ниже -60
0.9950
бового остатка
Synative® ES 2920
4.0
17.3
—
—
132
-69
0.9510
* Измерено при температуре -35°C.
** Индивидуальные пентаноаты триметилолпропана и ди(триметилолпропана) синтезированы известными методами
[17].
Высококипящие побочные продукты синтеза триметилолпропана и их переработка в сложные эфиры
661
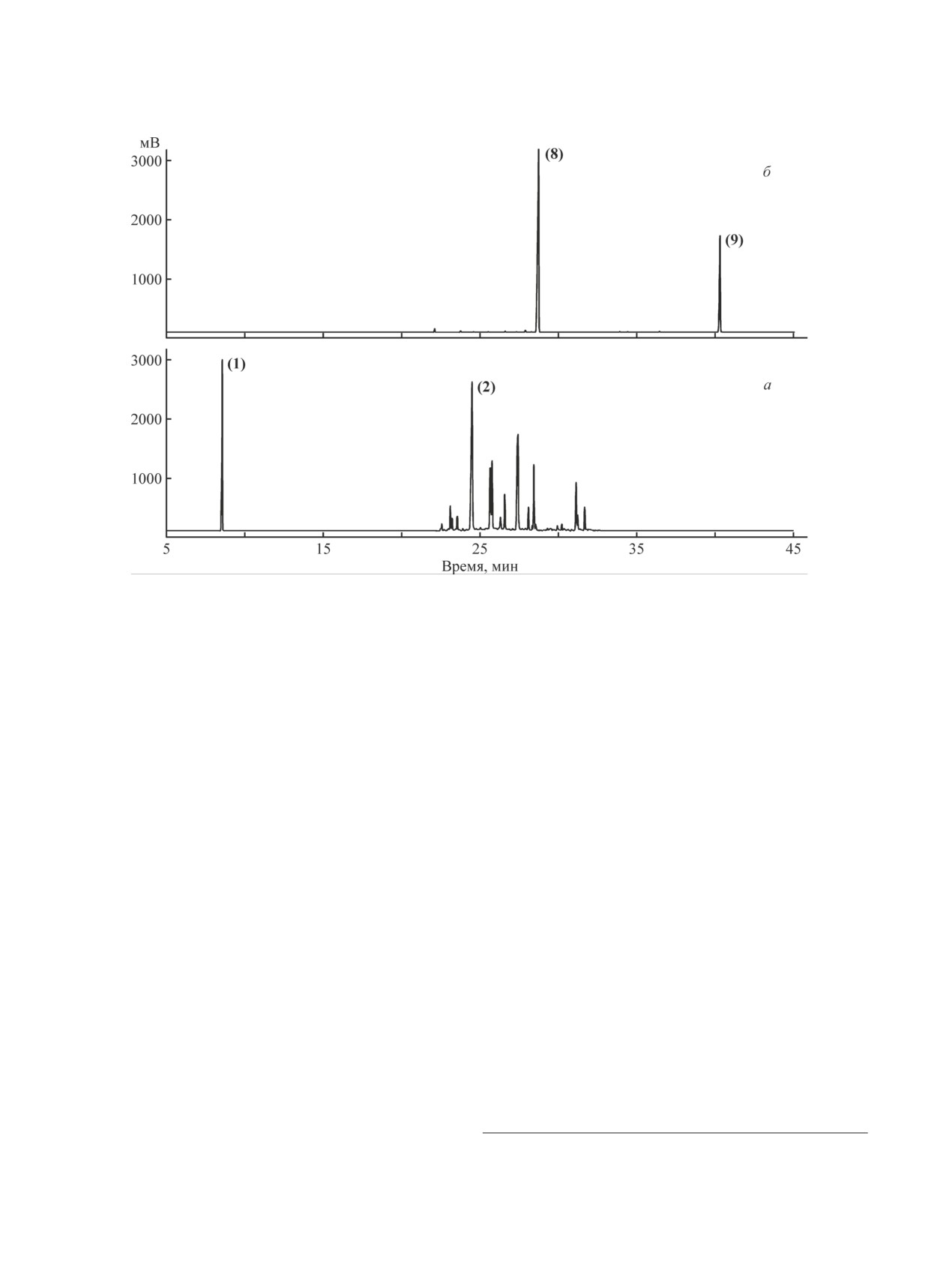
Рис. 1. Хроматограммы кубового остатка (а) и фракции сложных эфиров — продуктов этерификации н-пентановой
кислотой компонентов кубового остатка (б).
На хроматограмме кубового остатка (рис. 1, а)
метилольных фрагментов наблюдается наложение
хроматографические пики с временем удерживания
нескольких сигналов, принадлежащих, вероятно, три-
меньшим, чем время удерживания триметилолпропа-
метилолпропану (на рис. 2, б приведен спектр ЯМР
на, не фиксируются. Температуры кипения побочного
1Н триметилолпропана-сырца до вакуумной пере-
продукта монометилформаля триметилолпропана и
гонки) и ди(триметилолпропану) (рис. 2, в). Узкий
самого триметилолпропана практически совпадают
интенсивный синглет 3.29 м. д., накладывающийся
[14], поэтому их разделение трудноосуществимо.
на широкий сигнал d в области 3.0-3.35 м. д. гидрок-
При этом содержание монометилформаля в образцах
сильных групп, может свидетельствовать о наличии
выделенного триметилолпропана, определенное хро-
протонов типа e фрагмента —СH2—О—CH2— как
матографическим методом, составляет 0.1-0.4 мас%.
ди(триметилолпропана), так и бисформаля тримети-
Монометилформаль как трудноотделяемая примесь
лолпропана. Выделение или встречный синтез этого
также может быть одним из компонентов кубового
бисформаля в индивидуальном состоянии затрудни-
остатка (ввиду очень низкой концентрации данная
тельны, поэтому для идентификации использован
примесь на хроматограмме не фиксируется). Среди
расчетный спектр ЯМР 1Н, в котором протоны типа
более 15 присутствующих на хроматограмме ком-
е имеют химический сдвиг 3.32 м. д. Достаточно ин-
понентов доминируют триметилолпропан и ди(три-
тенсивный синглет 4.61 м. д. также может быть отне-
метилолпропан) (проведено сопоставление времени
сен к протонам типа g этого соединения, в расчетном
удерживания с эталонными образцами).
спектре химический сдвиг этих протонов составляет
Для определения природы компонентов, входящих
4.59 м. д.
в состав кубового остатка, был проанализирован его
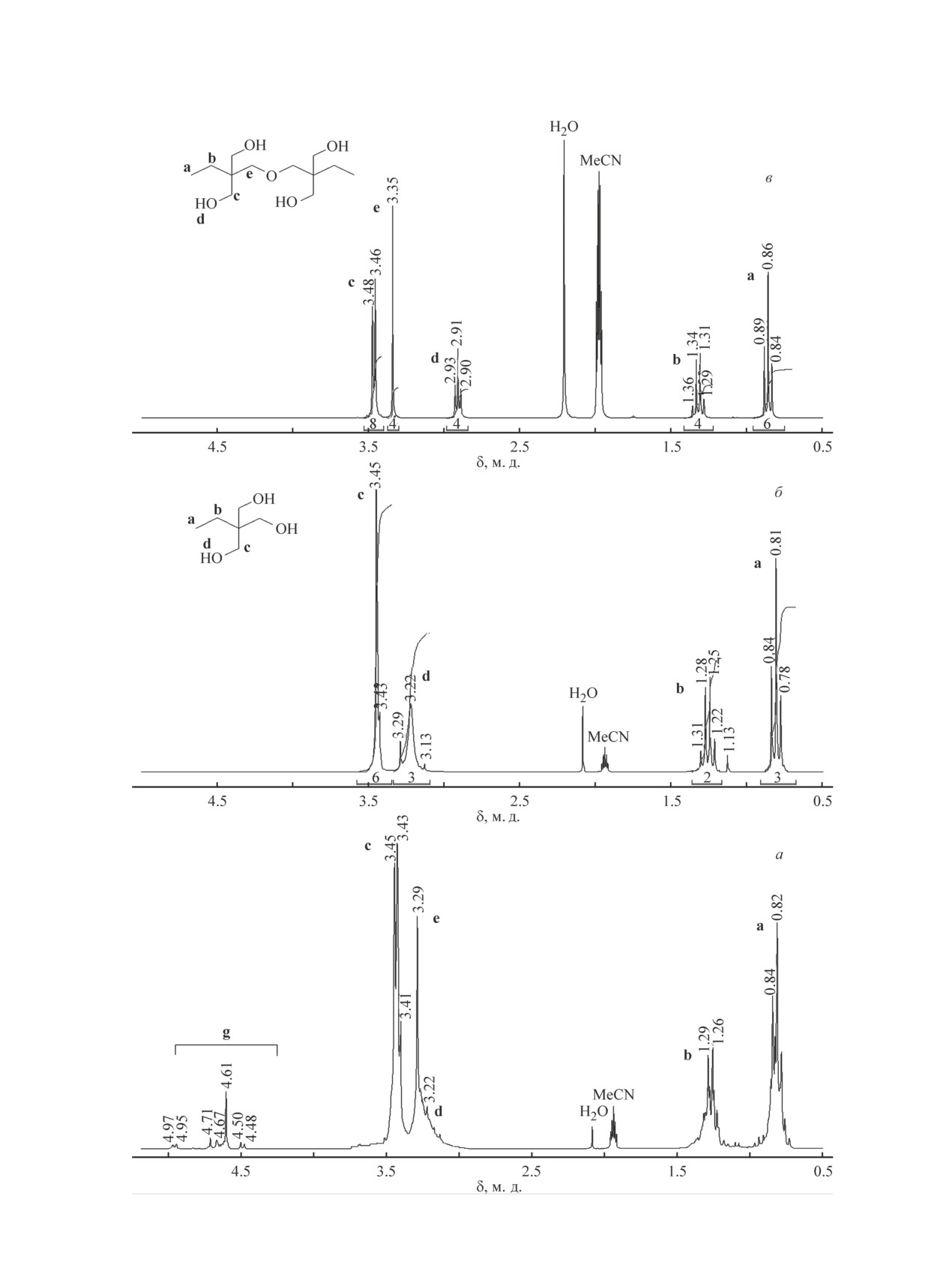
В слабопольной области можно выделить хоро-
спектр ЯМР 1Н (рис. 2, а). Ввиду значительного со-
шо различимые дублеты малой интенсивности с δН
держания примесей резонансные сигналы этильной
4.49 и 4.96 м. д. Эти сигналы, по-видимому, могут
группы (протоны а и b) проявляются в виде нало-
женных мультиплетных сигналов близких по при-
Рис. 2. Спектры ЯМР 1Н кубового остатка (а), триме-
роде веществ. В области 3.35-3.45 м. д. протонов с
тилолпропана-сырца (б), ди(триметилолпропана) (в).
Высококипящие побочные продукты синтеза триметилолпропана и их переработка в сложные эфиры
663
быть отнесены к геминальным протонам фрагмента
моноциклический формаль триметилолпропана и
—O—CH2—O— 1,3-диоксанового цикла [15] моно-
линейный бисформаль ди(триметилолпропана) в при-
циклического формаля ди(триметилолпропана) по
сутствии кислотного катализатора при температуре
аналогии с моноциклическим формалем тримети-
30-300°С превращаются в триметилолпропан. Кроме
лолпропана (см. Экспериментальную часть). Наряду
того, возможно прямое взаимодействие карбоновой
с указанными структурами спектр ЯМР 1Н кубового
кислоты с формалями с выделением формальдегида
остатка не противоречит наличию в смеси других
и образованием сложных эфиров триметилолпропана
формалей подобной природы, образующихся при
и ди(триметилолпропана). Легкие продукты распада
взаимодействии триметилолпропана и ди(тримети-
формалей (формальдегид, метанол) и реакционная
лолпропана) с формальдегидом и метанолом, присут-
вода удаляются из зоны реакции в виде азеотропа с
ствующими в реакционной массе на стадии синтеза,
толуолом.
например, метилполиформаля триметилолпропана.
Смесевая композиция сложных эфиров, получен-
На основании данных хроматографии и ЯМР H1
ная этерификацией кубового остатка, имеет вязкост-
спектроскопии можно заключить, что основными
но-температурные характеристики, промежуточные
компонентами кубового остатка являются сам три-
между таковыми для индивидуальных эфиров, и
метилолпропан и его димер, а также побочные фор-
является низкозастывающей. Можно полагать, что
мали, наиболее вероятные из которых — линейный
смазывающие, пластифицирующие и другие свой-
бисформаль триметилолпропана и моноциклический
ства обсуждаемой смесевой композиции эфиров так-
формаль ди(триметилолпропана).
же будут соответствовать типовым эксплуатацион-
Ввиду близости физико-химических свойств ком-
ным свойствам сложных эфиров этих полиолов [16].
понентов кубового остатка выделение из него востре-
Следует отметить, что подобную обработку различ-
бованных товарных продуктов триметилолпропана и
ными карбоновыми кислотами можно, по-видимому,
ди(триметилолпропана) значительно затруднено. По
проводить и с остатком, полученным сразу после
этой причине кубовый остаток в непереработанном
вакуумной перегонки триметилолпропана-сырца без
виде невостребован, что отрицательно сказывается
дополнительного выделения его димера кристаллиза-
на экономических показателях и технологичности
цией. В любом случае такой подход является одним
процесса получения целевого триметилолпропана в
из путей безотходной переработки и рационального
целом. В то же время известно, что сложные эфиры
использования побочных продуктов процесса полу-
полиолов и карбоновых кислот находят применение
чения триметилолпропана.
в качестве высокоиндексных смазочных материалов с
широким температурным диапазоном эксплуатации,
например Synative® ES 2920, Synative® ES 2925 ком-
Выводы
пании BASF.*
В настоящей работе предложено подвергать кубо-
Главными компонентами кубового остатка после
вый остаток взаимодействию с н-пентановой кисло-
вакуумной перегонки триметилолпропана-сырца,
той с целью перевода его компонентов, в том числе
полученного конденсацией н-бутираля с формаль-
формалей, в сложные эфиры. Образующиеся при
дегидом в присутствии гидроксида натрия, после
такой обработке эфиры представлены смесью двух
выделения основной части ди(триметилолпропана)
веществ — трипентаноатом триметилолпропана и
кристаллизацией являются триметилолпропан и
тетрапентаноатом ди(триметилолпропана) (рис. 1, б).
ди(триметилолпропан). Остальные примеси с вы-
По-видимому, тяжелые компоненты кубового остатка,
сокой вероятностью представлены формалями (4)-
включающие полиольные фрагменты с линейны-
(7). Показана возможность практически безотходной
ми и (или) циклическими структурами формалей,
переработки высококипящих побочных продуктов
в условиях этерификации, подвергаясь гидролизу,
процесса получения триметилолпропана путем этери-
превращаются в целевой триметилолпропан и его
фикации компонентов кубового остатка н-пентановой
димер, которые при взаимодействии с н-пентановой
кислотой с селективным получением смеси полных
кислотой дают соответствующие эфиры. Это не про-
сложных эфиров триметилолпропана и ди(тримети-
тиворечит, в частности, данным [6], согласно которым
лолпропана). Смесевая композиция сложных эфи-
ров, полученная из кубового остатка, имеет вязкост-
но-температурные характеристики, промежуточные
между характеристиками индивидуальных эфиров
8f499c0dc27deb2b46a/files/uploaded/B_Base_Stocks-6P_
Esters_02_2016.pdf (дата обращения: 07.04.2022).
триметилолпропана и ди(триметилолпропана), и,
664
Адериха В. Н. и др.
так же как и индивидуальные эфиры, является низко-
застывающей.
Носков Юрий Геннадьевич, к.х.н., заведующий
лабораторией ООО «Объединенный центр исследо-
ваний и разработок»
Конфликт интересов
Авторы заявляют об отсутствии конфликта инте-
ресов, требующего раскрытия в данной статье.
Список литературы
[1]
Беляева Е. Ю., Тархов Л. Г., Чекрышкин Ю. С.
Вклад авторов
Этриол: изучение отдельных стадий конденсации
н-масляного альдегида с формальдегидом // Хим.
Д. В. Марочкин — сбор и анализ научно-техниче-
пром-сть. 2005. Т. 82. № 7. С. 329-333.
ской информации по синтезу и выделению тримети-
[2]
Пат. РФ 2560156 С1 (опубл. 2015). Способ получе-
лолпропана, синтез триметилолпропана, проведение
ния этриола.
вакуумной перегонки триметилолпропана-сырца,
[3]
Pat. US 6265623 B1 (publ. 2001). Process for
выделение кубового остатка, отработка условий про-
the reductive cleavage of linear and cyclic acetals
ведения газожидкостного хроматографического ана-
especially formals.
лиза; О. Г. Карчевская — отработка методик синте-
[4]
Pat. US 7301058 B2 (publ. 2007). Method for
за моноциклического формаля триметилолпропана,
increasing yield in the production of polyvalent
alcohols by splitting by-products containing acetal.
проведение хроматографического анализа кубового
[5]
Pat. US 8759593 B2 (publ. 2014). Recovery of
остатка; Т. Е. Крон — интерпретация спектров ядер-
alcohols from purification residue.
ного магнитного резонанса, анализ и систематизация
[6]
Пат. РФ 2247704 C2 (опубл. 2005). Обработка ком-
результатов работы; Ф. В. Рыжков — отработка ме-
позиции, включающей триметилолалкан бис-мо-
тодик и проведение реакций этерификации кубового
нолинейный формаль.
остатка, проведение хроматографического анализа
[7]
Пат. РФ 2616004 С1 (опубл. 2017). Способ пе-
сложных эфиров; Г. А. Корнеева — сбор и анализ
реработки высококипящих побочных продуктов
литературных (в том числе патентных) данных по
процесса получения этриола.
побочным продуктам синтеза триметилолпропана,
[8]
Randles S. J. Esters / Synthetic lubricants and high-
интерпретация результатов работы; Ю. Г. Носков —
performance functional fluids / Eds L. R. Rudnick,
постановка методик синтеза и хроматографического
R. L. Shubkin. New York; Basel: Marcel Dekker, INC,
анализа триметилопропана и моноциклического фор-
1999. Ch. 3. P. 63-101.
маля триметилолпропана, методики этерификации,
[9]
Werle P., Morawietz M., Lundmark S., Sörensen K.,
интерпретация спектральных данных, результатов
Ullmannʹs Encyclopedia of Industrial Chemistry. 7th
газожидкостного хроматографического анализа.
Ed. Weinheim: Wiley, 2012. P. 263-284.
[10]
Опарина Л. А., Высоцкая О. В., Паршина Л. Н.,
Хилько М. Я., Гусарова Н. К. Винилирование аце-
Информация об авторах
тиленом гидроксилсодержащих циклических фор-
Марочкин Дмитрий Вячеславович, к.х.н., замести-
малей // ЖОХ. 2008. Т. 44. № 10. С. 1458-1461
тель заведующего лабораторией ООО «Объединен-
[Oparina L. A., Vysotskaya O. V., Parshina L. N.,
ный центр исследований и разработок»
Khilʹko M. Ya., Gusarova N. K. Vinylation of hydroxy-
containing cyclic formaldehyde acetals with acetylene
Карчевская Ольга Георгиевна, н.с. ООО «Объеди-
// Russ. J. Org. Chem. 2008. V. 44. N 10. P. 1434-
ненный центр исследований и разработок»
[11]
Pat. US
2013/0131391 A1 (publ.
2013).
Method for obtaining ditrimethylolpropane and
Крон Татьяна Евгеньевна, к.х.н., в.н.с. ООО
trimethylolpropane-enriched product streams from
«Объединенный центр исследований и разработок»
the side-streams in trimethylolpropane production.
[12]
Рудковский Д. М., Кецлах М. М., Эппель Ф. А.
Рыжков Федор Владимирович, к.х.н., ст.н.с. ООО
Многоатомные спирты. Л.: Химия, 1972. C. 92.
«Объединенный центр исследований и разработок»
[13]
Pat. US 5840994 A (publ. 1998). Process for producing
ditrimethylolpropane.
Корнеева Галина Александровна, д.х.н., г.н.с. ООО
[14]
Pat. GB 1290036 A (publ. 1972). Method for
«Объединенный центр исследований и разработок»
purification of crude trimethylolpropane.
Высококипящие побочные продукты синтеза триметилолпропана и их переработка в сложные эфиры
665
[15] Ramey K. C., Messik J. Stereospecific long range
[17] Марочкин Д. В., Носков Ю. Г., Крон Т. Е.,
couplings in the NMR spectra of substituted
Карчевская О. Г., Корнеева Г. А. Продукты оксо-
1,3-dioxanes // Tetrahedron Lett. 1965. V. 6. P. 4423-
синтеза в производстве сложноэфирных смазочных
масел // Науч.-техн. вестн. ОАО «НК «Роснефть».
[16] Динцес А. И., Дружинина А. В. Синтетические сма-
2016. № 4. С. 74-81.
зочные масла. М.: Гостоптехиздат, 1958. С. 113-
147.