716
Бадыкова Л. А. и др.
Журнал прикладной химии. 2022. Т. 95. Вып. 6
УДК 547.458.88:615.281.9
ТРАНСПОРТНЫЕ ХАРАКТЕРИСТИКИ ПЛЕНОЧНЫХ КОМПОЗИЦИЙ
НА ОСНОВЕ ПЕКТИНА И ПОЛИВИНИЛОВОГО СПИРТА
С МОКСИФЛОКСАЦИНОМ
© Л. А. Бадыкова, Р. Х. Мударисова, С. В. Колесов
Уфимский институт химии УФИЦ РАН,
450054, г. Уфа, пр. Октября, д. 71
E-mail: badykova@mail.ru
Поступила в Редакцию 6 мая 2022 г.
После доработки 7 сентября 2022 г.
Принята к публикации 7 сентября 2022 г.
На основе пектина и поливинилового спирта разработаны пленочные композиции с моксифлоксацином.
Исследован процесс высвобождения моксифлоксацина из пленок с различным содержанием поливинило-
вого спирта. Установлено, что изменение композиционного состава полимерных комплексов оказывает
влияние на размеры надмолекулярных образований в композиционных пленках и в итоге на кинетику
высвобождения моксифлоксацина. Методами электронной спектроскопии изучено комплексообразо-
вание полимеров с моксифлоксацином. Микробиологические испытания показали фармакологическую
активность пленок на основе пектина и поливинилового спирта с моксифлоксацином.
Ключевые слова: цитрусовый пектин; яблочный пектин; моксифлоксацин; комплексообразование;
полимерные пленки
DOI: 10.31857/S0044461822060056, EDN: DKDTBB
Аппликационные лекарственные формы, такие как
пленки на основе пектинов быстро растворяются в
полимерные пленки, нашли широкое применение в
воде. Модификация пленок иными водорастворимы-
различных областях медицины. При использовании в
ми полимерами, например поливиниловым спиртом,
качестве носителей лекарственных средств полимер-
может способствовать уменьшению растворимости.
ные пленки обеспечивают повышенную концентра-
Поливиниловый спирт имеет широкое практиче-
цию лекарственного вещества в месте аппликации,
ское применение в медицине, он нетоксичен, биосо-
создавая условия для максимального терапевтиче-
вместим, обладает хорошими адгезионными свой-
ского действия [1-3]. Основой для пленок могут быть
ствами. Соответственно использование пектинов в
либо индивидуальные полимеры, либо смеси поли-
комбинации с поливиниловым спиртом в качестве по-
меров, как природных, так и синтетических [4, 5].
лимерной матрицы представляется целесообразным.
В данной работе в качестве полимерного носителя в
Цель работы — исследование высвобождения
пленках с иммобилизованным лекарственным сред-
моксифлоксацина из пленок на основе цитрусового и
ством моксифлоксацин рассмотрена система пектин-
яблочного пектинов с поливиниловым спиртом.
поливиниловый спирт.
Пектины — природные полисахариды, главная
Экспериментальная часть
цепь которых состоит из 1,4-связанных остатков
α-D-галактуроновой кислоты, содержащих частично
В данной работе использовали цитрусовый
этерифицированные карбоксильные группы [6]. Это
(М = 80 000, степень этерификации 55%, Fooding
высокоэффективные природные сорбенты, способные
Group Ltd) и яблочный (М = 26 000, степень этерифи-
поглощать и прочно удерживать различные хими-
кации 65%, FuYuan pectin industry Co Ltd) пектины,
ческие соединения. Пектины обладают достаточно
поливиниловый спирт марки 11/2 (М = 48 000, степень
хорошими пленкообразующими свойствами, однако
гидролиза 98%, АО «Невинномысский Азот»), лекар-
Транспортные характеристики пленочных композиций на основе пектина и поливинилового спирта с моксифлоксацином
717
ственный препарат Вигамокс (рег. № ЛСР-003706/10,
концентрацию полимера изменяли от 0.25·10-5 до
Alcon Laboratories Inc.), действующее вещество —
1·10-3 моль·л-1. Ионная сила составляла 0.1.
моксифлоксацин (1-циклопропил-6-фтор-1,4-диги-
УФ-спектры растворов регистрировали в кварце-
дро-8-метокси-7-[(4aS,7aS)-октагидро-6H-пирро-
вых кюветах на спектрофотометре UV-VIS SPECORD
ло[3,4-b]пиридин-6-ил]-4-оксо-3-хинолинкарбоновой
M-40 в области 290-295 нм.
кислоты гидрохлорид). Моксифлоксацин относится к
Полимерные пленки, полученные из водных рас-
группе фторхинолонов IV поколения, проявляет вы-
творов цитрусового пектина и яблочного пектина
сокую антибактериальную активность по отношению
с поливиниловым спиртом и моксифлоксацином,
к различным группам микроорганизмов и широко
отливали на стеклянной подложке. Для приготов-
применяется в медицинской практике. Препарат ис-
ления пленок готовили водные растворы с суммар-
пользовали без дополнительной очистки.
ным содержанием смеси полимеров 3.04 (z = 0.36) и
Размеры частиц исследуемых соединений в вод-
3.38 мас% (z = 0.18), содержание моксифлоксацина
ном растворе определяли методом лазерного рассе-
составило 0.30 мас%. Пленки высушивали при тем-
яния на приборе Sald 7101 (Shimadzu). Длина волны
пературе 25°С в вакууме до остаточной влажности
полупроводникового лазера 375 нм, рабочий диа-
5-7%. Толщина пленок поддерживалась постоянной
пазон измерения диаметров частиц 10 нм-300 мкм.
и равной 11-12 мкм.
Мольное соотношение компонентов (z) определя-
ИК-спектры пленок регистрировали на ИК-Фурье-
ли как отношение молярной концентрации пектина
спектрометре Shimadzu IR-Prestige-21 3600-700 см-1
к молярной концентрации поливинилового спирта
(табл. 1).
(z = [пектин]/[поливиниловый спирт]). Образцы
Набухание пленочных образцов изучали в во-
сравнивали по модальному размеру частиц, которое
де при комнатной температуре весовым методом.
соответствовало максимуму на дифференциальной
Количество поглощенной пленками воды характери-
кривой распределения. Ошибка измерения состав-
зовали величиной степени набухания: В = m - m0/m0,
ляет 1%.
где m0 и m — навеска пленки до и после набухания.
Для определения состава образующихся соеди-
Кинетику высвобождения моксифлоксацина из
нений моксифлоксацина с пектинами использовали
пленок изучали спектрофотометрически по оптиче-
спектрофотометрические методы изомолярных серий
ской плотности при λ = 295 нм.
и мольных отношений. Суммарная концентрация
Антимикробную активность образцов опреде-
полимеров и моксифлоксацина в изомолярной серии
ляли на кафедре микробиологии и вирусологии
составляла 1·10-5 моль·л-1, молярные соотношения
Башкирского государственного медицинского уни-
[полимер]/[моксифлоксацин] варьировали от 50/1
верситета диско-диффузионным методом. В каче-
до 1/20. В сериях растворов с постоянной концен-
стве питательной среды был взят мясопептонный
трацией моксифлоксацина, равной 1·10-5 моль·л-1,
агар с глюкозой (ООО «НИЦФ», кат. номер 058103).
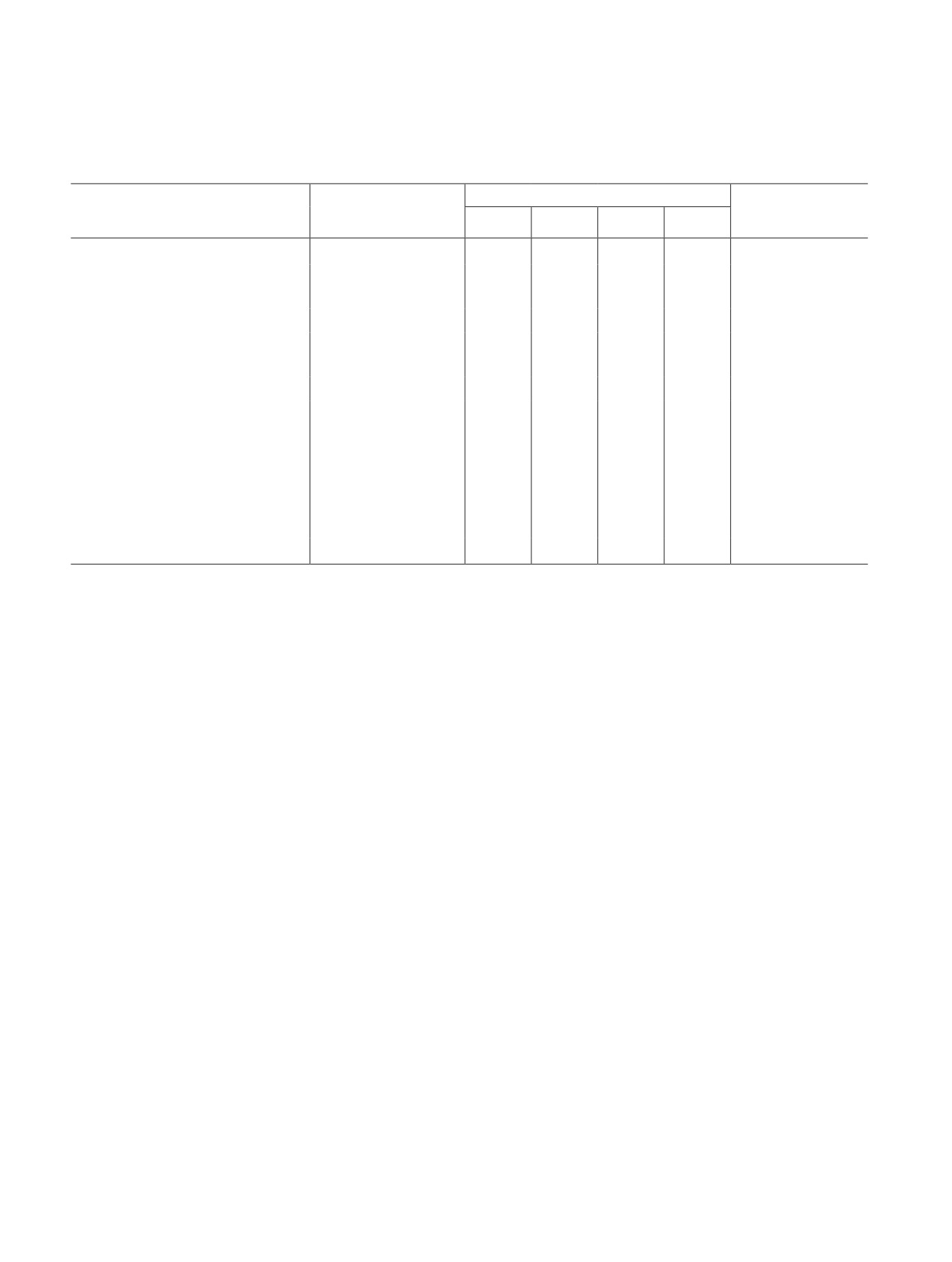
Таблица 1
Характеристические частоты основных функциональных групп моксифлоксацина и полимерных комплексов
Образец
ν, см-1
Моксифлоксацин
1707 (С О в СОО-), 1624 (С О), 1580-1440 (С СAr), 1375, 1352, 1330
(C—N), 1053 (С—F)
Поливиниловый спирт + моксифлоксацин
3325 (ОН), 1714 (С О в СОО-), 1622 (С О), 1570-1506 (С СAr)
1373-1360, 1328, 1240 (C—N), 1093 (С—F)
Цитрусовый пектин + моксифлоксацин
3363 (ОН), 1716 (С О в СОО-), 1614 (С О), 1550-1470 (С СAr),
1373-1361, 1328, 1259 (C—N), 1016-1139 (С—О—С), 1099 (С—F)
Яблочный пектин + моксифлоксацин
3352 (ОН), 1743 (С О в СОО-), 1627 (С О), 1550-1470 (С СAr), 1369,
1328 (C—N), 1010-1112 (С—О—С), 1051 (С—F)
Поливиниловый спирт/цитрусовый пектин +
3400 (ОН), 1732 (С О в СОО-), 1631 (С О), 1550-1470 (С СAr) 1334
+ моксифлоксацин
(C—N), 1000-1150 (С—О—С), 1024 (С—F)
Поливиниловый спирт/яблочный пектин +
3400 (ОН), 1737 (С О в СОО-), 1614 (С О), 1550-1470 (С СAr) 1330
+ моксифлоксацин
(C—N), 1000-1155 (С—О—С), 1024 (С—F)
718
Бадыкова Л. А. и др.
В качестве тест-культур использовали штаммы:
Staphylococcus epidermidis, Staphylococcus aureus,
Streptococcus pneumoniae, Pseudomonas aeruginosa,
Escherichia coli (ФГБУ «НЦЭСМП» Минздрава
России). В качестве контроля была взята пленка на
основе поливинилового спирта (без пектина) с содер-
жанием моксифлоксацина 0.30 мас%. В стерильные
чашки Петри разливали мясопептонный агар тол-
щиной 4 мм и засевали чистые культуры бактерий
методом «сплошного газона». Не позднее чем через
5 мин после инокуляции на поверхность питательной
среды наносили изучаемые пленки. Непосредственно
после аппликации чашки Петри помещали в термо-
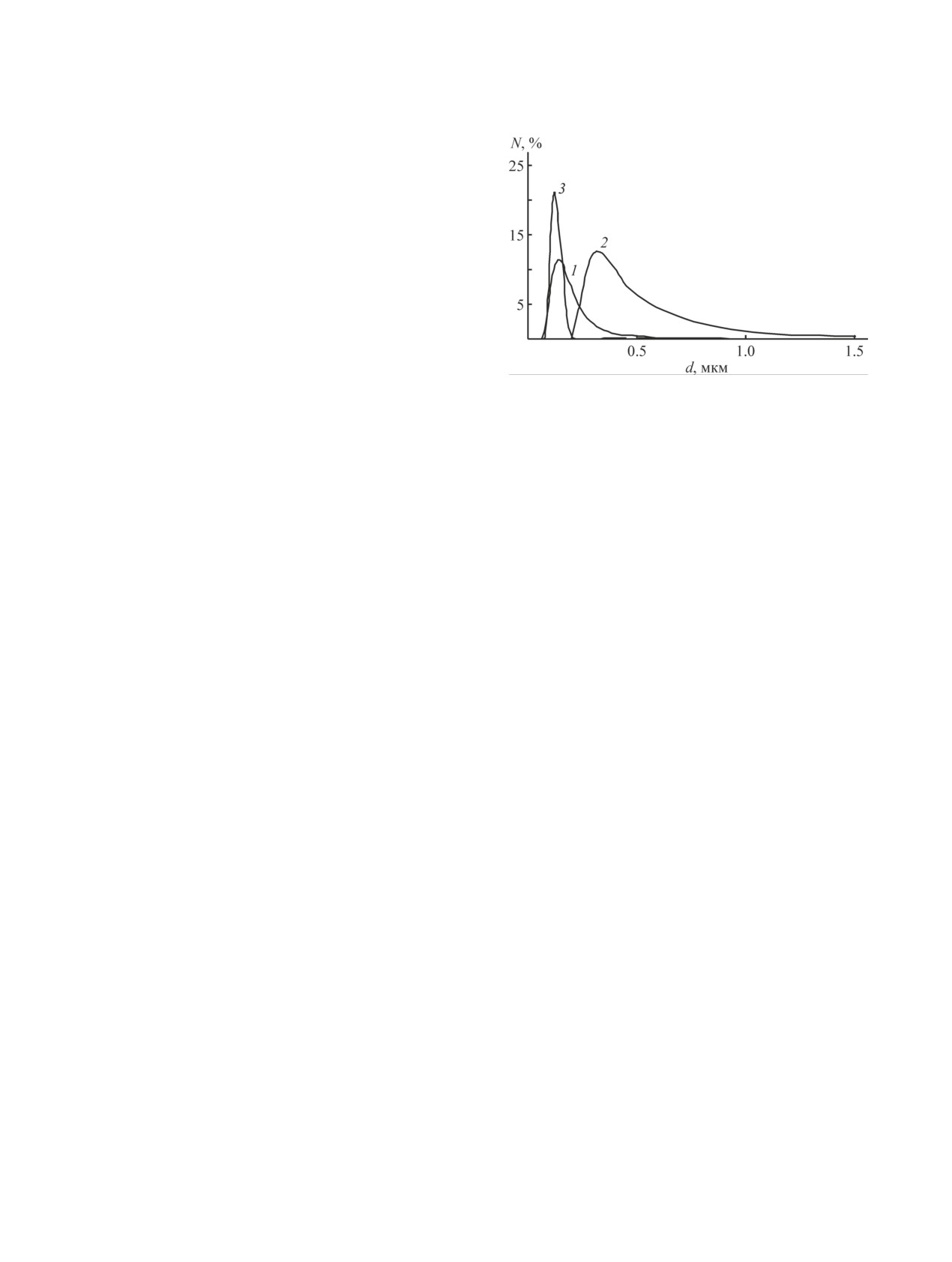
Рис. 1. Распределение микрочастиц по размерам.
стат и инкубировали при температуре 37°С в течение
1 — цитрусовый пектин, 2 — цитрусовый пектин/поливи-
24 ч. После окончания инкубации оценивали размер
ниловый спирт, 3 — цитрусовый пектин/поливиниловый
зоны подавления роста микроорганизмов на месте
спирт + моксифлоксацин; отношение цитрусовый пектин/
аппликации исследуемых систем.
поливиниловый спирт = 0.36.
Обсуждение результатов
личении содержания пектина, как цитрусового, так
При разработке препаратов в форме лекарствен-
и яблочного, в смешанных интерполимерных обра-
ной пленки немаловажным фактором является
зованиях размеры частиц ассоциатов уменьшаются.
оценка скорости высвобождения препарата из по-
В еще большей степени уменьшение размеров на-
лимерной матрицы. Как известно [7], на процесс
блюдается в присутствии моксифлоксацина. Размеры
высвобождения большое влияние оказывают размеры
интерполимерных ассоциатов на основе как цитру-
надмолекулярных образований. В связи с этим бы-
сового, так и яблочного пектинов уменьшаются в
ла исследована надмолекулярная структура данных
1.6-2.5 раза до значения 0.112 мкм независимо от
полимерных систем в умеренно концентрированных
вида пектина и соотношения z. Полидисперсность в
водных растворах, использующихся в дальнейшем
присутствии моксифлоксацина также снижается при-
для формирования пленок. Макромолекулы пектина
мерно в 2 раза. Видимо, между полимерами и мок-
способны к образованию ассоциатов [8], поэтому
сифлоксацином возникают новые межмолекулярные
можно предположить, что образующиеся в растворе
связи, связанные с процессами комплексообразова-
надмолекулярные образования сохраняются и в сфор-
ния, что в итоге приводит к сжатию макромолекуляр-
мированных пленках. Модальный размер частиц ци-
ных клубков, уменьшению размеров надмолекуляр-
трусового пектина составляет 0.141 мкм, добавление
ных частиц и сужению распределения.
поливинилового спирта к раствору пектина приводит
Через 1 сут размеры ассоциатов цитрусового
к уширению распределения частиц и увеличению
пектина с поливиниловым спиртом увеличивают-
размеров надмолекулярных образований до 0.355 мкм
ся примерно на 2-4%, а яблочного пектина с по-
(рис. 1).
ливиниловым спиртом — на 10-15%. В присут-
Было показано [9], что при увеличении массовой
ствии моксифлоксацина размеры не изменяются.
доли поливинилового спирта в композиции проис-
Примечательно, что для обоих видов пектинов в при-
ходят процессы структурообразования, связанные с
сутствии моксифлоксацина достигаются сходные раз-
перестройкой макромолекулярных ассоциатов пек-
мерные характеристики надмолекулярной структуры
тина и гибкоцепного поливинилового спирта, вслед-
растворов, на основании чего можно предположить,
ствие чего и образуются более крупные структурные
что и надмолекулярные структуры сформированных
образования. Формирование таких ассоциатов об-
пленок будут близки.
условлено водородными связями и гидрофобными
Строение моксифлоксацина позволяет предпо-
взаимодействиями макромолекул. Надмолекулярные
ложить его химическое взаимодействие с функ-
образования в растворах композиций на основе
циональными группами полимерных матриц.
яблочного пектина, молекулярная масса которого
О взаимодействии полимеров с моксифлоксаци-
почти в 3 раза меньше, чем у цитрусового, характе-
ном свидетельствуют данные УФ-спектроскопии.
ризуются меньшими размерами (табл. 2). При уве-
В УФ-спектре моксифлоксацина присутствует широ-
Транспортные характеристики пленочных композиций на основе пектина и поливинилового спирта с моксифлоксацином
719
Таблица 2
Распределение макромолекул по размерам в растворах смеси полимеров с моксифлоксацином
Мольное отношение
Диаметр частиц макромолекул,* мкм
Полидисперсность**
Образец
пектин/поливиниловый
dmod
d10
d50
d90
P
спирт z
Цитрусовый пектин
0.141
0.095
0.144
0.245
1.04
Цитрусовый пектин/поливинило-
0.36
0.282
0.248
0.355
0.668
1.18
вый спирт
0.18
0.355
0.273
0.379
0.699
1.12
Цитрусовый пектин/поливинило-
0.36
0.112
0.084
0.106
0.152
0.64
вый спирт + моксифлоксацин
0.18
0.112
0.090
0.118
0.154
0.54
Яблочный пектин
0.130
0.085
0.133
0.220
1.02
Яблочный пектин/поливиниловый
0.36
0.178
0.156
0.212
0.340
0.87
спирт
Яблочный пектин/поливиниловый
0.18
0.224
0.160
0.219
0.356
0.89
спирт + моксифлоксацин
0.36
0.112
0.090
0.118
0.154
0.54
0.18
0.112
0.086
0.107
0.123
0.35
* Модальные размеры (dmod) надмолекулярных образований измерены через 1 ч после приготовления растворов; d10,
d50 и d90 — средние диаметры 10, 50 и 90% частиц.
** P = (d90 - d10)/d50.
кая полоса поглощения при 295 нм, соответствующая
дается значительное уменьшение интенсивности и
поглощению ароматического остова фторхинолона.
сдвиг в коротковолновую область полосы поглощения
При добавлении полимера к раствору моксифлок-
С О-группы и уширение полосы поглощения
сацина наблюдается возрастание интенсивности
ОН-группы. Вероятно, ароматическое ядро и кар-
без изменения положения полосы поглощения мок-
боксильная группа хинолонового фрагмента мок-
сифлоксацина. Происходящие спектральные измене-
сифлоксацина участвуют в комплексообразовании с
ния свидетельствуют о влиянии, оказываемом поли-
пектиновой матрицей. В ИК-спектрах комплекса по-
мером на электронную систему моксифлоксацина, и
ливиниловый спирт + моксифлоксацин наблюдаются
образовании комплексного соединения [10].
аналогичные изменения, однако уменьшение интен-
Факт образования комплексных соединений
сивности основных полос поглощения моксифлокса-
подтверждается данными ИК-спектроскопии.
цина значительно меньше, чем в ИК-спектрах ком-
Основными характеристическими полосами погло-
плексов на основе пектинов.
щения моксифлоксацина в ИК-спектральной обла-
В ИК-спектре тройных комплексов (поливинило-
сти являются 1707 и 1624 см-1, соответствующие
вый спирт + цитрусовый/яблочный пектины + мок-
колебаниям карбоксильной и карбонильной групп
сифлоксацин) наблюдается значительное уширение
хинолонового фрагмента; полосы поглощения при
максимумов поглощения ОН-групп (3500-3100 см-1)
1516-1435 см-1 относятся к колебаниям связи С—С
полимеров и смещение полос поглощения С—О—С
в ароматической структуре хинолона; полоса по-
и С О пектина, что может быть обусловлено образо-
глощения 1052-1026 см-1 относится к колебаниям
ванием водородных связей как между функциональ-
связи C—F. В присутствии пектина (цитрусового
ными группами полимеров, так и между функцио-
или яблочного) наблюдается уменьшение интенсив-
нальными группами полимеров и функциональными
ности основных полос поглощения моксифлокса-
группами моксифлоксацина.
цина в области 1300-1730 см-1. Наиболее выражен
Исследование водных растворов полимеров с мок-
этот эффект для полосы поглощения 1445 см-1, со-
сифлоксацином методами изомолярных серий и моль-
ответствующей С—С колебаниям в ароматической
ных отношений показало образование комплексных
структуре хинолона. В спектрах пектинов наблю-
соединений состава 1:1 за счет донорно-акцепторного
720
Бадыкова Л. А. и др.
взаимодействия карбонильной группы в пиридино-
вом фрагменте моксифлоксацина с карбоксильной
группой пектина и дополнительного связывания кар-
боксильной группы моксифлоксацина с гидроксиль-
ной группой пектиновой матрицы в третьем поло-
жении. Данное взаимодействие можно представить
следующей схемой:
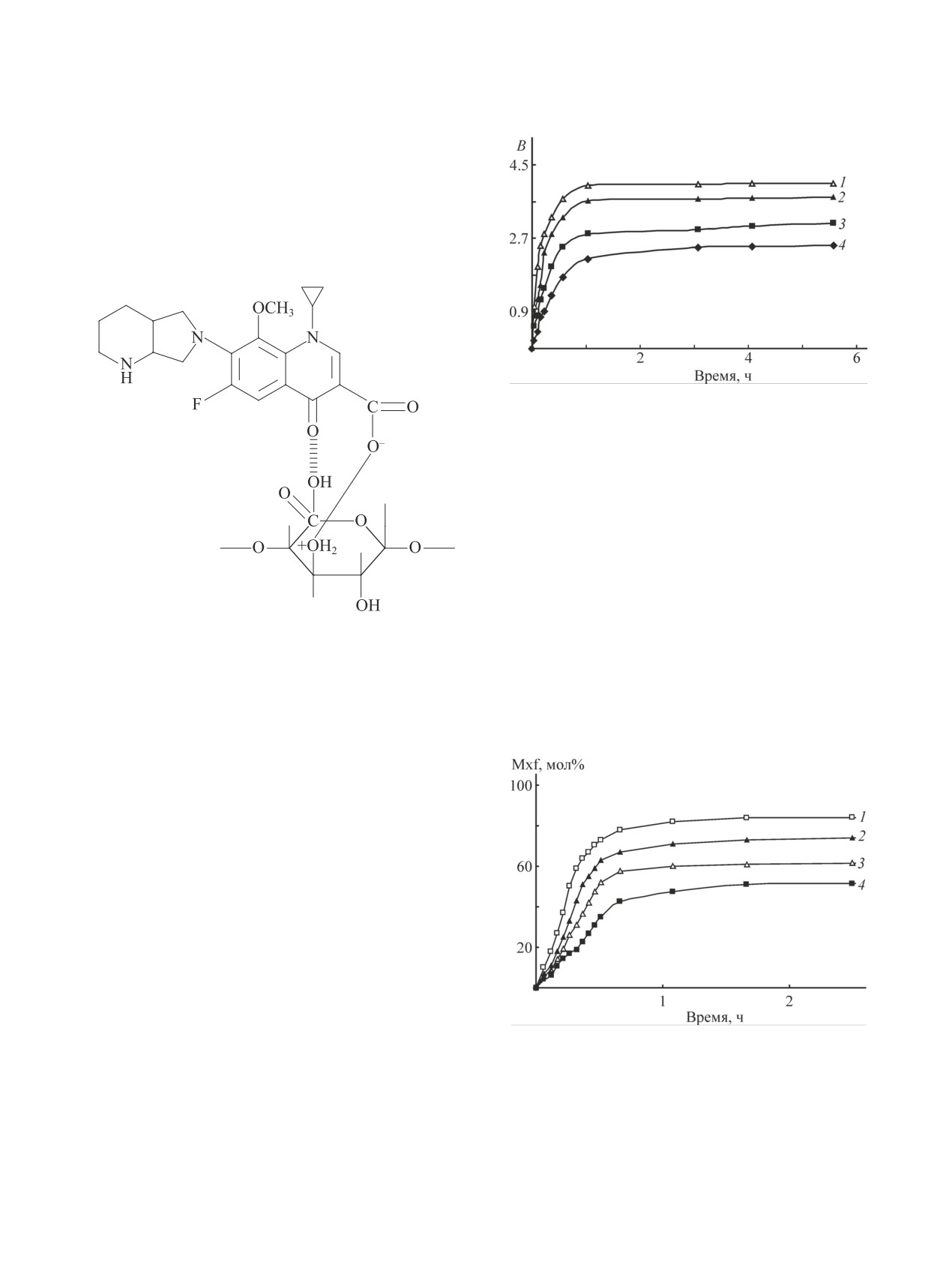
Рис. 2. Кривые набухания пленок.
1 — яблочный пектин/поливиниловый спирт + мокси-
флоксацин, 2 — цитрусовый пектин/поливиниловый
спирт + моксифлоксацин, 3 — яблочный пектин/поливини-
ловый спирт + моксифлоксацин, 4 — цитрусовый пектин/
поливиниловый спирт + моксифлоксацин.
Соотношение полимеров: 1, 2 — 0.36; 3, 4 — 0.18.
чальный период связан с диффузией из полимерной
матрицы моксифлоксацина, химически не связан-
ного с макромолекулами и находящегося в свобод-
ном виде в водной фазе набухшей пленки. После
быстрого высвобождения химически не связанного
В условиях практического применения высво-
моксифлоксацина из полимерной матрицы в объеме
бождение действующего вещества из пленки зави-
пленки устанавливается равновесная концентрация
сит в первую очередь от водопоглощения. Процесс
антибиотика, отвечающая устойчивости комплекса с
высвобождения начинается со стадии сорбции во-
макромолекулами.
ды пленкой и ее дальнейшего набухания (рис. 2).
Водопоглощение на начальном этапе происходит
достаточно быстро, и за 1 ч достигается практически
равновесная в данных условиях степень поглощения
влаги. Набухание сопровождается довольно значи-
тельным увеличением объема пленки, примерно в
5-6 раз, при этом сорбция воды зависит от состава
композиции. В общем случае уменьшение содержа-
ния в пленке более гидрофильного пектина приводит
к уменьшению степени набухания. Пленки яблочный
пектин/поливиниловый спирт набухают в большей
степени, чем пленки цитрусовый пектин/поливини-
ловый спирт.
Количество удерживаемой воды непосредствен-
но влияет на процесс высвобождения моксифлок-
сацина из полученных композиций в водную среду
Рис. 3. Кинетика высвобождения моксифлоксацина из
(рис. 3, табл. 3). На кинетических кривых высвобо-
пленок.
ждения моксифлоксацина из пленок фиксируются
1 — яблочный пектин/поливиниловый спирт + мок-
два участка: начальный период сравнительно бы-
сифлоксацин, 2 — цитрусовый пектин/поливиниловый
строго высвобождения от 40 до 80% (в зависимости
спирт + моксифлоксацин, 3 — яблочный пектин/поливини-
от вида пленки) количества введенного препарата и
ловый спирт + моксифлоксацин, 4 — цитрусовый пектин/
период последующего медленного высвобождения
поливиниловый спирт + моксифлоксацин.
моксифлоксацина. Можно предположить, что на-
Соотношение полимеров: 1, 2 — 0.36; 3, 4 — 0.18.
Транспортные характеристики пленочных композиций на основе пектина и поливинилового спирта с моксифлоксацином
721
Таблица 3
Скорость высвобождения и предельный выход моксифлоксацина из пленок
Количество
Отношение
Скорость высвобождения
Время,
выделившегося
Состав пленки
пектин/поливиниловый
моксифлоксацина,
сут
моксифлоксацина
спирт
мол%/мин
мол%
мас%
Цитрусовый пектин/поливиниловый
1
55
55
спирт
2
58
58
0.18
3
63
63
0.004
4
70
70
5
75
75
1
80
80
2
83
83
0.36
3
87
87
0.003
4
92
92
5
96
96
Яблочный пектин/поливиниловый
1
70
70
спирт
2
75
75
0.18
3
79
79
0.002
4
85
85
5
89
89
1
85
85
2
90
90
0.36
3
98
98
0.004
4
98
98
5
98
98
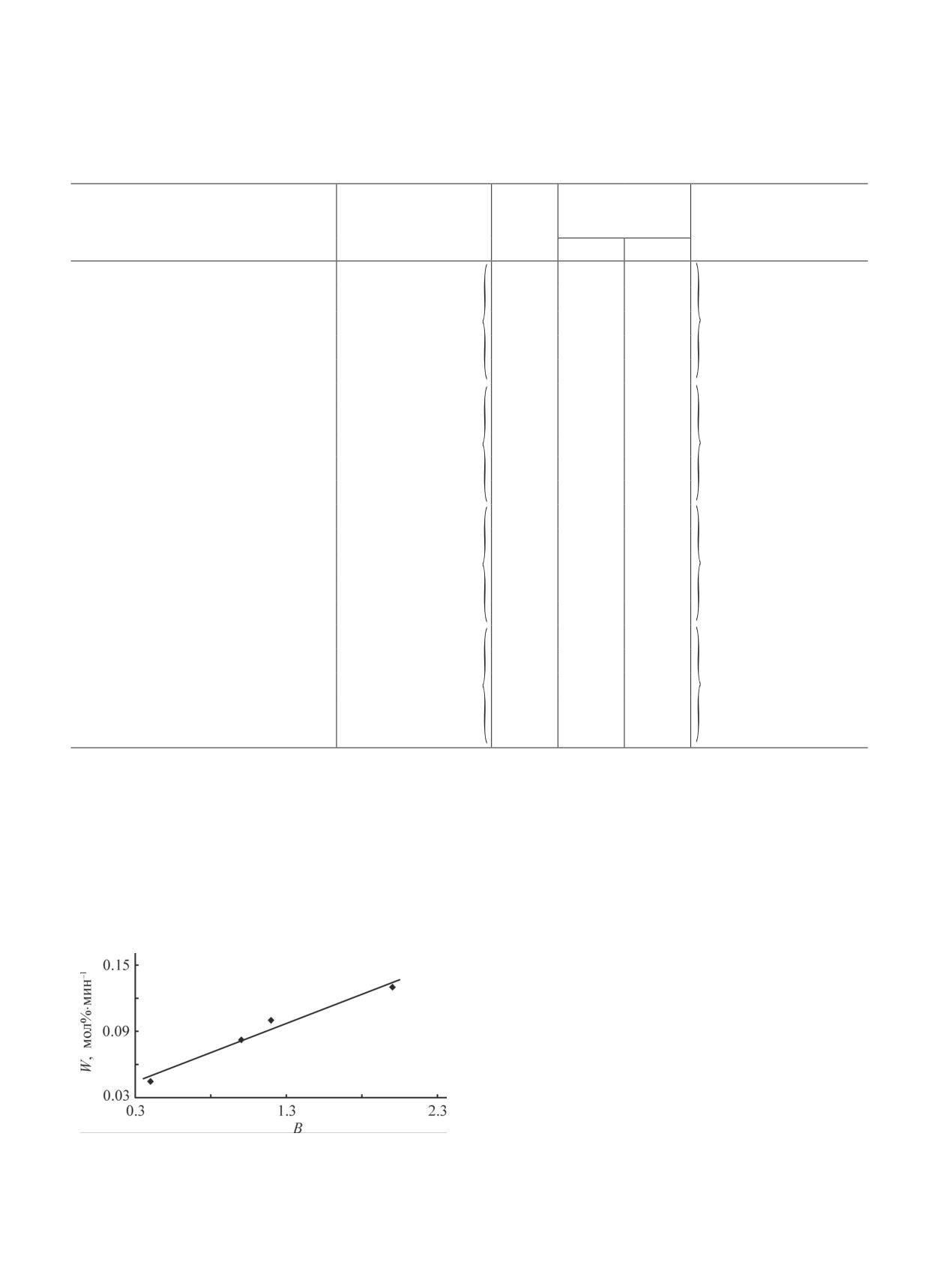
Начальная скорость выделения моксифлоксацина
висящей от характеристик пленок. Его медленная
линейно зависит от количества удерживаемой плен-
диффузия из пленки и соответствующее смещение
кой воды (рис. 4).
равновесия и обеспечивает пролонгирование дей-
Второй период характеризуется тем, что мок-
ствия моксифлоксацина. Соответственно время про-
сифлоксацин высвобождается со значительно мень-
лонгирования зависит от количества антибиотика,
шей и практически постоянной скоростью, не за-
остающегося в пленке после начального быстрого
периода его высвобождения, что в свою очередь за-
висит от характеристик пленки. Более выраженный
эффект будет достигаться для пленок с меньшей сте-
пенью набухания. Моксифлоксацин из пленок на
основе яблочного пектина с поливиниловым спиртом
высвобождается быстрее по сравнению с образцами
на основе цитрусового пектина и поливинилового
спирта.
Микробиологическое тестирование in vitro актив-
ности модельных пленок показало, что наибольшая
зона подавления роста микроорганизмов наблюда-
лась при применении пленок на основе цитрусовый
Рис. 4. Зависимость начальной скорости высвобождения
пектин/поливиниловый спирт + моксифлоксацин (по
W моксифлоксацина от степени набухания пленок.
722
Бадыкова Л. А. и др.
Таблица 4
Антимикробная активность образцов пленок
Зона задержки роста, мм
цитрусовый пектин/
яблочный пектин/
яблочный
цитрусовый пектин/
поливиниловый
Микроорганизм
поливиниловый
поливиниловый
пектин/
поливиниловый
спирт + мокси-
спирт + мокси-
спирт + мокси-
поливиниловый
спирт
флоксацин
флоксацин
флоксацин
спирт
Staphylococcus aureus
29
25
—
—
23
Staphylococcus
23
21
—
—
22
epidermidis
Serratia marcescens
28
24
—
—
25
Escherichia coli
28
20
—
—
25
Pseudomonas aeruginosa
—
—
—
—
—
П р и мечан и е. «—» — отсутствие антимикробного действия.
сравнению с пленками на основе яблочный пектин/
ров и впоследствии на структуру композиционных
поливиниловый спирт + моксифлоксацин) (табл. 4).
пленок, определяющую высвобождение препарата и
Штаммы микроорганизмов Staphylococcus aureus,
в итоге физиологическую активность.
Escherichia coli и Serratia marcescens обладают по-
Установлено, что полимерная композиция на ос-
вышенной чувствительностью к пленке цитрусовый
нове цитрусового пектина способствует повышению
пектин/поливиниловый спирт + моксифлоксацин и
антимикробной активности моксифлоксацина против
умеренной — к пленкам яблочный пектин/поливи-
штаммов Staphylococcus aureus, Escherichia coli и
ниловый спирт + моксифлоксацин, Staphylococcus
Serratia marcescens. Модифицированные пленки пер-
epidermidis показал умеренную чувствительность
спективны в качестве лекарственных форм пролон-
к тестируемым пленкам, а Pseudomonas aeruginosa
гированного действия. Преимущество полученных
оказалась резистентной ко всем пленкам.
пленок заключается в более медленном процессе
высвобождения лекарственного средства (в ~2 раза)
по сравнению с пленками, например, на основе во-
Выводы
дорастворимых полимеров поливинилового спирта и
На основе полимерной композиции пектин/по-
арабиногалактана лиственницы сибирской.
ливиниловый спирт с моксифлоксацином получе-
ны нерастворимые в воде полимерные пленки. При
Финансирование работы
взаимодействии полимеров с моксифлоксацином
образуются комплексы, размеры надмолекулярных
Статья подготовлена в рамках выполнения
образований которых зависят от композиционного
программы ФНИ государственных академий на
состава матрицы и модификации моксифлоксацином.
2022/2024 гг. Гос.задание «Развитие фундаменталь-
Увеличение содержания поливинилового спирта в по-
ных основ управления структурой полимеров и кине-
лимерной матрице приводит к возрастанию размеров
тикой процесса в каталитической полимеризации, на-
ассоциатов, а их модификация моксифлоксацином —
правленной модификации синтетических и биогенных
к уменьшению размеров частиц примерно в 2-3 раза
полимеров и получение полимерных систем для био-
независимо от вида пектина.
медицинских приложений» № 1021062311391-0-1.4.4.
Важным для практического использования по-
Анализы выполнены на оборудовании ЦКП «Химия»
лимерных композиционных пленок в качестве но-
УфИХ РАН и РЦКП «Агидель» УФИЦ РАН.
сителей лекарственных средств представляется об-
наруженный факт способности моксифлоксацина,
Конфликт интересов
химически сопряженного с макромолекулами, влиять
на процесс формирования надмолекулярных образо-
Авторы заявляют об отсутствии конфликта инте-
ваний в исходных рабочих растворах смесей полиме-
ресов, требующего раскрытия в данной статье.
Транспортные характеристики пленочных композиций на основе пектина и поливинилового спирта с моксифлоксацином
723
Информация об авторах
alcohol with carboxsymethyl cellulose ionized to
various extents // Russ. J. Appl. Chem. 2010. V. 83.
Бадыкова Лилия Абдулхаевна, к.х.н.
N 4. P. 712-717.
Мударисова Роза Ханифовна, к.х.н.
[6]
Оводов Ю. С. Современные представления о пек-
тиновых веществах // Биоорган. химия. 2009. Т. 5.
Колесов Сергей Викторович, д.х.н.
№ 3. С. 293-310 [Ovodov Yu. S. Current views on
pectin substances // Russ. J. Bioorg. Chem. 2009.
V. 35. N 3. P. 269-284.
Список литературы
[7]
Бадыкова Л. А., Фатыхов А. А., Мударисова
[1] Solis A. C., Bento D., Nunes S., Valente A., Pais A.,
Р. Х. Полимерные композитные пленки на осно-
Vitorino C. Rethinking transdermal drug delivery using
ве цитрусового пектина для регулируемой до-
PVA-NLC based films // Polymer. 2021. V. 230.
ставки цефтриаксона // ЖОХ. 2014. Т. 84. № 10.
С. 1728-1733 [Badykova L. A., Fatykhov A. A.,
[2] Sabbagh F., Kim B. S. Recent advances in polymeric
Mudarisova R. Kh.
Polymer composite films based
transdermal drug delivery systems // J. Controlled
on citrus pectin for controlled delivery of ceftriaxone //
Release. 2022. V. 341. P. 132-146.
Russ. J. Gen. Chem. 2014. V. 84. N 10. P. 2004-2008.
[3] Dong Z., Wang Q., Du Y. Alginate/gelatin blend films
[8]
Шелухина Н. П., Абаева Р. Ш., Аймухамедова Г. Б.
and their properties for drug controlled release // J.
Пектин и параметры его получения. Фрунзе: Илим,
Membr. Sci. 2006. V. 280. N 1-2. P. 37-44.
1987. С. 3-10.
[9]
Рашидова С. Ш., Воропаева И. Л., Мухамеджа-
[4] Касаткина М. А., Буданцева Н. А., Кильдеева Н. Р.
нова М. Ю., Решетникова И. В., Рубан И. Н.
Получение биологически активных материалов на
Реологические свойства концентрированных рас-
основе хитозана, модифицированных полисахари-
творов смесей лимонного пектина и гибкоцепных
дами // Хим.-фарм. журн. 2016. Т. 50. № 4. С. 32-39
виниловых полимеров // ЖПХ. 2002. Т. 75. № 7.
[Kasatkina M. A., Budantseva N. A., Kilʹdeeva N. R.
С. 1159-1163 [Rashidova S. Sh., Voropaeva I. L.,
Preparation of biologically active film-forming
Mukhamedzhanova M. Yu., Reshetnikova I. V.,
materials based on polyphosphate-modified chitosan //
Ruban I. N. Rheological properties of concentrated
Pharm. Chem. J. 2016. V. 50. N 4. P. 250-257.
solutions of mixtures of lemon pectin with flexible-
chain vinyl polymers // Russ. J. Appl. Chem. 2002.
[5] Бочек А. М., Шевчук И. Л., Калюжная Л. М.
V. 75. N 7. P. 1136-1140.
Свойства водных растворов смесей карбоксиме-
тилцеллюлозы разной степени ионизации с поливи-
[10]
Эндрюс Л., Кифер Р. Молекулярные комплек-
ниловым спиртом // ЖПХ. 2010. Т. 83. № 4. С. 660-
сы в органической химии / Пер. с англ. М. И.
665 [Bochek A. M., Shevchuk I. L., Kalyuzhnaya L. M.
Калинкина, под ред. И. Н. Моисеева. М.: Мир,
Properties of aqueous solutions of blends of polyvinyl
1967. С. 27-43.